عفونتهای قارچی در گیرندگان پیوند اعضاء جامد
دکتر محمد قهری – آزمایشگاه تشخیص طبی رسالت
مقدمه
موفقیت قابل توجهی که امروزه در پیوند ارگان بدست آمده موجب تغییر رویکرد مراقبت از بیماران با نارسائی پیشرونده و مزمن ارگانها شده است. تا همین چند دههی قبل “پیوند عضو” بعنوان آخرین راه درمانی از سر یأس و ناامیدی در نظر گرفته میشد، عوارض تکنیکال موجب آسیب میگردید، عفونت سیستمیک، دفع پیوند، و طیف وسیعی از عوارض ایمنوسوپرسیون بخصوص عوارض مربوط به استفاده از کورتیکوستروئیدها از دیگر مشکلات بیماران پیوندی بود. امروزه پیوند ارگان را بعنوان مؤثرترین راه احیاء بیمارانی که نارسائی ارگان با اتیولوژیهای مختلف دارند میشناسیم. هدف این نیست که گفته شود که تمام مشکلات حل شده است، بلکه فقط با توسعهی رویکردها شانس موفقیت افزایش پیدا کرده است.
درمان مؤثر آنتیمیکروبیال در گیرنده پیوند بدلائل متعددی دارای چالش است:
- بار یا فشار (load) میکروبی یک مؤلفهی مهم در تعیین پیشآگهی برای یک بیمار دارای عفونت است. پاسخ التهابی معیوب به تهاجم میکروبی که زیر فشار درمان ایمنوسوپرسیو بوجود آمده عموماً موجب مخفی شدن نشانهها میگردد، بطوریکه علائم و نشانه های عفونت کاهش یافته و یا دیرهنگام ظاهر میشوند. یافتههای رادیولوژیک اغلب ضعیف و محو هستند و تظاهرات درماتولوژیک واضح نیستند و بنابراین یافتههای کلاسیکی دیده نمیشوند و لزیونهای پوستی اغلب غیر اختصاصی هستند. بار میکروبی در بیمار پیوند شده نسبت به میزبان نرمال با بیماری مشابه همیشه زیادتر است. ملایمت پاسخ نسبت به بسیاری از عفونتهای قارچی فقط به مشکلات تشخیصی میافزاید. از آنجا که پیشآگهی مستقیماً مربوط به چگونگی تشخیص سریع و شروع درمان مناسب است، بنابراین یک رویکرد پرتکاپو (aggressive) برای ارزیابی بیمار الزامی است؛ از جمله آنکه، CT scan بعوض رادیوگرافی معمولی برای بررسی علائم قفسه سینه باید در نظر گرفته شود، کمترین یافتهها در رادیوگرافی معمولی مورد توجه قرار گیرد، لزیونهای پوستی و ندولهای ریوی نیاز به بیوپسی دارند، و تب با علت نامعلوم نیاز به ارزیابی وسیعی دارد.
- درمان آنتیمیکروبیال بویژه درمان ضد قارچی در گیرندهی پیوند نیز بسیار پیچیدهتر از دیگر گروههای بیماران است. سه سبک یا اسلوب درمانی وجود دارد: پروفیلاکتیک، تراپوئتیک و پریامپتیو (preemptive).
درمان پروفیلاکتیک در تمام جمعیت بیمارانی که عفونی نشدهاند هنگامی که ریسک بیماری کلینیکی به اندازه کافی بزرگ پنداشته میشود و مداخله را توجیه میکند انجام میگیرد. مثالی در این مورد انجام پیوند در شرایطی است که احتمال برخورد با آئروسلهای یکی از قارچهای آندمیک سیستمیک وجود داشته باشد. پروفیلاکسی ضد قارچی موجب حفاظت و حمایت بر علیه بیماری کلینیکی میشود. استفادهی درمانی از داروهای ضد قارچی در هنگام درمان عفونت تهاجمی ضرورت پیدا میکند که اغلب مربوط به نارسائی یا نقص رژیمهای پروفیلاکتیک است. درمان پریامپتیو زمانی بکار گرفته میشود که بیماران بدون علامت در معرض خطر افزایش یافتهی عفونت تهاجمی بر اساس مشاهدات آزمایشگاهی یا کلینیکال قرار گیرند. درمان ضد میکروبی در بیمار پیوند شده نسبت به سایر گروههای بیماران طولانیتر است زیرا در این گروه از بیماران هم بار میکروبی بزرگتر است و هم حالت ایمنوسوپرسیون استمرار دارد، در نتیجه سمیت داروئی معمولاً بیشتر بوده و مقاومت آنتیمیکروبیال نیز ممکن است پدید آید.
- دامنهی ارگانیسمها بسیار گستردهتر از آنهائی است که تظاهرات کلینیکی مشابه در میزبان نرمال ایجاد میکنند. در بیمار پیوند شده نه تنها باکتریهای معمولی (از قبیل استافیلوکوکوس اورئوس، انواع استرپتوکوکها، ایکولای، و سایر باسیلهای گرم منفی) و ویروسها (مثل آنفلوانزا، ویروس سنسیشیال تنفسی، هپاتیت B و C) بلکه اکثر پاتوژنهای غیر متداول نیز باید در نظر گرفته شوند. این پاتوژنهای غیرمعمول شامل قارچها، نه تنها ارگانیسمهای معمولی مثل کاندیدا آلبیکنس بلکه گونههای فرصت طلب مانند آسپرجیلوس و کریپتوکوکوس میباشند. علاوه بر این یک مشکل روزافزون در رابطه با آنچه تحت عنوان ارگانیسمهای “جدید و پدیدار شده” موسوم است، نظیر سدوسپوریوم، فوزاریوم، و زیگومیستها نیز وجود دارد. باکتریهای غیر متداول (مانند نوکاردیا، مایکوباکتریومها و کورینه باکتریومهای پاتوژن) و عفونتهای ویروسی (مانند سارس و ویروس نیل غربی) بطور قابل ملاحظهای مدیریت پرچالشی را رو در روی کلینیسین قرار میدهند. از یک طرف فشار پاتوژنهای شناخته شده در این گروه از بیماران بزرگتر است و از طرف دیگر پاتوژنهای جدید و غیر متداول بویژه در این بیماران و سایر بیمارانیکه ایمنوسوپرس هستند دارای اثرات تهدید کننده میباشند.
- بین تشخیص سریع و زودرس و درمان مؤثر رابطهی مستقیمی وجود دارد؛ در واقع بعنوان قسمتی از برنامهی مدیریت عفونت باید بوسیلهی تشخیص و درمان مناسب به بیمار کمک کرد. مسئلهای که نه تنها شامل درمان ضد میکروبی میشود، بلکه مسائل تشخیصی که به استفادهی مطلوب از این داروها کمک میکند نیز باید در نظر گرفته شود. اگرچه تکنیکهای کشت بعنوان اساس مدیریت بیماری باقی ماندهاند، اما روشهای جدید مثل آشکارسازی آنتیژن، آزمایش PCR و روشهای جدیدتر رادیولوژیک وعده بزرگی برای تشخیص زودرس و بکارگیری درمان مؤثر دادهاند. در مقابل، تشخیص سرولوژیک (آزمایش آنتیبادیهای اختصاصی در سرم) که پاسخ ایمنولوژیک به یک آنتیژن خاصی را اندازهگیری میکنند در این رابطه از حساسیت کمتری برخوردار میباشند و معمولاً در بیماران ایمنوکامپرومایزد دارای عفونت فعال، بعنوان بخشی از ارزیابی تشخیصی در نظر گرفته نمیشوند. کاربرد عمدهی تکنیکهای سرولوژیک در زمان قبل از پیوند است؛ یعنی هنگامی که این روشها میتوانند به ارزیابی خطر یک عفونت خاصی کمک نمایند. مسئله و تفکر کلیدی در اینجا این است که در ارتباط بین تشخیص زودرس و استفادهی پیشگیرانه و درمانی از آنتیمیکروبیالها باید تأکید شود.
خطر عفونت قارچی در گیرنده پیوند ارگان
خطر عفونت قارچی در گیرنده پیوند ارگان بوسیله اثرات متقابل 4 فاکتور تعیین میشود:
- حالت خالص ایمنوسوپرسیون
حالت خالص ایمنوسوپرسیون یک عملکرد پیچیده است که از فاکتورهای متعددی تشکیل شده است. سطح درمان ایمنوسوپرسیونی که انجام میگیرد یک تعیین کنندهی اولیه است، اما علاوه بر آن مسائل دیگر نیز در این عملکرد سهیم و شریک میگردند: نوتروپنی، سوء تغذیه پروتئین کالری، (و احتمالاً سایر اختلالات متابولیک مانند اورمی و هایپرگلیسمی)، عفونت سیستمیک با یک یا چند ویروس از ویروسهای ایمنومدولیتینگ (مانند ویروس سایتومگال، ویروس اپشتاینبار، ویروس هرپس انسانی-6، ویروسهای هپاتیت B و C، و ویروس HIV) و فاکتورهای دیگر مانند ژنهای درگیر در پاسخ ایمنی. اهمیت این عوامل شرکت کننده و سهیم در ایمنوسوپرسیون خالص توسط مشاهدات زیر مورد تأکید قرار گرفته است: بیماران پیوند شده با سطوح آلبومین سرم کمتر از 2.5gr/dl به میزان ده برابر افزایش در انسیدانس عفونت تهدیدگر حیات دارند، 90% عفونتهای فرصت طلب در حالتی که عفونت ویرال وجود دارد اتفاق میافتند و برای آن دسته از بیمارانی که عفونت ویرال ندارند خطر محیطی گستردهای در ارتباط با عفونت مهاجم وجود دارد. عفونت ویروسی حالت خالص ایمنوسوپرسیون را افزایش میدهد، طوریکه فرد مستعد عفونت تهاجمی میشود.
- برخوردهای محیطی
برخوردهای محیطی مفرط میتواند در محیط داخل و یا خارج از بیمارستان رخ دهد. در محیط خارج از بیمارستان مواجهه میتواند با آئروسلهائی که بعللی مانند عملیات تخریب و ساخت ساختمانی، باغبانی و کار در مزرعه تولید میشوند اتفاق افتد. مواجهههای محیط بیمارستانیِ با اهمیت که میتواند به عفونت مهاجم منجر شود را میتوان به دو قسمت کلی تقسیم نمود: خانگی (domiciliary) و غیر خانگی (non-domiciliary).
مواجههی خانگی مربوط به اکتساب عفونت در بخش بیمارستانی است؛ یعنی جائی که بیمار در آن مکان بستری است و طغیانهای مربوط به این نوع بوسیلهی موارد اتفاق افتاده در مکان و زمانِ مشترک مشخص میشود. مواجههی غیر خانگی هنگامی اتفاق می افتد که بیمار در بیمارستان برای انجام کارهای ضروری جابجا میشود. مواجهههای مربوط به این نوع میتواند در سالن اصلی بیمارستان، داخل اتاق عمل، محلهای رادیولوژی یا برونکوسکوپی یا جای دیگر اتفاق افتد. طغیانهای غیرخانگی غیرمعمول نیستند؛ هرگاه بروز عفونت در مقطعی از زمان رخ دهد که حالت ایمنوسوپرسیون به تنهائی برای ایجاد عفونت به حد کافی بزرگ نیست با این نوع مواجه هستیم. مقادیر بیش از اندازه ذرات عفونی در آب آشامیدنی و یا هوائی که تنفس میشود میتواند بیماری مهاجم ایجاد نماید بویژه در وضعیت مربوط به بیمار پیوندی که در وی پاسخ ایمنی سلولی نسبت به تهاجم بافتی قارچ بعلت درمان ایمنوسوپرسیو تحت تأثیر قرار گرفته است. در سالیان اخیر یک مشکل رو به افزایش مربوط به گسترش فرد به فرد عفونت کاندیدائی مقاوم به آزول (شامل گونهی آلبیکنس و نیز استرینهای غیر آلبیکنسی) از طریق دستهای شسته نشده پرسنل پزشکی جلب توجه نموده است.
قارچهای دیمورفیک (بلاستومایسس درماتیتیدیس، کوکسیدیوئیدس ایمیتیس، هیستوپلاسما کپسولاتوم) در خاک بصورت کپک مرکب از هایفیهای واجد دیواره عرضی که تولید کنیدی (ذرات عفونیزا) میکنند، وجود دارند. هنگامی که خاک محتوی این ارگانیسمها در نتیجهی پروژههای بازسازی شهری، پاکسازی و عملیات اکتشافی دستکاری میشوند استنشاق کنیدیهای آئروسل شده منجر به شروع عفونت کلینیکی از طریق ریهها میشوند. فرم تهاجم بافتی ارگانیسم بصورت مخمری میباشد. پیامدهای کلینیکی تهاجم بافتی بوسیلهی این ارگانیسمها میتواند بسیار متنوع باشد. عفونت اولیه معمولاً در یک ماه نخست بعد از مواجهه رخ میدهد که ممکن است بدون علامت باشد و یا علائمی شبیه آنفلوانزا ایجاد نماید. بعلاوه تظاهرات مربوط به ازدیاد حساسیت مانند اریتما مولتیفرم، اریتما ندوزوم و آرتریت واکنشی نیز از علائم متداول عفونت اولیه است و معمولاً در یک میزبان نرمال ایمنی ایجاد میشود. در بیماران پیوند شده این تأثیرات ایمنولوژیک غیر متداول هستند، در حالیکه پنومونی اولیهی پیشرونده و انتشار عفونت از طریق خون مسئلهی شایعی است. این قارچهای دیمورفیک دارای اپیدمیولوژی و پاتوژنزیس مشابهی هستند؛ به این صورت که معمولاً یک راه ورودی ریوی بعد از استنشاق آئروسلهای عفونیزا، یک پاسخ دفاعی اولیهی میزبان توسط لکوسیتهای پلیمرفونوکلئر و ماکروفاژهای ریوی در نتیجهی تهاجم ریوی و بدنبال آن ایجاد یک پاسخ هومورال و ایمنی با واسطه سلولی بطور اختصاصی دیده میشود.
- آبنرمالیتیهای تکنیکال یا آناتومیکال
حضور آبنرمالیتیهای تکنیکی یا آناتومیکی که منجر به تجمع مایع میشوند (خون، ادرار یا صفرا، و یا لنف)، بافتهای مرده، و نیاز به قرار دادن کاتتر برای درناژ و دیگر اجسام خارجی که سطوح موکوکوتانئوس را مساعد میکند میتوانند بصورت قابل ملاحظهای در ریسک عفونت سهیم باشند. حوادث ناگوار جراحی، دستگاههای دسترسی عروقی و نیاز به حمایت طولانی مدت تنفسی همگی میتوانند در اینجا نقش داشته باشند.
- فاکتورهای داروینین
اکنون فاکتورهای داروینین بعنوان شرکاء مهم در پاتوژنز عفونتهای ویژهای شناخته شده است. شایعترین مثال در مورد این پدیده هنگامی است که درمان با آنتیبیوتیک وسیعالطیف داده شده است در حالتی که یک مشکل آناتومیکی تصحیح نشده باشد. سوپرانفکسیون کاندیدا یک نتیجهی متداول است که نیاز به اصلاح جراحی و نیز درمان ضد قارچی سیستمیک دارد. نوع دیگر از اثرات داروینین موقعی است که مقادیر زیادی از فاکتورهای رشد وجود دارند و در نتیجه شرائط را برای رشد بیش از حد میکروبی مطلوب میکنند، بنابراین مقادیر اضافی آهن میتواند به زایگومایکوزیس، لیستریوزیس، و سایر عفونتهای تهدید کننده کمک کند.
عفونتهای قارچی
از همان نخستین روزهای انجام پیوند اعضاء، عفونتهای قارچی یک عامل مهم ابتلاء و مرگ و میر در بین این دسته از بیماران بوده است. دامنهی این عفونتها از موارد نسبتاً پیش پا افتاده و سطحی مثل کلونیزاسیون جلدی مخاطی کاندیدائی تا عفونتهای تهدید کنندهی حیات و یا عفونتهای منتشره با انتشار به چند ارگان متغیر میباشد. یک اختلاف مهم در بیماران پیوندی در مقابل میزبانانی که سیستم ایمنی آسیب دیدهای ندارند این است که انسیدانس بیماری منتشره و تهاجمی در هر رخداد کلونیزاسیون قارچی در بین بیماران پیوندی بسیار بالاتر است؛ بعنوان مثال، اگر ریسک انتشار احشائی از یک کاندیدمی گذرا در میزبان نرمال حدود 5% باشد در بیمار پیوند شده این ریسک بیشتر از 50 درصد است. بصورت مشابهی اگر کلونیزاسیون گذرا یا پایدار مجاری تنفسی با گونههای آسپرجیلوس در بیمارانی که سیستم ایمنی آنها سرکوب نشده (بویژه آنهائی که برونشیت مزمن و برونشکتازی دارند) غیر شایع نیست اما ریسک بیماری تهاجمی در آنها پائین است، در مقابل در بیمار پیوند شده هنگامی که یک کلونیزاسیون مجاری تنفسی ایجاد شده است ریسک تهاجم 50 تا 75 درصد است. بنابراین پیشگیری و درمان بیماری قارچی تهاجمی در گیرندگان پیوند یک نگرانی عمده است.
عفونتهای قارچی با بیشترین اهمیت در بیماران پیوندی را میتوان به دو دستهی عمومی تقسیم کرد: انواعی که در محدودههای جغرافیائی خاصی وجود دارند که به میکوزهای اندمیک مشهور هستند (مانند عفونت مربوط به بلاستومایسس درماتیتیدیس، کوکسیدیوئیدس ایمیتیس و هیستوپلاسما کپسولاتوم) و پاتوژنهای فرصت طلب (مثل گونههای کاندیدا، گونههای آسپرجیلوس، کریپتوکوکوس نئوفرمنس و اعضاء خانواده موکوراسه) که در محیط و در همه جا حضور دارند اما فقط در بیمارانی مثل گیرندگان پیوند عضو که نارسائی و نقائص قابل توجهی در ایمنی طبیعی و اکتسابی دارند عفونتهای تهاجمی ایجاد میکنند. علاوه بر این یک طبقه از پاتوژنهای فرصت طلب نوظهور (مثل آلترناریا و فوزاریوم) وجود دارند که اخیراً بصورت یک مشکل قابل توجه در بیماران گیرندهی پیوند مغز استخوان بروز کردهاند اما هنوز در بیماران پیوند اعضاء جامد شایع نیستند. پیشگیری، تشخیص و درمان عفونت قارچی در گیرندهی پیوند عضو یک چالش قابل ملاحظه را برای کلینیسین به دلائل زیر نشان میدهد:
- ارگانیسمهای مسئول در محیط بصورت فراگیری حضور دارند و یا اینکه همانند گونههای کاندیدا یک جزء معمولی فلور میکروبی آندوژن میباشند.
تغییرات نامحسوس در یکپارچگی و انسجام مخاطی جلدی، حالت ایمنوسوپرسیون، طبیعت کمی و کیفی چالش قارچی همگی در پاتوژنز بیماری کلینیکی دخالت دارند.
- ملایمت نسبی بسیاری از پاتوژنهای قارچی در ترکیب با پاسخ التهابی آسیب دیده که بوسیلهی درمان ایمونوسوپرسیو (که بعد از پیوند لازم است) بوجود آمده میتواند تا اندازه زیادی مدل تظاهرات کلینیکی عفونتهای تهدید کنندهی حیات را در این بیماران تغییر دهد: علائم کلینیکی، یافتههای فیزیکی و آبنرمالیتیهای رادیولوژیک ممکن است به مقدار زیادی کند شوند یا اینکه در طی دورهی کلینیکی بیماری بطور نسبی خود را دیرهنگام نشان دهند.
شناخت این حقیقت و نیاز به ارزیابی شکایات و یافتههای مبهم و نامحسوس (بعنوان مثال، بررسی دقیق نورولوژیکی شامل CT scan و پونکسیون مایع نخاع در ارزیابی سردردهای بدون علت، بویژه اگر تب نیز وجود داشته باشد، بیوپسی از لزیونهای پوستی مشکوک، CT scan ریه در بیماران با یافتههای نامشخص و گنگ در رادیوگرافیهای سینه) اساسی هستند.
مهمترین پارامتر در تعیین موفقیت درمان برای عفونت قارچی مهاجم در بیمار پیوند شده سرعت و شتابی است که بوسیلهی آن تشخیص بنا گذاشته شده و درمان مؤثر آغاز گردیده است.
- تشخیص آزمایشگاهی عفونتهای قارچی سیستمیک بسیار مشکل است، انجام کشتهای خون، مایعات بدن، و خلط که در بسیاری از بیماران غیرحساس است و سنجشهای ایمنولوژیک (تستهای پوستی و تستهای سرولوژیکی) در بسیاری از موارد- حداقل تا حدودی بعلت استفاده از درمان ایمنوسوپرسیو- غیر قابل اعتماد هستند. در بسیاری موارد بیوپسی تهاجمی از بافت تنها راه رسیدن به تشخیص است و باید بعنوان بخشی از راهکار جسورانه در چنین بیمارانی در نظر گرفته شود.
- درمان عفونت قارچی تهاجمی در چنین بیمارانی به دلائل زیر یک چالش مهم است حتی بعد از اینکه تشخیص صحیح صورت گرفته باشد:
آزمایش in vitro قابل اعتماد و مطمئن ایزولههای قارچی برای حساسیت ضد میکروبی هنوز دوران طفولیت خود را میگذراند، بعلت طبیعت تحت حاد- مزمن بیماری قارچی در این دسته از بیماران، درمان باید طولانی مدت باشد. از طرفی درمان طولانی مدت بدلیل سمیت سرشتی داروها (بویژه آمفوتریسین B ) و واکنشهای متقابلی که بین تمامی داروهای ضد قارچی مهم با سیکلوسپورین و تاکرولیموس وجود دارد اغلب مشکل است. دو داروی ذکر شده در حال حاضر تکیهگاه اصلی درمان ایمنوسوپرسیو میباشند. بدلیل چنین مشکلاتی است که هدف کلینیسین بعوض پرداختن به درمان بیماری کلینیکی باید به پیشگیری از عفونت قارچی تهاجمی معطوف شود.
خطر عفونت قارچی در گیرندگان پیوند عضو
میزان خطر عفونت قارچی تهاجمی در بیماران گیرنده پیوند عضو بوسیلهی تأثیر متقابل مابین سه فاکتور با یکدیگر معین میشود: مواجهههای اپیدمیولوژیک با عامل قارچی، وضعیت خالص ایمنوسوپرسیون بیمار و حضور آبنرمالیتیهای تکنیکال یا آناتومیک که به انسجام و یکپارچگی سطوح جلدی مخاطی و بافت حساس صدمه میرساند. مواجهههای اپیدمیولوژیک با اهمیت میتواند در اجتماع (داخل جمعیت) و یا در داخل بیمارستان رخ دهد. در جامعه این مواجههها را به دو گروه عمومی شامل میکوزهای آندمیک و پاتوژنهای فرصت طلب تقسیم میکنند. در رابطه با میکوزهای آندمیک سه طرح کلی از بیماری مشاهده میشود: فعال شدن مجدد یک عفونت کهنه با کانون خفته اغلب با انتشار ثانویه، عفونت اولیهی پیشرونده اغلب با انتشار بعدی، و سوپرانفکسیون که در آن قبلاً وضعیت ایمنی فردی در نتیجهی ایمنوسوپرسیون کاهش یافته و فرد را حساس کرده است و اکنون در مواجههی مجدد با ارگانیسم بار دیگر عفونت منتشره حاصل میشود.
سندرمهای کلینیکی منتج شده شامل شکایتهای ریوی (سرفه، پلورزی، دیسپنه و غیره)، تب با علت ناشناخته، یا شواهدی از عفونت متاستاتیک، اغلب سطوح جلدی مخاطی و یا سیستم اعصاب مرکزی را درگیر میکنند. پاتوژنهای فرصت طلبی مثل کریپتوکوکوس نئوفرمنس، گونههای آسپرجیلوس و موکوراسه بخوبی از طریق جامعه کسب میشوند.
بیماری کلینیکی در محیطهائی مانند باغ یا مزرعه، کارهای ساختمانی و وضعیتهای دیگر موقعی که یک آئروسل از میکروارگانیسمها به مقدار زیاد و غیر معمول بوسیلهی بیمار حساس بلعیده میشوند ایجاد میگردد. اگرچه در اکثر موارد عفونت مکتسبه از طریق جامعه، مواجهه کمتر و نامحسوستر است و نمیتوان آن را براحتی شناسائی نمود. مواجهههای بیمارستانی با اهمیت که میتوانند منجر به عفونت قارچی تهاجمی شوند را به دو گروه کلی تقسیم میکنند: عفونتهای مربوط و وابسته به محل اقامت و عفونتهای غیر وابسته به آن، عفونتهای مربوط به نوع اول به اکتساب عفونت در بخش یعنی جائی که بیمار در آنجا اقامت دارد مربوط میشود، طغیانهای بیمارستانی مربوط به این حالت بوسیلهی گروههائی از موارد اتفاق افتاده در زمان و مکان مشترک مشخص میشوند. بسیاری از اینها مربوط به مواجهه با هوای آلوده شده با کنیدیهای آسپرجیلوس است. علاوه بر این گسترش عفونت از فرد به فرد معمولاً مربوط به دستهای شسته نشده پرسنل پزشکی میتواند انسیدانس عفونت مربوط به گونههای مقاوم و بویژه ویرولانت کاندیدا را افزایش دهد.
مواجهههای غیر وابسته به اقامت بیمار هنگامی که بیمار در بیمارستان جابجا میشود در داخل بیمارستان رخ میدهند، بعنوان مثال بیمار به اتاق عمل جراحی، یا به محل رادیولوژی و یا به آزمایشگاه کاتتریزاسیون قلب منتقل میشود. طغیانهای مربوط به این نوع احتمالاً نسبت به طغیانهای نوع قبلی بیشتر شایع هستند اما آشکار ساختن آنها اغلب مشکلتر است زیرا با رخدادهای مشابه در زمان و مکان مشابه مواجه نیستیم. نکتهی کلیدی بسیار مهم مربوط به حضور غیر وابسته به محل اقامت بیمار وقوع یک مورد عفونت قارچی تهاجمی در یک زمان، هنگامی است که حالت خالص ایمنوسوپرسیون بیمار برای اینکه چنین حادثهای رخ دهد به آن اندازه کافی نیست. حالت خالص ایمنوسوپرسیون یک عملکرد پیچیده است که بوسیلهی واکنش متقابل بین فاکتورهای زیر مشخص و تعیین میشود:
طبیعت درمان ایمنوسوپرسیو که تجویز شده است- دوز، طول مدت و پیامد موقتی و زودگذر، وجود یا فقدان لکوپنی، فاکتورهای متابولیکی مثل سوء تغذیهی پروتئین-کالری، اورمی، و احتمالاً هایپرگلیسمی، و حضور یا عدم حضور عفونت با یکی از ویروسهای سایتومگالوویروس، ویروس اپشتاینبار (ویروسهای ایمنومدولیتینگ)، ویروس هپاتیت B و C و ویروس HIV.
اگرچه برنامهی ایمنوسوپرسیو تعیین کنندهی ابتدائی حالت خالص ایمنوسوپرسیون است، اهمیت برخی از فاکتورهای دیگر توسط آمارهای زیر نشان داده شده است (از برنامهی پیوند در بیمارستان عمومی ماساچوست):
خطر عفونت قارچی تهاجمی در بیماران با سطوح آلبومین کمتر از gr/dl 2.5 پنج تا ده برابر بزرگتر است، تقریباً 90 درصد از موارد آسپرجیلوزیس مهاجم و عفونتهای کریپتوکوکال در عفونت با ویروسهای ایمنومدولیتینگ مانند CMV اتفاق میافتد. در واقع اگر چنین عفونتهائی در غیاب عفونت ویروسی واقع شود این مسئله باید شروع کنندهی یک جستجو برای مواجههی محیطی زیاده از حد باشد. یک فاکتور تعیین کنندهی مهم برای خطر عفونت در بیمار پیوند شده جنبههای تکنیکال- آناتومیک عمل پیوند و مراقبت مربوط به عمل جراحی است (perioperative care)، بنابراین حضور بافت ضعیف شده، تجمع مایع و ادامهی نیاز به کاربرد اجسام خارجی مثل دستگاهها یا وسایل دسترسی وریدی، کاتترهای درناژ کننده و لولههای اندوتراشه، بصورت قابل توجهی خطر عفونت را افزایش میدهند و این خطر شامل خطر مربوط به گونههای کاندیدا نیز میباشد. علاوه بر این موفقیت درمان تا حدودی بوسیلهی توانائی کلینیسین برای اصلاح مشکل آناتومیک/ تکنیکال که منجر به عفونت در اولین محل شده است تعیین میشود. نقص و نارسائی برای اصلاح “آشیانهی اکولوژیک” که در آن عفونت توسعه پیدا کرده است به انتخاب ارگانیسمهای مقاوم به دارو و نقائص درمانی منجر خواهد شد.
جدول زمانی عفونت قارچی در بیمار دریافت کنندهی پیوند عضو
بدلیل اینکه رژیمهای ایمونوسوپرسیو در پیوند اعضاء استاندارد شده است، این امکان بدست آمده که بتوان یک جدول زمانی را تعریف کرد که چه موقع بعد از پیوند و کدام عفونتهای قارچی رخ خواهند داد. یک چنین برنامه یا جدول زمانی از سه جهت مفید است؛ در تعریف کردن تشخیص افتراقی برای یک فرد بیمار که یک سندرم بالینی بیماری عفونی را نشان میدهد، بعنوان ابزاری برای نشان دادن یا آشکار کردن موقعیتهای محیطی بالقوه خطرناک بویژه داخل بیمارستان، زیرا استثناها به برنامه زمانی بعنوان کلیدی برای حضور یک خطر اپیدمیولوژیک بیش از حد و نیز بعنوان یک راهنما برای تجویز استراتژیهای پیشگیری کنندهی هزینه- اثربخشی باید در نظر گرفته شوند. جدول زمانی برای عفونت قارچی در بیمار پیوند عضوشده را میتوان بطور مناسبی به سه بخش تقسیم نمود:
اولین ماه بعد از پیوند
در این دورهی زمانی 3 نوع عفونت اتفاق میافتد:
- عفونتی که از قبل در فرد گیرندهی پیوند وجود داشته است و تا قبل از زمان عمــــل پیوند ریشه کن نشده و بنابراین بعلت عمل جراحی و ایمنوسوپرسیون بعد از انجام پیوند برانگیخته شده و بدتر میشود، پس لازم است قبل از پیوند هرگونه عفونت فعالی بدقت غربالگری شود و همچنین توجه ویژهای به سابقه ایمنوسوپرسیون قبل از پیوند داشت. افرادی که مبتلا به بیماری کرون یا سیروز صفراوی اولیه و یا کاردیومیوپاتی هستند در تلاشی ناامیدانه برای پیوند بصورت مزمن کورتیکوستروئید دریافت کردهاند و به عفونت با پنموسیستیس و یا کریپتوکوکوس مبتلا هستند و مورد عمل پیوند قرار میگیرند. این عفونتها در زمان کوتاهی بعد از پیوند بصورت مشکل عمدهای خود را نشان میدهند.
- عفونتی که با آلوگرافت انتقال مییابد و مربوط به دهندهی ارگان است، عفونت پارانشیمال ممکن است در ایجاد عفونتهائی مثل هیستوپلاسموزیس و سایر قارچهای آندمیک در گیرندهی پیوند سهیم باشند.
- شایعترین عفونتها در این بازهی زمانی عفونتهای مرتبط با زخم یا آسیبهای مربوط به جراحی، همچنین عفونتهای ریوی، عروقی، یا کاتتر درناژ مربوط به عمل جراحی مربوط به پیوند عضو است که بطور مشابهی در بیمارانی که ایمنوسوپرس نیستند نیز واقع میشود. تعیین کنندهی اولیه مهارت تکنیکی است که در آن جراحی و مراقبتهای مربوط به عمل جراحی مدیریت شده است.
گونههای کاندیدا مهمترین علت عفونت قارچی در این دوره ی زمانی هستند. عفونت آسپرجیلوسی در این زمان اتفاق نمیافتد زیرا طول مدت درمان ایمنوسوپرسیو به اندازهی کافی پایدار نبوده است که اجازه دهد چنین عفونتی رخ دهد، مگر آنکه یک مواجههی محیطی فوقالعاده شدید اتفاق افتاده باشد، بنابراین پیشگیری ضد قارچی بر روی جراحی متمرکز میشود که از نظر تکنیکی بدون عیب و نقص باشد و نیز به مراقبت بعد از عمل جراحی و استفادهی مدبرانه از پروفیلاکسی فلوکونازول برای بیمارانی که بخصوص در معرض خطر زیاد عفونت کاندیدیائی هستند (مانند بیماران پیوند کلیه با آناستوموز صفراوی کولدوکوژوژنوستومی، بیماران پیوند ریه، و گیرندگان آلوگرافت پانکراتیک).
دورهی زمانی یک تا شش ماه بعد از پیوند
در این دورهی زمانی حالت خالص ایمنوسوپرسیون بطور استثنائی بالا است زیرا ایمنوسوپرسیون پایداری وجود داشته و نیز اثرات ویروسهای ایمنومدولیتینگ بویژه CMV که اثرات آن در این دوره در بیشترین حد خود است وجود داشته است. در نتیجه چنین عفونتهائی مانند عفونتهای مربوط به گونههای آسپرجیلوس در غیاب یک مواجههی شدید غیر قابل انتظار میتوانند رخ دهند. راهبردهای پیشگیرانه شامل درمانهای ضد ویروسی بر علیه CMV، تضمین کیفیت هوائی که بیمار با آن مواجه است (بعنوان مثال استفاده از فیلترهای hepa در بخش پیوند)، و درمان پیشگیرانه حتی اگر برای یکبار هم کلونیزاسیون آسپرجیلوس در مجاری تنفسی اثبات شده باشد.
دورهی زمانی بیشتر از شش ماه بعد از پیوند
در این دورهی زمانی برحسب میزان خطر بیماران برای ابتلاء به عفونتهای قارچی ممکن است به دو گروه تقسیم شوند: بیش از 80% بیمارانی که نتیجهی خوبی از پیوندشان گرفتهاند با عملکرد رضایتبخش عضو پیوند شده بوسیلهی ایمنوسوپرسون حفظ شده، باقی بیماران که سرانجام ضعیفی داشتهاند با عملکرد مختل شدهی عضو پیوندی، یک تاریخچه از درمان با مقادیر بیش از حد ایمنوسوپرسیو بصورت حاد و مزمن و اغلب عفونت ویروسی ایمنومدولانت مزمن همراه هستند.
گروه اول در معرض کمترین خطر برای عفونت قارچی تهاجمی هستند مگر اینکه برخوردهای محیطی فوقالعاده زیادی صورت گیرد، شایعترین عفونتهای قارچی که مشاهده میشود عفونت جلدی مخاطی کاندیدائی است و بندرت ندولهای ریوی بدون علامت مربوط به کریپتوکوکوس نئوفرمنس نیز دیده میشود.
در مقابل گروه دوم که آن را- خانه به دوش- “chronic ne’er do wells” نامیدهایم در معرض بیشترین خطر در تمام جمعیتهای پیوندی برای کریپتوکوکوزیس منتشره، آسپرجیلوزیس مهاجم، و در بیمارانی که تاریخچهی اپیدمیولوژیک مناسبی دارند، عفونت منتشره با میکوزهای آندمیک هستند. راهبرد فعلی از یک طرف نگهداشتن چنین بیمارانی روی پروفیلاکسی فلوکونازول بطور نامحدود و از سوی دیگر به حداقل رساندن برخوردهای خطرناک محیطی است.
عفونتهای قارچی با اهمیت ویژه در گیرندگان پیوند عضو
عفونتهای قارچی فرصت طلب
آسپرجیلوزیس. گونههای آسپرجیلوس سه دسته بیماری کلینیکی هم در میزبانان نرمال و هم در میزبانی که سیستم ایمنی آنها آسیب دیده است ایجاد میکنند:
- واکنشهای ازدیاد حساسیت، بعنوان مثال آسم و آلوئلیت آلرژیک اکسترینزیک
- سندرومهای کلونیزاسیون، بعنوان مثال تشکیل توپ قارچی یا مایستوما در سینوسهایی که قبلاً آسیب دیدهاند و بسیار شایعتر در حفرههای ریوی یا محلهای برونشیکتازی، و موسوم به آسپرجیلوزیس برونکوپولمونری، که در آن کلونیزاسیون درخت تراکئوبرونشیال در میزبانان به ظاهر نرمال اتفاق میافتد و موجب سرفه، انفیلتراهای ریوی ناپایدار، و کوتاه شدن نامنسجم (بریده بریدهی) تنفس میشود.
- آسپرجیلوزیس تهاجمی که تقریباً و منحصراً در افرادی که سیستم ایمنی لطمه دیده دارند اتفاق میافتد، در بیمار پیوند شده بیماری مهاجم مسئلهی مهمی است، اگرچه کلونیزاسیون بدون علامت مجاری تنفسی، خطر برجستهای از تهاجم بعدی را در بر دارد و بنابراین در مقولهی پیشگیری از بیماری مهاجم اهمیت دارد.
گونههای آسپرجیلوس در همه جا وجود دارند اما بویژه آماده هستند که در بیماران پیوند شده در حالتهای بیمارستانی یا غیر بیمارستانی که در آن فعالیتهای ساختمانی صورت میگیرد که منجر به تولید آئروسلهای محتوی کنیدیهای آسپرجیلوس است عفونت ایجاد کنند. علاوه بر این استعمال ماری جوانا نیز منجر به آسپرجیلوزیس مهاجم میشود زیرا ماری جوانا عموماً با مقادیر زیادی از اسپورهای آسپرجیلوس آلوده شده است. استنشاق این اسپورها در بیماران پیوندی منجر به ایجاد برونکوپنومونی یا عفونت سینوسهای اطراف بینی، با بیماری ریوی که بسیار شایعتر از بیماری سینوس است میشود. بعنوان راهی دیگر تلقیح مستقیم پوست آسیب دیده (محلهای دسترسی عروقی، زخمها، سوختگیها، محلهای خیس خورده و نرم شده) نیز میتواند به عفونت منجر شود. در بیماران پیوند ریه دو فرم اضافی بیماری مهاجم یعنی عفونت برونشیال خط بخیه آناستوموتیک، با نکروز بعدی و پارگی و بیماری تراکئوبرونشیال میتواند رخ دهد. بندرت، کانونهای میکروسکوپیک عفونت آسپرجیلوسی در بافت یا ارگان پیوند شده که از عفونت مربوط به دهنده نتیجه شده است میتواند عفونت منتشره در گیرندهی عضو ایجاد کند. هر آنچه که راه ورود باشد تهاجم عروق خونی صفت بارز و علامت مشخصهی آسپرجیلوزیس مهاجم است و به 3 خصوصیت از این عفونت شامل انفارکتوس بافتی، خونریزی و انتشار متاستاتیک توسط جریان خون منتج میشود.
از بین تمام گونههای آسپرجیلوس، آسپرجیلوس فومیگاتوس و آسپرجیلوس فلاووس اکثر موارد کلینیکال را در بر میگیرند، در حالیکه گونههای دیگر مثل آسپرجیلوس نیجر معمولاً فقط آلوده کنندهی آزمایشگاهی هستند. عملکرد کافی لکوسیتهای پلیمرفونوکلئر و ایمنی با واسطهی سلولی کلیدهای دفاع میزبان بر علیه آسپرجیلوز مهاجم هستند. از لحاظ بالینی بالاترین انسیدانس آسپرجیلوز مهاجم در آن دسته از بیمارانی رخ میدهد که در آنها حالت خاصی از ایمنوسوپرسیون و بصورت شدیدی وجود دارد: بیماران یک تا 4 ماه بعد از پیوند با عفونت فعال CMV و “chronic ne’er do wells” بیش از 6 ماه بعد از پیوند. اگرچه حتی بیمارانی که حالت خالص ایمنوسوپرسیون آنها در حداقل مقدار است (بعنوان مثال، آنهائی که کمتر از 3 هفته بعد از پیوند قرار میگیرند) اگر مواجههی محیطی به اندازه کافی زیاد باشد میتوانند آسپرجیلوزیس مهاجم را گسترش دهند.
Characteristics of the most common major pathogenic Aspergillus species
| Species | Global/Regional Distribution | Pathogenicity | Typical Clinical Presentation |
| A. fumigatus | Ubiquitous throughout world; decomposing vegetative matter is primary ecological niche; often found in and around human dwellings in rural areas; common in the home | Most pathogenic species; isolated in ~66% of all clinical infections, but with decreased prevalence in recent years | Responsible for >90% of invasive aspergillosis cases; most rapidly growing species; also causes pulmonary disease, aspergilloma, allergic bronchopulmonary aspergillosis, may be amphotericin B resistant |
| A. flavus | Found in soil and decaying vegetation | Isolated in ~14% of clinical infections | Common isolate in sinusitis, skin, and invasive infections; produces an aflatoxin; may be amphotericin B resistant |
| A. terreus | Found in soil; Increasingly found in water supplies | Isolated in ~5% of clinical infections | Increasingly reported in invasive infection in immunocompromised hosts; resistant to amphotericin B, more susceptible to newer azoles |
| A. niger | Found in soil, on plants, and in food and condiments (for example pepper) | Isolated in ~5% of clinical infections | Uncommon in invasive infections; usually causes superficial infection (for example otitis externa); common colonizing isolate |
| A. nidulans | Found in decomposing vegetative matter | Isolated in a small percentage of clinical infections | Causes diverse infections, especially in patients with chronic granulomatous disease; may be resistant to amphotericin B |
| A. ustus | Found in decomposing vegetative matter | Isolated in a small percentage of clinical infections | Causes disseminated infection, otitis media, skin burn and cutaneous infections, and endocarditis |
پیامد مهم این اصل این است که یک مورد منفرد آسپرجیلوز مهاجم که در اولین ماه بعد از پیوند رخ میدهد (یک دورهی طلائی که در طول آن عفونت فرصت طلب تنها تحت شرائط مواجههی غیر معمول رخ میدهد) باید آغازگر یک جستجو برای شناختن و برطرف کردن خطرهای محیطی باشد زیرا خطر بیماری اپیدمیک میرود. به لحاظ بالینی آسپرجیلوز مهاجم ریهها شایعترین فرمی است که مشاهده میشود و میتواند هم بصورت فرم اولیهی آسیب ریه یا بعنوان یک مهاجم ثانوی بعد از آسیب ریوی مربوط به ویروس، باکتری، انفارکتوس ریوی یا آسیب مربوط به آسپیراسیون رخ دهد. در هر دو این حالات علائمی که به آسپرجیلوزیس نسبت داده میشود شامل تب، سرفه، پلورزیتی (ذاتالجنب)، هموپتیزی، تولید خلط و کوتاه شدن تنفس است. در 30 تا 50 درصد موارد بیماری متاستاتیک بویژه مربوط به پوست و مغز در اولین زمان تشخیص حضور دارند. در واقع در 10درصد موارد محل عفونت متاستاتیک ممکن است اولین تظاهر کلینیکی این حالت باشد. تظاهر رادیولوژیک مشخصهی آسپرجیلوزیس مهاجم ریوی، بیماری کانونی ریوی با یک ندول و یا حالت سفت شدگی (consolidation)، اغلب با حفره است.
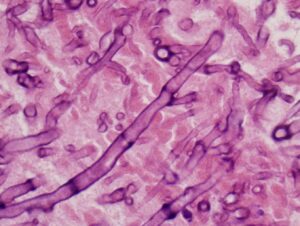
نمای هیستوپاتولوژیک آسپرجیلوما
برخلاف بیمار مبتلا به لوسمی و آسپرجیلوزیس، نشانههای halo و نشانههای هلال هوا در گیرندگان پیوند ارگان غیرمعمول هستند. تشخیص به یک نمونهی بیوپسی هم برای آزمایش هیستولوژیک و هم برای کشت نیاز دارد. درمان آسپرجیلوزیس مهاجم در بیماران پیوندی هم بدلیل سمیت و هم بدلیل اثربخشی آن بعنوان یک چالش باقی مانده است. اگرچه بیش از 50% میزان موفقیت میتواند در غیاب متاستازهای مغزی و یا نواحی دیگر بدست آید، موقعی که انفارکتوس مغزی وجود دارد بقاء کمتر از 5% است. آمفوتریسین B بعنوان درمان اساسی برای آسپرجیلوزیس مهاجم باقی مانده است. نشان داده شده است که فرمولاسیونهای لیپیدی جدید آمفوتریسین B کمتر نفروتوکسیک هستند اما اثربخشی آن در مقایسه با آمفوتریسین B معمولی هنوز باید روشن شود. ایتراکونازول جذب نامطمئنی دارد، بنابراین برای “تکمیل و تمام کردن درمان” (wrapup therapy) بعد از آنکه کنترل فرآیند بدست آمد، در نظر گرفته میشود. بدلیل مشکلاتی که در درمان آسپرجیلوزیس مهاجم وجود دارد (با توجه به نکات زیر که در زمان حاضر مسئول هستند) توجه زیادی به پیشگیری باید مبذول شود:
- اولین و شاخصترین مسئله این است که اطمینان داده شود که تأمین هوای تمیز برای بیماران تا جائی که ممکن است مهیا شود، حتی اگر این بدین معنی باشد که فیلترهای هپا را در بخشهای بستری بیماران راهاندازی کرد و هنگامی که بیماران در محیط بیمارستان جابجا میشوند و حرکت میکنند از ماسکهای محافظتی استفاده کنند.
- کوششهائی برای محدود کردن حالت خالص ایمنوسوپرسیون با پیشگیری از عفونت با CMV و سایر ویروسهای ایمنومدولیتینگ که به نظر میرسد زمینه را برای آسپرجیلوزیس مهاجم در بیش از 90% موارد مستعد میکند (آن مواردی که مربوط به یک چالش بخصوص اپیدمیولوژیک بالا نیستند) متمرکز شود.
- درمانهای ضد قارچی پیشگیرانه هنگامیکه کلونیزاسیون مجاری تنفسی با آسپرجیلوس فومیگاتوس یا آسپرجیلوس فلاوس نشان داده شد جهت پیشگیری از شروع بیماری مهاجم در نظر گرفته شود.
- شناسائی، تشخیص و درمان بموقع بیماری مهاجم.
کلنی آسپرجیلوس فومیگاتوس
در این رابطه مسئله بویژه سودمند این است که یک راهکار جسورانه برای ارزیابی لزیونهای پوستی مجهول بکار گرفته شود (در حدود 20% موارد لزیونهای پوستی بعنوان اولین نشانهی قابل شناخت آسپرجیلوزیس تهاجمی حضور دارند) و استفاده از تصاویر CT قفسهی سینه یا سینوسها برای ارزیابی موارد غیر طبیعی حداقلی روی رادیوگرافی سینه، سندرومهای تنفسی مبهم و تبهای با علت ناشناخته در بیماران یا حالت خالص ایمنوسوپرسیون بالا مد نظر قرار گیرند.
کاندیدیازیس
طیف سندرومهای کلینیکی که توسط گونههای کاندیدا در گیرندگان پیوند رخ میدهد کاملاً وسیع است و دامنهی آن از سندرومهای مربوط به رشد بیش از حد و سطحی موکوکوتانئوس تا عفونتهای جریان خون و پتانسیل عفونت متاستاتیک نوسان دارد. در پاتوژنز عفونت کاندیدائی باید سه مرحله را در نظر داشت:
- اولین مرحله افزایش در تعداد ارگانیسمهائی است که بر روی سطوح جلدی و مخاطی حضور دارند و مربوط به افزایش دسترسی و یا فراهم شدن بیشتر مواد مغذی بویژه گلوکز و گلیکوژن برای این پاتوژن فرصت طلب است. این مسئله در دو وضعیت اتفاق میافتد: حالت اول هنگامی است که فلور باکتریال نرمال بعلت استفاده از آنتیباکتریالهای وسیعالطیف ریشهکن میشود و حالت دوم وقوع شرائطی است که در آن سطح گلوکز در ترشحات بدن بدلیل فاکتورهای متابولیک افزایش مییابد (بعنوان مثال در دیابت ملیتوس خوب کنترل نشده، یا استفاده از دوزهای بالای کورتیکوستروئیدها و یا در حاملگی).
- دومین مرحله ایجاد یک رخنه در یکپارچگی و انسجام موکوکوتانئوس در محلی که پرولیفراسیون کاندیدا رخ داده است میباشد، بنابراین کاندیدا میتواند به بافتها و نیز به جریان خون نفوذ کند. این حالت معمولاً در بیمار تحت عمل پیوند در نتیجهی استفاده از وسائل و دستگاههای دسترسی عروقی، درنهای جراحی و کاتترها، یا آسیب و صدمهی بافت تروماتیک و جراحی شده رخ میدهد.
- موقعی که نفوذ کاندیدا انجام گرفت کلید دفاعهای میزبان بر علیه عفونت کاندیدائی عملکرد دست نخوردهی لکوسیتهای پلیمرفونوکلئر و ایمنی با واسطهی سلولی است، ایمنی با واسطهی سلولی بطور چشمگیری در بیمار پیوند عضو مختل شده است.
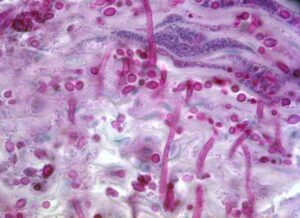
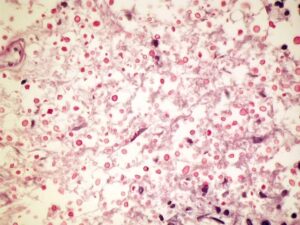
نمای هیستوپاتولوژیک کاندیدیازیس ریوی
مطالعات جدید اپیدمیولوژیک که از تکنیکهای تایپینگ مولکولی استفاده کردهاند نشان دادهاند که فلور اندوژنوس (درونزاد) یک شخص میتواند بوسیلهی تماسهای داخل محیط بیمارستان تغییر یابد. انتشار یا گسترش شخص به شخص (اغلب توسط دستهای پرسنل پزشکی) استرینهای خاص که اغلب گونههای کاندیدای مقاوم به دارو هستند اثر مهمی بر روی انسیدانس عفونت کاندیدائی دارند و برای ادارهی آن درمان الزامی است. اگرچه کاندیدا آلبیکنس و کاندیدا تروپیکالیس هنوز بیشترین عفونت کاندیدائی در بیمار پیوند ارگان را به خود اختصاص میدهند، استفاده از رژیمهای پروفیلاکتیک و انتشار داخل بیمارستانی (عفونت بیمارستانی) گونههای کاندیدا به افزایش انسیدانس عفونتها با کاندیدا گلابراتا و کاندیدا کروزی و سایر گونههای کاندیدا که احتمالاً به فلوکونازول مقاوم هستند منجر شده است. این مسئله بویژه اگر آبنرمالیتیهای متابولیک تکنیکال- آناتومیک (آشیانهی اکولوژیک) که منجر به عفونت کاندیدال میشود در اولین مکان اصلاح نشده باقی بماند، حقیقت دارد. عفونت موکوکوتانئوس در بیمار پیوند عضو در نواحی خیس خوردهی پوستی و در حلق، مری یا واژن غیرمعمول نیست. این حالت تنها اگر دستکاری جراحی یکی از این نواحی صورت گیرد معمولاً اهمیت دارد، در این حالت نفوذ از طریق گردش خون میتواند اتفاق افتد. اگرچه گونههای کاندیدا بطور معمول از خلط جدا میشوند، آنها بندرت علت عفونتهای مجاری تنفسی هستند. استثناء عمده نسبت به این قاعده، بیماری است که پیوند ریه شده است و خط بخیهی برونشیال وی در معرض خطر عفونت کاندیدال است. شایعترین فرمهای عفونت خطرناک کاندیدائی در این جمعیت از بیماران به شرح زیر است:
عفونت مرتبط با دسترسی عروقی
انسیدانس این نوع عفونت در موقعیتهائی که در آن سطح کلونیزاسیون کاندیدا در سطوح جلدی مخاطی زیاد شده است در حال افزایش است. حتی کاندیدمی گذرا در بیماران پیوندی به حذف و برداشتن دستگاه دسترسی عروقی مسئول و شروع درمان سیستمیک ضد قارچی حکم میدهد.
عفونت مربوط به درنها و کاتترها (شامل کاتترهای دیالیز پریتوانی)
مجدداً مدیریت مطلوب حکم میکند که جسم خارجی برداشته شود و درمان ضد قارچی سیستمیک شروع شود. یک فرم بخصوص مهم از این نوع عفونت کاندیدا توسعه و گسترش کاندیدوری در یک بیمار پیوند کلیهای است که اغلب در نتیجهی استفادهی جاری و یا قبلی از کاتتر مثانه در بیمار است. حتی کاندیدوری بدون علامت در بیماران پیوند کلیه بویژه در آن افراد که ظرفیت تخلیهی مثانهی مختل شده دارند میتواند به تشکیل توپهای قارچی مسدود کننده در محل اتصال میزنای به مثانه (ureterovesical junction) منجر شده و موجب پیلونفریت بالا رونده شود. بدلیل اینکه یک چنین پروسهای مرگ و میر بیش از 75% را دربردارد، از درمان ضد قارچی پیشگیرانه از کاندیدوری بدون علامت که بعد از برداشتن کاتتر مثانه بصورت پایدار باقی مانده طرفداری میشود.
عفونت مرتبط با روشهای جراحی
عفونت مرتبط با جراحی در گیرندگان پیوند آلوگرافت کبد و پانکراس بسیار شایع است. در بیماران کبدی انسیدانس عفونت زخم عمیق مربوط به گونههای کاندیدا در اولین ماه بعد از پیوند تا میزان 40 درصد بالا بوده است. فاکتورهای خطر شامل نیاز به تجسس مجدد یا تکرار پیوند اضطراری، نیاز به مقادیر زیاد خون در حین عمل و در حوالی زمان عمل، حضور لنفوسلها (lyphoceles)، خون، یا صفرا که نیازمند درناژ مستمر کاتتری و ایجاد بافت devitalized است. بنابراین فاکتورهای تکنیکی کلید تعیین کنندهای مربوط به احتمال گسترش عفونت کاندیدائی است. در بیمار پیوند آلوگرافت پانکراتیک فاکتورهای کلیدی که حضور دارند یکبار دیگر فاکتورهای تکنیکال مرتبط با جراحی است، این حقیقت که پوست بیماران دیابتیک بیش از افراد نرمال گونههای کاندیدا را در خود دارند و نیاز برای یک کاتتر مثانه برای 5 تا 7 روز بعد از پیوند (به منظور حفاظت از خط بخیه آناستوموز دودنال cuff-bladder که معمولترین راه برای فراهم کردن برون رفت ترشحات اگزوکرین پانکراتیک) نیز از عوامل مساعد کننده است. خطر بخصوص در زنان بزرگ است زیرا واژن در زمان کاتتر درناژ مثانه به دلیل ارتباط نزدیک و در موقعیت مجاورتی با این منبع عفونت دارای تعداد فراوانی کاندیدا است.
منظره هیستوپاتولوژیک ازوفاژیت کاندیدائی– رنگآمیزی PAS
در مطالعهای(Olczak,2010) که به منظور بررسی میزان کلونیزاسیون حفرهی دهانی با گونههای کاندیدا بعد از پیوند کلیه یا کبد در 185 بیمار در محدودهی سنی 4/2±13/1 سال صورت گرفت، گونههای کاندیدا در مخاط دهان 34% از گیرندگان پیوند عضو و در 27% از افراد نرمال بعنوان کنترل مشاهده شد. شایعترین گونه کاندیدا آلبیکنس بوده است. در مطالعهی مشابه دیگری (Al-Mohaya, 2002) حفرهی دهانی 58 بیمار دریافت کنندهی پیوند کلیه و 52 فرد سالم مورد بررسی قرار گرفت. شیوع کلونیزاسیون قارچی در بیماران پیوند کلیه بصورت معنی داری بیشتر از افراد سالم نبود (74/1 درصد در مقابل 59/6 درصد) اما دانسیتهی رشد در بیماران پیوند کلیه بیشتر بوده و کاندیدیازیس دهانی در 15/5 درصد بیماران پیوند شده دیده شد در حالیکه در افراد سالم مشاهده نگردید. بنابراین میتوان گفت که بدون توجه به ارگان پیوند شده و یا نوع ایمنوسوپرسیون پیگیری و پایش کشتهای قارچ شناسی دهانی بصورت منظم و تکرار شونده توصیه میشود و تشخیص افزایش دانسیتهی گونههای کاندیدا در حفرهی دهانی به شروع زودهنگام درمان ضد قارچی کمک خواهد کرد. عفونت قارچی مجاری ادراری در بیماران پیوند کلیه در یک مطالعه (Valera, 2006) بر روی 161 بیمار دریافت کنندهی پیوند کلیه به میزان 3 درصد بوده است.
پیشگیری
پیشگیری از عفونت کاندیدائی بدلائل آشکار نیاز به توجه کامل دارد. درمان ضد قارچی غیر قابل جذب موضعی یا خوراکی با نیستاتین یا کلوتریمازول در پیشگیری از کاندیدیازیس موکوکوتانئوس در گیرندگان پیوند کلیه و قلب و بدنبال اولین ماه بعد از پیوند در تمام گیرندگان پیوند آلوگرافت کاملاً مؤثر است. این راهبرد بویژه در بیماری که درمان آنتی باکتریال وسیعالطیف میگیرد مفید است. اکثر گروههائی که مورد پیوند پانکراس و پیوند ریه قرار میگیرند در حوالی زمان پیوند از پروفیلاکسی سیستمیک ضد قارچی با فلوکونازول در مقادیر 200 تا 400 میلی گرم در روز (که برای بد عملکردی کلیه تنظیم شده است) استفاده میکنند. در مورد پیوند کبد از راهبردهائی استفاده میشود که دامنهی آن از رفع آلودگی انتخابی رودهها قبل و بعد از پیوند تا استفادهی روتین از پروفیلاکسی فلوکونازول متغیر است و لذا در این مورد توافق کمتری وجود دارد. روشی که در بیمارستان عمومی ماساچوست جائی که انسیدانس عفونت مهاجم مربوط به کاندیدا بعد از پیوند کبد کمتر از 5% است به قرار زیر است:
نیستاتین یا کلوتریمازول خوراکی موقعی شروع میشود که بیمار در ردیفهای بالای لیست پیوند قرار میگیرد و بنابراین احتمالاً ظرف یک هفته پیوند آلوگرافت را دریافت میکند، ادامهی این حالت تا دورهی بعد از پیوند موجب میشود که با مشکلات تکنیکال اختصاصی مواجه نشویم و محدود کردن پروفیلاکسی فلوکونازول به بیماران در معرض خطر زیاد یعنی آن دستهای که به آناستوموز صفراوی کلدوکوژوژنوستومی نیاز دارند (در مقابل کلدوکوکولدوکوستومی) که در آن ژوژنوم باید باز شود، آنهائی که به تجسس دوباره (re-exploration) نیاز دارند، و آنهائی که در هفتههای قبل از پیوند کبد، آنتیبیوتیکهای وسیعالطیف دریافت کردهاند، بویژه اگر نیستاتین یا کلوتریمازول استفاده نشده باشد، محدود میباشد.
بیماران وخیمالحال مبتلا به سپسیس کاندیدائی باید با آمفوتریسین B درمان شوند و موقعی که بیماری کنترل شد دارو به فلوکونازول تغییر یابد. در صورتی که ارگانیسم به فلوکونازول مقاوم باشد (مانند کاندیدا کروزی یا کاندیدا گلابراتا) از ایتراکونازول استفاده شود. اکثر افرادی که بیماری تحت حادی دارند میتوانند بعنوان درمان اولیه با فلوکونازول درمان شوند بویژه هنگامی که گونههای جدا شده حساس بوده باشند. جنبهی بحرانی درمان توأم کردن درمان ضد قارچی با اصلاح فاکتورهائی که منجر به عفونت در اولین مکان شدهاند میباشد.
کریپتوکوکوزیس
کریپتوکوکوس نئوفرمنس یک ارگانیسم مخمری موجود در همه جا است که از طریق استنشاق وارد بدن میشود. کریپتوکوکوس نئوفرمنس یک مخمر فرصت طلب ملایمی است و هیچ نوع توکسینی ندارد اما یک کپسول پلی ساکاریدی دارد که آن را از فاگوسیت توسط سلولهای پلیمرفونوکلئر و نیز از عملکرد سیستم ایمنی با واسطهی سلولی محافظت میکند. مشاهدهی این کپسول پلیساکاریدی در خون و مایع مغزی نخاعی اساس تشخیص و نیز ارزیابی پاسخ به درمان است. متعاقب استنشاق ذرات قابل تکثیر (propagules) عفونی این قارچ بطور بالقوه سه پیامد ممکن است حاصل شود: پاکسازی عفونت، عفونت نهفته و ناپیدا، و عفونت حاد با و یا بدون انتشار خونی. دو حالت اول پیامد معمولی برخورد اولیه با کریپتوکوکوس نئوفرمنس است. عفونت نهفته توانائی این را دارد که دوباره فعال شده و بیماری کلینیکی ایجاد نماید بویژه بعد از شروع اختلال در سیستم ایمنی که در جمعیت عمومی غیرمعمول نیست. پاسخ پاتولوژیک به تهاجم کریپتوکوکال کاملاً متنوع است و از حالت بدون پاسخ (در آن دسته از بیمارانی که اختلال فاحش سیستم ایمنی دارند) تا یک پاسخ گرانولوماتوز قوی که مربوط به توانائی بنیادی بیمار در کنترل عفونت است فرق میکند. ماکروفاژهای فعال شده مهمترین نوع سلولی هستند که در این تلاش برای محدودسازی وسعت عفونت کریپتوکوکال شرکت دارند. کپسول پلی ساکاریدی کریپتوکوکوس نئوفرمنس که از فاگوسیتوز ممانعت میکند بعنوان فاکتور ویرولانس مهم در نظر گرفته میشود.
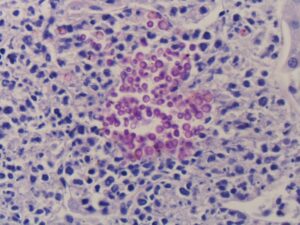
منظره هیستوپاتولوژیک مننژیت کریپتوکوکی– رنگآمیزی PAS
در بیمار پیوندی غالبترین فرم کلینیکی بیماری یک ندول بدون علامت است که در رادیوگرافی روتین از ریهها دیده میشود. تظاهر دیگر آن یک سندروم شبه آنفلوآنزا مرتبط با پنومونی است که ممکن است مشاهده شود. مهمترین فرم کریپتوکوکوزیس متعاقب انتشار سیستمیک آن پدید میآید، حدود 90% بیماران پیوندی که کریپتوکوکوزیس منتشره دارند بیماری CNS را نشان میدهند. محلهای دیگری که معمولاً گرفتار میشوند شامل پوست، سیستم اسکلتی و مجاری ادراری است. در 20 تا 30 درصد بیماران پیوندی با عفونت سیستمیک کریپتوکوکوس نئوفرمنس لزیونهای جلدی ممکن است اولین تظاهر چنین بیماری باشد. تهیهی یک بیوپسی از لزیونهای مشکوک پوستی قبل از آنکه بیماری CNS آشکار وجود داشته باشد فرصت درمان کریپتوکوکوزیس را مطرح میکند و در این حالت احتمال درمان بطور قابل ملاحظهای افزایش مییابد. اکثر موارد کریپتوکوکوزیس معمولاً بیش از 6 ماه بعد از پیوند رخ میدهند، استثنای عمدهای که در اینجا وجود دارد مربوط به گروهی از بیماران است که با تاریخچهای از ایمنوسوپرسیون برای بیماری زمینهای خود مورد عمل جراحی پیوند ارگان قرار گرفتهاند و یا اینکه سابقه دفع پیوند قبلی را داشتهاند و این بر عهده پزشک است که قادر به ارزیابی چنین بیمارانی به منظور احتمال عفونت کریپتوکوکال یا سایر عفونتهای فرصت طلب نظیر پنموسیستوز قبل از انجام پیوند باشد، بیماری منتشره بخصوص در جمعیت “chronic ne’er do well” رخ میدهد؛ یعنی دستهای از بیماران که سیستم ایمنی آنها بشدت سرکوب شده است.
مهمترین فرم عفونت کریپتوکوکال بطور مشخص فرم درگیرکنندهی CNS است. هرچند که بیماری پارانشیمال مغز ممکن است دیده شود، در تصویربرداری CT یا MRI بیماران پیوندی با کریپتوکوکوزیس، یک مننژیت تحت حاد- مزمن شایعترین تظاهر کریپتوکوکوزیس CNS است. شایعترین شکایت سردرد پایدار و مبهم و مشکوک معمولاً همراه با تب است که اغلب چندین هفته ادامه دارد، اما شکایات دیگر مثل تغییرات وضعیت ذهنی، اشکال در تمرکز و حتی نقائص نورولوژیک کانونی میتواند رخ دهد. علائم و نشانههای التهاب مننژیال در 50 درصد و یا بیشتر موارد در معاینات فیزیکی غایب است. برخلاف وضعیت برای سایر عفونتهای قارچی، تشخیص کریپتوکوکوزیس به سهولت تمام شده است. اگرچه ارگانیسم میتواند از خون، مایع مغزی نخاعی و گاهی اوقات ادرار اکثر بیماران جدا شود. سنگ بنای تشخیص نشان دادن حضور آنتیژن کریپتوکوکال در خون و مایع مغزی نخاعی است. این حالت به مقدار زیادی جایگزین روشهای سنتی مثل مرکب چین برای آزمایش میکروسکپی شده است. متأسفانه در این دسته از بیماران نتایج تستهای آنتیژنی اغلب منفی است و بنابراین برای تشخیص به بیوپسی نیاز است. فرمول مایع مغزی نخاعی در بیماران با مننژیت کریپتوکوکال برای عفونت قارچی تیپیک است. از جملهی این علائم، پلئوسیتوز لنفوسیتیک، پائین بودن غیر طبیعی میزان قند مایع مغزی نخاعی (hypoglycorrhachia)، فشار و پروتئین افزایش یافته میباشند، اما در صورت ظرفیت بالای ارگانیسم میتواند بطور کامل نرمال هم باشد. این مورد اخیر میزان ایمنوسوپرسیون زیاد را میرساند و نشانهی پروگنوستیک ضعیف است. به نظر میرسد که آمفوتریسین B و فلوکونازول به یک اندازه در درمان کریپتوکوکوزیس در بیماران پیوندی مؤثر باشند، هرچند که به نظر میرسد که دستیابی به فرآیند کنترل با آمفوتریسین B بسیار شایعتر است. روش جاری شروع درمان با آمفوتریسین B در بیماران با ناخوشی حاد است و سپس تغییر دادن آن به فلوکونازول هنگامی که پاسخ بدست آمده است. در بیماران با بیماری تحت حاد از آغاز از فلوکونازول استفاده میشود. طول مدت درمان بیماری بوسیلهی پاسخ سطوح آنتیژن کریپتوکوکال در خون و CSF تعیین میشود.
پنومونی کریپتوکوکال از حالت آسمپتوماتیک تا حالتی که دارای علائم قابل توجه باشد میتواند رخ دهد. بیماری ریوی بطور کلی اعم از پنومونی واقعی یا فقط بصورت یک ندول میتواند به همراه یک تست منفی سرمی برای آنتیژن کریپتوکوکال دیده شود، بنابراین به انجام تستهای تهاجمیتر مانند برونکوسکوپی و یا بیوپسی فرمان داده میشود. این بیماران باید برای درگیری در محلهای دیگر بدن مورد ارزیابی قرار گیرند و این ارزیابی باید شامل اسکن مغز، پونکسیون لومبار، اسکن استخوان، کشت ادرار و آزمایش پروستات باشد و یک آزمایش دقیق از پوست نیز برای یافتن شواهدی از لزیونهای کریپتوکوکال بعمل آید. در 20 درصد بیماران مبتلا به کریپتوکوکوزیس یافتههای پوستی شامل ندولها، پاپولها و زخمها جزء اولین علائم بیماری هستند. عفونت همزمان و دوتائی در این بیماران ناشایع نیست. چنین ترکیبهائی شامل توبرکلوز، نوکاردیوز و آسپرجیلوز همراه با بیماری کریپتوکوکال میباشند. مسئله کلیدی مهم در مورد عفونت کریپتوکال این است که به هر حال انتشار خونی رخ میدهد و در این صورت باید دانست که آیا سیستم عصبی مرکزی درگیر شده است؟ عفونت CNS کریپتوکوکی از نوع مننگوآنسفالیت است هرچند که جزء مننژیتی آن آشکارتر است. تغییرات پاتولوژیک همان پروسههای گرانولوماتوزی است که هم در مننژ و هم در مغز (لزیونهای تودهای سربرال گاهی اوقات در تصاویر مغز دیده میشود) وجود دارند.
برخی از علائم چشمی نیز ممکن است در این بیماران مشاهده شود که شایعتر از همه فلج اعصاب جمجمهای (بعنوان مثال ششمین عصب جمجمهای)، همچنین ادم پاپی (papilledema)، اندوفتالمیت و کاهش بینائی بدلیل افزایش فشار داخل جمجمهای است.
هر نقطهای از بدن میتواند مورد حملهی کریپتوکوکوس نئوفرمنس قرار گیرد دو ناحیه از نواحی بدن توجه ویژهای را میطلبد که شامل استخوانها و مفاصل، و غدهی پروستات میباشند. استئومیلیت کریپتوکوکال ممکن است بصورت یک عفونت ایزوله و یا اینکه بعنوان بخشی از یک عفونت منتشره که محلهای متعددی را درگیر کرده دیده شود. غدهی پروستات میتواند از عفونت کریپتوکوکال محافظت نموده و در این حالت در مقابل داروهای ضد قارچی مقاومت نسبی مینماید. از بین انواع عفونتهای قارچی که در بیماران پیوندی رخ میدهد تشخیص بیماری کریپتوکوکال آسانترین آنها میباشد مشروط بر اینکه احتمال وجود این عفونت در نظر گرفته شده باشد. کشت خون بویژه اگر از تکنیک لیز سانتریفیوژ استفاده شود حساسیتی در حدود 70% دارد. فرمول کلاسیك مایع نخاع برای مننژیت کریپتوکوکال پلئوسیتوز لنفوسیتیک، قند پائین، پروتئین بالا و افزایش فشار داخل جمجمهای است. آزمایش مرکب چین برای مایع نخاع در تقریباً 50% بیماران پیوندی به همراه بیماری CNS مثبت است. توانائی اندازهگیری پلی ساکارید کپسولی کریپتوکوکال در سرم و مایع نخاعی اساس و بنای تشخیص بیماری کریپتوکوکال است و باید در ارزیابی هر بیمار پیوندی با تب مشکوک و نیز با یافتههای موضعی که شرح داده شد در نظر گرفته شود.
زایگومیکوز
یک گروه از زیگومیستها که بیش از بقیه قابل توجه هستند عبارتند از: رایزوپوس، موکور و آبسیدیا که از علل موارد غیرمعمول عفونت نکروز دهنده و سریعاً پیشرونده در بیمار پیوند ارگان هستند. درمان با دوز بالای کورتیکوستروئید، دیابت ملیتوس (بویژه کتواسیدوز دیابتی)، اسیدوز پایدار به هر علت، و درمان با دسفروکسامین در سندرومهای ازدیاد آهن و آلومینیم فاکتورهای خطر اولیه در پاتوژنز موکورمایکوز هستند. سه طرح کلی زایگومیکوز در بیماران پیوندی رخ میدهد:
- عفونت اولیهی پوستی در محلهای تروماتیزه شده بوسیلهی درمانهای داخل رگی (extravasated)، زخمهای جراحی، یا استفاده از البسهی تنگ آلوده شده با اسپورانژیوسپورهای رایزوپوس
- عفونت اولیهی ریوی بدنبال استنشاق اسپورانژیوسپورهای قارچی
- زایگومیکوز بینی- مغزی که در آن آئروسل قارچی موجب بیماری بر روی مخاط بینی و سینوسهای اطراف بینی میشود و پیشروی وسیع و سریع به داخل ساختمانهای داخل جمجمهای دارد. صرف نظر از اینکه عامل قارچی از کدام راه بدواً وارد شده باشد پیامدهای پاتولوژیکی آن یکی است و عبارت از تهاجم عروقی، انفارکتوس و نکروز بافتی، التهاب شدید و خونریزی میباشد.
- این فرآیند مشابه آن چیزی است که در آسپرجیلوزیس تهاجمی البته با دو اختلاف درخور توجه دیده میشود، در زایگومیکوز انتشار از طریق جریان خون کمتر است و گسترش به داخل ساختمانهای مجاور هم در زایگومیکوز بسیار شایعتر است، بطوریکه این فرآیند را بصورت یک اضطرار پزشکی- جراحی درمیآورد. مشخصه و صفت بارز کلینیکی زایگومیکوز پیشرفت سریع آن، عفونت نکروز دهنده اغلب با تشکیل اسکار در پوست و مخاط اطراف بافتهای مبتلا است. مهلکترین فرم این بیماری نوع رینوسربرال است. به لحاظ بالینی این حالت با تب، سردرد، ناخوشی، یک اسکار سیاه رنگ روی ناحیهِ مخاطی محل ابتدائی عفونت و متعاقب آن سمیت سیستمیک، ترشحات بینی، انفارکتوس بافتی که به زخمهای مخاطی جلدی و بافت مرده منجر میشود، ورم صورت، پروپتوز، افتالموپلژی و گسترش به داخل سینوسها و مغز با ایجاد فلج عصب جمجمهای از پیامدهای آن است. تشخیص بوسیلهی یافتههای فیزیکی قابل ملاحظه و انجام یک بیوپسی برای ارزیابی هیستولوژیک صورت میگیرد. کشتها اغلب منفی است و حتی موقعی که مثبت هستند اطلاعات کافی مناسب و به هنگام را بدست نمیدهند تا درمان مناسب آغاز شود. در هیستولوژی علاوه بر التهاب و نکروز بافتی، هایفیهای بدون تیغهی عرضی، پهن و عریض و منشعب با زاویهی انشعاب 90 درجه نمای تیپیکال زایگومیکوز را به نمایش میگذارند. درمان طبی با دوز بالای آمفوتریسین B (mg/kg/d) 1/5-1/25 به تنهائی در موارد زیادی نارسا است. درمان با اکسیژن پرفشار (hyperbaric) درصورتیکه به سهولت در دسترس باشد ممکن است فرم کمک کنندهی مفیدی در درمان باشد. به هر حال اساس و بنیاد درمان برداشت تمام بافتهای گرفتار شده (surgical ablation) همراه با حاشیههای پاک بوسیلهی frozen section است که در زمان جراحی بدست میآید. اندازه و وسعت قطع کردن و بریدن در جراحی به میزان سرعتی که به تشخیص رسیده و جراحی شروع شده است بستگی دارد. درمان با آمفوتریسین B باید بعنوان راه حل دوم و ثانوی نسبت به مداخلهی جراحی درنظر گرفته شود.
درمان ضد قارچی در بیمار گیرندهی پیوند
درمان سیستمیک عفونت قارچی در بیمار پیوند عضو به دو دلیل بصورت یک چالش عمده باقی مانده است؛ احتمال زیاد واکنشهای داروئی بین عوامل ضد قارچی سیستمیک (شامل آمفوتریسین B و همچنین آزولها) و تکیهگاه اصلی ایمنوسوپرسیون مدرن یعنی سیکلوسپورین و تاکرولیموس (FK-506)، و نیاز به دورههای طولانی مدت درمان در اکثر موارد.
واکنشها بر دو نوع است:
- آمفوتریسین B با سیکلوسپورین و تاکرولیموس یک نفروتوکسیسیتهی سینرژیستیک ایجاد میکند. این مسئله از دو راه میتواند نشان داده شود: در شتاب گرفتن در اختلال عملکردی کلیوی، که در اکثر بیماران اتفاق افتاده و استفاده از آمفوتریسین B معمولی را محدود میکند و در فرم ایدیوسنکراتیک میزان کم حتی در حد 5 تا 10 میلیگرم از دارو میتواند در بیمارانی که از سطوح درمانی سیکلوسپورین یا تاکرولیموس برخوردارند نارسائی کلیوی و الیگوری ایجاد نماید.
- عوامل ضد قارچی آزولی، متابولیسم سیکلوسپورین و تاکرولیموس را بلوک مینمایند که منجر به افزایش قابل توجه در سطح سرمی این داروهای ایمنوسوپرسیو میشود و در نتیجه برای جلوگیری از مسمومیت نیاز به تنظیم دوز آنها خواهد بود. این اثر در رابطه با ایتراکونازول و کتوکونازول بیشتر درخور توجه است اما در مورد فلوکونازول هم دیده میشود. نکته حائز اهمیت این است که هنگامی که درمان با آزولها شروع شده است نه تنها دوز سیکلوسپورین و تاکرولیموس را باید کاهش داد بلکه هنگامی که تجویز داروی ضد قارچی متوقف میشود، لازم است دوز داروهای ایمنوسوپرسیو فوق به میزانهای بالاتری که مورد نیاز است مجدداً تنظیم شود. پایش دقیق دوز داروهای سیکلوسپورین و تاکرولیموس در آغاز و پایان استفاده از عوامل ضد قارچی ضرورت دارد. با توجه به مطالب گفته شده واضح است که در عفونتهای تحت حاد و یا در جاهائی که پاسخ کلینیکی با آمفوتریسین B بدست آمده است، درمان با آزولها در شرائطی که تأثیر یکسانی دارند ترجیح داده میشود. در مورد بیمارانی که عفونت حاد دارند و یا به عفونتهای ناشی از قارچهای مقاوم به آزول مبتلا هستند، درمان با آمفوتریسین B معمولی شروع میشود و بعد از کنترل بیماری برای محدود کردن میزان سمیت این دارو، یکی از فرمولاسیونهای لیپیدی آمفوتریسین B را جایگزین مینمایند. دادههائی که در حال حاضر در دسترس هستند هنوز برای اینکه استفاده از فرمولاسیونهای لیپیدی آمفوتریسین B را بعنوان گزینهی اولیه برای شروع درمان توصیه کنند کافی به نظر نمیرسند.
خلاصه و نتیجهگیری
عفونتهای قارچی یک مشکل قابل توجه در بیماران پیوند ارگان بوده و هستند. سه فاکتور عمده برای مشخص کردن خطر عفونتهای قارچی مطرح هستند: برخوردها و مواجهههای اپیدمیولوژیکی با عوامل قارچی، حالت خالص ایمنوسوپرسیون در بیمار، و ناهنجاریهای آناتومیکی و تکنیکی که منجر به آسیب به ساختمانهای اولیه جلدی و مخاطی شده است. توجه زیادی به راهبردهای پیشگیرانه در این گروه از جمعیت شده است و لازم است بشود. هنگامی که بیماری کلینیکی ایجاد شد، فاکتور کلیدی برای کنترل عفونت، سرعت عملی است که در آن به تشخیص رسیده و درمان مناسب را شروع کردهایم. اگرچه درمان با میزان بالائی از توکسیسیته و پتانسیل تداخل واکنشهای دارویی با ایمنوسوپرسیوها وجود دارد، اما پیشرفتهای خوبی انجام شده است. پیشرفت و بهبود عمدهای در درمان عفونتهای قارچی با کمک داروهای جدید هم از دستهی آزولها و هم فرمولاسیونهای لیپیدی آمفوتریسین B و اکینوکاندینها انجام شده و نویدهای بیشتری را برای آینده میدهند. تشخیص زودرس با استفاده از تستهائی مانند اندازهگیری گالاکتومانان یا تکنیکهای بر پایه PCR موجب بهبود نتایج درمانی شده است، همچنین عکسهای ریه با تکنیک high-definition CT نقش مهمی در تشخیص سریع دارد. نکتهی احتیاطی که باید در نظر گرفته شود این است که در صورت مصرف آنتیبیوتیکهائی مانند Amoxicillin/Clavulanate و Piperacillin/Tazobactam تا یک هفته بعد از قطع مصرف آنها آزمایش گالاکتومانان بصورت کاذب مثبت میشود.
عفونتهای قارچی در گیرندگان پیوند اعضاء جامد(2)
عفونتهای قارچی در گیرندگان پیوند اعضاء جامد
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام