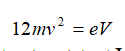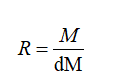طيفسنجي جرمي
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها…(عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (استاد دانشگاه)
اصول طیفسنجی جرمی[1]، بيشتر از هر یک از تکنیکهای دستگاهی دیگر توضیح داده شده است. تاریخ پایهگذاری اساس اين تكنيك به سال ۱۸۹۸ برمیگردد. در سال ۱۹۱۱ تامسون برای تشریح وجود نئون ۲۲ در نمونهای از نئون ۲۰، از طیف جرمی استفاده نمود و ثابت کرد که عناصر میتوانند ایزوتوپ داشته باشند. تا جایی که میدانیم، قدیمیترین طیفسنج جرمی در سال ۱۹۱۸ ساخته شد، اما روش طیفسنجی جرمی تا همین اواخر که دستگاههای دقیق و ارزان در دسترس قرار گرفتند، هنوز مورد استفاده چندانی نداشت. از مزاياي اين دستگاهها ميتوان به قيمت مناسب، تعمير و نگهداري آسان، بالا بودن قدرت تجزیه و تفکیک و تعيين ساختمان ترکیبات اشاره نمود. به بیان ساده، طیفسنج جرمی سه عمل اساسی را انجام میدهد:
مولکولها توسط جریاني از الکترونهای پرانرژی بمباران شده و بعضی از مولکولها به یونهای مربوطه تبدیل میگردند. سپس یونها در یک میدان الکتریکی شتاب داده میشوند. یونهای شتاب دادهشده، بسته به نسبت بار/ جرم خود، در یک میدان مغناطیسی یا الکتریکی جدا میگردند. یونهای داراي نسبت بار/ جرم مشخص به بخش خاصي از دستگاه برخورد كرده، شمارش شده و آشکار میگردند. نتایج حاصل توسط آشکارکننده تقويت شده و به قسمت ثبت داده میشوند. علامت یا نقشی که از ثبّات حاصل میگردد، یک طیف جرمی است. اين طيف جرمي شامل نموداری از تعداد ذرات آشکارشده، بر حسب تابعی از نسبت بار/ جرم است.
شکل 1: اصول اولیه طیفسنج جرمی
دستگاه طیفسنج جرمی
هنگامی که هر یک از عملیات را بهدقت مورد بررسی قرار ميدهیم، خواهیم دید که طیفسنج جرمی واقعاً پیچیدهتر از آن چیزی است که در بالا شرح داده شد.
سیستم ورودی نمونه
قبل از تشکیل یونها، باید راهی پیدا کرد تا بتوان جریانی از مولکولها را به محفظه یونیزاسیون که عمل یونیزه شدن در آن انجام میگیرد، روانه ساخت. یک سیستم ورودی نمونه برای ایجاد اين جريان مولكولي بهکار ميرود. نمونههایی که با طیفسنجی جرمی مورد مطالعه قرار میگیرند، میتوانند به حالت گاز، مایع یا جامد باشند. در این روش باید از وسایلی استفاده کرد تا مقدار کافی از نمونه را به حالت بخار درآورده، سپس جریانی از مولکولها، روانه محفظه یونیزاسیون شوند.
در مورد گازها، خود به حالت بخار وجود دارند، در نتيجه از سیستم ورودی سادهاي استفاده ميشود. این سیستم تحت خلأ بوده، به طوری که فشار محفظه یونیزاسیون كمتر از فشار سیستم ورودی است.
روزنه مولکولی
نمونه به انبار بزرگتری رفته و از آنجا، مولکولهای بخار به محفظه یونیزاسیون میروند. برای اطمینان از اینکه جریان یکنواختی از مولکولها به محفظه یونیزاسیون وارد میشود، قبل از ورود، بخار از میان سوراخ کوچکی که روزنه مولکولی خوانده میشود، عبور میکند. همین سیستم برای مایعات و جامدات فرّار نیز بهکار برده میشود. برای مواد غيرفرّار، میتوان سیستم را بهگونهای طراحی کرد که نمونه در یک اجاق یا تنور قرار گیرد و در اثر گرم شدن، فشار بخار بیشتری حاصل گردد. باید مراقب بود که حرارت زیاد باعث تخریب ماده نشود.
در مورد مواد جامد نسبتاً غیرفرّار، میتوان روش مستقیم را بکار برد. نمونه در نوک میلهای قرار داده شده و سپس از یک شیر خلأ، وارد محفظه یونیزاسیون میگردد. نمونه در فاصله بسیار نزدیکی از پرتو یونیزان قرار میگیرد، سپس میله گرم شده و نمونه به بخار تبديل ميشود. بخار حاصل از نمونه، در مجاورت پرتو قرار ميگيرد. در اثر پرتو، الکترونها از مولكولهاي نمونه خارج شده و به يون تبديل ميشوند. چنین سیستمی را میتوان برای مطالعۀ مولکولهایی که فشار بخار آنها در حرارت اتاق، کمتر از 10 – 9 میلیمتر جیوه است، بهکار برد.
محفظه یونیزاسیون
هنگامی که جریان مولکولهای نمونه وارد محفظه یونیزاسیون شد، توسط پرتوی از الکترونهای پرانرژی بمباران میشود. در این فرآیند، مولکولها به یونهای مربوطه تبدیل شده و سپس در یک میدان الکتریکی شتاب داده میشوند. در محفظه یونیزاسیون، پرتو الکترونهای پرانرژی از یک سیم باریک گرمشده ساطع میشوند. این سیم باریک تا چند هزار درجه سلسیوس گرم میشود. به هنگام کار در شرایط معمولی، الکترونها دارای انرژی معادل ۷۰ میکروولت هستند.
این الکترونهای پرانرژی با مولکولهایی که از سیستم نمونه وارد شدهاند، برخورد کرده و با برداشتن الکترون از آن مولکولها، آنها را یونیزه کرده و به یونهای مثبت تبدیل میکنند. یک صفحه دافع که پتانسیل الکتریکی مثبتی دارد، یونهای جدید را به طرف دستهای از صفحات شتابدهنده هدایت میکند. اختلاف پتانسیل زیادی (حدود ۱ تا ۱۰ کیلو ولت) از این صفحات شتابدهنده عبور داده میشود که این عمل، پرتوی از یونهای مثبت سریع را تولید میکند. این یونها توسط یک یا چند شکاف متمرکزکننده به طرف یک پرتو یکنواخت هدایت میشوند.
بسیاری از مولکولهای نمونه بههیچوجه یونیزه نمیشوند. این مولکولها به طور مداوم توسط مکندهها یا پمپهای خلأ که به محفظه یونیزاسیون متصل نیستند، خارج میگردند. بعضی از این مولکولها از طریق جذب الکترون به یونهای منفی تبدیل میشوند. این یونهای منفی توسط صفحه دافع جذب میگردند. ممکن است بخش کوچکی از یونهای تشکیلشده، بیش از یک بار داشته باشند (از دست دادن بیش از یک الکترون). این يونها نيز مانند یونهای مثبت تک ظرفیتی، شتاب داده میشوند.
پتانسیل یونیزاسیون
انرژی لازم برای برداشتن یک الکترون از یک اتم یا مولکول، پتانسیل یونیزاسیون آن مولكول محسوب ميشود. بسیاری از ترکیبات آلی دارای پتانسیل یونیزاسیون معادل ۸ تا ۱۵ الکترون ولت هستند، اما اگر پرتو الکترونهایی که به مولکولها برخورد میکند، پتانسیلی معادل ۵۰ تا ۷۰ الکترون ولت نداشته باشد، قادر به ایجاد یونهای زیادی نخواهد بود. برای ایجاد یک طیف جرمی، الکترونهایی با این میزان انرژی، برای یونیزه کردن نمونه بهکار برده میشوند.
تجزیهگر جرمی
پس از گذر از محفظه یونیزاسیون، پرتو یونها از درون یک ناحیه کوتاه و فاقد میدان عبور میکند. سپس آن پرتو، وارد تجزیهگر جرمی شده که در آنجا، یونها بر حسب نسبت بار/ جرم خود جدا میشوند. انرژی جنبشی یک یون شتاب دادهشده برابر است با:
که m جرم یون، v سرعت یون، e بار یون و V اختلاف پتانسیل صفحات شتابدهنده یون است.
تجزیهگر جرمی و قدرت تفکیک
از معادلات مربوطه چنین برمیآید که هر قدر مقدار m/e بزرگتر باشد، شعاع انحنای مسیر نیز بزرگتر خواهد بود. لوله تجزیهگر دستگاه طوری ساخته شده است که دارای شعاع انحنای ثابتی است. ذرهای که نسبت m/e صحیحی داشته باشد، قادر خواهد بود تا طول لوله تجزیهگر منحنیشکل را طی کرده، به آشکارکننده برسد. مسلماً اگر دستگاه، فقط یونهایی را که جرم بخصوصی دارند نشان دهد، این روش چندان جالب نخواهد بود، بنابراین بهطور مداوم، ولتاژ شتابدهنده یا قدرت میدان مغناطیسی تغییر كرده تا بتوان کلیه یونهایی که در محفظه یونیزاسیون تولید شدهاند را آشکار ساخت. اثری که از آشکارکننده حاصل میگردد، بهصورت نموداري است که تعداد یونها را بر حسب مقدار m/e آنها رسم میکند. فاکتور مهمی که باید در یک طیفسنج جرمی در نظر گرفت، قدرت تفکیک آن است. قدرت تفکیک بر طبق رابطه زیر تعریف میشود:
که R قدرت تفکیک، M جرم ذره و dM اختلاف جرم بین یک ذره با جرم M و ذره بعدی با جرم بیشتر است که میتواند توسط دستگاه تفکیک گردد. دستگاههایی که قدرت تفکیک ضعیفی دارند، مقدار R آنها حداکثر ۲۰۰۰ است. در بعضی مواقع قدرت تفکیکی به میزان پنج تا ده برابر مقدار فوق مورد نیاز است.
آشکارکننده
آشکارکننده بسیاری از دستگاهها، شامل یک شمارشگر است که جریان تولیدی آن متناسب با تعداد یونهایی است که به آن برخورد میکند. با استفاده از مدارهای تقويتكننده الکترون، میتوان آن قدر دقیق این جریان را اندازه گرفت که جریان حاصل از برخورد فقط یک یون به آشکارکننده اندازهگیری شود.
ثبّات آشکارکننده
سیگنال تولیدشده از آشکارکننده به یک ثبّات داده میشود که این ثبّات خود طیف جرمی را ایجاد مینماید. در دستگاههای جدید، خروجی آشکارکننده به رایانه متصل است. رایانه قادر به ذخیره اطلاعات بوده و خروجی را به هر دو صورت جدولی و گرافیکی درمیآورد. در نهايت، دادهها با طیفهای استاندارد موجود در رایانه مقایسه میگردند.
در دستگاههاي قدیمیتر، جریان الکترونی حاصل از آشکارکننده به یک سری از گالوانومترهاي با حساسیتهای متفاوت داده میشود. پرتو نوری که به آینههای متصل به گالوانومترها برخورد میکند و به یک صفحه حساس به نور منعکس میگردد. بدین طریق یک طیف جرمی بطور همزمان با پنج نقش، هر یک با حساسیتی متفاوت ایجاد میگردد. در حالی که هنوز دستگاه قویترین قلهها را در صفحه طیف نگاه میدارد، با استفاده از این پنج نقش، ثبت ضعیفترین قلهها نیز ممکن میگردد.
طيفسنجي جرمي MALDI-TOF
گسترش سريع زيستفناوري، موجب توسعۀ تكنولوژيهاي نوين شده است. طيفسنجي جرمي (MS) براي چندين دهه به طور گسترده مورد استفاده قرار ميگرفت، اما پس از توسعۀ تكنيكهاي يونيزاسيون، بازجذبي[2]، بازجذب ليزر با كمك ماتريكس [3](MALDI) و يونيزاسيون الكترواسپري [4](ESI)، استفاده از طيفسنجي جرمي بشدت گسترش يافت. اين تكنيكهاي جديد طيفسنجي جرمي، مطالعۀ مولكولهاي زيستي بزرگ از قبيل پروتئين و اسيد نوكلئيك را امكانپذير ساخته است.
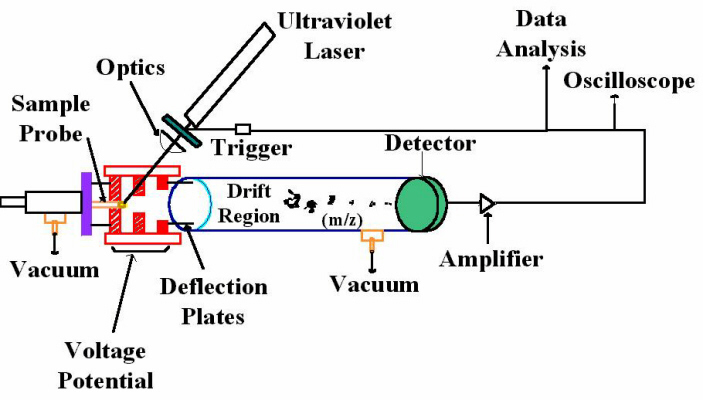
شکل 2: تصویر شماتیک از اسپکترومتر جرمی MALDI-TOF
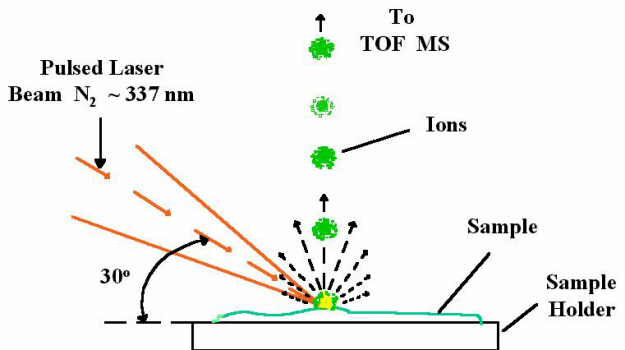
شکل 3: نحوه یونیزاسیون نمونه در MALDI-TOF MS
هستۀ اصلي تكنيك MALDI-TOF MS، واجذبي مولكولهاي زيستي است كه توسط ليزر القا شده[5] است (شکل 2 و 3). اين واجذبي به كمك مواد ماتريكسي كريستالشده صورت ميپذيرد. اين ماتريكس شامل مولكولهاي آلي است كه بر اساس طيف جذبي انرژي خود انتخاب شدهاند (اين طيف انرژي بر اساس طول موج ليزر انتخاب ميشود). ماتريكس، انرژي ليزر را جذب كرده، بخار ميشود و درون خلأ اسپكترومتر جرمي جمع ميشود. آناليتها توسط ماتريكس واجذب شده و با انتقالدهنده پروتون يونيزه ميشوند. يونها در يك ميدان الكتريكي شتابدهي شده و زمان حركت[6] (TOF) آنها تعيين ميشود. اين زمان حركت، به اندازه مولكولهاي ماده مورد آزمايش (آناليت) بستگي دارد. مولكولهاي با جرم كمتر، با سرعت بيشتري نسبت به مولكولهاي بزرگتر حركت ميكنند. واجذبي ميانجيشده با ماتريكس،[7] نسبت به ديگر روشهاي طيفسنجي جرمي (به استثناء ESI-TOF)، مولكولهاي بيشتري از آناليت را مورد بررسي قرار ميدهد. به همين دليل براي آشكار كردن و شناسايي مواد پايداري مثل اسيد نوكلئيك و پروتئين از اين روش حساس استفاده ميشود.
مطالعۀ DNA با استفاده از روش MALDI-TOF داراي چند مزيت است؛ به عنوان مثال در اين روش DNA به طور مستقيم و بدون نياز به تيمار با نشانگرهايي از قبيل مواد فلورسانس مورد آزمايش قرار ميگيرد. تعيين خصوصيات درون مولكولي آناليت و تعيين جرم مولكولي در اين روش دقيقتر است و ميتوان با استفاده از اين روش، محصولات واكنش را از آرتيفكتها تفكيك كرد و تميز داد. تعيين جرم مولكول با استفاده از این روش، مستقل از ساختار آن صورت ميپذيرد، بنابراين ساختار مولكولها (مثل ساختار دوم) تداخلي در اين آزمايش نخواهند داشت و مشكلاتي كه در تفسير نتايج الكتروفورز پيش ميآيد، در اينجا وجود نخواهند داشت، علاوه بر اين، فرايند انجام MALDI سريعتر از ديگر روشها است. اين تكنيك، اين امكان را بهوجود آورده است تا در كسري از ثانيه، دادههاي مورد نظر را بتوان بدست آورد. در سالهاي اخير اين روش براي تعيين گسترده ژنوتيپ بكار رفته است. از آن زمان تا كنون چندين كاربرد كيفي و كمّي براي اين تكنيك در نظر گرفته شده است كه از آنها ميتوان به تعيين نسبتاً كمّي اطلاعات ژنتيكي موجود در DNA ژنومی و نمونههاي مخلوط، كشف و شناسايي SNP، بررسي و جستجوي جهش و شناسايي ژنتيك موجودات از قبيل موجودات بيماريزا اشاره كرد. همچنين اندازهگيري دقيق و نسبي بيان ژن با استفاده از اين روش امكانپذير است، به همين دليل عنوان ميتوان گفت كه MALDI-TOF MS به بلوغ قابل قبولي براي مطالعۀ اسيد نوكلئيك با كارآيي بالا رسيده است.
تكنيك hME[8]
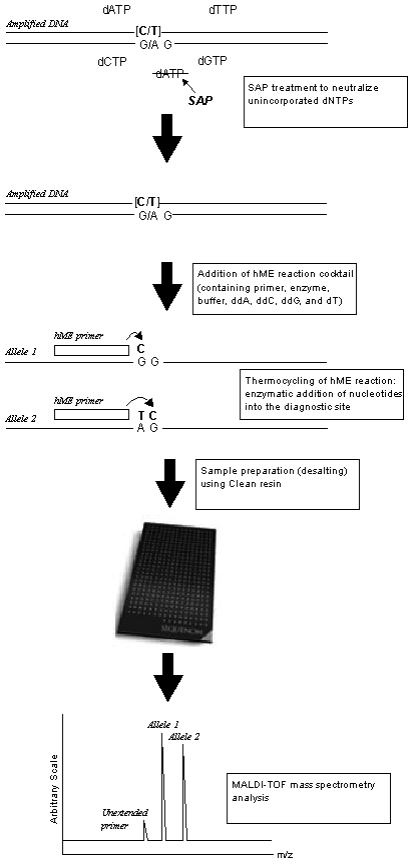
اغلب تكنيكهاي شناسايي SNP و تشخيص جهشهاي شناختهشده[9] كه بر اساس طيفسنجي جرمي بنا شدهاند، از گسترش و طويلسازي آغازگر[10] استفاده ميكنند. تكنيك hME (كه در ابتدا تحت عنوان بسط آغازگر[11] مطرح شد) يك روش طويلسازي آغازگر است كه اختصاصاً براي تعيين ژنوتيپ در سطح وسيع توسعه يافته است. اين آزمايش، معمولاً در پليتهاي ميكروتيتر 384 خانهاي انجام ميشود. شكل زير مراحل اصلي آزمايش را به تصوير ميكشد؛ ابتدا ناحيۀ حاوي SNP در طي واكنش PCR تكثير ميشود. dNTPهاي آزاد با آنزيم آلكالن فسفاتاز ميگو تيمار شده و دفسفريله ميشوند. آغازگر hME كه اختصاصي توالي است، به جايگاه SNP متصل ميشود.
شکل 4: تصویر شماتیک از بسط آغازگر
منطقه حاوی جهش توسط PCR تکثیر شده و نوکلئوتیدهای آزاد دفسفریله می شود. پس از اتمام واکنش، محصول PCR بر روی تراشهها قرار گرفته و توسط MALDI-TOF مورد تجزیه و تحلیل قرار میگیرد
فرايند طويل شدن آغازگر در حضور سه نوع ديدزوكسي ريبونوكلئوتيد تريفسفات[12] (مثل ddA, ddC, ddG) و يك نوع دزوكسي ريبونوكلئوتيد صورت ميپذيرد. انتخاب دزوكسي ريبونوكلئوتيد به ماهيت و نوع چندشكلي مورد مطالعه بستگي دارد. dTTP انتخابشده در شكل فوق براي شناسايي آلل A است. پس از انجام آزمايش، سه نوع پيغام جرمي[13] ميتواند حاصل شود: يك پيغام ناشي از آغازگري كه طويل نشده است، پيغام جرمي مخصوص اضافه شدن يك نوكلئوتيد كه مخصوص يك آلل است (آلل 1) و در نهايت پيغام جرمي حاصل از طويلسازي آغازگر با دو يا چند نوكلئوتيد مخصوص آلل ديگر (آلل 2). جرم محصول اين واكنش حداقل به اندازۀ جرم يك نوكلئوتيد (حدود 300 دالتون) تفاوت و اختلاف دارد. پس از اتمام واكنش زنجيرهاي بسط آغازگر، رزينهاي تعويض يوني به واكنش اضافه ميشود. در اين مرحله سديم و پتاسيم از اسكلت فسفاتۀ نوكلئيك اسيد حاصل حذف شده و براي انجام MALDI-TOF MS آماده ميشود.
بعد از آمادهسازي، نمونهها بر روي تراشهها (SpectroCHIP) توزيع ميشوند. اين تراشههاي بسيار دقيق و يكسان از جنس سليكون هستند كه بر روي ماتريكس قرار گرفتهاند. براي انجام اين مرحله مقدار بسيار كم نمونه در حد 10 نانوليتر لازم است و توزيع اين مقدار نمونه به وسايل حساس و دقيقي نياز دارد، سپس ژنوتيپ نمونه به صورت تمام اتوماتيك و در مدت چند ميليثانيه تعيين ميشود. در اين تكنيك كيفيت دادهها نيز مورد بررسي قرار ميگيرد و دستگاه مشخص ميكند كه آيا دادهها از صحت كافي برخوردارند يا به اطلاعات بيشتري در مورد نمونهها نياز است.
تعيين همزمان چندين ژنوتيپ[14]
يك راه سادۀ افزايش بازدهي و كاهش هزينۀ تعيين ژنوتيپ، استفاده از واكنش PCR/hME چندگانه در يك واكنش است. اين روش توانايي اندازهگيري محصولات بهدست آمده از واكنش بسط آغازگر، به جرم 9000-5000 دالتون (معادل 30-17 نوكلئوتيد) را دارا است. براي انجام اين روش، ميتوان آغازگري را طراحي كرد كه چندين SNP و يا جهش را دربر گيرد، اما بايد دقت شود كه جرم آغازگرهاي اوليه و انواع محصولات بدستآمده با هم تفاوت داشته باشند. جرم اين محصولات نبايد همپوشاني[15] داشته باشد تا بتوان با استفاده از يك طيف جرمي انواع محصولات را از يكديگر تميز داد و چندين SNP را به طور همزمان تعيين ژنوتيپ نمود.
توضيح جوانب مختلف اين تكنيك در اين مقال نميگنجد اما اشاره به چند نكته مهم آن ضروري بهنظر ميرسد؛ مهمترين نكتهاي كه بايد دقت شود، مربوط به PCR قطعۀ حاوي چندين SNP است. ابتدا بايد آغازگر به دقت بررسي شود تا به نقاط ديگر ژنوم متصل نشود و قطعات اضافي و ناخواسته را تكثير ننمايد، بنابراين اگر توالي ژنوم مورد بررسي موجود باشد، بايد آغازگرBlast شود تا از بروز اين اشكال جلوگيري بهعمل آيد. مشخص شده است كه انجام موفق اين آزمايش بستگي به Tm (حدود60 درجه سلسیوس)، درصد CG و اندازۀ قطعه محصول PCR (حدود 100 جفت باز) دارد. علاوه بر ميزان آنزيم، dNTP و غلظت آغازگر، دو فاكتور مهم در انجام اين واكنش قدرت يوني بافر و غلظت نهايي يون منيزيم آزاد است. مشخص شده است كه بافر 1.25x (در مقايسه با غلظت معمولي X1) و منيزيم با غلظت mM 1.3-1.7 مناسبترين حالت براي انجام اين واكنش است.
واكنش hME چندگانه مشابه PCR انجام ميشود. آغازگرهاي مورد استفاده در hME نبايد هيچ گونه دايمری را تشكيل داده و ميزان ساختمان سنجاقسري ايجادشده بايد به حداقل برسد. آغازگر و محصول بهدست آمده از واكنش PCR، پيغامي را بهوجود ميآورند كه هر كدام از اين پيغامها بيانگر يك آلل است. ممكن است پيغامهاي ناخواسته نيز ديده شود كه ناشي از توقف زودهنگام آنزيم پليمراز و يا اشكال در غلظت نمك بوده و بايد برطرف شود.
اين تكنيك در مقياس بالاتر نيز قابل انجام است، اما طراحي اين آزمايش، بايد با كمك نرمافزارهاي رايانهاي (از قبيل MassARRAY Assay Design) صورت پذيرد. با استفاده از اين نرمافزار ميتوان بهطور اتوماتيك تا 15 واكنش همزمان را طراحي، اجرا و تجزيه و تحليل نمود.
اين تكنيك مزاياي زيادي دارد و از كارآيي بالايي برخوردار است كه از آن ميان ميتوان به موارد زير اشاره نمود:
- طراحي كارآمد و مؤثر روش: در اين تكنيك آغازگرهاي PCR و hME با استفاده از نرمافزار به سرعت طراحي ميشوند، همچنين با كمك نرمافزار ميتوان واكنش چندگانه را طراحي نمود. از اوليگو دزوكسي نوكلئوتيد معمولي به عنوان آغازگر استفاده ميشود كه هزينه و زمان انجام واكنش را كاهش ميدهد.
- گردآوري دادهها و گزارش ژنوتيپ به صورت اتوماتيك: دستگاه مورد استفاده در اين روش، طيف جرمي هر تراشه را در مدت كمتر از 1/5 ثانيه ترسيم ميكند و در همان لحظه ژنوتيپ نمونۀ مورد مطالعه تعيين ميشود.
- با استفاده از روش MassArray ميتوان هزاران فرايند تعيين ژنوتيپ را در مدت يك روز بهصورت اتوماتيك به انجام رساند. در اين روش مطالعه 384 تراشه در مدت حدود 30 دقيقه امكانپذير شده است؛ اين بدان معناست كه در هر دقيقه 150 ژنوتيپ را ميتوان تعيين نمود (9000 ژنوتيپ در ساعت). اين تكنيك هزينههاي آزمايشات را نيز كاهش داده و هر ژنوتيپ با هزينهاي كمتر از 0/1 دلار قابل تعيين است.
[1]Mass spectrometry
[2]Desorption
[3]Matrix-assisted laser desorption
[4]Electro spray ionization
[5]Laser induced desorption of biomolecules
[6]Time of flight
[7]matrix-mediated desorption
[8]Homogeneous MassEXTEND Assay
[9]known mutations
[10]primer extension
[11]Primer Oligo Base Extension
[12]Dideoxyribonucleotide triphosphates
[13]Mass signal
[14]Multiplexing SNP Genotyping
[15]Overlap
مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
اصول و کاربرد روش Tandem MS در پژوهش و آزمایشگاه بالینی
نشانگرهای مولکولی و تكنيكهاي نقشهبرداري ژنومي و انگشتنگاري DNA
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام