سندرم زلوگر
Zellweger Syndrome
شاهین اسعدی (دانشجوی ژنتیک مولکولی)، مهسا جمالی (کارشناس ارشد ژنتیک)

نگارنده مسئول: شاهین اسعدی (Molecular Geneticist)
کلیاتی از سندرم زلوگر
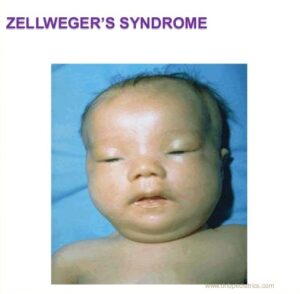
سندرم زلوگر که بهعنوان سندرم سربروهپاتورنال نیز شناخته میشود یک اختلال ژنتیکی نادر است که با کاهش یا عدم وجود آنزیم پراکسیزوم کاربردی، در سلولهای انسان همراه است. اختلالات طیف زلوگر میتواند بسیاری از اندامهای بدن را تحت تأثیر قرار دهد. سندرم زلوگر از شدید تا خفیف میتواند در هر فرد متفاوت باشد، بطوریکه شدیدترین حالت از طیف اختلالات زلوگر منجر به سندرم زلوگر و در حالت متوسط منجر به آدرنولکودیستروفی نوزادان و در حالت خفیف منجر به بیماری رفسام کودکانه خواهد شد.
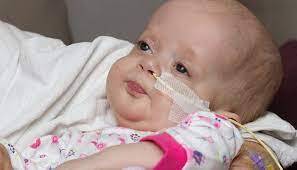
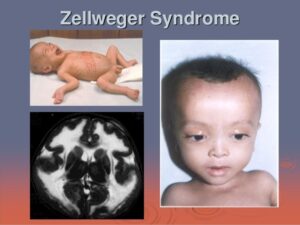
شکل 1: تصویر نوزاد مبتلا به سندرم زلوگر
آدرنولکودیستروفی: نوعی بیماری با منشأ نقائص پراکسیزومی است. آدرنولکودیستروفی یک نقص مغزی دژنراتیو و پیشرونده است که در کودکی با افزایش رنگدانه در پوست و شواهد آزمایشگاهی بیماری دژنراتیو غدد فوقکلیه بروز میکند.
بیماری رفسام: نوعی بیماری با منشأ نقص پراکسیزوم است که باعث نقص در متابولیسم لیپیدها میشود. اين بيماري در دسته نوروپاتيهاي حسي- حرکتي ارثي قرار میگیرد و با فقدان اسيد فيتانيک هيدروکسيلاز و تجمع اسيد فيتانيک در پلاسما و بافتها، همراه است. اختلالات عصبی، کاهش تون عضلانی (هایپوتونی)، از دست دادن حس شنوایی، مشکلات بینایی، اختلال عملکرد کبد و اختلالات کلیوی از یافتههای معمول در سندرم زلوگر هستند. اختلالات شدید طیف زلوگر، اغلب موارد تهدیدکننده حیات اولیه در دوران شیرخوارگی مبتلایان به این سندرم میباشد.
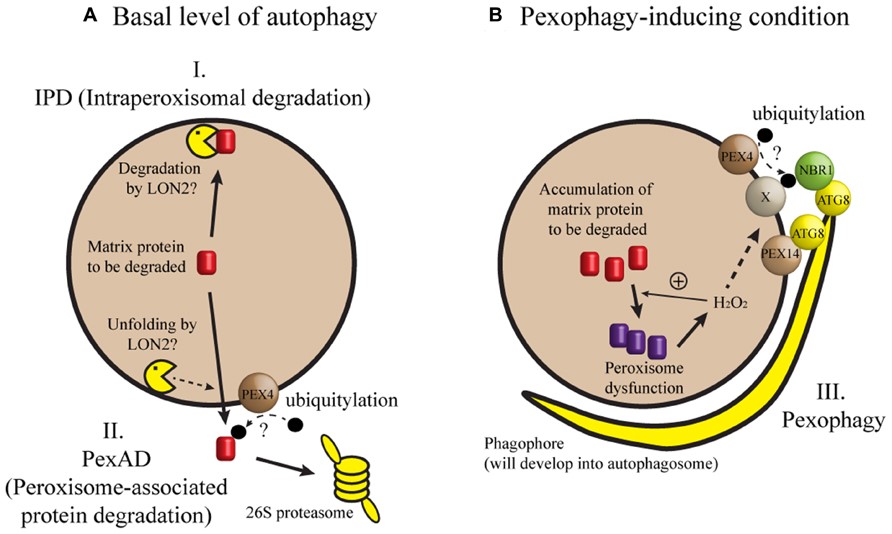
شکل 2: نمای شماتیک از مکانیسم عمل ارگانل پراکسیزوم
پراکسیزومها، اندامکهای مستقلی هستند که اغلب در سلولهای کبد و کلیه مشاهده میشـــوند. پراکسیزومها در سلولهای جانوری و گیاهی وجود دارند. این اندامکها در نزدیک شبکهی آندوپلاسمی صاف قرار دارند و بنظر میرسد از عناصر شبکهی آندوپلاسمی صاف باشند ولی برای سنتز پروتئینها و آنزیمهای آن به شبکهی آندوپلاسمی دانهدار نیاز است. آنزیمهای پراکسیزوم بهخصوص کاتالاز توسط ریبوزومهای آزاد در سیتوپلاسم ساخته میشوند.
ساختمان پراکسیزوم
پراکسیزوم دارای یک غشای به ضخامت حدود ۶۰ تا ۸۰ آنگستروم است که با شبکه آندوپلاسمی صاف در ارتباط است. ماتریس یا مادهی زمینهای که درون پراکسیزوم را پر کرده است همگن بوده و دارای ذرات بسیار ریز، تا حدی متراکم و گاهی رشتههای منشعب به طول ۴ تا 4/5 نانومتر است.
آنزیمهای موجود در پراکسیزوم:
- کاتالاز (جهت تجزیهی پراکسید هیدروژن یا آب اکسیژنه و تبدیل آن به آب و اکسیژن مولکولی- از بین بردن سمیت آب اکسیژنه)
- آلفا- ال- هیدروکسیداز
- د-آمینو اکسیداز (اکسیداسیون اسیدآمینههای نوع D)
- اوریکاز یا اورات اکسیداز (تجزیهی اسید اوریک حاصل از متابولیسم پورینها)
- گلیکواکسیداز (هنگام تنفس نوری موجب اکسایش اسید گلیکولیک حاصل از فتوسنتز)
- آنزیمهای لازم جهت بتا اکسیداسیون اسیدهای چرب
- آنزیمهای لازم جهت تولید فسفولیپید پلاسموژن
- آنزیمهای لازم جهت سمزدایی ترکیبات بیگانه مانند اتانول
منشأ پراکسیزوم
پراکسیزوم از جوانه زدن شبکهی آندوپلاسمی صاف ایجاد میشود. غشای پراکسیزومها با دخالت شبکهی آندوپلاسمی دانهدار یا خشن که هم پروتئینها و هم لیپیدها را میسازد گسترش مییابد. پراکسیزومهای جدید ممکن است از جوانه زدن شبکهی پراکسیزومی به وجود آیند.
شکل 3: نمای شماتیک از ساختمان ارگانل (اندامک) پراکسیزوم
علائم و نشانههای سندرم زلوگر
همانطور که ذکر شد، علائم و نشانههای سندرم زلوگر از فردی به فرد دیگر بسیار متفاوت است. سندرم زلوگر در شدیدترین حالت ممکن، اندکی پس از تولد آشکار میشود. نوزادان مبتلا به سندرم زلوگر اغلب اختلال عصبی شدید، اختلال پیشرونده کبد و کلیه و توسعه عوارض تهدیدکننده حیات را در سال اول زندگی، معمولاً تجربه میکنند. نوزادان مبتلا به آدرنولکودیستروفی و رفسام کودکانه، ممکن است علائم بیماری را تا زمانی که در دوران شیرخوارگی هستند از خود آشکار نکنند. برخی از این کودکان با رسیدن به دوران نوجوانی و بزرگسالی، ممکن است با درجاتی از ناتوانیهای فکری، از دست دادن حس شنوایی و مشکلات بینایی مواجه باشند. برخی دیگر نیز هایپوتونی شدید (کاهش عمیق تون عضلانی) را تجربه خواهند کرد، درحالیکه ممکن است برخی از مبتلایان سندرم زلوگر نیز هیچ ناهنجاری سر و صورت را از خود نشان ندهند. در موارد بسیار نادر سندرم زلوگر، افراد تحت تأثیر ممکن است تا زمان بلوغ و یا بزرگسالی قابل تشخیص و غربال نباشند. این افراد علائم ملایم و خفیف مانند از دست دادن حس شنوایی یا کاهش شنوایی و کاهش بینایی را در زمان شروع سن بلوغ یا بزرگسالی آشکار میکنند. نوزادان مبتلا به سندرم زلوگر ممکن است لنگی پا، پاسخ ضعیف به محرکهای محیطی، عدم توانایی در مکیدن شیر مادر، عدم توانایی بلع مایعات یا مواد غذایی، مشکلات تغذیه، عدم افزایش وزن و اختلال رشد را آشکار کنند.
شکل 4: تصاویر کودک مبتلا به سندرم زلوگر همراه با تصویر رادیولوژی از مغز
همچنین نوزادان مبتلا به سندرم زلوگر انواع عوارض عصبی از جمله، تشنجهای مکرر، کمتوانی ذهنی، تأخیر در رسیدن به نقاط عطف رشد مانند نشستن، خزیدن روی زمین، راه رفتن، اختلالات مختلف مغز منجمله نقص ناشی از مهاجرت غیرطبیعی سلولهای مغز (نورونها) به مناطقی که نباید در آنجا مستقر باشند (بنابراین مغز توانایی عملکرد مناسب را نخواهد داشت) و توسعه انحطاط پیشرونده رشتههای عصبی (ماده سفید) از مغز را ممکن است آشکار کنند.
علاوه بر این، نوزادان مبتلا به سندرم زلوگر ممکن است ویژگیهای متمایز صورت از جمله ظاهر مسطح صورت، پیشانی نسبتاً بزرگ رو به بالا، بزرگی غیرطبیعی نقاط نرم (فونتانل) در جمجمه، پل بینی بهصورت گسترده و یا پهن، سوراخهای کوچک در بینی و رو به بالا، پلک غیرطبیعی، فک کوچک، سقف بسیار قوس دهان (کام دهان)، چانه کوچک، پوست اضافی در گردن، ناهنجاری جزئی در قسمت بیرونی گوش، کاسه چشم بهطور غیرطبیعی کمعمق و پشت سر (استخوان پس سر) بهطور غیرطبیعی حالت تخت و صاف را آشکار کنند.
انواع اختلالات چشم مانند فاصله گسترده چشمها از یکدیگر (هایپرتلوریسم)، کدر شدن لنز چشم (آب مروارید)، کدورت قرنیه چشم، آتروفی عصب بینایی یا انحطاط عصبی که حامل تصاویر بصری از چشم به مغز است، حرکات غیرارادی و سریع چشم (نیستاگموس) و از دست دادن حس بینایی با درجات مختلف نیز ممکن است در مبتلایان سندرم زلوگر رخ دهد. برخی از نوزادان مبتلا به سندرم زلوگر ممکن است طحال بزرگ غیرطبیعی (اسپلنومگالی) و یا کبد بزرگ غیرطبیعی (هپاتومگالی) داشته باشند. در این نوزادان کبد ممکن است دچار زخم شود (فیبروتیک) و یا دچار التهاب شود (سیروز کبدی) که در این صورت با کاهش پیشرونده عملکرد کبد و در نتیجه با علائمی مانند زردی پوست و زردی کاسه چشم (یرقان) همراه خواهد بود. یافتههای اضافی شامل کیستهای کوچک در کلیه و خونریزی از دستگاه گوارش به علت کمبود یکی از فاکتورهای انعقادی خون میباشد. برخی از کودکان مبتلا به سندرم زلوگر، ممکن است خونریزی وسیع یا غیرقابل کنترل را در داخل جمجمه تجربه کنند.
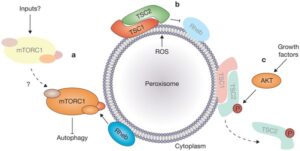
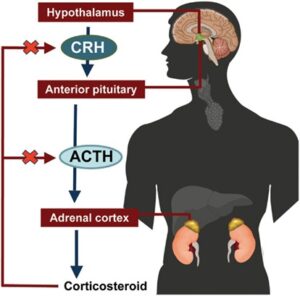
شکل 5: نمای شماتیک از مکانیسم سیگنالدهی مغز به غده آدرنال فوق کلیه
اختلالات اسکلتی در سندرم زلوگر شامل پا چنبری، خمیدگی انگشتان دست و پا و عدم توسعه کامل در حالت راست نگهداشتن انگشتان دست و پا میباشد. نقص قلبی ممکن است در نوزادان مبتلا به اختلالات طیف زلوگر از جمله نقص سپتوم و مجرای شریانی رخ دهد. نقص سپتوم قلب، همان سوراخ در قلب است که اگر اندازه بزرگی داشته باشد ممکن است باعث بینظمی در تنفس، فشارخون بالا و یا حتی ایست قلبی گردد. در برخی از نوزادان جنس مذکر مبتلا به سندرم زلوگر ممکن است مجرای ادراری در قسمت زیرین آلت تناسلی مرد (هایپوسپادیاس) و شکست بیضهها و فرود به داخل کیسه بیضه رخ دهد.
علتشناسی سندرم زلوگر
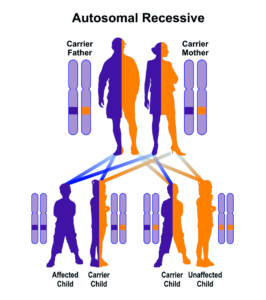
اختلالات طیف زلوگر توسط جهش 13 ژن مؤثر در فرآیندهای پراکسی زوم رخ میدهد. سندرم زلوگر با تمام جهشهای ژنتیکی از الگوی توارثی اتوزومال مغلوب پیروی میکند؛ بنابراین برای ابتلا به این سندرم به دو نسخه از ژنهای جهشیافته مربوطه (یکی از پدر و دیگری از مادر) نیاز است و شانس داشتن فرزندی مبتلا به سندرم زلوگر، 25% برای هر بارداری احتمالی مشروط بر حامل بودن والدین به ژنهای جهشیافته این سندرم میباشد. جهش هر یک از 13 ژن مؤثر در فرآیندهای پراکسی زوم، با توسعه یکی از اختلالات طیف زلوگر همراه است. این 13 ژن حاوی دستورالعمل برای سنتز پروتئینی به نام پراکسین هستند که برای ایجاد مناسب پراکسیزوم ضروری است. ژنهای جهشیافته در سندرم زلوگر عبارتند از: PEX1،PEX2،PEX3،PEX5،PEX6،PEX10،PEX11،PEX12،PEX13،PEX14،PEX16،PEX19، PEX26.
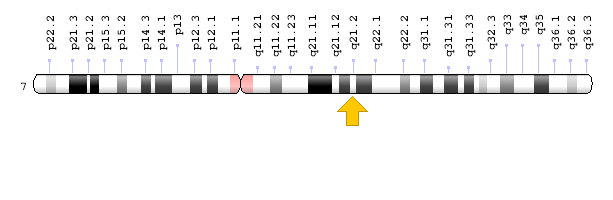
شکل 6: نمای شماتیک از کروموزوم شماره 7 که ژن PEX1 در بازوی بلند این کروموزوم بهصورت 7q21.2 مستقر است
حدود 68% از افراد با اختلال طیف زلوگر، در ژن PEX1 دچار جهش میشوند. ژن PEX1 در بازوی بلند کروموزوم شماره 7 بهصورت 7q21.2 مستقر است.
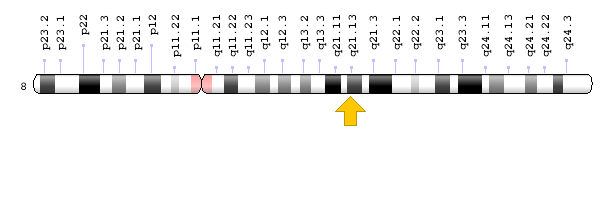
ژن PEX2 در بازوی بلند کروموزوم شماره 8 بهصورت 8q21.13 مستقر است.
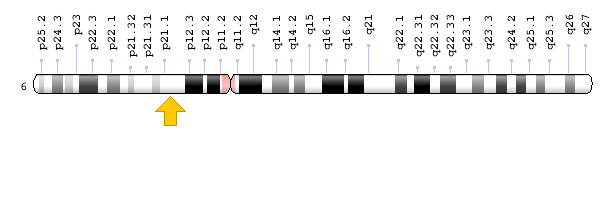
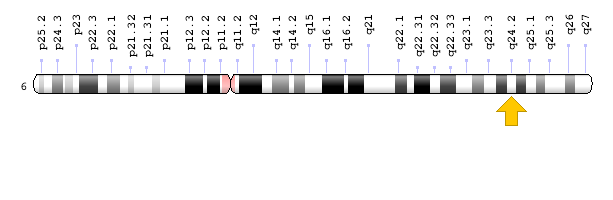
ژن PEX3 در بازوی بلند کروموزوم شماره 6 بهصورت 6q24.2 مستقر است.
ژن PEX5 در بازوی کوتاه کروموزوم شماره 12 بهصورت 12p13.31 مستقر است.
ژن PEX6 در بازوی کوتاه کروموزوم شماره 6 بهصورت 6p21.1 مستقر است.
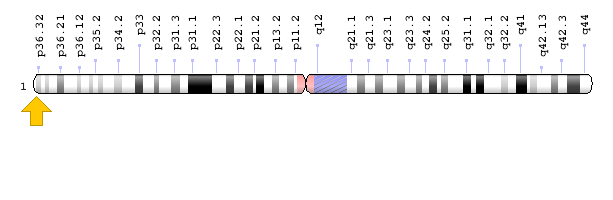
ژن PEX10 در بازوی کوتاه کروموزوم شماره 1 بهصورت 1p36.32 مستقر است.
ژن PEX11 شامل سه زیرگروه است:
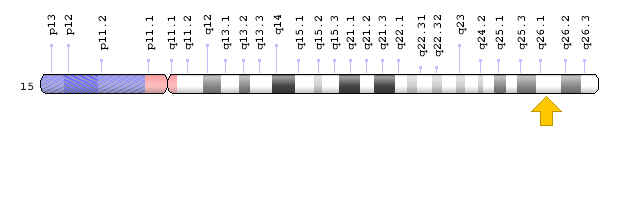
- ژن PEX11A در بازوی بلند کروموزوم شماره 15 بهصورت 1 مستقر است.
- ژن PEX11B در بازوی بلند کروموزوم شماره 1 بهصورت 1 مستقر است.
- ژن PEX11G در بازوی کوتاه کروموزوم شماره 19 بهصورت 2 مستقر است.
شکل 7: نمای شماتیک از کروموزوم شماره 8 که ژن PEX2 در بازوی بلند این کروموزوم بهصورت 8q21.13 مستقر است
ژن PEX12 در بازوی بلند کروموزوم شماره 17 بهصورت 17q12 مستقر است.
ژن PEX13 در بازوی کوتاه کروموزوم شماره 2 بهصورت 2p15 مستقر است.
ژن PEX14 در بازوی کوتاه کروموزوم شماره 1 بهصورت 1p36.22 مستقر است.
ژن PEX16 در بازوی کوتاه کروموزوم شماره 11 بهصورت 11p11.2 مستقر است.
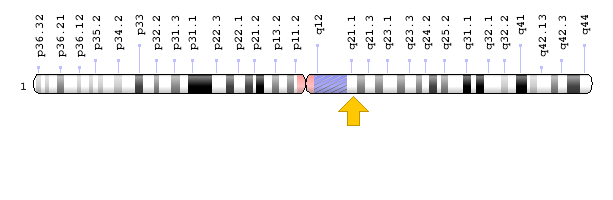
ژن PEX19 در بازوی بلند کروموزوم شماره 1 بهصورت 1q23.2 مستقر است.
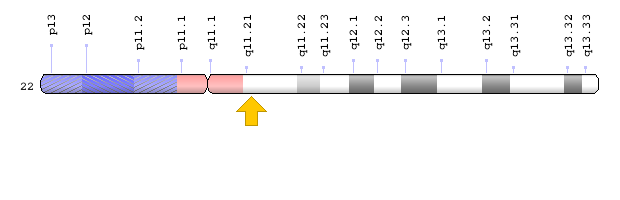
ژن PEX26 در بازوی بلند کروموزوم شماره 22 بهصورت 22q11.21 مستقر است.
شکل 10: نمای شماتیک از کروموزوم شماره 6 که ژن PEX6 در بازوی کوتاه این کروموزوم بهصورت 6p21.1 مستقر است
شکل 11: نمای شماتیک از کروموزوم شماره 1 که ژن PEX10 در بازوی کوتاه این کروموزوم بهصورت 1p36.32 مستقر است
شکل 12: نمای شماتیک از کروموزوم شماره 15 که ژن PEX11A در بازوی بلند این کروموزوم بهصورت 15q26.1 مستقر است
شکل 13: نمای شماتیک از کروموزوم شماره 1 که ژن PEX11B در بازوی بلند این کروموزوم بهصورت 1q21.1 مستقر است
شکل 14: نمای شماتیک از کروموزوم شماره 19 که ژن PEX11G در بازوی کوتاه این کروموزوم بهصورت 19p13.2 مستقر است
شکل 15: نمای شماتیک از کروموزوم شماره 17 که ژن PEX12 در بازوی بلند این کروموزوم بهصورت 17q12 مستقر است
شکل 16: نمای شماتیک از کروموزوم شماره 2 که ژن PEX13 در بازوی کوتاه این کروموزوم بهصورت 2p15 مستقر است
شکل 18: نمای شماتیک از کروموزوم شماره 11 که ژن PEX16 در بازوی کوتاه این کروموزوم بهصورت 11p11.2 مستقر است
شکل 20: نمای شماتیک از کروموزوم شماره 22 که ژن PEX26 در بازوی بلند این کروموزوم بهصورت 22q11.21 مستقر است
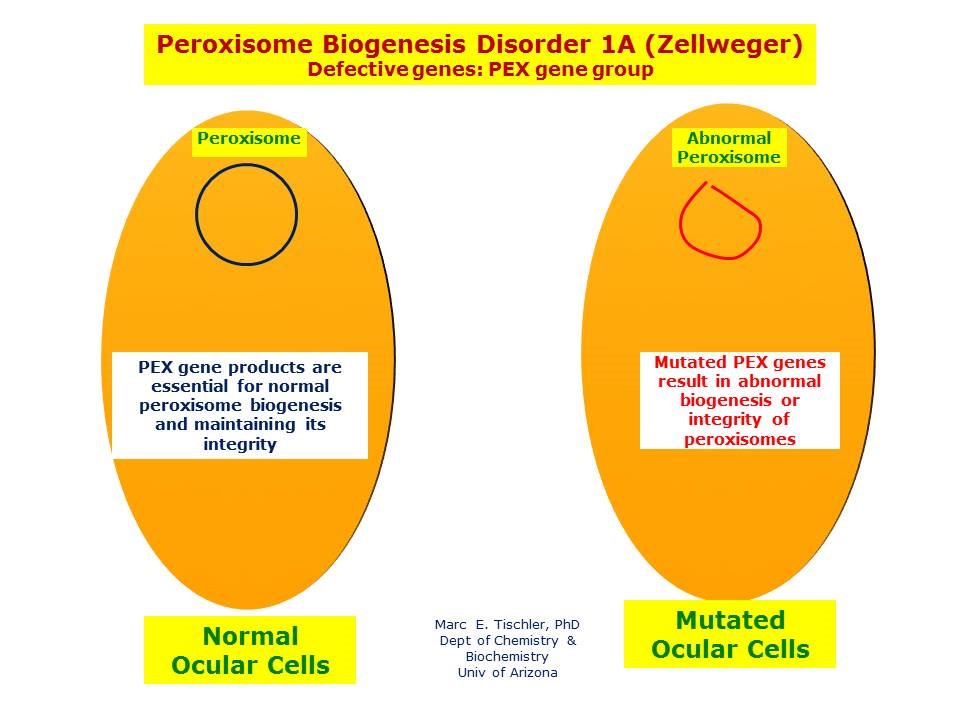
شکل 21: نمای شماتیک از مکانیسم بیان و اثرگذاری مسیر 1A ژنهای گروه PEX در سلولهای نرمال و سلولهای موتانت برای ایجاد سندرم زلوگر و مسیر پاتوژنز این سندرم
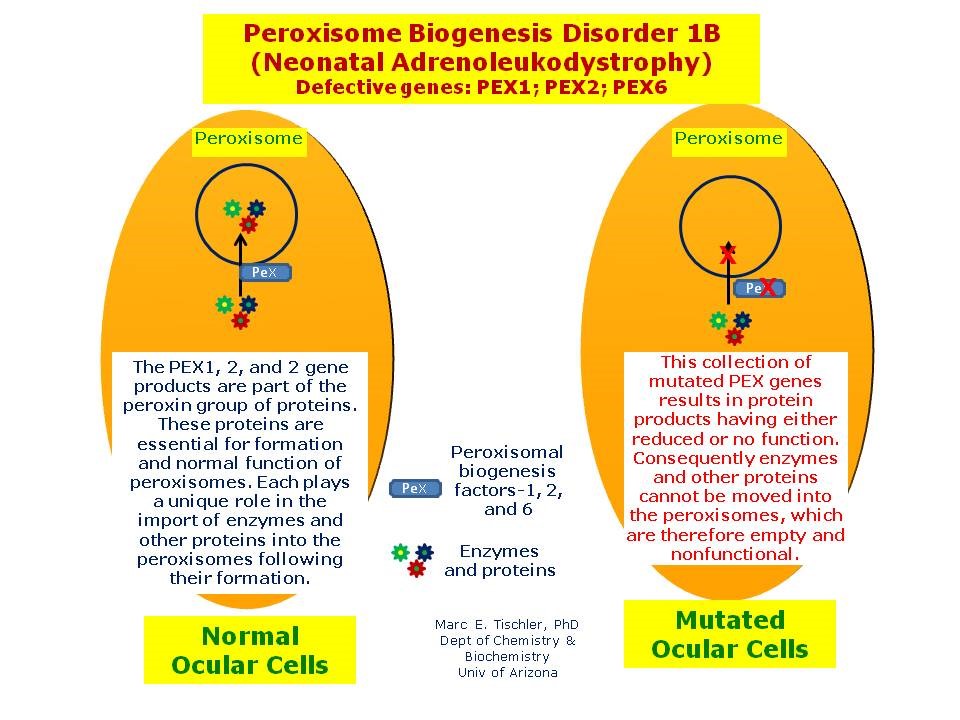
شکل 22: نمای شماتیک از مکانیسم بیان و اثرگذاری مسیر 1B ژنهای گروه PEX اعم از PEX1،PEX2،PEX6 در سلولهای نرمال و سلولهای موتانت برای ایجاد سندرم زلوگر
شکل 23: نمای شماتیک از الگوی توارثی اتوزومال مغلوب که سندرم زلوگر نیز از این الگو تبعیت میکند
فراوانی سندرم زلوگر
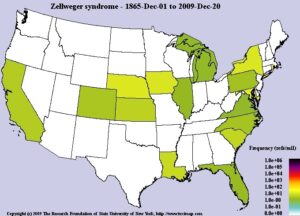
همانگونه که قبلاً ذکر شد، اختلالات طیف زلوگر معمولاً در هنگام تولد آشکار میشود. این اختلالات میتواند همه نژادهای انسانی را تحت تأثیر قرار دهد. در ایالات متحده آمریکا، فرکانس ترکیبی این سندرم تقریباً 1 در 50000 تولد زنده میباشد. ازآنجاکه برخی از موارد اختلالات زلوگر بهدرستی تشخیص داده نمیشود، بنابراین تعیین فرکانس واقعی این سندرم در جهان دشوار است.
شکل 24: نمای شماتیک از نقشه فرکانس سندرم زلوگر از سال 1865 تا سال 2009 در جهان
تشخیص سندرم زلوگر
اختلالات طیف زلوگر بر اساس ارزیابی دقیق و کامل مبتلایان و یافتههای فیزیکی مبتلایان و یافتههای کلینیکی پاتولوژی انجام میگیرد. گام اولیه در تشخیص سندرم زلوگر، تشخیص اسیدهای چرب طولانی در بدن است که میزان آنها افزایش مییابد، همچنین آزمایش خون و ادرار نیز مبنی بر بررسی مواد مرتبط با متابولیسم پراکسیزوم میتواند در تشخیص سندرم زلوگر، مفید باشد. تست بیوشیمیایی فیبروبلاست پوست برای تأئید اختلالات مشاهده شده در خون و ادرار مبتلایان سندرم زلوگر نیز مفید است. تصویربرداری رادیولوژی مانند سونوگرافی از جنین بهمنظور بررسی اندامهای جنین و همچنین بررسی وجود کیست احتمالی در کبد نیز میتواند مفید باشد. تشخیص پیش از لانه گزینی (PGD) با لقاح آزمایشگاهی در تشخیص جهشهای ژنتیکی بسیار مؤثر است، بااینحال قطعیترین تست بهمنظور تشخیص قطعی سندرم زلوگر، آزمایش ژنتیک مولکولی برای بررسی وجود جهش یا عدم وجود جهش در 13 ژن هدف مرتبط با عملکرد پراکسیزوم با تعیین توالی بهویژه روشهای نوین سکانس نوکلئوتیدی (NGS) میباشد.
مسیرهای درمانی سندرم زلوگر
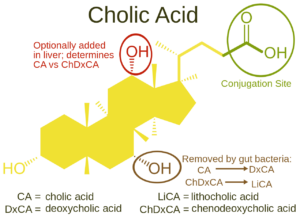
در سال 2015، داروی کولبام (اسید کولیک) بهعنوان اولین درمان برای کودکان و بزرگسالان مبتلا به اختلالات سنتز اسیدهای صفراوی به علت نقص آنزیم پراکسیزومی (طیف اختلالات زلوگر) از طرف سازمان غذا و داروی آمریکا (FDA) به تصویب رسید و روانه بازار گردید. درمان سندرم زلوگر بر اساس طیفی از اختلالاتی که در هر فرد آشکار میشود، متفاوت بوده و ممکن است از یک تیم متخصصان پزشکی و اجتماعی بهرهمند شود؛ از جمله متخصص اطفال، متخصص اعصاب، جراحان غدد، آدیومتریست (شنوایی سنجی)، اپتومتریست (بینایی سنجی)، متخصص ارتوپدی و دیگر متخصصان مراقبتهای بهداشتی میتوانند در بهبود وضعیت مبتلایان سندرم زلوگر مؤثر باشند. کودکان با اختلالات طیف زلوگر، ممکن است به یک لوله تغذیه (گاستروستمی) برای اطمینان از مصرف مناسب کالری غذا بهرهمند شوند.
شکل 25: نمای شماتیک از چرخه اسید کولیک و کپسول دارویی اسید کولیک (کولبام) که در درمان سندرم زلوگر استفاده میشود
لوله گاستروستمی بهطور مستقیم به معده وارد میشود و مواد غذایی مناسب را وارد حجم معده میکند. درمانهای دیگر شامل سمعک، کاشت حلزون، مصرف ویتامینهای محلول در چربی بخصوص ویتامین K برای درمان خونریزی که به دلیل نقص در یکی از فاکتورهای انعقادی خون رخ میدهد، جراحی آب مروارید و یا استفاده از عینک بهمنظور بهبود بینایی مبتلایان سندرم زلوگر میباشند. داروهای ضد صرع ممکن است برای درمان تشنج استفاده شود، اما تشنج ممکن است باقی بماند و کنترل آن با داروها شاید دشوار باشد.
نارسایی آدرنال اغلب در بیشتر طیفهای اختلالات زلوگر رخ میدهد. توصیه میشود نظارت آدرنال بهصورت سالانه با هورمون آدرنوکورتیکوتروپیک (ACTH) و هورمون کورتیزول صبحگاهی انجام پذیرد. مداخله زودهنگام در درمان کودکان مبتلا به اختلالات زلوگر از اهمیت ویژهای برخوردار است. مشاوره ژنتیک برای خانوادههایی که سابقه خانوادگی از سندرم زلوگر دارند بسیار مهم است، چرا که تشخیص قبل از تولد نیز در تعیین سرنوشت والدین و همچنین فرزندان بیمار احتمالی، بسیار حائز اهمیت است.
تاریخچه سندرم زلوگر
سندرم زلوگر اولین بار در سال 1964 توسط دکتر هانس زلوگر، پزشک متخصص اطفال آمریکایی- سوئیسی، استاد طب اطفال و ژنتیک در دانشگاه آیووا گزارش گردید.
شکل 26: تصویر دکتر هانس زلوگر، کاشف سندرم زلوگر در سال 1964
منابع:
اسعدی شاهین، جمالی مهسا، باقری رعنا، سادهدل سمانه، توحیدی راد مانوش، کتاب پاتولوژی در ژنتیک پزشکی جلد دوم (M-Z)، صفحات 1398-1383 انتشارات کتب دانشگاهی عمیدی، بهار 1396.
سندرم کمخونی دیاموند- بلکفان Diamond-Blackfan Anemia Syndrome
سندرم بال پروانهای Epidermolysis Bullosa (EB) Syndrome
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام