محاسن و معایب هشت تست آزمایشگاهی رایج
زهرا مولایی، کارشناس آزمایشگاه
گنجاندن مفاهیم و موضوعاتی همچون حساسیت، اختصاصیت و مقادیر پیشبینی مثبت و منفی در کارهای آزمایشگاهی روزمره، دشوار است اما در غیر این صورت ممکن است نتایج تستهای آزمایشگاهی معنیدار نباشد. در این مقاله آنچه شما باید بدانید، آورده شده است.
اشتباهات آزمایشگاه بهعنوان خطاهای تشخیصی تلقی نمیشوند اما اینچنین خطاهایی بهطور چشمگیری در هزاران اشتباه پزشکی که در هر سال رخ میدهند، دخیل هستند. بخشی از مشکل این است: با اینکه تفسیر دقیق از تستهای آزمایشگاهی اغلب به استفاده از مفاهیم آماری که همگی ما در دوره آموزش پزشکی آموختهایم، وابسته است اما پیدا کردن زمانی برای گنجاندن این اصول در یک حرفه پرمشغله، دشوار است.
| توصیههای عملی
· هنگام تفسیر سطوح هموگلوبین A1c (HbA1c)، آنمی و دیگر همابتلاییهایی که میتوانند تأثیر چشمگیری بر روی طول عمر گلبولهای قرمز داشته باشند را ارزیابی کنید. · تنها در بیمارانی که امکان ناشتا بودن ندارند آزمایش چربی را به صورت غیر ناشتا انجام دهید. نتایج این آزمایشها می تواند در غربال گری و شروع درمان مفید باشد. · از ارزیابی روتین هورمون محرک تیروئيدی (TSH) در بزرگسالان فاقد علامت خودداری کنید، زمانی که سنجش، اندیکاسیون دارد با TSH شروع کنید. |
استفاده بیش از حد از تستهای آزمایشگاهی نیز مشکلاتی را به بار میآورد. به دلیل اینکه «بازه نرمال» برای تستهای آزمایشگاهی بر اساس آنالیزهای آماری تعیین میشود، ۵% بیماران در یک توزیع استاندارد، در خارج از بازه نرمال قرار میگیرند. بسیار مهم است که پزشک تنها تستهایی را که واقعاً موردنیاز است درخواست کند چرا که تستهای بیش از حد بهطور خودکار به معنای بیشتر شدن نتایج مثبت کاذب است.
این مقاله با در نظر داشتن چنین معایب و خطراتی نگاشته شده است. در صفحاتی که در ادامه خواهید خواند، ما بر روی ۸ نوع از تستهایی متمرکز شدهایم که پزشکان خانواده مرتباً بر روی آنها تکیه میکنند؛ همه مواردی که در آنها نتایج تستها تنها در صورتی قابل اعتماد است که همابتلاییها (comorbidity)، احتمالات قبل و بعد از تست و زمینه بالینی بهدقت بررسی میشود. برای کمک به اینکه شما بتوانید این تستهای آزمایشگاهی را در زمینه مناسبی قرار دهید، در مورد هر یک از آنها ما به یک سؤال کلیدی اشاره کردهایم و هم مزایا و هم معایب آن را برجسته کردهایم.
تنها آزمایشی را که ضرورت دارد درخواست دهید، انجام آزمایش بیشتر موجب بروز موارد مثبت کاذب بیشتر میشود
۱: هموگلوبین A1c: چگونه آنمی بر آن تأثیر میگذارد؟
هموگلوبین A1c (HbA1c) را میتوان به روشهای مختلفی از جمله کروماتوگرافی مایع با کارایی بالا، برونات افینیتی، الکتروفورز کاپیلاری و ایمونواسی اندازهگیری کرد. همه این روشها میتوانند مقادیر یکسانی را بدون تغییر چشمگیری نشان دهند. با این حال در تفسیر این تستها آگاهی از اثر آنمی بر روی HbA1c بسیار حائز اهمیت است.
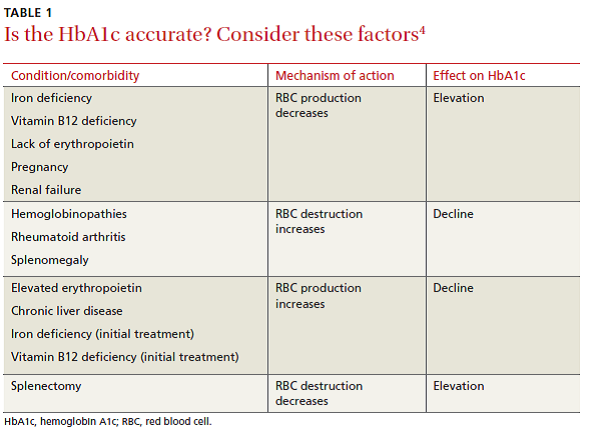
دو متغیر اصلی که روی HbA1c اثر میگذارند عبارتند از میانگین گلوکز و میانگین طول عمر گلبولهای قرمز (RBC). در حالت نرمال ارتباط مستقیمی بین میانگین گلوکز سرم و HbA1c وجود دارد. در بیماران مبتلا به آنمی، این ارتباط کمتر مشخص است و ممکن است تحت تأثیر اریتروپوئز و تخریب گلبول قرمز قرار گیرد. در آنمی فقر آهن (IDA) تولید هموگلوبین به دلیل کاهش ذخایر آهن کاهش مییابد و منجر به شکلگیری سلولهای میکروسیتیک با طول عمر بیشتر و افزایش HbA1c میشود. حداقل در یک مطالعه، سطوح HbA1c در یک بیمار بدون دیابت، (با افزایش به میزان 1.5%) نزدیک به سطوح آن در بیماران دیابتی به دست آمد که پس از درمان فقر آهن تصحیح گردید.
افزایش تخریب و همچنین افزایش تولید گلبولهای قرمز، طول عمر گلبولهای قرمز را میکاهد و این امر به نوبه خود باعث کاهش سطوح HbA1c میشود (جدول ۱). این مسئله را میتوان در بیماریهایی مانند اسپلنومگالی و هموگلوبینوپاتیها مشاهده کرد. در بیماران مبتلا به هموگلوبینوپاتی، درصد هموگلوبین A بهطور چشمگیری کاهش مییابد و اغلب به سطوح غیرقابل تشخیص میرسد و از این رو باعث میشود تست HbA1c فاقد دقت شود. الکتروفورز هموگلوبین و تشخیص گلیکوزیله شدن با استفاده از الکتروفورز کاپیلاری یا کروماتوگرافی مایع با میل ترکیبی بالا میتواند بهعنوان جایگزین استفاده شود، اما در عمل هیچیک به دلیل هزینه بالا و دسترسی محدود مورد استفاده قرار نمیگیرند.
نکته کلیدی: هنگامی که نتایج تست HbA1c را ارزیابی میکنید، بررسی بیمار از نظر آنمی و دیگر بیماریها و همابتلاییهایی که میتوانند بر طول عمر گلبول قرمز اثر گذاشته و نتایج تست را منحرف سازند، ضرورت دارد.
۲: دی- دایمر: چه زمانی باید از آن استفاده کنید؟
دی- دایمر یک فراورده حاصل از تخریب فیبرین است که در زمان انعقاد فعال افزایش مییابد و سنجش آن- که حساسیت بالا و اختصاصیت پایینی دارد- بهطور گسترده برای غربالگری آمبولی ریوی (PE) و ترومبوز ورید عمقی (DVT) مورد استفاده قرار میگیرد. با اینکه پایین بودن تعداد نتایج منفی کاذب، دی- دایمر را به یک تست غربالگری ارزشمند تبدیل میکند، اما بالا بودن نرخ نتایج مثبت کاذب، رسیدن به یک تشخیص قطعی را دشوار میسازد. استفاده مناسب و بجا از سنجش دی- دایمر برای به حداقل رساندن احتمال عواقب نامطلوب مانند خونریزی در بیمارانی که به دلیل نتایج مثبت کاذب بهطور نابجا تحت درمان با ضدانعقاد قرار گرفتهاند، ضروری است.
عموماً به دنبال دی- دایمر تستهای بیشتر انجام میشود. معمولاً به دنبال یک تست دی- دایمر مثبت، اسکن توموگرافی کامپیوتری (CT اسکن) از قفسه سینه یا اسکن پرفیوژن/ ونتیلاسیون انجام میشود تا وجود آمبولی ریوی یا ترومبوز ورید عمقی اثبات شود؛ اما این تستهای بعدی، هم موجب افزایش هزینههای مراقبتهای سلامتی میشود و هم بیمار را در معرض پرتوتابی قرار میدهد. استفاده از این اسکنها میتواند در وهله اول با بررسی احتمالات پیش از تست (pretest probability) بیمار برای آمبولی ریوی یا ترومبوز ورید عمقی کاهش یابد. معیارهای Wall (در نشانی www.mdcalc.com/wells-criteriafor-pulmonary-embolism-pe/ در دسترس است) و امتیازبندی Geneva (تصحیحشده) (در نشانی www.mdcalc.com/geneva-score-revised-for-pulmonary-embolism/) هر دو میتوانند برای این هدف سودمند باشند.
بیمارانی با احتمال قبل از تست بالا باید قبل از انجام دی- دایمر بهسرعت اسکن شوند و دی- دایمر باید برای بیمارانی با احتمال پیش از تست پایین یا متوسط اما با دلایل کافی برای مشکوک شدن به آمبولی ریوی یا ترومبوز ورید عمقی انجام شود.
اختصاصیت پایین تست دی- دایمر چالشهای دیگری را برای استفاده مؤثر و مفید از آن ایجاد میکند. عوامل بسیاری وجود دارد که میتوانند سطوح دی- دایمر را افزایش دهند؛ مانند سن، سرطان، بیتحرکی طولانیمدت، بیماری خودایمنی، التهاب، آنمی داسی شکل، بارداری، تروما و عمل جراحی. همه این فاکتورها باید قبل از تجویز این تست در نظر گرفته شوند.
در واقع اخیراً پژوهشی نشان داده است که استفاده از cutoff دی-دایمر تطبیق دادهشده با سن (سن بیمار برحسب سال × mcg/L ۱۰) بهجای cutoff مرسوم mcg/L ۵۰۰، در بیماران بالای ۵۰ سال، نتایج مثبت کاذب را بدون افزایش نتایج منفی کاذب، کاهش میدهد.
همچنین باید اشاره کرد که ضدانعقاد میتواند سطوح دی- دایمر را در پلاسما کاهش دهد، بنابراین، این تست در بیمارانی که تحت درمان با ضدانعقاد هستند نباید برای رد کردن آمبولی ریوی یا ترومبوز ورید عمقی استفاده شود.
نکته کلیدی: در ارزیابی بیماران برای آمبولی ریوی یا ترومبوز ورید عمقی، از معیارهای Wall و امتیازبندی Geneva (اصلاحشده)، برای تعیین احتمال پیش از تست بیمار استفاده کنید. در بیمارانی با احتمال پیش از تست پایین یا متوسط از سنجش دی- دایمر برای کنار گذاشتن این بیماریها استفاده کنید اما بیمارانی با احتمال پیش از تست بالا را مستقیماً برای اسکن ارجاع دهید.
3: پنلهای لیپید: ناشتا بودن چقدر اهمیت دارد؟
معمولاً به بیماران گفته میشود که بررسیهای آزمایشگاهی باید بهصورت ناشتا گزارش شوند، بهویژه در مورد بررسی پروفایل لیپیدی. بهصورت مرسوم، ناشتا بودن به معنای یک بازه 12-8 ساعته بدون مصرف غذا است. هرچند در حرفه پزشکی این مسئله توسط بیمار بهصورت نادرست تفسیر میشود، بیمار ممکن است در مورد مدت زمان غذا نخوردن گیج شود یا در مورد اینکه بلافاصله قبل از تست میتواند چیزی بخورد یا بیاشامد، نامطمئن باشد.
پژوهشهایی که اثر وعدههای غذایی را بر روی مقادیر آزمایشگاهی بررسی کردهاند، نشان دادهاند که تریگلیسریدها پس از صرف یک وعده غذایی بهطور مداوم تا حداکثر ۱۲ ساعت افزایش مییابند. اثر ناشتا بودن بر روی کلسترول تام، کلسترول ال دی ال (LDL) و کلسترول اچ دی ال (HDL) بیشتر مورد مناقشه است، در حالی که برخی تفاوتها شناخته شده است اما ارتباط بالینی مبهم است.
مقادیر لیپید غیر ناشتا میتواند اطلاعات مفیدی را فراهم آورد، بهویژه در بیمارانی که تمایل یا توانایی بازگشت به آزمایشگاه برای آزمایش ناشتا را ندارند. کارگروه خدمات پیشگیری کننده ایالات متحده امریکا (USPSTF) از این رویه حمایت میکند. اگرچه به این دلیل که گایدلاینها برای ارزیابی و درمان مبتنی بر لیپیدهای ناشتا هستند، برای شروع درمان و پایش بیماران با مقادیر غیرطبیعی، هر زمان که ممکن بود باید از آزمایشهای ناشتا استفاده شود. اگر از مقادیر لیپیدهای غیرناشتا استفاده شود، باید اثرات مصرف غذا بر روی تریگلیسریدها و متعاقباً دشواری سنجش سطوح کلسترول LDL را در نظر گرفت.
نکته کلیدی: ارتباط بالینی بین سطوح لیپید پس از صرف غذا و سطوح آن بهصورت ناشتا، مبهم است. پنل لیپیدی غیرناشتا، در غربالگری و درمان اولیه بهویژه در مواردی که بدست آوردن مقادیر ناشتا با مشکلاتی همراه است، کارایی بالینی معقولی دارد.
۴: تست مونونوکلئوز اسپات: چه زمانی باید از آن استفاده کنید؟
تست مونواسپات یک سنجش مبتنی بر لاتکس است که باعث هماگلوتیناسیون گلبولهای قرمز اسب در حضور آنتیبادیهای هتروفیل که مشخصه مونونوکلئوز عفونی هستند، میشود. این آنتیبادیها طی ۷ روز ابتدایی آغاز علائم ایجاد میشوند اما تا 5-2 هفته به بیشترین مقدار خود نمیرسند، در نتیجه تست مونواسپات با وقوع نتایج منفی کاذب بالایی در طول دو هفته ابتدایی حضور عفونت فعال، همراه است. نتایج منفی کاذب در بیماران جوانتر از ۱۴ سال، شایع است. آنتیبادیهای هتروفیل ممکن است تا حدود یک سال پس از عفونت فعال نیز حضور داشته باشند.
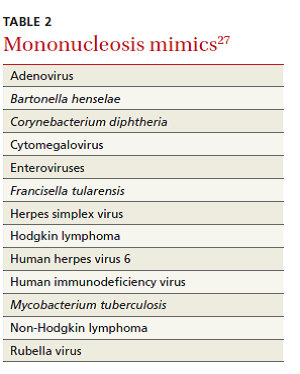
در بیمارانی که با احتمال پارگی طحال بالاست، مانند ورزشکاران، دشواری تشخیصی قابل توجهی وجود دارد. هنگامی که به لحاظ بالینی شک قوی به مونونوکلئوز وجود دارد علیرغم منفی بودن تست مونواسپات در چنین افراد پر ریسک، انجام تستهای پیگیری برای افتراق بیماری از بیماریهای مشابه مونونوکلئوز، توصیه میشود (جدول ۲). ترکیب بهینه از آزمایشهای سرولوژیک برای ویروس اپشتین- بار (EBV)، شامل اندازهگیری عیار آنتیبادی علیه ۴ مارکر میشود: ایمونوگلوبینهای M (IgM) و G (IgG) علیه آنتیژن کپسید ویروس، IgM علیه آنتیژن اولیه و آنتیبادی علیه آنتیژن هستهای اپشتین- بار (EBNA). واکنشگرهای فاز حاد در حالی که آنتیبادی علیه EBNA وجود دارد میتوانند نشاندهنده فعال شدن مجدد عفونت باشند. وجود یک تست مثبت، دیگر دلایل پزشکی را رد نمیکند، زیرا تا ۲۰% بیماران، برای چندین سال، دارای آنتیبادیهای فاز حاد هستند.
تشخیص مناسب بسیار مهم است زیرا EBV با عوارض قابل ملاحظهای همراه است. بیشترین خطر آسیب طحالی بین ۴ تا ۲۱ روز پس از آغاز علائم است، اما تا ۷ هفته هم خطر وجود دارد، بنابراین درمان محافظتی و انجام آزمایش مونواسپات در یک هفته بعد، یک روش معقول است.
مونونوکلئوز یا التهاب معمولی لوزه ؟ باید توجه داشت که شواهدی وجود ندارد که نشان دهد تست مونواسپات مثبت، مدیریت یا نتیجه التهاب لوزه معمولی را تحت تأثیر قرار میدهد، این مسئله پرسشهایی را در مورد کارایی این تست در چنین بیمارانی بهوجود آورده است. یک روش بهتر این است: تست را برای بیمارانی با یافتههای اضافی، یعنی اسپلنومگالی یا کسانی که علائم پابرجا به مدت بیش از ۲ هفته دارند، انجام دهید
نکته کلیدی: حداقل دو هفته برای انجام مونواسپات در بیمارانی با التهاب لوزه معمولی صبر کنید. اگر به لحاظ بالینی شک قوی به مونونوکلئوز وجود دارد، آزمایش سرولوژیک اختصاصیIgM و IgG را انجام دهید.
5: ارزیابی سطوح داروهای تجویزشده: عوامل مداخله کننده کدامند؟
تفسیر صحیح از تستهای آزمایشگاهی انجامشده برای اندازهگیری سطوح داروی تجویزشده، پیامدهای عمدهای در ارتباط با ایمنی بیمار بهویژه در مورد داروهایی با شاخص درمانی باریک دارد.
بیشتر تستهای سنجش سطح دارو، غلظت کل را اندازه میگیرند که اشکال متصلشده و متصلنشده (آزاد) را شامل میشود. اشکال متصلنشده، اجزا فعال دارو هستند؛ بنابراین برای یک ارزیابی دقیق، مهم است که از عواملی که باعث افزایش غلظت داروی آزاد میشوند، آگاه باشیم. در میان این عوامل مهمترین آنها، پایین بودن سطوح پروتئین سرم یا هایپوآلبومینمی است.
ریسکفاکتورهای هایپوآلبومینمی عبارتند از: سوختگی شدید، سن بالا، بارداری، سوءتغذیه و ویروس نقص ایمنی انسان/ سندرم نقص ایمنی انسانی اکتسابی (HIV/AIDS). بهخصوص HIV/AIDS ریسک بالایی دارد زیرا مهارکنندههای پروتئازی خاص بهشدت به پروتئینها متصل میشوند.
اتصال دارو به پروتئین بهصورت کم، متوسط و زیاد طبقهبندی میشود. پروتئینهای اصلی [متصلشونده] عبارتند از: آلبومین، آلفا-۱ اسید گلیکوپروتئین و لیپوپروتئین. داروهایی که به میزان زیاد به پروتئين متصل میشوند (بیش از ۸۰%)، بیشتر تحت تأثیر پایین بودن سطوح پروتئین سرم قرار میگیرند. مشکل زمانی بهوجود میآید که داروها کاملاً به تمام پروتئینهای در دسترس متصل میشوند و در دسترس قرار گرفتن داروهای اضافی، باعث افزایش سطوح داروی آزاد میشود.
داروهایی که بیتشر تحت تاثیر اتصال به پروتئين قرار میگیرند، عبارتند از: کاربامازپین، سیکلوسپورین، مایکوفنولیک اسید، فنیتوئين، مهارکنندههای پروتئاز (بهجز ایندیناویر)، تاکرولیموس و والپروویک اسید. هنگامی که سنجشهای دارویی را درخواست میکنید، در نظر گرفتن سطوح آزاد، حائز اهمیت است تا از این طریق بتوان از تفسیر نادرست سطوح سرمی در صورت پایین بودن اجتناب کرد؛ سناریویی که خطر سمیت دارویی و پیامدهای نامطلوب را افزایش میدهد.
مطالعهای بر روی ۱۱۹ نمونه فنیتویین از ۷۰ بیمار، در بیمارانی با سطوح پایین آلبومین، افزایش چشمگیر سطوح فنیتویین آزاد را نشان داد. سطوح بالاتر فنیتویین آزاد، در بیماران میانسال و افرادی با عملکرد کلیوی کاهشیافته (کلیرانس کراتینین < mL/min ۲۵) نیز دیده میشود. درجه اتصال به پروتئین هم بهوسیله غلظت سرمی دارو و هم سطوح آلبومین، تحت تأثیر قرار میگیرد اشباع اتصال به پروتئین در سطوح بالاتر دارو رخ میدهد.
سطح فنیتویین را با این معادله محاسبه کنید؛ برای محاسبه سطوح فنیتویین تصحیحشده در بیمارانی با سطوح پایین آلبومین، از فرمول ذیل که تحت عنوان معادله Sheiner-Tozer شناخته میشود، استفاده کنید:
غلظت تصحیحشده= غلظت گزارششده تقسیم بر([فاکتور تنظیم × آلبومین سرم] + 0.1)
فاکتور تنظیم = 0.2 برای کلیرانس کراتینین ≤ ۲۰ یا 0.1 برای کلیرانس کراتینین < ۲۰
دلایل دیگر تفسیر نادرست سطوح دارو. با اینکه هایپوآلبومینمی نقش عمدهای در تفسیر نادرست از سطوح دارو بر عهده دارد، اما فاکتورهای دیگری نیز غلظت سرمی دارو را تحت تأثیر قرار میدهند. این موارد شامل برهمکنشهای دارو- دارو که میتواند بهطور چشمگیری غلظت داروهای دخیل در برهمکنش را افزایش دهد و زمان انجام تست نسبت به زمان تجویز دارو است. به ویژه میزان دیگوکسین، ، باید حداقل ۶ تا ۸ ساعت پس از آخرین دوز مصرفشده، سنجیده شود تا در این زمان دارو بتواند بهطور مناسب توزیع و پخش شود.
نکته کلیدی: در نظر گرفتن پایش سطح داروی آزاد در بیمارانی با هایپوآلبومینمی یا افراد دارای ریسکفاکتورهای هایپوآلبومینمی ضروری است تا از این طریق بتوان از تخمین پایین سطوح دارو بهصورت کاذب اجتناب نمود.
6: تستهای عملکرد کبدی: آیا برای بیماران تحت درمان با استاتین، ضروری است؟
از زمانی که استاتینها تأییدیه سازمان غذا و داروی ایالات متحده امریکا را دریافت کردهاند، این داروها با افزایش مقدار تستهای عملکرد کبدی (LFTs) ا ، همراه بودهاند. در واقع بر اساس کارآزماییهای بالینی، یک باور قدیمی وجود دارد که با پایش آلانین آمینوترانسفراز (ALT) و حفظ آن در مقدار کمتر از ۳ برابر حد بالایی مقدار نرمال (ULN)، میتوان از سمیت کبدی جلوگیری کرد. با این وجود به لحاظ بالینی، افزایش بیشتر ALT بر اساس تحمل و قابلیت پذیرش بیمار مجاز است.
در فوریه سال ۲۰۱۲، FDA اطلاعات ایمنی خود را برای بازتاب دادن این روش، بازبینی نمود. این آپدیت FDA تأیید میکند که پایش روتین LFT برای بیماران تحت درمان با استاتین ضروری نیست و این عمل برای شناسایی یا جلوگیری از آسیب کبدی، کارآمدی زیادی ندارد.
بهصورت کلی سمیت کبدی وخیم، با نرخ وقوع کمتر از ۲ در هر ۱ میلیون بیمار در سال بسیار نادر است. در بیمارانی که تستهای عملکرد کبدی که در آنها ۳ تا ۵ برابر حد بالای نرمال افزایش یافته است انجمن ملی لیپید -کارگروه سنجش ایمنی استاتین، تکرار تستها را بعد از ۶ ماه و ادامه درمان با استاتین در صورت بدون علامت بودن بیمار را توصیه میکند.
نکته کلیدی: بررسی تستهای عملکرد کبدی بهصورت روتین در بیماران تحت درمان با استاتین ضروری نیست. یک روش بهتر این است: سطوح پایه ALT را بهدست آورید و تست را تنها در صورت وجود اندیکاسیون بالینی تکرار کنید.
7: غربالگری دارو در ادرار: چه عواملی دقت آزمایش را تحت تأثیر قرار میدهد؟
استاندارد طلایی برای سنجش سوءمصرف داروها، غربالگریهای دارو در ادرار (urine drug screens) است که حساسیت و اختصاصیت مناسبی دارند، بهراحتی انجام میشوند و هزینه آنها معقول است. غربالگری دارو در ادرار میتواند مخدرهای مختلف مانند مورفین، اکسیکدون و متادون را تشخیص دهد و دیگر داروهای غیرمجاز را شناسایی کند. البته اینکه کدام داروها و متابولیتها مورد سنجش قرار بگیرند، به آزمایشگاه و نوع تست بستگی دارد.
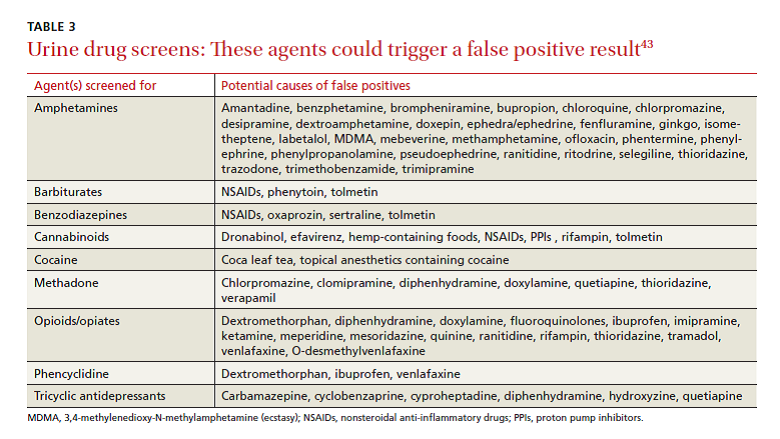
واکنش متقاطع. در حال حاضر ۶ ایمونواسی در دسترس است که همگی آنها از اتصال رقابتی بین نمونه دارو و یک داروی نشاندارشده با یک آنزیم، رادیوایزوتوپ یا فلوروفور استفاده میکنند. نمونه دارو و داروی نشاندارشده برای جایگاههای اتصال سوبسترا بر روی آنتیبادیهای اختصاصی دارو با یکدیگر رقابت میکنند. همانند اتصال رقابتی در مورد واکنشهای آنزیمی درون بدن، جایگاه اتصال سوبسترا میتواند دچار واکنش متقاطع شود که باعث میشود موادی به غیر از داروی موردنظر به ایمونوگلوبولین متصل شود و در نهایت نتایج مثبت کاذب بهدست آید (جدول ۳). دیگر عواملی که میتوانند نتایج را تغییر دهند عبارتند از مقدار cutoff تست و جذب، توزیع، متابولیسم و ترشح دارو؛ بنابراین یک تست تأییدی کروماتوگرافی گازی- اسپکترومتری جرمی پیش از تصمیمگیری بر اساس نتایج غربالگری دارو در ادرار، توصیه میشود.
غربالگریهای روتین برای بیماران تحت درمان مداوم با مخدرها. استفاده روتین از غربالگری دارو در ادرار بر اساس شواهدی که نشان میدهند نتایج، تأثیر چشمگیری بر مدیریت بیمار ندارد، دیگر در بخشهای اورژانس توصیه نمیشود، با این حال، در مورد بیمارانی که تحت درمان مداوم با مخدرها هستند، نشان داده شده است که غربالگری روتین در تشخیص سوءمصرف مخدر تجویزشده، استفاده از داروهای غیرمجاز و رد گم کردن مفید است. مشخص شده است که تا ۳۴% بیمارانی که برای آنها مخدر تجویز شده است، داروهای غیرمجاز نیز مصرف میکنند.
نکته کلیدی: از غربالگری دارو در ادرار بهعنوان ابزاری برای مدیریت بیماران تحت درمان مداوم با مخدر استفاده کنید، اما قبل از تصمیمگیری بر اساس نتایج، فاکتورهایی مانند استفاده از داروهای موضعی یا خوراکی و مقادیر cutoff تست را که ممکن است با نتایج مثبت یا منفی کاذب همراه باشند، ارزیابی کنید.
۸: سنجش عملکرد تیروئید: چه زمانی باید این تست را انجام دهید؟
سنجش هورمون محرک تیروئیدی (TSH) بهعنوان تست خط اول (first- line test) در هنگام بررسی پرکاری یا کمکاری تیروئید، مطرح است. سنجشهای کمیلومینومتری (chemiluminometry) نسل سوم، میتوانند بهصورت قابل اعتمادی غلظتهای کمتر از mU/L 0.01 هورمون محرک تیروئیدی را با استفاده از چندین آنتیبادی و با ایجاد اثر ساندویچی بر روی مولکول موردنظر، اندازهگیری کنند.
با این وجود، سطوح TSH تحت تأثیر تغییرات شبانهروزی و داروهایی از قبیل استروئیدها، مواد مخدر (opiates) و برخی آنتیهیستامینها و همچنین همابتلاییها قرار میگیرد. بیماریهای مزمن و حادی که ارتباطی به بیماری تیروئید ندارند میتوانند موجب تغییرات گذرا در غلظت TSH شوند و پتانسیل ایجاد تغییر در ظرفیت اتصالی پروتئینهای متصلشونده به هورمون تیروئيد در پلاسما را نیز دارا هستند؛ بنابراین سنجش TSH در بیماران بستری تنها زمانی درخواست شود که شک بالینی به حضور مشکلات تیروئيد وجود داشته باشد. کارگروه خدمات پیشگیری کننده ایالات متحده امریکا (USPSTF)، انجام غربالگری TSH بهصورت روتین را در بزرگسالان بدون علامت، توصیه نمیکند.
چگونه به نتایج غیرطبیعی واکنش نشان دهیم؟ در بیمارانی که سطوح TSH آنها غیرطبیعی است، سنجش T4 آزاد (fT4) بهعنوان تست بعدی مطرح است. سنجش T4 آزاد یک نشانگر عالی از وضعیت تیروئید است زیرا تحت تأثیر تغییرات در پروتئینهای متصلشونده به یدوتیرونین که بر اندازهگیری هورمون تام اثر میگذارد، قرار نمیگیرد. نتایج این سنجش در پرکاری تیروئيد، افزایش و در کمکاری تیروئيد کاهش مییابد.
اندازهگیری ترییدوتیرونین (T3) میتواند در تشخیص بیماری گریوز که در آن مسمومیت ناشی از T3 ممکن است اولین علامت یا نشاندهنده عود بیماری باشد، سودمند باشد. با این وجود، به دلیل اینکه T3 غالباً یک محصول جانبی است، بیماریهای غیرتیروئيدی و داروها میتوانند بهطور کاذب باعث نتایج غیرطبیعی شوند.
دیگر تستهای اختصاصی تیروئيد شامل آنتیبادیهای تیروئيدی مانند آنتی تیروئید پراکسیداز، آنتی تیروگلوبولین و رسپتور TSH، هم مسدودکننده و هم تحریککننده هستند. تیروگلوبولین پیشسازی از هورمون تیروئيد است و باید هنگامی که به وجود کمکاری تیروئید کاذب مشکوک هستید، اندازهگیری شود. مدیریت کمکاری و پرکاری تیروئيد غالباً مستقل از اتیولوژی است. سنجش مجدد TSH برای ارزیابی پاسخ به درمان باید تا بیش از ۲ ماه بعد از هرگونه تغییری در نوع دارو یا دوز آن به تعویق انداخته شود.
تفسیر بررسیهای صورت گرفته بر روی تیروئيد میتواند بسیار دشوار باشد. TSH باید بهعنوان اولین تست درخواست شود. با این حال، اگر مقادیر TSH با تصویر بالینی همخوانی نداشت، T4 آزاد، T3 و دیگر تستهای تیروئيدی که کمتر تحت تأثیر عوامل خارجی قرار میگیرند میتوانند برای تشخیص علت، مفید باشند.
نکته کلیدی: سنجش TSH بهصورت روتین در بزرگسالان بدون علامت، اندیکاسیون ندارد. زمانی که ارزیابی عملکرد تیروئید به لحاظ بالینی اندیکاسیون دارد، TSH بهعنوان تست انتخابی مطرح است.
این مقاله ترجمه ای است از :
Pitfalls & pearls for 8 common lab tests
Vol 63, No 4 | APRIL 2014 | The Journal of Family Practice
تأثیر داروها بر آزمونهای عملکرد تیروئید
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام