پلتفرم جدید برای تشخیص جامع بیماریهای اتوایمیون
علی عجمی، دکتری علوم آزمایشگاهی
محمدرضا سجادیه، دکتری ایمونولوژی
مسعود عدالتی، متخصص پاتولوژی
الهام ملکی، مریم نصر اصفهانی، لیلا حقشناس، مهدی جعفری، منصور شجریان: گروه R&D آزمایشگاه نوبل
آزمایشگاه تشخیص طبی نوبل، اصفهان
اختصارات
AAb: Autoantibody
ANA: Antinuclear antibody
ACyA: Anticytoplasmic antibody
ANCA: Antineutrophil cytoplasmic antibody
AASV: ANCA-associated systemic vasculitis
cANCA: Cytoplasmic ANCA
CLIFT: Crithidia luciliae immunofluorescence test
DSB: Double-strand break
dsDNA: Double-stranded DNA
ELISA: Enzyme-linked immunosorbent assays
GBM: Antiglomerular basement membrane
GPS: Goodpasture syndrome
IIF: Indirect immunofluorescence
IIM: Idiopathic inflammatory myopathy
LED: Light-emitting diode
MIA: Microbead-based immunoassay
MPO: Myeloperoxidase;
pANCA: Perinuclear ANCA
PR3: Proteinase 3
RA: Rheumatoid arthritis
SARD: Systemic autoimmune rheumatic disease
SLE: Systemic lupus erythematosus
SjS: Sj¨ogren’s syndrome
SSc: Systemic sclerosis.
مقدمه
بیماریهای خودایمنی روماتیسمی سیستماتیک (SARDs)، مانند لوپوس اریتروماتوز سیستمیک (SLE)، آرتریت روماتوئید (RA)، اسکلروز سیستمیک (SSc)، التهاب میوپاتی ایدیوپاتیک (IIM)، سندرم شوگرن (SjS) و آنتیبادی سیتوپلاسمی علیه نوتروفیل (ANCA) مرتبط با واسکولیت سیستمیک (AASV)، اغلب با وقوع اتوآنتیبادی (AAb)های اختصاصی غیروابسته به ارگان همراه است، بهویژه آنتیبادیهای علیه هسته (ANA) و اتوآنتیبادیهای علیه سیتوپلاسم (ACyA) مارکرهای مفیدی در تشخیص سرولوژیک SARD هستند. همچنین این مارکرها در آگاهی و طبقهبندی فعالیت بیماری نظارت دارند. ایمنوفلورسنت (IF) بر روی سلولهای HEp-2 (کارسینومای لارنژی اپیدرموئید انسان) متداولترین روش برای اسکرینینگ آنتیبادیها در استراتژی تشخیصی دو مرحلهای برای SARD تبدیل شده است. حساسیت بالا برای ارزیابی ANA توسط روش IF یک ابزار ایدهآل برای تکنولوژیهای متفاوت اسکرینینگ ایمنولوژیک میباشد، بااینحال تفسیر مناسب الگوهای رنگآمیزی IF به دلیل اتوماتیک نبودن دستگاه، کمبود زمان و همچنین تفسیر اپراتور دشوار میگردد، بنابراین IF با تکنیکهای جدید بر پایه ایمنواسی فاز جامد (مثل ELISA،dot/line immunoassay و addressable bead /microarray assays) جایگزین میشود. این روشها با توجه به افزایش تقاضای تشخیص بیماری میتوانند بهصورت خودکار و با هزینههای کارآمدتر در بیماریهای خودایمنی مورد استفاده قرار بگیرند. بااینوجود، در این تکنیکها میزان بالایی از نتایج منفی کاذب گزارش شده است. برای حل این مسئله کالج روماتولوژی آمریکا (ACR) روش IF را بهعنوان استاندارد طلایی تست ANA تأئید کردند.
بااینوجود، برای برطرف کردن نقصهای موجود در ارزیابی ANA بهواسطهی تکنیک IF، نیاز به استفاده از این روش در محیط آزمایشگاهی مدرن برای آنتیبادیهای مرتبط با SARD است. در دهه گذشته، تلاشهایی برای افزایش سطح استاندارد و اتوماسیون صورت گرفته تا اختلاف بالای درون و فرا آزمایشگاهی را کاهش داده و قابلیت این روش را برای اسکرینینگ با بازده بالا افزایش دهد. جدای از راهحلهای سیستم برای آمادهسازی اتوماتیک نمونه، شرکتهای تولیدکننده دستگاههای تشخیصی شروع به معرفی فناوریهای جدید برای تفسیر الگوی اتوماتیک IF کردهاند. سیستمهای تجاری موجود بهطور کلی مبتنی بر دسترسی دیجیتال و تحلیل تصاویر IF توسط الگوریتمهای تشخیص الگو میباشند. برخی از این سیستمها تنها نتایج غربالگری منفی و مثبت را از هم متمایز میسازند، درحالیکه دیگر سیستمها همچنین قادر به طبقهبندی الگوهای پایهای رنگآمیزی میباشند. سیستم تفسیری کاملاً اتوماتیک AKLIDES که در چهارچوب تکنولوژی VIDEO SCAN توسعه یافته، اولین پلتفرم موجود تجاری میباشد که در مطالعات بالینی مورد ارزیابی قرار گرفته است. بر اساس فلورسانس میکروسکوپی که دارای رنگهای متفاوت فلوروکروم میباشد، این سیستم قادر به اندازهگیری تراکم تعداد فلورسانس بوده و میتواند الگوهای رنگآمیزی پایهای IF سلولهای HEp-2 را تفسیر نماید. اخیراً دامنه کاربرد پلتفرم AKLIDES تا ANCA و ارزیابی آنتیبادی علیه DNA دورشتهای (dsDNA) با استفاده از نوتروفیلهای انسانی ثابت و Crithidia luciliae بهعنوان سوبسترا گسترش یافته است.
علاوه بر این، سیستم AKLIDES اکنون قادر به ارزیابی IF مبتنی بر سلول نقاط کانونی روشن γH2AX میباشد که برای سنجش بیودوزیمتریک مجزای آسیبهای DNA دوپشتهای (DSBs) مورد استفاده قرار میگیرد. بهطور مشخص، روش ایمونواسی مبتنی بر میکروبید (MIAs) برای آزمایش تأییدی آنتیبادیهای مرتبط با SARD برای اولین بار روی پلتفرم AKLIDES، ایجاد شده که بهوسیله آن راهحل تشخیصی- ترکیبی برای اسکرینینگ IF و آزمایش تأییدی در سرولوژی اتوایمیون، توسعه یافته است.
مقاله حاضر یک بررسی کلی از مطالعات اخیراً انتشاریافته میباشد که طی آن سیستم AKLIDES به همراه شیوههای مورد استفاده در تشخیصهای روتین مرتبط با استانداردسازی، اتوماسیون و قابلیت اعتماد به این تکنولوژی جدید مورد مقایسه قرار گرفته است.
پلتفرم AKLIDES
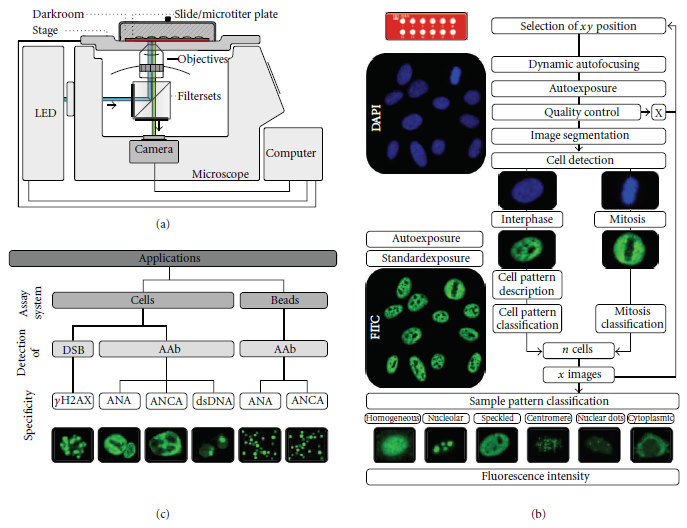
- مشخصات فنی و اجزای تشکیلدهنده
سیستم فنی AKLIDES بر اساس ساختارهای جدید و منحصربفرد سختافزاری است. واحدهای اندازهگیری همراه با الگوهای ریاضی، الگوریتمهای نرمافزاری تشخیصی، توانایی گرفتن عکس بهصورت اتوماتیک، تجزیه و تحلیل و ارزیابی تستهای ایمونوفلورسانس از ویژگیهای بارز این دستگاه میباشد. اسکلت اصلی سیستم AKLIDES از یک میکروسکوپ فلورسنت مجهز به موتور (Olympus IX81،Olympus Corp، توکیو، ژاپن) تشکیل شده است و شامل فیلترهای دولایهای است که میتوانند بهطور خودکار روشن شوند. همچنین اسکن متحرک (IM120،M¨rzh¨auser،Wetzlar، آلمان) همراه با مبدلهای قابل تعویض به انتخاب دقیق از موقعیت xy درخواستشده و اندازهگیری اسلایدها کمک میکند. برای گرفتن عکس بصورت خودکار، یک نرمافزار جدید بر پایه فوکوس اتوماتیک طراحی شده است. رنگآمیزی هستهای اضافی با استفاده از
4,6-دیامیدین-2-فنیل ایندول (DAPI) در چارچوب سنجشهای سلول محور برای فوکوس اتوماتیک، ارزیابی کیفی، و تشخیص دستگاهی انجام شده است.
- مفهوم نرمافزار
ارزیابی اتوماتیک IF توسط AKLIDES دربرگیرنده یک فرآیند چندمرحلهای متوالی میباشد که شامل دسترسی به تصویر، کنترل کیفی، تقسیمبندی دستگاهی، توصیف دستگاهی و طبقهبندی آن مطابق شکل است. بعد از گزینش موقعیت درخواستی xy بر روی اسلاید، فوکوس اتوماتیک دینامیک در کانال DPAI با شروع فوکوس غیرشفاف برای یافتن موقعیت تقریبی لایهای انجام میشود که در نتیجه توسط فوکوس دقیق برای یافتن صفحه کانونی دقیق دنبال میشود. برای خارج ساختن تصاویری که ارزیابی بیشتری به دلیل عدم کیفیت در ظهور، محبوس شدن هوا یا ناهمگونیهایی در رنگآمیزی فلورسنت نیاز دارند، یک آنالیز کیفی تصویر مورد اجرا قرار میگیرد، بنابراین هر تصویر به بخشهایی با اندازه یکسان تقسیمبندی میشود. مقایسه شفافیت محاسبهشده هر بخش و همگونی آن برای ارزیابی کیفی مورد استفاده قرار میگیرد. رنگآمیزی DAPI برای تعیین مکان سلول و برای تشخیص سلولهای میتوزی، جایی که تشخیص الگو در حالت FITC انجام میگیرد، استفاده میشود. طبقهبندی دستگاهی الگوهای ایمونوفلورسانس از طریق ترکیب ویژگیهای بافتی و ساختاری که در یک فلورسانس سهمرحلهای دنبال میشوند شامل (i) تشخیص مثبت یا منفی (ii) ارزیابی مکان هسته، سیتوپلاسم و (iii) رنگپذیری سلولهای میتوزی مورد اجرا قرار میگیرد. با وجود رویکرد کنونی، شش الگوی رنگآمیزی سلولهای HEp-2 شامل نقاط سیتوپلاسمیک، همگن، دانهدار، نوکلئولار، سانترومر و هستهای چندگانه میتواند مورد تمایز قرار بگیرد.
تشخیص اتوماتیک الگو میتواند از طریق دو استراتژی متفاوت بدست آید؛ AKLIDES مبتنی بر طبقهبندی کنندههای استاتیک بهمنظور استانداردسازی تفسیر سنجشهایHEp-2 میباشد. برای ارزیابی تراکم تصویر نرمافزار AKLIDES از طریق ترکیب پارامترهای چندگانه شامل تراکم تصویر، وضوح تصویر و شماری از سطوح خاکستری بوجود آمده در سراسر آن، شاخص واکنشدهی RI را محاسبه مینماید. همچنین RI تحت تأثیر زمان ظهور نیز میباشد. برای حصول اطمینان از ظهور تصویر ایدهآل، یک شیوه کامپیوتری اتوماتیک برای تصحیح زمان ظهور تصویر مورد اجرا قرار میگیرد که وابسته به بالاترین سطح خاکستری در تصویر میباشد. همچنین این شیوه، تشخیص الگوهایی با تراکم مطلق ضعیف تصویر (بهعنوان مثال سانتریول و نقاط چندهستهای) را امکانپذیر میسازد. محدودههای نمونههای بدست آمده از 200 اهداکننده خون برای واکنشدهیهای مثبت و بوردرلاین بر پایه معیار RI تعیین میشود. ارزیابی MIA چندگانه مورد بحث قابلمقایسه با سنجش سلولی از قبل توضیح داده شده به استثناء رنگآمیزی شمارشگر DAPI و تشخیص مکانهای زیرسلولی میباشد. کنترل کیفی و فوکوس اتوماتیک مستقیماً با ماکروبیدهای پلیمریزه میباشد و زیرسازی سطح میکروبیدها نیاز نیست.
- کاربردها
برای غلبه بر نتایج منفی IF و پاسخگویی به نیاز درحالیکه افزایش برای تشخیص آنتیبادی مرتبط با SARD رویکردهای تکنیکی متفاوتی برای آزمایش IF توسعه یافته است، براساس تشخیص الگوهای تصویرهای IF و کمیتسنجی تراکم فلورسانس، سنجشهای تجاری موجود IF برای ANA و ACyA در سیستم کاملاً اتوماتیک AKLIDES برای تفسیر IF تعریف شده است. تشخیص آنتیبادی و رنگآمیزی فلورسانس با استفاده از آنتیبادی IgG گوسفندی ضدانسانی که به فلورسنت ایزوتیاسیانات متصل شده و محیط حاوی DAPI انجام میپذیرد. بعد از انطباق الگوریتمهای تشخیصی الگو، طیف کاربرد سیستم AKLIDES تا تشخیصANCA در گرانولوسیتهای نوتروفیل انسانی فیکسشده با اتانول بهعلاوه تشخیص AAb بر ضد dsDNA با استـــــــــــفاده از Crithidia luciliae Immunofluorescence Test (CLIFT) گسترش یافت. با استفاده از MIA مورد بحث برای چندگانهسازی، دامنه این کاربرد از AKLIDES یک راهحل سیستماتیک بینظیر برای سرولوژی SARD را ارائه میکند و میتواند به دو گروه اصلی یعنی اسکرینینگ آنتیبادیها توسط سنجشهای مبتنی بر سلول IF و آنالیز مالتیپلکس ایمونواسی مبتنی بر میکروبید بهعنوان آزمایش تأییدی برای تشخیص AAb تقسیمبندی شود. یک کاربرد کاملاً جدید دیگر از سیستم AKLIDES اندازهگیری dsDNA DSBs از طریق ارزیابی γH2AX foci میباشد.
اسکرینینگ AAbها توسط آزمایشات مبتنی بر سلول
- تشخیص ANA بر روی سلولهای HEp-2
در سال 2010، Egerer و همکاران وی اولین ارزیابی بالینی IF مرتبط با تشخیص ANA را بهواسطه دستگاه AKLIDES در آزمایشات روتین یک آزمایشگاه رفرانس ارجاعی خصوصی انجام دادند. یافتههای مثبت و منفی مرتبط با 1222 سرم بهدستآمده از بیماران مشکوک برای ابتلا به SARD، 93 درصد دقت در تفسیر توسط دستگاه AKLIDES و 90 درصد دقت در مشاهده و گزارش ابتلا توسط دانشگاه را ارزیابی کرد. ارزیابی بعدی در همین راستا توسط هر دو مرکز دانشگاهی و آزمایشگاه خصوصی مؤید 90 درصد کیفیت مشاهده دانشگاهی و بیش از 92 درصد دقت دستگاه AKLIDES بود. تفاوت در تشخیص مشاهدات بین دو روش عمدتاً در بین سرمهایی مشاهده میشد که دارای الگوهای پیچیدهای بودند؛ مانند AAb بر ضد غشای سلولی و یا AAb سیتوپلاسمیک رنگ شده. مطالعات اخیر در مورد تشخیص ANA در اسکرینیگ سلولهای HEp-2 نشان داد که از مجموع 397 نمونه سرم، دقت بالای دستگاه AKLIDES برای انواع تستهای تشخیصی بیمارهای خودایمن بهصورت کاملاً مشهود بوده است، بهطوریکه حساسیت بین 97 و 98 درصد و اختصاصیت بین 91 تا 92 درصد تخمین زده شد.
- تشخیص ANCA در گرانولوسیتهای نوتروفیل انسانی
بهجز تست تشخیصی ANA، ارزیابی ANCA نیز بهوسیله دستگاه AKLIDES انجام میپذیرد. دقت تشخیصی این تست که با واسطه دستگاه AKLIDES صورت میگیرد، توسط Melegari و همکاران وی سنجش شد. در این مطالعه که بر روی 46 نمونه انجام پذیرفت، نمونهها هم توسط دستگاه AKLIDES و هم توسط دو فرد متبحر زیر میکروسکوپ فلوروسنت و هم توسط روش دستی الیزا مطالعه شد. مطابقت بین روش دستی و اتوماتیک 89 درصد گزارش شد. در مطالعهای دیگر که توسط Knuetter و همکاران وی بر روی 293 نمونه نوتروفیل در سرم بیماران AASV و SARDهای دیگر انجام گرفته شد، بررسی نتایج مثبت و منفی بین روش دستی و اتوماتیک نشان داد که دقت دستگاه AKLIDES در خوانش و کیفیت بررسی نمونههای نوتروفیل هم در اتانول و هم بهصورت فیکسشده با فرمالین بر روی تستهای pANCA و cANCA بسیار قابلقبول و مطابق با روش دستی بود.
- تشخیص Anti-dsDNA AAb در Crithidia Luciliae
آنتیبادیهای Anti-dsDNA میتوانند بهوسیله روش IF و با استفاده از CLIFT تشخیص داده شوند. تفسیر اتوماتیک CLIFT بهواسطه دستگاه AKLIDES یک بستر تشخیصی استاندارد را برای آنتیبادیهای اختصاصی مرتبط با بیماریهای خودایمن ارائه مینماید. یکی از مطالعات اخیر که بر روی 44 نمونه بیماران SLE انجام پذیرفته، نشان داده که بررسی چشمی و اتوماتیک، مطابقت بسیار عالی 91 درصد با یکدیگر داشته بهگونهای که میتوان از دستگاه بهعنوان جایگزینی برای بررسیهای چشمی توسط متخصص استفاده نمود، اگرچه ذکر این نکته ضروری به نظر میرسد که تفسیر همیشه باید با نظر متخصص در کنار دستگاه انجام پذیرد.
تستهای تأییدی AAb بهواسطهی تست مالتیپلکس مبتنی بر میکروبید
توصیه میگردد یافتههای مثبت آنتیبادی در اسکرینینگ سرولوژیک SARD به روش ایمنواسی مولکولی تأئید شود. برای ایجاد این پلتفرم مکمل که اجازه میدهد هر دو فاکتور اسکرینینگ آنتیبادی اختصاصی بهوسیله تکنیک IF شناسایی گردد، دستگاه AKLIDES با بکارگیری تکنیکهای آنالیز بسیار پیشرفته توانسته است استاندارد قابل قبولی برای AAbها و MIAها ارائه نماید. این MIAها از ترکیب پلیمتیل متاکریلات کربوکسیل با غلظت و اندازههای متفاوت از رنگهای فلورسنت چندگانه استفاده میکنند. هر یک از جمعیتهای موردنظر با استفاده از پیوندهای کوالان با آنتیژن اختصاصی نشاندار شدهاند و بیدهای مختلف موردنظر در 96 چاهک فیکس شدهاند. با معلق کردن هر بید درون یک چاهک میتوان سنجش مالتیپلکس را انجام داد. AAbها با کمک آنتیبادی IgG انسانی که با فلوروفور نشانگذاری شده، میتوانند تشخیص داده شوند. طبقهبندی و اندازهگیری جمعیت بیدها بهوسیله سنجش شدت فلورسانس مرتبط با لیگاند موردنظر بهآسانی میتواند توسط دستگاه AKLIDES انجام گیرد.
- سنجش مالتیپلکس ANA
Grossmann و همکاران وی یک MIA مالتیپلکس را برای تشخیص شش AAb آنتینوکلئار مختلف ارزیابی و سنجش کردند. در مجموع، از 72 نمونه سرم ارزیابیشده توسط دستگاه AKLIDES، خوانش دستگاه و دقت عکسبرداری و پاسخهای دستگاه در مقایسه با MIA و ELISA بسیار مطلوب بود.
- سنجش مالتیپلکس ANCA
بهمنظور ارزیابی آنتیبادیهای اختصاصی برای تشخیص سرولوژیک AASV بهعنوان یک MIA مالتیپلکس، جهت تشخیص AAbهای ضد MPO، PR3 و مناطق غیرکلاژنی متعلق به سابیونیت کلاژن نوع 4 (GBM)، دستگاه AKLIDES، پلتفرم تشخیص دقیقی را ارائه کرده است. یک MIA بر روی 265 نمونه سرم بیماران با بیماریهای خودایمن مختلف انجام پذیرفته که در آن کیفیت و دقت بررسی روش IF و ELISA با یکدیگر مقایسه شده است. در مقایسه با یافتههای MIA روش ELISA، دستگاه AKLIDES کیفیت بسیار عالی را در تشخیص نمونههای دارای آنتیبادی اختصاصی بیماریهای موردنظر به نمایش گذاشته است.
تشخیص شکستگیهای دورشتهای بهواسطه تست اتوماتیک IF
قابلیت پردازش تصویر و تشخیص الگوریتم مرتبط با الگوهای فلورسانس در دستگاه AKLIDES، یک پلتفرم کامل و قابل اطمینان را برای تشخیص آنتیبادیها بهواسطه روش IF به ارمغان آورده است. بعلاوه روشهای یادشده، توانایی اندازهگیری dsDNA برای DSB این دستگاه را تبدیل به یک ابزار ایدهآل جهت شناسایی بسیاری از ناهنجاریها در سطح DNA کرده است. پس از به جود آمدن DSB، تعداد زیادی از مولکولهای H2AX در مجاورت DSB در سرین 139 شروع به فسفوریله شدن میکنند (γH2AX) که منجر به پدیدار شدن کمپلکسی از مولکولهای متفاوت جهت تعمیر و بازسازی کروماتین میشود. تعداد کانونهای فلوروسنت بهوسیله رنگآمیزی ضد γH2AX برای این کمپلکسهای اختصاصی میتواند تعداد DSB را نشان دهد. نکته دیگری که در این حوزه حائز اهمیت میباشد، اندازهگیری کانونهای فلورسنت مرتبط با γH2AX بهوسیله میکروسکوپ فلورسنت و دستگاه AKLIDES است. در مطالعهای به بررسی وجود γH2AX در 100 هسته سلول پرداخته شده است. نتیجه این مطالعه بهوضوح بیانگر این نکته میباشد که بررسی این تعداد هسته در زیر میکروسکوپ بسیار زمانبر و بهشدت تحت تأثیر خطا و کیفیت حرفهای فرد متخصص میباشد، این در حالی است که دستگاه AKLIDES بهصورت تمام اتوماتیک میتواند تمام کانونهای یادشده را بهآسانی و با هزینه و زمان کمتر بهراحتی با کیفیت بسیار بالا بررسی کند. در این مطالعه جامع که در سه مرکز تشخیصی بر روی تشخیص و تفسیر نتایج مرتبط به تست γH2AX انجام شد، نتایج جالبتوجهی منتشر گردید. حدود 39 درصد تفاوت تشخیص در بین هر سه مرکز در بیان نتایج وجود داشته، حال آنکه کارکرد دستگاه AKLIDES در تشخیص کانونهای دارای γH2AX در مقایسه با مجموع تشخیصهای صحیح هر سه مرکز بسیار منحصربهفرد و دقیق بود.
بحث و نتیجهگیری
بررسی AAbها یکی از قدمهای بسیار مهم در تشخیص سرلوژیک بیماریهای خودایمن بهخصوص SARD میباشد. درواقع یکی از تکنیکهای اولیه در دسترس برای تشخیص ANA که امروزه در آزمایشگاههای روتین هنوز برای سلولهای HEp-2 به کار میرود، استفاده از IF برای اسکرینیگ مارکر است، اگرچه تکنیک IF با توجه به زمانبر بودن، متکی بودن بر تشخیص فرد متبحر، نداشتن اتوماسیون کافی و استانداردسازی ضعیف یکی از مشکلات آزمایشگاههای تخصصی میباشد. بعلاوه، عدم اطمینان در تشریح و دستهبندی الگوهای رنگآمیزی شده در روش بصری سبب کم شدن کیفیت و در نتیجه از بین رفتن تلاشها به جهت استانداردسازی میگردد. برای پاسخگویی به نیاز روزافزون انجام تستهای ANA برای SARD، روشهای نوینی بر پایه ایمونواسی فاز جامد شکل گرفت که از جمله آن میتوان به تکنیک روتین ELISA اشاره نمود. بههرحال تست ANA با روش IF به دلیل حساسیت بالا هنوز بهعنوان گلد استاندارد تشخیصی توصیه میگردد. بهکارگیری تعداد کم اتوآنتیژن برای ANA ELISA و یا ANA multiplex assays، سبب حدود 35 درصد نتایج منفی کاذب نسبت به تکنیک ANA IF بر روی سلولهای HEp-2 شده است.
جهت تشخیص استاندارد و اتوماتیک ANA در سلولهای HEp-2، پلتفرمهای تجاری مختلفی بوجود آمده است و مطالعات تشخیصی، همخوانی نتایج دستگاه AKLIDES نسبت به روش بصری بهواسطه فرد متخصص را تأئید کرده است؛ بهخصوص پیشرفت در تفسیر اتوماتیک الگوهای سابسلولار و تشخیص مکان دقیق و نیز یافتن الگوریتمهای جدید برای تکنیک IF باعث رشد بسیار چشمگیر محصولات تجاری مانند AKLIDES شده است.
اخیراً مطالعات متعددی در مورد عملکرد اولین سیستم کاملاً خودکار AKLIDES منتشر شده است. پلتفرم پیشرفته این دستگاه ترکیبی از تشخیص الگو و پردازش خودکار تصاویر میباشد که کارآییهای بیبدیل این دستگاه، ابزاری چندزبانه برای اهداف تشخیصی- درمانی فراهم آورده است که قادر به تجزیه و تحلیل انواع مختلفی از آزمایشات فلورسانس مبتنی بر بید و سلول است. دادههای گزارششده نشاندهنده تطابق بالا بین تفسیر دستی و اتوماتیک مرتبط بر تست سلولی IF برای ارزیابی ANA ,ANCA و Anti dsDNA میباشد که نهتنها از نظر تمایز نتایج منفی و مثبت بلکه شناسایی الگوهای فلورسانس نشاندهنده همبستگی بین روش بصری و خوانش با تکنیک IF است. اگرچه تعداد الگوهای شناختهشده و بررسی دقت تشخیص هنوز نیازمند بهبود قابلتوجهی میباشد، تفسیر اتوماتیک سنجش مبتنی بر سلول IF بهوسیله دستگاه AKLIDES میتواند در آزمایشگاههای تشخیصی بیماریهای خودایمن در جهت اسکرینینگ تشخیصی روتین بخصوص برای حذف نمونههای منفی بکار گرفته شود. بااینحال نتایج مثبت دستگاه همیشه باید توسط یک متخصص تأئید گردد.
بیشتر آزمایشگاههای ایمونولوژی بالینی برای تست ANA به شیوه دومرحلهای عمل میکنند که با یک اسکرینینگ اولیه سلولهایHEp-2 آغاز میگردد و در ادامه تستهای تأییدی اعمال میگردد. گسترش سیستمهای AKLIDES برای ارزیابی MIA یک پلتفرم منحصربهفرد را ایجاد نموده است که برای اولین بار اجازه میدهد تا بهصورت کامل ارزیابی اسکرینینگ مبتنی بر سلول و سنجش مالتیپلکس اختصاصی مرتبط با گسترهای از آنتیژنهای اختصاصی مختلف در یک سیستم انجام گردد. تشخیص SARD چندگانه مرتبط با AAb بهصورت همزمان در یک آزمایش نشان داده است که برای تستهای چندگانه ANA، روش اتوماتیک IF بهتر از تکنیک معمول ELISA است. با توجه بررسیهای انجام شده بر روی اتوآنتیژنها، مطالعات نشاندهنده تطابق رضایتبخش نتایج بدست آمده از تستهای تشخیصی ANA و ANCA هستند، بنابراین انجام تستهای مالتیپلکس با دستگاه AKLIDES اساس پروفایلینگ آنتیبادیها را بهعنوان رویکردی کارآمد و امیدوارکننده در سرولوژی بیماریهای خودایمن فراهم میکند.
از جمله کارآییهای منحصربهفرد دستگاه AKLIDES، تشخیص سرولوژیک بیماریهای سیلیاک شامل آنتیبادیهای بسیار اختصاصی علیه ترانس گلوتامیناز 2 (Tissue Trance Glutamines, tTG) و گلیادین دیآمید شده (di-Amid Gliadin,DG) میباشند. اسکرینینگ این تست بهواسطه بافت مری میمون به روش Endomysial Antibody (EMA) انجام میپذیرد.
تکنولوژی دیجیتال خوانش عکس فلورسانس و تشخیص الگوها بهصورت اتوماتیک میتواند همپایه سنجشهای دیگر IF مبتنی بر سلول واقع شود. تکنیکهای مختلف IF مبتنی بر سلول برای ارزیابی کانونهای γH2AX بسیار زمانبر است و بستگی به تبحر و خطای فرد دارد؛ همچنین برای اسکرینینگ تشخیصی با ویژگیهای کنونی که دارد مناسب نیست. علاوه بر رضایت عملکرد در ارتباط با ارزیابی آنتیبادیهای مرتبط با SARD، سیستم AKLIDES نتایج قانعکنندهای را برای سنجش اتوماتیک کانونهای γH2AX نشان داده است.
نیاز برای استانداردسازی تشخیص آنتیبادیهای SARD و نیز ارزیابی کانونهایγH2AX امروزه بیشتر از قبل احساس میگردد. تکنولوژی AKLIDES میتواند به بهبود تشخیص تنوع الگوهای جدید بیماری هم در داخل آزمایشگاه و هم بین آزمایشگاههای تشخیص بیماریهای اتوایمیون کمک نماید، بهعلاوه تجزیه و تحلیل هزینه برای تعداد قابلتوجهی از نمونهها در آزمایشگاههای روتین ممکن است تأئیدکننده نیاز مبرم متخصصان این حوزه برای تشخیص بهتر، سریعتر و دقیقتر باشد. با توجه به بررسی تستهای تخصصی که بهواسطه دستگاه AKLIDES Cell Damage در مرکز نوبل مشاهده شد، کیفیت و دقت خوانش و تفسیر این دستگاه بسیار عالی بوده و فیلدهایی شفاف و با جزئیات بسیار عالی در زمان بسیار کوتاه ارائه مینماید که خود مؤید مطالعات گذشته و نظرات اعلام شده در این مقاله میباشد. عقیده ما این است که استانداردسازی در نظام سلامت ملی بهخصوص با توجه به ظهور بسیار زیاد و روزافزون بیماریهای خودایمن و نداشتن یک مرکز رفرانس در کشورمان که نتیجتاً سبب نداشتن نتایج واحد در مراکز مختلف برای نمونههای ارجاعی میگردد، بسیار ضروری به نظر میرسد. امید است که بتوان در آیندهای نزدیک شاهد کیفیت بسیار عالی و رضایتبخش ارائه خدمات تشخیصی- آزمایشگاهی باشیم.
منابع:
- Melegari, C. Bonaguri, A. Russo, B. Luisita, T. Trenti,and G. Lippi, “A comparative study on the reliability of anautomated system for the evaluation of cell-based indirectimmunofluorescence,”Autoimmunity Reviews, vol. 11, no. 10,pp. 713–716, 2012.
- S. Wiik, M. Høier-Madsen, J. Forslid, P. Charles, andJ. Meyrowitsch, “Antinuclear antibodies: A contemporarynomenclature using HEp-2 cells,” Journal of Autoimmunity,vol. 35, no. 3, pp. 276–290, 2010.
- Wiik, P. Charles, and J. Meyrowitsch, “Multi-centre collaborationis needed to reach a unified and strictly definedclassification of IIF ANA patterns,” in From Prediction to Preventionof Autoimmune Disease, K. Conrad, E. K. L. Chan, M.J. Fritzler, R. L. Humbel, P. L. Meroni, and Y. Shoenfeld, Eds.,pp. 634–646, Pabst Science Publishers, Lengerich, Germany,7th edition, 2011.
- Sinclair, M. Saas, D. Williams, M. Hart, and R. Goswami,“Can an ELISA replace immunofluorescence for the detectionof anti-nuclear antibodies?—The routine use of anti-nuclearantibody screening ELISAs,” Clinical Laboratory, vol. 53, no.3-4, pp. 183–191, 2007.
- Glory and R. F. Murphy, “Automated subcellular locationdetermination and high-throughput microscopy,” DevelopmentalCell, vol. 12, no. 1, pp. 7–16, 2007.
- Knuetter, R. Hiemann, T. Brumma et al., “Performanceof the automated immunofluorescence system AKLIDES fordetection of antineutrophil cytoplasmic antibodies,” in FromPrediction to Prevention of Autoimmune Disease, K. Conrad,E. K. L. Chan, M. J. Fritzler, R. L. Humbel, P. L. Meroni,and Y. Shoenfeld, Eds., pp. 685–686, Pabst Science Publishers,Lengerich, Germany, 2011.
- Egerer, D. Roggenbuck, R. Hiemann et al., “Automated evaluation of autoantibodies on human epithelial-2 cells as an approach to standardize cell-based immunofluorescence tests,” Arthritis Research and Therapy, vol. 12, no. 2, article R40, 2010.
- Egerer, D. Roggenbuck, R. Hiemann et al., “Automatedevaluation of autoantibodies on human epithelial-2 cells asan approach to standardize cell-based immunofluorescencetests,” Arthritis Research and Therapy, vol. 12, no. 2, article R40,2010.
- Grossmann, D. Roggenbuck, C. Schr¨oder, K. Conrad,P. Schierack, and U. Sack, “Multiplex assessment of nonorgan-specific autoantibodies with a novel microbead-basedimmunoassay,” Cytometry A, vol. 79, no. 2, pp. 118–125, 2011.
- Huang and R. F. Murphy, “From quantitative microscopyto automated image understanding,” Journal of BiomedicalOptics, vol. 9, no. 5, pp. 893–912, 2004.
- Fenger, A. Wiik, M. Høier-Madsen et al., “Detectionof antinuclear antibodies by solid-phase immunoassays andimmunofluorescence analysis,” Clinical Chemistry, vol. 50, no.11, pp. 2141–2147, 2004.
- Runge, R. Hiemann, M. Wendisch et al., “Fully automated interpretation of ionizing radiation-induced gammaH2AX foci by the novel pattern recognition system AKLIDES(R),” International Journal Radiation Biologie, vol. 88, no. 5, pp. 439–447, 2012.
- Runge, R. Hiemann, M. Wendisch et al., “Fully automatedinterpretation of ionizing radiation-induced gammaH2AXfoci by the novel pattern recognition system AKLIDES(R),”International Journal Radiation Biologie, vol. 88, no. 5, pp.439–447, 2012.
- Kivity, B. Gilburd, N. Agmon-Levin et al., “A novelautomated indirect immunofluorescence autoantibody evaluation,”Clinical Rheumatology, vol. 31, no. 3, pp. 503–509,2012.
- Hu and R. F. Murphy, “Automated interpretation ofsubcellular patterns from immunofluorescence microscopy,”Journal of Immunological Methods, vol. 290, no. 1-2, pp. 93–105, 2004.
روشهای عملی در Time PCR – Real قسمت6
گایدلاینهای موقت IFCC در مورد پایش بیوشیمیایی و هماتولوژیکال بیماران COVID-19
برتری نسبی تست آنتیبادی IgG-IgM به rRT-PCR برای تشخیص عفونت SARS-CoV-2
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام