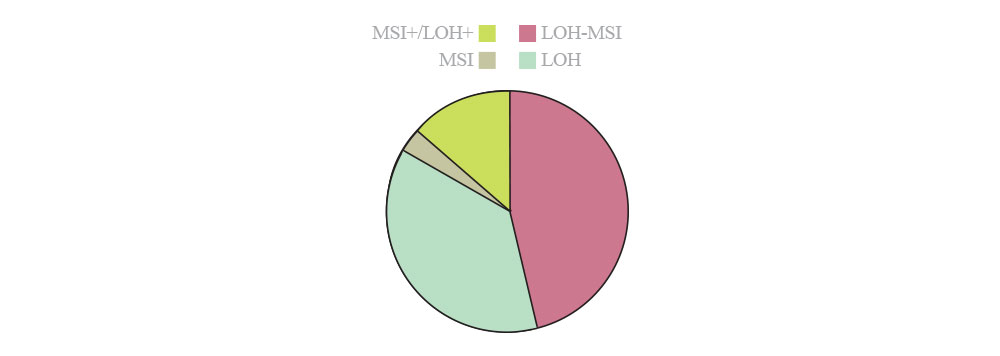اپیژنتیک و سرطان؛
افقهای جدید در رویکردهای درمانی و تشخیصی در آزمایشگاه
(بخش اول)
سید آرمان مهدوی1
1 دانشجوی کارشناسی ارشد بیوتکنولوژی پزشکی، مرکز تحقیقات بیولوژی مولکولی، دانشگاه علوم پزشکی بقیها…(عج)، تهران، ایران (نویسنده مسئول)
چکیده:
مقدمه: اپیژنتیک به معنای مطالعه تغییراتی در بیان یک ژن است که قابل توارث بوده و برعکس جهشهای ژنتیکی قابل برگشت هستند. در این زمینه انواع مطالعات انجامگرفته نشانگر نقش اساسی و مهم این موضوع در تنطیم بیان ژن و استفاده کاربردی از آن در درمان بیماریهای مرتبط نظیر سرطان است، از این رو با توجه به پیشرفتهای چشمگیر انجامشده در زمینه مطالعات وراثت و ژنتیک در جهت درمان بیماریهای مرتبط، بر آن شدیم تا با جمعآوری جدیدترین دستاوردهای علمی و مطالعات انجامشده به شکل نظاممند، ساختارهای ایجاد و بررسی برهمکنش آنها با محیط و همچنین چشمانداز آینده اپیژنتیک را جهت استفاده محققان و پژوهشگران داخلی ارزیابی کنیم.
مواد و روشها: این مطالعه به شکل نظاممند و سیستماتیک بوده و با جستجوی کلیدواژههای تعیینشده به جمعآوری مطالب پرداخته است.
یافتهها: امروزه مشخص شده است اهمیت علم اپیژنتیک و مطالعه آن از جهات مختلفی در بدست آمدن نتایج مطلوب در پیشگیری و درمان سرطانهای مختلف غیرقابل چشمپوشی است، همچنین با نگاه دقیق به مکانیسمهای اثر و یافتن اختلالها و برهمکنش آنها میتوان از ایجاد جهشهای نامطلوب جلوگیری نمود.
بحث و نتیجهگیری: با توجه به حجم مطالعات آیندهنگر انجامشده و مطالعه آنها در پایگاههای داده میتوان نتیجه گرفت اپیژنتیک همچون کوه یخ در برابر ما قرار گرفته که جنبههای پنهان و کشفنشده آن بسیار بیشتر از دادههای بدست آمده است، از این رو همواره نیاز به کاوش و بررسی مطالعاتی بیشتری احساس میشود.
کلمات کلیدی: اپیژنتیک، سرطان، درمانهای اپیژنتیک
مقدمه و تاریخچه:
در زبان یونانی اپی به معنای بالا یا فراتر است؛ توصیف اپیژنتیک شامل کلیه فرآیندهایی میشود که فراتر از سکانس ژنی یک فرد قابلردیابی است و شامل متیلاسیون DNA، آرایش هیستونها و تغییر در وضعیت قرارگیری نوکلوزومها میشود. بهطور خلاصه تغییر در فنوتیپ بدون تغییر در ژنوتیپ است که بهنوبه خود بر روی خواندن ژنها تأثیر میگذارد. تغييرات اپيژنتیک میتواند با عوامل متعددي همچون سن، محيط و سبک زندگي و وضعيت بيماري نيز تحت تأثیر قرار گيرد. عملکرد اپیژنتیک سلولها در جنین بهطور معمول میتواند به نحوي باشد که سلولها به شکل مؤثری تمایز داده شوند تا بهعنوان سلولهاي پوستي، سلولهاي کبدي، سلولهاي مغزي و غيره عملکرد خاص خودشان را داشته باشند. تغييرات اپيژنتيک میتواند اثرات مضرتري داشته باشد که میتواند منجر به بیماریهایی نظير سرطان شود. در حال حاضر حداقل سه سیستم از جمله متیلاسیون DNA، اصلاح هیستون و خاموش کردن ژن وابسته به RNA غیراختصاصی (ncRNA) در نظر گرفته میشود که تغییرات اپیژنتیکی را آغاز و حفظ کند. تحقیقات جدید و در حال انجام بهطور مداوم نقش اپیژنتیک در انواع اختلالات انسانی را کشف میکنند (1).
نخستین بار C.H Wdington جنینشناس انگلیسی در توصیف ژنهای غیروراثتی این اصطلاح را تعریف کرد، اما در آن زمان ماهیت فیزیکی ژنها و نقش آنها در وراثت شناخته نمیشد. او بهعنوان یک مدل مفهومی از اینکه چگونه اجزای ژنتیک ممکن است با محیطشان در ایجاد فنوتیپ ارتباط برقرار کنند از عبارت «چشمانداز اپی ژنتیک» بهعنوان یک استعاره برای توسعه بیولوژیکی استفاده کرد (2).
در ادامه Robin holliday اپیژنتیک را «مطالعه مکانیزم کنترل زمان و مکان فیزیکی فعالیت ژن» نامیده است؛ بنابراین از نظر گسترده بودن از اپیژنتیک میتوان برای توصیف چیزی غیر از توالی DNA که تأثیراتی وسیع بر توسعه یک ارگانیسم دارد، نام برد.
در حال حاضر، متیلاسیون DNA یکی از گستردهترین تغییرات شناختهشده اپیژنتیکی است که به مطالعات انجامشده توسط گریفیت و ملر در سال 1969 انجامید که نشان میدهد متیلاسیون DNA ممکن است در عملکرد حافظه بلندمدت مهم باشد. سایر تغییرات عمده نیز شامل تغییرات کروماتین، تغییرات هیستون و مکانیسمهای غیراختصاصی RNA دریچه جدیدی را به روی مطالعات مربوطه باز کردهاند (3)، اما علاقه جدید و پیشرفتهای چشمگیر مطالعاتی در مبحث اپیژنتیک بعد از یافتههای Sequencing و پروژه ژنوم انسان در قرن حاضر ایجاد شده که منجر به یافتههای جدید در مورد ارتباط بین تغییرات اپیژنتیک میزبان و اختلالات از جمله سرطانهای مختلف، اختلالات مربوط به عقبماندگی ذهنی، اختلالات ایمنی، اختلالات روانپزشکی و اختلالات اطفال گردیده است (4).
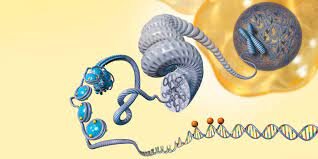
شکل 1: مکانیزمهای اپیژنتیک که به تنظیم فعالیت ژن کمک میکند
https://www.genengnews.com/topics/omics/evidence-of-epigenetic-role-in-breast-cancer/
در مطالعات نشان داده شده است که هم محیط و هم شیوه زندگی فرد میتوانند بهطور مستقیم با ژنوم ارتباط برقرار کنند تا تغییرات اپیژنتیکی را تحت تأثیر قرار دهند. این تغییرات ممکن است در مراحل مختلف در طول یک زندگی شخصی و حتی در نسلهای بعد منعکس شوند؛ بهطور مثال مادرانی که تحت تأثیر قحطی در هلند بین سالهای 1944 تا 1945 قرار داشتهاند فرزندان آنها دچار بیماریهای قلبی-عروقی بیشتری در مقایسه با جمعیتهای مشابه شدهاند (3).
مواد و روشها:
این مطالعه به شکل نظاممند و سیستماتیک بوده و با جستجوی کلیدواژههای تعیینشده در پایگاههای اطلاعاتی به جمعآوری مطالب پرداخته است.
یافتهها:
اپیژنتیک مکانیسم را برای توضیح توسعه سرطان فراهم میکند. تغييرات در تشخيص اپيژنتیک ممکن است بينش مهمي را در علت و علل طبيعي سرطان ارائه دهد. از آنجایی که چندین تغییرات اپیژنتیکی قبل از تغییرات هیستوپاتولوژی اتفاق میافتد، میتوانند بهعنوان نشانگرهای زیستی برای تشخیص سرطان و ارزیابی ریسک کمک کنند. بسیاری از سرطانها ممکن است تا مراحل نسبتاً دیرپای بدون علامت باشند. در مدیریت بیماری، تلاشها باید بر روی تشخیص زودرس، پیشبینی دقیق پیشرفت بیماری و نظارت مکرر متمرکز شود.
بر اساس اطلاعات اپیژنومیک، مشخص شده است که نشانگرهای زیستشناختی میتوانند بهعنوان ابزار تشخیصی عمل کنند. بعضی از این شاخصهای زیستی همچنین ممکن است در شناسایی افرادی که به درمان پاسخ خواهند داد و برای مدت طولانی زنده خواهند ماند، کمک کنند. اهمیت اعتبار سنجی تحلیلی و بالینی بیومارکرها، همراه با چالشها و فرصتها در این زمینه مورد بحث قرار گرفته است (5).
ژنتیک سرطان
سرطان یک بیماری ژنتیکی است که دو علت سلولی و ملکولی باعث به وجود آمدن آن میشوند (تقسیم غیرکنترلشده سلولی– اختلال در مرگ برنامهریزیشده).
نمودار 1: سرطان اولین بیماری انسانی است که با اپیژنتیک مرتبط بود. مطالعات انجامشده توسط Feinberg و Vogelstein در سال 1983 با استفاده از بافتهای اولیه تومور انسان نشان داد که ژن سلولهای سرطانی کولورکتال بهطور قابلتوجهی در مقایسه با بافتهای طبیعی دچار هیپومتیلاسیون شده است
https://www.abcam.com/epigenetics/epigenetics-in-cancer
مدلهای سرطان
مدل دو ضربهای توسط نادسون مطرح شد (رتینوبلاستوما) ولی اکثر سرطانها را نمیتوان با آن توجیه کرد و مدل چند ضربهای که توصیف چندین جهش را در ایجاد سرطان توضیح میدهد (6).
مطالعات اپیدمیولوژیک سرطان نشان داده که اگر فردی بهطور مثال از مکانی که شیوع یک نوع سرطان خاص مثلاً سرطان سینه در آنجا پایین است به محلی مهاجرت کند که شیوع آن سرطان خاص در آنجا بالا باشد، ریسک ابتلای فرد بالا میرود که نشاندهنده نقش محیط در ایجاد آن است اما در بعضی از سرطانها مثل سرطان معده این اتفاق را شاهد نیستیم (7).
ژنهای دخیل در ایجاد سرطان
گروه اول شامل انکوژنها است. این ژنها از جهش ژنهای پروتوانکوژن که نقش تنطیمی در چرخه تقسیم سلولی دارند ایجاد میشوند. این ژنها سرعت تقسیم سلولها را کنترل میکنند و اگر این ژنها جهش یابند سرعت تقسیم سلولها بدون کنترل پیش خواهد رفت.
گروه دوم شامل انواع ژنهای سرکوبکننده تومور یا Tumor Suppressor Genes است که از تکثیر بیقیدوبند سلولها جلوگیری میکنند. این ژنها الگوی رفتاری و وراثتی مغلوب دارند، درحالیکه انکوژنها الگوی رفتاری مغلوب دارند.
گروه سوم شامل دستهای از ژنهای محافظ هستند که از تمامیت ژنوم محافظت میکنند و شامل آنزیمهای ترمیمکننده جهش میباشند.
تغییرات اپیژنتیک و مکانیسمها:
این تغییرات را میتوان به سه دسته تقسیم کرد که شامل متیلاسیون DNA؛ تغییرات هیستونها (Histones Modification) و وضعیت قرارگیری نوکلئوزوم (Nucleosome Positioning) است (7).
هیپومتیلاسیونDNA میتواند انکوژنها را فعال کند و بیثباتی کروموزوم را آغاز کند، درحالیکه هیپرمتیلاسیون DNA باعث خاموش شدن ژنهای سرکوبکننده تومور میشود. تجمع خطاهای ژنتیکی و اپیژنتیکی میتواند یک سلول طبیعی را به سلول تومور مهاجم یا متاستاز تبدیل کند. علاوه بر این، الگوهای متیلاسیون DNA ممکن است بیان غیرعادی ژنهای مرتبط با سرطان را ایجاد کند. الگوهای اصلاح هیستون نیز با سرطانهایی مانند سرطان پروستات، پستان و پانکراس ارتباط دارد. در ادامه، تغییرات اپیژنتیکی میتواند بهعنوان نشانگرهای زیستی برای تشخیص مولکولی سرطان اولیه استفاده شود (5).
متیلاسیون DNA
آنزیم DNA متیل ترانسفراز در این فرایند، یک گروه متیل به موقعیت ۵ حلقه پیریمیدین سیتوزین یا به نیتروژن شماره ۶ حلقه پورین آدنین اضافه میکند. این تغییرات میتوانند از طریق تقسیمات سلولی به ارث برسند (به نسل بعد منتقل شوند) (8).
متیلاسیون DNA نقشی تعیینکننده در رشد و نمو عادی و نیز تمایز سلولی موجودات رده بالا دارد و الگوی بیان ژنها را در سلولها تغییر میدهد، برای مثال سلولهایی که در طی نمو جنینی برنامهریزی شدهاند که هپاتوسیت باشند، در کل زندگی موجود به همان صورت باقی میمانند، بدون وجود هرگونه علامتی که این وظیفه را به آنها یادآوری نماید.
متیلاسیون DNA نوعی تغییر کووالان است که طی آن در ژنوم یک گروه متیل از طریق -S آدنوزیل متیونین به یک سیتوزین متصل میشود. این فرایند طی یک واکنش آنزیمی پس از همانندسازی DNA رخ میدهد. در سلولهای پستانداران، متیلاسیون DNA معمولاً به موقعیت ۵ حلقه پیریمیدین واحدهای سیتوزین که در دینوکلئوتیدهای CpG واقع شدهاند، محدود میشود. گروه متیل در شیار بزرگ، خارج از مارپیچ مضاعف DNA قرار دارد. این گروه در جفت شدن بازها تداخل ایجاد نمیکند، بنابراین ۵- متیل سیتوزین درست مشابه با سیتوزینِ تغییرنیافته با گوانین جفت میشود، اما گروه متیل بهعنوان سیگنالی عمل میکند که توسط پروتئینهای خاص متصلشونده به CpG متیلهشده، تشخیص داده میشود.
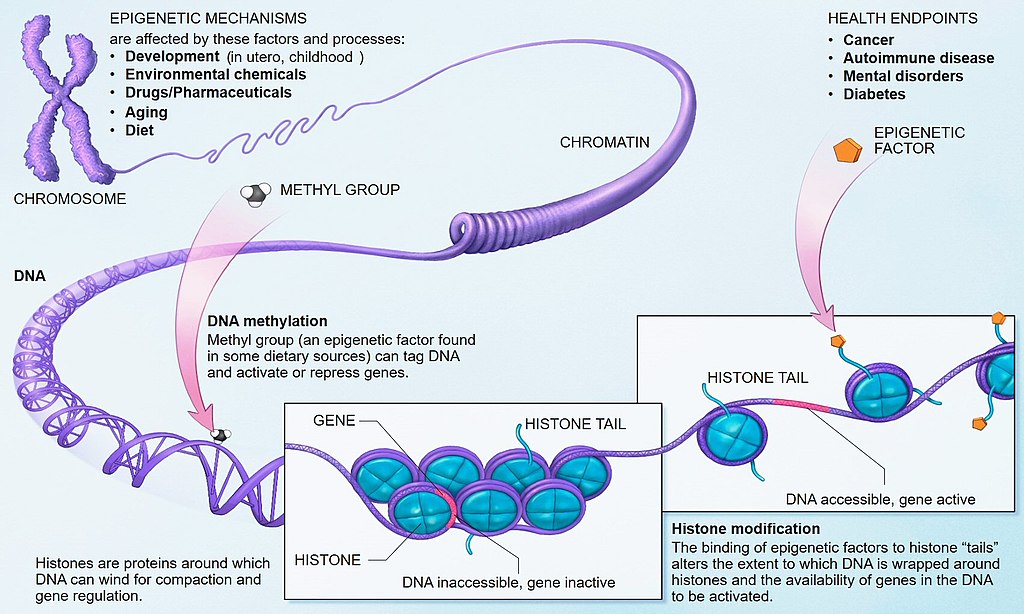
شکل 2: مکانیسم متیلاسیون DNA
https://www.whatisepigenetics.com/fundamentals/
گروههای متیل در تنظیم ساختار کروماتین و بیان ژن ایفای نقش میکنند و در حافظه اپیژنتیک از اهمیت زیادی برخوردارند. دینوکلئوتیدهای CpG به فراوانی در جزایر CpGکه نواحی غنی از جایگاههای CpG هستند، خوشهبندی میشوند. این جزایر به طول Kb 0/5-3بهطور متوسط در هر Kb حدود 100 ژنوم و بهطور متوسط در نیمی از همه ژنهای انسانی یافت میشوند. بهنظر میرسد متیلاسیون سایر CpG ها فاقد عملکردهای زیستی باشد.(6)
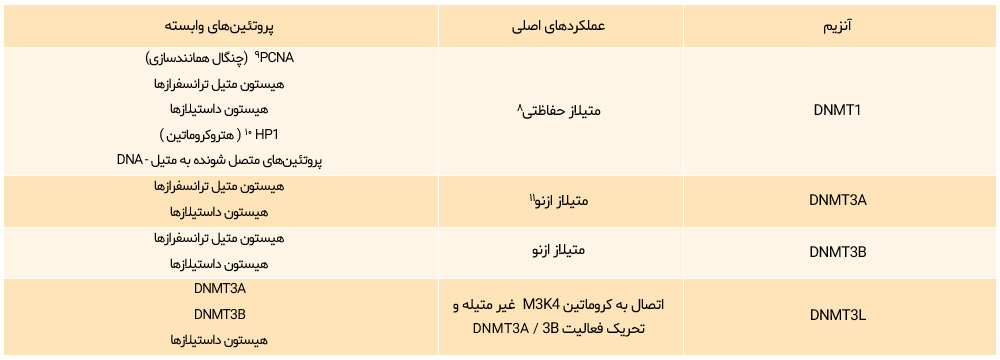
چهار نوع DNA متیل ترانسفراز شامل انواع DNMT1، DNMT3A، DNMT3B و DNMT3L یافت شدهاند (جدول 1)
جدول 1: طبقهبندی DNA متیل ترانسفراز
DNMTها میزان متیلاسیون ژنوم را کنترل میکنند:
DNMT1 برای حفظ متیلاسیون ضروری است و DNMT3A و DNMT3B متیلاسیون از نو را تحقق میبخشند. DNMT3 فعالیت آنزیمی ندارد، اما عملکرد سایر متیل ترانسفرازها را تنظیم میکند.
(مجله زیستشناسی رشد، بهارک بلالایی، متیل CpG ، بیان ژن و سرطان)
نقش متیلاسیون در تنظیم رونویسی
پس از وقوع متیلاسیون، کروموزومها پایدار میشوند و فعالیت آنها کاهش مییابد. متیلاسیون، بیان ژن را با دو مکانیسم جداگانه مهار میکند:
ممانعت مستقیم: در این مکانیسم از رونویسی کروموزوم متیلهشده ممانعت میشود.
ممانعت غیرمستقیم: در این مکانیسم، دو نوع از پروتئینها شامل پروتئینهای وابسته به متیلاسیون (MBDs) و هیستون داستیلازها (HDAC) در سطح کروموزوم به خدمت گرفته میشوند.
پروتئینهای MBD دارای یک دمین متصلشونده به متیل CpG هستند که نواحی متیلهشده DNA را شناسایی میکنند و به آنها متصل میشوند. پس از اتصال MBDها، پروتئینهای دیگری که وابسته به ساختارهای مهارگر هستند، از جمله هیستون داستیلازها، فراخوانی میشوند. انسان دارای پنج نوع پروتئین MBD است شامل 4-MBD1 و MECP2. فقدان عملکرد MECP2 سبب ایجاد سندرم رت میشود (9). این سندرم وضعیت عجیبی است که در آن دختران هتروزیگوت بهطور طبیعی رشد میکنند، اما پس از آن دچار سیر قهقرایی میشوند. ژن رمزکننده MECP2 وابسته به X است و جهشهای آن معمولاً در مردان کشنده است. متیلاسیون DNA در بیماران مبتلا به سندرم رت بهطور عادی ادامه مییابد، اما در نتیجه عدم حضور پروتئین MECP2 در سلولهایی که کروموزوم X عادی را غیرفعال کردهاند، برخی سیگنالها بهدرستی تشخیص داده نمیشوند.
MBDها همچنین میتوانند از نزدیکی فاکتورهای رونویسی و کوفاکتورها ممانعت کنند، در نتیجه این فاکتورها نمیتوانند به راهانداز ژن متصل شوند که نتیجه آن توقف رونویسی است.HDAC نیز در ناحیه DNA متیلهشده به خدمت گرفته میشود که در آنجا ضمن تحت تأثیر قرار دادن فعالیت راهانداز، آمینواسیدهای لیزین، هیستونهای 3 و 4 را داستیله میکنن و در نتیجه، پذیرش پروتئینهای موردنیاز برای شروع رونویسی بلوکه میشود (4). ژنهای دارای پروموترهای غیر متیله با جزایر CpG فعال، در جایگاههای آغاز رونویسی دارای فاکتورهای رونویسی هستند. آغاز نسخهبرداری در چنین شرایطی از طریق عناصر پاییندست متیلهشده و در مواردی پوشیدهشده با پروتئینهای MBD و HDAC امکانپذیر میشود (8).
در مورد ژنهای همیشه خاموش، مانند ژن اثرگذار یا ژن واقع بر کروموزوم Xغیرفعال، پروموتر متیله شده است. نتیجه این فرایند، اتصالMBDها، HDACها و سایر مهارکنندههای رونویسی و متعاقب آن، تراکم کروماتین است، در نتیجه، فاکتورهای رونویسی که بهطور معمول بیان ژن را تنظیم میکنند، قادر به دسترسی به راهانداز ژن نیستند (10).
بهطورکلی، متیلاسیون و داستیلاسیون در پیوند با بیان ژن عمل میکنند، اما متیلاسیون واقعهای متقدم در این فرایند است. با وجود این، تحت برخی شرایط، داستیلاسیون مقدمه وقوع متیلاسیون است.
متیلاسیون چگونه حفظ و القا میشود؟
اگرچه اهمیت متیلاسیون شناخته شده و تحقیقات درباره آن در حال انجام است ولی هنوز بهروشنی علت وقوع متیلاسیونهای غیرعادی را نمیدانیم. از آنجا که متیلاسیون توسطDNMT ها کاتالیز میشود، تغییر در این آنزیمها پیامدهایی خواهد داشت (11).
با حذفDNMT1، سطح متیلاسیون کل ژنوم تا ۳٪ و با حذف DNMT3 تا ۴٪ کاهش مییابد؛ اما با حذف هر دوی این آنزیمها سطح متیلاسیون تا ۹۸٪ کاهش مییابد، بنابراینDNMT ها برای متیلاسیون حائز اهمیتاند ولی فعالیت آنها تحت تأثیر بسیاری از فاکتورها ازجمله پرتوها و دما قرار دارد. از آنجا که سلولهای نزدیک سطح بدن با سهولت بیشتری از محیط پیرامون متأثر میشوند، متیلاسیون سلولهای پوست غالباً از تنظیم خارج میشود، بهعلاوه، آلودگی میتواند به متیلاسیون غیرطبیعی منجر شود. آلودگی با هلیکوباکتر پیلوری در معده که عامل بروز سرطانهاست، با تغییراتی در متیلاسیون DNA همراه است. کشیدن سیگار نیز بهعنوان عامل خطر میتواند در بسیاری از ژنها متیلاسیون را القا کند. مطالعهای نشان داده است که مصرف غذاهای فاقد فولیک اسید به برنامههای پیچیده متیلاسیون منجر میشود و احتمال سرطان را افزایش میدهد .(8)
متیلاسیون DNA و سرطان
الگوهای غیرطبیعی در متیلاسیون DNA عموماً در بسیاری از بیماریها دیده میشوند. خواه بهعنوان نتیجهای از افزایش بیان DNMTیا وقوع هیپرمتیلاسیون در راهاندازهای ویژه سلولهای سرطانی، الگوی چرخه سلولی، آپوپتوزیس و بروز تغییرات در ترمیم DNA، شاهد انحراف در تمایز و اتصالات سلولها هستیم که عموماً مشخصه بیماریهاست (4). گزارش شده است که ۴۸٪ از تومورها حاصل از دست رفتن هتروزیگوسیتی LOH است و این در حالی است که ۱۴٪ از تومورها حاصل ناپایداری میکروساتلایتیMSI) ) هستند و اقلیتی از تومورها (حدود ۳٪) با LOH همپوشانی دارند. حدود یکسوم از تومورها (۳۸٪) نه حاصل MSI و نه LOH هستند (شکل 3).
شکل 3: شاخص نسبت از دست رفتن هتروزیگوتی LOH و نسبت آن با MSI
(مجله زیستشناسی رشد، بهارک بلالایی، متیل CpG، بیان ژن و سرطان)
اگرچه اهمیت متیلاسیون شناخته شده و تحقیقات درباره آن در حال انجام است ولی هنوز بهروشنی علت وقوع متیلاسیونهای غیرعادی را نمیدانیم. هنگام بروز متیلاسیون DNA غیرعادی، رخ دادن چهار حالت محتمل است:
- غیرفعال شدن ترمیم جفت شدن بازی اشتباه
- ناپایداری کروموزومها
- هیپومتیلاسیون ژنهای سرطانی
- هیپرمتیلاسیون ژنهای بازدارنده تومور
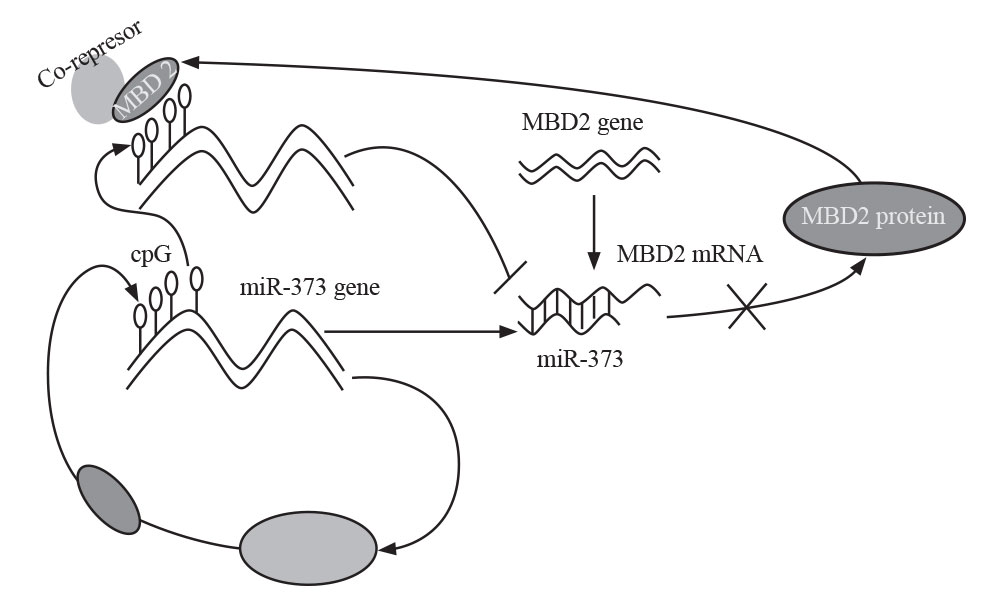
اثرهای متیلاسیون DNA و miRNA در برخی سرطانها از جمله سرطان معده بهطور قابل ملاحظهای مورد مطالعه قرار گرفته است. ژنهای فراوانی که بهطور اختصاصی در سرطان معده متیله میشوند، جزء miRNAها و siRNA ها هستند. سرطان مری نیز از جمله سرطانهایی است که اثر متیلاسیون ژنهای متعددی در بروز آن مورد بررسی قرار گرفته است که از جمله این ژنها میتوان به SST،TAC1 ،Reprimo ، NELL1 و MGMT اشاره کرد. در عین حال، تلاشهای گستردهای در زمینه درک ارتباط بین الگوهای ناهنجار متیلاسیون CpG و نقش آن در رونویسی ژن بهعمل آمده است (9). مطالعات نشان میدهند که 373- miR به لحاظ عملکردی با هدف قرار دادن ’3 UTR، بیان ژن MBD2 را تنظیم میکند (شکل 4).
شکل 4: نحوه تنطیم بیان ژن MBD2 توسط miR-373
(مجله زیستشناسی رشد، بهارک بلالایی، متیل CpG، بیان ژن و سرطان)
ارتباط وقوع، یا خاموشی متیلاسیون برخی miRNA ها نیز با ایجاد سرطان مورد بررسی قرار گرفته است، بهعنوان مثال تحقیقات نشان میدهند که خاموشی متیلاسیون ژنهای miRNAها به انضمام ژنهای کدکننده پروتئین ممکن است به ایجاد یک زمینه نقص برای سرطانهای معده کمک کند (12).
تنظیم کاهشی 212 – miR از طریق ژن هدف آنMECP2 ، ممکن است با سرطان معده در ارتباط باشد. همچنین هیپرمتیلاسیون 124- miR در سرطان معده دیده میشود. miRNA و c miR-34c ، ژنهای بازدارنده تومور جدیدی هستند که در سرطان معده به دنبال هیپرمتیلاسیون خاموش میشوند، همچنین، مشخص شده است که متیلاسیون MiRNA-10b یک نشانگر مولکولی زیستی برای سنجش خطر گسترش سرطان معده است .(10)
در مجموع میتوان گفت از آنجا که انکوژنها و ژنهای بازدارنده تومور میتوانند نقشهایی مهم در سرطان داشته باشند و با توجه به اینکه متیلاسیون میتواند بیان ژن را مهار کند، سطح متیلاسیون ژنهای خاص در سرطان میتواند انعکاسی از این موضوع باشد که ژن مذکور یک انکوژن است یا یک بازدارنده تومور.
منابع:
- Nebbioso A, Tambaro FP, Dell’Aversana C, Altucci L. Cancer epigenetics: Moving forward. PLoS Genet. 2018;14(6):e1007362.
- Noroozi Aghide A, Lashgari N. Epigenetic-Based Cancer Therapy. Paramedical Sciences and Military Health. 2015;10(2):56-68.
- Ushijima T. Cancer epigenetics: now harvesting fruit and seeding for common diseases. Biochem Biophys Res Commun. 2014;455(1-2):1-2.
- Campbell SL, Wellen KE. Metabolic Signaling to the Nucleus in Cancer. Mol Cell. 2018;71(3):398-408.
- Yang X, Gao L, Zhang S. Comparative pan-cancer DNA methylation analysis reveals cancer common and specific patterns. Brief Bioinform. 2017;18(5):761-73.
- Verma M, Rogers S, Divi RL, Schully SD, Nelson S, Joseph Su L, et al. Epigenetic research in cancer epidemiology: trends, opportunities, and challenges. Cancer Epidemiol Biomarkers Prev. 2014;23(2):223-33.
- Wang YP, Lei QY. Metabolic recoding of epigenetics in cancer. Cancer Commun (Lond). 2018;38(1):25.
- Lao VV, Grady WM. Epigenetics and colorectal cancer. Nat Rev Gastroenterol Hepatol. 2011;8(12):686-700.
- Kim J, Kim WH, Byeon SJ, Lee BL, Kim MA. Epigenetic Downregulation and Growth Inhibition of IGFBP7 in Gastric Cancer. Asian Pac J Cancer Prev. 2018;19(3):667-75.
- Chakravarthi BV, Nepal S, Varambally S. Genomic and Epigenomic Alterations in Cancer. Am J Pathol. 2016;186(7):1724-35.
- Burgess DJ. Epigenetics: Separate paths for epigenomes and genomes in cancer evolution? Nat Rev Genet. 2016;17(8):438.
- Banaudha KK, Verma M. Epigenetic biomarkers in liver cancer. Methods Mol Biol. 2015;1238:65-76.
پانل لوکمی لنفوبلاستیک حاد کودکان (ALL) بوسیله تکنیک FISH
نقش ژنها در شخصیت و روان انسان
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام