بررسی بیوسنتز و اختلالات ناشی از متابولیسم هم (Heme)
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروبشناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
اهمیت زیست پزشکی پورفیرینها:
شناخت بیوشیمی پورفیرینها و هم (Heme)، مبنای درک اعمال گوناگون هموپروتئینها در بدن میباشد. بر اثر اختلالات مسیر ساخت پورفیرینهای مختلف، پورفیریها (Porphyria) که نسبتاً نادر هستند، ایجاد میشوند. بر اثر افزایش بیلیروبین پلاسما، یرقان (Jaundice) ایجاد میشود که اختلال بالینی شایعتری است. افزایش بیلیروبین پلاسما به دلیل تولید زیاد و یا ناتوانی در دفع آن به وجود میآید.
نقش پورفیرینها و هموپروتئینها:
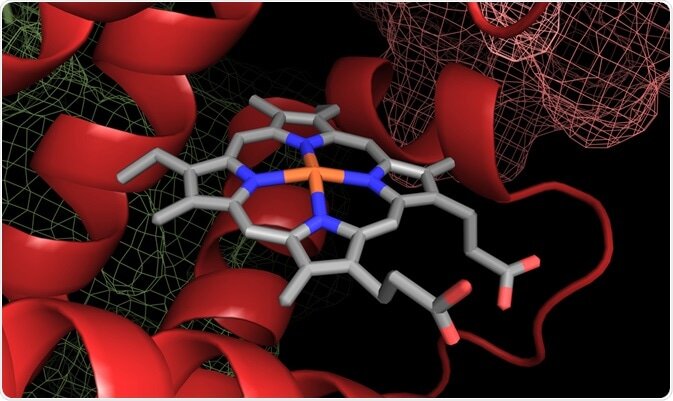
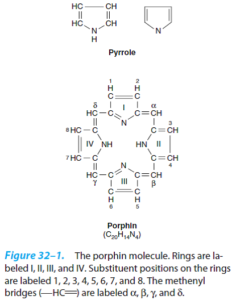
پورفیرینها، ترکیباتی حلقوی هستند که با اتصال 4 حلقه پیرولی از طریق پلهای متنیل ساخته میشوند.
پورفیرینها با یونهای فلزی متصل به اتم نیتروژن حلقههای پیرولی، کمپلکس میسازند. هموگلوبین یک پورفیرین آهندار و کلروفیل یک پورفیرین منیزیومدار است. پروتئینهای همدار (Heme)، (هموپروتئینها) توزیع گستردهای در طبیعت دارند.
تشکیل پورفیرینها:
پورفیرینهای موجود در طبیعت، به جای 8 اتم هیدروژن موجود در هسته پورفیرین خود، دارای زنجیرههای جانبی هستند.
برای سهولت نمایش این استخلافها، فیشر پیشنهاد یک فرمول خلاصه شده داد که در آن، پلهای متنیل حذف شده و هر حلقه پیرول با 8 موقعیت قابل استخلاف، شمارهگذاری شده است. 0
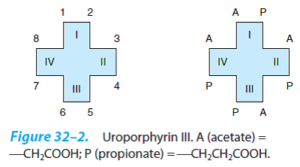
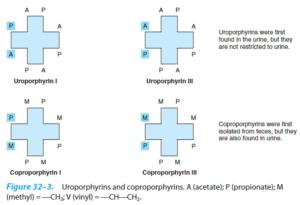
اگر استخلافها ]استات (A)، پروپیونات (P) و متیل (M)[ متقارن باشند، پورفیرین نوع I و چنانچه نامتقارن باشند، پورفیرین نوع III را تشکیل میدهند.
فقط انواع I و III در طبیعت یافت میشوند و نوع III به دلیل وجود در ساختمان هم (Heme)، بسیار فراوانتر و مهمتر میباشد. پروتوپورفیرین IX نیز جزو پورفیرینهای نوع III میباشد. هانس فیشر که از پیشگامان شیمی پورفیرینهاست، آنها را نهمین جزء از سری ایزومرهای فرضی خود در نظر گرفت.
سنتز هم (Heme):
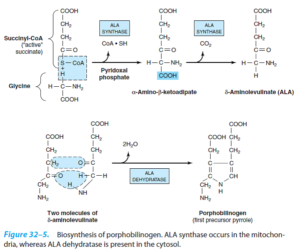
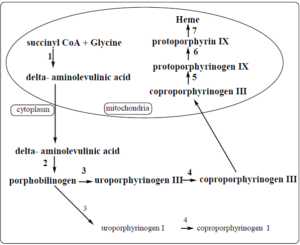
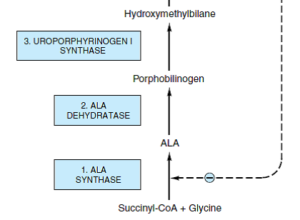
ابتدا سوکسینیلکوآ (مشتق از چرخه کربس) و اسیدآمینه گلایسین با هم واکنش میدهند. این واکنش به پیریدوکسال فسفات برای فعال کردن گلایسین، نیاز دارد. در این واکنش، ابتدا α- آمینو- β- کتوآدیپیک اسید تشکیل میشود که به سرعت دکربوکسیله شده و δ- آمینولوولینات (ALA) را میسازد. این واکنش توسط ALA سنتاز که آنزیم کنترل کننده سرعت سنتز پورفیرین در کبد پستانداران است و در میتوکندریها، کاتالیز میشود.
سپس دو ملکول ALA در سیتوزول توسط ALA دهیدراتاز با یکدیگر کاتالیز شده و دو ملکول آب و یک پورفوبیلینوژن (PBG) را میسازد. ALA دهیدراتاز، یک آنزیم حاوی روی بوده و در مسمومیت با سرب مهار میشود.
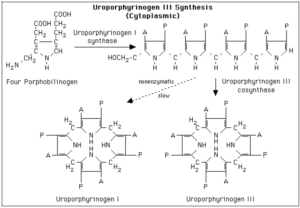
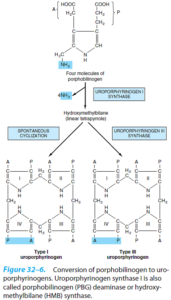
از ترکیب 4 ملکول پورفوبیلینوژن (PBG)، یک تتراپیرول حلقوی، یعنی یک پورفیرین، تشکیل میشود. این 4 ملکول به شکل سر به دم هم قرار گرفته تشکیل یک تتراپیرول خطی به اسم هیدروکسی متیل بیلان (HMB) را میدهند. این واکنش توسط اوروپورفیرینوژن I سنتاز (PBG دآمیناز) (HMB سنتاز) کاتالیز میشود.
هیدروکسی متیلبیلان به طور خودبخودی، حلقوی شده و اوروپورفیرینوژن I را میسازد و یا تحت اثر اوروپورفیرینوژن III سنتاز به اوروپورفیرینوژن III تبدیل میشود. در حالت طبیعی، تقریباً تمامی اوروپورفیرینوژن ساخته شده از نوع III میباشد.
اوروپورفیرینوژنهای I و III، دارای حلقههای پیرولی با اتصال پلهای متیلنی هستند که سیستم حلقوی کنژوگه نمیسازند، لذا این ترکیبات، همچون سایر پورفیرینوژنها، بیرنگ هستند. پورفیرینوژنها در اثر اکسیداسیون به پورفیرینهای رنگی مربوطه خود تبدیل میشوند.
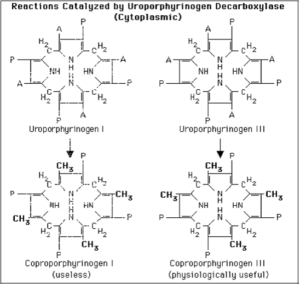
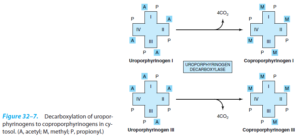
اوروپورفیرینوژن III بر اثر دکربوکسیلاسیون همه گروههای استات (A) و تغییر آنها به گروههای متیل (M) توسط اوروپورفیرینوژن دکربوکسیلاز به کوپروپورفیرینوژن III تبدیل میشود (اوروپورفیرینوژن I را به کوپروپورفیرینوژن I نیز تبدیل میکند).
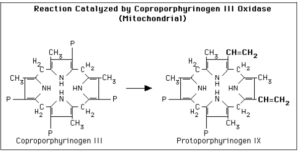
سپس کوپروپورفیرینوژن III وارد میتوکندری شده تا توسط کوپروپورفیرینوژن اکسیداز به پروتوپورفیرینوژن III تبدیل شود. این آنزیم، دو زنجیره جانبی پروپیونیک (P) را دکربوکسیله و اکسیده کرده تا پروتوپورفیرینوژن را بسازد. این آنزیم فقط بر کوپروپورفیرینوژن III اثر میکند.
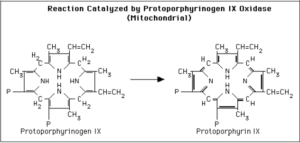
در مرحله بعد، آنزیم میتوکندریایی پروتوپورفیرینوژن اکسیداز، پروتوپورفیرینوژن III (IX) را اکسیده کرده و تولید پروتوپورفیرین III (IX) مینماید.
تبدیل کوپروپورفیرینوژن به پروتوپورفیرین در کبد پستانداران به اکسیژن ملکولی نیاز دارد.
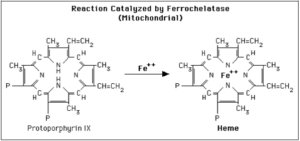
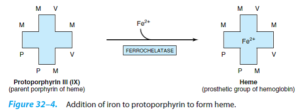
مرحله نهایی سنتز هم (Heme)، وارد کردن آهن فرو در ساختمان پروتوپورفیرین توسط آنزیم میتوکندریایی فروشلاتاز (هم سنتاز) میباشد.
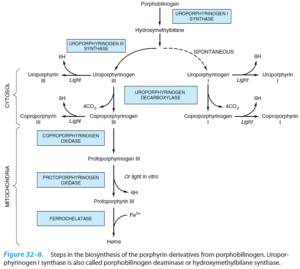
در تصویر زیر، خلاصهای از مراحل ساخت مشتقات پورفیرین از PBG نشان داده شده است.
در تصویر زیر، خلاصهای از مراحل ساخت مشتقات پورفیرین از PBG نشان داده شده است.
آنزیمهای ALA سنتاز و 3 آنزیم آخری این مسیر (کوپروپورفیرینوژن اکسیداز، پروتوپورفیرینوژن اکسیداز و فروشلاتاز)، میتوکندریایی هستند، در حالی که سایر آنزیمها، سیتوزولی هستند.
پورفیرینوژنها بیرنگ بوده و در مقایسه با پورفیرینهای رنگی مربوطه، 6 اتم هیدروژن اضافه دارند. انواع اریتروئیدی و غیر اریتروئیدی ALA سنتاز یافت میشوند. هم (Heme) در اکثر سلولهای پستانداران، بجز گلبولهای قرمز بالغ که فاقد میتوکندری هستند، ساخته میشود. تقریباً 85% هم (Heme) در مغز استخوان و بخش اعظم باقیمانده آن در کبد ساخته میشود.
ALA سنتاز:
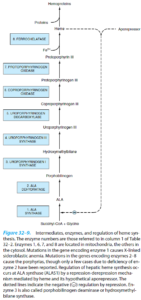
ALA سنتاز به دو شکل کبدی (ALAS1) و اریتروئیدی (ALAS2) وجود دارد. واکنش محدودکننده سرعت در سنتز هم (Heme) در کبد، واکنشی است که کاتالیزور آن، ALAS1 است. هم (Heme) احتمالاً از طریق یک ملکول آپورپرسور، به عنوان تنظیمکننده منفی سنتز ALA سنتاز عمل میکند (تصویر زیر). بنابراین، سرعت سنتز ALAS1 در فقدان هم (Heme) به میزان زیادی افزایش یافته و در حضور هم (Heme)، کاهش مییابد. در حالت عادی، سرعت نوسازی ALAS1 در کبد پستانداران، بالا (نیمه عمری حدود 1 ساعت) بوده، که ویژگی معمول آنزیمهای کاتالیزور واکنشهای محدودکننده سرعت است.
تجویز بسیاری از داروها به انسان باعث افزایش ساخت ALAS1 میگردد. اکثر این داروها توسط یکی از سیستمهای کبدی متابولیزه میشوند که از هموپروتئین خاصی به نام سیتوکروم P450 استفاده میکند. در طی متابولیسم این داروها توسط سیتوکروم P450، مصرف هم (Heme) افزایش یافته و لذا باعث کاهش غلظت هم (Heme) و رفع سرکوب ALAS1 میگردد. تنظیم نوع اریتروئیدی ALAS (ALAS2) با نوع ALAS1 تفاوت دارد؛ به عنوان مثال، ALAS2 توسط داروهای مؤثر بر ALAS1، تحریک نشده و متحمل تنظیم پسنورد توسط هم (Heme) نمیگردد.
| ALAS1 | ALAS2 | |
| محل فعالیت | کبد | اریتروئیدها |
| تنظیم پسنورد توسط هم (Heme) | دارد | ندارد |
| افزایش ساخت در پاسخ به مصرف داروها | تحریک میشود | تحریک نمیشود |
ویژگیهای رنگی و فلوئورسانس بودن پورفیرینها:
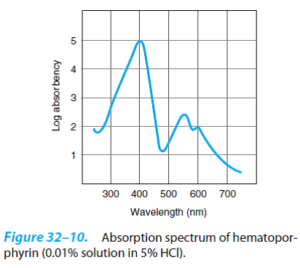
انواع پورفیرینوژنها بیرنگ بوده، در حالی که تمام پورفیرینها رنگی میباشند. طیف جذبی مشخص هر کدام از پورفیرینها و مشتقات آنها در محدوده نور مرئی و فرابنفش، ارزش زیادی در مطالعه آنها دارد. در تصویر زیر، منحنی جذب محلولی از پورفیرین در اسید کلریدریک 5% مشاهده میشود که نوار جذبی ماکزیممی در نزدیک 400 نانومتر دارد که یکی از وجوه تمایز حلقه پورفیرین (صرف نظر از زنجیره جانبی آنها) میباشد. این نوار، به افتخار کاشف آن، نوار سورت (Soret band) نام دارد.
پورفیرینها پس از حل شدن در حلالهای قوی اسیدهای معدنی یا حلالهای آلی، تحت تابش با نور فرابنفش، فلوئورسانس قوی و قرمز رنگ از خود نشان میدهند که از آن، در کشف مقادیر اندک پورفیرینهای آزاد استفاده میکنند. پیوندهای دوگانه واصل حلقههای پیرول پورفیرینها، مسئول جذب و فلوئورسانس مشخص این ترکیبات میباشند. پورفیرینوژنها فاقد این پیوندهای دوگانه هستند.
یکی از کاربردهای جالب خواص فتودینامیک پورفیرینها، استفاده احتمالی از آنها در درمان انواع خاصی از سرطان، موسوم به نوردرمانی سرطان (Cancer phototherapy) میباشد. تومورها غالباً پورفیرینها را بیش از بافتهای طبیعی برمیدارند؛ لذا با تجویز هماتوپورفیرین یا یک ترکیب مشابه دیگر به بیمار دارای تومور مناسب و تابش لیزر آرگون به آن، پورفیرینها برانگیخته شده و اثرات سمی خود را اعمال مینمایند.
آزمایشهای بررسی پورفیرینها:
دفع ادراری کوپروپورفیرینها و اوروپورفیرینها در پورفیریها زیاد میشود. در صورت وجود این ترکیبات در ادرار یا مدفوع میتوان آنها را با استخراج توسط حلالهای مناسب از یکدیگر جدا و با روشهای طیفسنجی نور، شناسایی و اندازهگیری کرد. ALA و PBG ادرار نیز با آزمایشهای مناسب رنگسنجی اندازهگیری میشوند.
پورفیریها:
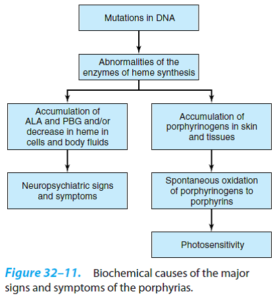
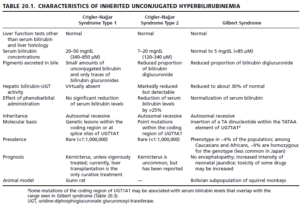
پورفیریها، گروهی از اختلالات مسیر سنتز هم (Heme) هستند که میتوانند ژنتیکی و یا اکتسابی باشند. پورفیریها شایع نبوده، اما در برخی شرایط خاص از قبیل تشخیص افتراقی درد شکم و انواع یافتههای عصبی- روانی، باید مدنظر باشند. حساسیت به نور (Phootosensitivity) (تمایل به انجام فعالیتهای شبانه) و زشتی شدید ظاهری در برخی از مبتلایان به پورفیری اریتروپویتیک مادرزادی، احتمالاً منشأ افسانه آدمهای گرگنما بودهاند.
علل، تشخیص و درمان پورفیریها:
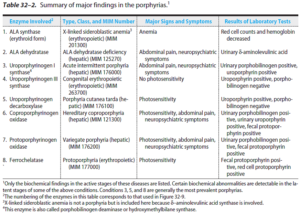
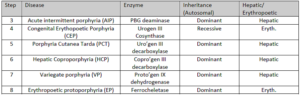
پورفیریها دارای انواع مختلفی بوده که بر اثر کاهش فعالیت برخی از آنزیمهای مسیر سنتز هم (Heme) ایجاد میشوند، بنابراین سنجش فعالیت یک یا چند تا از این آنزیمها با استفاده از یک منبع مناسب (مثلاً گلبولهای قرمز خون) در تشخیص قطعی موارد مشکوک به پورفیری نقش دارد. افرادی که دارای کاهش فعالیت ALAS2 هستند، به آنمی (و نه پورفیری) مبتلا میشوند.
به استثنای پورفیری اریتروپویتیک مادرزادی که الگوی وراثتی مغلوب دارد، سایر پورفیریها به صورت غالب به ارث میرسند.
در برخی موارد، نقص موجود در ژنهای مربوط به سنتز آنزیمهای دخیل در بیوسنتز هم (Heme)، مشخص شده و از این رو، با استفاده از پروبهای ژنی مناسب، امکان تشخیص پیش از تولد برخی از پورفیریها وجود دارد.
علائم و نشانههای بالینی پورفیری، بر اثر کمبود محصولات متابولیک ورای وقفه آنزیمی و یا بر اثر تجمع متابولیتهای پیش از وقفه ایجاد میشوند. چنانچه ضایعه آنزیمی در مراحل اولیه مسیر و قبل از تشکیل پورفیرینوژنها (پورفیری حاد متناوب) (ناشی از کاهش فعالیت اوروپورفیرینوژن I سنتاز (PBG دآمیناز) (HMB سنتاز)) باشد، ALA و PBG در بافتها و مایعات بدن، تجمع خواهند یافت. از لحاظ بالینی، بیماران از درد شکمی و علائم عصبی- روانی شکایت دارند.
وقفههای آنزیمی در مراحل بعدی مسیر سبب تجمع پورفیرینوژنها میشوند که محصولات اکسیداسیون آنها و مشتقات پورفیرینی مربوطه، باعث حساسیت به نور (واکنش به نور مرئی حدود 400 نانومتر) میشوند. معتقدند که پورفیرینها بر اثر قرارگیری در معرض نوری با این طول موج، برانگیخته شده و با ایجاد واکنش با اکسیژن ملکولی، رادیکالهای اکسیژن را میسازند که به لیزوزومها و سایر ارگانلها، آسیب میرسانند. لیزوزومهای آسیبدیده، با رهایی آنزیمهای تجزیهای، سبب درجات متفاوتی از آسیب پوستی از جمله خارش میشوند.
پورفیریها را میتوان بر اساس اعضا و یا سلولهایی که بیشترین ابتلا را دارند نیز طبقهبندی کرد. اینها اغلب اعضا و یا سلولهایی هستند که ساخت هم (Heme) در آنها بسیار فعال است. مغز استخوان مقدار قابل توجهی هموگلوبین میسازد و کبد در ساخت هموپروتئینی به نام سیتوکروم P450 فعال است، بنابراین یک طبقهبندی دیگر، تقسیم پورفیری به انواع اریتروپویتیک و کبدی میباشد.
همچنین پورفیریها را میتوان به انواع حاد و پوستی نیز طبقهبندی نمود؛ زیرا تأثیر انواع خاصی از پورفیریها بر برخی از ارگانهای بدن، شدیدتر از تأثیر آنها بر سایر ارگانها میباشد. یکی از دلایل آن، تفاوت میزان متابولیتهای آسیبرسان (مثل ALA، PBG، پورفیرینهای خاص و یا عدم وجود هم (Heme)) بسته به فعالیت متفاوت آنزیمهای سازنده هم (Heme) در اعضا و سلولهای مختلف میباشد.
ALAS1، آنزیم تنظیمکننده کلیدی مسیر بیوسنتز هم (Heme) در کبد است که توسط بسیاری از داروها و از طریق سیتوکروم P450، القا میشود. سیتوکروم P450، تمام هم (Heme) را مورد استفاده قرار داده و موجب رفع مهار (القای) ALAS1 میگردد. در بیماران مبتلا به پورفیری، افزایش فعالیت ALAS1، منجر به افزایش سطح پیشسازهای بالقوه مضر هم (Heme)، پیش از محل وقفه متابولیک میگردند؛ لذا، مصرف داروهای القاگر سیتوکروم P450 (القاگرهای میکروزومی) میتوانند آغازگر حملات پورفیری باشند.
تشخیص انوع خاص پورفیری از طریق بررسی موارد زیر امکانپذیر است:
1- دقت در گرفتن شرح حال بالینی و خانوادگی
2- معاینه فیزیکی
3- تستهای مناسب آزمایشگاهی
میزان بالای سرب میتواند با گروههای SH آنزیمهای ALA دهیدراتاز و فروشلاتاز ترکیب شده و با اثر بر متابولیسم هم (Heme)، متابولیسم پورفیرینها را تغییر دهد. در این موارد، میزان پروتوپورفیرین گلبولهای قرمز و ALA و کوپروپورفیرین ادرار افزایش مییابد.
درمان پورفیریها:
ممکن است در آینده، درمان پورفیریها در سطح ژنی، امکانپذیر شود. در حال حاضر، درمان علامتی است. بیماران باید از مصرف داروهای القاگر سیتوکروم P450 خودداری نمایند. خوردن مقادیر زیاد غذاهای پرکربوهیدرات (تحمیل گلوکز) و یا تجویز هماتین (نوعی هیدروکسید هم (Heme)) میتواند از طریق سرکوب ALAS1، موجب کاهش تولید پیشسازهای زیانبار هم (Heme) شود. تجویز بتا- کاروتن از طریق کاستن تولید رادیکالهای آزاد و کاهش حساسیت به نور، در بیماران حساس به نور ممکن است مفید باشد. محافظهای ضد نور خورشید که نور مرئی را فیلتر میکنند، میتوانند در این بیماران، مفید باشند.
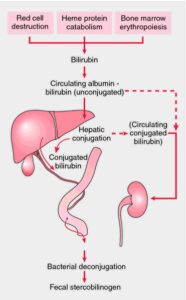
کاتابولیسم هم (Heme) و تولید بیلیروبین:
در شرایط طبیعی، در هر روز 200 بیلیون گلبول قرمز در یک انسان بالغ تخریب شده و نوسازی روزانه هموگلوبین در یک فرد بالغ 70 کیلوگرمی، تقریباً 6 گرم میباشد. پس از تخریب هموگلوبین در بدن، گلوبین به اسیدهای آمینه تشکیل دهنده خود تجزیه شده و آهن هم (Heme) نیز به مخازن آهن بدن برای استفاده مجدد وارد میشود. پورفیرین بدون آهن نیز تجزیه میشود که این کار به طور عمده در سلولهای رتیکولواندوتلیال کبد، طحال و مغز استخوان صورت میگیرد.
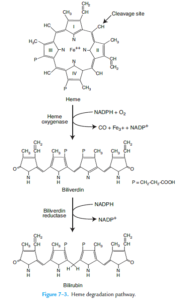
کاتابولیسم هم (Heme) تمامی هموپروتئینها (هموگلوبین، میوگلوبین و سیتوکرومها) در بخشهای میکروزومی سلولها و توسط سیستم آنزیمی هماکسیژناز با کمک NADPH و O2 صورت میگیرد. اکسیژن به پلهای α- متنیل بین پیرولهای I و II در پورفیرین اضافه میشود. یون فریک آزاد شده و مونوکسیدکربن (CO) تولید میشود. یک مقدار مولاریته مساوی از بیلیوردین نیز تولید میشود. CO تولید شده، در آخر به صورت کربوکسی هموگلوبین منتقل میشود که مقادیر سرمی آن میتواند در تشخیص آنمی همولیتیک مفید واقع گردد.
در پرندگان و دوزیستان، بیلیوردین دفع میگردد. در پستانداران، بیلیوردین توسط بیلیوردین ردوکتاز به بیلیروبین تبدیل میشود. در این واکنش، پلهای متنیل موجود بین پیرولهای III و IV به یک گروه متیلن احیا میشود. آنزیم بیلیوردین ردوکتاز وابسته به NADPH میباشد.
روزانه تقریباً 350- 250 میلیگرم بیلیروبین در بالغین سالم تولید میشود که قسمت عمده آن از هموگلوبین منشاء میگیرد. تخمین زده میشود که هر 1 گرم هموگلوبین حدود 35 میلیگرم بیلیروبین میسازد.
بیلیروبین تولید شده در بافتهای محیطی، توسط آلبومین پلاسما به کبد منتقل میشود و در آنجا، مراحل بعدی متابولیسم آن صورت میگیرد که شامل مراحل زیر میباشد:
1- برداشت بیلیروبین توسط سلولهای پارانشیم کبدی
2- کنژوگاسیون بیلیروبین با گلوکورونات در شبکه اندوپلاسمی صاف
3- ترشح بیلیروبین کنژوگه به داخل صفرا
مکانیسمهای ورود بیلیروبین به هپاتوسیتها:
1- توسط انتشار غیر فعال
2- به وسیله اندوسیتوز با واسطه رسپتور
برداشت بیلیروبین توسط کبد:
بیلیروبین به میزان اندکی در آب حل میشود؛ از این رو، در پلاسما توسط اتصال غیرکووالانسی به آلبومین متصل شده و حلالیت آن افزایش مییابد. هر ملکول آلبومین، دارای یک جایگاه با میل ترکیبی بالا و یک جایگاه با میل ترکیبی پایین برای آلبومین میباشد. در هر 100 میلیلیتر از پلاسما، تقریباً 25 میلیگرم بیلیروبین قادر است در جایگاه با میل ترکیبی بالا، اتصال محکمی با آلبومین برقرار نماید. بیلیروبین اضافه بر این میزان، تنها قادر به برقراری اتصال سست به آلبومین بوده و لذا به آسانی جدا شده و به داخل بافتها انتشار مییابد.
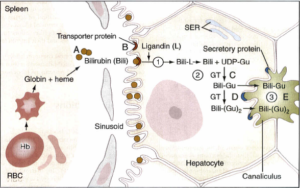
برخی از آنتیبیوتیکها و سایر داروها، بر سر جایگاه با میل ترکیبی بالای آلبومین، با بیلیروبین رقابت میکنند. در کبد، بیلیروبین از آلبومین جدا شده و توسط یک سیستم قابل اشباع با واسطه ناقل در سطح سینوزوئیدی سلولهای کبد برداشت میشود. این سیستم انتقال تسهیل شده، دارای ظرفیت بسیار بالایی میباشد و به نظر نمیرسد که حتی در شرایط پاتولوژیک، محدودکننده سرعت متابولیسم بیلیروبین باشد.
از آنجا که این سیستم انتقال تسهیل شده، تعادل بیلیروبین در دو سوی غشای سینوزوئیدی سلولهای کبدی را امکانپذیر میسازد، مقدار برداشت خالص بیلیروبین، به میزان کاهش بیلیروبین توسط مسیرهای متابولیسمی بعدی بستگی دارد. بیلیروبین پس از ورود به هپاتوسیتها، میتواند به پروتئینهای سیتوزولی خاصی متصل شده که این امر، به حفظ قابلیت انحلال بیلیروبین قبل از کنژوگه شدن آن کمک مینماید. این پروتئینها شامل لیگاندین (خانوادهای از گلوتاتیون S- ترانسفرازها) و پروتئین Y هستند. این پروتئینها احتمالاً از بازگشت بیلیروبین به خون نیز جلوگیری میکنند.
کنژوگاسیون بیلیروبین:
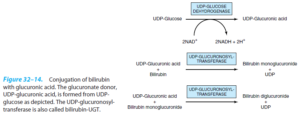
بیلیروبین یک ترکیب غیرقطبی است و اگر به صورت محلول در آب درنیاید، درون سلولها (مثلاً به صورت متصل به لیپیدها) باقیخواهد ماند. سلولهای کبدی از طریق افزودن ملکولهای اسید گلوکورونیک به بیلیروبین (فرآیند کنژوگاسیون) توسط گلوکورونیل ترانسفراز (بیلیروبین- UGT)، آن را به فرم قطبی تبدیل نموده که به راحتی میتواند از طریق صفرا دفع شود.
گلوکورونیل ترانسفراز، به طور عمده در شبکه آندوپلاسمی قرار داشته و از UDP- گلوکورونیک اسید به عنوان دهنده گلوکورونوزیل استفاده میکند. با افزودن یک مولکول UDP- گلوکورونیک اسید به بیلیروبین، بیلیروبین منوگلوکوورونید ساخته میشود و سپس با افزودن یک مولکول UDP-گلوکورونیک اسید دیگر به آن، فرم دیگلوکوورونید ساخته میشود. بیشتر بیلیروبینی که از صفرای پستانداران دفع میشود، فرم دیگلوکوورونید است. گلوکورونیل ترانسفراز (بیلیروبین- UGT) میتواند توسط بسیاری از داروها (مانند فنوباربیتال) القاء گردد.
ترشح بیلیروبین به درون صفرا:
بیلیروبین کنژوگه توسط انتقال فعال به درون صفرا ترشح میشود که احتمالاً محدودکننده سرعت کل فرآیند متابولیسم کبدی بیلیروبین میباشد. پروتئین مربوطه، MRP-2 (Multidrug resistans-like protein 2) (پروتئین شبه مقاوم به چند دارو) نام دارد که MOAT (Multispecific organic anion transporter) (ناقل آنیونی آلی چند ویژه) نیز نامیده میشود که یکی از اعضای خانواده ترانسپورترهای ABC (ATP-binding cassette) میباشد. این پروتئین در غشای پلاسمای غشای کانالیکولار صفراوی قرار دارد و تعدادی از آنیونهای آلی را جابجا میکند. انتقال کبدی بیلیروبین کنژوگه به داخل صفرا نیز توسط همان داروهای القاء کننده کنژوگاسیون بیلیروبین، القاء میگردد.
اثر باکتریهای رودهای بر بیلیروبین کنژوگه:
بیلیروبین کنژوگه در ایلئوم انتهایی و روده بزرگ، تحتتأثیر β- گلوکورونیدازها که از آنزیمهای باکتریایی میباشند، تجزیه شده و گلوکوورونیدهای آنها برداشته میشود. سپس رنگدانه باقیمانده، توسط باکتریهای مدفوع احیاء شده و تشکیل اوروبیلینوژنها (ترکیبات بیرنگ تتراپیرولی) را میدهد.
بخش کوچکی از اوروبیلینوژنها در ایلئوم انتهایی و روده بزرگ، جذب شده و دوباره از طریق کبد دفع میگردد (چرخه رودهای- کبدی اوروبیلینوژن). در موارد زیر، اوروبیلینوژن از طریق ادرار نیز دفع میشود:
1- در مواقعی که مقدار زیادی رنگدانه صفراوی تشکیل شود.
2- هنگامی که بیماری کبدی در چرخه رودهای- کبدی اوروبیلینوژن، اشکال ایجاد نماید.
در حالت عادی، بیشتر ترکیب بیرنگ اوروبیلینوژنی که توسط باکتریهای مدفوعی در کولون تشکیل میشود، در همان محل، به اوروبیلینها (ترکیبات رنگی) اکسیده شده و از طریق مدفوع دفع میگردد. تیره شدن رنگ مدفوع هنگام قرارگیری در هوا، ناشی از اکسیداسیون اوروبیلینوژن باقیمانده به اوروبیلینها است. قسمتی از اوروبیلینوژن در روده بزرگ به استرکوبیلینوژن تبدیل شده که در نهایت به صورت استرکوبیلین از طریق مدفوع، دفع و باعث ایجاد رنگ قهوهای در مدفوع میشود.
هیپربیلیروبینمی و یرقان
افزايش بیلیروبین خون بيشتر ازmg/dl 1 (μmol/L 1/17)، هیپربیلیروبینمی نامیده میشود. هیپربیلیروبینمی میتواند ناشی از موارد زیر باشد:
1- تولید بیلیروبین به مقدار بیش از ظرفیت طبیعی دفع کبدی
2- ناتوانی کبد آسیب دیده، در دفع مقادیر طبیعی بیلیروبین تولید شده
3- انسداد مجاری دفعی کبد.
در تمامی وضعیتهای فوق، بیلیروبین در خون تجمع یافته که اگر غلظت آن به حد معینی ( mg/dl2-2/5) برسد، با انتشار به درون بافتها باعث زرد شدن آنها و ایجاد یرقان (Jundice) یا زردی (Icterus) میشود.
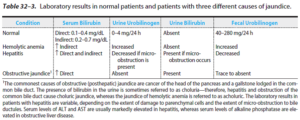
انواع تقسیمبندی هیپربیلیروبینمی و یرقان:
1- به صورت پيش كبدي (Pre-hepatic) (مانند آنمی همولیتیک)، كبدي (Hepatic) و پس كبدي (Post-hepatic) (مانند انسداد، کلستاز و تومور)
2- به صورت هیپربیلیروبینمی کنژوگه و هیپربیلیروبینمی غیرکنژوگه
3- هیپربیلیروبینمی احتباسی (Retension hyperbilirubinemia) (ناشی از افزایش تولید) و هیپربیلیروبینمی برگشتی (Regurgitation hyperbilirubinemia) (ناشی از پس زدن بیلیروبین به داخل جریان خون به علت انسداد صفراوی)
4- یرقان کلوریک (Choluric jaundice) و یرقان غیرکلوریک.
تنها فرم کنژوگه بیلیروبین به دلیل قابلیت انحلال در آب، میتواند در ادرار ظاهر شود که به آن، یرقان کلوریک گفته میشود. یرقان کلوریک در هیپربیلیروبینمی برگشتی رخ میدهد. یرقان غیرکلوریک در موارد ازدیاد بیلیروبین غیرکنژوگه اتفاق میافتد.
کلوری به صورت وجود رنگدانههای صفراوی در ادرار، تعریف میشود.
علل افزایش بیلیروبین غیرکنژوگه سرم
1- آنمی همولیتیک:
در آنمی همولیتیک به دلیل آزاد شدن مقادیر بالای غیرطبیعی هموگلوبین از گلبولهای قرمز، بیلیروبین غیرکنژوگه افزایش مییابد. اگر میزان بیلیروبین تولید شده، بیشتر از نسبت برداشت کبدی باشد، سطح بیلیروبین غیرکنژوگه سرم افزایش خواهد یافت. این حالت، شبیه حالتی است که در نوزادان به دلیل فعالیت پایین گلوکورونیل ترانسفراز ایجاد میشود. بنابراین، تأیید مقادیر بالای بیلیروبین غیرمستقیم (غیرکنژوگه) در سرم، روشی برای تأیید تشخیص آنمی همولیتیک در بزرگسالان میباشد. معمولاً این افزایش منظم نبوده و اغلب در محدودهی 3-1/5 میلیگرم در دسی لیتر میباشد.
2- یرقان فیزیولوژیک نوزادی:
این حالت گذرا، شایعترین علت هیپربیلیروبینمی غیرکنژوگه است. یرقان فیزیولوژیک نوزادی حاصل موارد زیر است:
- تشدید همولیز در حوالی زمان تولد
- عدم بلوغ دستگاه کبدی در برداشت، کنژوگاسیون و ترشح بیلیروبین
- کاهش فعالیت گلوکورونیل ترانسفراز (بیلیروبین- UGT) (UDPGT)
- کاهش سنتز UDP- گلوکورونیک اسید (به عنوان سوبسترا)
- غلظت اسید چرب آزاد خون آنها بالاتر است.
بالا بودن غلظت اسید چرب آزاد خون به ویژه در نوزادانی که از شیر مادر تغذیه میکنند مشاهده میشود که به این حالت Breast Feeding Hyperbilirubinemia”” گفته میشود. در شرایطی که مادر از قرصهای ضدبارداری استفاده کند، این افزایش به مراتب بیشتر است.
در نوزادان باکتریهای رودهای وجود ندارند تا بیلیروبین مستقیم را به اوروبیلینوژن تبدیل کنند. در عوض در روده باریک دارای آنزیم بتاگلوکورونیداز میباشند که بیلیروبین کنژوگه را دکنژوگه نموده که قابل جذب از روده است و باعث افزایش غلظت بیلیروبین خون میشود.
یرقان فیزیولوژیک نوزادی، چون بیلیروبین افزایش یافته از نوع غیرکنژوگه است، هنگامی که غلظت آن در پلاسما بیشتر از مدتی که بتواند محکم به آلبومین اتصال یابد (25- 20 میلیگرم در دسی لیتر)، تجاوز کند، از سد خونی- مغزی عبور کرده و با رسوب در گانگلیاهای پایه (Basal ganglia) و هستههای ساقه مغز (Brainstem nuclei)، باعث ایجاد انسفالوپاتی سمی ناشی از افزایش بیلیروبین خون (کرنیکتروس) (Kernicterus) شده که باعث ایجاد عقبماندگی ذهنی میشود. از علائم کرنیکتروس در نوزادان به سستی (Lethargy)، تغذیه ضعیف (Poor feeding)، تشنج (Seizures) و انحراف چشمها به سمت بالا (Upward deviation of the eyes) میتوان اشاره نمود.
چون سیستم متابولیزه کننده بیلیروبین، القاءپذیر است، بنابراین فنوباربیتال برای این نوزادان تجویز شده که در این اختلال مؤثر است. قرار دادن نوزادان زیر نور آبی (فتوتراپی)، موجب پیشبرد دفع کبدی بیلیروبین غیرکنژوگه میگردد. این کار از طریق تبدیل مقداری از بیلیروبین به مشتقات دیگری نظیر قطعات مالئیمید (Maleimide) و ایزومرهای هندسی بیلیروبین که از طریق صفرا دفع می شود، صورت میگیرد. بیلیروبین در طول موجهای 475-425 نانومتر جذب نوری دارد و به همین دلیل، در درمان نوزادان مبتلا به هیپربیلیروبینمی از لامپ UV نیز استفاده میشود.
بیلیروبین در متداولترین فرم ایزومری خود (ترانس)، به شدت در آب نامحلول بوده و به صورت متصل به آلبومین منتقل میشود. تنها بخش کوچکی از بیلیروبین به صورت آزاد منتقل میگردد. نور میتواند باعث فوتوایزومریزاسیون بیلیروبین از فرم ترانس به فرم فشرده سیس شده و با افزایش حلالیت آن، باعث ترشح بیلیروبین به ادرار شود. این حالت، اساس فوتوتراپی در درمان هیپربیلیروبینمی نوزادی (غیرکنژوگه) را تشکیل میدهد.
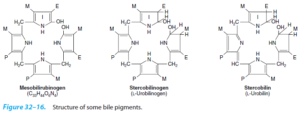
3- سندروم ژیلبرت (Gilbertʼs syndrome):
در سندروم ژیلبرت که با یک هیپربیلیروبینمی غیرکنژوگهی خفیف مشخص میشود، شایعترین اختلال ژنتیکی، ورود 2 باز به درون ناحیه پروموتور ژن UGT1A1 میباشد که نتیجه آن، کاهش میزان رونویسی و بنابراین، کاهش فعالیت آنزیمی (کاهش به حدود 30 درصد از فعالیت طبیعی) میباشد.
در سندروم ژیلبرت که در 5- 3 درصد جمعیت (در مردان شایعتر است) اتفاق میافتد، نقص ژنتیکی ممکن است ضروری باشد، اما کافی نیست؛ زیرا مشاهده شده است که درصد بارزی از مردان با نقص ژنتیکی، دارای هیپربیلیروبینمی بوده، در حالی که زنان دارای این نقص آنزیمی، فاقد هیپربیلیروبینمی بودهاند. در برخی از بیماران دارای سندروم ژیلبرت، ممکن است یک نقص ترانسپورت در غشاء سینوزوئیدهای کبدی وجود داشته باشد. از آن جایی که انتشار غیرفعال بیلیروبین به درون هپاتوسیتها اتفاق میافتد، این شرایط خیلی وخیم نمیباشد و ممکن است باعث افزایش خفیف بیلیروبین مانند آنچه که در آنمی همولیتیک اتفاق میافتد، شود.
در سندروم ژیلبرت، هیپربیلیروبینمی غیرکنژوگه به طور مشخص در محدوده 3- 2 میلیگرم در دسیلیتر بوده که با روزهداری افزایش یافته و به ندرت، به بیش از 5 میلیگرم در دسیلیتر تجاوز مینماید.
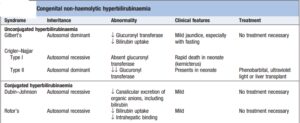
4- سندروم کریگلر نجار (Crigler-Najjar syndrome):
در سندروم کریگلر نجار که به وسیله مقادیر بالای بیلیروبین غیرکنژوگه سرم مشخص میگردد، وجود چندین جهش در ژن UGT1A1 شناسایی شدهاند که شامل تغییر در قالب خواندن، کدونهای خاتمه و جانشینیهای اسیدآمینهای حیاتی میباشند که همگی آنها موجب افزایش طیف وسیعی از پروتئینهای با اختلال عملکردی از یک حالت نسبتاً خفیف تا پروتئینهای کاملاً فاقد عملکرد میشوند. سندروم کریگلر نجار، یک بیماری ژنتیکی (اتوزوم مغلوب) بسیار نادر با شیوع یک مورد در هر یک میلیون تولد میباشد.
سندروم کریگلر نجار به انواع I و II تقسیمبندی میشود. در سندروم کریگلر نجار نوع I، در حضور پروتئینهای هموزیگوت فاقد عملکرد، هیپربیلیروبینمی غیرکنژوگه اغلب بیشتر از 20 میلیگرم در دسیلیتر بوده و معمولاً در 15 ماه اول زندگی، کشنده است. نوزادان درگیر با هیپربیلیروبینمی غیرکنژوگه شدید، عموماً دچار کرنیکتروس (رسوب بیلیروبین در مغز، به ویژه با اثر بر بازال گانگلیا و عمدتاً هسته لنتیکولار) میشوند که نتیجه آن، تأخیر و اختلال شدید حرکتی میباشد. در سندروم کریگلر نجار نوع I، تجویز فنوباربیتال اثری ندارد.
در سندروم کریگلر نجار نوع I، اگر بیمار دچار آسیب عصبی نشده باشد، نوردرمانی، ترانسفوزیون خون، مهارکنندههای آنزیم هماکسیژناز مانند tin-mesoporphyrin، ترکیبات کلسیم و کربنات خوراکی (از طریق ایجاد پیوند با بیلیروبین داخل روده و ممانعت از بازجذب آن از روده) و پیوند کبد میتوانند موجب بهبود وضعیت این بیماران شود.
سندروم کریگلر نجار نوع II، یک اختلال وراثتی نادر است که ناشی از جهش در ژن ایجادکننده بیلیروبین- UGT بوده، ولی مقداری از فعالیت آنزیم باقی مانده و نسبت به نوع I، دارای سیر خوشخیمتری میباشد. در سندروم کریگلر نجار نوع II که دارای شدت کمتری میباشد، فعالیت آنزیم تقریباً 10 درصد فعالیت طبیعی بوده و امکان حیات تا زمان بلوغ، وجود دارد. در این فرم، معمولاً غلظت بیلیروبین سرم از 20 میلیگرم در دسیلیتر تجاوز نمیکند و درمان با فنوباربیتال، به طور گستردهای به کار میرود. یک دوز دارو هنگام خواب غالباً برای نگهداری غلظت بیلیروبین پلاسما در حد طبیعی کافی میباشد.
5- هیپربیلیروبینمی سمی:
هیپربیلیروبینمی غیرکنژوگه میتواند ناشی از اختلال عملکرد کبد در نتیجه اثر سموم باشد. از جمله این عوامل میتوان به کلروفرم، ارسفنامینها، تتراکلریدکربن، استامینوفن، ویروس هپاتیت، سیروز و مسمومیت با قارچ آمانیتا اشاره کرد. اختلالات اکتسابی فوق، حاصل آسیب سلولهای پارانشیمی کبد هستند که باعث اختلال کونژوگاسیون میشود.
علل افزایش بیلیروبین کنژوگه سرم
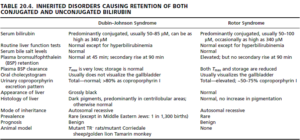
1- سندروم دوبین- جانسون (Dubin-Johnson syndrome):
در سندروم دوبین- جانسون، مانعی در ترشح بیلیروبین کنژوگه به داخل مجاری وجود دارد که ناشی از نقص در پروتئین MRP2 (Multidrug-resistance protein 2) میباشد. سندروم دوبین- جانسون، با افزایش بیلیروبین کنژوگه پلاسمایی، اغلب با یک یرقان خفیف (بیلیروبین تام 5- 2 میلیگرم در دسیلیتر) و پیگمانتاسیون تیره کبدی در نتیجه تجمع پیگمان لیپوفوزین (Lipofuscin) مرتبط میباشد. تجمع بیلیروبین کنژوگه در هپاتوسیتها موجب برگشت آن به داخل گردش خون میشود. سندروم دوبین- جانسون میتواند با سندروم روتر اشتباه شود؛ چرا که در سندروم روتر نیز یک انسداد در ترشح بیلیروبین کنژوگه اما بدون پیگمانتاسیون کبدی وجود دارد. در سندروم دوبین- جانسون، بیوپسی کبد اغلب نشاندهنده وجود انکلوزیون بادیهای سیتوزولی در هپاتوسیتها میباشد.
2- سندروم روتر (Rotor syndrome):
در سندروم روتر، موتاسیون ژنهای SLCO1B1 (solute carrier organic anion transporter family, member 1B1) و SLCO1B3 (solute carrier organic anion transporter family, member 1B3) که دارای نقش انتقالی میباشند، وجود دارد، بنابراین بیلیروبین کمتر از بدن حذف شده و در بدن تجمع مییابد.
افتراق سندروم دوبین- جانسون از سندروم روتر
| Rotor syndrome | Dubin–Johnson syndrome | |
| appearance of liver | normal histology and appearance | liver has black pigmentation |
| gallbladder visualization | gallbladder can be visualized by oral cholecystogram | gallbladder cannot be visualized |
| total urine coproporphyrin content | high with <70% being isomer 1 | normal with >80% being isomer 1 (normal urine contains more of isomer 3 than isomer 1) |
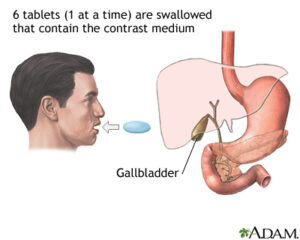
A cholecystogram is an x-ray procedure used to help evaluate the gallbladder. For the procedure, a special diet is consumed prior to the test and contrast tablets are also swallowed to help visualize the gallbladder on x-ray. The test is used to help in diagnosing disorders of the liver and gallbladder, including gallstones and tumors.
تست بروم سولفوفتالئین (Bromsulphthalein; Sulphobromophthalein; BSP):
برای انجام این آزمایش، بیمار باید ناشتا نباشد؛ زیرا ناشتا بودن طولانی موجب تغییر در نتیجه آزمایش خواهد شد. BSP به میزان 5 میلیگرم به ازای هر کیلو وزن بدن و به صورت درون رگی (IV) تزریق میگردد، سپس در طی 45 و 90 دقیقه پس از تزریق آن، خونگیری انجام شده و مقدار آن اندازهگیری میشود. تزریق BSP ممکن است موجب ایجاد واکنشهای آلرژیک از قبیل تب، Urticaria و سایر eruptionهای پوستی شود. این ماده به شدت باعث ایجاد خارش میشود؛ بنابراین باید در هنگام تزریق، از پخش شدن آن روی پوست اجتناب گردد.
تفسیر: کبد طبیعی، 95 درصد رنگ BSP را در طی 45 دقیقه پاک نموده و کمتر از 0/5 میلیگرم در 100 میلی لیتر از آن در گردش خون باقی خواهد ماند، بنابراین در افراد طبیعی، در نمونه دقیقه 45، میزان BSP نباید بیشتر از 5 درصد باشد. در سندروم دوبین- جانسون، مقدار BSP خون در نمونه 90 دقیقه، بیش از مقدار آن در نمونه 45 دقیقه است؛ اما در سندرم روتور، مقدار BSP در نمونه 45 دقیقه، مقدار بیشتری دارد ولی BSP نمونه 90 دقیقه طبیعی است.
3- انسداد صفراوی:
در افراد بزرگسال، کولهلیتیازیس (Cholelithiasis) که ناشی از حضور سنگهای صفراوی (ترکیبی از کلسترول یا بیلیروبین) در مجرای صفراوی عمومی یا سرطان دهانه پانکراس میباشد، شایعترین علت هیپربیلیروبینمی است. انسداد صفراوی باعث افزایش بیلیروبین تام میشود؛ به نحوی که بیش از 90 درصد آن را بیلیروبین مستقیم تشکیل میدهد. در انسداد صفراوی، بیلیروبین دیگلوکورونید دفع نشده و به داخل وریدها و عروق لنفاوی کبد، پس زده میشود، بنابراین بیلیروبین کنژوگه در خون و ادرار (یرقان کلوریک) ظاهر شده و مدفوع، کمرنگ (خاکستری) میباشد. در بیش از 90 درصد این بیماران، افزایش توأمی در آلکالن فسفاتاز (اغلب بیشتر از 300 واحد بینالمللی در لیتر) نیز مشاهده میشود.
اصطلاح یرقان کلستاتیک (Cholestatic jaundice)، دربرگیرنده تمامی موارد یرقان انسدادی خارج کبدی است. این اصطلاح، مواردی از یرقان که در آنها، هیپربیلیروبینمی بر اثر انسداددهای ریزی در مجاری کوچک صفراوی داخل کبدی ایجاد میشوند را نیز دربر میگیرد. انسدادهای فوق به علت انسدادهای کبدی متورم و آسیبدیده (مانند آنچه در هپاتیت عفونی روی میدهد) ایجاد میشوند.
اوروبیلینوژن و بیلیروبین ادرار:
در حالت عادی تنها مقدار بسیار کمی اوروبیلینوژن در ادرار وجود دارد. در انسداد کامل مجرای صفراوی، اوروبیلینوژن در ادرار یافت نمیشود، زیرا هیچ راهی برای رسیدن بیلیروبین به روده و تبدیل آن به اوروبیلینوژن وجود ندارد. در این مورد، وجود بیلیروبین (کنژوگه) در ادرار بدون وجود اروبیلینوژن، مطرح کننده یرقان انسدادی بر اثر ایجاد انسداد داخل کبدی یا پس از کبد است.
در یرقان ثانویه ناشی از همولیز، افزایش تولید بیلیروبین منجر به افزایش تولید اوروبیلینوژن در ادرار میشود. در یرقان همولیتیک، معمولاً بیلیروبین در ادرار یافت نمیشود (چون بیلیروبین غیرکنژوگه به داخل ادرار راه نمییابد). از این رو، افزایش اوروبیلینوژن و فقدان بیلیروبین با هم، مطرح کننده یرقان همولیتیک میباشد.
متابولیسم و دفع بیلیروبین
نمونه های موردنیاز:
سرم، پلاسما، CSF و ادرار ممکن است بمنظور اندازه گیری بیلیروبین با استفاده از روش نمک دیازونیوم مورد بررسی قرار گیرند. نمونه سرم برای اندازه گیری بیلیروبین را حتماً به دور از نور مستقیم و گرما نگهداری نمائید. همولیز مختصر در پاسخهای حاصل تداخل جدی ندارد. لیپمیک بودن نمونه ها میتواند موجب افزایش کاذب سطح بیلیروبین شود. توصیه میشود که 24 ساعت قبل از انجام آزمایش بیلیروبین، از مصرف داروهای مداخله کننده در نتیجه این آزمایش، خودداری شود.
روشهای اندازه گیری:
روشهای کالریمتری و اسپکتروفتومتری Diazotization از روشهای متداول میباشند. تفاوت انواع بیلیروبینها در اختلاف حلالیت آنها در آب میباشد. از آنجاییکه بیلیروبین کونژوگه و بیلیروبین متصل شده با آلبومین (بیلیروبین دلتا) در آب محلول میباشند، بنابراین بیلیروبین کنژوگه بصورت سریع و مستقیم با سوبسترا واکنش میدهد. در حالیکه بیلیروبین غیرکنژوگه پس از افزودن یک تسریع کننده (الکل و یا برخی حلالهای دیگر)، محلول در آب شده و در مخلوط واکنش اندازهگیری میشود. بنابراین، بیلیروبین مستقیم به اندازه گیری بیلیروبین کنژوگه و بیلیروبین متصلشده به آلبومین پرداخته و پس از افزودن تسریع کننده به واکنش، همه فرمهای بیلیروبین موسوم به بیلیروبین توتال اندازه گیری میشوند. روشهای Jendrassik-Grof و Malloy-Evelyn با استفاده از نمک دیازونیوم و ایجاد یک واکنش رنگی در نتیجه واکنش با بیلیروبین، به اندازه گیری این ماده میپردازند.
اصول آزمایش:
در روش Jendrassik-Grof که معمولاً در pH= 13 انجام میشود، بیلیروبین با نمک دیازونیوم اسید سولفانیلیک واکنش داده و ایجاد آزوبیلیروبین مینماید که در pH قلیایی، آبی رنگ است. سپس محصولات این واکنش قلیایی، شدت رنگ بیشتری در pH خنثی به خود میگیرد.
در روش Malloy-Evelyn که در pH= 1/3 انجام میشود، محصول قرمز رنگ نهایی در طول موج 560 نانومتر اندازه گیری میشود. ممکن است از مخلوط سدیم بنزوات- کافئین و یا متانول بعنوان تسریع کننده در این روشهای اندازه گیری بیلیروبین استفاده شود.
مداخله کننده ها:
همولیز و لیپمیک بودن نمونه های خون ممکن است که موجب تغییر در نتیجه این تســـت شوند. قرارگرفتن نمونه ها در معرض نور خورشید و یا نور مصنوعی بمدت بیش از یک ساعت میتواند منجر به تجزیه بیلیروبین و کاهش سطح آن گردد. مواد حاجب رادیوگرافیک ممکن است تا 24ساعت آینده نیز نتیجه تست را تحتتأثیر قرار دهند. در مواقع ناشتایی، بطور طبیعی، سطح بیلیروبین غیرمستقیم پایینتر میباشد. اختلالات همولیزدهنده (واکنشهای تزریق خون) میتوانند موجب افزایش سطح بیلیروبین مستقیم و غیرمستقیم شوند. البته همولیز به تنهایی، بندرت موجب افزایش سطح بیلیروبین به بیش از 4 تا 5 میلیگرم در دسیلیتر خواهد شد. چنانچه همولیز همراه با اختلال در عملکرد کبد شود، میزان افزایش سطح بیلیروبین بطور فزاینده ای بیشتر خواهد شد.
مقادیر نرمال:
مقادیر طبیعی بیلیروبین مستقیم و توتال افراد بالغ بترتیب 0/4-0 و 1-0 میلیگرم در دسی لیتر میباشد. واحد SI برای بیان غلظت بیلیروبین، µmol/L میباشد. فاکتور تبدیل واحد mg/dl به µmol/L، عدد 17/1میباشد.
بیلیروبین در نوزادان: غلظت بیلیروبین نوزادان طبیعی رسیده (Full-term) باید در نتیجه تکامل سیستم کبدی، تا روز دهم پس از تولد کاهش یافته و به سطح بیلیروبین افراد بالغ برسد. غلظت بیلیروبین نوزادانی که از شیر مادر تغذیه میکنند ممکن است بیش از 10روز طول بکشد تا به سطح بیلیروبین افراد بالغ برسد. همچنین سطح بیلیروبین نوزادان نارس (Premature infants) در مقایسه با نوزادان رسیده، بالاتر بوده و در آنها نیز ممکن است که بیش از 10روز زمان لازم باشد تا غلظت بیلیروبینشان به سطح غلظت بیلیروبین در افراد بالغ کاهش یابد.
روش اندازه گیری: غلظت بیلیروبین توتال در نوزادان از طریق تعیین جذب نوری نمونه در طول موج 454نانومتر در محلول بافر فسفات (7/4 =pH) بدست می آید. اکسی هموگلوبین که در سرم نوزادان به وفور یافت میشود، دارای جذب نوری در طول موجهای 454 و 540 نانومتر میباشد، بنابراین غلظت بیلیروبین توتال در نوزادان را میتوان با تعیین اختلاف جذب نوری در دو طول موج فوق بدست آورد.
اصول آزمایش: سرم با بافر فسفات (7/4=pH) رقیق شده و جذب نوری آن در طول موجهای 454 و 540 نانومتر قرائت میشود، سپس برای تعیین غلظت بیلیروبین نمونه، نتایج حاصل از تفریق جذب نوری نمونه در دو طول موج فوق را محاسبه نموده و از روی منحنی استاندارد، غلظت نمونه بدست میآید.
مداخله کننده ها:
این روش در کودکان بزرگتر و یا در افراد بالغ مورد استفاده قرار نمی گیرد زیرا در خون این افراد شاهد حضور پیگمانهای غذایی خواهیم بود. قرار گرفتن نمونه در معرض نور همانند نمونه های کنترل و یا استاندارد موجب تجزیه بیلیروبین خواهد شد.
نمونه های مورد نیاز: سرم و پلاسما ممکن است مورد استفاده قرار گیرد. پیگمانهای ناشی از مصرف مواد غذایی از قبیل کاروتن میتوانند بطور کاذب موجب افزایش سطح بیلیروبین شوند اما معمولاً بدلیل رژیم غذایی محدود در نوزادان این اتفاق نمی افتد. بیلیروبین میتواند در نتیجه حرارات و یا نور تجزیه شود، بنابراین باید نمونه در مقابل این عوامل محافظت شود.
مقادیر نرمال در نوزادان رسیده (Full-term):
نوزاد رسیده 24-0 ساعته 6-2 میلیگرم در دسی لیتر
نوزاد رسیده 48-24 ساعته 10-6 میلیگرم در دسی لیتر
نوزاد رسیده 5-3 روزه 8-4 میلیگرم در دسی لیتر
در نوزادان نارس (Premature):
نوزاد نارس 24-0 ساعته 8-1 میلیگرم در دسی لیتر
نوزاد نارس 48-24 ساعته 12-6 میلیگرم در دسی لیتر
نوزاد نارس 5-3 روزه 14-10 میلیگرم در دسی لیتر
روشهای اندازهگیری بیلیروبین
روش وان دن برگ (Van den Bergh reaction):
بيليروبين با استفاده از اسيد سولفانيليك اندازهگیری میشود که موجب تشکیل یک ترکیب کنژوگه با حلقههای پورفیرین بیلیروبین میشود. محصول رنگي نهائي (آزوبیلیروبین) در طول موج 540 نانومتر سنجيده ميشود. از آن جائي كه بيليروبين غيركنژوگه (غيرمستقيم) به آهستگي و آرامي وارد واكنش شيميائي ميشود، جهت اندازهگيري بيليروبين توتال معرفهاي تسريع كننده واكنش نظير كافئين يا متانول به معرف و محيط واكنش اضافه ميشوند. جهت اندازهگيري بيليروبين مستقیم از معرف بدون تسريع كننده استفاده ميگردد.
تا سال 1980 تصور ميشد بيليروبين مستقيم برابر بيليروبين كنژوگه ميباشد ولي امروزه مشخص گرديده كه ميزان اندازهگيري شده بيليروبين مستقيم شامل مجموع دلتا بيليروبين، 70 تا 80 درصد بيليروبين كنژوگه و درصد كمي از بيليروبين غيركنژوگه ميباشد.
قرار گرفتن نمونه به مدت طولانی در معرض نور منجر به فتوایزومریزاسیون و افزایش بیلیروبین واکنشدهنده مستقیم میگردد. مقادیر مرجع برای بیلیروبین تام، وابسته به سن و جنس میباشد. مقدار بیلیروبین معمولاً در سنین 18- 14 سالگی به بیشترین مقدار خود رسیده و تا سن 25 سالگی، به مقادیر ثابت بزرگسالی تبدیل میشود. فعالیت بدنی شدید موجب افزایش بارزی در مقادیر بیلیروبین در مقایسه با افراد در حال استراحت یا فعالیت عادی میشود.
روش مالوی اولین (Malloy Evelyn method):
سولفونیک اسید با نیتریت سدیم واکنش داده و منجر به تشکیل دیازوسولفانیلیک اسید میگردد. در حضور تسریعکننده دیمتیلسولفواکساید هر دو نوع بیلیروبین کنژوگه و غیرکنژوگه (بیلیروبین توتال) با دیازو واکنش داده و تولید آزوبیلیروبین مینمایند که در طول موج 540 حداکثر جذب را دارا میباشد (محلول یا معرف شماره 1 در کیت توتال حاوی سولفونیک اسید و تسریع کننده دیمتیل سولفوکساید است. محلول شماره 2 کیت توتال حاوی نیتریت سدیم است).
کیت بیلیروبین دایرکت فاقد معرف تسریعکننده دیمتیلسولفاکساید است و محلول یا معرف شماره 1 صرفاً حاوی سولفونیک اسید میباشد و معرف شماره 2 نیز مشابه کیت توتال نیتریت سدیم میباشد. استفاده از بلانک سمپل یا نمونه در هر دو روش توتال و دایرکت الزامی است و نهایتاً بایستی جذب بلانک از تست و استاندارد کسر گردد.
حد تشخیصی یا حساسیت بیلیروبین در روش مالوی الوین حدود 0/075 میلیگرم در دسیلیتر است. محدوده تشخیصی بیلیروبین در روش مالوی الوین تا 20 میلیگرم در دسیلیتر است و مقادیر بالاتر از این مقدار الزاماً بایستی رقیق شوند.
تداخلدهندههای مهم در روش مالوی اولین شامل گلوکز بالای 300، تریگلیسرید بالای 600 و هموگلوبین بالای 5 گرم در لیتر میباشند. پایداری سرم حاوی بیلیروبین در صورت محافظت از نور و حرارت و تبخیر نمونه 3 ساعت در حرارت اطاق است.
کنترل کیفی تست بیلیروبین بهتر است با دو سطح کنترل تجاری نرمال و بالا صورت گیرد و با استفاده از كاليبراتور در غلظت بالا و پائين تست كاليبر گردد. برای بيليروبينهاي بالاي 30 در نوزادان و اطفال بهتر است نمونه با آب مقطر ديونيزه رقيق گردد و جواب نهائي در ضريب رقت محاسبه گردد. در راستاي صحهگذاري كيتهاي بيليروبين مهمترين شاخص ارزيابي، تكرارپذيري و دقت كيت ميباشد كه در آزمايشگاه ميتوان با تكرار يك نمونه (در 10 نوبت مكرر در يك رديف كاري و در 10 رديف كاري متفاوت) به شاخص پراكندگي (ضريب تغييرات) مورد ادعا در بروشور كيت مراجعه نمود و وضعيت دقت اندازهگيري شده كيت را با دقت مورد ادعا (در بروشور كيت) مورد ارزيابي مقايسهاي قرار داد.
بیلیروبین دلتا یا بیلیپروتئین (Biliprotein or Deltabilirubin): بیلیپروتئین یا دلتابیلیروبین همان بیلیروبین کنژوگه میباشد که به واسطه پیوند کووالان به آلبومین باند شده و قابلیت دفع کلیوی آن کاهش یافته است و در نهایت عامل اصلی پایداری زردی در بیماران مبتلا به کلستاز یا یرقانهای کبدی میباشد.
زمانی که بیلیروبین کنژوگه نیمه عمر کمتر از 24 ساعت دارد دلتابیلیروبین یا بیلیپروتئین نیمه عمر طولانی معادل آلبومین و حدود 17 روز خواهد داشت و همین موضوع عامل پایداری علامت زردی در طول بهبود یرقانهای انسدادی یا کبدی بیماران است که به دلیل کاهش دفع ادراری آن میباشد. بیلیروبین کنژوگه یا مستقیم محلول در آب بوده و سریعاً از کلیهها فیلتر شده و در ادرار ظهور میکند و منجر به بیلیروبین مثبت ادرار میگردد.
فرمول محاسبه دلتابیلیروبین:
Deltabilirubin = Bili Total – (Bili conj + Bili unconj)
تأثير نور بر بيليروبين: غالب فرم بیلیروبین گردش خون از نوع ایزومر ترانس بوده (شدیداً غیرمحلول در آب) و عمدتاً در جریان خون به آلبومبن باند میگردد. نور منجر به فتو ایزومراسیون بیلیروبین از فرم ترانس به فرم سیس گردیده و فرم ایزومر سیس بیلیروبین با قابلیت حلالیت بالا در آب بیشتر در ادرار ترشح و دفع میگردد و این موضوع اساس فتوتراپی و درمان هیپربیلیروبینمی غیرکنژوگه نوزادان را تشكيل ميدهد. به عبارتی بیلیروبین نوزاد تحت اثر نور بیشتر دفع گردیده و کاهش میيابد.
نوسانات فیزیولوژیک بیلیروبین: ناشتاي طولانی مدت (24 تا 48) ساعت منجر به افزایش بیلیروبین توتال به میزان 20 الی 25% میگردد.
تأثیر نور روی بیلیروبین: آفتاب شدید تابستان منجر به کاهش 20 درصدی بیلیروبین نسبت به فصل زمستان میگردد.
گارو بستن به مدت طولانی و تغییر وضعیت نشسته به خوابیده منجر به نوسان بیلیروبین خون میگردد.
نوسانات سرمی بیلیروبین: سرم در مجاورت نور مستقیم 30% الی 50% افت بیلیروبین دارد که عمدتاً مربوط به تشکیل فتوبیلیروبین میباشد که در اندازهگیری به عنوان بیلیروبین کنژوگه اندازهگیری میشوند، لذا سرم نور خورده باعث کاهش بیلیروبین توتال و غیرکنژوگه و افزایش مختصر بیلیروبین غیرکنژوگه میگردد. بیلیروبین سرم در شرایط تاریکی (دور از نور) سه ساعت در حرارت اطاق و 12 ساعت در یخچال پایدار است. روش ديازو به شدت به هموليز حساس است و منجر به نتايج منفي كاذب در بيليروبين ميگردد (خصوصاً در روشهاي نمونهگيري از كف پاي نوزادان كه احتمال هموليز نمونه بالا است). سرم لیپمیک باعث افزایش کاذب بیلیروبین میگردد.
داروهای افزایشدهنده بیلیروبین: آلوپورینول/ اسید اسکوربیک/ کدئین/ متیل دوپا/ قرص ضد بارداری/ داروي ضد مالاریا/ استروئیدها
آزمایش کیفی ارلیخ (غربالگری اوروبیلینوژن در ادرار):
معرف ارلیخ: 10 گرم پارادیمتیل آمینوبنزآلدئید + 75 میلیلیتر اسیدکلریدریک غلیظ+ 75 میلیلیتر آب مقطر
روش انجام آزمایش:
- 10 میلیلیتر ادرار تازه را در یک لوله تمیز بریزید.
- یک میلیلیتر معرف ارلیخ اضافه کرده مخلوط کنید.
- پس از 5-3 دقیقه، تغییر رنگ در صورت وجود اروبیلینوژن مشاهده خواهد شد.
- گزارش بر اساس تغییر رنگ قرمز از Trace تا +4 خواهد بود.
بررسی کیفی بیلیروبین در ادرار:
- 2 میکرولیتر ادرار تازه و شفاف را داخل یک لوله شیشهای تمیز بریزید.
- 3-2 قطره لوگل به آرامی از جدار لوله به آن اضافه کنید.
- پس از 5-3 دقیقه، وجود بیلیروبین به صورت یک حلقه سبزرنگ در سطح نمونه ادرار آشکار خواهد شد.
- گزارش بر اساس شدت رنگ سبز از Trace تا +4 خواهد بود.
منابع:
1-Tietz Textbook of Clinical Chemistry and Molecular Diadnosis. 2006; 4th Edition.
2- Henrys Clinical Diagnosis and Management by Laboratory Methods. 2007; 21st Edition.
3 – Wendy Aineson and Jean Brickell. Clinical Chemistry; A Laboratory Perspective. 2007; 1st Edition.
4- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
5- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
6- Van Leeuwen AM, Kranpitz TR and Smith L. Laboratory and diagnostic tests with nursing implications. 2006 ; 2nd Edition.
7- Wilson DD. Manual of laboratory and diagnostic tests. 2008.
8-Cavanaugh BM. Nurses manual of laboratory and diagnostic tests. 2003; 4th Edition.
9-Rodwell VW, Bender DA, Botham KM, Kennelly PJ and Weil PA. Harpers illustrated biochemistry. 2015; 30th Edition.
https://medlabnews.ir/%d9%85%d8%b1%d9%88%d8%b1%d9%8a-%d8%a8%d8%b1-%d8%a2%d8%b2%d9%85%d8%a7%d9%8a%d8%b4-%d8%a8%db%8c%d9%84%db%8c%e2%80%8f%d8%b1%d9%88%d8%a8%db%8c%d9%86-bilirubin/
اوروبیلینوژن در ادرار
بیلیروبین : مروری بر آزمایش بیلی روبین(در تب جدید مرورگر باز می شود )
بیلیروبین مستقیم بیشتر از بیلیروبین توتال؟(در تب جدید مرورگر باز می شود )
تفسير آزمايشگاهي و باليني تستهاي كبدي روتين(در تب جدید مرورگر باز می شود )
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام