ایمونوهیستوشیمی
محسن مومنی، دانشجوی کارشناسی ارشد ایمونولوژی، دانشگاه علوم پزشکی مشهد
چکیده:
ایمونوهیستوشیمی (IHC)[1] یک تکنیک اساسی است که در بسیاری از آزمایشگاهها برای اهداف تشخیصی و پژوهشی استفاده میشود. در دهههای اخیر، توانایی تشخیص آنتیژنها در مقاطع بافتی به طور چشمگیری افزایش پیدا کرده است (1). ایمونوهیستوشیمی (IHC) یک مکمل رایج در پاتولوژی، جهت تشخیص مرفولوژی (شکلشناسی)، تحقیقات پاتولوژی و مطالعه فرآیند پاتوژنز بیماریها میباشد (2). تفسیر مناسب یک سنجش ایمونوهیستوشیمی از اهمیت بالایی برخوردار است. در این بررسی ما یک نمای کلی از جنبههای فنی ایمونوهیستوشیمی شامل آنهایی که مربوط به آنتیبادی (Ab)[2] و آنتیژن (Ag)[3]، روشهای تشخیصی، فیکساسیون و بازیابی آنتیژن (AR)[4] میباشند، را ارائه میدهیم.
کلید واژهها: آنتیبادیها، آنتیژنها، روشهای تشخیصی، فیکساسیون، بازآرایی آنتیژن، ایمونوهیستوشیمی.
مقدمه:
ایمونوهیستوشیمی (IHC) ترکیبی از تکنیکهای ایمونولوژی، بافتشناسی و بیوشیمیایی است که برای تشخیص اختصاصی اجزای (آنتیژنهای پروتئینی) بافتها، بواسطه آنتیبادیهای کنژوگه شده از طریق یک واکنش آنتیژن- آنتیبادی، استفاده میشود (1). تا سال 1941 تشخیص آنتیژنها در سطوح بافتی امکانپذیر نبود، و در این سال Dr. Albert Coons ابتدا این تکنیک ایمونوفلورسانس را مطرح، و سپس آنرا اجرایی کرد. در دهههای اخیر توانایی تشخیص آنتیژنها در برشهای بافتی به سرعت بهبود و افزایش یافته است (1,2). ایمونوهیستوشیمی (IHC) یک تکنیک رنگآمیزی است که برای اندازهگیری کمی و کیفی میزان بیان آنتیژنهای پروتئینی در نمونههای بیولوژیک و بافتی، بواسطه اتصال آنتیبادی اختصاصی به آنتیژن هدف، کاربرد دارد (3). در واقع ایمونوهیستوشیمی یک تکنیک اساسی میباشد، که در بسیاری از آزمایشگاههای دامپزشکی جهت اهداف تشخیصی و پژوهشی مورد استفاده قرار میگیرد. این تکنیک به طور وسیعی در تشخیص ایمونوفنوتیپینگ تومورها در پاتولوژی کاربرد دارد.
ارزیابی ژنهای اختصاصی بافتها از طریق ایمونوهیستوشیمی، به طور قابل ملاحظهای در طبقهبندی تومورها در هر یک از مراحل تشخیصی نقش دارد (4).
اصول ایمونوهیستوشیمی (IHC Principle):
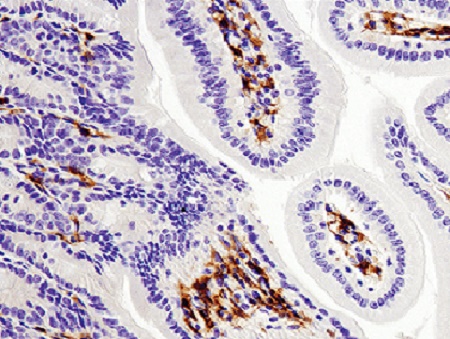
اصل ایمونوهیستوشیمی، ردیابی آنتیژنها در برشهای بافتی با استفاده از آنتیبادیهای کنژوگه شده با مواد فلوروسنت، آنزیمها و عناصر رادیواکتیو میباشد. بعد از اتصال آنتیبادی کنژوگه شده به آنتیژن هدف در سطح بافت و تولید یک محصول رنگی طی واکنش هیستوشیمی[5](رنگزا)، با میکروسکوپ نوری یا میکروسکوپ فلوروکروم و با نور ماوراء بنفش (UV)[6] میتوان محصول رنگی را که در واقع محل بیان آنتیژن موردنظر است، تشخیص داد (1,5).
آنتیبادی و آنتیژنها در ایمونوهیستوشیمی (Ab and Ag in the IHC):
- آنتیبادی: تولید آنتیبادی (Ab) اختصاصی برای تکنیک IHC، از طریق تزریق مکرر آنتیژنها (پروتئینی، گلیکوپروتئینی، پروتئوگلیکانی و بعضی پلیساکاریدها) به حیوان آزمایشگاهی و تحریک سیستم ایمنی حیوان و تمایز لنفوسیتهای B به پلاسماسلهای تولیدکننده آنتیبادی، انجام میشود. رایجترین آنتیبادیهای مورد استفاده در ایمونوهیستوشیمی از کلاس IgG میباشد و IgM کمتر استفاده میشود (4). آنتیبادیهای پلیکلونال در گونههای مختلف حیوانات تولید میشوند. Abهای پلیکلونال میل ترکیبی بیشتر و واکنش گستردهتری دارند، ولی اختصاصیت کمتری نسبت به Abهای مونوکلونال برای Ag هدف دارند. آنتیسرمهای پلیکلونال نه تنها دارای چندین Ab برای Ag هدف میباشند، بلکه Abهای غیراختصاصی نیز در غلظتهای بالا وجود دارد (3,6).
- مزیت Abهای پلیکلونال نسبت به مونوکلونال در این است که آنها میتوانند چندین اپیتوپ از Ag پروتئینی هدف را شناسایی کنند. Abها داری یک بخش Fc[7] که توسط انتهای C- ترمینال زنجیرههای سنگین ایجاد میشود و دو بخش [8]Fab که توسط انتهای N- ترمینال هر دو زنجیره سبک و سنگین ایجاد میگردد، میباشند. بخش Fc آنتیبادیها در IHC، مسئول رنگآمیزی پسزمینه ناشی از اتصالات غیر ایمن Abها به برشهای بافتی میباشد، بنابراین فقط بخش Fab آنتیبادیها برای IHC استفاده میشود (2). این آنتیبادیها زمانی در واکنش رنگآمیزی IHC قابل رؤیت میباشند که کنژوگه شوند. کنژوگاسیونهای رایج Abها در IHC، فلوروکرومها (رودامین، فلورسین)، یک سری آنزیمهای پایدار مانند آلکالن فسفاتاز (ALP)، پروکسیداز و گلوکزاکسیداز و ویتامین بیوتین میباشند. (7)
- آنتیژن: اکثر آنتیژنهایی که برای تشخیص توسط تکنیک ایمونوهیستوشیمی استفاده میشوند، از نوع پروتئینی، گلیکوپروتئینی و پروتئوگلیکانی میباشند. آنتیژنها میتوانند ایزوفرمهای متفاوت داشته باشند. یک ژن خاص میتواند ایزوفرمهای مختلف از پروتئینها را کد کند (7). منبع این آنتیژنها برای کسب بهترین کیفیت ایمونوهیستوشیمی بسیار مهم است. دو گروه بزرگ از این آنتیژنها (ایمونوژن) برای IHC وجود دارد: پپتیدهای مصنوعی و پروتئینهای خاص.
روشهای انجام تکنیک رنگآمیزی ایمونوهیستوشیمی (Detection Systems):
برای قابل رؤیتسازی واکنش Ag-Ab از کنژوگههایی (reporter moleculs) استفاده میکنند که به آنتیبادیها متصل میشود و در حضور یک سوبسترای اختصاصی (مثل پراکسید هیدروژن) و کروموژن (مثل دیآمینوبنزیدین DAB[9])، یک محصول رنگی تولید میکند که در محل واکنش Ag-Ab رسوب میکند و زیر میکروسکوپ فلوروکروم با نور UV میتوان آن را قابل رؤیت کرد (7,8). این تکنیک با روشهای مختلفی انجام میشود که دو روش عمده آن شامل:
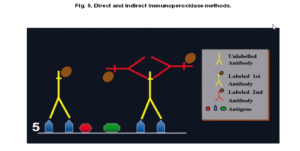
- روش مستقیم (direct method): یک واکنش رنگآمیزی ایمونوهیستوشیمی یک مرحلهای است. در این روش Ab اولیه (primary Ab) که کنژوگه میباشد، به طور مستقیم با Agهای مقطع بافتی واکنش میدهد. در این روش فقط از یک Ab استفاده میشود، در نتیجه بسیار ساده و سریع است ولی حساسیت (sensitivity) کافی را جهت تشخیص اکثر Agها در بافت ندارد (1,9).
- روش غیرمستقیم (indirect method): یک واکنش رنگآمیزی ایمونوهیستوشیمی دو مرحلهای میباشد. در این روش ابتدا Ab اولیه (first layer) بصورت غیرکنژوگه به Ag هدف در سطح بافت متصل میشود و سپس Ab ثانویه (second layer) کنژوگه شده، به بخش Fc آنتیبادی اولیه متصل میگردد. حساسیت این روش نسبت به روش مستقیم بسیار بیشتر است (2,9) که دو دلیل عمده دارد:
1) Ab اولیه غیرکنژوگه سبب حفظ فعالیت و در نتیجه تقویت سیگنال منتقله میشود (اتصال چندین Ab نسبت به يك Ab سبب تقویت سیگنال میگردد).
2) تعدادی از لیبلها (labels) مثل پروکسیداز در حضور Ab اولیه سبب افزایش شدت واکنش میشوند. این روش نسبت به روش مستقیم راحتتر است، بدلیل اینکه از همان Ab ثانویه میتوان برای تشخیص Abهای اولیه متفاوت در همان گونه استفاده کرد (5).
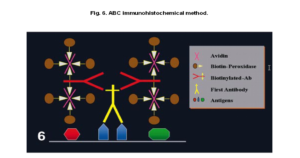
2-1) روش آویدین- بیوتین: یکی از روشهای غیرمستقیم است. آویدین یک گلیکوپروتئین بزرگ سفیده تخم مرغ است، که چهار جایگاه اتصال با میل پیوندی بالا برای ویتامین بیوتین را دارد. بیوتین قابلیت اتصال به Ab اولیه در روش مستقیم و همچنین Ab ثانویه در روش غیرمستقیم را دارد (2,9). بیوتین دارای یک جایگاه اتصال برای آويدين است و از طریق جایگاههای دیگر میتواند به Abها یا مولکولهای دیگر(آنزيمها) متصل گردد. در روش غیرمستقیم بیوتین با اتصال به Ab ثانویه از یک جایگاه، از طرف دیگر با افینیتی بالا با مولکول آویدین تشکیل کمپلکس میدهد.
این کمپلکس به لیبلهای مناسب متصل میشود. يكي از رايجترين روشهاي آويدين- بيوتين تشكيل كمپلكس آويدين- بيوتين (ABC) ميباشد. در اين مورد آنتيبادي ثانويه بيوتينه است و معرف سوم يك كمپلكسي از آويدين مخلوط با بيوتين متصل به ليبلهاي مناسب مثل آنزيمها ميباشد. يكي از معايب سيستم آويدن- بيوتين امكان رنگآميزي پسزمينه به ميزان زياد است. آويدين با اتصال به لكتين گروههاي كربوهيدراتي بافتها و اتصالات الكترواستاتيك در ايجاد رنگ پسزمينه نقش دارد (1).
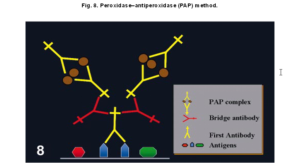
2-2) روش پراكسيداز- آنتيپراكسيداز(PAP): روش PAP يكي ديگر از روشهاي غيرمستقيم است كه از سه لايه تشكيل شده است. لايه سوم در روش PAP همان آنتيبادي اوليه خرگوشي ميباشد كه همراه پروكسيداز تشكيل كمپلكس پروكسيداز- آنتيپروكسيداز ميدهند. اين كمپلكس از دو مولكول IgG خرگوشي به همراه سه مولكول پروكسيداز تشكيل شده است. لايه اول و سوم توسط يك Ab ضدخرگوشي بهم متصل ميشوند. حساسيت اين روش 100 تا 1000 برابر بيشتر از روش غيرمستقيم دو مرحلهاي است (1,3).
بافتهایی که برای تکنیک رنگآمیزی ایمونوهیستوشیمی استفاده میشوند:
- رنگآمیزی بافتهای آغشته به پارافین (Paraffin Embeded Tissue): اکثر رنگآمیزیهای ایمونوهیستوشیمی در آزمایشگاههای پاتولوژی و فارماکولوژی، روی بافتهای پارافینه انجام میشود و بیشتر پروتکلهای ایمونوهیستوشیمی مربوط به بافتهای پارافینه میباشد (6).
- رنگآمیزی بافتهای منجمد شده (frozen tissue): رنگآمیزی ایمونوهیستوشیمی بافتهای منجمد کمتر استفاده میشود و نکته مهم این روش فیکس کردن سریع و انجماد سریع بافتها بدون تماس با هوای بیرون است (6).
مراحل کلی رنگآمیزی ایمونوهیستوشیمی بافتهای پارافینه:
1– تولید آنتیبادی مناسب اختصاصی آنتیژن: از طریق تزریق مکرر آنتیژن هدف به حیوان و تحریک سیستم ایمنی تولید میشود.
2– استخراج و گرفتن بافت مورد هدف و فیکس کردن آن: گرفتن نمونه بافتی و قرار دادن آن در فیکساتور مناسب.
3- مراحل پردازش بافتی (tissue processing): شامل الکل صعودی (از 70 تا 100) و آبگیری بافت هدف و تشکیل بلوکهای پارافینی
4- برش بافت پارافینی و تهیه لام: برش بافت پارافینی نوسط دستگاه میکروتوم انجام میگیرد و برش بافتی بعد از قرار گرفتن در حمام آب گرم (دستگاه واتربس)[10] روی لام گذاشته میشود.
5– پارافینزدایی و بازآرایی آنتیژن: پارافینزدایی با قرار دادن برشهای بافتی روی حمام آب گرم انجام میشود.
6– تیمار لامها با آنتیبادی و وآمادهسازی معرفهای رنگزا: در این مرحله آنتیبادیها را روی لامی که برش بافتی روی آن قرار دارد، رها میکنیم و معرفهای کنژوگه و سوبسترا و کروموژن را به آن اضافه میکنیم.
7– بررسی میکروسکوپی لامهای رنگآمیزی شده: بعد از رنگآمیزی لامها با استفاده از میکروسکوپ فلوروکروم با نور UV، برش بافتی و موقعیت آنتیژن را در بافت بررسی میکنیم.
پروتکلهای عمومی ایمونوهیستوشیمی: (General Immunohistochemistry Protocol)
پروتکلهای عمومی ایمونوهیستوشیمی شامل تمام مراحل انجام فرآیند رنگآمیزی ایمونوهیستوشیمی، از گرفتن نمونه بافتی از بیمار تا مرحله انتهایی و بررسی میکروسکوپی برشهای بافتی رنگآمیزی شده، میباشد و شامل مراحل ذیل است (1,2):
A: مرحله Pre analytic: این مرحله شامل گرفتن نمونه بافتی از بیمار و اقدامات اولیه روی نمونه میباشد که عبارتند از:
1- فیکساسیون (Fixation): فیکساسیون بافت به چند دلیل ضرورت دارد:a ) حفظ اجزای سلول شامل پروتئینهای محلول و ساختاری. b) جلوگیری از اتولیز و جابجایی اجزای سلول شامل آنتیژنها و آنزیمها. c) تثبیت مواد سلولی در برابر اثرات مخرب مواد و اجزاء روش انجام کار. d) تسهیل رنگآمیزی معمولی و ایمونوهیستوشیمی (1).
برای رنگآمیزیهای ایمونوهیستوشیمی عموماً از فیکساتورهای شیمیایی استفاده میشود که رایجترین این فیکساتورها فرمالین میباشد. فرمالدهید[11] بعنوان فیکساتور gold standard، برای هیستولوژی معمولی و ایمونوهیستوشیمی استفاده میشود. فرمالدهید سبب حفظ عمده پپتیدها و ساختار کلی اندامکهای سلولی میشود (10). فرآیند فیکساسیون با فرمالدهید یک فرآیند سه مرحلهای شامل نفوذ، پیوند کووالانسی و اتصال متقابل میباشد. فیکساسیون در 37 درجه سریعتر از 25 درجه انجام میشود. فیکساتور مناسبتر از فرمالدهید برای ایمونوهیستوشیمی وجود ندارد. معمولاً فیکساتور جایگزین فرمالدهید الکل است. فیکساتور کارنوی یک مخلوطی از الکل، اسید استیک و کلروفرم است که برای تشخیص برخی آنتیژنها در IHC از فرمالدهید بهتر است.
2- کلسیمزدایی (Decacification): کلسیمزدایی بافت فیکس شده معمولاً با اسید ضعیف انجام میشود و به نظر نمیرسد برای اکثر آنتیژنها در ایمونوهیستوشیمی مداخله داشته باشد. ولی کلسیمزدایی بافت فیکس شده با اسید قوی اثرات منفی برای حداقل تعداد کمی از آنتیژنها در ایمونوهیستوشیمی دارد (1,2,10).
3- پردازش بافت و انکوباسیون بافرها (Tissue Processing and Incubation Buffers): اگرچه فیکساسیون در تعیین نتیجه واکنش آنتیژن و آنتیبادی نقش دارد، بافر و پردازش بافت ممکن است اثر آنتیژنسیته برخی پروتئینها را تغییر دهد. واكنش آنتيژن- آنتي بادي در ايمونوهيستوشيمي در PH بافر بين 6/5 تا 8/5 انجام ميشود. معمولاً واكنش آنتيبادي- آنتيژن در بافر سالين فسفات (PBS) بهتر از بافر Tris ميباشد (3).
4- خشك كردن و برشهای بافتي (Drying of Paraffin Sectioning): نمونه بافتي مربوطه در قالبهاي پارافيني قرار گرفته و بعد از بستن پارافين در دماي يخچال، از اين بلوكههاي پارافيني توسط دستگاه ميكروتوم برشهاي چند سانتي از نمونه موردنظر ايجاد ميشود.
B: مرحله analytic: اين مرحله شامل موارد زير است:
- بازيابي آنتيژن (Antigen Retrieval): فرآيند فيكساسيون سبب تغيير در ساختار سوم پروتئينها (Ag) ميشود و تشخيص آنها بواسطه آنتيباديهاي اختصاصي غيرممكن ميشود (7). يكي از چالشهاي ايمونوهيستوشيمي براي توسعه روشها، تغييرات معكوس توليد شده در طي فيكساسيون ميباشد. حدود 85 درصد آنتيژنهاي فيكس شده در فرمالين براي بهينهسازي واكنش ايمني، نياز به نوعي بازآرايي آنتيژن (AR) دارند (1,11). نياز به بازآرايي آنتيژن، علاوه بر بررسي ميزان Ag، به Ab هم وابسته است. در غياب بازآرايي آنتيژن، Abهاي پليكلونال نسبت به Ab مونوكلونال بيشتر Ag را تشخيص ميدهند.
- دو روش عمده بازآرايي آنتيژن در ايمونوهيستوشيمي استفاده ميشود؛ يكي بازآرايي بواسطه آنزيمها و ديگري توسط حرارت ميباشد. بازآرايي اپيتوپ القاء شده توسط آنزيم پروتئاز (PIER) اولين با توسط هوانگ (Huang) معرفي شد (1,11,12). AR بواسطه چندين آنزيم از جمله تريپسين، پروتئيناز K، فيسين و پپسين انجام ميشود. بازآرايي اپيتوپ القاء شده با حرارت (HIER) از روشهاي مهم ايمونوهيستوشيمي در تشخيص آنتيژنهاي فيكس شده در فيكساتور فرمالدهيد ميباشد. روش HIER ابتدا توسط شي (Shi) و همكاران گزارش شد (12).
- بلاك كردن جايگاههاي غيراختصاصي: معمولاً براي بلاك كردن سايتهاي غيراختصاصي روی برش بافتي تهيه شده، از سرم نرمال 10 درصد استفاده ميكنند تا Abها به جايگاههاي غيراختصاصي متصل نشوند (1,5).
C: مرحله Post analytic: اين مرحله شامل موارد زير ميباشد:
- اعتبارسنجي روش (Assay Validation): در واقع اعتبارسنجي فرآيندي است جهت تأييد مناسب بودن روش مورد استفاده، توسعه آن، بهينهسازي و استاندارد كردن براي يك هدف خاص (13). اعتبارسنجي، ارزيابي عملكرد تحليلي و تشخيصي انجام گرفته در آزمون ميباشد. اعتبارسنجي تست ايمونوهيستوشيمي بايد با تكرارپذيري همراه با حساسيت و اختصاصيت بالا باشد (9,13).
- كنترلهاي ايمونوهيستوشيمي (Controls in Immunohistochemistry): شامل كنترل اختصاصيت روش و اختصاصيت آنتيباديهاي مورد استفاده جهت تشخيص آنتيژن هدف ميباشد (9,13).
- كنترل اختصاصيت روش شامل كنترل بافت مورد نظر، معرفها، آنتيباديهاي اوليه و ثانويه و آنزيمهاي كنژوگه ميباشد. همچنين از نمونه كنترل مثبت و منفي درايمونوهيستوشيمي استفاده ميشود (2,13).كنترل مثبت در واقع يك بافت شناخته شده با آنتيژنهاي هدف مشخص است، كه توسط تكنيك رنگآميزي ايمونوهيستوشيمي تعيين شده است. بافت كنترل مثبت، آنتيبادي اوليه را ارزيابي ميكند. همچنين در تكنيك ايمونوهيستوشيمي از يك كنترل منفي كه بافت فاقد آنتيژن موردنظر ميباشد استفاده ميگردد (9,13).
- ارزيابي كيفيت و كنترل كيفي (Quality Assurance/Quality Control): آزمايشگاه ايمونوهيستوشيمي موظف به رعايت استانداردهاي ارائه شده توسط آزمايشگاههاي باليني بهبود كيفيت ميباشد. آزمايشگاه ايمونوهيستوشيمي دامپزشكي توسط انجمن دامپزشكي آزمايشگاهيان آمريكا كنترل ميشود (9,13,14).
کاربردهای ایمونوهیستوشیمی:(1,3)
- تشخیص و درمان تومورها و سلولهای سرطان
- تشخیص فرآیند تمایز بافتها از طریق شناسایی مارکرهای سطحی
- در تحقیقات و پژوهشها در زمينه پزشكي و دامپزشكي
- در تشخیص سرطانهای اولیه ناشناخته (CUP)[12]
منابع:
- Ramos-Vara J. Technical aspects of immunohistochemistry. Veterinary Pathology Online. 2005;42(4):405-26.
- Ramos-Vara J, Miller M. When Tissue Antigens and Antibodies Get Along Revisiting the Technical Aspects of Immunohistochemistry—The Red, Brown, and Blue Technique. Veterinary Pathology Online. 2014;51(1):42-87.
- Miller RT, Kubier P. Immunohistochemistry on cytologic specimens and previously stained slides (when no paraffin block is available). Journal of Histotechnology. 2002;25(4):251-7.
- Furuya T, Ikemoto K, Kawauchi S, Oga A, Tsunoda Si, Hirano T, et al. A novel technology allowing immunohistochemical staining of a tissue section with 50 different antibodies in a single experiment. Journal of Histochemistry & Cytochemistry. 2004;52(2):205-10.
- Ward J, Rehg J. Rodent Immunohistochemistry Pitfalls and Troubleshooting. Veterinary Pathology Online. 2013:0300985813503571.
- Bendayan M. Possibilities of false immunocytochemical results generated by the use of monoclonal antibodies: the example of the anti-proinsulin antibody. Journal of Histochemistry & Cytochemistry. 1995;43(9):881-6.
- Shi S-R, Shi Y, Taylor CR. Antigen retrieval immunohistochemistry review and future prospects in research and diagnosis over two decades. Journal of Histochemistry & Cytochemistry. 2011;59(1):13-32.
- Koch S, Stappenbeck N, Cornelissen CG, Flanagan TC, Mela P, Sachweh J, et al. Tissue engineering: selecting the optimal fixative for immunohistochemistry. Tissue Engineering Part C: Methods. 2012;18(12):976-83.
- Fritz K. Method for making multitissue control blocks. Journal of Histotechnology. 2010;33(1):49-51.
- Ramos-Vara JA, Beissenherz ME. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 2000;12(4):307-11.
- Fowler CB, Evers DL, O’Leary TJ, Mason JT. Antigen Retrieval Causes Protein Unfolding Evidence for a Linear Epitope Model of Recovered Immunoreactivity. Journal of Histochemistry & Cytochemistry. 2011;59(4):366-81.
- Boenisch T. Heat-induced antigen retrieval restores electrostatic forces: prolonging the antibody incubation as an alternative. Applied Immunohistochemistry & Molecular Morphology. 2002;10(4):363-7.
- Hewitt SM, Takikita M, Abedi‐Ardekani B, Kris Y, Bexfield K, Braunschweig T, et al. Validation of proteomic‐based discovery with tissue microarrays. PROTEOMICS-Clinical Applications. 2008;2(10‐11):1460-6.
- Bogen SA, Vani K, McGraw B, Federico V, Habib I, Zeheb R. Experimental validation of peptide immunohistochemistry controls. Applied immunohistochemistry & molecular morphology: AIMM/official publication of the Society for Applied Immunohistochemistry. 2009;17(3):239.7
[1] -Immunohistochemistry
[2] -Antibody
[3] -Antigen
[4] -Antigen Retrival
[5]– Histochemistry
[6] -Ultra Violet
[7] -Fragment Crystalization
[8] -Fragment antigen binding
[9] -Diaminobenzidine
[10] -Water bath
[11] -Formaldehyde
[12] -Carcinoma of Unknown Primary
https://www.cancer.gov/publications/dictionaries/cancer-terms/def/immunohistochemistry
https://www.sciencedirect.com/topics/medicine-and-dentistry/immunohistochemistry
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3467869/
https://medlabnews.ir/wp-admin/post.php?post=14550&action=edit
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام

سلام خسته نباشید میخواستم بدونم چرا بافت بعد از مرحله حرارت دهی روی لام باقی نمیمونه؟تقریبا ۸۰درصد بافتها از بین میرن،روش فیکس بافت روی لام رو ممنون میشم بهم بگین
ممنون میشم پاسخ رو برام ایمیل کنید