ارزیابی آزمایشگاهی اختلالات عملکرد پلاکت
(بخش دوم)
اکبر درگلاله1، حسن مروتی2
1: گروه هماتولوژی و طب انتقال خون، دانشگاه علوم پزشکی ایران2
2: مرکز تحقیقات واکسن و سرمسازی رازی
- ارزیابی ترشح پلاکتی
بیش از 90% تمام اختلالات ارثی پلاکت مرتبط با اختلال در ترشح پلاکتی است؛ بنابراین مطالعات آزادسازی گرانولهای پلاکت از اهمیت خاصی در تشخیص بیماران با تظاهرات خونریزیدهنده برخوردار است (16).
ترشح گرانولهای پلاکتی به مسیر پیامدهی بستگی دارد و با برهمکنش یک آگونیست با گیرنده اختصاصی خود بر سطح پلاکتها شروع میشود. این مسیر منجر به تغییر در سطوح پیامبرهای ثانویه داخل سلولی مانند یون Ca2++، IP3 و DAG میشود. این تغییرات باعث تغییر ساختار اسکلت سلولی و در نهایت فیوژن گرانولها با غشای سطحی پلاکت و آزادسازی محتویات آنها میگردد. در صورتی که هر مرحله از این فرایند دچار اختلال شود، نتایج مطالعات ترشح پلاکتی غیرطبیعی خواهد بود. چندین روش آزمایشگاهی بهمنظور بررسی آزادسازی گرانولهای پلاکتی ایجاد شده است. این روشها ممکن است ترشح پلاکتی را بهعنوان بخشی از پاسخ پلاکتها به آگونیستها بررسی کنند یا ممکن است به محتویات خاص گرانولی محدود شوند.
3-1- مطالعات آزمایشگاهی آزادسازی گرانولهای آلفا
گرانولهای آلفای پلاکت حاوی محتویات بسیار متنوعی است که بهصورت محلول یا متصل به غشا هستند. بهمنظور ارزیابی ترشح گرانولهای آلفا، مقادیر محتویات محلول پلاکت بهویژه PF4 و β-TG که اختصاصیت بالایی برای پلاکتها دارند، ممکن است متعاقب فعالیت پلاکتها بررسی شوند. فیوژن یا ادغام غشای گرانول با غشای پلاسمایی پلاکت در طی ترشح گرانول منجر به نمایان شدن پروتئینهای متصـــــــــل به غشا مانند P- سلکتین میشود که میتواند بهعنوان یک شاخص جایگزین آزادسازی گرانول مورد بررسی قرار گیرد (16).
- ارزیابی سطوح PF4 و β-TG
PF4 و β-TG به خانواده کموکاین CXC تعلق داشته و به میزان قابلتوجهی توسط مگاکاریوسیتها تولید میشوند. این پروتئینها با غلظت بیش از μg 0/5 به ازای هر پلاکت در گرانولهای آلفا ذخیره میشوند و متعاقب فعال شدن پلاکت از گرانولها ترشح میگردند. در قدیم از روش رادیوایمونواسی برای اندازهگیری مقادیر PF4 و β-TG استفاده میکردند (17) اما مدتهاست که از این روش استفاده نمیشود (18).
امروزه معمولاً از روش الایزا بدین منظور استفاده میشود. ارزیابی مقادیر PF4 و β-TG به روش الایزای ساندویچی انجام میشود که از مزایای آن استفاده از دو آنتیبادی اختصاصی علیه آنتیژن است. آنتیبادی اول بر سطح پلیت الایزا کوت میشود و آنتیبادی گیرنده[1] نام دارد، در حالیکه آنتیبادی ثانویه کونژوگه بوده و تحت عنوان آنتیبادی شناساگر[2] نامیده میشود. آنتیبادی ثانویه بهصورت معرف تهیه شده است و پس از افزوده شدن نمونه به پلیت اضافه خواهد شد. کیتهای الایزای مختلفی جهت ارزیابی سطوح PF4 و β-TG بهصورت تجاری موجود است.
- ارزیابی P– سلکتین سطحی پلاکت
P- سلکتین، یک پروتئین غشایی گرانولهای آلفای پلاکتها است. وجود P- سلکتین بر سطح پلاکتها میتواند نشاندهنده آزادسازی گرانولهای آلفا باشد. P- سلکتین بهصورت محلول نیز وجود دارد و ممکن است توسط پلاکت، سلولهای اندوتلیال یا سایر بافتها تولید شود؛ بنابراین پروتئین اختصاصی پلاکت محسوب نمیشود.
P- سلکتین سطحی پلاکت با استفاده از آنتیبادی مونوکلونال اختصاصی توسط فلوسیتومتری مورد بررسی قرار میگیرد. فلوسیتومتری معمولاً یک روش نیمه کمی است که در آن شمار پلاکتهای P- سلکتین مثبت، قبل و بعد از افزودن یک آگونیست با یکدیگر ارزیابی و مقایسه میشود. این آزمایش یک روش حساس و بسیار مؤثر است اما نیاز به تکنسین آموزشدیده و ماهر دارد (16).
3-2- مطالعات آزمایشگاهی آزادسازی گرانولهای دلتا
3-2-1- اندازهگیری نوکلئوتیدهای آدنین
نوکلئوتیدهای آدنین شامل آدنوزین تری فسفات (ATP) و آدنوزین دی فسفات (ADP) ترکیبات مهم گرانولهای دلتا پلاکتی هستند و همچنین در سیتوپلاسم پلاکت بهصورت مواد متابولیکی فعال نیز حضور دارند. غلظت تامATP و ADP پلاکتی به ترتیب 6- 5 میکرومول و 3/5- 3 میکرومول به ازای 1011 پلاکت است و نسبت ATP/ADP حدود 1/5 تا 2/0 است. دو سوم از کل محتویات در گرانولهای دلتا ذخیره شده اما نسبت ATP/ADP ذخیرهشده حدود 0/78- 0/65 است. در کمبود منبع ذخیرهای دلتا نسبت ATP/ADP به بیش از 2 و معمولاً به بیش از 4 افزایش مییابد (16).
روشهای متعددی برای اندازهگیری نوکلئوتیدهای آدنین ایجاد شده است؛ شامل لومینومتری، لومیاگریگومتری[3] پلاسمای غنی از پلاکت (PRP)[4] یا خون تام و HPLC–فلورومتریک.
- لومینومتری
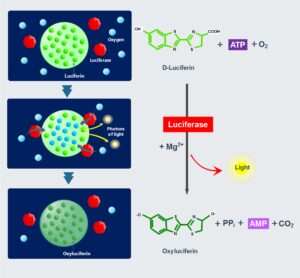
این روش بر اساس قابلیت ATP بهعنوان یک کوفاکتور برای معرف لوسیفرین- لوسیفراز عمل میکند. لوسیفراز یک آنزیم تولیدکننده بیولومینسنس با اختصاصیت بالا برای ATP است. در این آزمون، اضافه کردن آگونیست منجر به ترشح و آزادسازی ATP از گرانول دلتا میشود که سپس با لوسیفرین- لوسیفراز واکنش میدهد (کادر 4).
| کادر 4- اساس لومینومتری
این واکنش در دو مرحله رخ میدهد که هردو توسط لوسیفراز کاتالیز شده و منجر به دکربوکسیلاسیون اکسیداتیو لوسیفرین و تولید اکسی لوسیفرین و آدنوزین مونو فسفات (AMP) بهعنوان محصولات نهایی میشود. اکسی لوسیفرین محصول بسیار ناپایداری است که فوراً طی فرآیندی که به تولید نور منتهی میشود، به حالت پایدار تبدیل میگردد (شکل 6). سپس میزان نور ساطعشده که متناسب با غلظت ATP است، بهوسیله لومینومتر اندازهگیری میشود. با استفاده از مقادیر استاندارد ATP باید آزمون را کالیبره کرد .(19) Luciferin + ATP + Mg++ → luciferyladenylate + polymerase pyrophosphate (Ppi) Luciferyladenylate + O2 → oxyluciferin + AMP + CO2 + light شکل 6- مکانیسم بیولومینسنس لوسیفرین- لوسیفراز. لوسیفراز تبدیل لوسیفرین به اکسی لوسیفرین را در حضور اکسیژن کاتالیز میکند. این واکنش به ATP و Mg2+ بهعنوان کوفاکتور نیاز دارد و در نهایت منجر به ساطع شدن نور میشود که با میزان ATP متناسب است |
- لومیاگریگومتری
لومیاگریگومتری ترکیبی از اگریگومتری عبور نور (LTA)[5] و بیولومینسنس برای اندازهگیری همزمان تجمع پلاکتی و ترشح نوکلئوتیدهای آدنین از گرانولهای دلتا پلاکت است (20). نمونه موردنیاز ممکن است خون تام (لومیاگریگومتری امپدانس خون تام) یا PRP (لومیاگریگومتری PRP) باشد. با توجه به مقالات، نتایج لومیاگریگومتری در توافق نزدیک با نتایج بهدستآمده از اگریگومتری PRP است (21).
- HPLC– فلورومتریک
کروماتوگرافی مایع با توان بالا تکنیک دیگری است که میتواند برای اندازهگیری نوکلئوتیدهای آدنین، عمدتاً از طریق شناسایی فلورومتریک، مورد استفاده قرار گیرد. این روش دارای حساسیت، اختصاصیت و دقت بالایی است اما دارای محدودیتهای خاص خود مانند نیاز به کاربر متخصص و همچنین تجهیزات گرانقیمت است (16).
3-2-2- سنجش سروتونین (5-HT)
سروتونین که با نام 5-هیدروکسی تریپتامین (5-HT)[6] نیز شناخته میشود دارای نقشهای متعددی است که یکی از آنها القای تجمع پلاکتی است. سروتونین در پلاسما و گرانولهای دلتا پلاکتی یافت میشود که سروتونین پلاکتی از پلاسما جذب شده است. از آنجا که بیماران مبتلا به HPS دارای نقص در گرانولهای متراکم هستند، پلاکتهای این بیماران حاوی میزان کمتری از سروتونین در مقایسه با پلاکتهای نرمال هستند.
روشهای متعددی برای آنالیز سروتونین وجود دارد؛ شامل:
جذب و آزادسازی 14C یا 3H-5-HT از پلاکت، شناسایی فلورومتـــــــــریک o-phthalaldehyde (OPT)-5-HT، 5-HT ELISA، 5-HT ایمونوفلورسانس با فلوسایتومتری، HPLC-فلورومتریک و کروماتوگرافی مایع- طیفسنجی جرمی متوالی (LC-MS)[7] (22, 23).
روش 14C-5-HT استاندارد طلایی برای ارزیابی 5-HT آزادشده است (نه محتوای گرانولها). در این روش 5-HT رادیواکتیو به PRP افزوده میشود و سپس پلاکتها بهوسیله آگونیستهای رایج، در دوزهای بالاتر از حد معمول پیشنهادی برای LTA، فعال میشوند، سپس درصد 14C آزادشده به پلاسما را اندازهگـــــیری میکنند. روش 14C-5-HT دارای یک سری مزیتها است؛ بهطور مثال سریع، مقرون به صرفه و بهصورت کمی است، اما محدودیتهای خود را نیز دارد. از آنجا که این روش میزان 5-HT آزادشده را میسنجد نه محتوای کلی آن را، پس نمیتواند نقایص گرانول دلتا را از نقص در مکانیسم ترشح افتراق دهد. روش جایگــزین برای اندازهگیری 14C-5-HT آزادشده، استفاده از OPT-5-HT است که بر اساس فلوریمتری است؛ این روش حساسیتی در حد تشخیص غلظتهای پیکومولی دارد. این روش 5-HT پلاکتی تام و ترشحشده را با حساسیتی بالا تشخیص میدهد اما یک روش خودکار نیست (22, 24).
روش دیگر، فلوسایتومتری بهوسیله فلورسنت سبز رنگ مپاکرین[8] (با نام کویناکرین[9] نیز شناخته میشود) است. در این روش پلاکتها با مپاکرین رنگ شده و بعد از تحریک با آگونیست، میتوان مپاکرین را با فلوسایتومتری شناسایی کرد. فلوسایتومتری دارای معایبی همچون ناپدید شدن سریع فلئورسانس، رنگ شدن متغیر پسزمینه و نقطه پایانی نیمه کمی است. ELISA نیز میتواند 5-HT پلاکتی تام و ترشحشده را با حساسیت بالا اندازهگیری کند. HPLC- فلورسنس و LC-MS هردو میتوانند 5-HT تام و ترشحشده را اندازهگیری کنند و برای سنجـش 5-HT بسیار حساس و دقیق هستند، با این حال نیاز به تجهیزات گرانقیمت و کاربران آموزشدیـــده دارند. LC-MS میتواند بهعنوان روش مرجع استفاده شود (22, 25, 26).
1: فلوسیتومتری
در طی دو دهه گذشته، مطالعات ایمونوفنوتایپ نقش مهمی در تشخیص، طبقهبندی و پایش اختلالات هماتولوژیک داشتند. فلوسیتومتری یک روش مؤثر و قابل اعتماد برای شناسایی اختلال پلاکت و وسیلهای سریع و ساده برای تشخیص وضعیتهای هموزیگوت و هتروزیگوت کمبود گلیکوپروتئینهای غشایی پلاکت مانند GT است. (27, 28) تغییر گیرندههای پلاکتی یا تبدیل آنها به سایر مؤلفههای سطحی به دلیل پاسخ به محرکها میتواند توسط فلوسیتومتری با استفاده از آنتیبادیهای مونوکلونال خاص اندازهگیری شود. کمبود گیرندههای پلاکتی نیز با استفاده از این روش قابل شناسایی است (29).
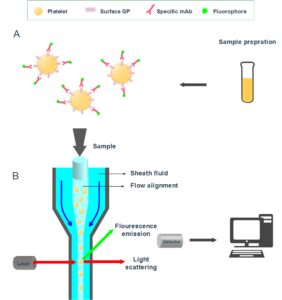
| کادر 5- اساس فلوسیتومتری
فلوسیتومتری ویژگیهای خاص تعداد زیادی سلول را بهصورت جداگانه اندازهگیری میکند. سلولها بهواسطه اتصال به یک آنتیبادی منوکلونال کونژوگه با مواد فلورسنت نشاندار میشوند (شکل A7). سلولهای معلق با سرعت 1000 تا 10000 سلول در دقیقه بهصورت تکی از یک جریان سلولی در دستگاه عبور میکنند. پرتو لیزر به سلولهای کونژوگه فلورسنت برخورد میکند و فلوروکروم را تحریک میکند (شکل B7). خواص پراکنش نور و طولموج انتشار مربوط به هر سلول اندازهگیری میشود. پراکنش مستقیم (FSC) و پراکنش کناری (SSC) برای هر سلول ثبت میشود. FSC بهطور مستقیم اندازه سلول و بهطور غیرمستقیم شفافیت سلول را بررسی میکند. از سوی دیگر SSC، گرانولاریتی سلول را ارزیابی میکند. هر سلول بهصورت یک نقطه در یک نمودار نقطهای[10] نشان داده میشود. برای تشکیل یک نمودار نقطهای دو پارامتر موردنیاز است؛ برای مثال، ما میتوانیم FSC را در محور X و SSC را در محور Y انتخاب کنیم؛ بنابراین، نقطهها بر اساس اندازه سلول و گرانولاریتی در نمودار نقطهای قرار میگیرند. شکل 7 A. آنتیبادیهای منوکلونال کونژوگه با فلورسنت که برای GP سطحی موردنظر اختصاصی هستند به نمونه اضافه میشوند B. تعداد زیادی سلول بهصورت منفرد از یک جریان سلولی عبور میکنند. پرتو لیزر با سلولهای کونژوگهشده برخورد میکند و فلوروکروم را تحریک میکند و اندازهگیریهایی از پراکنش نور (پراکنش مستقیم و کناری) و خواص انتشار فلورسانس انجام میشود |
پلاکتها معمولاً با آنتیبادی مونوکلونال متصل به فلورسئین ایزوتیوسیانات (FITC) و فایکواریترین (PE) کونژوگه میشوند. حدود 5000 تا 10000 پلاکت برای مثبت بودن هر دو فلوروکروم و خواص پراکنش نور بررسی خواهد شد. پلاکتها را میتوان به کمک الگوی پراکنش نوری آنها در خون تام تشخیص داد، با این حال تحت شرایط خاصی از انجام آزمایش، پراکنش نور پلاکت ممکن است شامل برخی از ذرات غیرمتصل به آنتیبادی منوکلونال اختصاصی پلاکت باشد؛ بنابراین، اگر خون تام مورد بررسی قرار میگیرد، توصیه میشود از روش دو رنگ/ دو آنتیبادی استفاده شود؛ یک آنتیبادی مونوکلونال برای تمایز پلاکت (معمولاً FITC کونژوگه) و یکی برای اندازهگیری GP موردنظر (معمولاً PE کونژوگه) (30, 31).
با استفاده از این روش میتوان نمونههای خون تام، پلاسمای غنی از پلاکت (PRP) و پلاکت شستهشده را مطالعه کرد. نوع نمونه باید بر اساس آنتیبادی و آگونیست مورد استفاده در آزمایش تعیین شود. بهطور کلی، خون تام ترجیح داده میشود زیرا پلاکتها در یک محیط فیزیولوژیک با حداقل دستکاری نمونه مورد بررسی قرار میگیرند. دستکاری نمونه میتواند منجر به فعال شدن پلاکتها در محیط آزمایشگاهی و از دست رفتن زیرگروهی از جمعیت پلاکتی شود. برای انجام این آزمایش، نمونه خون بسیار کم و فقط حدود 5 میکرولیتر لازم است و بنابراین روش مناسبی برای مطالعه نوزادان است. فلوسیتومتری قادر به شناسایی زیرگروهی از پلاکتهای فعال در خون تام حتی در مقادیر 1% است (32-36).
فلوسیتومتری در مقایسه با بسیاری از روشهای مورد استفاده برای ارزیابی پلاکت مزایایی دارد؛ این روش امکان اندازهگیری میزان فعال شدن پلاکتهای منفرد را فراهم میکند و جمعیتهای مختلف پلاکتی را از هم افتراق میدهد. اخیراً، کیتهای فلوسیتومتری پلاکت بهصورت تجاری در دسترس قرار گرفتهاند. این کیتها که معرفهای موردنیاز مانند آنتیبادیها و آگونیستها را ارائه میدهند، کاربرد فلوسیتومتری را در آزمایشگاههای انعقادی معمول تسهیل میکنند.
در این روش معایبی نیز وجود دارد که شامل تجهیزات و معرفهای گرانقیمت و آمادهسازی نمونه است؛ همچنین، اپراتور باید حرفهای باشد و نمونهها باید جهت جلوگیری از فعال شدن پلاکتها در محیط آزمایشگاه طی مدت 45 دقیقه برچسبگذاری و فیکس شوند (31).
منابع:
- Mumford AD, Frelinger III AL, Gachet C, Gresele P, Noris P, Harrison P, et al. A review of platelet secretion assays for the diagnosis of inherited platelet secretion disorders. Thrombosis and haemostasis. 2015;114(01):14-25.
- Kaplan KL, Nossel HL, Drillings M, Lesznik G. Radioimmunoassay of platelet factor 4 and β‐thromboglobulin: development and application to studies of platelet release in relation to fibrinopeptide A generation. British journal of haematology. 1978;39(1):129-46.
- Schraw T, Whiteheart S. The development of a quantitative enzyme‐linked immunosorbent assay to detect human platelet factor 4. Transfusion. 2005;45(5):717-24.
- McGlasson DL, Fritsma GA, editors. Whole blood platelet aggregometry and platelet function testing. Seminars in thrombosis and hemostasis; 2009: © Thieme Medical Publishers.
- Feinman R, Lubowsky J, Charo I, Zabinski M. The lumi-aggregometer: a new instrument for simultaneous measurement of secretion and aggregation by platelets. The Journal of laboratory and clinical medicine. 1977;90(1):125-9.
- Knoefler R, Siegert G, Kuhlisch E, Weissbach G, editors. Diagnostics of platelet function disorders by lumi-aggregometry—results and comparison of methods. 34th Hemophilia Symposium; 2005: Springer.
- Mumford AD, Frelinger AL, 3rd, Gachet C, Gresele P, Noris P, Harrison P, et al. A review of platelet secretion assays for the diagnosis of inherited platelet secretion disorders. Thromb Haemost. 2015;114(1):14-25.
- Szeitz A, Bandiera SM. Analysis and measurement of serotonin. Biomed Chromatogr. 2018;32(1).
- Brand T, Anderson GM. The measurement of platelet-poor plasma serotonin: a systematic review of prior reports and recommendations for improved analysis. Clin Chem. 2011;57(10):1376-86.
- Federico JR, Krishnamurthy K. Albinism. StatPearls. Treasure Island (FL)2018.
- El-Chemaly S, Young LR. Hermansky-Pudlak Syndrome. Clin Chest Med. 2016;37(3):505-11.
- Michelson AD. Evaluation of platelet function by flow cytometry. 2006.
- Rand ML, Leung R, Packham MA. Platelet function assays. Transfusion and apheresis science. 2003;28(3):307-17.
- Nagy Jr B, Debreceni IB, Kappelmayer J. Flow cytometric investigation of classical and alternative platelet activation markers. EJIFCC. 2013;23(4):124.
- Givan AL. Flow cytometry. Methods in Molecular Biology: Flow Cytometry Protocols, TSHaRG Hawley, Editor, Humana Press Inc. 1992:1-31.
- Michelson AD. Flow cytometry: a clinical test of platelet function. Open Access Articles. 1996:290.
- Abrams C, Shattil SJ. Immunological detection of activated platelets in clinical disorders. Thrombosis and haemostasis. 1991;66(05):467-73.
- Michelson A. Platelet activation by thrombin can be directly measured in whole blood through the use of the peptide GPRP and flow cytometry: methods and clinical applications. Blood coagulation & fibrinolysis: an international journal in haemostasis and thrombosis. 1994;5(1):121-31.
- Rajasekhar D, Kestin AS, Bednarek FJ, Ellis PA, Barnard MR, Michelson AD. Neonatal platelets are less reactive than adult platelets to physiological agonists in whole blood. Thrombosis and haemostasis. 1994;72(06):957-63.
- Santos M, Valles J, Marcus A, Safier L, Broekman M, Islam N, et al. Enhancement of platelet reactivity and modulation of eicosanoid production by intact erythrocytes. A new approach to platelet activation and recruitment. The Journal of clinical investigation. 1991;87(2):571-80.
- Shattil SJ, Cunningham M, Hoxie JA. Detection of activated platelets in whole blood using activation-dependent monoclonal antibodies and flow cytometry. Blood. 1987;70(1):307-15.
- Kitchen S, Olson JD, Preston FE, Rosendaal FR. Quality in laboratory hemostasis and thrombosis: Wiley Online Library; 2013.
- Podda G, Femia E, Cattaneo M. Current and emerging approaches for evaluating platelet disorders. International journal of laboratory hematology. 2016;38:50-8.
- Macfarlane R. A simple method for measuring clot-retraction. The Lancet. 1939;233(6039):1199-201.
- Sigle W. Analytical transmission electron microscopy. Annu Rev Mater Res. 2005;35:239-314.
- Brydson R, Brown A, Benning LG, Livi K. Analytical transmission electron microscopy. Reviews in Mineralogy and Geochemistry. 2014;78(1):219-69.
- Webb A, Kagadis GC. Introduction to biomedical imaging. Medical Physics. 2003;30(8):2267-.
- Raghavendra P, Pullaiah T. Advances in Cell and Molecular Diagnostics: Academic Press; 2018.
- Ma H, Shieh K-J, Qiao TX, Cherng S. Transmission Electron Microscopy (TEM) and Scanning Electron Microscopy (SEM). Nature and Science. 2006:14.
- White JG. Electron microscopy methods for studying platelet structure and function. Platelets and Megakaryocytes: Springer; 2004. p. 47-63.
- Pretorius E, Oberholzer HM, van der Spuy WJ, Meiring JH. Macrothrombocytopenia: investigating the ultrastructure of platelets and fibrin networks using scanning and transmission electron microscopy. Ultrastructural pathology. 2009;33(5):216-21.
- Perez Botero J, Warad DM, He R, Uhl CB, Tian S, Otteson GE, et al. Comprehensive Platelet Phenotypic Laboratory Testing and Bleeding History Scoring for Diagnosis of Suspected Hereditary Platelet Disorders: A Single-institution Experience. American journal of clinical pathology. 2017;148(1):23-32.
- Martin K, Ma AD, Key NS. Molecular Basis of Hemostatic and Thrombotic Diseases. Molecular Pathology (Second Edition): Elsevier; 2018. p. 277-97.
[1] Capture antibody
[2] Detection antibody
[3] Lumiaggregometry
[4] Platelet-rich plasma
[5] Light transmission aggregometry
[6] 5-hydroxytryptamine
[7] Liquid chromatography-tandem mass spectrometry
[8] Mepacrine
[9] Quinacrine
[10] Dot plot
پلاسمای غنی از پلاکت (پیآرپی)
ارزیابی آزمایشگاهی اختلالات عملکرد پلاکت (1)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام