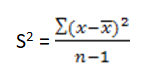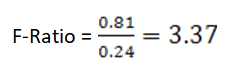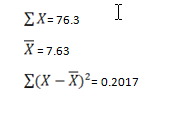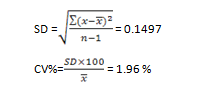آنالیزرهای هماتولوژی؛کنترل و کالیبراسیون
مهندس احسان درخشان نیا
از زمانی که اهمیت خونشناسی در آزمایشهای تشخیص طبی مشخص شد روشهای تجزیه و تحلیل خون نیز همواره در تغییر و تحول بوده است. امروزه آزمایش CBC به کمک دستگاههای الکترونیک متداول شده که در مقایسه با تکنیکهای معمول پیشین مزایای زیادی دارد؛ چراکه این تجهیزات دقت و سرعت بیشتری دارند و در عین حال اطلاعات کاملتری را یک جا در اختیار ما قرار میدهند. واضح است که این شمارندهها امتیازهای بسیار زیادتری نسبت به شمارش سلولی به روش دستی یا چشمی دارند.
در روش دستیِ شمارش سلولی توسط محفظهی هموسیتومتر، شخص آزمایشکننده سلولها را بهصورت واقعی مشاهده نموده و شمارش مینماید؛ بنابراین اطمینان حاصل میکند که ذرات گردوغبار، حبابها و یا مواد خارجی دیگری بهعنوان سلول شمارش نمیشوند. با وجود اینکه از نظر تئوری این روش صحت دارد ولی درواقع خطای بسیار بالایی داشته و فاقد دقت لازم است. چنانچه ناچار به استفاده از این روش بهعنوان روش مرجع باشیم میبایست بر روی یک نمونه چندین آزمون انجام گیرد. برآورد شده است که یک نتیجه نسبتاً مطمئن در این روش نیاز به ۲۰ تا ۳۲ بار شمارش مکرر دارد که همین امر باعث طولانی و خستهکننده بودن این روش میگردد. درنتیجه کمیته بینالمللی استانداردسازی هماتولوژی (ICSH) روش مرجع را برای شمارش سلولی، استفاده از شمارشگرهای الکترونیک اتوماتیک یا نیمه اتوماتیک معرفی نموده است.
توسعه تکنولوژی شمارش سلولها
اولین تلاش براي شمارش سلولها توسط Leeuwenhoek براي شمارش گلبولهاي قرمز جوجه انجام پذیرفت. وي با استفاده از یک میکروسکوپ و یک لوله موئین شیشهاي مدرج اقدام به این کار نمود. بعدها، با معرفی تکنولوژي رقیقسازی، دقت و سرعت شمارش بالاتر رفت. در اویل قرن بیستم، Moldovan و همکارانش روشی را مبتنی بر تئوري فتوالکتریک برای شمارش سلولها ابداع کردند، اما به دلیل بیاعتباری وسیله فتوالکتریک استفاده شده، این تلاش بینتیجه ماند.
در اواسط ۱۹۵۰، Walter H. Coulter تکنیکی جدید براي شمارش سلولها ارائه داد و یک شمارشگر سلولهاي خونی اتوماتیک را معرفی کرد. این تکنیک بر این اصل استوار بود که مقاومت ویژه سلولهاي خونی بسیار بیشتر از مایعی است که سلولها در آن شناورند. این اصل از شمارش که بر امپدانس سلولها استوار است، به نام تکنیک امپدانس روزنه یا «اصل کولتر» معروف است. از سال ۱۹۵۰، این تکنیک بهسرعت گسترش یافته است و امروزه بهعنوان اصلیترین تکنیک شمارش در دستگاههاي شمارشگر سلولها بکار میرود.
چند مسئله که پیش روی شمارندههای مدرن وجود دارد عبارتند از: ماهیت سلولهاي خون، مشکل بودن کنترل میزان مایع لازم جهت رقیقسازی و نهایتاً نیاز به یک شمارنده مجزا براي سلولهاي متفاوت.
- ماهیت سلولهاي خون
اولین و اصلیترین مشکل از اینجا ناشی میشود که سلولهاي خونی بسیار کوچک و متمرکز هستند؛ بنابراین، شمارنده باید قادر باشد که سیگنال دریافتی از سلولها را از سیگنالهاي کوچک مزاحم دیگر تمایز دهد. ثانیاً، قسمت حسگر دستگاه باید به اندازهاي کوچک طراحی شود که اجازه عبور یک سلول را در هر لحظه بدهد و همچنین آنقدر بزرگ باشد که در اثر عبور سلولها مسدود نشود. چون سلولها بسیار متمرکز هستند، احتمال اینکه در یک لحظه چندین سلول از حسگر عبور کنند بالاست. این فرآیند، شمارش همزمان نام دارد و خطاي ناشی از آن خطاي همزمانی نامیده میشود. این خطا را میتوان با رقیق کردن محلول و کنترل پارامترهاي دخیل در قسمت حسگر دستگاه به حداقل رساند. در ادامه بیشتر به این مورد میپردازیم.
- دستهبندی سلولهای مختلف
مسئله اساسی دیگر این است که بدست آوردن تعداد کل سلولهای خونی، از لحاظ پزشکی شاید اهمیت چندانی نداشته باشد؛ آنچه مهم است محاسبه تعداد سلولها برحسب نوع آنها بهصورت مجزا است. عموماً، هرچه قابلیت تمایز سلولها بالاتر باشد دستگاه از لحاظ پزشکی ارزش و اهمیت بالاتري خواهد داشت. براي جداسازي راحتتر سلولها، عملیاتی قبل از شمارش بر روي آنها انجام میپذیرد؛ بهعنوان مثال براي شمارش و تمایز راحتتر گلبولهاي قرمز از گلبولهای سفید، قبل از شمارش عمل همولیزبر روي آنها انجام میگیرد. به بیان بهتر، با افزودن ماده ليزکننده به نمونه و با کمک رقیقکننده، گلبولهای قرمز ليز شده و گلبولهای سفيد که دستنخورده ماندهاند، شمارش ميشوند.
تکنولوژیهای تشخیص سلول در شمارندههای سلولهای خونی
یک سلول یا ذره معمولاً بهوسیله سیگنالی که در اثر ایجاد اختلال یا آشفتگی در یک میدان الکتریکی یا الکترومغناطیسی ایجاد میکند، تشخیص داده میشود. روش کولتر که بهعنوان روش امپدانس روزنه نیز شناخته میشود، از یک میدان الکتریکی ایستا استفاده میکند و از آشفتگی ایجاد شده در این میدان براي تشخیص سلولها بهره میجوید. روش دیگري که در شمارندههاي امروزي بسیار معمول است استفاده از پراکندگی نور است. در ادامه به بررسی این دو روش میپردازیم.
روش امپدانس روزنهای
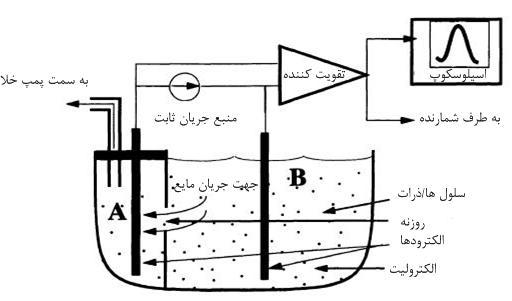
روش امپدانس روزنه در شکل ۲ نشان داده شده است.
شکل ۲. شمایی کلی از یک شمارنده امپدانس روزنهای
ظرف نشان داده شده در شکل ۲ از یک الکترولیت (معمولاً محلول نمک) پر میشود. سلولهایی که قرار است شمارش شوند در این محلول، معلقاند. ظرف بوسیله یک دیواره نارسانا به دو قسمت A و B تقسیم شده است. تنها راه ارتباطی بین این دو قسمت یک روزنه است که قطري در حدود ۵۰ تا ۱۰۰ میکرومتر دارد. دلیل استفاده از پمپ خلأ این است که با این عمل و به کمک نیروي هیدرودینامیک، سلولها ردیف شده و یک به یک از روزنه عبور میکنند. بیشتر شمارندههاي امروزي نیز از همین تکنیک پمپ خلأ استفاده میکنند.
دو الکترود از جنس پلاتین در دو طرف روزنه قرار داده میشوند و همانطور که در شکل ۲ نشان داده شده است به یک منبع جریان ثابت متصل میشوند. اگر ذره یا سلولی درون روزنه نباشد، مقاومت دیده شده بین دو الکترود تابع مقاومت ویژه الکترولیت و شکلِ روزنه خواهد بود؛ به عبارت دیگر، هرچه قطر روزنه کوچکتر باشد مقاومت بیشتر خواهد بود و برعکس. اگر غشاي سلولهاي خونی سالم باشد، مانند مقاومت بیولوژیکی عمل میکند. به بیان دیگر، سلولها همانند ذرات با مقاومتهاي بسیار بالا در مقایسه با مقاومت ویژه الکترولیت عمل میکنند. اگر ذرهاي در روزنه وجود داشته باشد، مقاومت دیده شده توسط دو الکترود پلاتین افزایش مییابد، زیرا سلول نارسانا جایگزین الکترولیت رسانا میشود و مقاومت کل را افزایش میدهد. چون یک منبع جریان ثابت داریم، این تغییر در مقاومت، طبق قانون اهم، باعث تغییر در پالس ولتاژ میشود. ارتفاع پالس متناسب با حجم سلول است. پالسها بر روی اسیلوسکوپ ظاهر میشوند و در قسمت حسابگر دستگاه شمارش و ضبط میگردند. سپس دستگاه تعداد پالسها را بهصورت تعداد RBC و از روی شدت اختلاف هر پتانسیل اندازه یا حجم متوسط سلولی (MCV) و میزان هموگلوبین و از روی تغییرات شدت این پالسها، RDW (معیاری جهت نشان دادن تغییرات اندازه گلبولهای قرمز) را ضبط کرده و سپس با استفاده از روابط زیر سایر معیارها را در حجم یک میلیمتر مکعب محاسبه و نتیجه شمارش را بر روی برگه مخصوص چاپ میکند:
MCH = Hb (gr/Lit) / RBC (10/microlit)
HCT= MCV (fl) × RBC (10/microlit)
MCHC= Hb (gr/Lit) – HCT (%)
معیارهای MCH، MCHC و HCT به ترتیب به میانگین وزن هموگلوبین در گلبول قرمز، تراکم هموگلوبین در گلبول قرمز و هماتوکریت اشاره دارند.
در دستگاههایی که با این روش کار میکنند بایستی از تغییرات PH، درجه حرارت و میزان یونیزاسیون پرهیز شود چراکه این تغییرات ممکن است موجب تغییر در اندازه، شکل و مقاومت سلولهای خونی در محلول گردد. میزان خطای شمارش در دستگاههایی که با روش فوق کار میکنند یک درصد و خطای رقیقسازی دو تا چهار درصد است.
کولترهای الکترونیک جدید چند کانالهاند و علاوه بر شمارش سلولی، رسم هیستوگرام و شمارش افتراقی گلبولهای سفید را نیز انجام میدهند.
نکاتی در خصوص شمارشگرهای امپدانس
- یکی از مهمترین منابع خطا با شمارشگرهای امپدانس، خطای ناشی از عبور همزمان چند سلول یا تودهای از سلولها از روزنه است که در این حالت دستگاه آن را بهصورت یک پالس الکتریکی قلمداد میکند. خطای فوق، زمانی که تراکم سلولی زیاد باشد با شیوع بیشتری رخ میدهد، بهعنوان مثال در افراد دچار پلیسیتمی.
- وجود تراکم زیاد سلولی مثلاً گلبول قرمز در افراد دچار پلیسیتمی و یا گلبول سفید در افراد مبتلا به لوسمی موجب خطای انتقال- Carry error میشود. این به آن مفهوم است که موجب افزایش گلبولهای سفید یا قرمز بیمار بعدی میشود که نمونه خونی وی را بعد از نمونهی بیماران فوق به دستگاه میدهند. در این مواقع باید قبل از دادن نمونه بعدی به دستگاه، عمل شستشو را انجام داد تا موجب کاهش خطای انتقال شود.
- در سیستمهای امپدانس چنانچه سلولی درست از مرکز روزنه عبور کند تولید ولتاژی متناسب با حجم خود میکند. عبور سلولها از اطراف روزنه تولید ولتاژ بیش از حد میکند که در نتیجه موجب گزارش اشتباه در شناسایی سلولها میشود. برای رفع این پدیده برخی از دستگاهها، پالسهای با ارتفاع بسیار بلند که از کنارههای روزنه عبور کردهاند را حذف کرده و در برخی دیگر با استفاده از محلول شیت –sheat سلولهای خون را به طرف مرکز هدایت میکنند.
- وقتی که دستگاه شمارشگر، شمارش گلبولهای سفید یا گلبولهای قرمز را بهصورت 99/9 گزارش میکند بیانگر این است که شمارش سلولی بیمار فوقالعاده بالاست و خارج از محدودهی خطی دستگاه است. در چنین حالاتی باید شمارش به طریقه درستی صورت گیرد و در ضمن پارامترهای دیگر نیز در چنین حالتی فاقد اعتبار هستند.
روش نوری
Laser Light Scatter
در این تکنولوژی، سوسپانسیون رقیقشده سلولهای خونی به داخل جریانی از محلول الکترولیتی تزریق میشود، بهطوریکه سلولها بهتدریج از جلوی اشعه لیزر عبور میکنند. عبور سلولهای خونی به نسبت اندازه هر سلول موجب تغییر شدت اشعه لیزر میشود. میزان تغییر شدت نور از طریق تیوبهای تقویتکننده نور- Photo Multiplier tube به آنالیزرها میرسد و تجزیه و تحلیل میشود و بهصورت پالسهای الکتریکی در دستگاه الکترونیک ضبط میگردد. این روشها برای ارزیابی مشخصات مورفولوژیک سلولها بسیار کارا هستند. بطور کلی این دستگاهها نوعی فلوسایتومترFlow Cytometer هستند بهطوری که اساس شمارش، افتراق سلولی، تعیین نوع و اندیسهای سلولی به طریق فلوسایتومتری و تعیین هموگلوبین به روش شیمیایی (روش متهموگلوبین) است. دستگاههایی که با این روش کار میکنند H1،H2 و H6000 میباشند. این دستگاهها بر اساس خاصیت مورفومتری گلبولهای سفید و قرمز و با کاربرد روشهای سیتوشیمی، سلولهای خونی را برای سنجش آماده میکنند. سیتومتر-Cytometer ، ابعاد دقیق و مشخصات را میسنجد و سپس یک سیستم کامپیوتری دادهها را با محاسبه عددی بهصورت نتایج قابل نمایش درمیآورد.
از میان تجهیزاتی که با روش نوری کار میکنند، دستگاه H1 که در سال ۱۹۸۵ توسط شرکت Technicon معرفی شد، پیشرو است. با استفاده از این دستگاه میتوان وضعیت کلینیکی بیمار را همراه با اطلاعات متعددی از قبیل مورفولوژی سلولهای خونی، سیتوگرامها و هیستوگرامهای آن تفسیر نمود. دستگاه آنالیزر H1 مثل سایر دستگاههای همخانوادهاش بر اساس فلوسایتومتری کار میکند و قادر است سلولهای خونی و افتراق گلبولهای سفید بالغ و نیز مورفولوژی گلبولهای سفید و قرمز را بهطور کامل شمارش کند. برای این منظور، این دستگاه، کار را در سه مرحله جداگانه انجام میدهد:
- واکنشهای سیتوشیمیایی که خون را جهت آنالیز آماده میکند.
- تعیین معیارهای سیتومتری سلولهای مختلف خونی
- الگوریتمهایی که ارقام بدست آمده را از طریق محاسبات کامپیوتری به نتایج قابل تفسیر برای دستهبندی سلولی، شمارش سلولی، اندازه سلولی و … تبدیل میکند.
این دستگاه (H1) شامل ۴ کانال جداگانه است که عبارتند از:
- کانال هموگلوبین
روش اندازهگیری هموگلوبین در این دستگاهها روش تعدیلیافتهی سیان متهموگلوبین است که طی آن ماده سورفاکتانت- surfactant گلبولهای قرمز را لیز میکند و هموگلوبین آنها را خارج میکند، پروتئين دنــــــــــاتوره میشود و قسمت Heme با سیانید ترکیب میگردد و مخلوط حاصلشده توسط رنگسنج- Colorimeter خوانده میشود.
- کانال پراکسیداز
در این کانال گلبولهای قرمز لیز میشوند و گلبولهای سفید فیکس و رنگآمیزی میگردند و فعالیت پراکسیداز گرانولهای آنها که با شدت رنگ متناسب است، مورد بررسی قرار میگیرد، مثلاً ائوزینوفیل فعالیت پراکسیداز پررنگ، نوتروفیلها فعالیت پراکسیداز قوی و مونوسیتها فعالیت پراکسیداز ضعیف دارند و لنفوسیتها و سلولهای بدون رنگ بزرگ بدون فعالیت پراکسیداز میباشند. هر یک از گلبولهای سفید (به غیر از بازوفیلها) بهوسیله روش نوری برحسب میزان تفرق نور- Light scatter، بهصورت نقطهای در صفحهی تاریک (dark field) در محل مخصوص به خود ظاهر میشوند. سپس تمام این نقاط توسط دستگاه کامپیوتر شمارش شده و در برگه گزارش آورده میشود.
- کانال بازوفیلی
در این کانال اطلاعات مربوط به هسته در گلبولهای سفید بررسی میگردد، بهطوریکه توسط مادهای اسیدی غشاء و سیتوپلاسم کلیه گلبولهای سفید بهجز بازوفیلها از بین میرود و هستهی آنها رسوب میکند. آنگاه سلولهای باقی مانده که بازوفیل هستند شمارش میگردند. سیتومتر این کانال از روی شکل هسته بهوسیله روش تفرق نوری گلبولهای سفید را در صفحه سیاه بهصورت نقاط سفید رنگ در محل مخصوص ثبت مینماید.
- کانال گلبولهای قرمز و پلاکت
در این کانال گلبولهای قرمز و پلاکتها بهوسیله محلول مخصوص فیکس میشوند و سپس از طریق تفرق نور، هر سلول برحسب اندازه و میزان تراکم هموگلوبین بررسی میگردد. گلبولهای قرمز که بزرگتر هستند بهوسیله نقاطی سفید رنگ بر روی صفحه سیاه رنگ ثبت میشوند. آنگاه میزان هموگلوبین، تعداد گلبولهای قرمز و MCV تعیین و اندیسهای مختلف RDW،MCH ،MCHC توسط کامپیوتر محاسبه و همگی در برگه CBC ثبت میگردند. پلاکتها نیز شمارش میشوند و منحنی حجمی آنها بر روی صفحه سیاه ثبت میگردد و از روی این منحنی تعداد پلاکتها و حجم متوسط یک پلاکت (MPV) محاسبه و ثبت میگردد.
مواد مرجع سلولی مورد استفاده در آزمایشگاههای هماتولوژی
در شمارش سلولهای خونی، فرآوردههای مرجع برای تنظیم دستگاههای شمارنده خودکار ضروری هستند، خصوصاً در مورد سیستمهایی که میتوان آنها را بهطور دلخواه تنظیم نمود. این بدان معنی است که برای رسیدن به یک نتیجه واقعی باید دستگاه را با مادهی مرجعی که دارای صحت شناخته شدهای است تنظیم کرد. یک ماده مرجع سلولی آماده باید در تمامی جنبهها مشابه با خون تازه باشد، یعنی خواص مورفولوژیک، ضریب شکست و هدایت الکتریکی ویژه آن مشابه با خون کامل تازه باشد. همچنین پارتیکلهای آن باید اندازه، شکل و تغییر شکلپذیری مشابه اریتروسیتهای تازه انسانی داشته باشد. این معرفها باید پایدار بوده و بهکارگیری آنها ساده و بدون مرحله رقیقسازی باشد. بهعلاوه باید توسط چندین روش قابل اندازهگیری باشند تا بتوانند نتایج مشابهی ارائه دهند.
سه نوع ماده مرجع که معمولاً مورد استفاده قرار میگیرند به قرار زیرند:
- خون کامل تازه که دارای ضد انعقاد EDTA میباشد.
- معرفهای دارای RBC حفظ شده (Preserved RBC)
- معرفهای دارای RBC فیکس شده
خون کامل دارای EDTA کاملاً مشابه نمونههای خونی بیماران عمل کرده و میتواند توسط تمامی روشها، مورد سنجش قرار گیرد. این خون یک کنترل بسیار عالی برای کالیبراسیون آنالیزرهای هماتولوژی توسط روشهای مرجع است. متأسفانه این نوع خون کنترل، ناپایدار بوده و تنها چند ساعت در دمای اتاق و ۲۴ ساعت در دمای ۴ درجه سانتیگراد، اندازهگیری پارامترهای آن قابل اعتماد است. این بدان معنا است که نهایتاً میتوانیم از خون امروز، تنها بهعنوان کنترل فردا استفاده کنیم، لذا مسلم است که از این کنترل نمیتوان بهعنوان یک فرآورده کنترل کیفی در پایشهای طولانی مدت استفاده کرد.
معرفهای کنترلی حفظشده و ثابتشده نیاز به چندین مرحله فراورش دارند و عمدتاً به طریق تجاری تهیه میشوند. البته این معرفها در آزمایشگاه نیز قابل تهیه میباشند.
در کنترلهایی که در آنها اریتروسیتها حفظ میشوند (خون حاوی مواد نگهدارنده)، سلولها زنده بوده و از نظر متابولیک دستنخورده باقی میمانند. این امر توسط اضافه کردن نگهدارندههای حاوی گلوکز صورت میگیرد. این محلولها همچنین ممکن است حاوی سایر افزودنیهای اختصاصی نظیر آدنین، توکوفرول، اوابین- Ouabain و نیز آنتیبیوتیکها باشند تا بتوانند طول عمر ذخیرهای گلبولهای قرمز را افزایش دهند. انتظار میرود این سلولهای حفظ شده–که زنده هستند- خواصی مشابه با خون کامل تازه داشته باشند و اندازهگیری پارامترهای آنها توسط روشهای مرجع و اتوماتیک، پاسخهای یکسانی را بدست دهد، ولی در عمل پاسخهای حاصل از بسیاری از این معرفها ممکن است بسته به روش اندازهگیری اندکی متفاوت باشد. در برخی از معرفهای حفظشدهای که مشابهت بیشتری با خون تازه دارند، پاسخها وابسته به روش سنجش نمیباشند. در عوض این معرفها طول عمر کوتاهتری داشته و به مدت چندین روز در دمای اتاق و ۴ تا ۶ هفته در یخچال پایدار باقی میمانند. پس از این زمان، بهتدریج اریتروسیتها شروع به تورم کرده و میزان MCV بهطور غیرقابل قبولی بالا میرود؛ بنابراین تنها برای مدت محدودی میتوان آنها را بهعنوان ماده کنترلی در کنترل کیفی دستگاهها بکار برد.
معرفهای دارای اریتروسیتهای فیکسشده یا ثابتشده معمولاً دارای فرمالدئید یا گلوتارآلدئید بهعنوان فیکساتیو هستند. این مواد با حداقل تغییر در MCV، پایداری اریتروسیتها را به مدت ۳ تا ۴ ماه افزایش میدهند. مشکل اصلی این محلولها آن است که اندازهگیری پارامترهای مختلف سلولهای فیکسشده بسته به روش اندازهگیری متفاوت میباشد؛ بهعلاوه سلولهای فیکسشده در مقایسه با سلولهای حفظشده، خواص غشایی متفاوتتری نسبت به سلولهای تازه از خود نشان میدهند؛ بنابراین حالتهایی که باعث تغییر و یا آسیب در اریتروسیتهای بیمار شده و نتایج بیمار را تحت تأثیر قرار میدهند نمیتوانند بر سلولهای فیکسشده –که نسبتاً مستحکمتر شدهاند- تأثیرگذار باشند. زمانی که جهت پایش کنترل کیفی تنها از کنترلهای فیکسشده استفاده شود ممکن است چنین حالتهایی تشخیص داده نشوند و همین امر استفاده از این کنترلها را محدود مینماید.
اگرچه هیچ نوع ماده کنترل سلولی واحدی وجود ندارد که در تمامی شرایط و حالتها بر بقیه ارجحیت داشته باشد، با این وجود در تهیه کنترلهای RBC حفظ شده بهبودهایی حاصل شده بطوریکه پایداری آنها به میزان زیادی افزایش یافته است، لذا این محلولها به مدت طولانیتری قابل استفاده هستند.
بعضی از مواد کنترل سلولی حاوی اریتروسیتهای هستهدار فیکسشدهی پرندگان بهجای جزء لکوسیت انسانی هستند.
همچنین ذرات لاتکس در اندازههای مشخص (به قطر ۲ تا ۱۲ میکرومتر) تهیه میشوند که مناسب بوده و برخی از آنها را میتوان بهعنوان ماده اولیه مرجع به کار برد؛ مثلاً از ذرات لاتکس با قطر دو میکرون میتوان بهجای پلاکت استفاده نمود. ذرات لاتکس نیز محدودیتهای سلولهای فیکسشده را دارند اما امتیاز عمده این ذرات آن است که یکدست بوده و در اندازههای مشخص ساخته شدهاند؛ بنابراین در سنجشهای متوالی هرکدام از آنها انحراف معیار بسیار کمی از میانگین از خود نشان میدهند.
در ادامه به کنترلهای سلولی تجارتی ساخت شرکتهای کولتر و سیسمکس میپردازیم.
معرفی برخی از خون کنترلهای تجارتی
مواد کنترل کیفی نقش بسزایی در استمرار قابل اعتماد بودن پاسخ آزمایشهای روتین دارند. مقادیری که توسط شرکتهای سازنده جهت این مواد در نظر گرفته میشوند از طریق اندازهگیریهای متعدد و با استفاده از آنالیزرهای رفرانس که با روشها و مواد مرجع بینالمللی کالیبره شدهاند، تعیین میگردند. میتوان با بکارگیری این خون کنترلها و پایش میزان انحرافِ پاسخهای حاصله، از پاسخهای در نظر گرفته شده، میزان صحت پاسخها را ارزیابی کرد.
- خون کنترلهای ساخت شرکت کولتر
شرکت کولتر که از پیشروان ساخت آنالیزرهای هماتولوژی است کنترلهای سلولی مختلفی را جهت کنترل کیفی عملکرد این دستگاهها به بازار عرضه کرده است که از جمله آنها میتوان به کنترل سلولی 4C PLUS اشاره نمود (شکل ۳). معمولاً به همراه هر بسته حاوی این کنترلهای سلولی یک برگه پیوست وجود دارد که اطلاعات ضروری مرتبط با آنها را در اختیار مصرفکننده قرار میدهد. این اطلاعات میتواند شامل نام ماده کنترلی، شماره سریال، نوع آنالیزری که خون کنترل برای آن مناسب است، تاریخ انقضاء، جدول مقادیر در نظر گرفته شده جهت هر پارامتر با توجه به نوع آنالیزر و دامنه مورد انتظار پاسخها، چگونگی استفاده از خون کنترل، چگونگی تشخیص خرابی کیتها، بررسی مشکلات احتمالی مرتبط با این فرآورده و اطلاعاتی از این دست باشد.
شکل ۳. کنترل سلولی 4C PLUS
- خون کنترلهای ساخت شرکت سیسمکس
شرکت سیسمکس نخستین خون کنترل خود را به نام Cell Check-B در سال ۱۹۶۸ به بازار عرضه نمود و تاکنون نیز به تهیه و تکامل انواع مختلف مواد کنترلی ادامه داده است. در طی این تکامل از مواد مختلفی مانند ذرات لاتکس، سلولهای خونی حیوانات و عناصر سلولی انسانی و نیز ترکیبات شیمیایی مختلف جهت پایداری این مواد و رسیدن به یک کنترل مناسب که بتواند مشابه با خون تازه انسانی عمل نماید، استفاده شده است.
هر یک از خون کنترلهای سیسمکس جهت یک مدل خاص از آنالیزرها ساخته شدهاند. در واقع این مواد سازگار با اساس کار، متد آشکارسازی و معرفهای این دستگاهها در نظر گرفته شدهاند.
در خون کنترلهای اولیه سیسمکس از ذرات لاتکس بهعنوان لکوسیت استفاده میشد. بهتدریج این مواد با سلولهای خونی فیکسشدهی حیوانات مختلف نظیر اریتروسیتهای هستهدار پرندگان جایگزین شدند. اندازهی اریتروسیتها در انسان و گونههای مختلف حیوانی ثابت است، بهعنوان مثال قطر این سلولها در انسان ۸ میکرون و در جوجه ۱۲ میکرون میباشد. با در نظر گرفتن این مسئله، شرکت سیسمکس با استفاده از RBCهای فیکس شدهی حیوانات مختلف، خون کنترلهای گوناگونی که با اساس اندازهگیری و تکنولوژی بکار گرفته شده در آنالیزرها سازگار بودند را تولید نمود.
فرآوردههای کنونی این شرکت، لکوسیتهای انسانی را به خدمت گرفتهاند. با افزایش پارامترهای قابل سنجش لکوسیتی، خون کنترل EIGHTCHECK که نمودار پراکندگی لکوسیتی آن دارای یک پیک (قله) بود به خون کنترلهای EIGHTCHECK 2-Peak با دو قله در نمودار پراکندگی لکوسیتی و EIGHTCHECK 3wp با نمودار پراکندگی سه قلهای لکوسیتی تکامل پیدا کردند (شکل ۴).
شکل ۴. خون کنترلهای EIGHTCHECK 3wp
روشهای ارزیابی عملکرد آنالیزرهای هماتولوژي
آنالیزرهای هماتولوژی غالباً دستگاههایی قابل تنظیم بوده و باید با روشهای مرجع کالیبره گردند. البته این دستگاهها نسبتاً پایدار بوده و نیاز به کالیبراسیون پیوسته ندارند، در واقع کالیبراسیون آنها بیشتر در مواقعی نظیر راهاندازی و setup اولیه دستگاهها، به دنبال تعمیر و یا تعویض قطعاتی از آنها و نیز هنگامی که سنجشهای دستگاه فاقد صحت باشند، انجام میگیرد. در عوض ارزیابی کالیبراسیون این دستگاهها بایستی بهصورت معمول انجام گیرد.
در ادامه مقاله، به روشهای ارزیابی کالیبراسیون میپردازیم. ضمن اینکه بحث کالیبراسیون آنالیزرهای هماتولوژی را نیز بعد از این مبحث، پی میگیریم.
راههای مختلفی جهت تصدیق کالیبراسیون آنالیزرها و یا پایش انحراف از کالیبراسیون وجود دارد که هر یک دارای ویژگیها و مسائل خاص خود میباشند. بطور کلی جهت ارزیابی و کنترل عملکرد این دستگاهها میتوان از نمونههای خون کنترل، نمونههای بیماران و یا ترکیبی از این دو استفاده کرد.
پایش عملکرد آنالیزرها با استفاده از نمونهها و نتایج بیماران
کنترل کیفی با استفاده از نمونهها و نتایج بیماران، بر اساس پاسخهای مربوط به تکتک آنها و یا چندین بیمار به اجرا درمیآید. مزایای این روش عبارتند از هزینه پایین و مقرون به صرفه بودن، مفید بودن آن با وجود تعداد زیادی آزمایش و توانایی کشف مشکلات مرتبط با نمونهها.
بهطورکلی میتوان به دو شکل عام از نمونهها و نتایج بیماران در ارزیابی عملکرد آنالیزرها استفاده نمود:
- انجام روشهای کنترلی بر روی نمونههای بیماران به شیوههای مختلف
از جمله این شیوهها میتوان به روش بریتین، انجام روشهای مرجع بر روی نمونههای بیماران، مقایسهی پاسخهای بدست آمده از یک آنالیزر با آنالیزر دیگری که کالیبره است (آزمون F)، آزمون Duplicate و آزمون چک یا بازبینی استفاده کرد.
- کنترل بر اساس نتایج بیماران
بررسی دلتا و … از جمله روشهای کنترل کیفی بر اساس نتایج بیماران میباشند.
در ادامه به بررسی موارد گفته شده میپردازیم.
روش کنترلی بریتین- Britin method
این روش که در آن از آزمون آماری t استودنت و یا آزمون Gosset استفاده میشود، روشی جهت پایش عملکرد آنالیزرهای هماتولوژی است. بر اساس مشاهدات بریتین، هفت پارامتر مهم در آزمون CBC یعنی RBC، WBC، Hb، HCT، MCV، MCH و MCHC در خون حاوی ضد انعقاد EDTA به مدت ۲۴ ساعت در دمای یخچال پایدار هستند. برای انجام روش بریتین به ترتیب زیر عمل میشود:
تعداد ۵ نمونه یا ترجیحاً ۱۰ نمونه خون بیمار که مقادیر پارامترهای آنها در محدوده طبیعی است را به دستگاه داده و مقادیر آنها یادداشت میشود. نمونهها را در یخچال قرار داده و روز بعد آنها را از یخچال بیرون آورده و پس از آن که به دمای اتاق رسیدند مجدداً آنها را توسط دستگاه آزمایش میکنیم.
با اطمینان از آنکه درجه حرارت یخچال در طی ۲۴ ساعت گذشته در محدودهی ۴ درجه سانتی گراد بوده، پاسخهای دو روز متوالی میبایست با هم همخوانی داشته باشند. برای اثبات همخوانی پاسخهای هر یک از پارامترها از رابطهی زیر استفاده میکنیم:
که در این روابط:
d: اختلاف دو روز
: میانگین اختلاف دو روز
SD: انحراف معیار اختلاف
n: تعداد جفتهای مورد آزمایش
برای مثال میتوان در روز اول حداقل 5 نمونه که دارای مقادير طبیعی هستند را پس از آزمايش در يخچال نگهداری کرد (n=5) و روز بعد، مجدداً مورد آزمایش قرارداد و وجود اختلاف معنیدار بين مقادير نمونههای جفت (مقادیر اندازهگیری شده در روز اول و دوم) را با استفاده از روابط محاسبه کرد.
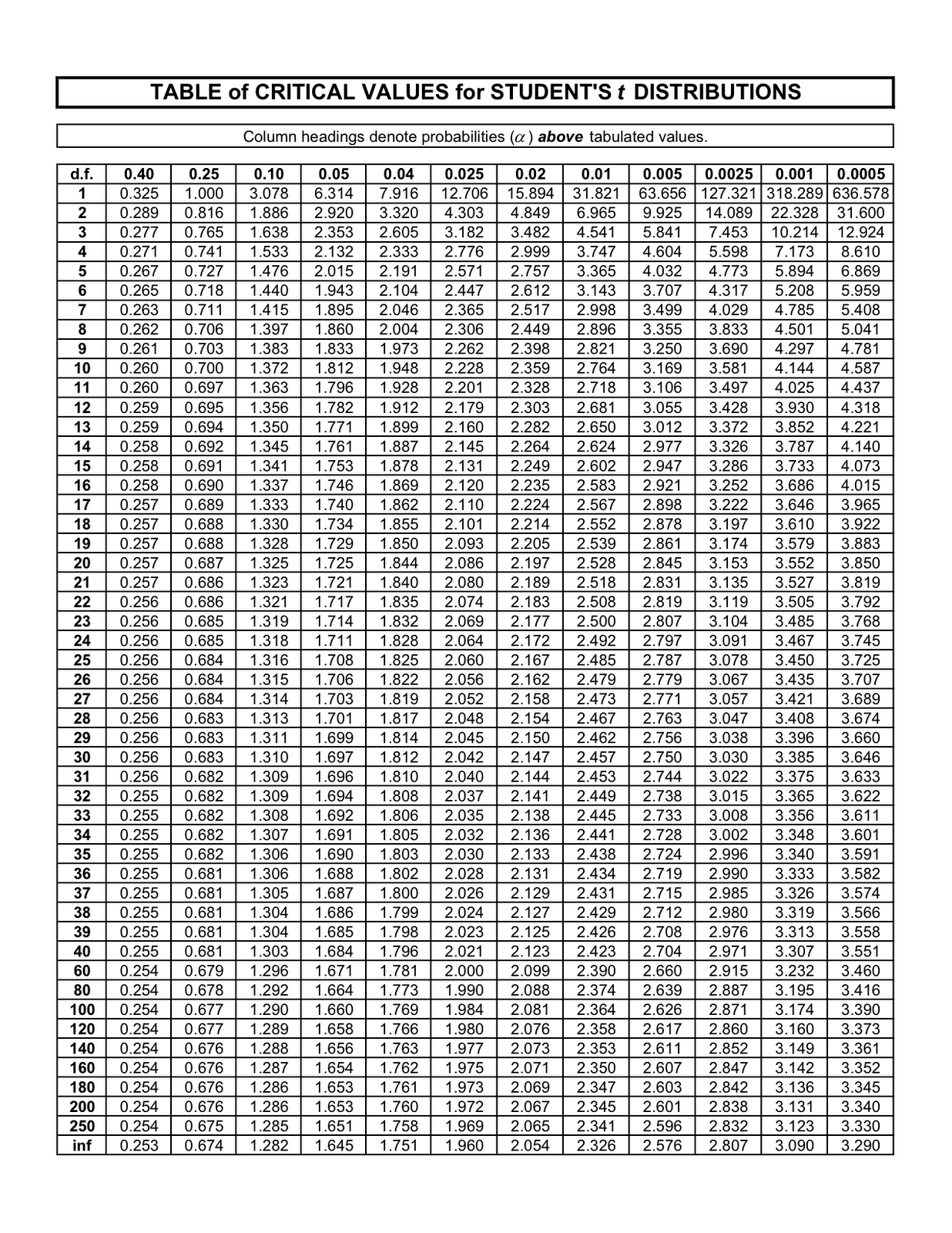
درصورتیکه tn بدست آمده برای ۵ نمونه بیشتر از 2/776 باشد، با ۹۵ درصد اطمینان میتوان گفت اختلاف معنیداری بین دو روز متوالی در پارامتر سنجیده شده وجود دارد. در این حالت دستگاه کالیبره نبوده و باید اقدام به رفع اشکال در کانال مربوط به آن پارامتر نمود. عدد 2/776عدد بحرانی است که برای ۵ نمونه از جدول t استودنت (شکل ۵) بدست آمده است. این عدد برای ۱۰ نمونه برابر با 2/228 خواهد بود. در صورتی که tn محاسبهشده کوچکتر از عدد بحرانی باشد، تفاوت معنیداری بین نتایج دو روز دیده نمیشود. این حالت از نظر کنترل کیفی وضعیت مناسبی بشمار رفته و در پی آن میتوان شروع به انجام آزمایش نمونههای بیماران نمود.
شکل ۵. جدول آماری t استودنت
انجام روشهای مرجع بر روی نمونههای بیماران
در این روش، ۱۰ و یا ترجیحاً ۲۰ نمونه خون تازه را گرفته و هریک از پارامترهای آنها را ۳ بار با روشهای مرجع و سه بار بهوسیله دستگاه اندازهگیری میکنیم، سپس میانگین هر یک از پارامترها را در هر روش بدست آورده و با هم مقایسه میکنیم.
آزمون آماری نسبتِ F
از لحاظ تئوری چنانچه چند آنالیزر هماتولوژی تحت کالیبراسیون با روشهای رفرانس باشند بایستی از یک نمونهی خون تازه، پاسخهای مشابهی را ارائه دهند. حال چنانچه از کالیبراسیون یک آنالیزر اطمینان داشته باشیم میتوانیم با استفاده از پاسخهای آن، کالیبراسیون دستگاههای دیگر را ارزیابی نماییم. جهت رسیدن به این هدف از روش آماری تحلیل واریانس یا نسبت F–F-Ratio، استفاده میشود. روش نسبت F، واریانس دو سنجش را با هم مقایسه میکند.
این نسبت نباید کمتر از یک باشد؛ بنابراین مجموعهای را که واریانس بزرگتری دارد در صورت کسر قرار میدهیم. نتایج حاصل از نسبت F با عدد بحرانی موجود در جدول F با درجه آزادی n-1، مقایسه میگردد (شکل ۶).
شکل ۶. جدول F
در صورتی که نسبت F کوچکتر از این عدد (عدد بحرانی موجود در جدول F با درجه آزادی n-1) باشد اختلاف واریانسها معنیدار نبوده و در نتیجه آنالیزر دوم نیز کالیبره میباشد. چنانچه نسبت F، بزرگتر از عدد بحرانی موجود در جدول F باشد، اختلاف واریانسها معنیدار میباشد. در این حالت آنالیزر دوم خارج از کالیبراسیون بوده و میبایست کالیبره گردد.
بهعنوان مثال، چنانچه شمارش لکوسیتی یک نمونه خونی توسط دو آنالیزر (۱۰ مرتبه توسط هر آنالیزر) بهصورت جدول زیر باشد:
WBC×109 /L
که برای محاسبه واریانس داریم:
بنابراین واریانس پاسخهای دستگاه اول برابر خواهد بود با 0/81 و واریانس پاسخهای دستگاه دوم، 0/24
نهایتاً نسبت F برابر است با:
همچنین عدد بحرانی بر اساس جدول F (شکل ۶) با درجه آزادی ۹ به احتمال ۹۵ درصد برابر با 3/18 است.
از آنجا که 3/37 از 3/18 بیشتر است، بنابراین اختلاف پاسخهای دو دستگاه معنیدار میباشد.
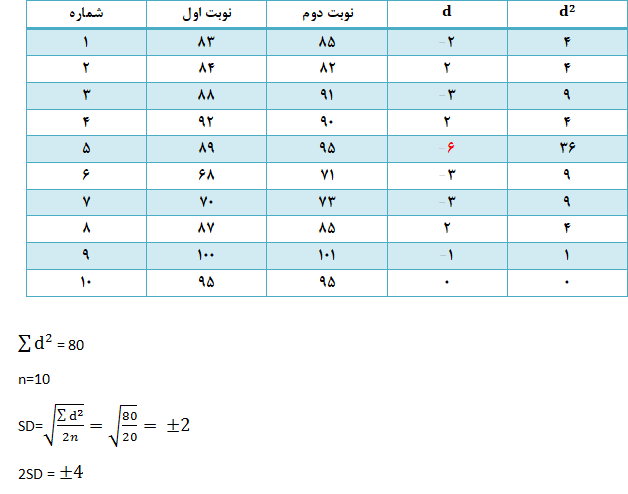
آزمون Duplicate
میتوان نمونههای بیماران را هرکدام دو بار به آنالیزر داد و پاسخها را باهم مقایسه نمود. این روش سادهترین راه کنترل کیفی است ولی دارای معایبی نیز هست؛ نخست آنکه فقط میتواند عدم دقت دستگاه را نشان دهد (خطای تصادفی) و از تشخیص عدم صحت عملکرد آنالیزر ناتوان است. ایراد دوم این روش آن است که وقتگیر بوده و به علت حجم کاری زیاد آزمایشگاه انجام آن امکانپذیر نیست؛ اما میتوان بهگونهای دیگر از این روش استفاده نمود؛ بدین ترتیب که ۱۰ یا ۲۰ نمونهی خونی بیمار بهصورت تصادفی برداشته شده و هرکدام بهطور متوالی دو بار به دستگاه داده میشوند. انحراف معیار مقادیر بدست آمده با استفاده از رابطه زیر محاسبه میشود:
لازم به ذکر است که هیچکدام از آزمایشهای Duplicate نباید بیش از 2SD با هم اختلاف داشته باشند.
بهعنوان مثال:
MCV (fl)
با توجه به مقدار 2SD، پاسخ MCV نمونهی پنجم، قابل قبول نیست و این مهم نمايانگر بروز خطای تصادفی و لزوم تکرار آزمايش روی همان نمونه است، چراکه اختلاف نمونه پنجم (d) خارج از محدودهی 2SD± است.
لازم به ذکر است که استفاده از این آزمون مشروط به کالیبره بودن دقیق آنالیزر است.
آزمون بازبینی یا چک
يکی ديگر از روشهای کنترل کيفيت، آزمون بازبيني است که در صورت نگهداری نمونهها در دمای مناسب مثلاً در یخچال، قابل اجراست. براي اين كار بايد در زمان شروع کار (مثلاً در صبح، چون این آزمونها باید روزانه بر روی دستگاهها انجام شوند) دو تا سه نمونه را پس از آزمايش بلافاصله با درِ بسته در يخچال قرارداد و حدود ۶ تا ۸ ساعت بعد يا بعدازظهر، آنها را مجدداً مورد آزمايش قرارداد. پيش از آزمايش، نمونهها بايد به دماي اتاق رسيده و كاملاً مخلوط شوند. نتايج اين دو آزمايش را میتوان با استفاده از فرمول آزمون Duplicate مقایسه نمود که اختلاف نتايج در محدوده 2SD قابل قبول است. در صورت نگهداری نمونهها در شرايط مناسب، هرگونه تغيير در نتايج خارج از اين محدوده، نشاندهنده اشکال در عملکرد دستگاه يا معرفها است. اين آزمايش براي بررسی تغييرات هموگلوبين و گلبولهای قرمز مناسب است و به ميزان کمتر براي گلبولهاي سفيد و پلاکتها کاربرد دارد ولي براي هماتوکريت، بهویژه اگر فاصله زماني بين دو آزمايش ۶ ساعت يا بيشتر باشد، کارايي ندارد.
چک دلتا
در این روش، نتایج کنونی آزمایشهای بیمار با نتایج قبلی وی (حدود ۲ تا ۳ هفته قبل) مقایسه میگردد. در صورتی که شرایط بیمار ثابت باشد، نتایج حاصل از آزمونهای وی باید ثابت باشد. اختلاف بین آزمونهای متوالی را در حالت ثابت دلتا گویند. این اختلاف بایستی اندک بوده و از حد خاصی تجاوز نکند. چنانچه اختلاف بین دو پاسخ متوالی از یک محدودهی مشخص بیشتر باشد نمونه بیمار جهت بررسی بیشتر کنار گذاشته میشود. طبق مطالعات صورت گرفته، اختلاف در دلتا چک در اثر خطاهای تکنیکی و یا اختلالات دستگاهها ایجاد میشود. اختلاف بین نتایج (دلتا) به دو روش محاسبه میشود:
- اختلاف درصدی (درصد دلتا)
- اختلاف عددی (اختلاف دلتا)
اختلاف دلتا = مقادیر کنونی – مقادیر قبلی
برای بررسی دلتا، حداقل نیاز به دو سری آزمایش از یک بیمار است. در این روش داشتن محدودهی تغییرات یا محدودهی دلتا ضروری است؛ بنابراین تعیین این محدوده از اهمیت ویژهای برخوردار است. چنانچه این محدوده کوچک انتخاب شود، نتایج مثبت کاذب و چنانچه بزرگ انتخاب شود، نتایج منفی کاذب بدست خواهد آمد. محدودهی دلتا از تغییرات فیزیولوژیک و ضریب تغییرات (CV) محاسبه میشود.
در بررسی دلتا که یکی از رایجترین روشهای کنترل کیفی با استفاده از نتایج بیماران است ثبت کامپیوتری نتایج قبلی بیماران لازم است زیرا در این روش چنانچه اشاره شد، نتایج فعلی بیمار با نتایج گذشته وی مقایسه میشوند. این روش به خطاهای نمونهگیری بسیار حساس است. گاهی در شرایط بالینی بیمار تغییرات زیادی ایجاد میشود که در چنین حالتی نمیتوان از روش دلتا چک استفاده کرد.
بطور کلی در موارد زیر استفاده از روش دلتا چک جهت کنترل کیفی امکانپذیر نیست:
- بیمارانی که فقط یک بار به آزمایشگاه مراجعه میکنند و یا فواصل زمانی مراجعهی آنها بسیار طولانی است.
- بیمارانی که تحت درمان فعال بوده و به آن پاسخ میدهند.
- بیمارانی که سیر بیماری در آنها فعال بوده و باعث تغییر در پاسخهای آنها میشود.
ارزیابی عملکرد آنالیزرها از طریق شرکت در برنامههای کنترل کیفیت خارجی
کنترل کیفی خارجی عبارت است از ارزیابی نتایج حاصل از یک نمونه خاص که توسط آزمایشگاههای مختلف ارائه میگردد. در این حالت وضعیت کالیبراسیون یک آنالیزر با مقایسه نتایج آن برای نمونههای خاص و نتایج بدست آمده در آزمایشگاههای دیگر روی همان نمونه مشخص میشود. در مورد آنالیزرهای هماتولوژی، این روش به علت ناپایداری خون تازه با مشکل اساسی مواجه است، زیرا انتقال نمونه به آزمایشگاههای مختلف بر کیفیت سلولها تأثیر خواهد گذاشت. کنترلهای سلولی پایدار شده نیز دارای مشکلات خاص خود میباشند؛ در این نمونههای کنترلی به دلیل آنکه اریتروسیتها خاصیت ارتجاعی و تغییر شکلپذیری خود را از دست میدهند، قادر به تقلید رفتار اریتروسیتهای تازه نبوده و همچنین در سیستمهای مختلف پاسخهای گوناگونی بدست میدهند. به این پدیده اثر Matrix گویند که به دلیل ماهیت خود نمونه است، بهعنوان مثال اریتروسیتهای فیکسشده که بهصورت دیسکهای ثابت شده و یا کروی هستند به هنگام عبور از روزنه امپدانس نمیتوانند به حالت کشیده درآیند و به همین دلیل حجم آنها بیشتر از اریتروسیتهای تازه برآورد میشود، همچنین از آنجا که فرمالدئید باعث تغییر ضریب شکست نور در این سلولها میشود بر اندازهگیریهایی که توسط سیستمهای نوری انجام ميشود نیز تأثیر خواهد گذاشت، به همین دلیل بهاستثنای هموگلوبین، تهیه و ارسال نمونههای کنترلی جهت دیگر پارامترهای خون با مشکل مواجه خواهد بود. البته چنانچه آزمایشگاههای مختلف از یک مدل آنالیزر استفاده کنند با استفاده از خون کنترلی تجارتی ویژهی آن آنالیزر میتوان علاوه بر هموگلوبین، کنترل کیفی سایر پارامترها را نیز انجام داد.
بطور کلی چنانچه بخواهیم بدون استفاده از خون کنترلهای تجارتی و فارغ از محدودیتهای ذکرشده یک کنترل کیفی خارجی در سطح استانی و یا کشوری انجام دهیم باید به روش زیر عمل کرده و پاسخها را تطبیق دهیم:
- روش تطبیق جوابها
- نمونههای کنترلی یکسان جهت اندازهگیری هموگلوبین به تمام آزمایشگاهها فرستاده شده و پاسخهای آنها دریافت میگردد.
- میانگین
و انحراف معیار (SD) این پاسخها تعیین میشود.
- آن دسته از نتایج که در خارج از محدودهی
هستند حذف میگردند.
- از مابقی نتایج میانگین سنجیده یا Weighted mean و انحراف معیـــار سنجیده یا Weighted SD بدست آمده و شاخص انحراف Deviated Index از رابطه زیر محاسبه میشود:
چنانچه میزان DI کمتر از 0/5 باشد، نمره آزمایشگاه عالی است. اگر DI بین 1 تا 0/5 باشد پاسخها رضایتبخش بوده و اگر بین 1 تا 2 باشد، هنوز قابل قبول و چنانچه بیش از 2 باشد غیرقابل قبول بوده و باید کالیبراسیون آنالیزر بررسی شود. در حالتDI بیشتر از 3، یک نقص جدی وجود داشته و باید علت آن مشخص شود.
چنانچه پراکندگی جوابهای دریافت شده بسیار زیاد است بهجای میانگین، میانه این جوابها محاسبه شده و شاخص انحراف یا DI به شکل زیر محاسبه میشود:
- روش ارزش اختصاص داده شده
در این روش خون کنترلی (مثلاً کنترل Hb) ساخته شده و میزان واقعی آن با روشها و مواد مرجع تعیین میگردد. سپس این نمونه کنترلی به آزمایشگاههای شرکتکننده فرستاده شده و پاسخهای آنها دریافت میگردد. این پاسخها را میتوان با دامنه یا انحراف معیار از میانگین اختصاص یافتهشده قضاوت نمود. چنانچه نتایج آزمایشگاهها کوچکتر از 1SD باشد، پاسخها عالی محسوب میشوند. نتایج بین 1 تا 2 SD نیز رضایتبخش هستند. اگر نتایج آزمایشگاهها بین 3 – 2 SD باشند، دارای نقص بوده و نیاز بهدقت دارند. چنانچه نتایج بیش از 3SD باشند باید علت امر بررسی شود.
کالیبراسیون آنالیزرهای هماتولوژی
آنالیزرهای هماتولوژی جهت گزارش صحیح پارامترهای هماتولوژیک (آزمون CBC) نیاز به کالیبراسیون دقیق دارند. کالیبراسیون، فرآیندی جهت تنظیم دستگاه است بهگونهای که سنجشهای آن به شکل صحیحی انجام پذیرد. در حقیقت کالیبراسیون بهمنظور تصحیح هرگونه عدم صحت ناشی از عملکرد سیستمهای پنوماتیک، هیدرولیک و الکترونیک آنالیزر (که ممکن است نتایج آزمون را تحت تأثیر قرار دهد)
انجام میگیرد. همانطور که پیشتر هم اشاره شد، آنالیزرهای هماتولوژی دستگاههایی نسبتاً پایدار بوده و نیاز به کالیبراسیون پیوسته ندارند. شاید یک تا دوبار کالیبراسیون در طول سال برای این دستگاهها کفایت کند. از جمله مواردی که نیاز مبرم آنالیزرهای هماتولوژی را به انجام کالیبراسیون نشان میدهد میتوان به راهاندازی اولیه دستگاه، تعویض یا تعمیر قطعاتی از آنالیزر که در اندازهگیریها نقش دارند، بکارگیری معرفهایی که سری ساخت متفاوتی از معرفهای قبلی دارند، وقوع شیف و یا انحراف در نمودارهای کنترلی و … اشاره نمود؛ بنابراین کالیبراسیون منظم این دستگاهها در فواصل زمانی خاص ضرورتی ندارد.
غالب آنالیزرها هم از طریق مد خون کامل- whole blood mode و هم به روش مد خون از پیش رقیقشده- Prediluted Mode و یا در برخی دستگاهها مد خون کاپیلاری، کالیبره میشوند. قبل از اقدام به کالیبراسیون باید اطمینان حاصل کرد که تمام قسمتهای دستگاه به شکل صحیحی عمل نموده و نقصی در دستگاه مشاهده نمیشود. برخی از اقداماتی که انجام آنها پیش از آغاز کالیبراسیون ضرورت دارد به شرح زیر میباشند:
- ارزیابی کلی دستگاه و معرفها: میبایست از عملکرد طبیعی دستگاه، کافی بودن معرفها و دسترسی به تمام مواد موردنیاز اطمینان حاصل نمود.
- ارزیابی شمارش زمینهای دستگاه: لازم است شمارش زمینهای آنالیزر در محدودههای قابل قبول باشند.
- ارزیابی میزان دقت (تکرارپذیری) دستگاه: تا زمانی که آنالیزر قابلیت تکرارپذیری نتایج یک آزمون CBC را نداشته باشد، نمیتوان آن را به شکل مناسبی کالیبره کرد.
- فراهمسازی یک فرم ویژه که بتوان اطلاعات خاصی نظیر تاریخ کالیبراسیون، منابع و شماره سریال کالیبراتور، مقادیر مرجع کالیبراتور و مقادیر شمارش زمینهای آنالیزر را در آن ثبت نمود.
بررسی دقت یا تکرارپذیری آنالیزر
اين بررسي به دو شكل انجامپذير است؛ در صورت استفاده از خون کنترل، میتوان با استفاده از نتايج نمونه کنترل که طی روزهای متوالی با دستگاه آزمایششده، عدم دقت هر پارامتر را محاسبهكرد و در صورت دسترسی نداشتن به خون کنترل، بايد از نمونههای خون تازه روزانه برای اين امر استفاده کرد. به این ترتيب، هر ماه دو نمونه يا بيشتر را حداقل 10 بار بهصورت متوالی با دستگاه آزمايش کرده و از نتايج بدست آمده، عدم دقت هر پارامتر را محاسبه کرد. توصیه میشود كه عدم دقت دستگاه بهویژه هنگام نصب و راهاندازی، با استفاده از نمونههایی با دامنههای طبيعی و غيرطبيعی بررسی شود. برای تهيه نمونه غيرطبيعی پايين، میتوان از نمونه رقیقشده استفاده کرد، به این ترتيب كه پلاسماي نمونه را جدا کرده و سپس حجمي از نمونه را با اين پلاسماي بدست آمده مخلوط کرد. نمونه خون با دامنه غيرطبيعی بالا را نيز میتوان با غلیظ کردن نمونه تهیه نمود. براي اين كار بايد ظرف نمونه را به مدت 2 ساعت با زاویه °45 نگهداری کرد و سپس با برداشتن نيمی از پلاسمای ايجادشده و مخلوط کردن كامل، از آن بهعنوان نمونه غيرطبيعي بالا استفاده نمود.
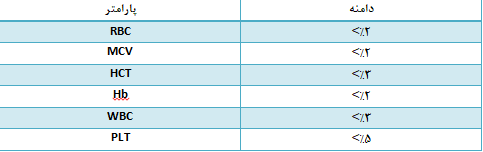
بطور کلی در صورتی که ضریب تغییرات (CV) پارامترها در محدودههای ذکرشده در جدول ۱ باشد، تکرارپذیری دستگاه قابل قبول خواهد بود. چنانچه ضریب تغییرات بالاتر از موارد یادشده باشد، پیش از اقدام به کالیبراسیون، نخست باید مشکل تکرارپذیری دستگاه را برطرف نمود. این کار از طریق اعمالی مانند شستشوی مکرر آنالیزر، بررسی فنی دستگاه و … انجام میگیرد.
جدول ۱. مقادیر قابل قبول CV برای پارامترهای ارائه شده توسط آنالیزرهای هماتولوژی
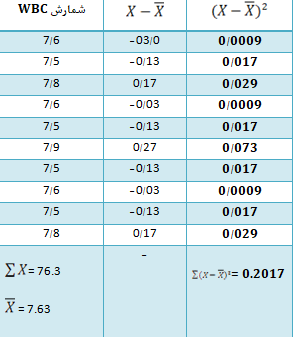
بهعنوان مثال، محاسبه عدم دقت دستگاه برای شمارش گلبولهای سفید (برای 10 بار شمارش متوالی n=10) در زیر آمده است:
اگر هر بار شمارشهای اندازه گرفته شده (در اینجا گلبولهای سفید) را x بنامیم، داریم:
بنابراین برای محاسبه SD و عدم دقت یا CV داریم:
روشهای کالیبراسیون
از طریق منوی کالیبراسیون آنالیزر، امکان کالیبراسیون دستگاه به دو روش اتوماتیک و دستی وجود دارد.
جهت انجام کالــیبراسیون به روش دســـتی نیاز به محاسبهی فاکتور یا ضریب کالیـــبراسیون–Calibration Factor یا به بیان دیگر فاکتور تصحیح داریم. فاکتور کالیبراسیون عددی است که بهصورت درصد محاسبه میشود و در حقیقت ضریبی است که به مقادیر اندازهگیریشده داده میشود تا آنها را به مقادیر واقعی نزدیک نماید. این فاکتور در روش اتوماتیک کالیبراسیون توسط خود دستگاه محاسبه شده و در کالیبراسیون اعمال میگردد.
چندین روش جهت محاسبه فاکتور کالیبراسیون وجود دارد که بسته به دستورالعمل کالیبراسیون دستگاه میتوان یکی از آنها را به کار گرفت. در ادامه به دو روشِ آن میپردازیم.
- در برخی از دستگاهها پس از آنکه میانگین هر یک از پارامترها به روش مرجع و نیز اندازهگیری توسط آنالیزر کالیبره شونده بدست آمد، با استفاده از رابطه زیر فاکتور تصحیح یا CF برای هریک از پارامترها محاسبه میگردد.
یک فاکتور تصحیح مثبت نشان میدهد که نتایج بدست آمده از آنالیزر (توسط دستگاه)، پایینتر از روشهای دستی مرجع است و بالعکس
برای هر پارامتر از ۱۰ یا ۲۰ نمونه خون، ۱۰ تا ۲۰ فاکتور تصحیح بدست میآید. میانگین این فاکتورهای تصحیح برای هر پارامتر حساب شده و جهت اصلاح دستگاه به کار گرفته میشود.
میانگین فاکتور تصحیح میتواند عددی مثبت و یا منفی و یا صفر باشد. اگر مثبت باشد به مفهوم آن است که دستگاه پاسخها را بهاندازهی این میانگین فاکتور تصحیح پایینتر از روش مرجع بدست میآورد و بالعکس. چنانچه این میانگین صفر باشد دستگاه نیازی به کالیبراسیون ندارد.
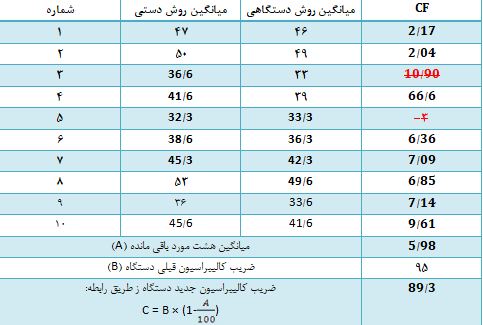
برای مثال، جهت کالیبراسیون پارامتر هماتوکریت، ۱۰ نمونه خون را هرکدام سه بار با روش دستی مرجع و روش دستگاهی به شرح زیر تعیین کردهایم:
فاکتورهای کالیبراسیون را به روش گفته شده بدست آورده و پس از آن میانگین فاکتورها را نیز محاسبه میکنیم.
بنابراین، میانگین فاکتور کالیبراسیون برای هماتوکریت در مثال بالا برابر شد با 5/5٪ که مقدار مثبتی است. علامت مثبت، چنانچه پیشتر هم به آن اشاره شد به این معنی است که آنالیزر، میزان هماتوکریت نمونهها را 5/5٪ کمتر از روش مرجع دستی گزارش میکند. حال بهصورت اختیاری یک نمونه را به دستگاه داده و هماتوکریتی را که دستگاه گزارش میکند، 5/5 درصد بالاتر میبریم، سپس هماتوکریت دستگاه را بر روی عدد بدست آمده تنظیم میکنیم؛ مثلاً چنانچه میزان هماتوکریت نمونه توسط دستگاه، ۴۱ گزارش شود، میزان تصحیحشده برای آن عبارت است از:
41 × 5.5% = 2.25
41 + 2.25 = 43.25
- محاسبه از طریق رابطه زیر:
در روش قبلی پس از آنکه فاکتور تصحیح (CF) مثلاً برای ۱۰ مورد هماتوکریت محاسبه شد، میتوان پس از حذف دو مورد از آنها یعنی بالاترین CF و پایینترین CF، از باقیماندهی CFها میانگین گرفته که این عدد با نماد A در رابطه بالا مشخص شده است. در این رابطه، حرف B جهت نشان دادن ضریب کالیبراسیون قبلی دستگاه و حرف C نمایانگر ضریب کالیبراسیون جدید دستگاه است؛ بهعنوان مثال چنانچه ضریب قبلی هماتوکریت سلکانتر ۹۵ درصد باشد، ضریب جدید کالیبراسیون آن چنانچه در جدول زیر مشخص است، برابر با 89/3 درصد خواهد شد.
روند کالیبراسیون آنالیزرها بهصورت دستی
بنا بر آنچه گفته شد، نخست کالیبراتور را حداقل ۵ بار به آنالیزر داده و میانگین هر یک از پارامترها را محاسبه میکنیم، سپس از منوی کالیبراسیون دستگاه، گزینهی Manual Calibration را انتخاب کرده و فاکتورهای قبلی کالیبراسیون را برای هر یک از پارامترها مشاهده میکنیم. در مورد پارامترهایی که نیاز به کالیبراسیون داشته باشند، فاکتور جدید کالیبراسیون را محاسبه کرده و آن را بهجای قبلی ثبت میکنیم.
روند کالیبراسیون آنالیزرها بهصورت اتوماتیک
در روش اتوماتیک کالیبراسیون، آنالیزر خود اقدام به محاسبه و اعمال فاکتور جدید کالیبراسیون میکند، بنابراین انجام آن سادهتر از روش دستی است. برای انجام کالیبراسیون به روش اتوماتیک، به ترتیب زیر اقدام میشود:
نخست از منوی کالیبراسیون دستگاه، گزینه Auto Calibration انتخاب میشود (شکل ۷).
شکل ۷. منوی کالیبراسیون اتوماتیک
در این مرحله معمولاً پنجرهای ظاهر میشود که حاوی مکانهایی برای ثبت اطلاعاتی نظیر تاریخ، شماره سریال کالیبراتور، پارامترهای قابل کالیبراسیون و … میباشد. پس از وارد کردن مقادیر مرجع نمونه کالیبراتور در جایگاه مربوطه و تأیید آن، کالیبراتور را به دفعات ۵ بار یا بیشتر به دستگاه میدهیم. در پایان فاکتور کالیبراسیون توسط دستگاه محاسبه شده و پس از تأیید توسط اپراتور، روند کالیبراسیون به اتمام میرسد.
برخی از منابع
- کتاب فرآوردههای بیولوژیک خون و داروهای بیولوژیک مؤثر بر خون، تألیف دکتر محمد ربانی، دکتر وجیهه اکبری، انتشارات دانشگاه علوم پزشکی اصفهان
- کسری پورنگ، «شمارش و طبقهبندی سلولها به روش اندازهگیری امپدانس»، پایاننامه برای دریافت درجه کارشناسی ارشد در رشته مهندسی برق گرایش طراحی مدارات مجتمع آنالوگ، دانشکده مهندسی برق و کامپیوتر دانشگاه تبریز
- Bhardwaj, J., Ashraf, H. and McQuarrie, A. Dry Silicon Etching for MEMS. Symposium on Microstructures and Microfabricated Systems. May 4-9, Montreal, Canada.
- دکتر حبیبالله گلافشان، کاربردهای بالینی پارامتر توزیع دامنه حجم گلبول قرمز (RDW)، فصلنامه آزمایشگاه و تشخیص، شماره ۳۱
- کتاب تکنیکهای عملی در آزمایشگاه تشخیص، جلد سوم، «هماتولوژی بالینی» تألیف دکتر امیر سیدعلی مهبد
- کتاب اصول کار و منابع خطا در آنالیزرهای هماتولوژی (سلکانترها)، دکتر علی ملکی
- کتاب کنترل کیفی در آزمایشگاه هماتولوژی تألیف دکتر علی ملکی، دکتر سعید کاویانی و کامران منصوری
- بررسي ضرورت كنترل كيفي دستگاههاي شمارنده سلولهاي خوني در آزمايشگاههاي تشخيص طبي، دكتر وحيد چنگيزي و همکاران، مجله پياورد سلامت
- کتاب کنترل کیفیت در آزمایشگاههای پزشکی، دکتر فریده رضی، انتشارات نوید شیراز
- کتاب دستگاههای خودکار شمارنده سلولی (اساس کار، کالیبراسیون، کنترل کیفیت و خطاها)، دکتر پریسا داهیم
- Practical Hematology; Dacie & Lewis; 10th edition; Churchill-Livingston
اساس كار، کنترل کیفی و کالیبراسیون آنالیزورهای خون شناسی (2)
کنترل کیفی در آزمایشگاه خونشناسی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام