گلوکز-6- فسفات دهیدروژناز
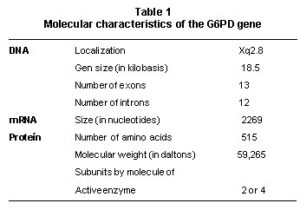
(Glucose-6-phosphate dehydrogenase, G6PD)
محمد علیمحمدی: کارشناس ارشد بیوشیمی بالینی، دانشگاه آزاد اسلامي واحد اراک
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
مقدمه:
کمبود آنزیم گلوکز-6-فسفات دهیدروژناز (G6PD)، شایعترین بیماری ناشی از کمبود آنزیم در جهان است و تقریباً 400 میلیون نفر در سراسر جهان به این بیماری مبتلا هستند. موتاسیونهای ژن کد کننده G6PD میتواند موجب تولید آنزیمی با فعالیت کمتر و یا پایداری کمتر شود. تاکنون بیش از 440 واریانس مختلف در ژن G6PD شناسایی شده که با درجات مختلفی از نقص در عملکرد این آنزیم، همراه بودهاند.
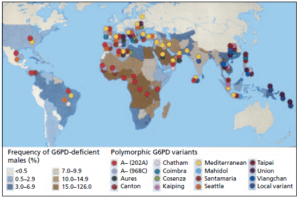
تصویر: توزیع جهانی واریانتهای ژن G6PD که موجب کمبود G6PD میشوند. در این تصویر، 14 واریانت شایع بررسی شدهاند.
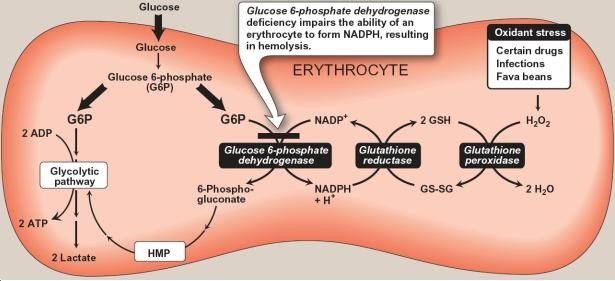
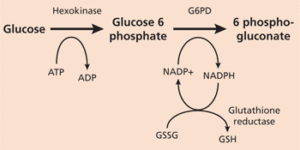
انرژی مورد نیاز گلبولهای قرمز، که در فعالیت غشاء سلول و محافظت از اجزای داخلی آن نقش دارند، از طریق متابولیسم گلوکز تأمین میگردد که 90 درصد آن به صورت متابولیسم بیهوازی و از مسیر امبدن میرهوف (گلیکولیز) به انجام میرسد. 10 درصد باقیمانده نیز به صورت هوازی و استفاده از شانت هگزوز منوفسفات یا پنتوز فسفات حاصل شده، که این مسیر، در سیتوزول و در طی دو مرحله اکسیداتیو و غیراکسیداتیو انجام میشود. نقش اساسی این مسیر در تولید NADPH (برای استفاده در واکنشهای آنابولیک) و ریبوز 5ـ فسفات (برای استفاده در بیوسنتز اسیدهای نوکلئیک) میباشد.
G6PD یک آنزیم حیاتی کلیدی در چرخه متابولیسم گلوکز بوده که در طی تبدیل گلوکز 6ـ فسفات به 6ـ فسفو گلوکونولاکتون، NADPH نیز که گلبولهای قرمز را از آسیب اکسیداتیو داخل سلولی هموگلوبین محافظت میکند، تولید میشود. در حالت طبیعی وقتی گلبول قرمز با داروها و سموم تولید کننده رادیکالهای اکسیژن مواجه میشود، فعالیت این آنزیم تا چندین برابر افزایش یافته و با افزایش تولید گلوتاتیون، از تخریب هموگلوبین و غشای گلبولهای قرمز توسط این مواد، جلوگیری مینماید. تاکنون بیش از ۴۰۰ نوع G6PD شناسایی شده که این امر سبب تنوع زیادی در شدت بالینی بیماری از یک کمخونی بدون مواجهه با عوامل اکسیدان (مثلاً در مدت کوتاهی پس از تولد)، کمخونی در اثر مواجهه با اکسیدانهای خفیف یا شدید و تا نوعی که بدون هیچ گونه اختلال بالینی است، مشخص میشود.
كمبود G6PD يك بيماري مادرزادي بوده كه در آن فعاليت آنزيم G6PD در داخل گلبولهاي قرمز كاهش مييابد. اين آنزيم به عنوان يك آنزيم محافظ براي گلبولهای قرمز و طول عمر طبيعي آنها ضروري بوده و كاهش و یا فقدان آن، سبب تخريب گلبولهاي قرمز و در نتيجه ایجاد كمخوني موسوم به آنمي هموليتيك میگردد.
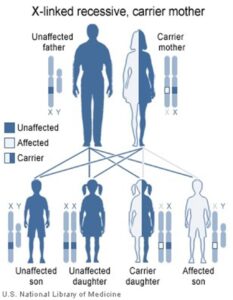
از آن جایی که آلل ژن این آنزیم، روی کرموزوم X قرار دارد، بنابراین، کمبود G6PD، یک اختلال وابسته به جنس است. در نتیجه، نقص در این آنزیم، در مردان به صورت هموزیگوت و در زنان به صورت هتروزیگوت (ناقل سالم) تظاهر مییابد. مردان مبتلا (هموزیگوت) ژن غیرطبیعی را از مادران خود به ارث میبرند. زنان فقط هنگامی که هر دو کروموزم X آنها دارای ژن معیوب G6PD باشد دچار علائم خواهند شد. زنانی که دارای یک کروموزوم X مبتلا میباشند، اغلب سالم هستند.
تصویر: مسیر بیوشیمیایی سنتز NADPH
تخريب گلبولهاي قرمز معمولاً در اثر خوردن باقلا و برخی از داروهای اکسیدان و یا ابتلا به برخی از عفونتهای باکتریایی و یا ویروسی، آغاز ميشود. در برخی گزارشهای موردی، نشان داده شده است که قرار گرفتن برخی از بیماران فاویسمی در معرض بوی حنا نیز باعث ایجاد همولیز در آنها شده است. همچنین دیده شده که برخی از بیماران دچار کمبود و یا فقدان G6PD، پس از مصرف باقلا و یا داروهای اکسیدان، دچار همولیز نمیشوند. بررسیها نشان داده است که این افراد، دارای مقادیر بالایی از آنزیم کاتالاز بوده و سطوح بالای این آنزیم، کمبود و یا فقدان آنزیم G6PD را جبران مینماید.
در طی یک بررسی، بین سطوح بالاتر بیلیروبین در نوزادان متولد شده، با کمبود G6PD، یک ارتباط مستقیم مشاهده شده است.
| گروه نوزادان تازه متولد شده | تعداد (نفر) | درصد کمبود G6PD |
| طبیعی | 500 | 22/5 |
| زردی ملایم
(میزان بیلیروبین 20- 15 میلیگرم در دسیلیتر) |
38 | 45 |
| زردی ملایم
(میزان بیلیروبین بیشتر از 23 میلیگرم در دسیلیتر) |
70 | 60 |
| بستری شده با علامت کرنیکتروس | 20 | 78 |
مکانیسم عمل آنزیم G6PD:
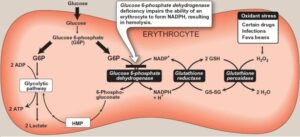
در شرایط طبیعی، مواد اکسیدان به سرعت توسط گلوتاتیون احیاء (GSH) در ترکیب با گلوتاتیون پراکسیداز غیر فعال میشوند که منجر به تبدیل GSH به گلوتاتیون اکسیده (GSSG) میگردند. GSH تخلیه شده، توسط گلوتاتیون ردوکتاز و با انجام واکنش احیاء GSSG به GSH، مجدداً بازیابی میشود. این واکنش به NADPH احتیاج دارد که از طریق شانت هگزوز منو فسفات یا پنتوز فسفات، تأمین میشود.
تصویر: مسیر بیوشیمیایی سنتز NADPH
در کمبود G6PD، گلبولهای قرمز نمیتوانند در هنگام مواجهه با مواد اکسیدان، NADPH کافی تولید نموده و GSH را از گلوتاتیون اکسیده، بازسازی نمایند، لذا قابلیت سلول در حذف H2O2 یا رادیکالهای آزاد از بین رفته و هموگلوبین، اکسیده شده و به صورت اجسام هاینز (Heinz body) در داخل گلبولهای قرمز رسوب مینماید. در نتیجه، گلبولهای قرمز در طحال تخریب شده و موجب ایجاد کمخونی میگردند.
تصویر: مکانیسم عملکرد NADPH در هنگام مواجهه با استرسهای اکسیداتیو
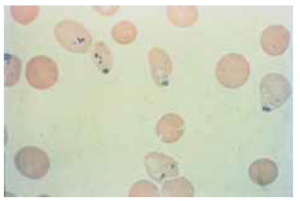
تصویر: اجسام هاینز
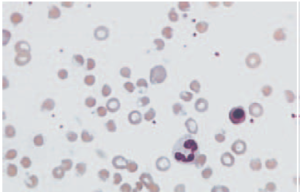
تصویر: گستره خون محیطی یک بیمار مبتلا به کمبود G6PD، متعاقب دریافت داروهای اکسیدان
انواع G6PD:
G6PD حدود 30 نوع مختلف است که در زیر، به اختصار، به برخی از انواع مهمتر آن اشاره میگردد:
1)G6PD-B : نوع طبیعی آنزیم G6PD به نام G6PD-B نامیده میشود.
2) +G6PD-A: در 20% از سیاهپوستان دیده میشود. این نوع از آنزیم دارای عملکرد طبیعی میباشد.
3) –G6PD-A: دسته دیگری هستند که فقط 15% آنزیم G6PD طبیعی، فعالیت داشته و در 11% از سیاهپوستان آمریکایی دیده میشود. در این نوع از آنزیم، فعالیت آنزیمیG6PD ، در گلبولهای قرمزی که عمرشان به ۴۰ روز میرسد، به سرعت کاهش مییابد؛ در صورتی که، فعالیت G6PD طبیعی پس از 120 روز عمر گلبول قرمز، به میزان 50% خود، کاهش مییابد.
4) G6PD-Med: که در ناحیه مدیترانه مشاهده شده و شدیدتر از سایر انواع میباشد.
5) G6PD-Canon: که یک ژنوتایپ غیرطبیعی بوده و در تایلند، ویتنام و سایر جمعیتهای آسیایی مشاهده میشود.
6) سایر انواع G6PD: در جمعیت مدیترانهای و چینی، شایعتر هستند.
بیشترین شیوع این بیماری، در آفریقا و سپس در آسیا و به ویژه در ناحیه مدیترانه دیده میشود. ژن G6PD روی کروموزوم X قرار دارد (صفت وابسته به جنس).
انواع G6PD بر اساس طبقه بندی WHO:
سازمان جهانی بهداشت (WHO)، به طبقه بندی انواع G6PDهای مختلف بر اساس میزان کمبود آنزیم و شدت همولیز پرداخته است.
کلاس I: نادر بوده و کاهش آنزیم در آنها شدید (کمتر از 10% فعالیت طبیعی آنزیم) میباشد. این افراد دارای آنمی همولیتیک مزمن هستند.
کلاس II: در این دسته نیز کاهش آنزیم شدید بوده، اما اغلب، همولیز متوسطی (intermittent hemolysis) دارند.
کلاس III: دارای کاهش آنزیم با شدت متوسط (10 تا 60% فعالیت طبیعی آنزیم) بوده و در صورت مواجهه با عفونت و یا مصرف داروهای اکسیدان، همولیز متوسطی (intermittent hemolysis) پیدا میکنند.
کلاس IV: فاقد کاهش آنزیم و یا همولیز میباشند.
کلاس V: در این دسته فعالیت آنزیمی افزایش یافته است.
کلاسهای IV و V، از نظر کلینیکی فاقد اهمیت هستند.
شدت بیماری G6PD به مقدار کمبود این آنزیم بستگی دارد:
ـ کمتر از ۱۰% طبیعی، بیماری شدید
ـ بین ۱۰% تا ۶۰% طبیعی، بیماری با شدت متوسط
ـ بیشتر از ۶۰% طبیعی، علائم ندارند.
۱۰ تا ۱۵% سیاهپوستان آمریکایی به این بیماری مبتلا هستند. فرد بیمار (که دچار کمبودG6PD است) در هنگام مواجهه با مواد اکسیدان (بعضی از داروها، عفونت و باقلای مازندرانی) دچار تخریب هموگلوبین و در نتیجه رسوب آن در گلبول قرمز میشود و ایجاد اجسامی بنام اجسام هاینز (Heinz Bodies) مینماید، این مواد اکسیدان در ضمن سبب آسیب به غشای گلبول قرمز نیز میشوند، گلبول قرمز آسیب دیده سبب همولیز داخل عروقی (که بصورت هموگلوبین در ادرار دیده میشود) و هم سبب همولیز خارج عروقی (که بصورت بزرگی طحال و زردی نمایان میشود) میگردد.
تشخیص کمبود آنزیم معمولاً در زنان هتروزیگوت و افراد دارای گروه خونی ¯A دشوار است.
علاوه بر برخی از خوراکیها مانند باقلا، برخی از بیماریها مانند اسیدوز دیابتی، نارسایی حاد کلیوی و هپاتیت نیز میتوانند منجر به بروز همولیز در افراد مستعد شوند. داروها و ترکیباتی از قبیل سولفامتوکسازول، سولفانیلامید، سولفاپیریدین، کلروکوئین، پاماکوئین، پنتاکوئین، نیتروفورانتوئین، نالیدیکسیک اسید، فنازوپیریدین)، سیپروفلوکساسین، نورفلوکساسین، کلرامفنیکل، نفتالن، آنالوگهای ویتامین K، متیلنبلو، استانیلید، دوکسوروبیسین، ایزوبوتیل نیتریت و فنیل هیدرازین نیز میتوانند با خطر بروز همولیز در افراد دچار کمبود G6PDهمراه باشند که این نوع از بیماران باید از مصرف این گونه داروها خودداری نمایند.
کاربرد بالینی:
این آزمایش برای شناسایی کمبود G6PD در بیماران دچار آنمی همولیتیک پس از مصرف برخی داروهای اکسیدان (اکسید کننده) استفاده میشود، همچنین در غربالگری برخی جمعیتهای بومی مستعد این نقص ژنتیکی سودمند است. آزمایشهای DNA اخیراً برای تشخیص G6PD معمول شده است.
علائم بالینی:
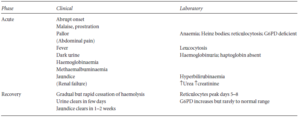
بیماران مبتلا به کمبود به G6PDزمانی که در معرض عوامل اکسیدان قرار میگیرند، دچار حملات لیز گلبولهای قرمز میشوند. علائم بیماری شامل کسالت، بیحالی، درد شکم و یا درد کمر، تهوع و استفراغ بوده و پس از چند ساعت تا چند روز (اغلب ۲ تا ۳ روز) (البته شروع علائم در کودکان ناگهانی است)، بیمار دچار زردی و ادرار تیره رنگ میشود (نشانه وجود هموگلوبین در ادرار).
جدول: علائم شایع در حملات همولیتیک ناشی از کمبود G6PD
مهمترین خطر این بیماری، نارسایی حاد کلیه (ARF) خصوصاً در کودکان است. کمخونی معمولاً از نوع نرموسیتیک- نرموکرومیک بوده و هموگلوبین بیماران گاهی به g/dl ۴ و یا حتی کمتر نیز میرسد. کاهش شدید هموگلوبین و هماتوکریت خون، هموگلوبینمیا (وجود هموگلوبین در جریان خون)، هموگلوبینوریا (وجود هموگلوبین در ادرار)، کاهش یا فقدان هاپتوگلوبین پلاسما و افزایش درصد رتیکولوسیتهای خون محیطی در آزمایش این افراد مشاهده میشود. لازم به ذکر است که انجام آزمایش G6PD پس از وقوع حملات همولیزی در این افراد، به دلیل وجود فعالیت بالای این آنزیم در رتیکولوسیتها میتواند به صورت کاذب، طبیعی جلوه نماید.
بیماری فاویسم (Favism):
در اغلب مطالعات انجام شده، میزان ناکافی آنزیم G6PD در نوزادان پسر بین 4-3% و در نوزادان دختر، کمتر از 1% گزارش شده است. 8% نوزادان گیلانی به کمبود G6PD مبتلا هستند. مهمترین و شدیدترین شکل آنمی همولیتیک، ناشی از کمبود G6PD است. این بیماری در هر سنی میتواند اتفاق بیفتد، ولی در کودکان بیشتر دیده میشود. شروع بیماری در بچهها معمولاً همراه با بیقراری، سپس تب، درد شکمی، اسهال و گاهی اوقات استفراغ و بیحالی و سستی (lethargic) میباشد. هموگلوبینوریا ظرف ۶ تا ۲۴ ساعت پس از شروع علائم ایجاد میشود. در معاینه فیزیکی، رنگپریدگی، تاکیکاردیا، زردی و بزرگی کبد قابل مشاهده خواهد بود. در موارد شدید بیماری، شوک هیپوولمیک و در موارد خیلی نادری نیز نارسایی قلبی مشاهده شده است.
علت فاویسم به خاطر وجود دو ماده ویسین (Vicine) و کانویسین (Convicine) در باقلای مازندرانی (Fava Bean; Vicia Faba) است که در بدن، تحت روند اتواکسیداسیون، تولید رادیکالهای آزاد اکسیژن مینمایند. باید توجه داشت که همه اشکال تهیه شده باقلا (پخته، خشک و بوی آن) ایجاد همولیز مینمایند. سایر باقلاها اغلب این مشکل را ندارند. بالغین مبتلا به دلایل نامعلوم دچار حملات حاد فاویسم نخواهند شد (البته به مقدار و کیفیّت باقلای خورده شده نیز بستگی دارد). البته همان طوری که قبلاً نیز بیان شد، این افراد احتمالاً دارای مقادیر بالایی از آنزیم کاتالاز بوده و سطوح بالای این آنزیم، کمبود و یا فقدان آنزیم G6PD را جبران مینماید.
علل افزایش G6PD:
کمخونی پرنیسیوز، کمخونی مگالوبلاستیک، خونریزی مزمن، انفارکتوس میوکارد، اغمای کبدی و هیپرتیروئیدی میتوانند سبب افزایش G6PD شوند، بنابراین در این موارد، میزان آنزیم افزایش داشته و کمبود آن اغلب مشخص نمیشود.
علل کاهش G6PD:
کمبود یا نقص آنزیم G6PD، کمخونی همولیتیک غیر ایمونولوژیک نوزادان و کمخونی نادر غیر اسفروسیتی، سبب کاهش G6PD میشوند.
نمونه های مورد نیاز:
نمونه CBC غیرهمولیز. برای انجام این آزمایش، نیازی به ناشتا بودن فرد نیست. برای نمونهگیری در این آزمایش، از ضد انعقادهای EDTA و یا هپارین استفاده میشود. استفاده از ضد انعقادهای اگزالات و یا فلوئور در این آزمایش توصیه نمیشود. در مورد این آزمایش، از فریز کردن نمونه باید اجتناب شود. آنزیم G6PD در دمای 4 درجه سانتیگراد به مدت 20 روز پایدار است. به دلیل این که گلبولهای سفید دارای فعالیت آنزیمی بیشتری نسبت به گلبولهای قرمز هستند، توصیه میشود که آزمایش بر روی گلبولهای قرمز شسته شده انجام گردد.
روشهای اندازه گیری و اصول آزمایش:
روش تست فلورسانت لکهای (Fluorescent Spot Test) یا روش باتلر:
گلبولهای قرمز در حالت طبیعی، حاوی مقادیر نرمالی از آنزیم بوده که اگر این سلول را با گلوکز 6ـ فسفات و NADP مجاور نماییم، تبدیل NADP بهNADPH را انجام داده و باعث ایجاد خاصیت فلورسانس میشود؛ زیرا NADPH دارای خاصیت فلورسانسی میباشد. میزان فلورسانس متناسب با میزان آنزیم است.
این روش، یک روش کیفی مناسب و رایج برای غربالگری آنزیم G6PD میباشد که فعالیت آنزیم را به صورت کافی(Sufficient)، ناکافی نسبی (Partial deficient) و یا ناکافی (Deficient) بیان میکند. معمولاً فعالیت کمتر از 30% آنزیم به صورت ناکافی گزارش میشود.
روش اسکوربات سیانید:
در این روش خون با محلول سیانید سدیم و اسکوربات سدیم انکوبه میشود. در این مدت از طریق اکسیداسیون اسکوربات H2O2 تولید میشود و از طرفی سیانید، آنزیم کاتالاز را مهار میکند؛ بنابراین H2O2 برای اکسیداسیون Hb در دسترس قرار گرفته و باعث ایجاد متهموگلوبین و در نتیجه ایجاد رنگ قهوهای میشود. این تغییر رنگ در نقص آنزیمی سریعتر دیده میشود.
ارزيابي کمي:
بررسي مقدار کمي G6PD از طريق اسپکتروفتومتري انجام پذير است. اساس اين تست اندازهگيري مقدار جذب در طول موج 340 نانومتر است که نمايانگر شکلگيري NADPH است. اين تست از طريق مخلوط کردن هموليزات که حاوي گلوکز-6- فسفات ميباشد با کوفاکتور NADP در دمای 30 درجه سانتیگراد و بررسي توليد NADPH انجام ميشود. در نهايت، فعاليت آنزيم G6PD به صورت IU/RBCs و يا IU/Hb گزارش ميگردد.
تشخيص مولکولي:
تشخیص مولکولي ميتواند براي غربالگري جمعيتي، بررسيهاي خانوادگي و تشخيص پيش از تولد مورد استفاده قرار گيرد. بيشترين اهميت تستهاي مولکولي جهت آناليز G6PD در زنان هتروزيگوت ميباشد.
مداخله کننده ها:
رتیکولوسیتوز قابل توجه میتواند نتایج مثبت کاذب در آزمون ایجاد کند. در مواردی که فرد دچار همولیز شده باشد (مانند افراد فاویسمی که باقلا و یا داروهای اکسیدان مصرف کرده باشند)، توصیه میشود که در طی مراحل مختلف آزمایش، قبل از انتقال نمونه بر روی کاغذ صافی، برداشتن نمونه از ته لوله صورت بگیرد، زیرا در این بیماران دچار همولیز، تعداد رتیکولوسیتها افزایش یافته و از آن جایی که فعالیت آنزیم G6PD در رتیکولوسیتها، بالاتر است، برداشتن نمونه از لایههای رویی میتواند منجر به نتیجه مثبت کاذب (طبیعی نشان دادن فعالیت آنزیم G6PD) در این بیماران شود، زیرا رتیکولوسیتها نسبت به گلبولهای قرمز دارای وزن مخصوص کمتری بوده و در سطح نمونه قرار میگیرند.
خشک نشدن لکه خون روی کاغذ صافی نیز از جمله علل ایجاد منفی کاذب در این آزمایش به شمار میرود.
تشخیص کمبود آنزیم معمولاً در زنان هتروزیگوت و افراد دارای گروه خونی ¯A دشوار است.
مقادیر نرمال:
در بررسیهای کیفی، نتیجه این آزمایش به صورتهای زیر گزارش میشود:
فعالیت طبیعی آنزیم (Sufficient)
کاهش نسبی آنزیم (Partial deficient)
فقدان آنزیم (Deficient)
در بررسیهای کیفی، مقدار طبیعی این آنزیم معمولاً U/gr hemoglobin 8/8- 13/4 میباشد.
منابع:
1- علیمحمدی م. و رستمی م. آزمایشگاه بیوشیمی پزشکی 1 و 2. قم. انتشارات ابتکار دانش . چاپ اول. 1393.
2- Salvemini F, Franze A, Iervolino A, Filosa S, Salzano S, Ursini MV. Enhanced Glutathion levels and oxidative resistance mediated by inhibited G6PD expression. J Biol Chem 1999;274:2750-54.
3- Bruneel F, Gachot B, Wolff M, Bedos JP, Regnier B, Danis M, et al. Blackwater fever. Presse Med 2002;31(28):1329-34.
4- Djibo A, Souna-Adamou A, Brah Bouzou S.Blackwater fever in adults with sickle cell anemia. Two fatal cases. Med Trop 2000;60(2):156-8.(French.
5- Harrisons principles of internal medicine. 2005; 16th Edition.
6- Provan D. and Gribben J. Molecular hematology. 2000; 2nd Edition.
7- Ciesla B. Hematology in practice. 2007.
8- Beck N. Diagnostic hematology. 2009.
9- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
10- Cavanaugh BM. Nurses manual of laboratory and diagnostic tests. 2003; 4th Edition.
11- Van Leeuwen AM, Kranpitz TR and Smith L. Laboratory and diagnostic tests with nursing implications. 2006 ; 2nd Edition.
12- Wilson DD. Manual of laboratory and diagnostic tests. 2008.
13- Hoffbrand A.V., Catovosky D. and Tuddenham E.G.D. Postgraduate hematology. 2005. 5th Edition.
https://medlineplus.gov/genetics/condition/glucose-6-phosphate-dehydrogenase-deficiency/
https://medlabnews.ir/%d8%a8%db%8c%d9%85%d8%a7%d8%b1%db%8c%e2%80%8c%d9%87%d8%a7%db%8c-%d8%a7%d8%b1%d8%ab%db%8c/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام