آزمایشگاه و بالین
گزارش پاتولوژی
دکتر محسن منشدی
آزمایشگاه تشخیص طبی دکتر منشدی
پزشک پس از انجام بیوپسی، نمونه را برای پاتولوژیست ارسال میکند. پاتولوژیست نمونهها را در دو حالت ماکروسکوپی (مشاهده با چشم غیرمسلح) و میکروسکوپی (با بزرگنمایی) بررسی کرده و سپس گزارش مربوطه را برای پزشک ارسال میکند. این گزارش شامل اطلاعاتی درباره ظاهر بافت، ساختار سلولی و وضعیت بیماری یا سلامت است. گزارش آسیبشناسی برای پزشک، جهت درمان بیمار، از آن نظر که انتخاب روش درمان مبتنی بر اطلاعات مندرج در گزارش است، حیاتی میباشد.
.
گزارش ماکروسکوپی
اولین بخش از گزارش آسیبشناسی، گزارش ماکروسکوپی است. این گزارش، ظاهر کلی بیوپسی را شرح میدهد. اغلب اوقات پاتولوژیستها محلی را که از آن نمونهبرداری شده است، همچنین شکل تومور و داشتن و یا نداشتن حاشیه مشخص را، گزارش میکنند. در این بخش اندازه بیوپسی نیز گزارش میشود. معمولاً قطر یا طول و وزن نمونه گزارش میگردد. تمام ابعاد و یا اندازه شناسهها برمبنای سیستم اندازهگیری متریک است؛ به این معنی که طول یا قطر به سانتیمتر و وزن به گرم ارائه میشود.
نکته: تقریباً هر 2 و نیم سانتیمتر معادل 1 اینچ و هر 454 گرم معادل 1 پوند است.
گزارش میکروسکوپی
بخش دوم از گزارش آسیبشناسی، گزارش میکروسکوپی است. این بخش حاوی اطلاعات و توصیفاتی است که پاتولوژیست با مشاهده نمونه توسط میکروسکوپ بدست میآورد. در اینجا بیوپسی، با زبان بسیار فنی در سطح سلولی توصیف میشود.
آتیپیکال، اصطلاحی است برای توصیف سلولهایی که در هنگام بررسی، ظاهری غیرطبیعی دارند. چندین عامل میتوانند سطوح مختلف “آتیپی” را توصیف کنند؛ یک سلول آتیپیک غالباً دارای هستهای بزرگتر از حد معمول و حاوی مقدار بیشتری کروماتین، نسبت به حالت طبیعی است. آسیب شناسان همچنین میزان تقسیم سلولی را که نشانهای از سرعت تکثیر آنها میباشد، مورد بررسی قرار میدهند.
تمایز، اصطلاحی برای توصیف میزان تخصص سلول، برای انجام یک کار خاص، در یک بافت معین است. هر چه سلول از تمایز کمتری برخوردار باشد، آن سلول آتیپیکتر اطلاق میشود.
همچنین، یکی از نگرانیها در گزارش میکروسکوپی این است که آیا تمام سلولهای غیرطبیعی، از قسمت بیوپسیشده، برداشته شدهاند یا خیر؟ برای اطمینان از این امر، پاتولوژیست حاشیه بیوپسی را زیر میکروسکوپ بررسی میکند، اگر حاشیهای از سلولهای طبیعی، سلولهای غیرطبیعی را احاطه کرده باشند، گفته میشود که بیوپسی دارای حاشیههای واضح است و فرض بر این قرار میگیرد که تمام سلولهای غیرعادی برداشته شدهاند. اگر به نظر برسد که در لبه بافت برداشتشده، سلولهای غیرطبیعی قرار دارند، پس حاشیهها واضح نبوده و گزارش پاتولوژی حاوی دستورات بیشتری برای پزشک خواهد بود که شامل اطلاعات خاص در مورد مناطقی که نیازمند درمان بیشتر مثل جراحی و یا سایر روشهای دیگر است، میباشد.
تشخیص
معمولاً یک گزارش پاتولوژی شامل یک بخش انتهایی به نام تشخیص است. در این بخش پاتولوژیست یک تشخیص فنی میدهد که بیانگر خوشخیم یا بدخیم بودن بیوپسی است. اگر مشخص شود که بیوپسی خوشخیم است، پاتولوژیست نظر خود را در مورد میزان خطر بافت برداشتشده برای سلامت بیمار در آینده و احتمال اینکه این بافت یا تومورهای دیگری مثل این، به تومورهای بسیار مضر بدخیم مبدل گردد را، ارائه میدهد. اگر مشخص شود که بیوپسی حاوی بافت بدخیم است، در این صورت، پاتولوژیست شدت سرطان را بر اساس یافتههای موجود در بخشهای دیگر گزارش، ارائه میدهد.
در برخی موارد، ممکن است یک بخش اضافی به نام “نظرات” در گزارش وجود داشته باشد که در آن سایر آزمایشهایی که باید بر روی بیوپسی انجام شود و یا سایر آزمایشهایی که هنوز نتایج آنها کامل نشده است، لیست شدهاند. سرطانهای برخی از اندامها، نیازمند آزمایشهای خاص اضافی دیگر است که این آزمایشهای اضافی در گزارش قید میشوند.
پاتولوژی چیست؟
پاتولوژی یکی از شاخههای پزشکی است که علت و ماهیت بیماری را بررسی میکند. در پاتولوژی سرطان پستان، پاتولوژیست نمونههای بافت بدست آمده از بیوپسی یا جراحی را بررسی میکند.
نمونههای پاتولوژی چگونه تهیه میشوند؟
برای مثال در پاتولوژی سرطان پستان، نمونهها از طریق بیوپسی یا جراحی، از ضایعات پستان گرفته میشوند. انواع بیوپسیهای مورد استفاده برای سرطان پستان عبارتند از: آسپیراسیون سوزنی (FNA)، بیوپسی سوزنی هسته و تکهبرداری.
پس از تهیه نمونهها چه اقداماتی بر روی آن انجام میشود؟
پس از اخذ نمونه، بافت از نظر شیمیایی محافظت میشود و برای انجام آزمایش، مرحله آمادهسازی صورت میگیرد، سپس نمونه توسط میکروسکوپ مورد بررسی قرار میگیرد. رنگهای متنوعی برای نشان دادن ویژگیهای مهم نمونه، استفاده میشوند.
مرحلهبندی یک تومور چگونه انجام میشود؟
شدت سرطان، به کمک یافتههای بیوپسی در گزارش پاتولوژی، بهوضوح مشخص میشود. مرحلهبندی برای تعیین گزینههای مناسب در درمان یک سرطان خاص، دارای اهمیت است. ضمن مهم بودن مرحله سرطان، باید توجه داشت که پیشآگهی ممکن است تحت تأثیر عوامل دیگری از قبیل سن بیمار و سایر عوامل مرتبط با سلامتی قرار گیرد.
پاتولوژیستها از روشهای مختلفی برای تعیین مرحله تومور استفاده میکنند؛ آنها ویژگیهای سلولهای سرطانی و همچنین ساختار کلی نمونه را مورد مطالعه قرار میدهند، آنها شاخص میتوزی (چه تعدادی از سلولها تقسیم میشوند) و درجه هیستولوژیکی (مقیاسی از ظهور سلولهای غیرطبیعی) را نیز تعیین میکنند. یکی از روشهای رایج، سیستم T/N/M است که سه ویژگی مهم سرطان را شناسایی میکند و میزان شدت هرکدام از آن ویژگیها، تعیینکننده میزان شدت ابتلا به سرطان در بیمار است.
- عنصر “T” تومور (TUMOR) – اندازه تومور یا میزان گسترش آن را به بافتهای اطراف نشان میدهد. عنصر “T” همراه با یک عدد 1 تا 4 است که بیانگر اندازه و محل گسترش تومور میباشد. عدد بالاتر یا نشاندهنده تومور بزرگتر است و یا اینکه تأثیر بیشتری بر روی بافتهای اطراف گذاشته است.
- گرههای لنفاوی (Lymph Nodes) – مؤلفه “N” درگیری گره لنفاوی را تشریح میکند و نشاندهنده گسترش یا عدم گسترش تومور به گرههای لنفاوی اطراف، تعداد گرههای درگیر و اندازه آنها است. عدد بین 0 تا 2 نشاندهنده سطح درگیری گره لنفاوی است که در آن عدد بالاتر، نشاندهنده یک وضعیت شدیدتر است. یک تومور نسبتاً کوچک که به غدد لنفاوی اطراف گسترش یافته است، ممکن است علیرغم اندازه کوچکش، بهعنوان N1 یا N2 با شدت بیشتر، طبقهبندی شود.
- متاستاز (Metastasis) – میزان احتمال گسترش سرطان به نقاط دیگر بدن. مؤلفه “M” نشان میدهد که متاستازهای دور، شناسایی شدهاند. یک رشد متاستاتیک در مکانی متمایز از سایت اصلی تشکیل تومور، مستقر میشود. در این مورد، M0 نشان میدهد که هیچ متاستاز دوری وجود ندارد و M1 نشان میدهد که متاستازهای دور توأم با سرطان وجود دارد. واژه M برای سیستم یا عضوی که متأثر از متاستاز باشد نیز بکار میرود. این مؤلفه، اطلاعات بیشتری را در مورد شدت سرطان ارائه میدهد، چون مکان متاستاز ممکن است پیشآگهی بیمار را تغییر دهد.
هر توموری مجموعهای از شناسهها را شامل میشود که شامل جزء T، N و M میباشد. مجموع این مؤلفهها، مبیّن شدت سرطان هستند، سپس این مجموعه باارزش، برای توصیف یک مرحله سادهتر و کلی در طبقهبندی سرطان، شامل مراحل I، II، III یا IV بکار میرود. همانطور که انتظار میرود، درجه ملایمT، N و M، به یک مرحله پایینتر مربوط میشود؛ بهعنوان مثال، تومور T1، N0، M0، به احتمال زیاد یک سرطان مرحله Iاست. این روش مرحلهبندی سادهشده، میتواند به پزشکان و بیماران در تصمیمگیری برای انتخاب روش درمان کمک کند و همچنین نشاندهنده پیشآگهی بیماری است. (1)
ایمنوهیستوشیمی (IHC) چیست؟
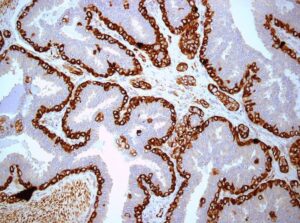
ایمنوهیستوشیمی تکنیکی است که برای تعیین حضور و میزان پروتئینهای خاص سلولی از آن استفاده میشود. این تکنیک، مقادیر پروتئین را با استفاده از آنتیبادیهای نشانداری که تمایل به اتصال به پروتئینها دارند، اندازهگیری میکند. آنتیبادی با اجزای سلول توموری باند میشود، بعد از گذشت مدت زمان معینی، این مخلوط شسته شده و فقط آنتیبادی متصل به پروتئینهای خاص باقی میماند. حضور آنتیبادیها زیر میکروسکوپ، قابل بررسی است، مناطقی که حاوی آنتیبادیهای متصلشده هستند، رنگی متفاوت از مناطق فاقد آنتیبادی دارند. نمونههایی که حاوی پروتئینهای زیادتری هستند، به آنتیبادی بیشتری متصل شده و سیگنال (رنگ) قویتری میدهند، بنابراین رنگ تیرهتری هم دارند. این خاصیت به تست این امکان را میدهد تا نهتنها حضور پروتئین را نشان دهد، بلکه میزان نسبی پروتئین را نیز مشخص کند. نتایج آزمون بستگی بهشدت رنگآمیزی و درصد سلولهای رنگشده دارد.
IHC یک تکنیک متداول میباشد، چون هم ارزان است و نیاز به تجهیزات خاصی ندارد و هم بهطور کلی بسیار دقیق است.
بهعنوان مثال، سه پروتئین خاص سرطان پستان عبارتند از: HER2، گیرنده استروژن (ER) و گیرنده پروژسترون (PR).
HER2 یک گیرنده عامل رشد واقع در سطح سلولهای پستان است. حدود 30٪ از بیماران مبتلا به سرطان پستان، تومورهایی دارند که میزان بسیار زیادی از HER2 را بیان میکنند. داروهای ضد سرطان Herceptin® در این پروتئین مورد هدف قرار میگیرند و باعث تعیین دقیق وجود یا عدم وجود این پروتئین در یک تومورمیگردند که گام مهمی در تعیین درمان مناسب است.
پروتئین ER یکی دیگر از گیرندههای رشد است. پروتئین ER، به هورمون جنسی زنانه “استروژن” متصل میشود و نقش مهمی در تحریک تقسیم سلولی، در سلولهای پستان دارد. از آنجا که داروهایی که با سیگنالینگ استروژن مواجه میشوند، ابزار مهمی در درمان سرطان پستان هستند، تعیین دقیق سطوح ER برای طراحی برنامههای درمانی مهم است.
پروتئین PR یک گیرنده هورمون جنسی زنانه “پروژسترون” است. درحالیکه هیچ هدف درمانی در مقابله با پروتئین PR وجود ندارد، وجود یا عدم وجود این گیرنده در سلولهای سرطانی عامل تعیینکننده پیشآگهی بیماری است.
هیبریداسیون فلورسانس درجا (FISH) چیست؟
FISH تکنیکی است که تکثیر ژن و ناهنجاریهای کروموزومی را با استفاده از پروبهای DNA نشاندارشده با فلورسنت اندازهگیری میکند. DNA نشاندارشده با فلورسنت، به مناطق خاصی از DNA چفت میشود و هنگامی که مناطق چفتشده در معرض تماس با هم قرارمیگیرند، به یکدیگر متصل میشوند. حضور این پروب، نشان از زمینههای تمایل است. مقدار و موقعیت پروب محصورشده برای شناسایی ژنهایی که بهطور غیرطبیعی کپی شدهاند یا در برخی از مسیرهای اصلی تغییر کردهاند، تجزیه و تحلیل میشوند.
نمونه بافت تومور پستان را گرم کرده و آن را برای انجام تست FISH آماده میکنند. این فرآیند گرمایشی که به آن دناتوراسیون گفته میشود DNA را به دو رشته تکرشتهای تقسیم میکند. پروب نشاندارشده، به مخلوط DNA دناتورهشده اضافه میشود. DNA نشاندارشده با فلورسنت با مناطق خاصی از DNA دناتورهشده چفت شده و وقتیکه این مناطق چفتشده در تماس با یکدیگر قرار گیرند، به یکدیگر متصل میشوند، سپس این مخلوط شسته میشود و DNAهای نشاندارشدهای که متصل نشدهاند، از این مخلوط جدا میگردند. مخلوط شستهشده توسط میکروسکوپ مخصوصی که قادر به تشخیص رنگ منتشره از پروب است بررسی میگردد. پروب، مناطقی از DNA (ژنها) را که برای پروتئین خاص مورد توجه هستند، نشان میدهد، بنابراین مقدار پروب متصلشده به DNA یک اندیکاتور غیرمستقیم در تعداد ژنهای حاضر کدشده برای پروتئین هستند.
FISH تکنیک سریع و بسیار حساسی است که یک سیستم امتیازدهی را فراهم میکند. این تکنیک بسیار گرانتر از IHC است و به یک میکروسکوپ فلورسانت برای تفسیر کردن نیاز دارد و به همین دلیل در همه جا این روش قابل انجام نیست.
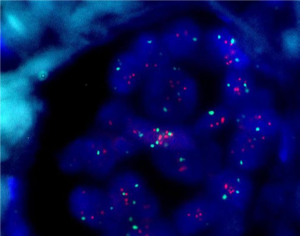
FISH برای تعیین وضعیت HER2 در سرطان پستان
در مورد وضعیت HER2 در سرطان پستان، پروب نشاندارشده با DNA به ناحیهای از DNA که برای پروتئین HER2 کد شده است، متصل میگردد. پاتولوژیستها قادر خواهند بود تعداد ژنهای HER2 را با اندازهگیری تعداد پروب در نمونه مشخص کنند. توموری HER2 مثبت تلقی میشود که در نمونه آن، بیش از 2 نسخه کپی از ژن HER2 در هر کروموزوم 17 موجود باشد.
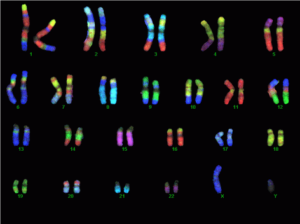
نمونهای از مجموعه کامل کروموزوم با استفاده از انواع تکنیکهای FISH که با رنگهای مختلف نشاندار شدهاند در شکل زیر نمایش داده میشود.
منابع:
- b. Z Theodosiou, IN Kasampalidis, G Livanos, M Zervakis, I Pitas, K Lyroudia. Automated analysis of FISH and immunohistochemistry images: a review. Cytometry Part A. 2007. 71;7:439-50. [PUBMED]
- Zafrani B, Aubriot MH, Mouret E, et High sensitivity and specificity of immunohistochemistry for the detection of hormone receptors in breast carcinoma: comparison with biochemical determination in a prospective study of 793 cases. Histopathology. 2000; 37(6):536-45. [PUBMED]
- b. M Bilous, M Dowsett, et al. Current Perspectives on HER2 Testing: A Review of National Testing Guidelines. Modern Pathology. 2003; 16(2):173-182. [PUBMED]
- Zafrani B, Aubriot MH, Mouret E, et High sensitivity and specificity of immunohistochemistry for the detection of hormone receptors in breast carcinoma: comparison with biochemical determination in a prospective study of 793 cases. Histopathology. 2000; 37(6):536-45. [PUBMED]
- b. c. DG Hicks, RR Tubbs. Assessment of the HER2 status in breast cancer by fluorescence in situ hybridization: a technical review with interpretive guidelines. Human Pathology. 2005 Mar;36(3):250-61. [PUBMED]
- b. DG Hicks, RR Tubbs. Assessment of the HER2 status in breast cancer by fluorescence in situ hybridization: a technical review with interpretive guidelines. Human Pathology. 2005; 36:250-261. [PUBMED]
- b. M Bilous, M Dowsett, et al. Current Perspectives on HER2 Testing: A Review of National Testing Guidelines. Modern Pathology. 2003; 16(2):173-182. [PUBMED]
- . College of American Pathologists [http://www.cap.org/]
- . The Biopsy Report: A Patient’s Guide [http://www.cancerguide.org/pathology.html]
- . The American Cancer Society [http://www.cancer.org]
11.. American Joint Committee on Cancer. AJCC Cancer Staging Manual, 5th ed. Philadelphia: Lippincott-Raven, 1997.
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام