کنترل کیفی در آزمایشگاه تجزیه ادرار
نویسنده: محمدرضا یزدانی کارشناس ارشد ایمنیشناسی پزشکی دانشگاه علوم پزشکی شیراز
حصول اطمینان از صحت و دقت کارهای انجامشده بر روی نمونههای آزمایشگاهی امری ضروری است. علیرغم تعداد زیاد تستهای تجزیه ادرار، متأسفانه برنامههای کنترل کیفیت به مانند سایر بخشهای آزمایشگاه در آن اجرا نمیشود. البته انجام کنترل کیفی در بخش تجزیه ادرار بسیار کار مشکلی است؛ چون بخش بزرگی از آزمایش تجزیه ادرار مشاهده میکروسکوپی نمونه ادرار میباشد و کنترل این بخش بهسادگی امکانپذیر نیست. برنامه تضمین کیفیت در آزمایشگاه باید حاوی مکانیسمی برای تشخیص مشکلات باشد و فرصتی برای ارتقاء سیستم را فراهم نماید، در اصل تضمین کیفیت مجموعه عظیمی از تصمیمها، سیاستها و دستورالعملهایی است که در کنار هم ساختاری نظارتی را برای رسیدن به اهداف کلان آزمایشگاه، فراهم مینماید. در مقیاس کلان، کلیه اجزای سیستم درمانی، شامل پزشکان، پرستاران، درمانگاهها، بیمارستانها و خدمات مرتبط با آنها در تضمین کیفیت دخیل میباشند.
آزمایشگاه فقط قسمتی از یک برنامه عظیم جهت اطمینان از کیفیت خدمات درمانی است. یک برنامه تضمین کیفیت، همه اجزای آزمایشگاه تجزیه ادرار را شامل میشود. جمعآوری نمونه، نگهداری نمونه، حملونقل و انتقال نمونه، تجهیزات مورد استفاده و نگهداری آنها، تهیه محلولها و کنترل کیفی آنها، صلاحیت علمی و عملی پرسنل، حداقلهای لازم برای اطمینان از جواب آزمایش بدست آمده در بخش تجزیه ادرار محسوب میگردد. برای رسیدن به اهداف تعیینشده در برنامه QA، تعهد همه پرسنل آزمایشگاهی، از جمله کسانی که در رأس کار و مدیریت هستند، ضروری است. این تعهد باید در تصمیمات مدیریتی، از جمله تخصیص فضای آزمایشگاهی، خرید تجهیزات و منابع و اختصاص بودجه مناسب آشکار شود، بدون منابع کافی، کیفیت خدمات آزمایشگاهی به خطر افتاده است.
استفاده از کارکنان آزمایشگاهی باتجربه و آموزشدیده با سطح مهارتی بالا برای اطمینان از کیفیت نتایج آزمایشگاهی امری ضروری میباشد. بسیاری از مطالعات نشان دادهاند که بطور کلی استانداردهای تهیهشده مرتبط با روشهای جمعآوری و آنالیز نمونه کمتر توسط آزمایشگاههای سطح بالا مورد استفاده قرار میگیرد. برنامه تضمین کیفیت در بخش تجزیه ادرار از سه قسمت؛ 1- قبل از آنالیز (شامل دستورالعملهای مربوط به نحوه صحیح جمعآوری نمونه، نحوه صحیح انتقال نمونه، شرایط نگهداری نمونه قبل از انجام و پروسسینگ نمونهها) 2- حین آنالیز (استفاده از نوار ادرار و یا روشهای تکمیلی نامناسب، عدم ثبت نتایج در زمان صحیح، انجام ناصحیح واکنشها) و 3- پس از آنالیز (همانند گزارش یکسان طبق استانداردهای گزارشدهی، گزارش جابجا، گزارش نتایج بحرانی در بخش آنالیز ادرار) تشکیل گردیده است. ازآنجاکه بروز خطا در هر قسمت، مستقیماً بر کیفیت نتایج اثر میگذارد، هرکدام از سه قسمت فوق باید تحت کنترل، ارزیابی و محافظت قرار گیرد.
مؤلفههای بخش پریآنالیتیکال اطمینان کیفیت:
-
Preanalytical Components of Quality Assurance
بخش آنالیتیکال شامل تعدادی از کارمندان اصلی و کارمندان مرتبط با آزمایشگاه و در بسیاری از موارد بخشهای مختلف میباشد. با توجه به هزینه بالای انجام آزمایش، آزمایشگاهها با اجتناب از تکرار بیدلیل تستها و اطمینان از صحت جواب حاصلشده، نقش بسزایی در کاهش هزینه و مقرونبهصرفه شدن شیوههای انجام تست ایفا مینمایند. هر آزمایشگاه با توجه به روشهای جریان کاری و ساختار خاص خود باید روشهایی برای بازرسی و از بین بردن آزمایشهای غیرضروری طراحی نماید. آزمایشگاه نباید بیشازحد به گزارش بهموقع نتایج آزمایشگاهی توجه نماید. تأخیر در انتقال و بررسی نمونه مستقیماً بر زمان چرخه کاری آزمایشها تأثیرگذار است. زمان چرخه کاری از دید پزشکان و پرستاران با این زمان از دید آزمایشگاه در تعارض است. از نظر پزشکان، زمان چرخه کاری یک تست از زمان نوشتن درخواست تست تا زمانی که نتایج به آنها اطلاع داده میشود محسوب میگردد.
اما از دید آزمایشگاه زمان چرخه کاری یک تست، از زمان پذیرش تست در آزمایشگاه تا زمان ورود نتایج در کامپیوتر یا یک بانک اطلاعاتی در نظر گرفته میشود. برای نظارت و رسیدگی به تأخیرهای احتمالی که مستقیماً مربوط به آزمایشگاه میشوند، سیاستهایی برای مستندسازی زمان جمعآوری و انتقال نمونه، پذیرش و زمان جوابدهی نتایج لازم است. تکنیکهای جمعآوری نمونه متفاوت است و اغلب توسط پرسنل درمانی خارج از آزمایشگاه کنترل میشود و میتواند مستقیماً در نتایج آزمایشگاه تأثیر بگذارد، بعلاوه اینکه فاکتورهای زیادی (تغذیه، ورزش، داروها و …) میتواند بر روی نمونه ادرار جمعآوریشده تأثیر بگذارد.
برای اطمینان از جمعآوری یک نمونه مناسب، باید آزمایشگاه دستورالعمل کامل جمعآوری نمونه و نحوه لیبلگذاری نمونهها را نوشته و بین پرسنل درمانی درگیر در این پروسه توزیع نماید. پرسنل آزمایشگاه که مسئول دریافت نمونه میباشند باید با معیارهای رد یا قبول نمونه آشنا بوده و بتوانند یک نمونه نامناسب را شناسایی نمایند (جدول 1)، بعلاوه اینکه ایشان باید مشکلات نمونه را مستند نموده و اطلاع دهند تا مشکلات برطرف گردد. روش کار پرسنل پذیرش باید شامل موارد زیر باشد:
- تطبیق لیبل روی نمونه بیمار و برگه درخواست آزمایش
- ارزیابی مدت زمان سپریشده بین جمعآوری و دریافت نمونه
- استفاده از روشهای مناسب نگهداری نمونه در صورت نیاز
- قابلیت پذیرش نمونه (حجم مناسب نمونه، ظرف استفادهشده، تمیزی و عدم آلودگی با مدفوع و …)
اگر نمونه قابلقبول نباشد، یک روش باید در نظر گرفته شود تا اطمینان حاصل شود که پزشک یا کارکنان پرستاری از مشکل اطلاع یافته، مشکل یا اختلاف ثبت شده و اقدامات مناسب انجام شده است. دستورالعملهای نوشتاری که معیارهای رد نمونه را تعیین میکنند و همچنین روش برای مدیریت نمونههای نامناسب، باید طراحی شود و توسط پرسنل بکار گرفته شود. یکی از منابع خطای قبل از تجزیه، پروسه انجام تست در آزمایشگاه است. نمونه ادرار باید بلافاصله مورد آزمایش قرار بگیرد، اگر امکان انجام سریع آزمایش نیست باید نمونه در یخچال و دور از نور قرار بگیرد.
ازآنجاکه تعداد زیادی پرسنل و عوامل تأثیرگذار بر روی جمعآوری و پردازش نمونه ادرار تأثیرگذارند، آموزش و نظارت مناسب امری ضروری محسوب میگردد. مستندات بخش تجزیه ادرار باید در دسترس باشند و پرسنل باید دستورالعملهای تجهیزات و برنامههای نگهداری را انجام دهند؛ پرسنل باید در مورد اقدامات احتیاطی در مورد خون و مایعات بدن، آموزش مناسب داشته باشند و ارتباط با پرسنل در مورد تمام تغییرات رویه یا معرفی رویههای جدید باید مداوم و پایدار باشد.
جدول 1: معیار رد یا قبول نمونه تجزیه ادرار
| · کم بودن حجم نمونه ادرار
· روش جمعآوری یا نمونه ادرار نامناسب · وجود آلودگی آشکار در نمونه (آلودگی با مدفوع، مواد و قطرات چربی و…) · استفاده از نگهدارنده نامناسب · عدم نگهداری مناسب نمونه جهت نمونههایی که با تأخیر انتقال داده میشوند · نمونه بدون لیبل، دارای لیبل اشتباه · عدم وجود فرم درخواست تست، فرم ناقص |
در ادامه مبحث متغیرهای پریآنالیتیکال، به شرح عوامل تأثیرگذار قبل از انجام آزمایش تجزیه ادرار میپردازیم.
1-1 فرم درخواست آزمایش تجزیه ادرار:
فرمهای درخواست دستی و یا سیستمهای کامپیوتری باید شامل نام، سن، جنسیت، سرپایی یا بستری بودن بیمار و تشخیص پزشک، نوع نمونه ادرار جمعآوریشده، ساعت و تاریخ جمعآوری باشند. همچنین باید دارای بخشی برای ثبت اطلاعات زیر باشد:
- تاریخ و زمان واقعی جمعآوری ادرار
- شرایط خاص جمعآوری نمونه ادرار (نمونه اول صبح، استفاده از کاتتر و…)
- اگر نمونه قبل از انتقال در یخچال نگهداشته شده است.
- زمان تحویل نمونه به آزمایشگاه و زمان انجام تست
همچنین فرم باید شامل قسمتی برای یادداشت شرایط ویژه که ممکن است روی نتایج تأثیر بگذارد (داروها مثل آسپرین، ویتامینها یا آنتیبیوتیکها، مواد نگهدارنده، سابقه بیماری، ورزش شدید و قاعدگی) باشد.
2-1 جمعآوری ادرار و مسائل مرتبط با آن:
1-2-1 ارزیابی نمونه
قبل از انجام آزمایش تجزیه ادرار باید ادرار از نظر شرایط لازم برای پذیرش یک نمونه بررسی شود. این شرایط عبارتند از:
- منطبق بودن نمونه گرفتهشده با آزمایش درخواست شده
- لیبلگذاری صحیح نمونه (باید حداقل شامل نام کامل بیمار، تاریخ و زمان جمعآوری نمونه باشد).
- استفاده از نگهدارنده مناسب
- عدم مشاهده مواد مداخلهگر
- عدم خرابی نمونه بعلت ماندن زیاد
هر آزمایشگاه باید نسبت به تهیه یک دستورالعمل جهت رد یا قبول نمونه ادرار اقدام نماید.
2-2-1 ظرف نمونهگیری:
ظرف نمونهگیری باید خشک و تمیز و ترجیحاً یکبار مصرف باشد. برای آزمایشهای میکروبشناسی و کشت، ظرف مورد استفاده باید حتماً استریل باشد.
3-2-1 حجم ادرار:
حجم ادرار بستگی به تست درخواستی دارد؛ برای آزمایش روتین باید حجم مشخصی آزمایش شود. حداقل حجم ادرار لازم برای آزمایش میکروسکوپی و ماکروسکوپی،12 میلیلیتر میباشد (50 میلیلیتر عالی است). نمونههای ادرار کودک ممکن است کمتر از این میزان باشد. نمونه گرفتهشده باید تمیز و فاقد هرگونه آلودگی با مواد خارجی یا آلودگی با مدفوع باشد، در غیر این صورت باید موارد را برای پزشک نوشته و تقاضای نمونه مجدد نمود.
نکته: آزمایش ادرار در حجم کمتر سبب کاهش کاذب نتایج میگردد، در مواردی که حجم ادرار کم بوده و نمونهگیری مجدد امکانپذیر نباشد میتوان به روش ذیل عمل کرد و جواب را گزارش نمود، برای مثال اگر 5 میلیلیتر ادرار در دسترس باشد میتوان با سرم فیزیولوژی حجم ادرار را به 12 میلیلیتر رساند و بعد جواب را در ضریب 2.4 ضرب نموده و گزارش کرد.
4-2-1 نمونه مناسب:
بهترین نمونه برای انجام آزمایش ادرار نمونه صبحگاهی است چون بعلت 8 ساعت ماندن در مثانه غلظت آن بیشتر است. آزمایش نمونه ادرار باید ظرف مدت دو ساعت انجام پذیرد، اگر یک نمونه ادرار برای انجام چندین آزمایش به آزمایشگاه فرستاده شد، آزمایشهای میکروبشناسی ابتدا باید انجام پذیرد. نمونههایی که بهصورت تصادفی در طول روز گرفته میشود بعلت الگوی متفاوت مصرف مایعات جواب درستی نمیدهد، اگرچه تعداد محدودی از آزمایشها اگر روی نمونههایی که در ساعات معینی از روز جمعآوریشدهاند، انجام گردد، جواب بهتری میدهند؛ مثلاً گلوکز دو تا سه ساعت پس از صرف غذا و یا اوروبیلینوژن در ساعات اول بعدازظهر.
5-2-1 جمعآوری ادرار 24 ساعته:
ادرار 24 ساعته برای متابولیتهایی که در طی شبانهروز با غلظت متفاوت دفع میشوند (مانند کراتینین، پروتئین، VMA و 17KETO) درخواست میگردد. برای انجام این آزمایش باید قبل از جمعآوری ادرار به بیمار دستورالعمل دارویی و غذایی لازم را داد تا تأثیر اینگونه مواد بر روی تست حداقل گردد، برای مثال مصرف موز، آناناس و گردو بعلت تداخل با تست VMA سبب مثبت شدن کاذب تست میگردد. برای جمعآوری نمونه ادرار 24 ساعته باید بیمار ساعت شروع نمونهگیری را ثبت کرده و اولین ادرار پس از این ساعت را بیرون بریزد (چون متعلق به چند ساعت گذشته میباشد) و سپس تمام ادرارها را تازمان 24 ساعت در ظرف مخصوص ریخته وجهت جلوگیری از تخریب مواد موجود در ادرار ظرف را در یخچال نگهداری نماید.
بعضی از تستها، نیاز به مواد نگهدارنده مخصوص خود دارند که باید به این موضوع توجه نمود، برای مثال برای انجام تست VMA نیاز به HCL بهعنوان نگهدارنده در ظرف ادرار میباشد.
6-2-1 روشهای جمعآوری ادرار:
الف) جمعآوری کل ادرار:
نمونه شرایط لازم جهت بررسی باکتریولوژی و کشت را ندارد و ممکن است در خانمها آلوده به ترشحات واژن باشد. 10 میلیلیتر ابتدای ادرار جهت تشخیص اورتریت (عفونت پیشابراه) و نمونه میانی (میداستریم) برای تشخیص عفونت مثانه مناسب است.
ب) سوند مثانه و سوپرابوبیک:
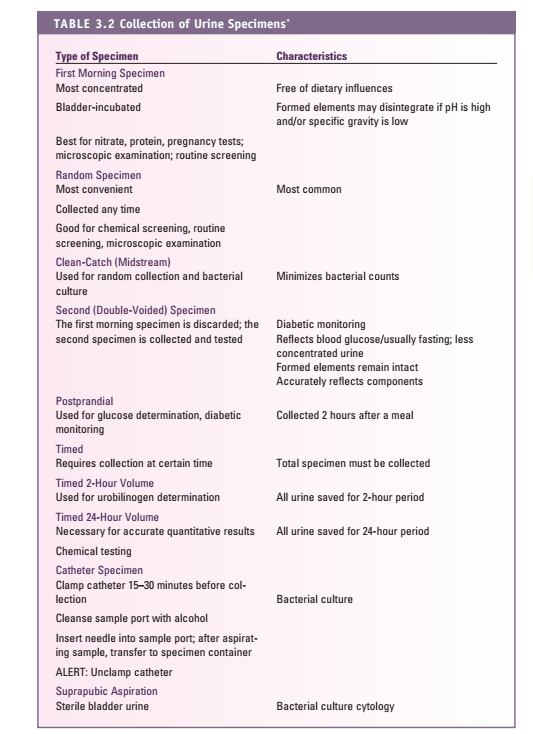
هردو نمونه برای انجام آزمایش ادرار مناسب هستند ولی گرفتن نمونه سخت است. روش مرجع استفاده از نمونه میداستریم به طریق CLEAN-CATCH و یا CLEAN VOIDED و برای نوزادان استفاده از کیسههای ادراری است (جدول 2).
7-2-1 مدت زمان انجام آزمایش:
ماندن بیش از دو ساعت نمونه ادرار، سبب تغییر ترکیبات شیمیایی و تخریب عناصر ادراری میشود. بیلیروبین و اوروبیلینوژن بسیار ناپایدارند و سیلندرها، گلبولهای قرمز و گلبولهای سفید در ادرار با وزن مخصوص کمتر از 1.010 و یا ادرار با PH بیشتر از 7.0 لیز میشوند. در صورت وجود باکتریهای تجزیهکننده اوره، بر اثر تولید آمونیاک ph ادرار قلیایی میشود. ضمناً باکتریها در صورت وجود گلوکز از آن استفاده میکنند و موجب ایجاد منفی کاذب جهت آزمایش قند در ادرار میشوند. چنانچه ادرار بعد از جمعآوری در حرارت 2 تا 8 درجه سانتیگراد قرار گیرد تا 24 ساعت میتوان کشت داد. برای کشت هیچ ماده نگهدارندهای نبایستی به ظرف نمونهگیری اضافه شود.
8-2-1 نگهداری نمونه و استفاده از مواد نگهدارنده:
براساس دستورالعمل GP16-A2 مؤسسه استاندارد آزمایشگاههای بالینی آمریکا (CLSI)، بهطورکلی باید از استفاده مواد نگهدارنده شیمیایی جهت آزمایش تجزیه ادرار اجتناب نمود. آزمایش تجزیه ادرار را باید حداکثر تا مدت دو ساعت بعد از جمعآوری ادرار انجام داد. اگر انجام تست و یا تحویل نمونه به تعویق افتاد میتوان برای بعضی از ترکیبات شیمیایی (بجز بیلیروبین و اوروبیلینوژن) نمونه را در یخچال نگهداری نمود، اگرچه ممکن است اورات آمورف و فسفات آمورف رسوب نماید و فیلد میکروسکوپی تیرهوتار شود.
اگر نمونه کشت داشت باید در زمان انتقال و تا زمان انجام کشت در یخچال بماند. برای نمونههای حساس به نور مثل بیلیروبین باید نمونه ادرار دور از نور نگهداری گردد. در صورت استفاده از مواد نگهدارنده تجاری، باید ابتدا این مواد توسط آزمایشگاه مورد بررسی قرار بگیرد. شاید این مواد برای برخی از ترکیبات مفید باشد اما ممکن است باعث محدودیت برای سایر تستهای ادرار گردد. برای مثال:
سدیم فلوراید: حالت بازدارنده بر روی گلوکز نوار ادراری بهروش آنزیمی دارد و آن را مختل میکند.
فرمالین: غلظت زیاد آن (یک قطره در 30 میلیلیتر ادرار) سبب رسوب پروتئین و پاسخ مثبت کاذب به مواد احیاکننده میگردد.
کلروفرم: مشخصه سلولی رسوب را تغییر میدهد.
قرص نگهدارنده: باعث مثبت کاذب مواد احیاکننده و افزایش وزن مخصوص به میزان 0/005 میشود.
جدول 2: جمعآوری نمونههای مختلف ادرار
2- مؤلفههای مرحله آنالیتیکال اطمینان کیفیت:
Analytical Components of Quality Assurance
اجزای بخش آنالیتیکال بر اساس تستهای آزمایشگاهی انجامشده در آزمایشگاه متفاوت است و شامل مواد، تجهیزات، متدها، روشهای کنترل متدهای آنالیتیکال و مهارتهای پرسنلی میباشند. بعلت تأثیر هرکدام از این عوامل در نتایج آزمایش، روشها باید با دقت توسعه یافته و دنبال شوند تا اطمینان از کیفیت حاصل گردد.
1-2 تجهیزات:
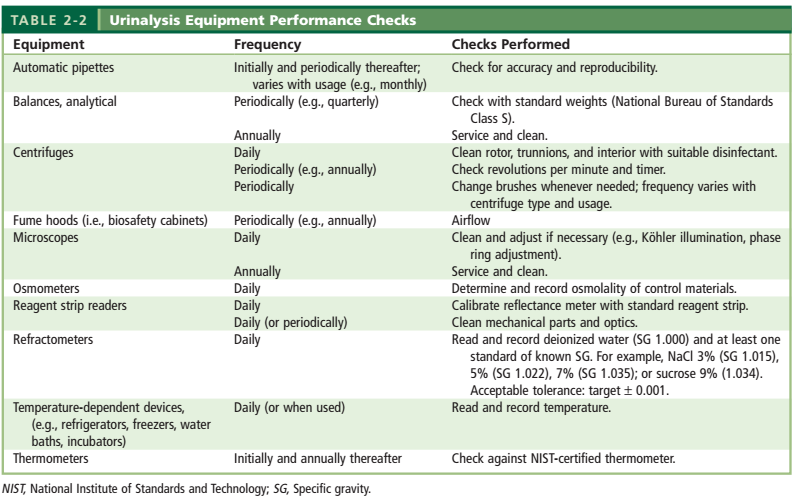
همه تجهیزات مورد استفاده در بخش تجزیه ادرار مانند ظروف شیشهای، پیپتها، ترازوها، سانتریفوژها، یخچالها، فریزرها، میکروسکوپها و رفراکتومتر ها نیازمند کنترل، کالیبراسیون، دستورالعمل فنی و نگهداری میباشند (جدول 3). در ادامه به کنترل کیفی مهمترین تجهیزات بخش تجزیه ادرار اشاره شده است.
جدول 3: کنترل تجهیزات مرتبط با آزمایش تجزیه ادرار
|
|
1-1-2 لوله آزمایش:
- لوله آزمایش ادرار باید پلاستیکی یا شیشهای شفاف باشد.
- لوله آزمایش ادرار باید در برابر شکستگی مقاوم باشد.
- لوله باید دارای برچسب هویت باشد.
- لوله آزمایش بهتر است مدرج باشد و دارای انتهای مخروطی باشد.
- لوله آزمایش سردار باشد تا از پاشیدن ادرار به بیرون جلوگیری نماید.
2-1-2 سانتریفوژ:
– سرعت و زمان سانتریفوژ:
برای آزمایش تجزیه ادرار باید استاندارد باشد. سرعت باید براساسg محاسبه شود. تقریباً g 450 برای مدت پنج دقیقه زمان و سرعت انتخابی است. سانتریفوژ مورد استفاده در بخش تجزیه ادرار باید horizontal باشد تا رسوب عناصر به بهترین شکل صورت پذیرد. برای تبدیل RPM به G از فرمول زیر استفاده میشود.
G=1/118 (10 -5(R) (rpm)2
R برحسب سانتیمتر میباشد.
– کنترل کیفی سانتریفوژ:
برای کنترل کیفی سانتریفیوژ بهطور معمول دور، زمان و دما را کنترل میکنند.
الف) دور سانتریفیوژ (RPM):
هر سه ماه یکبار بهوسیله تاکومتر اندازهگیری میشود. دور بدستآمده با تاکومتر با دور مشاهدهشده بر روی عقربه سانتریفیوژ مقایسه میشود. تا 5% خطا اشکال ندارد. در صورت خطای بیشتر دستگاه باید سرویس شود. سانتریفیوژ باید در ماکزیمم سرعت خود کالیبرشود. شرایط کالیبراسیون باید یکسان باشد با همان Head و همان تعداد لوله خالی
ب) کنترل تایمر:
1- بین حداکثر و حداقل زمانهای سانتریفیوژ، 5 زمان را با فواصل مساوی انتخاب کنید.
2- زمانهای موردنظر را یادداشت کنید.
- زمانسنج سانتریفیوژ را با یکیک این زمانهای انتخابشده تنظیم نمایید و هر بار دکمهی آغاز کرنومتر را فشار دهید. هنگامیکه مدت زمانسنج تمام شد کرنومتر را خاموش کنید. نتیجه را در فرم کالیبراسیون وارد کنید و اختلاف بیش از 10% را گزارش کنید.
ج) کنترل دما:
یک لوله آزمایشگاه را از آب مقطر استریل پر میکنیم و دمای آن را یادداشت میکنیم، سپس لوله را در سانتریفیوژ میگذاریم و بلافاصله دمای آن را با دماسنج اندازه میگیریم. تا c˚5 اختلاف دما در سانتریفیوژ معمولی و c˚2 اختلاف دما در سانتریفیوژ یخچال دار اشکال ندارد. کنترل دما باید ماهی یکبار صورت گیرد.
د) بازدید زغال:
هر سه ماه یکبار باید انجام شود ولی زغال سانتریفیوژ باید هر شش ماه یکبار عوض شود.
3-1-2 وزن مخصوص ادرار و کنترل کیفی آن:
- وزن مخصوص ادرار:
بررسی وزن مخصوص و اسمولاریته ادرار دو روش شایع برای سنجش غلظت ادرار است. سنجش اسمولاریته مفیدتر و دقیقتر از سنجش وزن مخصوص است اما سنجش وزن مخصوص بسیار راحتتر انجام میگیرد. اسمولالیته و وزن مخصوص ادرار هر دو برای ارزیابی قدرت غلیظسازی ادرار استفاده میشوند. همه موادی که در ادرار حل میشوند مانند املاح یونیزه و املاح غیریونیزه (اوره، اسیداوریک، قند) در اسمولالیته و وزن مخصوص اثر میگذارند اما ذرات کلوئیدی مانند پروتئین و لیپید بر روی اسمولالیته چندان اثری نداشته ولی باعث افزایش وزن مخصوص ادرار میشوند. وزن مخصوص ادرار درواقع نسبت وزن نمونه به وزن یک حجم برابر از آب مقطر در دمای یکسان است. میزان نرمال وزن مخصوص از 1.003 تا 1.035 میباشد. میزان بالای وزن مخصوص در زمانی که ادرار حاوی مواد حاجب عکسبرداری و میزان زیادی قند و پروتئین باشد، مشاهده میگردد.
 |
برای اندازهگیری وزن مخصوص پنج روش وجود دارد:
- رفراکتومتر
- اسمومتر
- نوار اداری
- هیدرومتری
- آنالیزر با نوسان هماهنگ
استفاده از رفراکتومتر ارجحیت دارد. جهت استفاده از نوار در ادرار با Ph قلیایی مساوی یا بالاتر از 6/5 باید 0/005 به عدد خوانده شده اضافه کرد. مواد غیریونی مثل گلوکز یا اشعه ایکس و پروتئین با غلظت mg/dL 100-750 اثر ناچیز دارند، لذا جواب در صورت وجود این مواد نسبت به سایر روشها پائینتر است. در رفراکتومتر برای گلوکز و پروتئین باید ضریب تصحیح به کار ببریم، یعنی برای هر gr/dL پروتئین 0/003 و برای gr/dL گلوکز 0/004 از جواب Special gravity کم نمود. چون این مواد هیچ ارتباطی با توانایی تغلیظ کلیه ندارند. برای نمونه حاوی مواد حاجب عکسبرداری استفاده از نوار ادراری دارای وزن مخصوص و یا سنجش اسمولالیته میتواند مفید باشد.
- کنترل کیفی رفراکتومتر:
- باید روزانه و در هر نوبت کاری دستگاه رفراکتومتر با آب مقطر کلاس 1 صفر شود.
- برای کنترل کیفی رفراکتومتر دو راه وجود دارد:
- سنجش وزن مخصوص با رفراکتومتر (و تصحیح آن) و مقایسه با نوار ادراری یا سایر روشها. البته این روش دقیق نیست.
- از محلولهای زیر یا کنترل Low و High استفاده کنیم (جدول 4).
جدول 4: مواد مورد استفاده برای کنترل کیفی وزن مخصوص
| مواد مورد استفاده برای کنترل کیفی وزن مخصوص | وزن مخصوص |
| 20.29 گرم پودر پتاسیم سولفیت را در آب مقطر حل میکنیم و به حجم یک لیتر میرسانیم | 1.009 |
| NACL 3% | SG: 1.015 ± 0.001 |
| SUCROSE 9% | SG: 1.034 ± 0.001 |
| NACL 5% | SG: 1.022±0.001 |
2-2 معرفها (reagents):
جوابهای قابل اعتماد در آزمایشگاه تجزیه ادرار با استفاده از معرفهای باکیفیت بدست میآید. آزمایشگاه باید دارای منبع کافی از آب مقطر، آب دیونیزه و آب آزمایشگاهی (clinical laboratory reagent water) باشد. هر پروسیجر بخش تجزیه ادرار نیازمند آب مخصوص به خود است. کیفیت آب آزمایشگاهی باید بهصورت دورهای از نظر ترکیبات یونی، ناخالصیهای ارگانیک و آلودگی میکروبی کنترل گردد (جدول 5). بعلت جذب دیاکسید کربن توسط آب آزمایشگاهی، تهیه آب باید بهصورت روزانه انجام گردد. باید دستورالعمل کنترل کیفی آب در آزمایشگاه وجود داشته باشد. برای روشهای کمی، استفاده از استانداردهای اولیه لازم است. برای ساخت این استانداردها باید از باکیفیتترین مواد استفاده گردد.
علاوه بر استانداردهای اولیه، استانداردهای ثانویه و یا محلولهای کالیبراسیون نیز باید ساخته شوند. همه حلالها باید از خلوص کافی برخوردار باشند. باید با اعمال روشهای استاندارد آزمایشگاهی تمام استانداردها و معرفها قبل از استفاده چک شوند که با آنالیز یک ماده کنترلی با استفاده از استاندارد قدیم و جدید انجام میگردد. اگر کارایی استاندارد جدید برابر استاندارد قدیم بود قابلقبول است و میشود از آن استفاده کرد در غیر اینصورت باید استاندارد جدید را دور ریخت. هر lot number جدید از معرفها و استانداردهای تجاری باید در برابر معرفها و استانداردهای قدیمی کنترل گردد و مستندات آنها باید در آزمایشگاه موجود باشد. تمام استانداردها، معرفها و قرصها باید دارای تاریخ اعتبار کافی باشند و زمان تهیه و یا ورود به آزمایشگاه (معرفهای تجاری) روی آنها تاریخ درج شود.
جدول 5: مشخصات انواع آبهای آزمایشگاهی
| مشخصات انواع آبهای آزمایشگاهی (clsi) | درجه 1 | درجه 2 | درجه 3 |
| قابلیت هدایت الکتریکی برحسب s/ µ | 0/1 | 0/5 | 10 |
| مقاومت الکتریکی برحسب مگااهم (Megahms/ c 25) | 10 | 2 | 1/0 |
| سیلیکات برحسب mg/dL | 0/5 | 0/1 | 1/0 |
| ماکزیمم فلز سنگین برحسب mg/L | 0/01 | 0/01 | 0/01 |
| احیاء پرمنگنات | منفی | منفی | منفی |
| مواد آلی | جذب توسط ذغال فعال | NA | NA |
| محتوی میکروبی برحسب CFU/ml | 10 | 103 | NA |
| PH | NA | NA | 5-8 |
| مواد ذرهای معلق که از فیلتر 0/22 میکرون عبور داده میشود | 500/Lit< آب | NA | NA |
1-2-2- آزمایش شیمیایی تجزیه ادرار با استفاده از نوار ادراری
نوارهای ادراری با استفاده از شیمی خشک، پارامترهای متنوعی (نظیر گلوکز، خون، پروتئین، بیلیروبین) در ادرار جستجو میکنند.
 |
 |
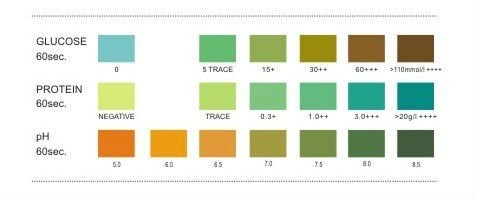
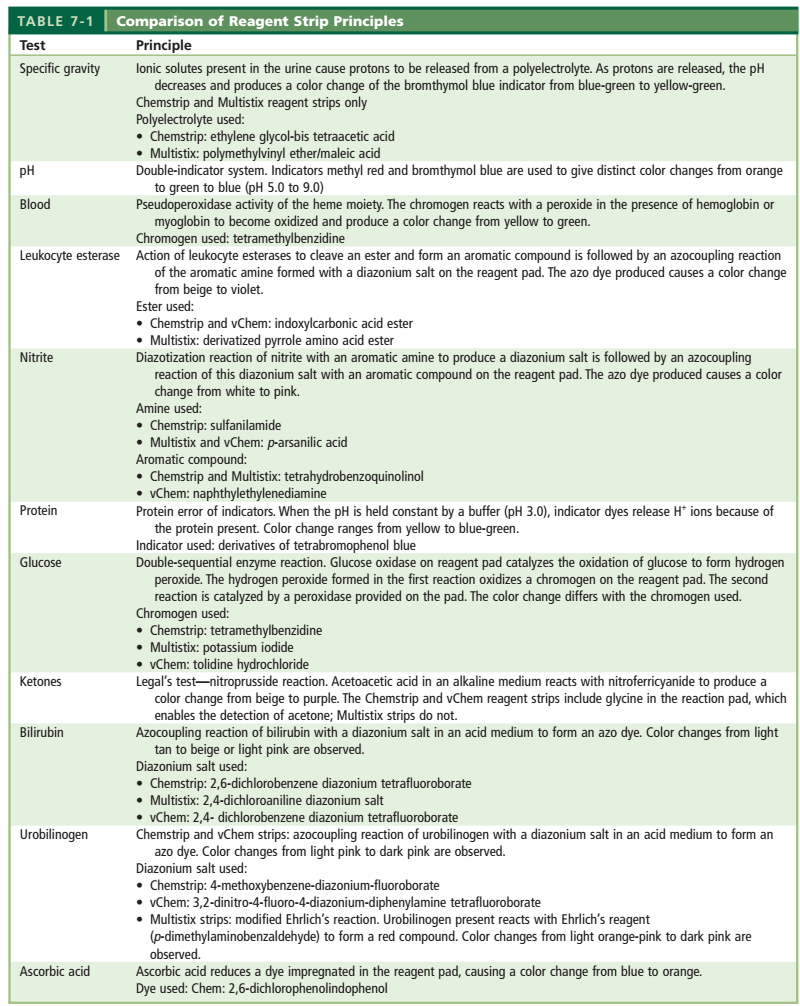
اصول شیمیایی مورد استفاده در نوارهای ادراری اساساً یکسان است و تولیدکنندگان معمولاً تنها در تعیین یوربیلینوژن از مواد متفاوتی استفاده مینمایند (جدول شماره 6).
جدول 6: اساس پارامترهای مختلف نوار ادراری
الف) نحوه استفاده و نگهداری از نوار ادراری:
- نوار ادراری را حداکثر 1 ثانیه در ادرار سانتریفیوژ نشده قرار داده و در کمتر از یک دقیقه قرائت کنید.
- هنگام خارج کردن نوار از ادرار بهمنظور کاهش تداخل رنگی باندهای نوار ادراری بایستی با تماس لبههای نوار به لوله آزمایش، ادرار اضافی را از نوار پاک کرد و بعد نوار را روی یک گاز قرار داد تا پل ادراری بین باندهای مختلف نوار تشکیل نگردد و سپس در شرایط مناسب نوری قرائت نمود.
- نوار ادراری را در معرض نور، رطوبت، حرارت زیاد، اسید فرار و بخار قلیا نگهداری نکنید.
- ظروف حاوی نوار ادراری را در یخچال یا دمای بالاتر از 30 درجه سانتیگراد نگهداری ننمایید.
- اگر رنگ قسمتهای مختلف نوار با رنگ روی قوطی تطابق نداشت، نوار را دور بیندازید.
- نوار ادراری را به اندازه مناسب برداشته و در قوطی آن را محکم ببندید.
- نوار را از وسط نصف ننمایید.
- پس از عوض شدن هر lot نوار، دستورالعمل سازنده را چک نمایید.
- باندهای روی نوار را با انگشت لمس نکنید.
ب) کنترل کیفی نوار ادراری:
تحقیقات نشان میدهند حتی با وجود افراد کارآزموده، در قرائت نتایج مثبت نوار ادراری 1%± خطا وجود دارد. البته نکته مهم این است که جواب مثبت را منفی و جواب منفی را مثبت رد نکنید. کنترل کیفی نوار ادراری امری ضروری محسوب میگردد. کنترل منفی و مثبت برای هر تست شیمیایی توصیه میشود. کنترلهای مثبت باید برای شناسایی جواب مثبت ضعیف طراحی شوند. کنترلها باید براساس تعداد نمونه و بهصورت مکرر توسط آزمایشگاه امتحان شوند، برای مثال برای آزمایشگاهی که در طول یک ماه از یک سری ساخت نوار ادراری استفاده میکند کنترل کیفی هفتگی توصیه میشود اما برای آزمایشگاههایی که در روز از چندین ظرف نوار ادراری استفاده میکنند، استفاده از کنترل روزانه توصیه میشود.
کنترل نوارهای ادراری هم بهصورت تجاری در دسترس است و هم میتوان در آزمایشگاه آنها را ساخت، اما بهطور معمول از کنترلهای تجاری برای کنترل نوار ادراری استفاده میشود. باید هر کنترل تجاری جدید با یک ادرار که قبلاً با کنترل تجاری قبلی چک شده، کنترل گردد و در صورت هرگونه تفاوت بین نتایج بررسیهای لازم صورت پذیرد. مقادیر حاصل از مواد کنترلی باید در محدوده جوابهای آزمایشگاه باشد.
ج) ساخت کنترل نوار ادراری در آزمایشگاه (جدول 7):
جدول 7: ساخت کنترل نوار ادراری در آزمایشگاه
| مواد لازم جهت ساخت کنترل | کنترل LOW | کنترل HIGH | کنترل منفی |
| کلرورسدیم | 5 gr | 10 gr | 5 gr |
| اوره | 5 gr | 10 gr | 5 gr |
| کراتینین | 0.5 gr | 0.5 gr | —- |
| گلوکز | 3 gr | 15 gr | —- |
| آلبومین (بانک خون) | 5 cc | 35 cc | —- |
| خون کامل | 100 µl | —- | —- |
| استون | —- | 2 cc | —- |
| کلروفرم | 5 cc | 5 cc | —- |
| آب مقطر | 1000 cc | 1000 cc | 1000 cc |
مواد فوق باید همه analytical grade باشند و کنترلها به مدت 6 ماه در ظروف قهوهای پایدار است. چنانچه کنترل در فریزر 20- نگهداری شود نیازی به کلروفرم نیست.
| PH | PROTEIN | GLUCOSE | KETON | BLOOD | SG | |
| کنترل low | 5 | 3+ | 2+ | ——- | کم تا متوسط | 1.009 |
| کنترل high | 6 | 4+ | 3+ | کم تا متوسط | ——- | 1.026 |
| کنترل منفی | 5 | ——– | —— | ——– | ——- | 1.006 |
د) کنترل نوار ادراری بر اساس دستورالعمل آزمایشگاه مرجع سلامت:
بهمنظور ارزیابی نوارهای ادراری، برای هر یک از پارامترهای موجود در نوار بهطور جداگانه نمونههایی با غلظت مشخص تهیه میشود. برای این کار از ادرار تازهی افراد سالم استفاده میشود. پس از کنترل یکایک ادرارها با نوارهای ادراری معتبر، ادرارهای طبیعی را انتخاب و با هم مخلوط نموده و مجدداً ادرار تهیهشده را با استفاده از نوار ادراری تأئیدشده کنترل مینماییم. اگر هدف کنترل اولیهی نوار ادراری باشد، لازم است حداقل 20 نوار ادراری از 3 قوطی مختلف را در هر یک از غلظتهای موردنظر فرو برده و سریعاً خارج نماییم (ادرار اضافی روی نوار را به کمک لبه لوله میگیریم).
پس از سپری شدن زمان تعیینشدهی روی قوطی، رنگ حاصله را با کد رنگی روی قوطی مقایسه میکنیم. رنگ حاصله باید کاملاً هموژن و مطابق با کد رنگی مربوطه باشد. حال 20 نوار مربوط به هر غلظت را با یکدیگر مقایسه کرده و جواب نهایی را بهصورت درصد گزارش میکنیم. محدودهی قابلقبول 95% ≤ میباشد. این کار را با نوار مرجع نیز تکرار میکنیم. میزان اختلاف قابلقبول +/- یک پردهی رنگی است.
جهت بررسی کلینیکی، نتایج دستکم 40 نمونهی ادرار بیماران را با نوار مورد ارزیابی و نوار مرجع مقایسه میکنیم. نمونهها باید طوری انتخاب شوند که برای تمام پارامترها نتایج نرمال و پاتولوژیک را شامل شوند.
- طرز تهیه کنترل گلوکز: متناسب با غلظت گلوکز ثبت شده روی ظرف نوار ادراری، نمونهها تهیه میشوند؛ بهطور مثال برای تهیه نمونهای با غلظت50 mg/dl لازم است که میزان 50 mg گلوکز به 100 ml از ادرار جمعآوریشده اضافه شود. به همین ترتیب نمونههایی با غلظتهای 100 ,250 ,300 ,500 ,1000 mg/dl تهیه میگردند. صحت غلظت نمونههای تهیهشده را با روش گلوکز اکسیداز و در مقابل کنترل صحت تأئید مینماییم.
- طرز تهیه کنترل پروتئین: با استفاده از استاندارد آماده 5 g/dl، غلظتهای 30 ,100 ,500 mg/dl تهیه میشود. این استاندارد تنها آلبومین موجود در ادرار را مشخص مینماید. صحت استانداردهای تهیهشده با کیت توتال پروتئین (روش بیوره) و در مقابل کنترل صحت مورد بررسی قرار میگیرد.
- طرز تهیه کنترل هموگلوبین: برای تهیهی نمونهی مشخص هموگلوبین، ابتدا هموگلوبین نمونهی خون را اندازه گرفته، سپس خون را با استفاده از آب مقطر لیز و رقیق مینماییم. برای این کار 1 ml خون را با استفاده از آب مقطر به حجم 100 ml میرسانیم. حال از این محلول غلظتهای موردنظر 0.03 ,0.2 ,1 mg/dl هموگلوبین تهیه میکنیم.
- طرز تهیه کنترل RBC: تهیهی استاندارد RBC مشابه هموگلوبین میباشد، با این تفاوت که نباید نمونههای ما لیز شود. بنابراین:
- نمونهها باید در روز ارزیابی تهیه شود. 2- برای رقیق کردن نمونه از ادرار بهجای آب مقطر استفاده گردد.
- طرز تهیه کنترل بیلیروبین: با استفاده از استانداردهای بیلیروبین با غلظت مشخص، میتوان نمونههای موردنیاز برای ارزیابی بیلیروبین نوارهای ادراری را تهیه کرد. پس از تهیهی نمونهها، صحت غلظت آنها را با روش jendrassick grof و در مقابل کنترل صحت تأیید مینماییم. غلظتهای مختلف بیلیروبین باید روزانه تهیه شوند و در طول مدت ارزیابی، از برخورد نور مستقیم با نمونههای تهیهشده جلوگیری گردد.
- طرز تهیه کنترل نیتریت: مقدار بسیار جزئی از نیترات سدیم را با آب مقطر مخلوط کرده و بهعنوان نمونهی معلومالعیار نیتریت از آن استفاده میکنیم.
- طرز تهیه کنترل اوروبیلینوژن: استاندارد اوروبیلینوژن را نمیتوان بهطور مصنوعی تهیه کرد، بنابراین برای ارزیابی نوارها از نظر این پارامتر باید دستکم از 20 نمونهی ادرار تازهی اوروبیلینوژن مثبت استفاده شود.
- طرز تهیه کنترل آسکوربیک اسید: برای تهیهی غلظتهای مختلف آسکوربیک اسید میزان مشخص پودر ویتامین C را در ادرار حل میکنیم؛ مثال: برای تهیهی غلظت 10 mg/dl باید میزان 10mg پودر ویتامین C را در 100 ml ادرار حل کنیم.
- طرز تهیه کنترل لکوسیت: استاندارد لکوسیت را نمیتوان بهطور مصنوعی تهیه کرد. برای ارزیابی نوارها از نظر توانایی تشخیص لکوسیت، باید دستکم از 20 نمونهی ادرار تازهی دارای لکوسیت استفاده شود.
- طرز تهیه کنترل کتون: برای ارزیــابی نـــوار ادراری از نمــــونهی استــواستیک بــــــــــا غلظتهای 5 ,15 ,40 ,80 mg/dl استفاده میشود.
- طرز تهیه کنترل pH: برای بررسی پارامتر pH، نمونههایی از ادرار تازه را جمع کرده سپس با استفاده از دستگاه pH متر، pH ادرار جمع شده را اندازهگیری میکنیم. در صورت بالا بودنpH ادرار، با استفاده از چند قطره اسید سولفوریک pH آن را به زیر 5 میرسانیم. حال قطرهقطره سود اضافه کرده و pH آن را روی 5 تنظیم میکنیم. در این حالت نوار را در محلول فرو برده و سریعاً خارج میکنیم و پس از گذشت مدت زمان مشخصشده توسط سازنده، رنگ حاصله را با رنگ روی قوطی نوار ادراری مقایسه مینماییم. به همین ترتیب با اضافـــــه کردن سود، pH های 6 و 7 و 8 و 9 درست میکنیم و نوار ادراری را در pHهای معین بهصورتی که ذکر شد، مورد ارزیابی قرار میدهیم.
- کنترل Specific Gravity: برای بررسی پارامتر وزن مخصوص، از نمونهی ادرار با وزنهای مخصوص متفاوت استفاده میکنیم. برای این کار ابتدا وزن مخصوص دستکم 20 نمونهی ادرار را به کمک رفرکتومتر تعیین میکنیم، سپس با نوار ادراری موردنظر، مقایسه مینماییم.
- کنترل پایداری نوار ادراری: بهمنظور کنترل پایداری، قوطی حاوی نوار ادراری را باید تا پایان تاریخ انقضا نگهداری میکنیم. بهتر است به مدت 4 ماه، هرماه یکبار نوارها را از نظر پایداری بررسی کنیم و یا به روش Accelerated Stability، نوارها را در دماهای 37 و 45 درجه سانتیگراد قرار داده و پایداری آنها را برای مدت دستکم دو هفته ارزیابی کنیم. برای این کار تمامی مراحل ذکرشده در قسمت قبل را با 3 نوار ادراری تکرار کرده و نتایج حاصله را بررسی میکنیم.
- کنترل حساسیت نوار ادراری: جهت بررسی حساسیت نوارها برای پارامترهای مختلف میبایست استانداردهایی با حداقل غلظت ادعایی در بروشور برای هر پارامتر به روش ذکرشده تهیه کرد و نوارهای مورد کنترل را از نظر حساسیت مورد ارزیابی قرار داد.
- تست تأییدی: تأیید جواب نوار ادراری باید با استفاده از حساسیت برابر یا بیشتر از نوار ادراری صورت بگیرد و یا سنجش ترکیبات شیمیایی با متد و واکنش متفاوت انجام پذیرد. تکرار آزمایش ادرار، تست تأییدی بشمار نمیآید. شایعترین تست تأییدی شیمیایی استفاده از سولفوسالسیلیک اسید برای آلبومینوری و TABLET TEST برای بیلیروبین میباشد. مشاهده میکروسکوپی نمونه تجزیه ادرار یک تست تأییدی برای خون، لکوسیت استراز و نیتریت میباشد. آزمایش سیتولوژی ادرار نیز یک تست تأییدی برای تأیید آزمایش میکروسکوپی ادرار غیرطبیعی (التهاب، عفونت، بدخیمی) میباشد.image cytometry و آنالیز DNA با استفاده از رنگآمیزی فیلگن (FEULGEN) بهعنوان یک تست تأییدی برای تشخیص بدخیمیهای مجاری ادراری محسوب میشود.
نکات مهم در استفاده از نوار ادراری و مداخلهگرها
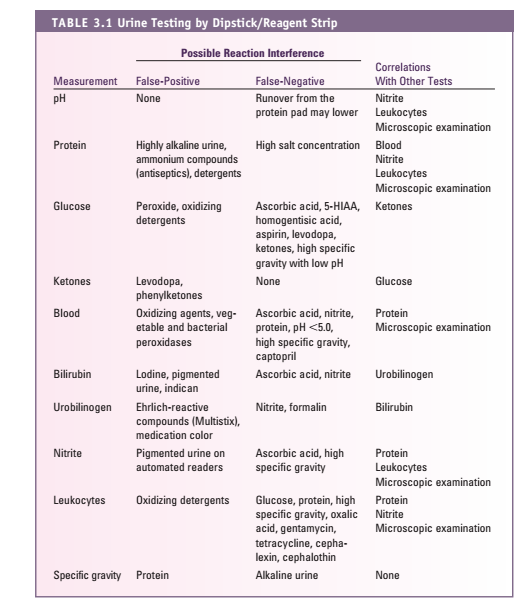
- PH ادرار: معرف آن متیل رد و برومو تیمول بلو است که PH ، 5 تا 8/5 را نشان میدهد. اگر نوار زیاد در ادرار بماند معرف اسیدی پروتئین روی PH اثر گذاشته و پدیده RUN-OVER اتفاق میافتد، پس PH ادرار را باید سریعاً قرائت نمود.
- نگهداری طولانی ادرار و باکتری اوری (بعلت تولید آمونیاک) همراه با PH قلیائی ادرار هستند. حداکثر ترشح +H از لولههای ادراری ممکن است PH ادرار را به 4/5 برساند و این کمترین درجه از PH است که کلیه قادر به ایجاد آن میباشد.
پروتئین ادرار: تست نوار ادرار (بر پایه خطای پروتئینی معرف) باید با اسید سولفوسالسیلیک یا معرف exton (محلول 5% اسید سولفوسالسیلیک در سولفات سدیم) تأیید شود، چون حساسیت این تستها متفاوت است و نوار ادراری حساسیت بیشتر به آلبومین دارد. آلودگی با ترشحات واژن، منی، موکوس زیاد، خون و ادرار قلیایی و ماندن زیاد نوار در ادرار و درمان با فنازوپیریدین سبب مثبت کاذب و در صورت رقت نمونه و وجود پروتئین غیرآلبومین، منفی کاذب داریم. در روش اسید، ادرار قلیایی سبب منفی کاذب و درمان با پنیسیلین، تولباتامید، رنگهای یددار، سالسیلات، سولفونامید و تجویز مواد رنگی رادیولوژی (سه روز پس از تجویز) سبب مثبت کاذب میشود (جدول 8).
 |
 |
جدول 8: مثبت کاذب پروتئین در نوار ادراری و استفاده از اسید سولفوسالسیلیک
| مواد ایجادکننده | نوار ادرار | اسید سولفوسالسیلیک |
| ادرار غلیظ | + | + |
| هماچوری واضح | + | + |
| فنازوپیریدین | + | – |
| پنیسیلین، سفالوسپورین، سولفونامید، تولبو تامید | – | + |
| ادرار قلیایی (pH>9)/ ادرار رقیق/ دترجنت | + | – |
| ماده حاجب رادیولوژی | – | + |
گلوکز: روش ارجح گلوکز اکسیداز و تست تأییدی بندیکت است. در گلوکز اکسیداز مثبت کاذب نادراست. گلوکز اکسیداز فقط گلوکز رانشان میدهد. مواد ضدعفونیکننده نتایج مثبت کاذب و موادی از قبیل اسید آسکوربیک، مواد کتونی، سدیم فلوراید، سالسیلات (در غلظتهای بالا) نتایج منفی کاذب ایجاد میکنند. اجسام کتونی با میزان بالا، قرائت قند روی نوار را به تأخیر میاندازند. وزن مخصوص پایین ادرار موجب حساس شدن بیشتر نوار و وزن مخصوص بالای ادرار موجب کاهش حساسیت نوار ادراری در نمایش قند میگردد. آزمون مثبت برای قندهای احیاکننده با محلول بندیکت در حضور آزمون منفی نوار که خاص اندازهگیری b-D-glucose است، نشانگر حضور قندهای دیگر از جمله لاکتوز، گالاکتوز یا فروکتوز در ادرار است (جدول 9).
جدول 9: مقایسه روش گلوکز اکسیداز و بندیکت
| تفسیر | گلوکز اکسیداز | احیاء مس (بندیکت) |
| گلوکز | + | + |
| گلوکز به میزان کم | + | – |
| مواد احیاء کننده غیر گلوکز (گالاکتوزو…) | – | + |
خون: اساس تست همان پراکسیداز است و با هماچوری، هموگلوبینوری و میوگلوبینوری مثبت میشود. متابولیتهای میکروبی (در غلظت بالا) باعث پاسخ مثبت کاذب میشوند، همچنین مواد ضدعفونیکننده و پاککننده نتایج مثبت کاذب ایجاد میکنند. اسید آسکوربیک در غلظت بالا باعث نتایج منفی کاذب میشود. جدایی هموگلوبینوری از هماچوری و میوگلوبینوری بسیار مهم است. PH قلیایی و وزن مخصوص کمتر از 1.007 و دیده شدن GHOST cell به نفع هماچوری است و برای جدایی هموگلوبینوری و میوگلوبینوری از تست سولفات آمونیوم استفاده میشود.
کتون: اساس اندازهگیری تست روترا است. اجسام کتونی در ادرار توسط سدیم نیتروپروساید (نیتروفریسیانید) در محیط قلیایی مورد سنجش قرار میگیرند. سنجش کتون، حساس به استواستات و به میزان کم به استون بوده و با بتاهیدروکسی بوتیریک اسید واکنشی نمیدهد. شرایط اسیدوز موجب تشکیل بیشتر بتاهیدروکسی بوتیریک شده و ممکن است موجب کاهش کاذب اجسام کتونی در کتواسیدوز دیابتی گردد. داروی الدوپا و فنیل پیرویک اسید (PKU) و برخی آنتیبیوتیکها ممکن است موجب مثبت کاذب گردند. فنیلکتونها و ترکیبات حاوی فتالئین ایجاد واکنش رنگی غیرطبیعی (قرمز) مینمایند. ترکیبات دارای 2 مرکاپتواتانل، سولفونات سدیم یا سولفاهیدرید باعث ایجاد نتایج منفی کاذب میگردند.
بیلیروبین: تنها بیلیروبین کانژوگه از ادرار دفع میگردد. معرف ادراری نمک دیازونیوم است. داروهای ریفامپین و کلروپرومازین و فنازوپیریدین موجب مثبت کاذب میگردند و مقادیر بالای اسید آسکوربیک و نیتریت یا تبدیل بیلیروبین به بیلیوردین بعلت ماندن زیاد نمونه یا ماندن نمونه در معرض نور سبب منفی کاذب میگردد.
اسید آسکوربیک (VIT C): در اندازهگیری گلوکز، خون، بیلیروبین و نیتریت ادرار دخالت کرده و موجب کاهش یا منفی کاذب میگردد.
اوروبیلینوژن: یوروبیلینوژن ادرار با معرف آلدئیدی ارلیخ (پاراآمینوبنزآلدهید در اسیدکلریدریک) ایجاد رنگ صورتی میکند. پورفوبیلینوژن، سالسیلات، سولفانامید وفنازوپیریدین ممکن است موجب مثبت کاذب گردند یوروبیلینوژن دارای تغییرات در ترشح روزانه است و بیشترین مقدار آن در نمونه 2 ساعته بعد از غذا خوردن در بعدازظهر است. گفتنی است که یوروبیلینوژن بهسرعت به یوروبیلین اکسیده میگردد که با معرف نوار واکنشی نخواهد داد.
آزمون واتسون شوارتز جهت افتراق یوروبیلینوژن و مشتقات ایندول از پورفوبیلینوژن (PBG) بکار میرود. هر دو ترکیب فوق با معرف ارلیخ واکنش داده و تولید رنگ صورتی میکنند، چنانچه رنگ صورتی با اضافه کردن کلروفرم که در لایه زیری قرار میگیرد، استخراج گردد، بیانگر یوروبیلینوژن یا ترکیبات ایندول است. پورفوبیلینوژن بعد از استخراج با کلروفرم و بوتانول در فاز مایع باقی میماند و ازاینرو مشاهده رنگ صورتی در فاز مایع که بعد از اضافه کردن بوتانل مشاهده گردد بیانگر پوروفوبیلینوژن است
نیتریت: آزمون نیتریت وابسته به فعالیت آنزیم ردوکتاز باکتریها میباشد. نیتریت ایجادشده با واکنش با پاراآرسانیلیک اسید یا سولفانیل آمید ایجاد ترکیب دیازونیوم میکند. واکنش مثبت کاذب در مصرف فنازوپیریدین و واکنش منفی کاذب در ادرارهای فوقالعاده اسیدی و مصرف مقادیر زیاد آسکوربیک اسید، عدم انکوباسیون کافی نمونه و تجزیه نیتریت به نیتروژن مشاهده میگردد.
لکوسیت استراز: نوارهای ادراری با استفاده از خاصیت استراز ادرار، وجود گلبولهای سفید را در ادرار مشخص میکنند. آستانه تشخیصی برای گلبول سفید 15-5 عدد در میکرولیتر ادرار است. قطعه نمایش استراز لکوسیتی شامل مخلوط بافری از پیرول آمینو اسیداستر (Amino Acid Ester Pyrol) و املاح دیازونیوم میباشد. در صورت وجود استراز لکوسیتی در ادرار، این آنزیم باعث هیدرولیز پیوند استری پیرول امینواسید استر شده و منجر به رها شدن فنیل پیرول میگردد که در واکنش با نمک دیازونیوم کمپلکس رنگی میدهد. افزایش قند ادرار، افزایش وزن مخصوص و مصرف داروهایی مانند سفالوکسین و تتراسایکلین موجب کاهش حساسیت تست میگردد. فرمالین ممکن است موجب نتیجه مثبت کاذب گردد.
جدول 10: مثبت و منفی کاذب نوار ادراری
3-2 روشهای انجام کار
روشهای انجام کار باید در آزمایشگاه موجود باشند و باید الزامات راهنمای GP02-A5 مؤسسه استانداردهای آزمایشگاهی آمریکا (CLSI) را برآورده کند. مستندات آزمایشگاهی باید توسعه یافته و کنترل شوند. تمام دستورالعملها باید جامع و شامل جزئیات پروسههای اجراشده (جمعآوری نمونه، انتقال نمونه، تهیه معرف، کنترل و حد قابلقبول آنها، اجرای گامبهگام تست، محاسبات، شیوه گزارش جواب و رفرنسها) باشد. بعلت اهمیت روشهای کار در آزمایشگاه، باید این روشها سالانه بازنگری و به روز شود و تغییرات ایجادشده مکتوب گردد. یک روش ادراری معمول شامل روشهایی برای اطمینان از کیفیت پایدار در هر یک از اجزای آن است.
روش کارهای آزمایشگاهی تمام جزئیات آزمونهای فیزیکی، شیمیایی و میکروسکوپی و حتی کنترل کیفیت، اصطلاحات و حد قابلقبول یک تست را شامل میشوند. علاوه بر این، روشها باید شامل معیارهایی برای همبستگی آزمون فیزیکی و شیمیایی و میکروسکوپی و اقدامات لازم جهت پیگیری اختلافات و حل آنها باشند، برای مثال اگر معرف نوار ادراری، خون را نشان نداد ولی در تست میکروسکوپی ما خون را مشاهده نمودیم، باید نمونه برای اسکوربیک اسید کنترل شود. دستورالعملهای مرجع مانند کتابهای رفرنس چارتها و اطلسهای مناسب باید در آزمایشگاه وجود داشته باشد.
| روش کار استاندارد در آزمایشگاه تجزیه ادرار (هنری 2016) |
| · 10 تا 15 میلیلیتر از نمونه ادرار را بهخوبی مخلوط کنید و در لوله سانتریفیوژ یکبار مصرف مدرج بریزید.
· بررسیهای فیزیکی (رنگ، ظاهر، بو) و شیمیایی را (با استفاده از استریپ ادراری) انجام دهید. · ادرار را درg 450 برای پنج دقیقه سانتریفوژ کنید. · با دقت محلول رویی را خارج نموده و نگه دارید. حجم نهایی مورد استفاده برای رسوب ممکن است با سیستم استاندارد مورد استفاده متفاوت باشد، اما در هر آزمایشگاهی باید مشخص و ثابت باشد. · با استفاده از یک پیپت مناسب بهآرامی رسوب را در مایع رویی باقیمانده حل کنید. در صورت نیاز یک قطره رنگ supravital به آن اضافه نمایید. یک قطره از آن را بهآرامی بروی لام ریخته و لامل استاندارد را روی آن قرار داده و اجازه میدهیم تا ادرار برای مدت 30 تا 60 ثانیه در سکون باشد. · ادرار را با بزرگنمایی 100(LPF) و 400 (HPF) بررسی میکنیم. بهطور منظم تمام سطح لام را جستجو کرده و با توجه به تمایل سیلندرهای ادراری در تجمع در لبههای لامل، تمام اطراف لامل را بررسی میکنیم. · سیلندرها را در حداقل ده میدان میکروسکوپی شمرده و میانگین آنها را در LPF گزارش میکنیم. با استفاده از HPF نوع سیلندرهای ادراری را مشخص میکنیم. · شناسایی و شمارش اریتروسیتها، لکوسیتها و سلولهای اپیتلیال کلیه با استفاده از HPF و حداقل در ده میدان میکروسکوپی صورت میپذیرد و میانگین تعداد شمردهشده در 10 میدان میکروسکوپی گزارش میگردد. · سایر چیزهایی که گزارش میگردد عبارتند از: 1- اپی تلیال ترانزیشنال و پوششی اگر به میزان زیاد باشد. 2- .باکتری، مخمر و میکروارگانیسم 3- کریستالهای ادراری (با LPF گزارش میشود). اگر کریستالها پاتولوژیک باشد علاوه بر تأیید با تست شیمیایی باید سابقه بیمار نیز کنترل گردد. 4- مشاهده میزان زیاد موکوس
نویسندگان پیشنهاد میکنند در صورت مشاهده موارد زیر از تستهای سیتوپاتولوژی و یا شیمیایی (کریستالها) برای تأیید استفاده گردد: 1- بیشتر از دو سلول اپیتلیال کلیوی در HPF 2- سیلندرهای پاتولوژیک 3- سلولهای تکهستهای غیرمعمول بخصوص سلولهای پیشابراه 4- تکههای بافتی 5- کریستالهای پاتولوژیک تمام گزارش را از جمله دادههای فیزیکی، شیمیایی و میکروسکوپی را مرور کنید و با اطلاعات بالینی موجود تطبیق دهید. اختلافات باید قبل از انتشار گزارش حلوفصل شود. مقادیر نرمال برای تجزیه ادرار عبارتند از WBC 0-10 per HPF RBC 0-10 per HPF HYALINE CAST 0-2 per LPF البته مقادیر نرمال براساس سیستم استاندارد استفاده شده، متفاوت میباشد. |
4-2 نظارت (MONITORING):
آزمایشهای میکروسکوپی نیازمند استانداردسازی تکنیک و پیروی از روشهای ایجادشده توسط تمام کارکنان آزمایشگاه بهمنظور اطمینان از هماهنگی در نتایج بهدستآمده و گزارش آنها میباشد. آمادهسازی ادرار برای مطالعه میکروسکوپی نیازمند نگارش دستورالعملهای قدمبهقدمی است که حجم ادرار مورد استفاده، سرعت و زمان سانتریفوژ، غلظت رسوب و حجم رسوب مورد آزمایش، شیوه گزارش جواب و نحوه برخورد با نتایج غیرطبیعی و بحرانی را شرح داده باشد (جدول 10). ازآنجاکه بسیاری از مراحل انجام شده در آزمایشگاه ادرار بهصورت دستی انجام میشود، نظارت بر مهارتهای فنی بسیار مهم است. استفاده از تکنیک یکسان توسط تمام پرسنل لازم است و میتواند از طریق آموزش مناسب، پیروی از پروتکلهای موجود در آزمایشگاه و ارزیابی و نظارت بخش کنترل کیفیت آزمایشگاه اعمال گردد. تکنسینهای جدید باید قبل از انجام تست، مورد ارزیابی علمی و عملی قرار گیرند (جدول 11)،
همچنین روشهای کار باید قبل از بکار گیری در آزمایشگاه مورد تحقیق و بررسی قرار گرفته و صحت آنها اثبات گردد. قبل از گزارش نتایج، کاردان آزمایشگاه باید قادر به ارزیابی نتایج، تشخیص اختلافات و یا نادرستی جواب و حل مشکل باشد. ثبت نتایج حتی زمانی که خارج از انتظار است امری مهم محسوب میگردد. مستندسازی خطاها یا مشکلات و اقدامات انجام شده برای اصلاح و جلوگیری از تکرار خطا، شیوه اقدام اصلاحی و امری ضروری است. این سیاستها باید بهعنوان وسیلهای برای تضمین کیفیت نتایج آزمایشگاهی موردتوجه قرار گیرند.
نتایج دقیق نهتنها به دانش علمی و عملی پرسنل مربوط است بلکه به توانایی تفسیر و تشخیص آنها وابسته است، برای مثال اگر کاردان آزمایشگاه نتایجی را بدست آورد که متفاوت از نتایج قبلی و وضعیت کنونی بیمار است، باید این دانش را داشته باشد که شاید این جواب در اثر مخلوط شدن نمونه یا تجویز دارو حاصل شده است. این نشاندهنده نیاز به برقراری ارتباط خوب بین همه پرسنل و مسئولین آزمایشگاه و همچنین نیاز به جلسات کارکنان با مسئولین کنترل کیفیت و آموزش بهمنظور دریافت اطلاعات جدید میباشد.
5-2 نظارت بر اجزای آنالیتیکال سیستم تضمین کیفیت
برای انجام کنترل کیفی داخلی و بدست آوردن خطاهای آزمایشگاهی باید دقت و صحت یک روش را اندازهگیری نمود. مواد کنترل کیفیت به آزمایشگاه این امکان را میدهند که تغییراتی را که بهطور مستقیم روی آزمایش اثر میگذارند را شناسایی و اندازهگیری نمایند. این مواد مشخصات فیزیکی و شیمیایی شبیه نمونههای بیمار را دارند و میتوان آنها را در آزمایشگاه تولید و یا اینکه بهصورت تجاری تهیه نمود. برای بعضی از مواد QC، تولیدکننده ارزشهای مورد انتظار را تعیین و اختصاص میدهد. این مقادیر باید در صورت لزوم برای تأیید روش و شرایط هر آزمایشگاه تأیید و تنظیم شود.
مواد کنترلی بسیاری جهت آزمایش ادرار موجود است؛ برخی از مواد کنترلی فقط نوارهای ادراری را کنترل میکنند درحالیکه برخی دیگر میتوانند آزمایشهای میــــــکروسکوپی ادرار و مراحل مربـــــوط به پردازش نمـــــونه ادرار (سانتریفوژ نمونه) را بررســــی و کنتـــــرل کننــــــد. بــــــــــــــرای مثـــــــال کنتــــــرلهای (Redondo Beach, CA) (DipandSpin, QuanTscopics) میتوانند برای کنترل گلبولهای قرمز، گلبولهای سفید و کریستالهای ادراری مورد استفاده قرار گیرند. یکی دیگر از روشهای کنترل کیفی ادرار این است که یک نمونه ادرار را خوب مخلوط نموده و به دو پرسنل متفاوت از یک شیفت کاری و یا حتی شیفت متفاوت داده تا روی آن آزمایش تجزیه ادرار صورت پذیرد. نتایج باید مستقل ثبت و ارزیابی شوند.
این یک ارزیابی داخلی بهحساب میآید. اگر کنترلهای تجاری برای همه عناصر موجود در رسوب ادراری موجود نبود، تکرار آزمایش نمونه تازه بیماران میتواند تکرارپذیری آنالیز میکروسکوپی را در داخل آزمایشگاه و بین آزمایشگاهها مشخص نماید. برای هر عنصر گزارش شده، نتایج باید مطابق با ± رنج گزارش آزمایشگاه باشد. عناصر غیرطبیعی رسوب ادرار باید توسط هر آزمایشگاه مشخص گردد و کلیه رسوبهای غیرطبیعی دو مرتبه دیده و سپس گزارش گردد. نتایج حاصل از کنترل کیفی داخلی باید مستند گردد و درصورتیکه کنترلها خارج از رنج مجاز بود، اقدام اصلاحی لازم صورت پذیرد. محدوده مجاز کنترلهای تجاری یا خانگی در آزمایشگاه با انجام تجزیهوتحلیل مکرر در طول روزهای مختلف تعیین میشود.
این کار امکان دخیل کردن متغیرهایی نظیر پرسنل، واکنشگرها و منابع را در دادههای تولیدشده، میدهد. پس از تجزیهوتحلیل کامل، دادههای QC جدولبندی میشوند و محدوده کنترل با استفاده از میانگین و انحراف معیار (SD) تعیین میشود. چون از منحنی توزیع نرمال استفاده میگردد میتوان با استفاده از چارت لووی جنینگ بروز خطا را تشخیص داد. عدم صحت را با میانگین و عدم دقت (خطای تصادفی) را با انحراف معیار نشان میدهند.
جدول 11: ارزیابی صلاحیت پرسنل در بخش تجزیه ادرار
| ردیف | عنوان تست مهارتی | حداکثر امتیاز | امتیاز کسب شده | اقدام اصلاحی |
| 1 | مهارت در اصول جمعآوری و نگهداری ادرار | 10 | ||
| 2 | مهارت در انجام استاندارد ماكروسكوپي ادرار | 30 | ||
| 3 | كنترل كيفي نوار ادرار | 10 | ||
| 4 | مهارت شناسایی مثبت و منفي كاذب نوار ادرار | 10 | ||
| 5 | مهارت در زمانبندی و گردش كار نمونه ادرار اورژانس | 20 | ||
| 6 | مهارت در تهيه رسوب استاندارد ادرار | 20 | ||
| 7 | شناسایی و گزارش استاندارد عناصر سلولي رسوب ادرار | 20 | ||
| 8 | شناسایی و گزارش استاندارد عناصر غیرسلولي رسوب | 20 | ||
| 9 | مهارت در گزارش گلبول قرمز ديسمورف | 10 | ||
| 10 | مهارت در افتراق سلولهای مشابه در رسوب | 10 | ||
| 11 | مهارت در انجام رنگآمیزی حياتي رسوب | 10 | ||
| 12 | مهارت در انجام و گزارش پروتئين بنس جونز | 10 | ||
| 13 | رسم شكل شماتيك كريستال نرمال و ابنرمال اسيدي | 10 | ||
| 14 | رسم شكل شماتيك كريستال نرمال و ابنرمال قليائي | 10 | ||
| 15 | مهارت افتراق عناصر آرتيفكت رسوب ادرار | 10 | ||
| جمع کل امتیاز: | 200 | |||
6-2 آزمایش میکروسکوپی ادرار:
برای انجام یک آزمایش میکروسکوپی دقیق، غلظت رسوب نهایی باید ثابت باشد، استفاده از سیستمهای استاندارد که شامل لولههای مخصوص، پیپت و اسلاید ویژه میباشـــــــــــــــــــــــــــــــــد در این راه کمککننده است. Uri system ,kova ,Count10 ,Count6 از جمله سیستمهای تجاری استاندارد میباشند. در صورت موجود نبودن این وسایل باید روش خالی کردن مایع رویی مشخص باشد و همه از آن روش استفاده نمایند تا نهایتاً حجم رسوب باقیمانده در لوله ثابت باشد. برخی از آزمایشگاهها ml 0/5-1 از رسوب و مایع رویی را نگه میدارند و بعد از مخلوط کردن آن 50 لاندا از رسوب را روی لام میریزند.
1-6-2 سلولهای خونی در آزمایش ادرار
سلولهایی را که میتوان در ادرار دید عبارتند از گلبول قرمز، گلبول سفید و سلولهای اپیتلیال
گلبول قرمز (RBC):
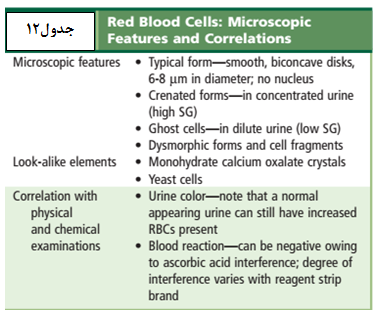
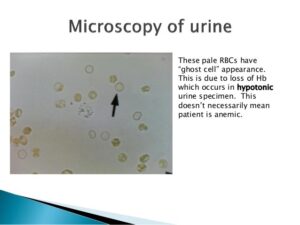
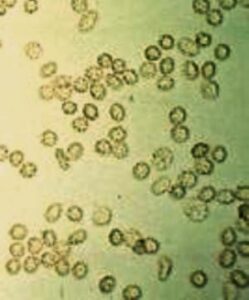
در نمونه ادرار تازه گلبولهای قرمز دارای ظاهر طبیعی، رنگپریده و یا زردفام، بدون هسته و مقعرالطرفین و با قطر تقریبی 7 میکرون میباشند. در ادرارهای هیپوتونیک و یا قلیایی گلبولهای قرمز متورم و لیز میشوند. سلولهای لیزشده که موسوم به سلولهای شبح (GHOST CELL) هستند، دوایر کمنور و بیرنگ میباشند و درواقع غشای خالی گلبولهای سرخ هستند. در ادرار هیپرتونیک گلبولهای قرمز دندانهدار میشوند و در بعضی از اوقات ممکن است دندانهها شبیه گرانول شود (جدول 12).
 |
عناصری که ممکن است با گلبول قرمز اشتباه شود:
- وقتی گلبول قرمز متورم یا دندانهدار میشود ممکن است با گلبول سفید اشتباه شود. اگر تست نوار ادراری برای خون منفی بود، گلبول سفید و در غیر این صورت گلبول قرمز است.
- سلولهای مخمر (yeast) در صورت داشتن جوانه یا تشکیل هایفی بهراحتی قابل تشخیص هستند، اما اگر جوانه نداشته باشند از نظر شکل و اندازه شبیه گلبولهای قرمز بوده و قابل اشتباه هستند. در حضور مخمر قطعه نمایش خون نوارهای ادراری منفی بوده و همچنین با اضافه کردن اسیداستیک 2 درصد به رسوب ادراری میتوان گلبولهای قرمز را لیز نموده و از مخمر افتراق داد.
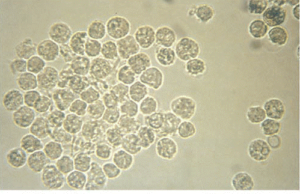
گلبول سفید (WBC):
گلبولهای سفید از قطر تقریبی در حد 12-10 میکرون برخوردارند و از گلبول قرمز بزرگتر و از سلولهای اپیتلیال کوچکترند. گلبولهای سفید معمولاً گرد هستند و به رنگ خاکستری کدر و یا زرد مایل به سبز به نظر میرسند.
گلبولهای سفید ادرار اکثراً نوتروفیل هستند. وقتی گلبولهای سفید دریک ادرار رقیق یا هیپوتونیک منبسط میشوند گرانولهای آنها ممکن است حرکت براونی نشان دهند. به این سلولها glitter میگویند (جدول 13).
جدول 13: چهره میکروسکوپی گلبول سفید |
|
|
Crenated RBC |
|
WBC |
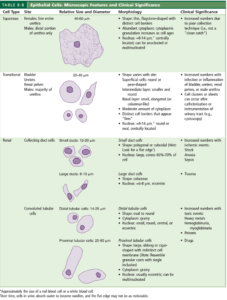
سلول اپیتلیال:
سه نوع اصلی سلول اپیتلیال ممکن است در ادرار دیده شوند که عبارتند از سلولهای اپیتلیال توبولار کلیوی، ترانزیشنال و اسکواموس (پوششی) (جدول 14). سلولهای توبولار کلیوی با توجه به منشأ ممکن است مکعبی، چندوجهی و یا بیضی شکل باشند؛ بهعنوان مثال سلولهای اپیتلیال پروکسیمال، استوانهای و سیتوپلاسم آنها پرزدار (brush border) است. سلولهای اپیتلیال توبولار 4-2 برابر گلبول سفید سایز دارند و در سیتوپلاسم دارای یک هسته کروی (بعضاً دو هسته) میباشند. سلولهای ترانزیشنال از لگنچههای کلیه (Pelvic) تا مثانه و تا 2/3 قسمت بالایی یورترا را پوشش میدهند. سوندگذاری مجاری ادراری و حرکت سنگ کلیه موجب جدا شدن غلاف یا تودههای بهم چسبیده سلولهای ترانزیشنال میگردند که گاهی ممکن است با سلولهای بدخیم در سرطان ترانزیشنال مثانه اشتباه گردد.
سلولهای ترانزیشنال بهسادگی آب را جذب کرده و ازاینرو ممکن است گاهی بهصورت اپیتلیال گرد (Round Ep cell) درآیند. سلولهای اپیتلیال اسکواموس 1/3 قسمت انتهایی یورترا و مخاط واژن را پوشش میدهند. هسته سلولهای اپیتلیال اسکواموس تقریباً 1:8 سیتوپلاسم است، درحالیکه هسته ترانزیشنال 1:3 سیتوپلاسم و هسته سلولهای اپیتلیال کلیوی به اندازه سیتوپلاسم است. در بررسی میکروسکوپی رسوب ادرار، برای کمک به افتراق سلولهای اپیتلیال کلیوی از سلولهای ترانزیشنال و سلولهای PMN میتوان از رنگ حیاتی sternhemier-malbin که ترکیبی از کریستال- ویولت و سافرانین است استفاده نمود. در این رنگآمیزی سلولهای ترانزیشنال اکثراً به رنگ آبی درآمده درحالیکه سلولهای اپیتلیال کلیوی هر دو رنگ را بخود گرفته و ظاهری آژروفیل (سیتوپلاسم نارنجی- بنفش با هستهای بنفش تیره) را نشان ميدهند.
| جدول 14 |
کریستالهای ادراری:
اگرچه اکثر کریستالهای موجود در ادرار از اهمیت بالینی محدودی برخوردار هستند، شناسایی مناسب بهمنظور تشخیص کریستالهای غیرطبیعی مرتبط با بیماریهای پاتولوژیک، ضروری است. جهت تشخیص کریستالهای پاتولوژیک (سیستئین، تیروزین و…) گرفتن سابقه بیمار و استفاده از تست تأییدی ضروری است. (جدول 15).
| جدول 15: کریستالها |
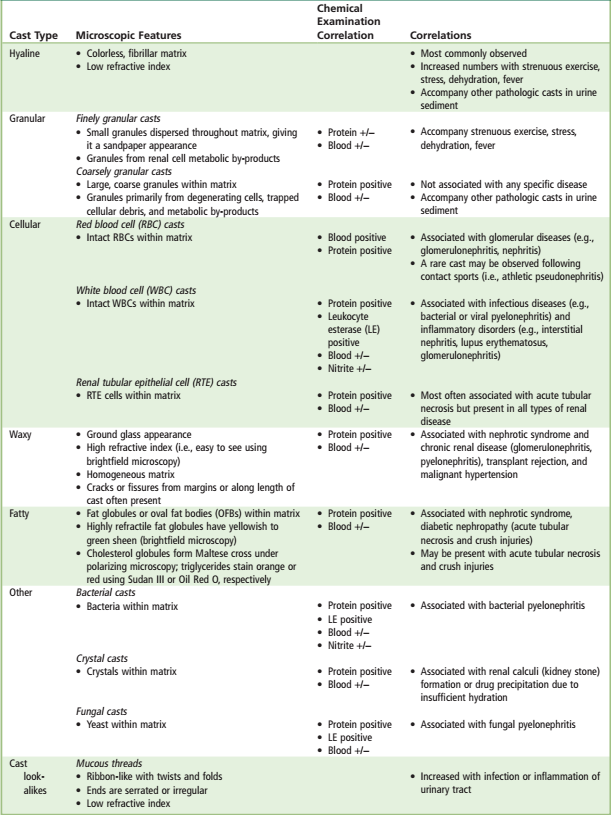
سیلندرهای ادراری:
تشکیل سیلندرها معمولاً در مجاری جمعکننده و دیستال کلیه اتفاق میافتد، زیرا در آن مناطق ادرار به حداکثر غلظت و اسیدیته خود میرسد (جدول 16). سیلندرها در ادرار قلیایی و ادرار خنثی با وزن مخصوص1.003 و یا کمتر از آن حلشده و از بین میروند. سیلندر هیالن ممکن است در ادرار افراد سالم درنتیجه تجویز داروهای مدر و یا بعد از ورزش و دویدن مسافتهای طولانی دیده شود. کست کاذب یا سودوکست (Pseudo cast) اشاره به رسوب کریستالهای اورات آمورف به شکل سیلندر یا استوانه دارد که حالت کست گرانولار را تقلید میکند. برخلاف کست گرانولار این ذرات بسیار براق بوده و فاقد حاشیه واقعی کست میباشد.
| جدول 16: سیلندرهای ادراری |
مؤلفههای مرحله پست آنالیتیکال تضمین کیفیت:
نتایج تجزیه ادرار باید با استفاده از فرمت جوابدهی استاندارد و عبارات صحیح گزارش گردد. یک برگه گزارش باید شامل رنجهای نرمال و مرجع بوده و امکان اضافه کردن اطلاعات مفید دیگر در آن وجود داشته باشد. نتایج باید بهصورت کمی باشد (RBC:10-25 HPF). همه پرسنل آزمایشگاه باید از عبارات و استانداردهای مشترکی جهت گزارش جواب ادرار استفاده نمایند. روشهای کار آزمایشگاهی باید با جزئیات کامل شیوه و فرمت جوابدهی، محدوده نتایج نرمال آزمایشگاهی و محدوده بحرانی را شرح دهد.
نحوه گزارش عناصر موجود در ادرار:
- کلیه پرسنل فنی باید از یک فرمت جهت جوابدهی، اصطلاحات و دامنه مرجع جهت جوابدهی استفاده نمایند. با بزرگنمایی پایین و نور کم تمام میدانها را بگردید. سیلندرها را بیشتر در کناره لامل میتوان دید.
- تعداد سیلندرها را حداقل در 10 میدان میکروسکوپی با بزرگنمایی کم (LPF= x 10) شمارش کرده، معادل آن را گزارش نمایید. از بزرگنمایی بالا (HPF) جهت تعیین نوع سیلندرها استفاده کنید.
- تعداد گلبولهای قرمز و سفید و سلولهای اپیتلیال را با بزرگنمایی بالا شمارش و گزارش نمایید. میانگین تعداد گلبولهای سفید و قرمز با درشتنمایی 40 (HPF) در 10 فیلد میکروسکوپی برای بیمار گزارش میگردد. میانگین تعداد گلبولهای سفید و قرمز بهصورت آزاد و دستجات (Clump) گزارش میشود. تعداد بیشتر از 40 گلبول سفید یا قرمز را در هر میدان بهصورت فراوان (Many) و تعداد فوقالعاده زیاد و غیرقابل شمارش، بهصورت (Numerous) گزارش میگردد.
- موارد ذیل را هم باید گزارش نمود:
الف) باکتری، قارچ، انگل
ب) کریستالها را باید با بزرگنمایی کم گزارش نمود. بلورهای غیرطبیعی باید به طریق شیمیایی تعیین هویت شده و با شرححال بیمار تطبیق داده شوند. گزارش کریستالها، موکوس و باکتریها بهصورت کیفی است (جدول شماره 17)
جدول 17: شرایط و شیوه گزارش کیفی عناصر ادراری (کریستالها)
| rare | 1+ | حضور دارند ولی بهسختی رؤیت میشوند |
| few | 1+ | حضور یک یا بیشتر در تقریباً تمام فیلدها |
| moderate | 2+ | حضور در همه فیلدها، بیشتر از few و کمتر از many |
| many | 3+ | به میزان فراوان در همه فیلدها |
| numerous | 4+ | بسیار فراوان، همه فیلد میکروسکوپی را اشغال کرده باشد. |
ج) مقادیر زیاد مخاط (موکوس)
5- تمام گزارش، شامل خصوصیات فیزیکی و شیمیایی و میکروسکوپی را از نظر گذرانیده با اطلاعات بالینی موجود مقایسه نمایید، چنانچه ناهماهنگی وجود داشته باشد میبایست بررسی و مرتفع گردد.
محدوده مرجع:
محدودهای از کمیتها که بهعنوان معیار برای تخمین سلامت/ بیماری مقابل مقادیر بدست آمده در آزمایشگاه قرار میگیرد.
منابع:
1- A Manual of Laboratory and Diagnostic Tests, Ninth Edition, Frances Talaska Fischbach, Rn, Bsn, Msn.
2- Henry’s Clinical Diagnosis and Management Isbn: 978-0-323-29568-0 ,By Laboratory Methods, 23e,Copyright © 2017 By Elsevier Inc
3- Fundamentals of Urine and Body Fluid Analysis, Third Edition, Isbn: 978-1-4377-0989-6, Copyright © 2013, 2004, 1994 By Saunders, an Imprint of Elsevier Inc.
4– Laboratory Tests and Diagnostic Procedures, Fifth Edition, Cynthia C. Chernecky, PhD, RN, CNS, AOCN, FAAN, 2008
5- Library of Congress Cataloging-in-Publication Data, Marshall Barnett Dunning III, BS, MS, PhD. 9TH Edition, 2015.ISBN: 978-1-4511-9089-2
- بیوشیمی کامل ادرار همراه با اطلس رنگی، دکتر عظیم اکبرزاده خیاوی-دکتر فریبا فتحالهزاده، انتشارات نوردانش، چاپ اول سال1380
- آنالیز آزمایشگاهی ادرار و مایعات بدن، دکتر حبیبالله گلافشان، انتشارات دانشگاه علوم پزشکی شیراز، چاپ اول سال 1387
- انتشارات آزمایشگاه مرجع سلامت
- کتاب جامع تجهیزات آزمایشگاهی، دکتر حمیدرضا سقا، انتشارات میر
- تضمین کیفیت در آزمایشگاههای تشخیص طبی: کنترل کیفی آزمایشها و تجهیزات [کتاب]/ تألیف سیما ذوالفقاری انارکی، تهران: تیمورزاده: طبیب، ۱۳۸۱
الزامات پرهآنالیتیک آزمایش ادرار
https://medlabnews.ir/%d8%a2%d8%b2%d9%85%d8%a7%db%8c%d8%b4-%d8%a7%d8%af%d8%b1%d8%a7%d8%b1/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام





عالی بود