پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب
قسمت سوم
دکتر محمد قهری
دكتراي علوم آزمايشگاهي
PhD قارچ شناسي
آزمایشگاه تشخیص طبی رسالت
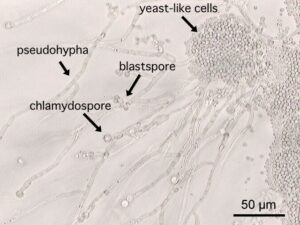
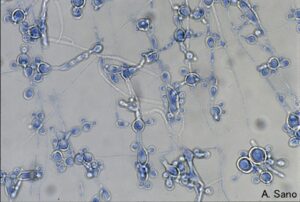
فرمهای مختلف سلولی در کاندیدا آلبیکنس
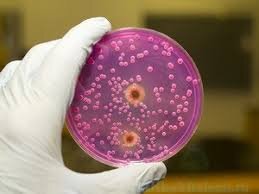
کاندیدا آلبیکنس
انواع عفونتهای ایجاد شده توسط گونههای مختلف کاندیدا از برفک گرفته تا عفونتهای واژینال و تا کاندیدمی آشناترین عفونتهای قارچی برای پزشکان و بیماران هستند.
در ایالات متحده، عفونتهای کاندیدایی در ردیف چهارم شایعترین عفونتهای قارچی بیمارستانی میباشند. رایجترین گونه تعیین شده در عفونتهای انسانی کاندیدا آلبیکنس میباشد. در عین حال عفونتهای حاصل از گونههای دیگری از کاندیدا از قبیل کاندیدا دابلینینسیس، کاندیدا گلابراتا، کاندیدا کروزهای، کاندیدا لوزیتانی، کاندیدا پاراپسیلوزیس و کاندیدا تروپیکالیس در حال افزایش میباشند. کاندیدا آلبیکنس میتواند از ناحیهی دهان و حلق بیش از 40 درصد افراد نرمال جدا شود و یک گونه کومنسال قسمتهای تحتانی دستگاه گوارش به شمار میرود.
همانند آسپرژیلوس و کریپتوکوکوس، اکثریت موارد کاندیدیازیس در افراد دچار نقص ایمنی اتفاق میافتد. به هر حال عفونتهای کاندیدایی به خاطر منشاء آندوژن آن منحصر به فرد میباشند. بر خلاف آسپرژیلوس و کریپتوکوکوس، کاندیدا آلبیکنس به ندرت در خاک و محیط خارجی یافت میشود. در عوض به عنوان یک میکروارگانیسم کومنسال و ساکن طبیعی انسان محسوب میگردد. این ویژگی زیستی کاندیدا آلبیکنس اهمیت زیادی را در بحث پاتوژنز قارچ به خود اختصاص میدهد.
ما درگذشته درباره فعل و انفعالات بین فشارهای انتخابی در محیط خاک و صفات ویرولانس در آسپرژیلوس فومیگاتوس بحث کردیم و در بخشهای بعدی راجع به آن در کریپتوکوکوس نئوفورمنس نیز بحث خواهد شد. کاندیدا آلبیکنس از این نظر که رایجترین ارگانیسم موجود در غشاهای مخاطی پستانداران بویژه انسان است به میزان زیادی با محیط بدن میزبان سازگار شده است. برخی از این سازگاری و تطابق که برای رشد و پایداری ارگانیسم در انسان لازم است شامل: اتصال به سطوح مخاطی، توانایی تحمل دمای بدن انسان و نیز مقاومت در برابر تب، و یک توانایی ذاتی برای سازش سریع با تغییرات شرایط محیطی در بدن میزبان. کاندیدا برای باقی ماندن به عنوان یک عضو کومنسال باید بتواند بدون اینکه بیماری ایجاد نماید مکانیسمهای استادانه و دارای جزئیاتی را جهت طفره رفتن یا به حداقل رساندن پاسخهای ایمنی میزبان به کار گیرد. علاوه بر آن از آنجائیکه کاندیدا آلبیکنس میتواند در محلهای متنوعی از محیط بدن میزبان (دهان، واژن و دستگاه گوارش) کلونیزه شود باید توان بقاء در این موقعیتهای غیرمتجانس میزبان را داشته باشد. در ادامه، درباره برخی از جنبههای منحصر به فرد زیستی کاندیدا آلبیکنس و اثرات آنها بر روی پاتوژنز بحث خواهیم کرد.
اتصال به بافت میزبان
در ارگانیسمهای کومنسال نظیر کاندیدا اتصال به بافت میزبان برای کلونیزاسیون و ایجاد بیماری لازم است. در مطالعات اخیر بر روی کاندیدا آلبیکنس بسیاری از ادهزینهای (adhesions) قارچی جهت اتصال این قارچ به بافتهای مختلف میزبان شناسائی شدهاند. یک خانــــــــــواده خاص از این ژنها خانــــــوادهی ژن ALS (aglutinin_Like Sequence) است که توجه بسیاری را به خود جلب کردهاند. خانواده ژن ALS حاوی حداقل هشت عضو میباشد که بوسیله توالیهای تکراری محافظت شده در ناحیهی مرکزی پروتئینها مشخص میگردد. پایانهی C پروتئینها حاوی یک جایگاه لنگر مانند گلیکوزیل فسفاتیدیل اینوزیتول میباشند که پروتئینها را به دیواره سلولی قارچی لنگر میکنند.
مطالعات روی اتصال سوبسترا با استفاده از ویران کردن اعضاء خانواده ژنی ALS و همچنین بیان هترولوگوس در مدل غیر پاتوژن مخمر ساکارومایسس سرویسیه ویژگیهای پتانسیل اتصال اعضاء ژنهای خانواده ALS را شناسائی کردند. موتانتهای null ژنهای ALS1 و ALS3 قدرت اتصال کاهش یافته به سلولهای اندوتلیال داشتند و بیان بالای این دو عضو از خانواده ژن ALS باعث افزایش اتصال در ساکارومایسس سرویسیه میشود. همچنین اتصال موتانت null ژن ALS3 به سلولهای اپیتلیال دهانی کاهش یافته است. بیان ALS1، ALS3 و ALS5 در ساکارومایسس سرویسیه اتصال به محدوده وسیعی از سوبستراها از جمله کلاژن، سلولهای اندوتلیال، فیبرونکتین، لامینین و سلولهای اپیتلیال دهانی را افزایش میدهد. علاوه بر آن مشخص شد که ALS5 اندوسیتوز بوسیلهی سلولهای اپیتلیال را میانجیگري میکند. بنابراین ALS3 احتمالا یک فاکتور اساسی در تهاجم به سلول های اندوتلیال میباشد.
عدم تشابه ادهزینها در کاندیدا و سایر قارچهای بیماریزا توجه بسیاری را در رابطه با مکانیسمهای پاتوژنز قارچی به خود جلب کرده است. بنابراین توانایی اتصال به سوبسترا احتمالا مختص یک جایگاه اکولوژیک میباشد که هر قارچی به طور معمول آن را اشغال میکند. کاندیدا آلبیکنس کومنسال انسان، به طور منحصر به فردی برای اتصال به بافتهای میزبان موضع گرفته است و بر خلاف آن آسپرژیلوس فومیگاتوس یا کریپتوکوکوس نئوفورمنس به طور معمول در خاک یافت میشوند و کلونیزه کننده پایدار و ثابت بافتهای پستانداران نمیباشند. میتوان چنین فرض کرد که آسپرژیلوس فومیگاتوس و کریپتوکوکوس نئوفورمنس دارای ادهزینهایی برای اتصال به سوبستراهاي مهم در محیط طبیعی خود از قبیل گیاهان و دیگر ترکیبات آلی میباشند. به هر حال واضح است که حتی آسپرژیلوس فومیگاتوس و کریپتوکوکوس نئوفورمنس قبل از تهاجم به بافتهای میزبان اتصال پیدا میکنند. این موضوع نشان میدهد که ادهزینهای مختص این قارچها ممکن است با سوبسترای اختصاصی آنها دارای اشتراکاتی باشند. بدون شک مطالعات آینده، پروتئینها و مولکولهای چسبنده اختصاصی این پاتوژنهای قارچی مهم را کشف خواهد کرد که میتواند جهت مقایسه و افتراق با ادهزینهای کاندیدا مورد استفاده قرار گیرد.
همچنین در ارتباط با اتصال به بافت میزبان کاندیدا آلبیکنس و دیگر گونههای بیماریزای کاندیدا، آسپارتیک پروتئیناز ترشحی (SAP) تولید می کنند که از دیرباز به عنوان یک فاکتور مهم جهت واکنش با سطوح سلولی میزبان و نیز فاکتور ویرولانس شناخته شده است. ثابت شده است که SAPsها موجب تخریب مولکولهای سطحی سلول میزبان و همچنین تخریب بافت شده و در نتیجه به عفونت های کاندیدایی اجازه انتشار میدهند. اخیرا نشان داده شده است SAPs میتوانند پاسخ ایمنی میزبان را از طریق تعدیل پاسخ سایتوکاینی اپیتلیال در مدل In vitro از کاندیدیازیس واژینال تغییر دهد. نهایتاً SAPs که از فاکتورهای اصلی در تغییر سطوح سلولی میزبان است بر پاسخهای سیستم ایمنی میزبان تاثیر میگذارد و همچنین باعث اتصال قویتر و تهاجم بافتی سلولهای کاندیدا میشود.
تشکیل بیوفیلم
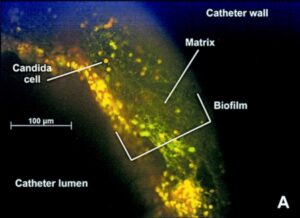
امروزه واضح است بسیاری از میکروارگانیسمها روی سوبستراهای اختصاصی در محیطهای اکولوژیک خود به شکل اجتماعات پیچیدهای رشد میکنند بعوض آنکه بصورت ارگانیسمهای آزادِ منفرد باشند. این جوامع چسبیده به سوبسترا که غالبا به عنوان بیوفیلم توصیف میشوند به وسیله یک ماتریکس ترشح شدهی خارج سلولی پیرامون یک کلنی از سلولها مشخص میشوند واضح است که تشکیل بیوفیلم یک تاثیر قابل توجه بر روی سلامت انسان دارد. کاندیدا آلبیکنس میتواند بیوفیلمهای وسیعی را در لوازم پزشکی بکار گذاشته شده در بدن انسان از قبیل کاتترها تشکیل دهد. از این رو که کاندیدا آلبیکنس کومنسال انسان میباشد میتواند در تماس با این لوازم پزشکی قرار گیرد و پس از اتصال تشکیل یک بیوفیلم بدهد و عفونتهای شدیدی را ایجاد کند. در حقیقت تعداد قابل توجهی از عفونتهای کاندیدایی در حال حاضر به همراه تشکیل بیوفیلم گزارش شدهاند. از آنجا که فعالیت ضد قارچی در بیوفیلمها در مقایسه با سلولهای مخمری آزاد و تنها تغییر میکند، تشکیل بیوفیلم اثرات مستقیمی بر روی مدیریت بالینی این گونه عفونتهای کاندیدایی دارد.
تصویر فلئورسانسی از بیوفیلم کاندیدائی در لومن کاتتر
اهمیت تشکیل بیوفیلم در عفونتهای کاندیدا آلبیکنس منجر به این مسئله شده است که تحقیقات برای روشن کردن مکانیسمهای مولکولی تشکیل بیوفیلم متمرکز گردد. تشکیل بیوفیلم یک پدیده تکاملی پیچیده و همچنین یک پدیده کنترل شده ژنتیکی با سه مرحله اساسی میباشد:
- اتصال و کلونیزاسیون سلولهای مخمری در سوبسترا
- رشد و تکثیر سلولهای مخمری و تشکیل یک لایه بازال از سلولهای مخمری
- سودوهایفی، بسط و توسعهی هایفی و تولید پیوسته یک ماتریکس خارج سلولی
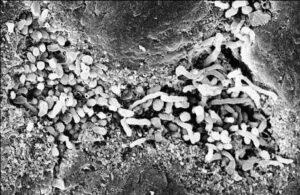
بیوفیلم کاندیدا آلبیکنس
دادههای تازه مطرح میکنند که سلولهای کاندیدا آلبیکنس میتوانند حضور یک سطح اختصاصی را ردیابی کنند و در پاسخ، با به راهاندازی برنامهی رونویسی منجر به تشکیل بیوفیلم شوند. به عنوان مثال در یک تماس 30 دقیقهای با یک سطح پلیاستیرن، سلولهای مخمری ظاهراٌ رونویسی از یک ژن خاص را انجام میدهند که در ارتباط با تماس سطحی میباشد. بعنوان یک مسئله جالب کلینیکی، ژنهای پمپ انتشار به خارج (efflux) آزول یعنی CDR1 و MDR1 در عرض 6 ساعت بعد از تماس سطحی بصورت رونویسی القاء میشوند. این القاء مربوط به تماس سطحی و بیان ژنهای پمپ انتشار دارو به خارج، میتواند اهمیت افزایش مقاومت آزولی موجود در سلولهای بیوفیلم را توضیح دهد. مقاومت دارویی بیوفیلم همچنین میتواند مربوط به هتروژنیتی مورفولوژیک بیوفیلمها باشد. بیوفیلمها حاوی هر سه شکل از کاندیدا آلبیکنس شامل سلولهای مخمری، سودوهایف و هایف میباشد. به طور مثال گزارش شده است که سودوهایف و هایف در مقابل کلرهگزیدین نسبت به سلولهای مخمری مقاومتر میباشند. همچنین نشان داده شده است که مخمر در بیوفیلمها به آزولها و پلیانهای استاندارد مقاوم میباشد اما در رابطه با اکینوکاندینها و محصولات لیپیدی آمفوتریسین B فعالیت ضد قارچی وجود دارد.
بصورت قابل توجهی نتایج اخیر نشان داده است که تشکیل بیوفیلم توسط فعالیت الکل دهیدروژناز با یک مکانیسم وابسته به اتانل مهار میشود. این موضوع ممکن است مطرح کنندهی یک استراتژی درمانی جدید با استفاده از اتانل برای حذف بیوفیلم کاندیدا باشد.
سازگاری با محیط میزبان
یکی از ویژگیهای محیط میزبانان پستاندار، تنوع دامنهی PH بافتهای مختلف بدن میباشد. بنابراین کاندیدا آلبیکنس باید قادر به سازگاری و پاسخ به محدوده وسیعی از دامنهی PH در جریان کلونیزاسیون در بافتهای مختلف میزبان باشد. برای مثال باید قادر به پاسخ به تغییرات PH مجرای واژن در طول دوره قاعدگی در میزبان باشد. توانایی کاندیدا برای پاسخ به تغییرات متنوع خارج سلولی PH به وسیله شبکه محافظت شدهای از ژنها اداره میشود که تا حدودی توسط فاکتور رونویسی وابسته به روی RIM101/PacC تنظیم میشود. این مسیر اختصاصا به کاندیدا اجازه پاسخ به شرایط خنثی و یا قلیایی را که نوعا در میزبانهای پستاندار وجود دارد، میدهد. استفاده از موتانتهای مسیر RIM101 نشان داده که برای ایجاد کاندیدیازیس سیستمیک، توانایی پاسخ به شرایط PH محیطی مورد نیاز میباشد. ممکن است PH محیطی یک تنظیم کننده قوی برای تغییر قارچ از فاز مخمری به فاز هایفی باشد که اغلب با بیماریزایی قارچ همراه است. موتانتها در چندین جزء مسیر RIM101 شامل خود RIM101، قادر به تشکیل هایف در PH برابر 8 نبودند و به صورت مخمری باقی ماندند.
دیمورفیسم
کاندیدا آلبیکنس یک قارچ دو شکلی میباشد. این قارچ میتواند به اشکال سلولهای مخمری، سودوهایف و هایف وجود داشته باشد. این توانایی برای تغییر مورفولوژی به عنوان یک فاکتور ویرولانس برای کاندیدا آلبیکنس در نظر گرفته شده است. این فرضیه بیان میکند شکل هایفی قارچ، مهاجم و شکل مخمری آن غیر مهاجم میباشد. مطالعات متعدد انجام شده در مدل موشی، ارتباط بین مورفولوژی و ویرولانس را نشان داده است. استفاده از طبیعت چندگرایی موتاسیونها در استرینها مشخص کرد که ارتباط مستقیم مورفولوژی با ویرولانس غیرقابل دفاع میباشد. در حقیقت در مطالعات با موتانتهایی با ژن NRG1 (تنظیم کننده منفی رشتهای شدن) بوسیله پروموتور القا کردنی با تتراسایکلین، هیچ ارتباطی بین بار قارچی، مرگ و میر و مورتالیتی هایفی در مدل موشی کاندیدیازیس وجود نداشت. بعلاوه کاندیدا گلابراتا قابلیت تولید هایف را ندارد و یک پاتوژن فرصت طلب برجسته میباشد. شاید بیشترین احتمال برای این فرضیه وجود دارد که صلاحیت کاندیدا آلبیکنس برای حضور در شرایط In vivo مستقیما در ارتباط با شرایط منحصر به فرد محیط میزبان میباشد که در طول بیماریزایی ارگانیسم قارچی بدست میآید. بنابراین شکلهایی از قارچ بسته به محل و موقعیت عفونت در بدن میزبان میتواند اساسیتر از اشکال دیگر باشد.
دیمورفیسم در پاراکوکسیدیوئیدس برازیلینسیس
به عبارت دیگر دیمورفیسم به عنوان یک صفت بیماریزای ضروری در گروه قارچهای دو شکلی عنوان میشود. در این قارچها کونیدیا و هایف در محیط طبیعی آنها تولید میشود و میتواند پستانداران را آلوده کند. در پدیده دیمورفیسم تبدیل شکل مخمری به شکل هایفی در شرایط In vivo توسط دمای بالای بدن پستانداران ایجاد میشود. پیشرفتهای اخیر با کمک بیولوژی مولکولی برای روشن کردن مکانیسمها و اهمیت دیمورفیسم قارچی در این دسته از میکروارگانیسمها آغاز شده است.
پاتوژنهای قارچی دوشکلی–تعویض کنندههای شکل
همانند کاندیدا آلبیکنس توانایی برای تغییر چشمگیر مورفولوژی در گروه کوچکی از قارچها به نام قارچهای دوشکلی وجود دارد. ایـــــن قارچها شــــــــــامل: بلاستومایسس درماتیتیدیس، کوکسیدیوئیدس ایمیتیس، هیستوپلاسما کپسولاتوم، پاراکوکسیدیوئیدس برازیلینسیس، اسپوروتریکس شنکئی و پنیسیلیوم مارنفئی میباشند.
این قارچها مسئول بیش از یک میلیون عفونت جدید بطور سالیانه در ایالات متحده میباشند. اکولوژی و اپیدمیولوژی این ارگانیسمها مشخص نیست. به هر حال، آنها اغلب در خاک دارای فضولات حیوانی و مواد پوسیده گیاهی یافت میشوند. آنها در محیط ایجاد هایف و کونیدیا (احتمالا اسپورهای عفونی زا) میکنند. هنگامیکه توسط میزبان پستاندار استنشاق شد، همانند کریپتوکوک، این قارچها درون ماکروفاژها مقاومت کرده و عفونتهای پنهانی را ایجاد میکنند. مسئلهی مهم این است که این قارچها میتوانند مرفولوژی خود را از حالت رشد هایفی در دمای محیط به شکل سلولهای مخمری در دمای بدن میزبان پستاندار(°37 سانتیگراد) تغییر دهند. طبق این فرضیه توانایی تغییر مورفولوژی برای پاتوژنز یا بیماریزایی لازم میباشد و شواهد مولکولی در حال افزایش دادههای بیشتری برای حمایت از این فرضیه فراهم کرده است.
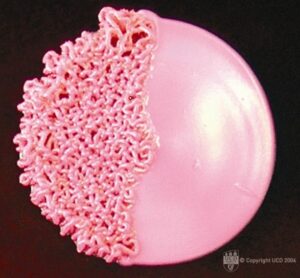
تصویری از سویچ زدن مرفولوژیک در کلنی کاندیدا
برخی از اولین دادههائی که ارتباط بین دیمورفیسم قارچی و ویرولانس قارچ را نشان داد از تحقیقات بر روی هیستوپلاسما کپسولاتوم (عامل هیستوپلاسموزیس) بدست آمده است. میسلیومهای تیمار شده با یک مهار کننده سولفیدریل مانند P-کلرومرکوری فنیل سولفونیک اسید، ترکیبی که از تبدیل فرم مخمری به فرم هایفی جلوگیری میکند، عدم ایجاد بیماری را در مدل موشی از خود نشان دادهاند. با پیشرفت در تکنیکهای بیولوژی مولکولی قابل دسترسی در مطالعه این پاتوژنهای دیمورفیک، تعیین کنندههای مولکولی دیمورفیسم قارچی و متعاقبا پاتوژنیسیتی آنها برای شناسائی آغاز شدهاند. برای مثال یک پروتئین کوچک متصل به کلسیم (CBP1) مخصوص فاز مخمری هیستوپلاسما کپسولاتوم نشان داده شده است که برای ویرولانس ضروری میباشد. دو نقش بالقوه برای CBP1 در ویرولانس هیستوپلاسما کپسولاتوم فرض شده است. CBP1 میتواند کلسیم را از محیط خارج سلولی کسب کند که این عمل بسیار شبیه سیدروفورها برای جذب آهن میباشد. همچنین CBP1 میتواند یک جزء اساسی از آبشارهای انتقال سیگنال مختلف باشد که مانند مسیر سیگنالینگ کلسینورین به کلسیم متکی میباشد.
واضح است که دیمورفیسم در این قارچها توسط دما تنظیم میشود. در دمای محیط قارچهای دیمورفیک همانند گونههای آسپرژیلوس به شکل هایفی وجود دارد. در واقع اسپور تولید شده از شکل فیلامنتوس این قارچها شکل عفونی کننده آنها میباشد. در داخل بدن میزبان پستاندار تغییر دما به ˚37 سانتیگراد یک پاسخ مولکولی و بیوشیمیایی پیچیده را در قارچ القاء میکند که به تغییر شدید در مورفولوژی، از شکل کپکی به شکل مخمری کروی منجر میشود. علاوه بر آن در پاراکوکسیدیوئیدس برازیلینسیس مسیر تبدیل کونیدیا به مخمرها به وسیله استروژن مسدود میشود. این یافتهها به نظر میرسد افزایش شیوع این بیماری قارچی را در مردان نسبت به زنان توجیه کند. بنابراین سوالاتی ایجاد میشود: چرا این قارچها توانائی تغییر مورفولوژی از شکل فیلامنتوس یا هایفی در دمای محیط به شکل مخمری در دمای بدن پستانداران را بدست آوردهاند؟ یک فرضیه این است که این انتقال از یک مرحله به مرحله دیگر در آشیانهی اکولوژیک آنها لازم میباشد، اما امروزه شواهد متقاعد کنندهای جهت تایید و یا رد این فرضیه وجود ندارد.
اخیرا یک ژن درگیر در تنظیم تعویض (سویچ زدن) مورفولوژیک بین رشد هایفی و مخمری در بلاستومایسس درماتیتیدیس شناسایی شده است. این تنظیم کننده DRK1 (dimorphism-regulating histidine kinase) نامیده میشود و در دو جزء ترکیب دهندهی سیستم سیگنالینگ درگیر میباشد که دیمورفیسم، بیان ژن ویرولانس و ویرولانس را تنظیم میکند. یک استرین فاقد DRK1 از بلاستومایسس درماتیتیدیس قادر به تغییر از فاز هایفی به فاز مخمری در دمای ˚37 سانتیگراد نبوده و ترکیب دیواره سلولی آن متفاوت بود و همچنین کاهش چشمگیری در اسپورولاسیون آن مشاهده گردید. موتانتهای drk 1 در مدل موشی عفونت پولمونری قادر به ایجاد بیماری نبودند. برای نشان دادن میزان حفاظت این ژن مهم، DRK1 در هیستوپلاسما کپسولاتوم خاموش شد و این استرین موتانت drk 1 قادر به ایجاد بیماری در مدل موشی هیستوپلاسموزیس نبود. این نتایج به شدت از این فرضیه حمایت میکند که دیمورفیسم قارچی برای پاتوژنز قارچها در پستانداران لازم میباشد. چون انسان فاقد هیستیدین کینازی مثل DRK1 است، هیستیدین کینازهای قارچی میتوانند به عنوان هدفهای جذاب برای تهیهی داروهای ضد قارچی استفاده شوند. علاوه برآن Nmecek و همکارانش این فرضیه را ارائه کردند که موتانتهای drk1 میتوانند در تولید و توسعه یک واکسن علیه پاتوژنهای قارچی دوشکلی استفاده شوند.
منبع:
Anaissie E J. , McGinnis M R., Pfaller M A. Clinical Mycology. CHURCHILL LIVINGSTONE 2009, Elsevier Inc. Chap: 2
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب (4)
پیشرفتهای جدید در درک مکانیسمهای بیماریزایی قارچهای فرصت طلب
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام