انتخاب روش اندازهگیری و استاندارد مناسب در اندازه گیری پروتئین ها
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروب شناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
مقدمه:
پروتئين ها، دستهاي بزرگ و ضروري از ماكروملكولهاي سلولي را تشكيل ميدهند. تعيين مقدار پروتئين نمونههاي مختلف، در اغلب موارد، يكي از كارهاي ضروري، پيش از جداسازي و خالصسازي نمونههاي مختلف ميباشد. اين مرحله، يك مرحله ضروري قبل از ارائه نمونههاي پروتئيني مختلف براي انجام كروماتوگرافي، الكتروفورز و تفكيك و آناليزهاي بيشتر ايمونو- شيمي ميباشد. روشهاي متفاوتي در تعيين غلظت محلولهاي پروتئيني به كار گرفته ميشوند كه آنها را ميتوان به دو دسته روشهاي جذبي و رنگسنجي تقسيمبندي نمود.
هر يك از اين روشها داراي مزايا و محدوديتهايي بوده و هيچ كدام داراي دقت 100 درصد نميباشند. هر يك از اين روشها فقط حضور قسمت خاصي مثلا يك اسيد آمينه خاص را از محلول پروتئيني تشخيص ميدهند. از آنجائي كه حضور و فراواني اين قسمتها در پروتئين هاي مختلف با يكديگر فرق میکند، براي رفع اين مشكل و افزايش دقت بايستي روش مناسبي را انتخاب نمود. در تمامي اين روشها از اسپكتروفتومتر استفاده ميشود .
| نكاتي كه در استفاده از اسپكتروفتومتر بايد رعايت شوند:
1- از وسايل شيشهاي كاملا تميز استفاده شود. 2- كووت بايد كاملا تميز بوده و استفاده از كووتهاي يكبار مصرف ارجحيت دارد. 3- براي پايداري طول موج بايستي دستگاه حداقل 10 دقيقه قبل از شروع اندازه گيريها روشن گردد. 4- هنگامي كه غلظت نمونه بالا ميباشد بايستي ابتدا نمونه را رقيق نموده و سپس ضريب رقت را در محاسبه غلظت نمونه لحاظ نمود. |
سادهترين روش اندازه گيري غلظت پروتئين در يك محلول، ميزان جذب نور UV آن است. اگر پروتئين خالص باشد، غلظت آن را ميتوان از روي OD به دست آمده، محاسبه كرد. اگر پروتئين خالص نباشد، مقدار جذب نوري، تنها امكان تخمين تقريبي غلظت پروتئين را فراهم ميسازد. اين روش براي مقادير كم پروتئين(0.05-0.1 mg/ml) در محلولي كه حاوي ساير مواد جاذب اشعه UV نظير بعضي بافرها، اسيدهاي نوكلئيك و بعضي ليپيدها و يا محلول هاي سوسپانسيون باشد، مناسب نیست.
روشهاي رنگسنجی، پيچيدهتر بوده، اما حساستر میباشند و براي پروتئين هايي كه به صورت سوسپانسيون هستند، نيز مناسب است. روشهاي بسياري براي تعيين غلظت پروتئين ها وجود دارند. معيارهايي كه براي ارزيابي روش مناسب به كار ميروند، شامل حساسيت كافي، صحت و قابليت تكرارپذيري ميباشد. رايجترين روش براي تعيين اندازهگيري غلظت پروتئين ها در آزمايشگاههاي بيوشيمي پيشرفته احتمالا روش لوري و (يا) برادفورد است.
انتخاب روش اندازهگيري مناسب:
اندازهگيري پروتئين، به منظور بررسي حضور پروتئين در نمونه به كار ميرود. اين نوع آزمايشها بر پايه توانايي اتصال اختصاصي رنگ به پروتئين حتي در مخلوطهاي كمپلكس مانند شير يا هموژنيت سلول استوارند. برخي روشهاي اندازهگيري پروتئين ها، كيفي بوده و فقط حضور و يا عدم حضور پروتئين را در نمونه نشان ميدهند. روشهاي اندازهگيري كمي پروتئين ها از قبيل بيوره، لوري، برادفورد و … توانايي تشخيص مقادير مختلف پروتئين در نمونه را دارا مي باشند (جدول 1). محققين فارماكولوژيست ممكن است از اطلاعات و ويژگيهاي روش اندازهگيري پروتئين در تركيب با ساير آزمايشها براي نتيجه يا فعاليت اختصاصي يك دارو كه به عنوان يك پروتئين يا داروي حاوي پروتئين عمل مينمايد، استفاده كنند.
اگر نمونهها حاوي عوامل احيا كننده يا معرفهاي شلاته كننده مس باشند، روش كوماسي بلو، روش انتخابي ميباشد. چنانچه نمونههاي مورد نظر براي آناليز، حاوي يك يا چند دترجنت (تا غلظت 5 درصد) باشند، روش انتخابي، روش BCA Bbicinchoninic acid assay)) ميباشد.
گاهي اوقات نمونهها حاوي موادي هستند كه آنها را براي اندازهگيري با هر روشي نامناسب ميسازد. روش ارجح در اين گونه موارد، خارج كردن ماده مزاحم با روشهايي از قبيل دياليز، نمكزدايي (Desalting)، بلوكه سازي شيميايي (Chemical Blocking) و رسوب پروتئين و محلولسازي مجدد آن (Resolubilization) ميباشد.
بلوكه سازي شيمي، شامل تیمار نمونه با موادي است كه مانع تداخل مواد مزاحم با روش مورد نظر براي اندازهگيري ميشوند. رسوب پروتئين ها موجب خارج شدن آنها از محلول ميشود. در اين هنگام، بافر تداخل كننده، خارج شده و پروتئين مجددا محلول ميگردد. در روش تیمار شيمي، كه در روش BCA كاربرد دارد، برخلاف روش رسوب پروتئين ها، محلول كردن مجدد پروتئين هاي هيدروفوب انجام نميشود.
جدول 1: مقايسه روشهاي مختلف رايج اندازهگيري غلظت پروتئين ها

- محدوده پاسخ ديناميك و حساسيت:
همه روشهاي اندازهگيري داراي محدوده پاسخ ديناميك ميباشند. محدوده پاسخ ديناميك عبارت است از محدودهاي كه غلظتهاي نمونه در آن، ايجاد پاسخهاي افتراقي نمايند.
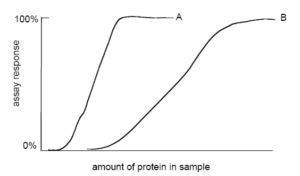
تصوير 1: مقايسه حساسيت دو روش اندازهگيري مختلف
در تصویر 1، روش اندازهگيري B (منحنی B) نشان دهنده توانايي ايجاد پاسخهاي افتراقي در محدوده مقادير وسيعتري ميباشد؛ در حالیکه، روش اندازهگيري A (منحنی A)، غلظتهاي پايينتر پروتئين را كه با روش B نميتوان آنها را اندازهگيري کرد، نشان ميدهد. در اينجا ميگوييم كه حساسيت روش A، بيشتر از روش B ميباشد. در نتيجه، روش A ممكن است در مواردي كه غلظت پروتئين نمونه پايين است، روش انتخابي باشد. نمونههاي داراي غلظت بالاي پروتئين را ميتوان به وسيله رقيق کردن با اين روش (روش A) انجام داد.
- اختصاصيت:
يك روش اندازهگيري اختصاصي تنها با ماده مورد اندازهگيري و نه هر گونه ماده ديگر، واكنش ميدهد. هر گونه ماده ديگري كه توليد پاسخهاي مشابه با ماده مورد نظر براي اندازهگيري نمايد، ماده «تداخل كننده يا مداخلهگر» ناميده ميشود. روشهاي اندازهگيري بسيار كمي، 100 درصد اختصاصي عمل کرده و اكثر روشها، به برخي مواد مداخلهگر پاسخ ميدهند. يك محقق كارآزموده ميداند كه چه موادي با روش اندازهگيري تداخل ايجاد کرده و چه مواد مداخلهگري احتمالا در نمونه حضور دارند.
- بازيافت نمونه:
در برخي موارد، مقدار نمونه موجود، بسيار محدود و كم ميباشد. در اين گونه موارد لازم است كه براي كارهاي بعدي، نمونه پروتئين را از روش اندازهگيري بازيافت نماييم. براي اين كار لازم است روشي را انتخاب کنیم كه ساختمان پروتئين را تخريب ننمايد.
- مقرون به صرفه بودن:
يكي از كارهاي ضروري براي انتخاب هر روشي، مقرون به صرفه بودن و در دسترس بودن مواد مورد نياز براي آن روش ميباشد. شما بايد هزينه تجهيزات، معرفهاي شيميايي و ساعت كاري پرسنل را براي تهيه و ساخت معرفها و مواد شيميايي و انجام آزمايش را مد نظر قرار دهيد.
- ايمني:
روشي را كه بر ميگزينم بايد تا حد امكان داراي كمترين احتمال خطر براي پرسنل و محيط زيست و طبيعت باشد.
انتخاب استاندارد مناسب در اندازهگیری پروتئینها:
در اندازهگيري پروتئينها، انتخاب استاندارد نامناسب ميتواند بزرگترين منبع ايجاد خطا باشد. بهترين انتخاب براي نوع استاندارد پروتئين، نمونه با خلوص بالاي پروتئين غالب يافت شده در نمونه ميباشد. البته اين كار هميشه امكانپذير نبوده و از طرفي ضروري هم به نظر نميرسد. در برخي موارد در مراحل اوليه خالصسازي يك پروتئين، فراكشني كه حاوي بيشترين مقدار پروتئين ميباشد به عنوان استاندارد انتخاب مينماييم. اگر نمونه با خلوص بالاي پروتئين مورد نظر كه قرار است به عنوان استاندارد انتخاب کنيم در دسترس و يا مقرون به صرفه نباشد، از نمونه (پروتئيني) استفاده مينماييم كه منحني ايجاد پاسخ رنگ آن، مشابه منحني ايجاد شده در روش اندازهگيري پروتئين مورد نظر باشد.
به طور كلي، سرم آلبومين گاوي (BSA)، به دليل وفور فرم با خلوص بالا و هزينه نسبتا پايين آن، استاندارد مناسبي تلقي ميشود. اگرچه وجود ايمونوگلبولينهاي متعدد در استاندارد BSA، از معايب آن به شمار ميرود.
گاما گلبولين گاوي (BGG) نيز در هنگامي كه به دنبال تشخيص غلظت آنتيباديها هستيم، استاندارد مناسبي محسوب ميگردد؛ زيرا منحني ايجاد پاسخ رنگ آن بسيار شبيه منحني ايجاد پاسخ رنگ ايجاد شده توسط ايمونوگلبولين G ميباشد.
در هر روش اندازهگيري پروتئين، پروتئين ايدهآلي كه ميتوانيم به عنوان استاندارد انتخاب کنيم، فرم خالص شده همان پروتئين مورد نظر براي اندازه گيري است. در صورت در دسترس نبودن فرم خالص آن پروتئين، پروتئيني ارجح است كه رنگ حاصل از واكنش آن، مشابه رنگ حاصل از واكنش پروتئين مورد نظر براي اندازه گيري باشد. انتخاب اين نوع پروتئين بيشتر از روي تجربه انجام ميگيرد. در مواردي كه هيچ يك از اين دو روش عملي نبوده و يا ضرورتي براي اين كار احساس نشود، ممكن است كه هر پروتئيني براي انتخاب استاندارد استفاده شود. دو پروتئين رايج كه به عنوان استاندارد انتخاب ميشوند شامل سرم آلبومين و گاماگلبولين گاوي ميباشند.
براي صحت بيشتر محاسبه غلظت پروتئين توتال نمونه مجهول، ضروري است كه در هنگام انجام آزمايش، منحني استاندارد نيز رسم نماييم. اين كار به ويژه در روشهايي كه توليد منحنيهاي استاندارد غير خطي مينمايند بايد انجام شود. تصميمگيري در مورد تعداد استانداردها و تعداد دفعات تكرار آنها، به درجه غير خطي بودن منحني استاندارد و ميزان صحت مورد نياز در اندازهگيري پروتئين، بستگي دارد. به طور كلي، اگر منحني ايجاد پاسخ رنگ استاندارد، خطي باشد، به تعداد نقاط كمتري نياز خواهيم داشت. منحنيهاي استاندارد معمولا با استفاده از تكرار هر نقطه به تعداد حداقل دو بار، رسم ميشوند.
رسم منحني استاندارد:
در تمامي روشهاي رايج تعيين غلظت پروتئين، بايد منحني استاندارد رسم شود. منحني استاندارد از تعيين ميزان جذب نور در غلظتهاي مشخص نمونه استاندارد به دست ميآيد. در اندازهگيري غلظت پروتئين ها معمولا از سرم آلبومين گاوي (BSA) به عنوان نمونه استاندارد استفاده ميشود. اگر چه اين پروتئين هميشه نميتواند به عنوان يك استاندارد كامل و بينقص عمل کند، اما در عمل، رايجترين استاندارد مورد استفاده ميباشد. معمولا به منظور جلوگيري از اختلاف در غلظت پروتئين استاندارد، نمونه استاندارد BSA را در محلول هاي ذخيره با غلظت 5-1 ميلي گرم در ميليليتر در حجمهاي بالا (100-50 ميليليتر) تهيه کرده و به صورت قسمتهاي 2-1 ميليليتري در دماي 20- درجه سانتيگراد نگهداري مينمايند.
| در تهيه منحني استاندارد با BSA رعايت نكات زير الزامي است:
1- BSA پتانسيل آلودگي به پريون را دارد. 2- BSA يك پروتئين چسبناك بوده و به ظروف مورد استفاده متصل ميشود. 3- در هنگام محلول كردن BSA آن را به آرامي مخلوط نماييد. 4- در حجمهاي كاري مناسب (معمولا يك ميليليتري) در دماي 20- درجه سانتيگراد نگهداري شود. 5- در هنگام استفاده از استاندارد بايستي اجازه داد كه محلول BSA كاملا به دماي اتاق برسد. 6- غلظتهاي مورد نياز بسته به روش مورد استفاده، متفاوت ميباشند. در روشهاي حساستر مانند برادفورد بايد از طيف غلضتي كوتاهتري (معمولا 25-0 ميكروگرم) به منظور حفظ خطي شدن منحني استاندارد استفاده شود. 7- براي تهيه استانداردهاي مربوطه بايد از همان بافرهاي موجود در نمونه استفاده شود. 8- به منظور دستيابي به نتيجه بهتر و دقيقتر، بايد از قرار گرفتن جذب نمونه مجهول در بين دو نقطه از جذبهاي استاندارد اطمينان حاصل شود. |
:Refrences
1- Bradford MM. A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976: 72; 248-254.
2- Zor T. and Selinger Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal. Biochem. 1996: 236; 302–308.
3- Noble J.E. and Bailey M.J.A. Quantitation of Protein. Methods Enzymol. 2009: 463;73–95.
4- Glover BP. and McHenry C.S. The DNA Polymerase III oloenzyme – an asymmetric dimeric replicative complex with leading and lagging strand polymerases. Cell. 2001: 105; 924-934.
5- Knight MI. and Chambers PJ. Problems associated with determining protein concentration. Molecullar Biotechnology. 2003: 23; 19-23.
6- Gornall AG., Bardawill CJ. and David MM. Determination of serum proteins by means of the Biuret reaction. Journal of Biological Chemistry. 1949: 177; 751.
7- Layne E. Spectrophotometric and turbidimetric methods for measuring proteins. Methods in Enzymology. 1957: 3; 447.
8- Peterson GL. Determination of total protein. Methods in Enzymology. 1983: 91; 95.
روش برادفورد در اندازهگیری پروتئینها(در تب جدید مرورگر باز می شود )
https://medlabnews.ir/%d8%b1%d9%88%d8%b4-%d9%84%d9%88%d8%b1%db%8c/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام