پرسش و پاسخهای آزمایشگاهی و کاربردی در طب انتقال خون
قسمت چهارم
دکتر حبیباله گلافشان1، پریسا تندل2
1: هیئتعلمی دانشگاه علوم پزشکی شیراز
2: کارشناسی ارشد خونشناسی و بانک خون دانشکده پیراپزشکی
مقدمه
سمینارهای طب انتقال خون و هموویژولانس بهطور مکرر در بیمارستانهای استان برای پرسنل علوم آزمایشگاهی، پرستاران و پزشکان برگزار میگردد. توفیق الهی نصیب اینجانب در برگزاری سمینارها در طی سالیان متمادی گردید و موفق به جمعآوری پرسشهای کلیدی و کاربردی از طرف عزیزان علوم آزمایشگاهی گردیدم که در حد بضاعت علمی با توجه به رفرانس های مرجع و معتبر که در بخش آخر خواهد آمد، پاسخ داده شده است. این پرسش و پاسخ در 5 قسمت تقدیم شما عزیزان میگردد، به این امید که گره مشکلات آزمایشگاهی در رابطه با تزریق خون و فرآوردههای آن گشوده گردد.
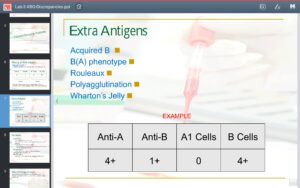
پرسش 31) کنترل کیفی معرفهای گروهبندی چگونه انجام میشود؟
پاسخ: برای گروهبندی سلولی (Cell Type) احتیاج به Anti A و Anti B و برای گروهبندی سرمی (Back Type) احتیاج به سوسپانسیون سلولهای A1 و B و O است. Anti A و Anti B بایستی برای آفینیتی (Affinity) یا عیار و میل ترکیبی (Avidity) در رابطه با زمان لازم جهت واکنش، شفافیت، شدت واکنش (Intensity)، نبود پدیده پروزون (Prozone)، نبود رولکس و با کنترلهای مثبت و منفی مورد ارزیابی قرار گیرند؛ برای مثال Anti A بایستی شفاف، فاقد ماده ژلهای و ذرهای باشد و در حداقل رقت 256 بتواند با گلبولهای A1 واکنش دهد. کنترل مثبت برای Anti A شامل گلبولهای A1 و A2 و AB و کنترل منفی شامل گروه O و B است. زمانی کهAnti A با گلبولهای گروه A بر روی اسلاید مخلوط میشود، بایستی در کمتر از 10 ثانیه واکنش ظاهر گردد و واکنش آگلوتیناسیون در 2 دقیقه به شدت 3+ یا 4+ شود. واکنشهای کنترل منفی بایستی فاقد پدیده رولکس زیر میکروسکوپ باشد. چنانچه Anti A در رقتهای بالاتر، واکنش قویتری نسبت به رقتهای پایینتر بدهد، گفته میشود که دارای پدیده پروزون (Prozone) است.
کنترل کیفیAnti B هم شبیه Anti A است، گرچه استانداردها، استفاده از Anti AB را برای گروهبندی ضروری نمیدانند، ولی چنانچه به روش لولهای، گلبولهای قرمز با Anti A و Anti B واکنش ندهند ولی با Anti AB واکنش دهند، گروه احتمالی Ax مطرح میگردد.
با تک معرف Anti AB میتوان گروه O را مشخص کرد. تایپ سرمی سیستم ABO نیاز به سوسپانسیون گلبولهای A1، B و O دارد. چنانچه از گلبولهای A2 در تایپ سرمی استفاده شود، با واکنشهای ضعیف گروههای B و O در تایپ سرمی همراه میشود، زیرا حضور Anti A در گروههای B و O با گلبولهای A2 واکنش ضعیف میدهد. از طرف دیگر آن دسته از افراد A2 وA2B را که سرمشان حاوی Anti-A1 است را نمیتوان در تایپ سرمی تشخیص داد. با استفاده از عصاره لکتین دولیشوس که با گلبولهای A1 و A1B واکنش میدهد میتوان گلبولهای A1 برای تایپ سرمی تهیه کرد. چنانچه عصاره در اختیار ندارید از گلبولهای سه نفر با گروه A استفاده کنید و بعد از اینکه هر کدام را جداگانه شستشو دادید، سوسپانسیون آنها را باهم مخلوط کنید، زیرا از نظر آماری 80% افراد A دارای گروه A1 و 19% دارای گروه A2 هستند و مخلوط 3 گروه A حضور گلبولهای A1 را قطعیتر میکند. لوله Ocell در بک تایپ به عنوان کنترل منفی است و مثبت شدن آن ممکن است بیانگر حضور آنتی H، آنتیبادی سرد، رولکس و واکنشهای آنتیژن-آنتیبادی در خارج از سیستم ABO باشد. آنتی D بایستی در حداقل عیار 32 با گلبولهای ارهاش مثبت واکنش دهد.
پرسش 32) چگونه مشخص میشود که بیــمار تــــرومایی نیاز به ترانسفیوژن ماسیو (Massive Transfusion) دارد و پدیده شست (Washed Out) در انتقال خون به چه مفهومی است؟
پاسخ: اسیدوز، هایپوترمی و اختلالات انعقادی سه عارضه تهدیدکننده زندگی در بیماران ترومایی است که خون زیادی از دست دادهاند.
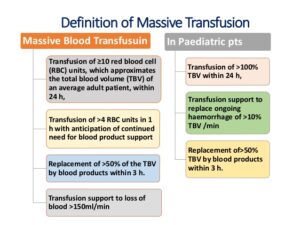
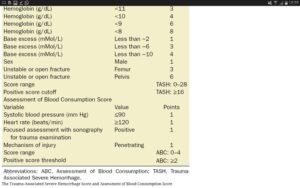
درجهبندی (Scoring) بیماران ترومایی که نیاز به ترانسفیوژن سنگین یا ماسیو دارند بر اساس میزان هموگلوبین، جنس، مثبت شدن سونوگرافی برای تروما، تعداد ضربان قلب و کاهش بیکربنات که بهصورت Base excess با عدد منفی گزارش میگردد، صورت میگیرد. دو سیستم طبقهبندی در تابلوی زیر مشاهده میگردد.
تعاریف ترانسفیوژن سنگین یا ماسیو
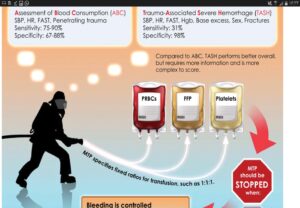
سیستمهای نمرهدهی ABCو TASH در نیازسنجی بیمار برای ترانسفیوژن ماسیو
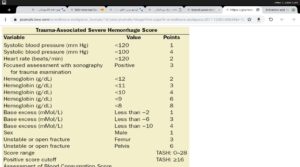
معیارهای TASH برای درجهبندی شدت تروما و نیاز به ترانسفیوژن ماسیو.اسکور بیشتر از 16 بیانگر شدت تروما است.هر چه مقدار منفی عددی base excess بیشتر باشد، بیانگر شدت اسیدوز متابولیک است
معیارهای ABC برای درجهبندی شدت تروما و نیاز به ترانسفیوژن ماسیو مشاهده میشود اسکور بیشتر از 2 به عنوان مثبت و نیاز به ترانسفیون ماسیو است
چنانچه به بیماری که خونریزی شدید دارد تنها گلبول قرمز فشرده همراه با محلولهای کریستالوئید مثل سرم فیزیولوژی تزریق شود، موجب پدیده شست میگردد؛ بدین مفهوم که پلاکتها و فاکتورهای انعقادی که بیمار با خونریزی از دست داده است با تزریق خون فشرده جبران نمیشود و از طرفی پلاکتها و فاکتورهای باقیمانده در گردش خون بیمار رقیق میگردند؛ برای مثال اگر پلاکت بیماری با وزن 70 کیلوگرم، 200000 باشد و به علت خونریزی یک حجم خون معادل 10-8 کیسه به وی تزریق شود، تنها 35-30% پلاکتها در گردش خون باقی میمانند که حدود 60000 میشود یا چنانچه پلاکت نوزادی 100000 باشد و به علت افزایش بیلیروبین با 2 حجم خون (دو برابر حجم خون نوزاد) تعویض خون گردد تنها حدود 20000 پلاکت در گردش باقی میماند که به آن پدیده شست گویند. پدیده شست به شرط فعال بودن مغز استخوان ظرف 7 روز ناپدید میگردد، از این رو در بیمارانی که ترانسفیوژن ماسیو لازم دارند بایستی خون و پلاکت و پلاسما را به نسبت 1:1:1 تزریق کرد و در نوزادی که خون تعویض میشود بایستی حین تعویض، شمارش پلاکت را انجام داد و چنانچه شمارش به حد بحرانی برسد، اقدام به تزریق پلاکت کرد. در بیمارانی که ترانسفیوژن ماسیو دارند، شمارش پلاکت و آزمایشهای PT و PTT راهنمای خوبی جهت تصحیح اختلالات انعقادی است. یادآوری میشود که خون فشرده یا حتی خون کامل که در یخچال نگهداری شده است فاقد پلاکت و فاقد فاکتورهای انعقادی است.
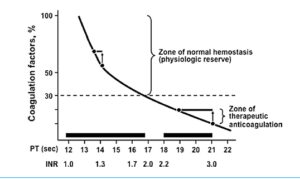
پرسش 33) پزشک برای یک بیمار مبتلا به سیروز کبدی تقاضای 3 واحد FFP (پلاسمای تازه) برای یک عمل جراحی کرده است. چه زمانی پلاسما را آب کرده و به بخش تحویل دهیم؟
پاسخ: پلاسمای تازه (FFP) در 37 درجه (Water bath) حدود 20 دقیقه نگه داشته میشود تا کاملاً آب شود. پلاسمای آب شده در یخچال 4 درجه برای 24 ساعت تازه است و حاوی کلیه فاکتورهای انعقادی است. از پلاسما به عنوان منبع فاکتورهای انعقادی برای بیمارانی که همزمان کمبود چندین فاکتور انعقادی دارند، مانند افراد مبتلا به سیروز استفاده میشود. توجه داشته باشید که برای بیمار کبدی که آزمایش PT طولانی دارد، تزریق 10 تا 15 سیسی پلاسما به ازای هر کیلوگرم وزن با شیب تند آزمایش PT را کوتاه میکند و به حدود 15 ثانیه یا 1/5INR میرساند و تزریق زیادتر پلاسما آزمایش PT را به حد نرمال 12 ثانیه یا یک INR تصحیح نمیکند و از این رو نبایستی با تزریق بیشتر پلاسما سعی در نرمال کردن PT داشت. با توجه به اینکه نیمهعمر فاکتور VII انعقادی کوتاه و حدود 4 تا 6 ساعت است از این رو بایستی پلاسما را یک ساعت قبل از یک عمل جراحی تهاجمی به بیمار تزریق کرد.
تزریق 10 تا 15 سیسی پلاسما به ازای هر کیلوگرم با شیب تند آزمایش PT را کوتاه میکند و به حدود 15 ثانیه یا 1/5 INR میرساند و تزریق زیادتر پلاسما آزمایش PT را به حد نرمال 12 ثانیه یا یک INR تصحیح نمیکند و از این رو نبایستی با تزریق بیشتر پلاسما سعی در نرمال کردن PT داشت
پرسش 34) زمانی که پزشک خون را برای بیمار اورژانس بدون کراس مچ تقاضا میکند، وظیفه آزمایشگاه چیست؟
پاسخ: در موارد اورژانس که حتی فرصت گروهبندی نیست، خون O– به همراه پلاسما و پلاکت AB دهنده همگانی است. در برخی از مراکز تروما حتی چند کیسه پلاسمای آب شده در دسترس است که به محض ورود بیمار به مرکز، تأخیری در ترانسفیوژن رخ ندهد. در این موارد آزمایشگاه بایستی از پزشک امضاء بگیرد که خون بدون کراس مچ از بانک خون خارج شده است. آزمایشگاه هم بایستی گروهبندی و کراس مچ را در اسرع وقت انجام دهد و چنانچه کراس مچ ناسازگار بود، فورا پزشک را آگاه سازد. کراس مچ صحرایی یا تکنیک چرخش فوری (IS) که در آن مخلوط سرم بیمار با گلبولهای اهداکننده مجاور و فوری سانترفیوژ میشود، در کشف خطاهای ABO بسیار حائز اهمیت است. گفتنی است که کیسههای خون که از سازمان انتقال خون به بانک خون بیمارستان تحویل داده میشود بایستی گروه ABO آن مجدداً چک گردد و چنانچه ارهاش آن منفی باشد با آزمایش مجدد تأیید گردد.
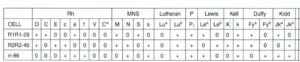
پرسش 35) آیا برای آزمایش اسکرین آنتیبادی یا ICT میتوان سه تا +O را مخلوط کرد و به عنوان سلولهای معرف اسکرین بکار برد؟
پاسخ: سلولهای اسکرین از 2 تا 3 ویال گروه خون O انتخاب میشوند که در مجموع حاوی آنتیژنهای مهم با شیوع بیشتر از 2% در جامعه باشند. در تهیه سلولهای اسکرین تلاش میشود که پدیده اثر دوزاژ برای شناسایی آنتیبادیهایی که با آنتیژنهای هموزیگوت واکنش بهتر میدهند، رعایت گردد. سلولهای اسکرین در ویالهای جداگانه هستند و مخلوط نمیشوند زیرا مخلوط کردن گلبولها موجب کاهش حساسیت و واکنشهای میکس فیلد میگردد. استفاده از گلبولهای اسکرین استاندارد برای تکرارپذیری آزمایش ICT ضروری است. مخلوط شانسی سه گروه +O به عنوان گلبولهای اسکرین نه تنها آزمایش تکرارپذیر در آزمایشگاههای مختلف را به دست نمیدهد، بلکه دارای حساسیت کم است. ترکیب آنتیژنی سه گروه +O در آزمایشگاههای مختلف متفاوت بوده و بیمار ممکن است در یک آزمایشگاه جواب مثبت و در آزمایشگاه دیگر جواب منفی دریافت کند. جالب است بدانیم که تاریخچه مخلوط کردن 3 گروه +O در زمانهای قدیم شکل گرفت؛ زمانی که تازه روگام کشف گردیده بود و به مادران با گروه منفی که آزمایش کومبز غیرمستقیم در آنها از نظر آنتی D فعال منفی بود و نوزاد گروه مثبت داشت، تزریق میشد، پزشک در آن زمان تقاضای آزمایش ICT از نظر آنتی D میکرد. چنانچه سرم مادر با سه گروه +O که جداگانه تهیه میشود دارای واکنش مثبت و با سه گروه –O که جداگانه تهیه میشود دارای واکنش منفی باشد، به احتمال 95% حضور آنتی D تأیید میشود. امروزه منظور پزشک از آزمایش ICT حضور کلیه آنتیبادیهای حائز اهمیت بالینی نه تنها آنتی D بلکه آنتیبادیهای مهمی چون Anti K، Anti c و … است. حالا خودتان قضاوت کنید که آیا آن سه تا +O که مخلوط شده حاوی آنتیژنهای مهم بودهاند که با سرم واکنش مثبت دهند؟ ویالهای استاندارد از گروههای مثبت و منفی O تهیه میشوند زیرا آنتیژنهای c و e بهطور هموزیگوت با شیوع بیشتری روی گلبولهای O منفی وجود دارند.
ویالهای استاندارد سلولهای معرف اسکرین برای تجسس آنتیبادی در کومبز غیرمستقیم
پرسش 36) مفهوم عدم تطابق تاریخی Historical mismatch در گروهبندی ارهاش چیست؟ تعریف جدید فنوتایپ Du چیست؟
پاسخ: در سالهای گذشته منبع آنتی D برای گروهبندی ارهاش سرم خانمهای حامله ارهاش منفی بود که بر اثر تحریک با گلبولهای قرمز ارهاش مثبت از جنین و جفت تولید شده بود و یا افراد ارهاش منفی که بهصورت داوطلب، تحریک ایمنی با ارهاش مثبت میشدند. عیار اینگونه آنتی D پایین و اغلب دارای ناخالصی بود. امروزه آنتی D با تکنولوژی مولکولار تهیه میشود و در تهیه آن IgG و IgM علیه آنتیژن D ممزوج (Blend) میگردد و دارای عیار بسیار بالایی است، بهطوری که با بسیاری از فنوتایپهای D ضعیف (Du) بهطور مستقیم واکنش مثبت میدهد، بنابراین ممکن است افرادی در گذشته با فنوتایپ D ضعیف، گروه منفی گزارش شده ولی حالا با آنتی D از نوع مونوکلونال ارهاش مثبت گزارش گردند. فنوتایپ Du به آنتیژن ارهاش ضعیف گفته میشود که در واکنش با آنتی D بعد از دو دقیقه واکنش منفی یا ضعیف 1+ میدهد، ولی همین واکنش منفی یا ضعیف در فاز آنتی هیومن گلوبولین به واکنش قوی 3+ تبدیل میگردد.
پرسش 37) آیا در گروهبندی سیستم ABO در بک تایپ وجود سوسپانسیون سلول O
(O cell) لازم است؟ آیا پدیده پروزون در بک تایپ ممکن است رخ دهد؟
پاسخ: بنا به استانداردها بایستی برای فرد با سن بالاتر از 6 ماه همزمان گروهبندی سلولی و سرمی انجام گردد و جواب این دو یکدیگر را تأیید کند؛ برای مثال چنانچه تایپ سلولی گروه O گردد، بایستی سرم دارای آنتی A و آنتی B باشد. آنتیبادیهای سیستم گروه خونی ABO از 4 تا 6 ماهگی شکل گرفته و در 5 تا 10 سالگی به اوج عیار میرسد و ممکن است در کهنسالی از عیار آنها کاسته شود. لوله O cell در بک تایپ به عنوان کنترل منفی است. گروه بمبئی (Oh)، پارابمبئی، آگلوتیناسیون سرد، رولکس و آنتیبادی علیه آنتیژنهای LIPMAN (لوئیس، I، P،M و N) میتواند لوله O را در بک تایپ مثبت کنــــد. هنگامی که واکنش در لوله O cell منفی باشد، واکنش مثبت در لولههای A1cell و Bcell در بک تایپ قابل اعتماد است و چنانچه واکنش در لوله O cell مثبت شد، نیاز به پیگیری دارد.
عیار آنتی A گاهی آنقدر بالاست که در مجاورت گلبولهای A1 به سرعت کمپلمان را فعال کرده و سطح گلبول آکنده از کمپلمان گردیده و موجب پوشش آنتیژنهای A و واکنش منفی با آنتیبادی A میگردد که به آن اثر پروزون تأخیری (Delay prozone effect) گفته میشود. آنتی A در عیار بالا ممکن است موجب همولیز گلبولهای قرمز در بکتایپ نیز گردد. برای رفع مشکلات فوق بایستی از سوسپانسیون EDTAدار گلبولهای قرمز در بکتایپ استفاده کرد یا اینکه لوله را بدون وقفه سانترفیوژ و برای آگلوتیناسیون مشاهده کرد. استفاده از غذاهای پروبیوتیک موجب افزایش عیار آنتیبادیهای گروه خونی میگردد. آنتی A در گروههای B و O یافت میشود. آنتی B که در گروههای A و O یافت میشود دارای عیار ضعیفتری نسبت به آنتی A است.
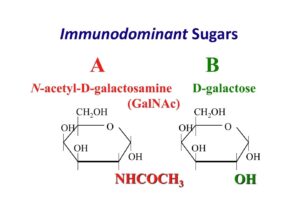
پرسش 38) آنتیژن B کاذب چیست؟ چگونه از B واقعی افتراق داده میشود؟ چگونه میتوان گروههای فرعی ضعیف A را از گروه خونی O افتراق داد؟
پاسخ: قندهای اختصاصی در آرایشهای مخصوص در سطح گلبولهای قرمز، گروه خون را تشکیل میدهند. قند ان-استیل گالاکتوزآمین (N-acetyl galactosamine) قند غالب گروه خونی A و قند گالاکتوز (Galactose) قند اختصاصی گروه خونی B و قند فوکوز (Fucose) قند اصلی بر روی گلبولهای قرمز افراد O است. میکروبهایی در روده بزرگ وجود دارند که در صورت تکثیر بیش از حد، انسداد رودهای بر اثر تومور، عفونت فضای شکم و یا پارگی روده، به خون راه یافته و با ترشح آنزیم دیاستیلاز گروه استیل را از روی تعدادی از قندهای اختصاصی گروه A برداشته و آن را به گالاکتوز آمین که شبیه به گالاکتوز است تبدیل میکنند. در این حالت گروه خونA بهصورت موقت بهصورت AB درمیآید. در B کاذب، گرچه سل تایپ AB را نشان میدهد، ولی تایپ سرمی، گروه A را نشان میدهد. البته واکنش با آنتی B در حد 1+ یا بهندرت 2+ است، ولی با آنتیA واکنش 4+ دارد.
در B کاذب گرچه سل تایپ AB را نشان میدهد، ولی تایپ سرمی، گروه A را نشان میدهد. البته واکنش با آنتی B در حد 1+ یا بهندرت 2+ است، ولی با آنتی A واکنش 4+ دارد
همیشه به یاد داشته باشید که واکنشهای 4+ و 3+ حرف اصلی را در گروهبندی دارند و واکنشهای 1+ چه در سل تایپ و چه در بک تایپ نیاز به مطالعه بیشتر دارند. پرسش در مورد تاریخچه بیماری و مشورت با پزشک بیمار در حل تناقض گروهبندی کمککننده است.
امروزه آنتی A و آنتی B برای گروهبندی از منبع منوکلونال تهیه میشود. آنتی B از کلون (Clone)ES4 آنتیژن B کاذب را بهتر از کلونهای دیگر آنتی B تشخیص میدهد و چنانچه آنتی B با هیدروکلریک اسید 0/1 نرمال اسیدی گردد و PH آن حدود6 -4/5 گردد، قادر به واکنش با B کاذب نیست و به همین دلیل برخی از سازندگان، آنتی B را جهت اینکه با B کاذب واکنش ندهد، اسیدی میکنند.
گروههای فرعی A مانند Am، Ax و A elبه علت آن که آنتیژن A در آنها بسیار ضعیف است در گروهبندی سلولی مانند گروه O عمل میکنند ولی تایپ سرمی، حضور آنتی B را بهصورت 4+ نشان میدهد. شیوع گروههای فرعی A به غیر از A1 و A2 حدود یک درصد در افراد A است. گروه خون Ax با آنتی A واکنش نمیدهد ولی با آنتی AB واکنش 2+ میدهد.
پرسش 39) واکنشهای میکسد فیلد (Mixed Field) در گروهبندی ABO و کومبز چه مفهومی دارند؟
پاسخ: واکنش زمینه مخلوط آگلوتیناسیون و گلبولهای آزاد غیر آگلوتینه در هنگام تایپ سلولی را واکنش Mixed field گویند که به علامت MF نشان داده میشود. واکنش MF در هنگام تایپ سلولی بیانگر یکی از موارد زیر است:
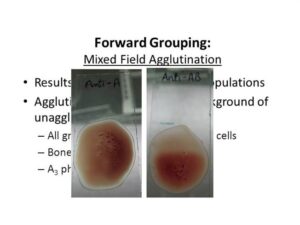
واکنش MF در هنگام تایپ سلولی
* بیماری که با گروه A یا B یا AB، خون از گروه O دریافت کرده است، در این حالت گلبولهای قرمز مخلوطی از A و O بوده و با آنتی A واکنش MF میدهند.
* تضعیف آنتیژنهای گروه خونی در لوسمیها و سندرومهای مایلودیسپلاستیک، بهطوری که ممکن است از روی برخی از گلبولها، آنتیژن ناپدید گردد.
* پیوند سلولهای بنیادین خونساز از گروه O به سایر گروهها که در این حالت برای مدتی خون بیمار مخلوطی از گلبولهای O و گلبولهای بیمار میشود. گفتنی است که پیوند سلولها از هر گروهی به گروه دیگر بلامانع است؛ چون آنتیژنهای ABO بر سطح سلول مادر وجود ندارند و پیوند گروه مخالف موجب رد پیوند نمیشود.
* گروه خونA3 در واکنش با آنتی A واکنش MF میدهد.
* کایمریسم ژنتیکی که در این حالت بافتهای خونساز در دوقلوهای غیر یکسان مبادله شده و خون برای همیشه MF باقی میماند.
* واکنش مثبت کومبز مستقیم بهصورت MF در بیماری که به تازگی (دو سه ماه پیش) تزریق خون داشته است بیانگر ساخته شدن آلوآنتیبادی علیه گلبولهای تزریقی است.
پرسش 40) آیا گروهبندی ABO در بیمارانی که سرطان خون یا سرطانهای گوارشی دارند تغییر میکند؟ پیوند سلولهای بنیادی خونساز چگونه گروه خون را تغییر میدهد؟ آیا پیوند کلیه و کبد روی گروه خون اثر میگذارد؟
پاسخ: از موارد مهم تناقض گروهبندی سلولی و سرمی، نبود آنتیبادی در سرم بیماران یا آنتیبادی اضافه در سرم است؛ برای مثال نوزادان، بیماران با کاهش ایمنی مانند سندروم بروتون یا بیماری ویسکوت آلدریچ فاقد آنتیبادیهای گروه خونی هستند و گروهبندی سرمی بهصورت AB درمیآید که بیانگر نبود آنتی A و آنتی B است.
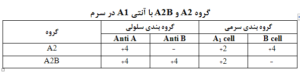
حضور آنتی A1 در سرم گروه A2 و A2B در واقع بهصورت آنتیبادی اضافی عمل میکند، زیرا در گروه A تنها انتظار آنتی B میرود. در این موارد بک تایپ گروههای A2 و A2Bبه ترتیب بهصورت O و B درمیآید.
بهندرت حضور آنتی H در گروههای A1 وA1B که تمامی قندهای H به آنتیژنهای A و B تبدیل میشوند، گزارش شده است. آنتی H در این حالت سرد و بیخطر است ولی آنتی H در گروه بمبئی و پارابمبئی بسیار پرخطر است. آنتی H با گلبولهای O cell واکنش قوی میدهد.
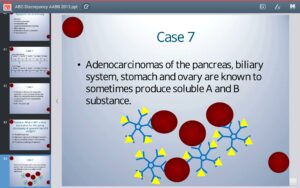
در سرطانهای لوزالمعده (Pancreas)، مجاری صفراوی، معده و تخمدان ممکن است آنقدر ترشح مواد محلول گروه خونی زیاد شود که معرفهای گروهبندی را در تایپ اسلایدی خنثی کرده و جواب منفی کاذب دهد؛ برای مثال در فردی با گروه A با سرطان معده ممکن است ترشح ماده A در پلاسما به حدی افزایش یافته باشد که قادر به خنثی کردن آنتی Aو واکنش منفی یا ضعیف با گلبولهای قرمز گردد. در موارد فوق بایستی از روی خون شسته شده گروهبندی صورت گیرد تا آنتیژنهای محلول گروه خونی از خون پاک شوند.
خنثی شدن معرفهای گروهبندی با آنتیژنهای محلول ترشحی
در لوسمیها و سندرومهای مایلو دیسپلاستیک ممکن است آنتیژنهای گروه خون ضعیف گردند؛ برای مثال آنتیژن A گاهی از روی برخی گلبولها ناپدید میشود و گلبولهای بیمار بهصورت A+O و یا A ضعیف (Ag) عمل میکنند. حرف g برای آن است که A ضعیفشده در لوسمی با گروههای فرعی A ضعیف اشتباه نشود.
در پیوند کلیه و کبد هنگامی که اهداکننده گروه O و یا بیمار گروه A یا B یا AB باشد، بهطور موقت لنفوسیتهای مهاجر که در کلیه و کبد اهدایی وجود دارند با ترشح آنتی AB موجب مثبت شدن موقتی کومبز مستقیم میگردند که پس از 2 تا 3 هفته کومبز منفی میگردد. در این حالــت چنانچـــــه بیمار نیـــاز به تــــــزریق خون داشته باشـــــــــد بایستی از گروه O استفاده کرد. به حالت فوق Passenger donor lymphocytes یا لنفوسیتهای مهاجر اهداکننده گفته میشود.
پرسش و پاسخهای آزمایشگاهی و کاربردی در طب انتقال خون (1)
پرسش و پاسخهای آزمایشگاهی و کاربردی در طب انتقال خون (2)
پرسش و پاسخهای آزمایشگاهی و کاربردی در طب انتقال خون (3)
درباره اهدای خون بیشتر بدانیم (قسمت اول)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام