مقدمهای بر تکنیک واکنش زنجیرهای پلیمراز و انواع آن
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها… (عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (استاد دانشگاه)
واكنش زنجيرهاي پليمراز[1] روشي است كه طي آن، قسمتي از توالي مولكول DNA كه بين دو آغازگر[2] قرار دارد، توسط آنزيم پليمراز و به كمك چهار دزوكسي نوكلئوتيد تريفسفات، در آزمايشگاه تكثير[3] ميشود. DNA الگو به صورت دو رشتهای[4] و متشكل از دو رشته آنتي پارالل است كه توسط اتصالات هيدروژني و به صورت كووالانت به يكديگر متصل هستند. این DNA الگو حاوی قطعه هدف به طول دهها نوکلئوتید تا دهها هزار نوکلئوتید است.
همانندسازي DNA به كمك اليگونوكلئوتيدهايي به نام آغازگر انجام ميگيرد. این اليگونوكلئوتيدها، مولكولهاي DNA تك رشتهاي كوتاهي هستند كه هر كدام از آنها مكمل يك انتهاي DNA هدف (الگو) ميباشند.
روش PCR توسط کری موليس كارمند شركت Cetus ابداع گرديد. ابتدا اين كار توسط سه بنماري با حرارتهاي مختلف انجام ميگرفت و از آنزيم كلنو[5] به عنوان DNA پليمراز استفاده ميشد. اين آنزيم در اثر حرارت واسرشت ميشود و اجباراً بايد دوباره در هر چرخه به واكنش اضافه شود. Saiki از آنزيم DNA پليمراز مقاوم به حرارت كه از باكتري ترموس آكواتيكوس خالص ميشود و اصطلاحاً به آن Taq polymerase DNA گفته ميشود، استفاده كرد. امروزه واكنشPCR به صورت اتوماتيك انجام ميگيرد. در این واکنش پلیمراز مقاوم به حرارت مثل Taq، با استفاده از الیگونوکلئوتید آغازگر و چهار نوع دزوکسی نوکلئوتید تریفسفات (dNTP)[6] میلیونها نسخه از توالی هدف را میسازد.
فرایند PCR
PCR یک فرایند سه مرحلهای تکراری است که تحت عنوان چرخه PCR شناخته میشود. این سه مرحله شامل واسرشت شدن[7] و باز شدن دو رشته DNA، اتصال دو آغازگر اولیگونوکلئوتیدی به DNA الگوی تک رشتهای شده[8] و طویلسازی[9] آنزیمی آغازگر بهمنظور ساخت قطعه مورد نظر است. انتهای ‘3 آغازگر باید دقیقاً مکمل رشته الگو باشد؛ اما درانتهای ‘5 آغازگر میتوان توالیهای غیرمکمل مثل پروموتر، توالی شناسایی آنزیمهای محدودگر و را … قرار داد. در طی چرخههای واکنش، DNA الگو و قطعات تکثیرشده مراحل قبل بهعنوان سوبسترای مراحل واسرشت شدن، اتصال آغازگر و طویلسازی مورد استفاده قرار میگیرند. برای انجام واکنش، آغازگر و dNTP را به بافر 10mM Tris-HCl با pH=8.3 (در دمای اتاق) اضافه میکنند. علاوه بر این، 50mM KCl بهمنظور تأمین قدرت یونی و یون منیزیم به عنوان کوفاکتور آنزیم پلیمراز به واکنش اضافه میشود.
مرحله واسرشت سازی به سرعت در دمای 96-94 درجه سلسیوس انجام میشود. اتصال آغازگر بستگی به Tm[10] یا دمای ذوب هیبرید آغازگر- الگو دارد. نرم افزارها با در نظر گرفتن توالی آغازگر و غلظت نمکی بافر، Tm را تعیین میکنند، اما بهترین دمای اتصال آغازگر را باید بهصورت تجربی بدست آورد. دمای طویلسازی برای اکثر واکنشها °72 سلسیوس است، همچنین میتوان PCR را دو مرحلهای نمود؛ دمایی برای واسرشت شدن الگو و دمای دیگر به عنوان دمای اتصال آغازگر/ طویلسازی.
مراحل يك چرخه PCR:
1- مرحله تکرشتهای کردن یا Denaturation: در اين مرحله DNA هدف بر اثر حرارت تكرشتهاي ميشود.
2- مرحله اتصال یا Annealing: در اين مرحله با كاهش حرارت، آغازگرها در محل مناسب روي رشته مكمل متصل ميشوند.
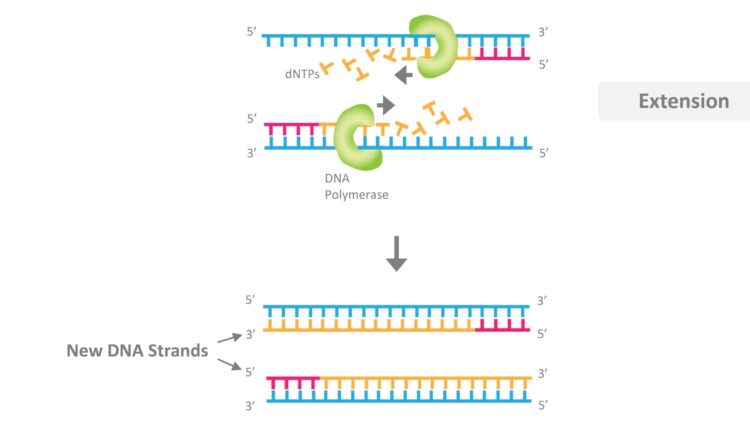
3- مرحله امتداد دادن یا Extension: دماي اين مرحله براي آنزيم DNA پليمراز مطلوب است، در نتيجه موجب طویلسازی آغازگرها شده و همانندسازي DNA هدف انجام ميگيرد. محصول PCR عبارت است از قطعه همانندسازي شدهاي كه دو طرف اين قطعه، آغازگرها وجود دارند (شکل 1).
شکل 1: شمايي از PCR
در هر چرخه PCR تعداد مولكولهاي DNA دو برابر ميشود. رشتههاي DNA توسط حرارت (95-93 درجه) از يكديگر باز ميشوند (Denaturing) و سپس در دور بعد كه حرارت پايين ميآيد (60-50 درجه)، آغازگرها بهصورت اختصاصي به ناحيه هدف متصل ميشوند (Annealing). آنزيـــــــــــــم Taq DNA polymerase در دماي مطلوب (72 درجه) و در بافر مخصـــــــــــــوص، چهار dNTP dATP, dTTP, (dCTP, dGTP) را طبق رشته الگو به هم متصل ميكند (Extension). لازم به ذكر است كه DNAهاي كوتاه (Short target product)، يعني رشتههايي كه بين دو آغازگر محصور هستند، بهصورت تصاعد هندسي (exponential) و DNAهاي بلند (long target product) يعني رشتههايي كه از يك طرف توسط يك آغازگر محدود هستند و از سمت ديگر نامحدود ميباشند، بهصورت تصاعد حسابي (linearly) تكثير ميشوند.
کاربرد PCR
PCR به طور گسترده در زیستشناسی مولکولی و مطالعه بیماریهای ژنتیکی بهکار میرود. عوامل ویروسی از قبیل HIV و HCV را میتوان با این روش شناسایی و اندازه گیری نمود. به کمک تکنیک RT-PCR محصولات ژن را شناسایی کرده و توسط Real time PCR این محصولات را اندازهگیری میکنند. در مطالعات باستانشناسی و تکامل، DNA قدیمی و خوردشده را PCR و تعیین توالی مینمایند. حساسیت و اختصاصیت بالای این تکنیک موجب شده است که از آن در پزشکی قانونی استفاده شود. در حوزه تولیدمثل گیاهان و جانوران، این تکنیک در غربالگری صفات ژنتیکی بهکار میرود. پاتوژنهای موجود در غذا و محیط به کمک PCR شناسایی و اندازهگیری میشوند. PCR شناسایی ژنومها را سرعت بخشید. به کمک این تکنیک، فراوانی کراسینگ اوور در یک اسپرم را میتوان تعیین کرد. همچنین میتوان جنین چهار سلولی را تعیین تایپ، جنسیت و … نمود. PCR در همسانهسازی و تعیین توالی DNA بهکار میرود.
پارامترهاي مؤثر در PCR:
1- زمان و دماي واسرشتسازی كه بستگي به تعداد نوكلئوتيدهاي G و C دارد.
2- دماي اتصال آغازگرها كه بايد 4-3 درجه كمتر از دماي ذوب آغازگرها باشد.
3- زمان طویلسازی كه به تعداد بازهاي بين دو آغازگر بستگي دارد.
4- طول قطعه هدف: كارآيي PCR براي قطعات بزرگتر از 3kb پائين است. در این مواقع باید از تکنیک Long PCR استفاده شود.
5- تعداد چرخهها: بعد از 25 تا 30 چرخه به علت حرارت، آنزيم پليمراز واسرشت و غيرفعال ميشود.
6- Ramping دستگاه (زماني كه طول ميكشد تا دماي مبدأدستگاه به دماي مقصد برسد): هرچه اين زمان كمتر باشد، نتيجه كار بهتر است و واكنشهاي غيراختصاصي كمتري در دماي ناخواسته انجام ميشود.
7- غلظت dNTPs و يون منيزيم: اين دو مجموعهاي را تشكيل ميدهند كه موجب فعاليت آنزيم پليمراز ميشود. غلظت اين دو ماده تابعي از يكديگر ميباشند.
8- غلظت DNA الگو: معمولا غلظت DNA الگو در حد يك دهم تا يك ميكروگرم است. غلظت زياد رشتههاي هدف موجباتصال مجدد رشتهها[11] شده و با آغازگرها رقابت ميكنند. چنانچه DNA هدف به تعداد چندین نسخه در ژنوم وجود داشته باشد، بهتر است.
9- اضافه كردن تشديدكنندههاي PCR
10- حذف مهاركنندههاي آنزيم از محيط
11- بهتر است نقطه ذوب آغازگرها شبيه هم باشد (Tm يكسان داشته باشند).
پیشگیری از آلودگی
PCR حساسیت بالقوهای برای تکثیر تک مولکولها دارد؛ بنابراین محصولات PCR میتواند به عنوان الگوی واکنشهای بعدی مورد استفاده قرار گرفته و موجب آلودگی و اشتباه شود، به همین دلیل باید محصولات PCR را از محل انجام آزمایش جدا کرد. بدین منظور باید حداقل دو اتاق pre-PCR و post-PCR تعبیه گردد. در اتاق pre-PCR نمونهها و مواد واکنش آماده شده و به اتاق post-PCR برده میشود. در اتاقpost-PCR واکنش PCR و الکتروفورز انجام میشود. جریان مواد، وسایل و نمونهها همیشه از pre-PCR به post-PCR است و برای جلوگیری از آلودگی نباید عکس این جریان اتفاق بیافتد. حتی کوچکترین آئروسلهای ایجادشده میتواند حاوی هزار مولکول از محصول PCR باشد و یک نمونه منفی را بهطور کاذب مثبت نشان دهد. این نوع از آلودگی به Carryover معروف است. برای جلوگیری از این نوع آلودگی باید از پیپتها و سمپلرهای جداگانه، سرسمپلرهای فیلتردار، فضای کار مجزا برای تهیه نمونه، آمادهسازی محلولهای واکنش، انجام PCR و آنالیز محصولات استفاده نمود. همچنین همیشه استفاده از کنترلهای مثبت و منفی الزامی است. استفاده از dUTP به جای dTTP در تمام واکنشهای PCR این امکان را به وجود میآورد که بتوان با استفاده از روشهای بیوشیمیایی این مشکل را رفع نمود. محصول حاوی dU را میتوان به طور معمول در همسانهسازی، تعیین توالی و آنالیز نمونهها مورد استفاده قرار داد. در این روش قبل از هر واکنش، آنزیم یوراسیـــــــــــل N-گلیکوزیلاز[12] (NGU) را به محلول واکنش اضافه میکنند. این آنزیم باز یوراسیل را ازDNA تکرشته و دو رشتهای حذف کرده و محصولات PCR واکنشهای قبلی را از بین میبرد.
آنزیم پلیمراز
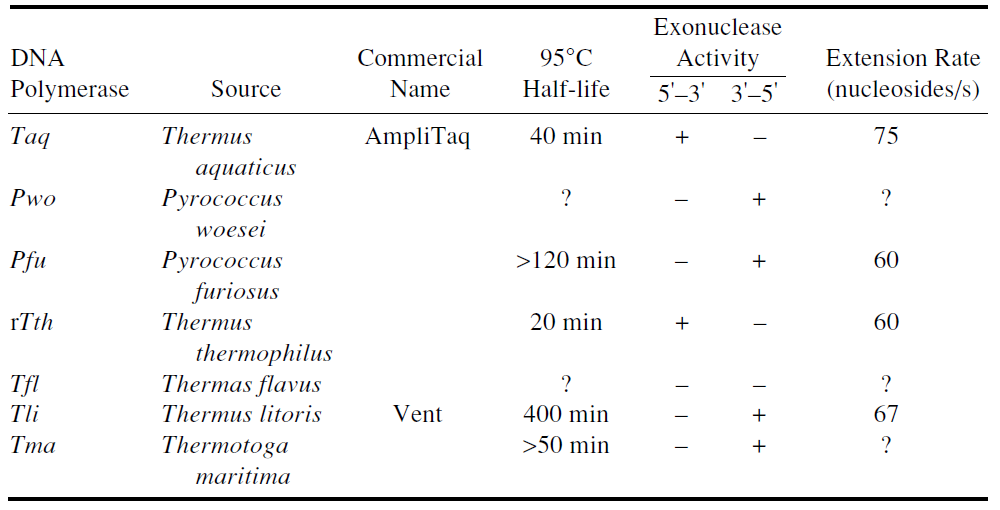
انتخاب آنزیم پلیمراز برای انجام PCR بستگی به نوع کار و هدف آزمایش دارد. چندین آنزیم پلیمراز بهصورت تجاری وجود دارد که بسته به پایداری در دمای بالا[13]، سرعت و صحت فعالیت، میتوان آنزیم موردنیاز را انتخاب کرد (جدول 1). معمولترین و بیشترین آنزیم مورد استفاده Taqپلیمراز است. این آنزیم اکنون بهصورت نوترکیب در باکتری E.coli تولید و تخلیص شده و با غلظت 5U/µl در بافر (V/V) 50% گلیسرول عرضه میشود.
خصوصیات بیوفیزیکی:
این آنزیم 94 کیلودالتون وزن داشته و فعالیت پلیمرازی ‘5 به ‘3 دارد. بهترین دما برای فعالیت این آنزیم °80-°70 سلسیوس است و پایداری خوبی در دمای بالا دارد. نیمهعمر آنزیم 40-35 دقیقه است. محصولاتی که با این آنزیم ساخته شده در انتهای ‘3 خود دارای یک نوکلئوتید آزاد (بدون مکمل)[14] از آدنین هستند که از آن میتوان در همسانهسازی ژن درون ناقل[15]T/A استفاده نمود.
واکنش بیوشیمیایی:
این آنزیــم به یون منـــیزیم به عنوان کوفاکــــتور نیاز داشـــته و واکنش طویلســــازی آغازگر را در دمای °72 سلسیوس کاتالیز میکند. آنزیم پلیمراز از 4 نوع dNTP (شامل dATP ,dCTP ,dGTP ,dTTP/dUTP) استفاده کرده و طبق قانـــــون مکمــــــلی بــــــازها، طویـــــــــلسازی را انجام میدهد. این آنــــزیم میتـــــــواند از بـــــازهای تغییــــــریافته (ddNTPs، biotin-11-dNTP، dUTP، deaza-dGTP و dNTPs نشاندارشده با فلورسنت) نیز استفاده کرده و طویلسازی را انجام دهد.
آنزیم Taqپلیمراز در ساختار چنگالی[16] فعالیت بیشتری از خود نشان میدهد. همچنین آنزیم فعالیت ‘5 به ‘3 نوکلئازی دارد که به کمک آن آغازگرهای پاییندست را تخریب میکنـــــــــــد. این فعالیت بخصوص در Real time PCR کاربرد داشته و موجب تولید سیگنال فلورسانس میشود. این آنزیم فاقد فعالیت ‘3 به ‘5 نوکلئازی و تصحیح اشتباه[17] است.
نوع تغییریافته این آنزیم نیز تولید شده که حاوی تغییرات شیمیایی قابل برگشت است (AmpliTaq Gold). آنزیم تغییریافته در دمای اتاق غیرفعال است. دمای بالا و pH پایین موجب برگشت تغییر و فعال شدن آنزیم میشود. بافر تریس و دمای °95-°92 سلسیوس این شرایط برگشت را بوجود میآورند. pH بافر تریس در دمای°25 معادل 8/3 بوده و در دمای بالای °90 به 7 میرسد. هنگام استفاده از این آنزیم و به منظور فعال نمودن آن، یک مرحله Pre-PCR به مدت 10 دقیقه در دمای°95 به واکنش اضافه میشود، همچنین به جای این مرحله میتوان 10 سیکل به PCR اضافه نمود که نتیجه مشابهی حاصل میشود.
جدول 1: خصوصیات آنزیمهای پلیمراز که بهصورت تجاری موجود است
آغازگر
آغازگرهای مورد استفاده در PCR عبارتند از الیگودزوکسی ریبونوکلئوتیدهایی که بهصورت كاملاً اختصاصي و مكمل ناحيه مد نظر از DNAهدف طراحي ميگردند. این قطعه از DNA مصنوعی 30-15 نوکلئوتید طول داشته و حاوی 60-50% نوکلئوتیدهای G+C است. آغازگرهاي حاوي بيش از 30 نوكلئوتيد اختصاصيت خوبي ندارند، همچنين دماي اتصال آغازگر بايد مناسب باشد. بهتر است تعداد نوكلئوتيدهاي دو آغازگر مساوي بوده و پليپورين يا پليپيريميدين نباشند. همچنين نواحي تكرارشونده نداشته باشند. چنانچه نوكلئوتيدهاي G يا C به صورت تكراري و پشت سرهم باشند، آغازگر بهصورت حلقه در آمده و عملاً سيستم كار نميكند. در طراحی آغازگر باید دقت شود که دو آغازگر تشکیل دایمر و ساختار سنجاقسر[18] ندهند، بخصوص انتهاي ‘3 دو آغازگر به هیچ عنوان نبايد مكمل هم باشد؛ زيرا این آغازگر دايمر به شدت مشکلآفرین خواهد بود.
انتهای ‘3 آغازگر باید دقیقاً مکمل DNA هدف باشد تا PCR بهطور کارآمد انجام شود. از این خصوصیت در طراحی PCR اختصاصی آلل[19] یا ARMS-PCR استفاده میشود. انتهای ‘5 آغازگر الزاماً مکمل رشته الگو نیست. در این انتها میتوان توالیهای فاقد مکمل از قبیل سایت برش آنزیم محدودگر و پروموتر را قرار داد. برای تکثیر قطعاتی که فقط توالی اسید آمینه آن مشخص است و اطلاعاتی از توالی اسید نوکلئیک آن در دسترس نیست، میتوان با توجه به کدونهای هر یک از اسید آمینهها، آغازگر را طراحی کرد. از آن جا که هر اسید آمینه ممکن است چند کدون داشته باشد، این آغازگر حاوی نوکلئوتیدهای بدون مکمل[20] خواهد بود. هنگام کار با این آغازگرها، دمای اتصال آغازگر در چرخههای اول را پایین در نظر میگیرند تا آغازگرهای حاوی نوکلئوتید بدون مکمل نیز به DNA الگو متصل شود، سپس در چرخههای بعدی دمای اتصال بالا رفته و شرایط سختتر میشود تا تکثیر از توالیهای غیر اختصاصی انجام نشود.
آغازگر میتواند به صورت هموپلیمرهایی مثل اولیگوdT باشد که در RT-PCR مورد استفاده قرار میگیرد. در تکنیک دیگری تحت عنوان RAPD[21]، از تکآغازگر کوچک (در حدود 10 نوکلئوتید) استفاده میشود. این آغازگر دارای توالی تصادفی بوده و موجب تکثیر از هر دو رشته شده و مجموعهای از انواع محصولات PCR را تولید میکند که در انگشتنگاری ژنوم کاربرد دارد.
امروزه نرمافزارهايي وجود دارد كه طراحي آغازگر را انجام ميدهند. بعد از طراحي آغازگر، حتماً باید توسط نرمافزارهايي مانندBlast آنها را چك نمود تا مشخص شود كه به چه نواحي ديگري از ژنوم ميتوانند متصل شوند. نرم افزار Blast مشابهت بین توالی آغازگر با تمام توالیهای موجود در بانک اطلاعاتی اسید نوکلئیک را چک میکند. آغازگر نباید غیر از توالی هدف به دیگر توالیها متصل شود، در غیر این صورت قطعات ناخواسته تکثیر خواهند شد. این نرمافزار به صورت On Line به نشانی www.ncbi.nlm.nih.gov/blast در دسترس عموم کاربران قرار دارد.
مواقعي كه آغازگرها كاملاً مكمل DNA هدف (الگو) نیستند:
- آغازگرهايي كه برايايجاد جهش در يك ژن طراحي ميگردند.
- آغازگرهايي كه در سمت ‘5 آنها جايگاه شناسايي آنزيم محدودگر تعبيه ميشود تا بتوانمحصول PCR را توسط آن آنزيم برش داد. اين كار براي همسانهسازی محصول PCR انجام ميشود.
- آغازگرهايي كه لازم است محصول PCR آنها داراي پروموتر باشد و براي بيان ژن كاربرد دارند.
- آغازگرهایی که در طراحی آنها به جای استفاده از توالی اسید نوکلئیک از توالی پروتئینی آن استفاده میشود.
دمای Tm
DNA دو رشتهای از قبیل کمپلکس آغازگر- الگو دارای سطحی از پایداری است که این پایداری وابسته به نوع و طول توالی دو رشته، غلظت این دو جزء و غلظت نمک بافر است. حرارت میتواند این دو رشته را از هم گسسته و باز کند. دمایی که در آن نصف مولکولها تکرشته شده و نصف دیگر هنوز بهصورت دو رشتهای باقی ماندهاند را Tm کمپلکس میخوانند. به علت وجود پیوندهای هیدروژنی بیشتر بین نوکلئوتیدهای G و C، Tm توالیهایی با نسبت GC بالا، بیشتر است. اغلب از روی میزان CG یک توالی Tm آن را محاسبه میکنند، اما توالیهایی که میزان CG آنها یکسان است نیز Tm متفاوتی از خود نشان دادهاند.
یک فرمول ساده برای محاسبه Tm عبارت است از:
Tm = 4(G+C) + 2(A+T) °C
امروزه نرم افزارهای متعددی طراحی شدهاند که به طور دقیقتر Tm را محاسبه میکنند.
از آن جا که اختصاصیت فرایند PCR وابسته به اتصال دقیق آغازگر به الگو است، دمای اتصال آغازگر بر اساس دمای ذوب[22] آغازگرها (Tm) محاسبه میشود. دمای اتصال آغازگر معمولا °4-2 سلسیوس کمتر از دمای Tm است.
نمونه مورد آزمایش
نمونههایی که در فرایند PCR مورد آزمایش قرار میگیرد شامل DNA تک رشتهای و دو رشتهای جانوران، باکتریها، گیاهان و ویروسها است. انواع mRNA، tRNA، rRNA و RNA ویروسی نیز بعد از تبدیل شدن به cDNA[23] توسط آنزیم رونویس معکوس[24] میتوانند در فرایند PCR بهکار روند.
میزان نمونه لازم برای انجام PCR میتواند بسیار کم و در حد یک مولکول باشد. برای انجام PCR در شرایط معمول، اگر نمونه شامل DNA همسانهسازی شده باشد در حد نانوگرم و اگر DNA ژنومیک باشد در حد میکروگرم کافی است. بهطور کلی تعداد 105 مولکول از نمونه هدف باید به محلول واکنش افزوده شود.
نمونه DNA که برای انجام PCR بهکار میرود نیازی به خلوص بالا ندارد. تک سلول، لیز سلولی و یا حتی نمونه کوچکی از DNA تخریبشده نیز میتواند به عنوان الگو برای PCR بهکار رود. برای انجام PCR، خلوص نمونه باید در حدی باشد که حداقل یک مولکول DNA حاوی توالی هدف سالم و یکپارچه در نمونه وجود داشته و ناخالصیهای همراه نمونه رقیق شده و مانع فعالیت آنزیم پلیمراز نشوند، البته در بعضی از مواقع از جمله در انجام Long PCR کیفیت و کمّیت نمونه باید بالاتر باشد. اگر مقدار نمونه زیاد باشد میتواند موجب آلودگی نمونهها با هم و یا با محصولات PCR قبلی شده و مثبت کاذب پدید آید.
در مواقعی که نمونه الگو کم باشد، حساسیت و کارآیی واکنش کم شده و جواب منفی کاذب خواهد بود. اگر کیفیت نمونه پایین و مقدار DNA خوردشده زیاد باشد، تعیین میزان دقیق DNA الگو در واکنش مشکل خواهد شد.
کوفاکتورهای فلزی
کلرید منیزیم یک کوفاکتور اصلی برای آنزیم پلیمراز است و مقدار مناسب آن برای هر سیستم آغازگر- الگو باید محاسبه شود. بسیاری از اجزای PCR از قبیل آغازگر، الگو، محصول PCR و dNTP به یون منیزیم متصل میشوند. مهمترین جزء PCR که به صورت 1:1 به یون منیزیم متصل میشود dNTP است. از آن جا که یون منیزیم به عنوان کوفاکتور پلیمراز ضروری است، بنابراین میزان منیزیم باید بیشتر از dNTP باشد. برای شروع PCR به طور معمول mM1/5 از یون منیزیم را در حضورmM 0/8 dNTP به واکنش اضافه میکنیم. در این شرایط حدود mM0/7 از منیزیم برای پلیمراز باقی خواهد ماند. برای بهینه سازی شرایط PCR، غلظت منیزیم را در 6 واکنش مجزا، از 1/5 تا mM4 تغییر داده تا بهترین غلظت تعیین شود.
سوبسترا
آنزیم DNA پلیمراز dNTP را با کارآیی بالا درون رشته در حال ساخت قرار میدهد، همچنین این آنزیم میتواند همراه با dNTP، از سوبسترای تغییریافته نیز استفاده کند.
Digoxigenin-dUTP، biotin-11-dUTP، dUTP، c7deaza-dGTP و dNTP نشاندارشده با فلورسنت میتوانند به عنوان سوبسترای آنزیم پلیمراز مورد استفاده قرار گیرند. در PCR معمولی نسبت هر کدام از dNTPها یکسان در نظر گرفته شده و mM200 از هر کدام به واکنش اضافه میشود، اما در بعضی شرایط انحراف از این حالت استاندارد میتواند مفید واقع شود، به عنوان مثال در مواقعی که هدف از PCR جهشزایی تصادفی[25] است، بر هم زدن این نسبت، الحاق بازهای اشتباه[26] به درون رشتههای در حال ساخت را تشدید میکند.
بافر و نمکها
غلظت مناسب بافر، نمک و pH بافر بستگی به آنزیم پلیمراز مورد استفاده در PCR دارد. بافر مورد استفاده برای DNA پلیمراز Taq حاوی mM50 کلرید پتاسیم (KCl) و mM 10 از Tris-HCl بوده و pH آن در دمای اتاق 8/3 است. این بافر قدرت یونی و ظرفیت بافری لازم برای واکنش را فراهم میسازد. غلظت نمک بر روی Tm دو رشته آغازگر- الگو و در نتیجه دمای اتصال آغازگر مؤثر است.
مواد دیگر
ترکیبات متعددی همراه با محلول PCR بهکار میروند که تحت عنوان Cosolvent شناخته شده و موجب افزایش محصول، کارآیی واکنش و اختصاصیت PCR میشوند. اگرچه این مواد موجب بهبود شرایط واکنش میشوند، اما پیشبینی تأثیر مثبت یک ماده بر روی هر سیستم آغازگر- الگو تقریباً غیرممکن است؛ بنابراین تأثیر هر کدام از این مواد افزودنی بر روی هر سیستم آغازگر- الگو باید بهصورت تجربی بدست آید. تعدادی از این مواد در جدول زیر ذکر شدهاند.
جدول 2: برخی از Cosolventها که موجب افزایش محصول، کارآیی واکنش و اختصاصیت PCR میشوند
میکروتیوبهای PCR
PCR باید درون لولههایی انجام شود که برای حداقل میزان آنزیم و DNA طراحی شده و خصوصیات انتقال گرمایی مناسبی داشته باشند. معمولاً این لولهها از جنس پلیپروپیلن بوده و دارای دیواره نازک هستند. بهمنظور جلوگیری از تبخیر محلول واکنش میتوان روغن معدنی و موم بر روی نمونهها قرار داد. البته امروزه لولهها طوری طراحی شدهاند که مانع تبخیر محلول میشوند، همچنین درب دستگاههای ترموسیکلر موجود دمایی بالاتر از دمای واسرشتسازی (در حدود °105-100 سلسیوس) را ایجاد کرده که مانع تبخیر محلول درون لوله شود.
تعداد چرخههای PCR
تعداد چرخههای PCR با توجه به غلظت DNA اولیه تعیین میشود. اگر غلظت الگوی اولیه حدود 50 مولکول باشد، 45-40 چرخه و اگر غلظت آن105× 3 مولکول باشد 30-25 چرخه کافی است. این عدم تناسب به علت وجود پدیدهای تحت عنوان اثر پلاتو[27] است. در اثر این پدیده در مراحل انتهایی PCR، سرعت تکثیر و تولید محصول کاهش مییاید. این پدیده ممکن است به علت تخریب و از بین رفتن مواد (مثل آنزیم پلیمراز و dNTP)، اتمام مواد (مثل آغازگر و dNTP)، مهار واکنش توسط محصولات جانبی[28] (پیروفسفات)، رقابت برای مصرف مواد توسط محصولات غیر اختصاصی یا رقابت بین آغازگر و محصولات تجمعیافته برای اتصال به هدف[29] اتفاق بیفتد.
بايدها و نبايدها در PCR
1- هنگام تهيه محلول واكنش، نمونه كنترل مثبت را در آخر كار تهيه كنيد.
2- اعمال قبل و بعد از PCR، جدا از يكديگر انجام گيرند.
3- براي استفاده از هر ماده، از پيپت جداگانه و اختصاصي استفاده كنيد.
4- از پيپتهاي با قابليت اتوكلاو و يا از پيپتهاي يكبار مصرف استفاده كنيد.
5- مواد ذخيرهاي آزمايشگاه را تقسيم كرده و فريز كنيد و هرچند وقت صحت و سلامت آنها را كنترل نمایيد.
6- هنگام استفاده، هر لوله را ميكروفيوژ كنيد تا موادي كه به اطراف درب لوله چسبيدهاند، رسوب كنند.
7- حتماً كنترل منفي نيز در كنار نمونهها قرار دهيد.
8- براي انجام آزمايشهاي تأييدي از مواد فريز شده استفاده كنيد.
9- هميشه محصول PCR را خارج از محل آمادهسازي نمونه نگهداري كنيد.
10- هنگام كار با PCR product، مقداري از آن را جداگانه نگهداري كنيد.
انجام واكنش PCR
توجه: آزمايش بايد در محلي بدون رفت و آمد انجام گيرد. سمپلرهاي مورد استفاده نبايد براي كارهاي ديگر استفاده شوند. ظروف، لولهها و سر سمپلرها اتوكلاو شده و هنگام كار از دستكش استفاده شود.
مواد زير را داخل لوله مخصوص واكنش PCR بريزيد:
10 mMdNTP 0.5 μl (0.1 mM)
10x PCR buffer 5 μl
MgCl2 1.5 μl (1.5 mM)
Primer -1 20 pmmol
Primer -2 20 pmol
Taq DNA polymerase 0.25 μl (1.25 U)
Template DNA 0.1- 1 μg
dH2O up to 50μl
لولهها را داخل Block دستگاه ترموسايكلر قرار داده و دستگاه را روشن كنيد. مقدار 100μl روغن معدني روي محلول بريزيد تا از بخار شدن مواد ممانعت بهعمل آورد. لازم به ذكر است كه دستگاههاي ترموسايكلر جديد به صورت Heated lid ساخته شدهاند؛ يعني درب دستگاه كه روي لولههاي واكنش قرار ميگيرد، حدود 105 درجه سلسیوس گرم ميشود، در نتيجه بالاي لوله گرمتر از پايين آن است و از بخار شدن مواد داخل لوله جلوگيري ميشود. پس از اتمام كار چگونگي رديابي (detect) محصول PCR مطرح میشود. دو روش بدین منظور وجود دارد:
- دورگهگيري محصول PCR با اليگو نوكلئوتيد نشاندار (کاوشگر)
- الكتروفورز روي ژل آگاروز يا پلياكريلاميد
انواع PCR:
Hot start PCR:
دمایAnnealing تعیینکننده اختصاصیت PCR است. هر چه این دما کمتر باشد، اتصال آغازگر به توالیهای غیراختصاصی بیشتر است. هنگام تهیه محلول واکنش در دمای اتاق یا روی یخ، تمام مواد موردنیاز در لوله وجود دارد. پس در این دما آغازگرها بهراحتی اتصالات غیراختصاصی، آغازگر دایمر و حلقه[30] را تشکیل میدهند. آنزیم پلیمراز در این دما به میزان کمی فعال بوده و از روی هیبریدهای حاصل واکنش را کاتالیز میکند. آغازگری که بهطور اشتباه به نقاط غیراختصاصی متصل شده، در این شرایط طویل شده و توالی آن تغییر میکند. هنگامی که دما افزایش یابد، دیگر این آغازگر به جای توالی اختصاصی خود به توالی غیراختصاصی متصل میشود، زیرا ‘3 این آغازگر حاوی مکمل توالی غیراختصاصی است. بهمنظور جلوگیری از وقوع این مشکل، استراتژیهای مختلفی تحت عنوان Hot start توسعه یافته است. در این تکنیک يك يا چند تركيب مهم PCR (ترجيحاً آنزيم پليمراز) از محلول واکنش جدا شده و زمانی که دما افزایش یافت، به واکنش اضافه میشود. استراتژیهای زیر برای این جداسازی بهکار گرفته شده است:
- روش دستی
در روش دستی، یکی از اجزای کلیدی واکنش مثل پلیمراز یا کلرید منیزیم در محلول اولیه وجود ندارد و زمانی به واکنش اضافه میشود که دمای محلول به دمای Annealing رسیده باشد. از آن جا که در این روش دوباره درب لوله واکنش باز میشود، مقداری از محلول تبخیر شده، غلظت یونی تغییر میکند. همچنین احتمال آلودگی واکنش وجود دارد.
- روش انسداد فیزیکی1
ديواره لولههاي مخصوص اين كار به نوعي واكس آغشته است كه بعد از مختصري گرم كردن ذوب شده و روي واكنش را ميپوشاند. آنزيم پليمراز را روي واكس قرار ميدهند. در دماي 94 درجه اين واكس بخار ميشود و آنزيم پليمراز با واكنش تماس پيدا ميكند. این تکنیک تحت عنوان Hot start به كمك Ampliwax نیز شناخته می شود.
- به كمك آنتيبادي
منوكلونال آنتيبادي ضد آنزيم پليمراز را به واكنش اضافه ميكنند؛ درنتيجه فعاليت پليمرازي آنزيم مهار ميشود. هنگاميكه دماي واكنش به 94 درجه ميرسد، آنتيبادي واسرشت ميشود و دوباره پليمراز فعال ميگردد.
- پلیمراز تغییریافته2
در این روش آنزیم DNA پلیمراز را بهصورت شیمیایی تغییر دادهاند. این تغییر شیمیایی فعالیت پلیمرازی آنزیم را مهار میکند تا هنگامی که دما افزایش یابد. در این روش یک مرحله Pre-PCR وجود دارد تا این ممانعت شیمیایی رفع شود. در این مرحله محلول به مدت 10 دقیقه در دمای °95 سلسیوس قرار میگیرد؛ بنابراین محلول واکنش تا زمانی که به طور دقیق به دمای Annealing نرسیده است، هیچگونه واکنش پلیمرازی نخواهد داشت. اگر این مرحله Pre-PCR حذف شود، تغییر شیمیایی بهتدریج طی مراحل واسرشت سازی PCR از بین رفته و آنزیم کمکم فعال میشود. دراین صورت نهتنها PCR به صورت Hot start انجام میشود، بلکه اثر آزادسازی وابسته به زمان[31] آنزیم را نیز به همراه دارد. با پیشرفت واکنش، سوبسترای آنزیم (محصولات PCR که خود بهعنوان الگو استفاده میشود) بیشتر شده و نیاز به پلیمراز بیشتری هست. طبق این اثر، طی PCR، پلیمراز نیز رفتهرفته بیشتر شده و تعادل بین سوبسترا و آنزیم حفظ میشود.
- اولیگونوکلئوتید مهارکننده پلیمراز
در این تکنیک اولیگونوکلئوتیدهای دارای قابلیت اتصال به پلیمراز، به واکنش اضافه میشوند. این اولیگونوکلئوتید به پلیمراز متصل شده و آنزیم را در دمای محیط غیرفعال نگه میدارد. با افزایش دما، این مهارکننده از آنزیم جدا میشود. در این حالت آنزیم شروع به پلیمریزاسیون میکند.
Touch down PCR
در اين روش دماي اتصال آغازگر از دماي بالاتر از Tm شروع شده و بندرت كاهش مييابد و موجب كاهش محصول كاذب و آغازگر دايمر ميشود.
PCR آشیانهای یا داخلي[32]
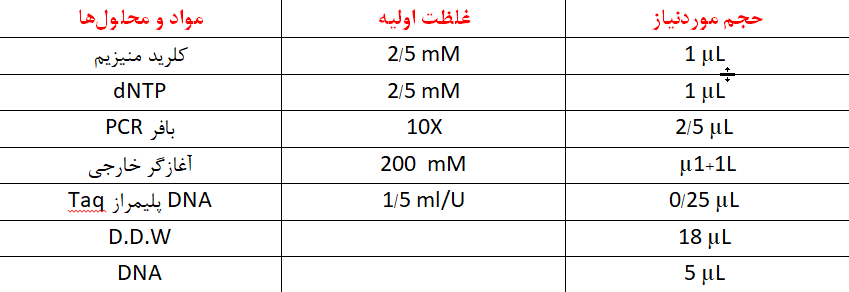
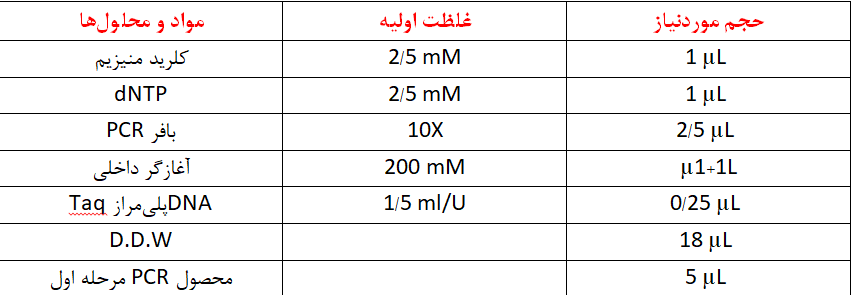
مواقعي كه DNA هدف در نمونه مورد آزمايش كم باشد، براي جلوگيري از بالابردن مقدار DNA و مهار واكنش، توسط آغازگرهاي خارجي، قطعه طويلتري همانندسازي ميشود و از محصول PCR اول يك واكنش ديگر با آغازگرهاي داخلي انجام ميگيرد. در اين روش اختصاصيت و حساسيت PCR بالا ميرود. این تکنیک يك روش سريع و قابل اطمينان براي تأييد محصول PCR است. در اين روش اغلب از دو آغازگر استفاده ميشود كه نسبت به محصول PCR اول، داخلي هستند. محصول PCR واكنش اول به عنوان الگو براي يك PCR دوم حاوي اين آغازگرهاي داخلي مورد استفاده قرار ميگيرد. اين واكنش دوم بايد محصول PCR كوچكتري درمقايسه با محصول اوليه ايجاد كند.
طبق محاسبات انجام شده، Nested PCR باعث افزايش حساسيت تشخيص محصول صحيح، به ميزان 410 برابر ميگردد. حتي اگر محصول PCR واكنش اول در بين پسزمينۀ محصولات غيراختصاصي محو شده باشد، با استفاده از آغازگرهاي PCR داخلی امكان تكثير مؤثر و اختصاصي را خواهد داشت؛ از طرف ديگر احتمال اين كه محصولات PCR غيراختصاصي، توالي مشابه آغازگر داخلي را داشته باشند، بسيار كم است و به همين دليل معمولاً بعد از Nested PCR نبايد محصولات غيراختصاصي وجود داشته باشد. حتي اگر طراحي دو آغازگر داخلي، به دليل عدم دسترسي به توالي كامل ممكن نباشد؛ مثلاً هنگامي كه توالي پپتيدي محدودي در دست است، باز هم استفاده از اين روش امكانپذير است. يك آغازگر داخلي جديد را ميتوان همراه با يكي از آغازگرهاي اوليه استفاده كرد و همچنين استفاده از توالي همان آغازگرهاي اوليه با افزودن فقط دو يا سه نوكلئوتيد به انتهاي ‘3 براي بالا بردن ويژگي در Nested PCR كافي است. در واقع انتهاي ‘3 آغازگر است كه در تعيين ويژگي واكنش PCR نقش اصلي را بهعهده دارد. در صورتي كه نوكلئوتيد انتهاي ‘3 با DNA جفت نشود، واكنش باعث تكثير اختصاصي توالي هدف و حذف محصولات غيراختصاصي خواهد شد. با اين كه آغازگرهاي داخلي همپوشاني قابلتوجهي با آغازگرهاي اوليه دارند، باز اين سطح از اختصاصيت بدست ميآيد، البته در اين حالت نبايد از آنزيمهاي پليمراز داراي فعاليت تصحيح اشتباه اگزونوكلئازي استفاده كرد تا انتهاي ‘3 تعيين كننده حفظ شود.
براي كاهش دستکاري و جلوگيري از مشكلات آلودگي هر دو واكنش PCR اوليه و Nested را ميتوان در يك لوله انجام داد. براي اين كار هر دو جفت آغازگر در آغاز واكنش افزوده ميشوند، ولي آغازگرهاي داخلي طوري طراحي شدهاند كه دماي ذوب پايينتري نسبت به جفت آغازگر اوليه دارند. اين كار اجازه ميدهد كه تكثير توالي هدف اوليه در دماي اتصال بالاتري نسبت به آغازگرهاي داخلي صورت گيرد، سپس يك برنامۀ PCR دوم اجرا ميشود كه دماي اتصال پايينتري دارد و اجازه ميدهد كه جفت آغازگر داخلي، محصول PCR اختصاصي را از روي محصول اوليه تكثير نمايند. محصولات PCR را ميتوان بر روي ژل آگارز بررسي كرد و در واقع بايد محصولات تكثير اوليه به همراه قطعه كوچكتر تكثيرشده در Nested PCR مشاهده شوند. بهتر است كه از محصول PCR اول براي آزمايشات بعدي استفاده نشود، زيرا بالا بردن تعداد چرخههاي PCR احتمال وقوع جهشهاي ناشي از PCR را افزايش ميدهد.
يك مشكل اصلي بالقوه در هنگام تأييد صحت محصولات PCR اوليه با استفاده از Nested PCR وجود DNA الگوي اوليه است. اگرچه محصول اوليه غيراختصاصي است، ولي مقدار الگوي اوليه باید به حدي باشد كه امكان تكثير مستقيم توسط آغازگرهاي داخلي فراهم باشد. نتيجه مثبت ممكن است باعث اين اشتباه شود كه محصول PCR اوليه در واقع همانند توالي صحيح هدف است. براي جلوگيري از هرگونه تكثير از روي DNA الگوي اوليه محصول PCR اول را ميتوان رقيق كرد. بهطوريكه مقدار كل الگوي اوليه در PCR دوم قابل اغماض باشد. در مواردي كه يك محصول PCR اوليه مشخص وجود دارد، راه مطمئنتر، خالصسازي فيزيكي محصول PCR از DNA الگوي اوليه است. براي مثال ميتوان از الكتروفورز روي ژل آگارز و خالصسازي از ژل استفاده كرد.
در هر واكنش PCR قرار دادن كنترلهاي مناسب اهميت فوقالعاده دارد تا دقت و ويژگي PCR قابل اطمينان باشد. در Nested PCR به دليل افزايش حساسيت، وجود كنترلها اهميت بيشتري دارد، زيرا هرگونه آلودگي جزئي نيز تكثير خواهد شد. انجام واكنشهاي تكآغازگري براي اطمينان از ويژگي آغازگرها و همچنين كنترلهاي بدون DNA و بدون آغازگر ضروري است. به طور خلاصه Nested PCR يك روش حساس و سريع براي تأييد واكنشهاي تكثيري PCR است، با وجود اين اگر دادههاي لكهگذاري ساترن همراه با هضم به كمك آنزيمهاي محدودالاثر در شرايط اتصال سخت[33] بهدست آمده باشد، روش گوياتري براي تأييد صحت محصول است. بعضي از روشهاي تركيبي ممكن است در موارد خاص موردنياز باشد، البته بهترین روش تأييد صحت محصول PCR تعيين توالي DNA است كه اين روش در صورت كم بودن تعداد نمونهها ميتواند حتي سريعتر از لكهگذاري ساترن نيز باشد.
روش انجام كار:
مواد موردنياز اين مرحله را به صورت زير آماده كنيد:
- مواد مورد نياز را از فريزر 20- بيرون آورده و بر روي يخ قرار دهيد تاذوب شود.
- مواد را طبق جدول فوق آماده كنيد. دقت كنيد كه حجم نهايي هر واكنش 25 ميكروليتر باشد.
- در نمونه كنترل منفي به جاي DNA آب مقطر اضافه كنيد.
- يك قطره روغن معدني مخصوص PCR اضافه نماييد تا از تبخير محلول طي واكنش جلوگيري شود.
نمونهها را در دستگاه قرار داده و برنامۀ PCR را به صورت زير تنظيم كنيد:
- واسرشت سازي اوليه در دماي ْ94 به مدت 2 دقيقه
- واسرشت سازي در دماي ْ94 به مدت 1 دقيقه
- اتصال آغازگر در دماي ْ57 به مدت 1/5 دقيقه
- طويلسازي به مدت 1 دقيقه در دماي ْ72 سانتيگراد
- تكرار اين سه مرحله به مدت 30 چرخه
- طويلسازي نهايي در دماي ْ72 به مدت 5 دقيقه
بعد از اتمام مرحله اول PCR از محصول بهدستآمده جهت مرحله دوم PCR استفاده كرده و به صورت زير عمل كنيد:
مواد مورد نياز اين مرحله را به صورت زير آماده كنيد:
پس از مخلوط كردن محلولهاي فوق، يك قطره روغن معدني به ميكروتيوب اضافه كرده و در دستگاه ترموسيكلر قرار دهيد. دستگاه را طبق برنامۀ زير تنظيم كنيد:
- واسرشتسازي اوليه در دماي ْ94 به مدت 2 دقيقه
- واسرشتسازي در دماي ْ94 به مدت 1 دقيقه
- اتصال آغازگر در دماي ْ58 به مدت 1 دقيقه
- طويلسازي به مدت 1 دقيقه در دماي ْ72 سلسیوس
- تكرار اين سه مرحله به مدت 30 چرخه
- طويلسازي نهايي در دماي ْ72 به مدت 10 دقيقه
Long distance PCR
با اين روش قطعات ببيش از 20 kb همانندسازي ميشوند. براي انجام اين نوع PCR بايد DNA ژنومي از كيفيت بالايي برخوردار باشد و آغازگرها بهدقت طراحي شوند، بدين منظور از کلنو Taq استفاده ميشود. اين آنزيم نسخهاي از DNA پليمراز است كه قسمت N ترمينال آن حذف شده است و باpfu پليمراز به نسبت 180 به 1 مخلوط ميشود و فاقد فعاليت ‘5 اگزو نوكلئازي است.
Reverse Transcriptase PCR (RT- PCR)
تعدادي از آنزيمهاي پليمراز به جايDNA ازRNA بعنوان سوبسترا استفاده كرده و از روي RNA يك رشته DNA سنتز ميكنند. رشته جديد سنتزشده، cDNA ناميــده شده و به واكنش، نسخهبرداري معكوس Reverse transcription)) گفته ميشود. آنزيمهايي كه از RNA بعنوان سوبسترا استفاده ميكنند، بهReverse transcriptase معروف هستند.
آنزيم Tth كه از باكتري ترموس ترموفيلوس بهدست ميآيد، در حضور يون منگنز فعاليت رونویسی معکوس و در حضور يون منيزيم، فعاليتDNA پليمرازي دارد. آنزيم AMV كه از يك نوع ويـروس پرندگان به نام Avian Myeloblastosis Virus transcriptase استخراج ميگردد، فعاليت RNase H هم دارد. دماي مطلوب براي فعاليت اين آنزيم 42 درجه سلسیوس بوده و براي تهيه cDNA با طول كمتر از 500 b استفاده ميگردد. آنزيم MMLV ازيك نوع ويروس جوندگان به نامMouse Molony Leukemia Virus استخراج شده و فعاليت RNase H آن كمتر از آنزيم قبلي است. اين آنزيم در 37 درجه سلسیوس فعاليت ميكند. آنزيم Superscript، آنزيم MMLV مهندسيشده است كه ژن قسمت حاوي فعاليت RNAse H را از آن حذف كردهاند و براي تهيه cDNA بزرگ استفاده ميگردد.
روش انجام RT-PCR:
1- مقدار 10 ميكروليتر از محلول حاويRNA را براي انجام RT-PCR استفاده كنيد.
RNA 10 μl
RT buffer 4 μl
RT enzyme 0.5 μl
RNasine 0.3 μl
dNTP 1 μl
Primer (1&2) 20 pmol
DEPC water up to 20 μl
قبل از اضافه كردن RNA، به مدت 10 دقيقه RNA را در 70 درجه قرار دهيد تا از تشكيل حلقه جلوگيري شود. محلول واكنش را يك ساعت در 42 درجه و سپس 5 دقيقه در 94 درجه سانتيگراد قرار دهيد تاRT غيرفعال شده و آنزيم پليمراز را مهار نكند، سپس به هر لوله مقدار 0.25 μl آنزيم پليمراز اضافه كنيد و با برنامه زير واكنش را براي 30 چرخه ادامه دهيد:
Denaturation 94o 30 sec
Annealing 55o 30 sec
Extension 72o 30 sec
PCR با آغازگرهاي احتمالي[34]
اين آغازگرها بر اساس اطلاعات حاصل از توالي آمينو اسيدي پروتئين يك ژن طراحي ميشوند. از آنجا كه بعضي از اسيدآمينهها بيش از يك كدون دارند، بنابراين چندين آغازگر متفاوت براي يك ناحيه از ژن طراحي و ساخته ميشود. اين نوع PCR در مواردي انجام ميشود كه توالي ژن مورد نظر در دسترس نيست ولي توالي پروتئين آن ژن شناسايي شده است.
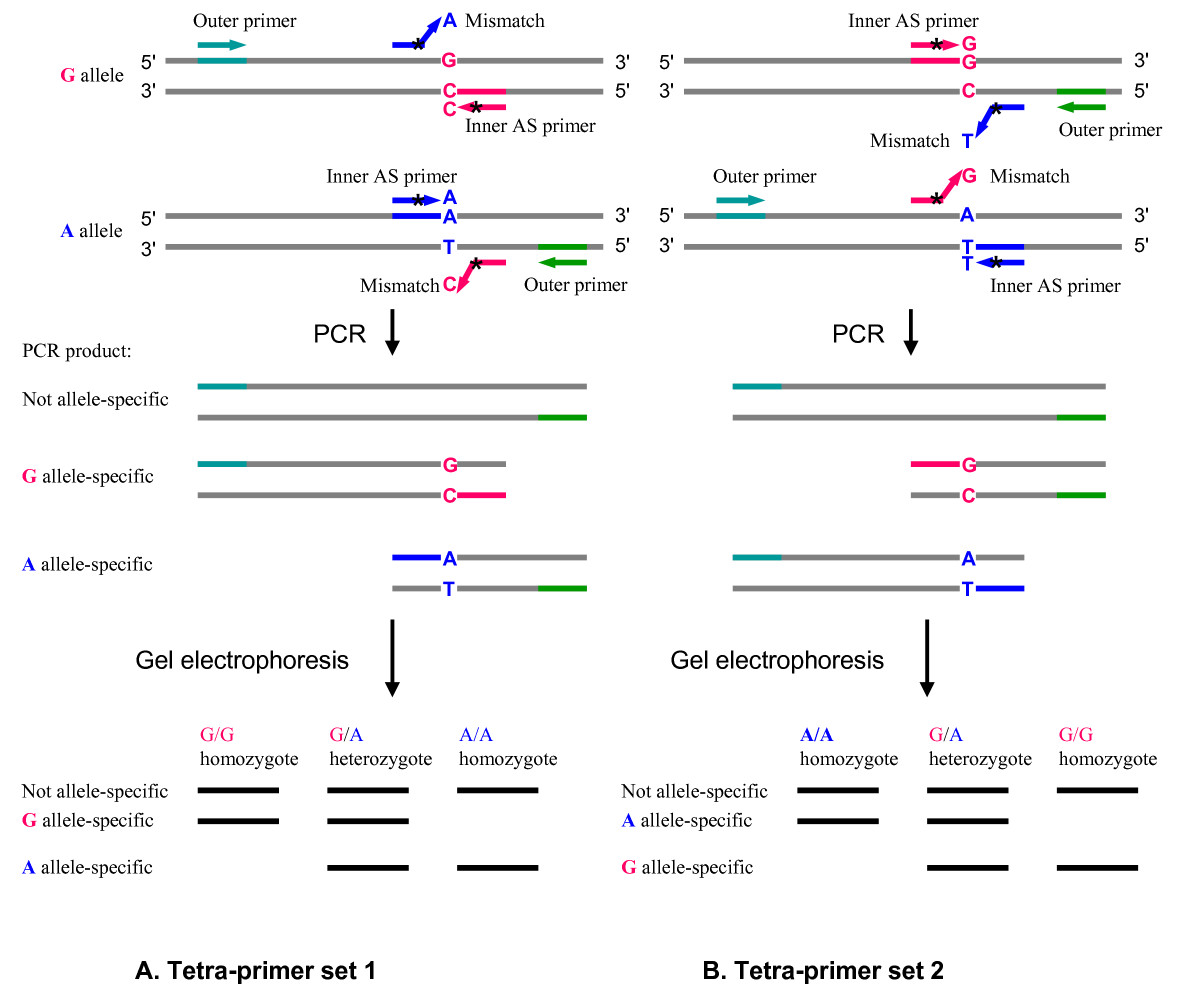
ARMS- PCR
روشARMS روش سريعي براي تعيين جهشهاي نقطهاي و حذف و اضافهها است. اين روش اولين بار توسط Newton وGroham در سال 1994 براي آناليز بازهاي متفاوت در والدين دچار كمبود آنتيترپيسين و همچنين براي تشخيص والدين ناقل بيماري سيستيك فيبروزيس و بتا تالاسمي بهكار گرفته شد.
اين تكنيك بر اساس طراحي آغازگرهاي اختصاصي آللها در PCR است. براي تشخيص يك جهش ويژه، دو آغازگر كنترل در نزديكي محل موتاسيون براي اطمينان از عمل صحيح PCR طراحي ميشوند. براي تكثير منطقه حاوي جهش نيز يك آغازگر مشترك براي آلل موتانت و وحشي طراحي ميگردد. دو آغازگر باقيمانده همان آغازگرهاي ARMS است كه باز′3 آنها به ترتيب مكمل توالي آلل موتانت و آلل وحشي هستند. چنانچه آغازگر ARMS داراي ′3 مكمل DNA الگو بود، همراه با آغازگر مشترك قطعه ما بين دو آغازگر تكثير ميگردد و در روي ژل دو باند مشاهده ميشود.
اگر آغازگر ARMS داراي′3 مكمل DNA الگو نبود، فقط يك باند در روي ژل كه حاصل تكثير منطقه بين دو آغازگر كنترل است، مشاهده ميگردد، زيرا انتهاي′3 ناجور جفتشدگي دارد و باعث جلوگيري از عمل پليمراز به جهت دور شدن ′3 آغازگر از DNA ميشود.
شکل 3: شکل شماتیک ARMS-PCR
جهش R (G/A) در این قطعه فرضی مورد بررسی قرار گرفته است. در این واکنش یک جفت آغازگر داخلی اختصاصی آلل و یک جفت آغازگر خارجی استاندارد بهکار میرود. پس از اتمام واکنش، دو نوع محصول شامل آلل A و آلل G بوجود خواهد آمد. بهمنظور افزایش اختصاصیت واکنش، یک باز ناجور در موقعیت سوم آغازگر (از سمت ‘3) قرار میگیرد که در این شکل با علامت * نشان داده شده است. آغازگرهای خارجی موجب میشوند تا محصولات واکنش بر حسب نوع آلل، از لحاظ اندازه متفاوت بوده و با الکتروفورز آگارز قابل تمیز باشند.
واکنش زنجیرهای پلیمراز معکوس
واکنش زنجیرهای پلیمراز معکوس[35] نوعی از PCR است که در آن فقط از یک توالی شناختهشده برای تکثیر DNA استفاده میشود. یکی از محدودیتهای PCR معمولی این است که در آن از دو آغازگر به عنوان مکمل دو انتهای توالی مدنظر استفاده میشود، اما در این تکنیک از یک آغازگر به عنوان مکمل یک انتهای توالی هدف استفاده میگردد. PCR معکوس بهخصوص برای تعیین محل یک قطعه DNA کاربرد دارد؛ به عنوان نمونه، رتروویروس و ترانسپوزونها به طور تصادفی درون هر نقطه از ژنوم انسان قرار میگیرند. بدین منظور با استفاده از توالی شناختهشده رتروویروس یا ترانسپوزون، یک آغازگر طراحی شده و پس از انجام واکنش PCR بخش کوچکی از DNA ژنومی نیز تکثیر میشود. در ادامه این قطعه کوچک جدا شده و توالی آن تعیین میشود. نتایج حاصل از تعیین توالی با بانکهای مربوط به توالی ژنوم انسان مقایسه شده و محل الحاق این عناصر مشخص میشود. این تکنیک حاوی مراحل برش آنزیمی با آنزیمهای محدودگر و اتصال با لیگاز است. نتیجه این مراحل ایجاد قطعه حلقوی حاوی توالی شناختهشده است که از توالی میتوان به عنوان مکمل آغازگر و شروع PCR استفاده نمود.
این مراحل به صورت زیر انجام میپذیرد:
ابتدا DNA ژنومی را با استفاده از آنزیمهای محدودگر با فراوانی محل شناسایی پایین تا متوسط هضم نمایید. نتیجه این امر ایجاد قطعات چند کیلوبازی است. در ادامه غلظت پایینی از DNA هضمشده را در شرایطی قرار دهید تا این قطعات به صورت DNA حلقوی درآیند (self-ligation). حال از آنجا که این محصول حلقوی است، با یک آغازگر نیز میتوان آن را تکثیر نمود.
[1] Polymerase Chain Reaction (PCR)
[2] primer
[3] Amplify
[4] dsDNA
[5] Klenow
[6] deoxynucleoside triphosphates
[7] Denaturation
[8] Annealing
[9] Extension
[10] Melting temperature,
[11] Reannealing
[12] Uracil-N glycosylase
[13] Thermal stability
[14] Overhang
[15] Vector
[16] Fork-like structure-dependent
[17] Proofreading activity
[18] Hairpin
[19] Allele-specific PCR
[20] Mismatch
[21] Randomly amplified polymorphic DNA
[22] Melting temperature
[23] Complementary DNA
[24] Reverse transcriptase
[25] Random mutagenesis
[26] Misincorporations
[27] Plateau effect
[28] End-product inhibition
[29] Reannealing
[30] Loop
[31] Time release effect
[32] Nested PCR
[33] High stringency
[34] Degeneracy primer
[35] Inverse PCR
روشهای عملی در Time PCR – Real (قسمت 5)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام