نيتريك اكسيد و اهميت آن در برخي از بيماريها
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفي: کارشناس ارشد ميكروب شناسي، دانشگاه علوم پزشكي جندي شاپور اهواز
چكيده:
نيتريك اكسيد يكي از مهمترين ملكولهاي سيگنالي است كه در بسياري از بافتها، طيف وسيعي از پروسههاي فيزيولوژيكي و سلولي را تنظيم مينمايد. NO يكي از مهمترين ملكولهايي است كه بخاطر نقشهاي متعدد آن و به اميد طراحي داروهايي به منظور كمك در درمان برخي بيماريها مورد مطالعه قرار گرفته است. روشن شده است كه NO در پروسههاي بيولوژيكي مختلفي از قبيل هدايت عصبي، دفاع ايمني، تنظيم مرگ سلولي و حركت سلولي نقش دارد. نيتريك اكسيد قادر است به سرعت از طريق انتشار از غشاي سلولي بگذرد و بسته به شرايط، صدها ميكرون را طي نمايد.
اثرات بيولوژيكي نيتريك اكسيد از طريق واكنش نيتريك اكسيد با شماري از تارگتها از قبيل گروههاي هِم، ريشههاي سيستئين و خوشههاي آهن و روي صورت ميگيرد. اين طيف وسيع تارگتهاي NO به نقشهاي وسيعي كه بازي مينمايد كمك ميكنند. بنا به اهميت زياد NO، تنظيم غيرطبيعي آن، شماري از مكانيسمهاي بيولوژيكي را تحت تأثير قرار داده و ممكن است منجر به ايجاد بيماريهاي مختلفي گردد. در اين مقاله ما ابتدا به خلاصهاي از آنزيمهاي دخيل در سنتز NO و سپس به نقش آن در برخي بيماريهاي مختلف از قبيل افسردگي، تب، كليه، قلب و … ميپردازيم.
كلمات كليدي: نيتريك اكسيد، نيتريك اكسيد سنتاز
نيتريك اكسيد (NO):
نقش نيتريك اكسيد (NO) در ابتدا به وسیله گروههاي متعـــــددي كه در پی تشخیص عامل شل کننده (Vessel relaxation) و تنظیم کننده کشش عروق خون (Regulating vascular tone) بودند کشف گردید. این عامل، فاکتور مشتق شده از اندوتلیوم (Endothelium derived relaxing factor; EDRF) نامیده شد. EDRF کشف شده در واقع همان NO بود که در طی 10 سال گذشته منجر به انتشار بیش از 60000 مقاله در این زمینه گردید. نقش NO به عنوان یک پیامبر بیولوژیک در سال 1987 کشف گردید و در سال 1998، Robert F. Furchgott، Louis J. Ignarro و Ferid Murad کسب جایزه نوبل را به خود اختصاص دادند.


| Robert F. Furchgott | Louis J. Ignarro | Ferid Murad |
| 1/3of the prize | 1/3of the prize | 1/3of the prize |
| USA | USA | USA |
| SUNY Health Science Center Brooklyn, NY, USA |
University of California School of Medicine Los Angeles, CA, USA |
University of Texas Medical School at Houston Houston, TX, USA |
| b. 1916 | b. 1941 | b. 1936 |
نشان داده شده است كه نيتريك اكسيدموجب فعال شدن گوانيلات سيكلاز محلول شده و متعاقب آن موجب افزايش سطح cGMP در بافتهاي متعددي از جمله عضلات صاف عروق و سيستم عصبي مركزي (CNS) ميشود.
اهمیت NO در تنظیم هموستاز عروقی، هدایت عصبی، دفاع علیه عوامل عفونی، حرکت سلولی، عملکرد میوکارد، شوک عفونی، تنظیم عملکرد مدولای کلیه، بیماریهای ریوی، پروسههای تولید مثلی ماده، تنظيم دماي بدن و تب، عملکردهای مختلف سیستم تولید مثلی مرد و توانایی باروری اسپرم، تعادل نروترانسمیتر در گانگلیای پایه (Basal ganglia) و در پاتولوژی بیماری پارکینسون، عملکرد بازدارندگی غیرمستقیم بر آزاد شدن β- آندورفین، سوئیچینگ پرولیفراسیون به افتراق (Switch from proliferation to differentiation) در طی نوروژنز، عمل بازدارندگی بر تکثیر نروبلاست (Neuroblast) به صورت in vivo در سیستم عصبی مهرهداران و بیمهرگان، تنظیم ترشح شیر، عملکرد حافظه و مهار متابولیسم سلولهای تومور به خوبی اثبات شده است.
تاکنون NO از پلاکتهای انسانی، پانکراس و مغز گاو، مغز گوسفند، کلیه گوسفند، میتوکندریهای کبد موش صحرایی، استافیلوکوکوس آرئوس و گونههای نوکاردیا جداسازی و خالص سازی شده است.
نيتريك اكسيد سنتاز (NOS):
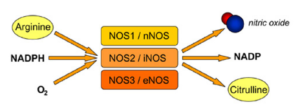
نيتريك اكسيد به وسيله گروهي از آنزيمها موسوم به NOSs از تبديل L– آرژينين به سيترولين ساخته ميشود. اين واكنش به كوفاكتورهايي از قبيل NADPH، FMN، FAD، تتراهيدروبيوپترين، كلسيم و كالمودولين نياز دارد.
سنتز NO
اكسيژن ملكولي نيز در اين واكنش از طريق تشكيل واسطه Nω-hydroxyarginine كه منجر به تشكيل L– سيترولين و NO ميشود، نقش دارد. NOSs آنزيمهاي همداري هستند كه داراي تشابه ساختاري با سيتوكروم P-450 ردوكتاز بوده و تنها پروتئينهاي شناخته شده در پستانداران ميباشند كه هر دو واكنش هيدروكسيلاسيون و احيا NADPH را انجام ميدهند.
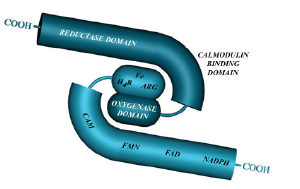
پروتئين عملكردي NOS داراي ساختمان دايمر بوده و از دو ساب يونيت يكسان تشكيل شده است. در هر ساب يونيت، 3 ناحيه مجزا وجود دارد كه شامل ناحيه ردوكتاز، ناحيه اتصال به كالمودولين و ناحيه اكسيژناز ميباشد.
ناحيه ردوكتاز:
اين ناحيه حاوي اجزاي FAD و FMN بوده و در انتقال الكترون از NADPH به ناحيه اكسيژناز نقش دارد. قابل ذكر است كه ناحيه ردوكتاز، الكترونها را به ناحيه اكسيژناز ساب يونيت مقابل از دايمر انتقال ميدهد و اين انتقال در ناحيه ساب يونيت خودي صورت نميگيرد.
ناحيه اتصال به كالمودولين:
اتصال كالمودولين براي فعاليت ايزوفرمهاي NOS ضروري ميباشد. كالمودولين، تغييرات داخل سلولي كلسيم را تشخيص ميدهد، اگرچه عملكرد دقيق آن در هر كدام از 3 ايزوفرم اندكي متفاوت است.
ناحيه اكسيژناز:
اين ناحيه داراي محلهايي براي اتصال تتراهيدروبيوپترين، هِم و آرژينين ميباشد. ناحيه اكسيژناز، واكنش تبديل آرژينين به سيترولين و NO را كاتاليز مينمايد.
ساختمان NOS
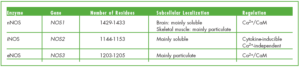
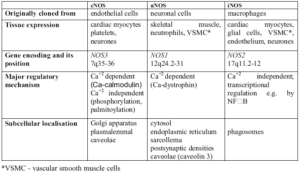
NOS داراي 2 فرم ساختماني و قابل القا و يا 3 ايزومر ميباشد كه بر اساس نوع بافتي كه نخستين بار از آن جدا شدهاند، نامگذاري شده است. فرمهاي ساختماني ابتدا در نرونها (nNOS) و اندوتليوم عروق (eNOS) يافت شدند و اكنون مشخص گرديده است كه در سلولها و بافتهاي مختلفي بيان ميشوند. NO توليد شده در نرونها به عنوان نروترانسميتر و NO توليد شده در عروق موجب القاء اتساع عروقي، مهار تجمع پلاكتي، تنظيم مرگ برنامه ريزي شده سلولي و … ميشود.
ايزومرهاي nNOS و eNOS وابسته به كلسيم و كالمودولين بوده و توليد مقدار اندكي NO مينمايند كه نقشهاي فيزيولوژيكي مختلفي را اعمال مينمايد. با اين وجود، در شرايط خاصي فعاليت اين دو ايزومر در پاسخ به تنظيم مثبت هورمونهاي جنسي افزايش نشان ميدهد. افزايش mRNA كد كننده اين دو ايزوفرم در رحم پس از درمان با استراديول، نشان دهنده قابل القا بودن آنها ميباشد. در برخي موارد مانند پاسخ به تحريكاتي از قبيل Shear stress، ايزوفرمهاي ساختماني مستقل از سطح كلسيم، توليد NO را افزايش ميدهند.
eNOS و nNOS از نظر وزن ملكولي با همديگر تفاوت دارند زيرا eNOS فاقد ناحيه 220 اسيد آمينهاي انتهاي آميني nNOS ميباشد. eNOS داراي وزن ملكولي 130 و nNOS داراي وزن ملكولي 160 كيلو دالتون ميباشد. eNOS داراي ناحيه N-myristoylation است كه در حضور اين ايزوفرم در غشا نقش دارد.
با القاء همانندسازي نشان دادهاند كه ايزوفرم ديگري از NOS وجود دارد كه به وسيله عوامل ايمونولوژيكي و التهابي القا شده و موجب افزايش آزاد شدن NO ميگردد. اين ايزوفرم كه iNOS ناميده شده و در ماكروفاژها يافت ميشود در فعاليتهاي Cytotoxic و Cytostatic ماكروفاژها عليه سلولهاي توموري و ميكروارگانيسمهاي مهاجم نقش دارد. اگرچه iNOS نيز وابسته به كلسيم و كالمودولين ميباشد اما از eNOS و nNOS متفاوت است، زيرا iNOS براي حداكثر فعاليت خود به مقدار بسيار كمي كلسيم نياز دارد و اتصال محكمتري با كالمودولين برقرار مينمايد.
توليد نيتريك اكسيد به وسيله iNOS از طريق نسخه برداري كنترل ميشود. در اغلب سلولها سطح پروتئين iNOS بسيار ناچيز يا غير قابل اندازهگيري است، با اين وجود تحريك اين سلولها با موادي از قبيل سيتوكاينها و فاكتورهاي رشد منجر به افزايش نسخهبرداري از ژن iNOS شده و در نتيجه توليد NO افزايش مييابد. اعتقاد بر اين بود كه iNOS تنها در شرايط پاتولوژيك القا ميشود اما اخيراً نشان داده شده است كه iNOS در تنظيمات فيزيولوژيك از قبيل تخمك گذاري، حاملگي و زايمان نيز نقش دارد.
ايزوفرمهاي مختلف NOS را گاهي با شماره گذاري نيز مشخص مينمايند. در اين سيستم nNOS را NOS1، iNOS را NOS2 و eNOS را NOS3 مينامند.
با استفاده از آنتيبادي عليه iNOS، eNOS و nNOS نشان داده شده است كه همه اين ايزوفرمها تقريباً در همه بافتهايي كه تاكنون مورد مطالعه قرار گرفتهاند وجود دارند.
NOSs تشابه اسيد آمينهاي 60 درصدي با هم دارند و توسط حداقل سه ژن مجزا كد ميگردند. در انسان، ژنهايي كه iNOS، eNOS و nNOS را كد ميكنند به ترتيب بر روي كروموزمهاي 17، 12و 7 قرار دارند.
ويژگيهاي ايزوفرمهاي مختلف NOS
بازدارندههاي اندوژنوس NOS:
سنتز NO میتواند به وسیله دو آنالوگ متیله آرژینین، دی متیل آرژینین نامتقــــــــــــارن (ADMA) و (L-NMMA) NG-monomethyl-L-arginine مهار شود. این مهار کنندههای اندوژنوس، مهار کننده رقابتی NOS میباشند. هر دوی این بازدارندهها در خون و ادرار انسان یافت میشوند. ADMA با غلظتی حدود 10 برابر بیشتر وجود دارد. غلظت داخل سلولی آن حدود 5 برابر بیشتر از غلظت خارج سلولی آن است. ADMA در گردش، در طی حاملگی طبیعی پایین میآید اما در پرهاکلامپسی افزایش مییابد. سطوح افزایش یافته ADMA در شرایطی از قبیل دیابت، آترو اسکلروز و نارسایی کلیوی مهم است. تجویز بازدارندههای NOS در موشهای صحرایی حامله منجر به حالاتی شبیه پرهاکلامپسی، شامل کاهش اندازه جفت و گردش خون جفت- رحمی (Utero-placental blood flow) میشود که هردوی آنها میتوانند با تجویز ال- آرژینین برگردانده شوند.
افزایش غلظت ADMA را در پیشگویی و ارزیابی کلینیکی پرهاکلامپسی مفید ارزیابی نمودهاند و نقش آن را در ایجاد شرایط پاتوفیزیولوژیک این بیماری دخیل دانستهاند. ADMA نیز همانند NO توسط سلولهای اندوتلیال ساخته و آزاد میشود. مقدار ADMA آزاد شده برای مهار تولید NO اندوژنوس کافی میباشد. بررسیهای اخیر نشان دادهاند که ADMA هم یک مارکر و هم یک مدیاتور قوی در سندرم عملکرد نامطلوب اندوتلیال (Endothelial dysfunction syndrome) نه تنها در بیماریهای قلبی عروقی و کلیوی بلکه در پرهاکلامپسی نیز ميباشد.
اثرات مفيد نيتريك اكسيد:
اثرات مفيد NO در تنظیم هموستاز عروقی، هدایت عصبی، دفاع علیه عوامل عفونی، حرکت سلولی، عملکرد میوکارد، شوک عفونی، تنظیم عملکرد مدولای کلیه، پروسههای تولید مثلی ماده، تنظيم دماي بدن و تب، عملکردهای مختلف سیستم تولید مثلی مرد و توانایی باروری اسپرم، تعادل نروترانسمیتر در گانگلیای پایه و در پاتولوژی بیماری پارکینسون، سوئیچینگ پرولیفراسیون به افتراق در طی نوروژنز، تنظیم ترشح شیر، عملکرد حافظه و مهار متابولیسم سلولهای تومور به خوبی اثبات شده است.
اثرات مضر نيتريك اكسيد:
علیرغم اثرات مفید NO در کشش عروقی، تعدیل دفاع ایمنی و هدایت عصبی، تولید بیش از حد NO به خاطر تولید گونههای نیتروژن فعال (Reactive nitrogen species; RNS) و نیتروزیلاسیون (Nitrosylation) پروتئینها، دارای اثرات سمی میباشد. غلظتهای پایین NO، بیان مولکولهای چسبندگی، سنتز سایتوکاین و کموکاین و چسبندگی گلبولهای سفید و مهاجرت آنها را مهار میکند. غلظتهای بالای NO دارای اثرات سمی بوده و زمینه التهاب را فراهم میآورند. از آنجایی که NO، دارای قدرت واکنشگری و نفوذ بسیار بالا میباشد کنترل آن باید به شدت تنظیم گردد.
استرس Nitrosative و نیتراسیون پروتئینها در اپیتلیوم مجاری هوایی ممکن است مسئول ایجاد مقاومت به استروئید در موارد آسم و در نتیجه غیر مؤثر بودن آن در بیمـــــــــــــــــاری انسدادی ریوی مزمن (Chronic obstructive pulmonary disease; COPD) باشد و استراتژیهای درمانی بیشتری برای کمک به تنظیم سنتز NO در بیماری آسم و COPD را میطلبد.
افزایش تولید NO در میوکارد، در پاتوفیزیولوژی عملکرد غیرطبیعی میوکارد در بیماریهای ایسکمی قلب دخیل میباشد. نقش RNSها در پاتوژنز عملکرد غیرطبیعی میوکارد پس از ایسکمی در بررسیهای زیادی مورد مطالعه قرار گرفته است.
نيتريك اكسيد و تب:
تب پديدهاي است كه منجر به افزايش دماي بدن ميگردد. بخوبي شناخته شده است كه تب ميتواند به وسيله شماري از عوامل از جمله ليپوپليساكاريد (LPS)، ويروسها، مخمر و باكتريهاي گرم مثبت آغاز شود. تلاشهاي زيادي به منظور شناخت مكانيسم تب انجام شده است و اعتقاد بر اين است كه تب ناشي از القاي سيتوكاينهايي از قبيل IL-1β ، IL-6 ، اينترفرون و فاكتور نكروز دهنده تومور (TNF) و متعاقب آن توليد پروستاگلاندينها (PGE2) در CNS بويژه پروستاگلاندين E2 كه تصور ميشود به عنوان واسطه پروگزيمال تب عمل مينمايد ميباشد.
عليرغم اين هنگامي كه يك پيروژن به حيواني تزريق ميشود، شماري از مكانيسمها كه NO در آنها نقش دارد فعال ميشوند.
بيشترين اطلاعات در مورد نقش NO در پاسخهاي تبي از طريق تعديل كنندههاي فارماكولوژيك مسير NO بدست آمدهاند. نشان داده شده است كه مهار كنندههاي NOS از قبيل L-NAME، موجب حذف و يا حداقل كاهش القاي تب به وسيله LPS، موراميل ديپپتيد (MDP) و مخمر در موش صحرايي و خوكچه هندي ميشوند.
نيتريك اكسيد و افسردگي:
اضطراب و افسردگي شايعترين بيماريهاي رواني هستند كه تا 25 درصد افراد جوامع را شامل ميشود. با اين وجود، مكانيسم حقيقي ايجاد افسردگي هنوز روشن نيست. شواهد زيادي بيانگر ارتباط بين استرس بويژه استرس مزمن و افسردگي هستند. مطالعات اخير حكايت از نقش NO در ايجاد رفتارهاي شبه افسردگي ناشي از استرس مزمن دارند. به نظر ميرسد كه ايزوفرم iNOS در مكانيسم ايجاد افسردگي نقش داشته باشد.
هيپوكامپ نقش مهمي در مكانيسم افسردگي بازي ميكند. نشان داده شده است كه استرس مزمن، اما نه استرس حاد، تأثيرات زيادي بر شيمي، مرفولوژي و عملكرد نرونها در هيپوكامپ بر جاي ميگذارد. با استفاده از تزريق بازدارندههاي iNOS از قبيل آمينوگوانيدين در داخل هيپوكامپ، تغييرات رفتاري شبه افسردگي را سركوب نمودهاند.
نيتريك اكسيد و عروق:
NO مشتق شده از اندوتلیوم عروق، یک فاکتور شل کننده عضلات صاف بوده و بنابراین یک واسطه مهم کشش عروقی به شمار میآید. تعدادی از عملکردهای پلاکت شامل اتصال (Adhesion) و تجمع (Aggregation) آنها به وسیله تولید NO توسط پلاکتها و سلولهای اندوتلیال کنترل میشود.
عملکرد نامطلوب اندوتلیال ناشی از کاهش NO، اولین مرحله در ایجاد بیماری آترواسکلروتیک عروقی (Atherosclerotic vascular disease) است. تولید NO میتواند به وسیله بازدارندههای اندوژنوس NOS از قبیل ADMA مهار شود. در حیوانات آزمایشگاهی، تجویز ADMA بطور بارزی تولید NO را کاهش داده و موجب افزایش فشار خون و مقاومت عروق کلیوی (Renal vascular resistance) میشود. در مطالعات کلینیکی، ارتباط قوی میان افزایش سطح ADMA خون و اختلال افزایش قطر عروق خونی وابسته به اندوتلیال (Impaired endothelial-dependent vasodilation) و اختلالات و مرگ و میرهای ناشی از بیماریهای قلبی عروقی در جمعیتهای مختلفی از جمله در بیماران کلیوی مشاهده شده است. به نظر میرسد ADMA مسئول اصلی و البته نه تنها دلیل بیوشیمیایی ایجاد آترواسکلروتیک باشد.
نيتريك اكسيد و كنترل هورموني:
NO نقش مهمی در کنترل هورمونی محور نوروآندوکرین بازی میکند که از میان آنها به جلوگیری از ترشح هورمون آزاد کننده هورمون رشد و تنظیم آزاد شدن هورمون جسم زرد (LH) میتوان اشاره نمود.
نيتريك اكسيد و آپوپتوز:
NO یک تنظیم کننده مهم آپوپتوزیس میباشد و حیات سلولهای CLL به تولید اتوکراین NO وابسته است. آپوپتوز سلولهای CLL به وسیله کاسپازهایی که آپوپتوز را تسریع میکنند و به وسیله فاکتورهایی از قبیل bcl-2 که آپوپتوز را مهار میکنند، تنظیم میشود. NO به حفظ سطح bcl-2 در محیط کشت سلولهای B طحال موش کمک کرده و از آپوپتوز خودبخودی آنها جلوگیری مینماید. NO همچنین توانایی اتصال به اکتیو سایت تعداد زیادی از اعضاء خانواده کاسپاز انسانی و مهار آنها را دارا میباشد.
علیرغم اثرات سمی NO درغلظتهای بالا، سطحی از آن که در بسیاری از کانسرهای انسانی تولید میشود، احتمالاً به تسهیل رشد تومور و انتشار آن کمک مینماید. بازدارندههای NOS موجب القاء آپوپتوز در CLL گردیده و برای آنها پتانسیل درمانی علیه این بیماری را قائل شدهاند.
اثر آپوپتوز به دوز NO و نوع سلولي كه به منظور القاي آپوپتوز يا محافظت از آپوپتوز بكار ميرود، دارد. نشان داده شده است كه NO قابليت مهار آپوپتوز در شماري از سلولها شامل سلولهاي لكوسيت، هپاتوسيت، تروفوبلاست و اندوتليال را دارد. اثر ضد آپوپتوزي NO ميتواند از طريق تعدادي مكانيسمها از قبيل نيترازيلاسيون و غير فعال كردن تعدادي از كاسپازها مثل كاسپاز 3، كاسپاز 1 و كاسپاز 8 رخ دهد. مكانيسمهاي ديگر شامل فعال كردن p53، تنظيم مثبت پروتئين شوك گرمايي (hsp70)، تنظيم مثبت Bcl-2 و Bcl-XL و فعال كردن cGMP كه منجر به فعال شدن پروتئين كينازهاي وابسته به cGMP و سركوب فعاليت كاسپاز ميشود، ميباشد.
اثر NO بر آپوپتوز اغلب به دو دسته وابسته به cGMP و مستقل از cGMP تقسيم بندي ميشود. NOقادر به فعال نمودن cGMP از طريق واكنش بين NO و گروه هِم گوانيلات سيكلاز ميباشد.
نيتريك اكسيد و باروري:
محصولات NO در گردش خون در طی رشد و تمایز فولیکول، افزایش و پس از تخمک گذاری کاهش مییابند. بازدارندههای NO منجر به کاهشی 50 درصدی در تخمک گذاری میشوند که با NO به طور کامل قابل برگشت میباشد. تولید کنندههای NO ممکن است برای تسریع باروری مفید باشند در حالیکه بازدارندههای NO ممکن است برای جلوگیری از بارداری به کار گرفته شوند.
سطح تستسترون موش صحرایی، با تجویز بازدارنده NOS افزایش و به وسیله عواملی که تولید NO را افزایش میدهند، کاهش پیدا میکند. NO در تحرك اسپرم، ظرفيت پذيري اسپرم، اتصال اسپرم به لايه ترشحي و شفاف تخمك، واكنش آكروزوم و ادغام اسپرم و تخمك نقش دارد. نشان داده شده است كه غلظت پايين تركيبات آزاد كننده NO مانند سديم نيتروپروسايد در تحرك و حيات اسپرمها پس از مايع شدن اسپرم نقش دارند. در حضور غلظت بالاي تركيبات آزاد كننده NO، مهار تحرك اسپرم مشاهده شده است كه احتمالاً از طريق مهار تنفس اسپرم روي ميدهد. مطالعه بر روي نمونههاي اسپرم از افراد مختلف نشان داده است كه ارتباطي معكوس بين غلظت NO و درصد سلولهاي متحرك وجود دارد كه بيانگر نقش غلظتهاي پايين NO در تحرك اسپرم ميباشد.
نيتريك اكسيد و التهاب:
NO نقشهاي تعديل كننده متعددي در التهاب دارد و در تنظيم پاسخهاي ايمني نقشي كليدي بازي مينمايد. NO در حقيقت در همه مراحل التهاب نقش دارد. غلظتهاي پايين NO توليد شده به وسيلهeNOS و nNOS، موجب مهار بيان ملكولهاي چسبندگي، سنتز سيتوكاين و كموكاين، اتصال لكوسيت و مهاجرت ميشوند. سنتز مقدار زياد NO كه عمدتاً توسط iNOS صورت ميگيرد سمي بوده و نقشهاي پيش التهابي بازي ميكند. در حالت عادي NO در تنظيم لنفوسيتهاي Th1 و Th2 در پاسخهاي ايمني و بيماريهاي آلرژيك بازي مينمايد. NO داراي اثر تنظيمي بر پاسخهاي ايمني از طريق مكانيسمهاي متعددي شامل سيستمهاي سيگنال سلولي از قبيل cGMP، G– پروتئين، JAK/STAT يا مسيرهاي انتقال سيگنال وابسته به MAPK ميباشد. NO همچنين ممكن است از طريق اصلاح فاكتورهاي نسخه برداري از طريق تعديل بيان واسطههاي التهاب در ايجاد التهاب نقش داشته باشد.
نيتريك اكسيدو حاملگي:
فقدان نيتريك اكسيددر طی حاملگی با افزایش فشار خون حاملگی و پرهاکلامپسی ارتباط داشته و دهندههای NO و بازدارندههای NOS ممکن است منجر به تهیه داروهایی جدید، مؤثر، ایمن و ارزان برای تنظیم و پیشبرد عملکردهای مختلف در دوره تولید مثلی جنس ماده گردد. ADMA موجود در گردش خون که به عنوان یک بازدارنده تولید NO مطرح میباشد، مقدارش در طی حاملگی طبیعی پایین آمده، اما در پرهاکلامپسی افزایش مییابد.
تجویز بازدارندههای NOS در موشهای صحرایی حامله منجر به حالاتی شبیه پرهاکلامپسی، شامل کاهش اندازه جفت و گردش خون جفت- رحمی میشود که هر دوي آنها میتوانند با تجویز ال- آرژینین برگردانده شوند. افزایش غلظت ADMA را در پیشگویی و ارزیابی کلینیکی پرهاکلامپسی (مسمومیت حاملگی) مفید ارزیابی نمودهاند و نقش آن را در ایجاد شرایط پاتوفیزیولوژیک این بیماری دخیل دانستهاند.
نيتريك اكسيد و بيماران همودياليزي:
سطوح پلاسمایی افزایش یافته NO در بیماران همودیالیزی بویژه در آنهایی که مستعد کاهش فشار خون در هنگام دیالیز میباشند، یافت شده است. تولید NO در طی همودیالیز افزایش مییابد. افزایش تولید NO در حين دیالیز و در فواصل بین جلسات دیالیز ممکن است منجر به انبساط عروق و در نتیجه کاهش فشار خون گردد. با تجویز بازدارندههای NO از قبیل متیلن بلو که اثرات متسع کننده NO را مهار میکنند، میتوان مانع از حملات کاهش فشار خون در هنگام دیالیزگردید.
مشاهده شده است که در طی دیالیز، تولید NO ممکن است افزایش شدیدی پیدا نماید. افزایش تولید NO در حین و بین جلسات دیالیز ممکن است منجر به انبساط شدید و سریع عروق و در نتیجه کاهش فشار خون گردد. در بیماران مستعد کاهش فشار خون، MB بطور کامل از کاهش فشار خون در طی دیالیز جلوگیری نموده و در طی روزهایی که دیالیز صورت نمیگیرد موجب افزایش فشار سیستولیک و دیاستولیک میگردد.
نيتريك اكسيدو قلب:
افزایش تولید NO در میوکارد، در پاتوفیزیولوژی عملکرد غیرطبیعی میوکارد و در بیماریهای ایسکمی قلب دخیل میباشد. نقش RNSها در پاتوژنز عملکرد غیرطبیعی میوکارد پس از ایسکمی در بررسیهای زیادی مورد مطالعه قرار گرفته است. به نظر میرســـــــد ADMA مسئول اصلی و البته نه تنها دلیل بیوشیمیایی ایجاد آترواسکلروتیک باشد.
NO و كليه:
NO داراي نقشهاي مهمي در كليه از جمله تنظيم هموديناميك كليه و گلومرول، تعديل فشار ناتريورز، مهار بازجذب توبولي سديم و تعديل فعاليت نرونهاي كليه ميباشد. اثر خالص NO در كليه، تسريع ناتريورز و ديورز ميباشد. NO نقش مهمي در تطبيق كليه با تغييرات دريافت نمك از طريق رژيم غذايي دارد. كاهش سنتز NO در پاسخ به دريافت مقدار نمك از طريق رژيم غذايي در پاتوژنز فشار خون نقش دارد.
بیماری مزمن کلیه و افزایش فشار خون به کاهش NO و عملکرد غیرطبیعی اندوتلیال نسبت داده شده است. در این موارد، افزایش غلظت ADMA، مشاهده شده است.
در حیوانات آزمایشگاهی تجویز ADMA منجر به کاهش تولید NO و در نتیجه افزایش فشار خون و مقاومت عروق کلیوی میشود. کاهش مقدار NO با پیشرفت بیماری کلیوی مرتبط است و افزایش سطح ADMA خون ممکن است در این پروسه مشارکت داشته باشد. مداخلاتی که بتوانند موجب کاهش سطح ADMA در بیماران کلیوی شوند، توانایی کاهش ضایعات آتروژنیک و جلوگیری از پیشرفت نارسایی کلیوی را خواهند داشت.
در حیوانات آزمایشگاهی تجویز ADMA بطور بارزی تولید NO را کاهش داده و موجب افزایش فشار خون و مقاومت عروق کلیوی میشود. در مطالعات کلینیکی، ارتباط قوی میان افزایش سطح ADMA خون و اختلال افزایش قطر عروق خونی وابسته به اندوتلیال و اختلالات و مرگ و میرهای ناشی از بیماریهای قلبی عروقی در جمعیتهای مختلفی از جمله در بیماران کلیوی مشاهده شده است.
نيتريك اكسيد و ريه:
استرس Nitrosative و نیتراسیون پروتئینها در اپیتلیوم مجاری هوایی ممکن است مسئول ایجاد مقاومت به استروئید در موارد آسم و در نتیجه غیر مؤثر بودن آن در COPD باشد و استراتژیهای درمانی بیشتری برای کمک به تنظیم سنتز NO در بیماری آسم و COPD را میطلبد.
NO و روده:
تولید NO در بیماری التهابی روده، در بافتهای انسان افزایش مییابد. شمار زیادی از بررسیها، بهبود بیماری التهابی روده متعاقب استفاده از بازدارندههای NOS را گزارش کردهاند. برخی بررسیها نیز تشدید علائم این بیماری متعاقب درمان با این بازدارندهها را گزارش نمودهاند.
NO و شبكيه چشم:
در بیماری انسداد وریدهای شبکیه (Retinal venous occlusive disease)، افزایش سطح پلاسمایی ADMA مشاهده شده است. استفاده از بازدارندهها و دهندههای NO در مراحل مختلف ایسکمی شبکیه، از ایجاد عروق جدید و پرولیفراسیون جلوگیری مینماید.
نيتريك اكسيد و آنمی داسی شکل:
سطوح افزایش یافته پلاسمایی ADMA در بیماران دارای آنمی داسی شکل یافت شده است. اين در حالي است كه سطح ADMA در طي كريزهاي Vaso-occlusive افزايش پيدا نميکند.
References:
1-Ghaffari MA and Rostami M. Lipid Peroxidation and Nitric Oxide Levels in Sperm Cells of Smoker Men and ITS Relation with Sperm Motility. J of Fertil and Infertil. 2012; 13(2): 87-81.
2-Kadkhodaei Elyaderani M., Rostami M., Pedram M., Keikhaie B. and Shane S. Plasma concentrations of nitric oxide and asymmetric dimethylarginine in sickle cell anemia patients. Biochem. Cell. Arch. 2010; 10(2): 281-279.
3-Rostami M. and Jorfi M. Nitric oxide and Malondialdehyde concentrations in preeclampsia. J Repod Infertil. 2010; 11(2): 105-112.
4-Kadkhodaei Elyaderani M., Malek Askar AM., Rostami M., Aberomand M. and Khirollah AR. Inhibitory effect of asymmetric dimethylarginine and NG-Monomethyl-L-arginine methyl seter on nitric oxide synthase activity. J of Gorgan University of Medical Sciences. 2013; 15: 84-92.
5- Kadkhodaei Elyaderani M, Rostami M, Keikhaie B, Pedram M. Correlation between Nitric oxide (NO) & Asymmetric dimethylargininie (ADMA) Hemoglobin. mljgoums. 2010; 4 (1) : 7-12.
6-Alexandre A.S. And Luiz G.S.B. Nitric oxide in the regulation of body temperature and fever. Journal of Thermal Biology. 2001; 26: 325-330.
7 – Berges A., Van Nassauw L., et al. Role of nitric oxide and oxidative stress in ischaemic myocardial injury and preconditioning. Acta Cardiol.2003; 58: 119-132.
8-Brennan P.A., Thomas G.J., et al. The role of nitric oxide in orale diseases. Arch Oral Biol. 2003; 48: 93-100.
9-Cowley A.W., Mori T., et al. Role of renal NO production in the regulation of medullary blood flow. Am J Physiol Regul Inter Comp Physiol. 2003; 284: 1355-1369.
10-Kharitonov S.A., Barnes P.J. Nitric oxide, nitrotyrosine, and nitric oxide modulators in asthma and chronic obstructive pulmonary disease. Curr Allergy Asthma Rep. 2003; 3: 121-129.
11-Maul H., Longo M., et al. Nitric oxide and its role during pregnancy: from ovulation to delivery. Curr Pharm Des. 2003; 9: 359-380.
12 – Gibbs S.M. Regulation of neuronal proliferation and differentiation by nitric oxide. Mol Neurobiol. 2003; 27: 107-120.
13 – Shukorski L., Tsafriri A. The involvement of nitric oxide in the ovulatory process in the rat. Endocrinology. 1994; 135: 2287-2290.
14- Guzic T.J., Korbut R., Adamek-Guzic T. Nitric oxide and superoxide in inflammation and immune regulation. Physiology and Pharmacology. 2003; 54: 469-487.
15– Bredt D.S. Nitric oxide signaling specificity- the heart of the problem. 2003; 116: 9-15.
https://www.healthline.com/nutrition/nitric-oxide-supplements
https://medlabnews.ir/microrna-%d9%88-%d8%b3%d8%b1%d8%b7%d8%a7%d9%86/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام