نقش Quorum sensing در باکتریها
(بخش اول)
لیلا دهاقین
فوق لیسانس بيماري شناسي گياهي – دانشآموخته دانشگاه تربيت مدرس
مقدمه
از زمان كشف زندگي پروكاريوتها تصور ميشد كه اين ارگانیسمهای ساده يك زندگي تکسلولی دارند و تنها هدف آنها تقسيم شدن و ايجاد تعداد بيشتري باكتري است. بر اساس نظريه رايج، اینگونه پذيرفته شده بود كه باکتریها موجودات منفردي هستند و بهصورت انفرادي به تحريكات خارجي پاسخ ميدهند. اين نظريه در سالهای اخير دچار تغييرات شديدي شده است.
در سالهای 1960 و 1970 مطالعات ژنتيكي و بيوشيميايي نشان دادند که در باکتریها «رفتارهای اجتماعي سازمان يافته» وجود دارد كه سیستمهای ارتباطي پیچیدهای را به خدمت ميگيرند. هدف اين رفتارها هماهنگ كردن فعالیتهای افراد در يك جمعيت است. اگرچه در ابتدا اين پديده نادر به نظر ميرسيد و شامل چندين مثال محدود بود، اما اكنون اين مسئله به این صورت مطرح ميشود كه دامنه وسيعي از میکروارگانیسمها توانايي درك كردن و پاسخ به جمعيت سلولي اطراف خود را دارند. براي توصيف چنين پديده وابسته به تراكم جمعيت واژه Quorum sensing بكار برده شد. اين واژه براي اولين بار در يك مقاله review توسط Fuqua و همكاران مورد استفاده قرار گرفت و اساساً منعکسکننده حداقل آستانه توده سلولهای منفرد براي شروع يك پاسخ دستهجمعی و هماهنگ ميباشد.
بيولومينسانس اولين فنوتيپ کشفشدهای است كه توسط quorum sensing كنترل ميشود
پدیده Q.S اولين بار در باكتري نورزاي دريازي بنام Vibrio fischeri توصيف شد. در سال 1970 سه محقق با نامهاي Hastings،Nealson و Kennethاز دانشگاه هاروارد مشاهده كردند كه اين باكتريها تا زماني كه تعدادشان به يك تراكم جمعيتي بالا نرسد، نور توليد نميكنند. بر اساس اين مشاهده آنها حدس زدند كه ويژگي نورزايي در V. fischeri احتمالاً بهوسیله مولکولهای پيامبري كه مابين سلولها منتقل ميشود، تنظيم ميگردد. آنها اين مولکولهای پيامبر را Autoinducer (AI) ناميدند. نامگذاری مذكور به اين مسئله اشاره داشت كه پدیده خودالقایی (Autoinduction) در پاسخ به مايع حاصل از محيط كشت باکتریها ايجاد ميشد. آنها نشان دادند كه اين مولکولها ميتوانند وارد سلولهای هدف شده و بيان ژنهای مسئول بيولومينسانس را فعال كنند.
شکل 1. پروسه بروز بيولومينسانس (•) در مقايسه با رشد باکتري ( Δ) در واحــــــــد زمان
(Gera and Srivastava, 2006)
- fischeri همزيست اختياري ماهیها و ماهیهاي مركب درياست. باكتري در دستگاه نوري اين جانوران دريازي زندگي، و نوري توليد ميكند كه جانور با كمك آن از شكارچيان فرار ميكند. در مقابل باكتري از ميزبان خود غذا و محل زندگي دريافت ميكند. البته اين باكتري توانايي زندگي به روش آزادزي را نيز دارد، اما فنوتيپ بيولومينسانس تنها در روش زندگي همزيستي ايجاد ميشود و در روش زندگي آزادزي ايجاد نمیگردد.
مطالعات بيشتر روي V. fischeri مشخص كرد كه اين باكتري خيلي سريع رشد كرده و وارد مرحله ايستايي ميشود، اما فنوتيپ لومينسانس تنها در حدود نيمه مرحله رشد لگاريتمي (زماني كه تراكم سلولي به 1010-1011 سلول در هر میلیلیتر ميرسد) به شكل ناگهاني افزايش مييابد (شکل 1). اين افزايش ناگهاني در بيولومينسانس به تنظيم رونويسي آنزيم لوسيفراز كه خود وابسته به يك آستانهای از تراكم سلولهاي باكتري است، نسبت داده ميشود.
اساس مولكولي تنظيم بيولومينسانس
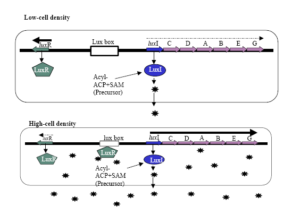
كلاستر ژني بيولومينسانس در V. fischeri از هشت ژن تشكيل شده است (luxA-E, luxR, luxI, luxG) كه در دو اپرون دو جهتي كه بهوسیله يك توالي bp218 از هم جدا شدهاند، آرايش يافته است (شکل 2). يك اپرون شامل ژن luxR است و اپرون ديگر شامل ژنهای luxG, luxE, luxB, luxA, luxD, luxC, luxI ميباشد كه بهوسیله كمپلكس پروتئيني AI/LuxR فعال ميشود. محصولات ژنهای luxR و luxI بهعنوان تنظیمکنندههای بيولومينسانس عمل ميكنند. ژن luxI مسئول سنتز AI (در اين مورد -oxo-hexanoyl homoserin lactone 3يا 3-oxo-C6-HSL) ميباشد و ژن luxR پروتئين تنظیمکننده رونويسي LuxR را كد ميكند. ژنهای luxA و luxB نيز زيرواحدهاي آنزيم لوسيفراز را كد ميكنند. آنزيم لوسيفراز اكسيداسيون يك آلدئید و يك منونوكلئوتيد فلاوين احياشده را كاتاليز ميكند كه محصولات اين واكنش يك اسيد چرب با زنجيره بلند، آب و منونوكلئوتيد فلاوين هستند. محصولات كدشده توسط ژنهای luxC,D,E يك كمپلكس چند آنزيمي تشكيل ميدهند كه سوبستراي آلدئیدی آنزيم لوسيفراز را ميسازند. ژن luxG يك آنزيم فلاوين ردوكتاز احتمالي را كد ميكند. شروع تحريك بيولومينسانس شامل يك كنش مابين AI و پروتئين تنظیمکننده رونويسي luxR است. سلولهای V. fischeri زماني كه تراكم سلولي پاييني دارند، ژن luxI را در يك سطح پايه بيان ميكنند. در نتيجه غلظت AIها در محيط پايين ميماند. همراه با افزايش تراكم جمعيت باكتريايي در درون جسم نوري، غلظت AIها نيز در محيط افزايش مييابد. زماني كه غلظت بحراني AIها فراهم شد، AIهاي منتشر شده به بيرون سلول، دوباره به داخل انتشار يافته و به پروتئين LuxR متصل ميشوند. بهمحض اتصال AI به دومين تنظيمي انتهاي آمين LuxR، تشكيل مولتيمرها توسط اين پروتئين تشديد شده و دومين انتهاي کربوکسيل آن رونويسي از هر دو اپرون lux را فعال ميكند.
شکل 2. سيستم Q.S LuxI/LuxR در Vibrio fischeri
شش ژن ساختاري لوسيفراز (lux CDABEG) و دو ژن تنظیمکنندهluxI و luxR براي كنترل بيولومينسانس در V. fischeri موردنیازند. ژنها در كنار هم قرار دارند ولي در دو جهت مختلف رونويسي میشوند. پروتئين LuxI مسئول سنتز AIهاي N-(3oxo hexanoyl)-homoserine lactone يا OHHL میباشد. در تراكم جمعيتي پائين، luxI و luxR در مقادير كم رونويسي شده و براي نورزايي، تجمع سیگنالهای OHHL جهت تحريك اپرون lux وابسته به luxR به رونويسي كافي نيست. زماني كه تراكم سلولي افزايش مییابد، غلظت AI نيز در داخل و خارج سلول بالا میرود و در يك غلظت بحراني از AI، پروتئینهای LuxR به AI متصل شده و اين كمپلكس به پروموتور lux متصل و رونويسي از اپرون فعال میشود. اين كار باعث رونويسي luxI و افزايش نمايي در توليد نور میگردد. كمپلكس LuxR-AI نیز به پروموتور luxR متصل ميشود، ولي از رونويسي luxR جلوگيري میکند (Gera and Srivastava, 2006).
بيان ژنهای كلاستر lux تحت تنظيمات شديد قرار دارد. بيان اپرون luxR بهوسیله دو پروتئين تنظیمکننده شامل LuxR و CAP تنظيم ميشود. در بين دو اپرون، يك توالي bp20 بنام lux box قرار دارد كه بهعنوان محل اتصال پروتئين LuxR عمل ميكند. تحريك رونويسي از اپرون luxICDABEG سطح mRNAاي را كه براي سنتز AI و بيولومينسانس لازم است، افزايش ميدهد. با افزايش غلظت مولکولهای AI، تعداد بيشتري از آنها به درون سلول منتشر شده و قادر خواهند بود تعداد بيشتري از پروتئینهای LuxR را فعال كنند، بنابراين پديده «خودالقایی»، ادامه يافتن جريان بيولومينسانس و توليد مولكول سيگنال AI را تضمين ميكند. البته كمپلكس AI/LuxR به پروموتور ژن luxR نيز متصل شده و رونويسي از اين ژن را مهار ميكند. اين تأثير منفي درواقع جبرانکننده عملكرد مثبت كمپلكس مذكور روي پروموتور luxICDABEG است.
معرفي عناصر كليدي در يك سيستم quorum sensing در باکتریهاي گرم منفي
۱- عناصر خودالقایی/ Autoinducerها
AIها معمولاً مولکولهای كوچكي هستند كه يا به شكل آزاد از غشاي سلول منتشر ميگردند و يا به شكل فعال از سلول به خارج منتقل ميشوند.
الف) آسيل هموسرين لاكتونها (AHL)
AHLها مهمترین گروه AIها در باکتریهاي گرم منفي هستند. آنها داراي يك حلقه هموسرين لاكتون حفاظتشده (HSL) با يك زنجيره جانبي آسيل متغير ميباشند. بر اساس طول گروههای آسيل، AHLها را ميتوان به دو گروه بزرگ مولکولهای با زنجيره كوتاه يا با زنجيره بلند طبقهبندی نمود. AHLهاي با زنجيره كوتاه داراي چهار تا هشت اتم كربن در گروه آسيل ميباشند، در حاليكه AHLهاي با زنجيره بلند داراي 10 تا 18 اتم كربن ميباشند. طول و درجه اشباع زنجيره آسيل همراه با حضور يا عدم حضور گروههای اكسو (oxo) يا هيدروكسيل در جايگاه كربن شماره 3 باعث ايجاد تنوع و اختصاصي شدن Q.S در يك جمعيت مخلوط باكتريايي ميشود.
طبق مطالعات، برخي از سویههای مختلف باكتريايي ميتوانند AHLهاي يكساني را تولید کنند با اين وجود، اين AHLها ممكن است در تنظيم فنوتيـــــــــــــــپهاي مختلف در هر سویه نقش داشته باشند. براي مثال، 3-oxo-C6-HSL باعث فعالسازی بيولومينسانس در V. fischeri و تنظيم توليد اگزو پليساكاريدها در Erwinia stewartii ميشود.
ب) Autoinducer- 2
AI-2 براي اولين بار بهعنوان يك سيگنال Q.S در Vibrio harveyi تشخيص داده شد. بعد از آن، اين مولکول سيگنال در بسياري از باکتریهاي گرم منفي مثل گونههای سالمونلا، اروينيا و اشريشيا كشف شد. از آنجا كه مولكول AI-2 توسط هر دو نوع باکتریهاي گرم منفي و گرم مثبت ساخته ميشود، اين مولكول بهعنوان يك مولكول سيگنال عمومي براي مكالمه بینگونهای توصيف شده است. سيگنال AI-2 در تنظيم بيولومينسانس در V. harveyi، تنظيم تيپ ترشحي III در V. harveyi و Vibrio parahaemolyticus و تنظيم فاكتور بیماریزایی در Shigella flexneri نقش دارد.
ج) ديپپتيدهاي حلقوي
اين نوع از Autoinducerها اخيراً در سویههای سودوموناس شناسایی شدهاند و به دليل تواناییشان در فعال كردن بيوسنسورهاي AHL، در گروه AIها قرار میگیرند. مطالعات ساختاري مشخص كرده است كه اين مولکولهای سيگنال جديد ديكتوپيپرازين (DKP) هستند. اگرچه DKP بيوسنسورهاي AHL را فعال ميكنند، اما براي اين كار بايد غلظت بيشتري از خود AHLها داشته باشند. اين مسئله ممكن است نشاندهنده نقش کمرنگ تركيبات DKP در محيط طبيعي باشد. برخي از DKPها نظير cyclo (L-Pro-L-Tyr) بهعنوان آنتاگونيستهايي عمل ميكنند كه با 3-oxo-C6-HSL (يك نوع AHL) بر سر LuxR رقابت كرده و ژنهای تنظيمشونده بهوسیله Q.S را مهار ميكنند. نكته قابلتوجه اين است كه DKPها در برخي از سویههای باكتريايي بهعنوان آنتاگونيست AHL و در برخي ديگر بهعنوان فعالکننده AHL عمل مینمایند. اين توانايي که DKPهاي يك سویه باكتريايي ميتوانند با شبكههاي Q.S باکتریهاي غيرمرتبط ارتباط برقرار كنند به پيچيدگي و تنوع زبان Q.S ميافزايد.
د) برادياكسیتين Bradyoxetin
در باكتري گرم منفی japonicum Bradyrhizobium، كه همزيست بسياري از بقولات بوده و تثبیتکننده نيتروژن میباشد، پيشنهاد شده است كه يك فاكتور وابسته به تراكم سلولي در تنظيم بيان ژنهای گرهزا نقش دارد. ژنهای گرهزا در تراكم بالاي جمعيت مهار ميشوند. اين كار از طريق حضور مولکولهای سيگنال كوچك و قابل انتشار كه در محيط كشت باکتریهای وحشي وجود دارد، انجام میگیرد. فاكتور مذكور برادياكسيتين نام دارد. علاوه بر AIهاي اشارهشده در اينجا، سیگنالهای ديگري نيز در باکتریهاي گرم منفي وجود دارند که عبارتند از AI-3 و فاكتور سيگنال قابل انتشار (DSF: diffusible signal factor). سیگنالهای مذکور میتوانند فنوتيپهاي تنظيمشونده توسط Q.S را تنظيم كنند.
۲- سنتتازهاي AI
الف) سنتتازهاي AHL
LuxI آنزيمي است كه مسئول سنتز AHLها در سيستم Q.S باكتري V. fischeri ميباشد. در باکتریهاي ديگر مثل گونههای ريزوبيوم و سودوموناس، ژنهای دخيل در توليد AHL سنتتازها همولوگ luxI هستند و محصولات اين ژنها داراي اسیدآمینههای حفاظتشده مشترك ميباشند كه براي فعاليت آنزیمها موردنیاز هستند. اين امر بيانگر آن است كه مكانيزم عملكرد تمامي همولوگهاي LuxI ميتواند شبيه يكديگر باشد. LuxI سنتتاز تشكيل باند آميدي مابین S. adenosyl methionine (SAM) و يك اسيد چرب متصل به پروتئين حامل آسيل را بهطور اختصاصي كاتاليز ميكند. همچنين سنتز آسيل هموسرين لاكتون از ماده حدواسط آسيل SAM را نيز كاتاليز مينمايد. ويژگي AHL سنتتاز براي يك طول زنجيره خاص متفاوت بوده و بستگي به سویه باكتري دارد، اين امر سبب ايجاد تنوع در اندازه AHLهاي ساختهشده توسط باکتریهاي مختلف شده و توجیهی براي توليد چندين نوع AHL بهوسیله يك باكتري است. چنين باکتریهايي معمولاً داراي چندين آنزيم سنتز كننده AHL هستند كه هرکدام از آنها مسئول توليد تعداد محدودي از AHLها ميباشند.
ب) سنتتازهاي ساير AIها
بدليل كشف AIهاي جديدي چون ديپپتيد حلقوي، AI3 و DSF انتظار ميرود كه علاوه بر سنتتازهاي اشاره شده، آنزیمهاي ديگري نيز وجود داشته باشند. از آنجا که آنزيمهاي تولیدکننده ديپپتيدهاي حلقوي تابحال شناسايي نشدهاند، لذا حدس زده ميشود كه اين تركيبات از حلقوي شدن غيرآنزيمي ديپپتيدهاي خطي در دما و pH بالا ايجاد ميشوند. آنزيم مسئول سنتز AI-3 هنوز توصيف نشده است، اما DSFهاي تولیدشده توسط باكتري Xanthomonas campestris وابسته به وجود ژنهای rpfB و rpfF ميباشد.
3- تنظیمکنندههای quorum sensing
الف) تنظیمکنندههای نوع LuxR
تنظيم ژن بهواسطه Q.S بهوسیله پروتئینهای تنظیمکننده رونويسي ميانجيگري ميشود كه بهدنبال اتصال مولکولهای AI فعال میشوند. LuxR پروتئين فعالکننده رونويسي در V. fischeri است. LuxR به AHL مربوطهاش يعني 3-oxo-C6-HSL متصل ميگردد. واكنش بين LuxR و 3-oxo-C6-HSL بسيار اختصاصي بهنظر ميرسد. دومين C ترمينال LuxR شامل يك موتيف Helix-Turn-Helix است كه با DNA از طريق جایگاه اختصاصي lux box واكنش ميدهد. lux box يك توالي تكراري معكوسشده bp20 در بالادست جايگاه شروع رونويسي از ژن هدف است. پروتئینهای نوع LuxR براي ايجاد Q.S وابسته به AHL، موردنیاز ميباشند. ساختار كريستال TraR كه همولوگ LuxR در Agrobacterium tumefaciens است نشان ميدهد كه AHL كاملاً درون پروتئين وارد ميشود. آناليز ساختار كريستال مشخص كرده است كه TraR به شكل دايمر بوده و هرکدام به دو مولكول 3-oxo-C8-HSL و يك قطعه DNA دو رشتهای متصل ميشوند. اتصال AHL، دايمرهاي TraR را پايدار كرده و از تجزيه شدن توسط پروتئازهاي سلولي محافظت ميكند.
ب) تنظیمکنندههای نوع LuxP/Q
سیستم Q.S از نوع AI-2 وابسته به فعاليت پروتئینهای نوع LuxP/Q است (شکل 3). LuxP يك گيرنده پريپلاسميك است كه به AI-2 متصل میشود. LuxP فعاليت حسگر كيناز LuxQ كه در غشاي دروني جاي گرفته است را تغيير میدهد و بنابراين سيگنال AI-2 را به سيتوپلاسم منتقل میکند. LuxQ يك حسگر كيناز است كه داراي دو جزء میباشد و از يك دومين حسگر پريپلاسميك و دومینهای تنظیمکننده پاسخ و هيستيدين كيناز سيتوپلاسمي تشكيل شده است. در تراكم پائين سلولي، LuxQ بهعنوان يك كيناز عمل میکند و اسیدآمینههای هيستيدين درون دومين هيستيدين كيناز را فسفريله میکند. در ادامه آبشار فسفوريلاسيون باعث فسفوريلاسيون LuxO میشود.Phospho-LuxO مسئول مهار كردن LuxR (فعالکننده رونويسي براي ژنهای لومينسانس در V.harveyi) میباشد. در تراكم بالاي سلولي، LuxP متصل به AI-2 با LuxQ واكنش داده و آن را به يك فسفاتاز تبديل میکند. اين امر منجر به دفسفريلاسيون LuxQ و معكوس شدن مراحل پيشروي فسفوريلاسيون در مسير سيگنال AI-2 میشود و نهايتاً منجر به برداشته شدن مهار از LuxR میگردد. به اين ترتيب LuxR آزاد میشود تا رونويسي از ژنهای بيولومينسانس را فعال نمايد.
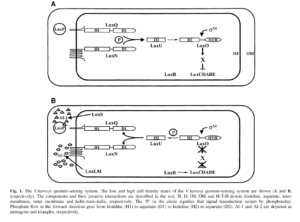
شکل 3. مسيرQuorum Sensing وابسته به سيگنال AI-2 و AI-1 در تراکمهای پائين و بالاي جمعيت باکتري
V. harveyi
H: هيستيدين، D: آسپارتات، IM: غشاي دروني، OM: غشاي بيروني، HTH: هليکس-ترن-هليکس. P داخل دايره نشاندهنده گروه فسفوريل است.
در بخشهای بعدی این مقاله در مورد Quorum Sensing در باکتریهای گرم مثبت و کاربردهای این پدیده در باکتریها مطالبی ارائه خواهد شد.
منابع:
Gera C, Srivastava s. quorum – sensing: the phenomenon of microbial communication. Current Science. 2006;90(5):666-76.
Fuqua, C., Parsek, M. R. and Greenberg, E. P. (2001). Regulation of gene expression by cell-to-cell communication: acyl-homoserine lactone quorum sensing. Annual Review of Genetics, 35: 439–468.
Visick, K. L. and McFall-Ngai, M. J. (2000). An exclusive contract: specificity in the Vibrio fischeri–Euprymna scolopes partnership. Journal of Bacteriology, 182: 1779–1787.
Finney, A. H., Blick, R. J., Murakami, M., Ishihama, A. and Stevens, A. M. (2002). Role of the C-terminal domain of the alpha subunit of RNA polymerase in LuxR dependent transcriptional activation of the lux operon during quorum sensing. Journal of Bacteriology, 184: 4520–4528.
Shadel, G. S. and Baldwin, T. O. (1992). Identification of a distantly located regulatory element in the luxCD gene required for negative autoregulation of the Vibrio fischeri luxR gene. Journal of Biological Chemistry, 267: 7690–7695.
Bassler, B. L. (2002). Small talk: cell-to-cell communication in bacteria. Cell 109: 421–24.
Abraham, W. R. (2006). Controlling biofilms of gram-positive pathogenic bacteria. Current Medicinal Chemistry, 13: 1509–1524.
Andersson, R. A., Koiv, V., Norman-Setterblad, C. and Pirhonen, M. (1999). Role of RpoS in virulence and stress tolerance of the plant pathogen Erwinia carotovora subsp. carotovora. Microbiology, 145: 3547–3556.
Bainton, N. J. (1992b). A general role for the lux autoinducer in bacterial cell signalling: control of antibiotic synthesis in Erwinia. Gene, 116: 87–91.
Bainton, N. J., Stead, P., Chhabra, S. R., Bycroft, B. W., Salmond, G. P. C., Stewart, G. S. A. B. and Williams, P. (1992a). N-(3-oxohexanoyl)-L-homoserine lactone regulates carbapenem antibiotic production in Erwinia carotovora. Biochemical Journal, 288: 997–1004.
Coulthurst, S. J., Lilley, K. S. and Salmond, G. P. C. (2006). Genetic and proteomic analysis of the role of luxS in the enteric phytopathogen, Erwinia carotovora. Molecular Plant Pathology, 7: 31–45.
Day, W. A. and Maurelli, A. T. (2001). Shigella flexneri LuxS quorum sensing system modulates virB expression but is not essential for virulence. Infection and Immunity, 69: 15–23.
De Keersmaecker, S. C., Sonck, K. and Vanderleyden, J. (2006). Let LuxS speak up in AI-2 signaling. Trends in Microbiology, 14: 114–119.
Zhao J, Quan C, Jin L, Chen M. Production, detection and application perspectives of quorum sensing autoinducer-2 in bacteria. J Biotechnol. 2018 20;268:53-60.
Defoirdt T. Quorum-Sensing Systems as Targets for Antivirulence Therapy. Trends Microbiol. 2017. pii: S0966-842X(17)30232-9.
Banerjee G, Ray AK. The talking language in some major Gram-negative bacteria.Arch Microbiol. 2016;198(6):489-99.
نقش Quorum sensing در باکتریها (2)
تأثیر سیستم حساسیت جمعیتی در بیماریزایی باکتری گرم مثبت استافیلوکوکوس اورئوس
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام