مگنتیک ایمونواسی و کاربردهای آن
زهرا سلیمانی
دانشجوی کارشناسی ارشد، گروه ایمونولوژی پزشکی، دانشگاه علوم پزشکی مشهد، مشهد، ایران
چکیده:
[1]MIA نوع جدیدی از ایمونواسیهای تشخیصی است که در آن از ذرات مغناطیس به عنوان نشانگر استفاده میشود.
جداسازی مغناطیسی با استفاده از ذرات مغناطیس، تکنیک رایجی برای جداسازی سلولهای کلیدی، اندامکهای سلولی و ترکیبات فعال از نظر بیولوژیکی (مانند: نوکلئیک اسیدها، پروتئینها، زنوبیوتیک[2]، میکربها) از سوسپانسیونهای بیولوژیکی شده است.
به دلیل توانایی ذاتی آهنربا در فراهم ساختن نیروهایی در یک فاصله، جداسازی مغناطیسی گام استاندارد شدهای در زمینههای متعددی همچون پزشکی، مهندسی بافت و پژوهشهای بیولوژیکی بنیادی محسوب میشود.
در این مقاله وضعیت کنونی ذرات مغناطیسی که برای تسهیل جداسازی سلولها و دیگر موارد ذکر شده به کار میروند را بررسی کرده و روی ویژگیهای فیزیکی اصلی ذرات مغناطیسی و کاربردهای جداسازی سلول، تخلیص DNA و به دام انداختن ویروسها با استفاده از ذرات مغناطیسی تمرکز کردیم.
و همچنین پیشروی جداسازی سلول با این روش را در پژوهشهای پزشکی و بیوپزشکی مورد مطالعه قرار دادیم.
کلید واژه: MIA، ذرات مغناطیسی[3]، جداسازی سلول[4]، [5]MACS ، جداسازی ماکروملکولها، روش Boom.
مقدمه:
MIA نوع جدیدی از ایمونواسیهای تشخیصی است که در آن از ذرات مغناطیسی برای جداسازی استفاده میشود. ذرات مغناطیسی هم ذرات پایدار و گرانقیمت پلیمری هستند که حاوی مقداری ماده مغناطیسی میباشند.
استفاده از ذرات مغناطیسی در ایمونواسیها، به طور قابلتوجهی رو به گسترش است. ویژگیهای مغناطیسی این ذرات، جداسازی در حجمهای زیاد را آسانتر و سریعتر کرده و در برخی موارد دقت و حساسیت را بالا میبرد (1).
در این زمینه، ذرات مغناطیسی (نانوذرات، ساب میکروذرات، میکروذرات) یک جزء مهم تکنیکهای جداسازی در تحقیقات پزشکی و بیوپزشکی در چهار دهه اخیر میباشند (2).
توانایی جداکردن عوامل هدف با خلوص و قابلیت بازیابی[6] بالا از مخلوطهای پیچیده، برای بسیاری از کاربردهای بیوپزشکی نقش حیاتی دارد (3،4).
از تکنیکهای جداسازی مغناطیسی برای جداکردن سلول با تکنیک MACS، تخلیص نوکلئیک اسیدها و پروتئینها و به داماندازی میکربها استفاده میشود.
جداسازی سلولهای بیولوژیکی برای یکسری کاربردهای بیوپزشکی مثل تشخیص، درمان و بیولوژی سلولی بسیار ضروری است.
با توجه به اینکه نمونهها عمدتاً حاوی جمعیتهای ناهمگون سلولی میباشند، جداسازی سلولهای کلیدی موردنظر بسیار حائز اهمیت است (2).
MACS جزء تکنیکهایی است که به مقدار زیادی برای جداسازی سلول خصوصاً سلولهای بنیادی[7] استفاده میشود (5).
تکنیکهای استانداردی مثل فیلتراسیون، سانتریفوژ و رسوبگذاری هم برای جداسازی سلولها وجود دارند که هم به صورت مرحله به مرحله و هم به صورت پیوسته میتوانند انجام شوند اما اگر اختلاف اندازه سلولها ناچیز باشد این تکنیکها چندان کارآمد نیستند (2).
تخلیص DNA و یا RNA قبل از بسیاری از فرایندهای تشخیصی و بیوشیمیایی گام مهمی به حساب میآید (6).
نکته قابل توجه در تخلیص مغناطیسی DNA این است که نوکلئیک اسیدها میتوانند مستقیماً از مواد اولیه مثل خون، بافت هموژنیزه، آب و محیط کشت جدا شوند.
برای تخلیص DNA انواع مختلفی از ذرات مغناطیسی و انواع دستگاههای دستی و خودکار در دسترس میباشد. توضیح مختصری از روشهای جداسازی مغناطیسی DNA در این مقاله داده شده است.
این روش از نظر زمان و همچنین از نظر اقتصادی به صرفه است، خطر آلودگیهای متقاطع هنگام استفاده از روشهای سنتی حذف میشود و برای تخلیص بسیار ساده، سریع و آسان است.
در حقیقت جداسازی مغناطیسی تنها روش ممکن برای بازیافت ذرات کوچک در حضور بقایای زیستی و دیگر مواد رسوبی با سایز مشابه است. از این گذشته، جداسازی مغناطیسی خصوصاً برای تخلیصهایی در مقیاس بزرگ مناسب است (6،7).
با توجه به ظهور ویروسهای جدید و انتشار آنها، تخلیص و جداسازی ویروسها به دغدغه جهانی تبدیل شده است که جداسازی آنها توسط ذرات مغناطیسی روشی سریع و کمهزینه به شمار میرود.
این نوع جداسازی روش جدیدی است که در این روش از ذرات مغناطیسی با پلیمر آنیونی خاصی استفاده میشود که مراحل اصلی این روش را در این مقاله بررسی میکنیم (8).
ایمونواسی:
در سال 1950 سوسمن یالو[8] وسولومون برسون[9] با توسعه و اختراع روش ایمونواسی به شهرت رسیدند و یالو دومین زن آمریکایی بود که در سال 1977 موفق به کسب جایزه نوبل شد (9).
ایمونواسی یک تست بیوشیمیایی مبتنی بر واکنش آنتیژن- آنتیبادی است که حضور و یا غلظت ماکروملکولهای موجود را با استفاده از آنتیبادی اندازه میگیرد.
ماکروملکولی که توسط ایمونواسی تشخیص داده میشود آنالیت نام دارد که معمولاً پروتئینی بوده و متناسب با هدف پزشکی- پژوهشی در مایعات بیولوژیکی مختلفی مثل سرم، ادرار و … اندازه گرفته میشود (10).
مگنتیک ایمونواسی (MIA):
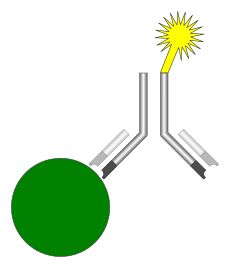
مگنتیک ایمونواسی یکی از جدیدترین انواع ایمونواسیهای تشخیصی است که در این روش همانند استفاده از آنزیم در ELIZA[10]، رادیوایزوتوپ در [11]RIA و مواد فلوئورسنت در فلوروایمونواسی از ذرات مغناطیسی به عنوان نشانگر استفاده میشود. (شکل 1)
شکل 1: آنتیبادی از یک طرف به ذرات مغناطیسی (رنگ زرد) و از طرف دیگر به آنالیت موردنظر (رنگ سبز) متصل شده است
حضور این ذرات مغناطیسی توسط مگنتیک ریدر (مگنتومتر) تشخیص داده میشود. در واقع این مگنتیک ریدر تغییرات میدان مغناطیسی را که توسط ذرات القا میشود اندازه میگیرد.
سیگنالی که توسط مگنتومتر اندازه گرفته میشود با مقدار آنالیت مورد نظر (ویروس، باکتری، توکسین، مارکرهای قلبی…) نسبت مستقیم دارد و هرچه مقدار آنالیت بیشتر باشد سیگنال قویتری تولید خواهد شد.(11)
ذرات مغناطیسی[12]:
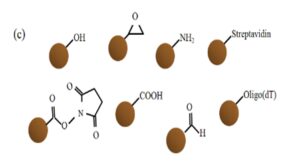
ذرات مغناطیسی پوستههای پلیمری بوده که حاوی مواد مغناطیسی در اندازههای نانومتریکی هستند که عمدتاً از جنس اکسیدآهن میباشند.
مگنتیک بیدها را به عنوان استاندارد مرجع[13] در نظر میگیرند. اندازه این ذرات بین 1μm-100μm متغیر است که اکثراً 1μm -2μmمیباشند و میزان آهن آنها 60%-15% میتواند باشد (12).
ویژگیهای ذرات مغناطیسی:
این ذرات یک سری ویژگیها دارند که آنها را برای این روش مناسب کرده است:
- ذرات پایداری هستند که تحتتأثیر معرفها تغییر نمیکنند.
- برای نمونههای مختلف، ذره اختصاصی وجود ندارد بلکه فقط مارکرهای سطحی تغییر میکند.
- کدورت و یا ماندن نمونه اثری بر ویژگیهای مغناطیسی این ذرات ندارد.
- با استفاده از میدان مغناطیسی میتوان به میزان اندکی بر عملکرد این ذرات اثر گذاشت، مثلاً با حذف میدان مغناطیسی میتوان عملکرد این ذرات را متوقف ساخت و بالعکس (13).
از روشهای مغناطیسی برای جداسازیهای متفاوتی استفاده میشود: برای جداسازی سلول، ماکروملکولها، پاتوژنها و… که به طور مختصر به ارائه هرکدام میپردازیم.
جداسازی سلول:
بطور کلی تکنیکهای جداسازی سلول در سه گروه تقسیمبندی میشوند:
- جداسازی سلول بر مبنای کشت
- جداسازی سلول بر مبنای ویژگیهای فیزیکی مثل چگالی، اندازه
- جداسازی سلول بر اساس میل ترکیبی که اینها دو نوع هستند :FACS و MACS(14).
تکنیک استاندارد برای جداسازی سلولها وجود دارد از جمله فیلتراسیون، سانتریفوژ و رسوبگذاری. در مواردی که اختلاف اندازه و یا چگالی سلولها ناچیز باشد این روشها کارا نبوده و از روشهای دیگری مثل FACS و MACS باید استفاده نمود (2).
- روش FACS : در این روش سلولها به ماده فلوئورسنت متصل شده و جدا میشوند.
- روش MACS
تکنیک MACS:
تکنیک MACS روشی است برای جداسازی سلولها که در آن از ذرات مغناطیسی استفاده میشود.
در سال 1977، رمبائوم[14] و همکارانش یک روش ایمونومغناطیس را کشف کردند که MACS نام گرفت (15). این تکنیک روشی روتین است که برای جداسازی سلولهای کلیدی به کار میرود و در آن از نانوذرات (nm20-nm100 ) متصل شده با آنتیبادی استفاده میشود.
از بین تمامی مواد کاربردی، مواد مغناطیسی از نظر انتقال نیرو یا انرژی در هوا و یا خلأ، بدون برقراری تماس، منحصر به فرد میباشند (14).
روش MACS روشی با قدرت انتخاب[15] بالا، میزان حساسیت و دقت بالا و کسب نتیجه مناسب است (16).
به طور کلی جداسازی سلولهای بیولوژیکی برای تشخیص، درمان و همچنین در بیولوژی سلولی ملکولی مهم میباشند.
با توجه به اینکه نمونهها اکثراً به صورت ناهمگن[16] و ترکیبی از مواد و سلولهای مختلف هستند، لذا برای درک بهتر چگونگی عملکرد سلولها و نحوه پاسخ آنها به محرکهای مختلف از روشهای مغناطیسی استفاده میکنیم که این روشها گام استانداردی در مهندسی بافت، پزشکی و پژوهشهای بیولوژیکی بنیادی میباشند.
استفاده از سلولهای خالصسازی شده تنوع را در آزمایشات کم کرده، میزان دقت آزمایش را بالا برده و کشفیات علمی را سرعت میبخشد؛ همچنین برای درک رفتار و عملکرد سلولی اغلب نیاز است که زیرمجموعههای سلولی جدا شوند تا میزان ناهمگنی در نمونههای موردنظر کاهش یابد (2).
نحوه جداسازی سلول با روش MIA:
ابتدا سلولهای هدف به آنتیبادیهایی که از قبل با ذرات مغناطیسی نشاندار شدهاند متصل میشوند. سپس محلول حاوی سلولهای هدف به درون ستون سیستم جداساز ریخته میشود. در دو طرف ستون آهنربا قرار گرفته در نتیجه سلولهای متصل شده به آنتیبادی نشاندار شده در ستون، به سمت آهنرباها کشیده میشوند. محلول رویی دور ریخته میشود و ستون از سیستم جدا شده و سلولهای هدف درآن باقی میمانند. (شکل2)
شکل 2: جداسازی سلولها با استفاده از روش مگنتیک ایمونواسی
اجزای سیستم MACS:
این سیستم سه جزء دارد:
- ذرات MACS
- ستون MACS
- جداکننده MACS
ذرات MACS:
تقریباً در طی 35 سال گذشته، ذرات مغناطیسی به ابزار استانداردی برای جداسازی زیرمجموعههای سلولی معین، در پزشکی، ایمونولوژی و بیولوژی تبدیل شدند.
همچنین در سال 1977، مولدای[17] و همکارانش برای اولین بار گویچههای[18] پلیمریک حاوی آهن که با لکتین کونژوگه شدهاند را برای جداسازی RBC و سلولهای چسبیده به آنتیبادی به کار بردند (15).
ستونهای MACS:
ستونهایی در این دستگاه بکار برده میشوند تا مسیر سلولهای مشخص شده و برچسب شده را در میدان مغناطیسی تولید شده توسط آهنرباهای بیرونی، کنترل کنند.
این ستونهای جداسازی معمولاً از یک ماده پارامغناطیسی فولاد یا اصطلاحاً گویچههای آهنی پوشیده شدهاند تا بتوانند جریان مغناطیسی را به خوبی متمرکز کرده و میدان مغناطیسی قویای ایجـــــاد کنند (در حدود 0.4T-1T) تا بتواند سلولهایی را که حتی به میزان اندکی به نانو ذرات مغناطیس متصل شدهاند را جدا کند (17).
جداساز[19]ها معمولاً از یک سری آهنرباهای قوی دائمی کمیاب ساخته شدهاند که میتوانند مقادیر متفاوت میکروتیوبها یا تیوبها را نگهدارند. (شکل 3)
شکل 3
البته همه جداسازها ساده نیستند؛ انواع خودکار هم وجود دارد که میتـــوانند حدود 1010×2 سلول را در زمان 30-5 دقیقه جدا کنند، همچنین میتوانند چندین نمونه را همزمان بررسی کنند (14) (شکل4).
شکل 4: دستگاههای جداکننده متنوعی وجود دارد؛ از انواع بسیار ساده تا دستگاههای پیشرفته. شکل تصویری از جداساز پیشرفته میباشد
A) قسمت اصلی جداساز با میلههایی که قابلیت مغناطیس داشته و ذرات را به سمت خود جذب میکنند.
B) الکترومغناطیس C) محلولهای بافری مورد نیاز در طی روند جداسازی D) واحد ردیابی (18)
تعیین کارایی دستگاه جداکننده سلول:
برای تعیین میزان کارایی یک دستگاه جداکننده سلول سه مؤلفه وجود دارد: (19)
1: میزان خلوص
2: بازیافت[20]
3: القای زیستی
- میزان خلوص: یعنی غنیسازی سلولهای خاص هدف که از یک جمعیت سلولی ناهمگن مشتق میشوند با استفاده از فنوتایپها و مارکرهایی که در سطح سلول هدف وجود دارند.
میزان خلوص اینگونه بیان میشود:
تعداد سلولهای هدف تقسیم بر کل سلولهای جداشده
درصد سلولهای هدف در مقایسه با سلولهای غیرهدف جداشده در یک نمونه
- بازیافت: این مؤلفه هم کارآمدی دستگاه را نشان میدهد و برحسب درصد بیان میشود:
درصد سلولهای جدا شده در مقایسه با تعداد کل سلولها
تعداد سلولهای جداشده در مقایسه با سلولهای هدف در محلول سلولی اولیه
- القای زیستی: مؤلفه بسیار مهمی است که میزان سلولهای زنده را به کل سلولهای جدا شده نشان میدهد.
کاربردهای تکنیک MACS:
این تکنیک برای جداسازی انواع سلول به کار میرود:
- سلولهای بنیادی
- CTC[21]ها
- سلولهای بنیادی سرطانی[22]
- زیرمجموعههای WBC
- جداسازی سلولهای عفونی شده با مالاریا برای تشخیص بیماری
- تصفیه خون (برداشت باکتریها از خون قبل از برگشت آن به دهنده)
- جداسازی CTCها برای جلوگیری از انتشار سرطان
همچنین جداسازی سلولهای کلیدی میتواند منجر به کشفیات متعددی شود، برای مثال جداسازی WBCهای عفونی شده با HIV از بیماران، برای بررسی فرد به فرد و در نتیجه درمان و کنترل بهتر بیماری مفید است (14و20).
جداسازی DNA با استفاده از ذرات مغناطیسی:
همانطور که قبلاً اشاره شد از ذرات مغناطیسی برای جداسازی ماکروملکولهایی همانند پروتئین، DNA و… هم استفاده میشود که در این قسمت به بررسی جداسازی DNA میپردازیم.
جداسازی DNA یا RNA قبل از بسیاری از فرایندهای تشخیصی و بیوشیمیایی یک گام بسیار مهم به حساب میآید و باعث جداسازی مواد اتصالی احتمالی مثل پروتئینها و کربوهیدراتها میشود.
خالصسازی DNA با روشهای مغناطیسی و غیرمغناطیسی انجام میشود که روشهای مغناطیسی در فرایندهای بیوشیمیایی و زیست ملکولی در مقایسه با روشهای غیر مغناطیسی دارای اهمیت بیشتری میباشند (18).
Boom method:
روش جداسازی نوکلئیک اسیدها است که در فاز جامد انجام شده و به افتخار مخترعش ویلیام بوم[23] در سال 1990 روش Boom نام گرفت (18).
در واقع جداسازی DNA با استفاده از ذرات مغناطیسی از روشهای جداسازی سنتی مثل سانتریفوژ سادهتر است و همچنین در سانتریفوژ نیروهایی تولید میشوند که ممکن است سبب تخریب نوکلئیک اسید شوند (21).
مشخصه مهم این روش جذب نوکلئیک اسیدها به ذرات متصل به سیلیکا است.
ذرات سیلیکا[24] ذرات مغناطیسی هستند که لایه پلیمری اطراف آنها میل ترکیبی لازم برای اتصال به نوکلئیک اسیدها را دارا است.
واژه سیلیکا به معنی کریستالهای SiO2 است، اشکال دیگری از ذرات سیلیکا مثل اکسید سیلیکون آمورف، پودر شیشه، سیلیکات آلومینیوم و… هم در دسترس هستند (22).
بسیاری از این دانههای مغناطیسی به طور مصنوعی در دسترس هستند و یا میتوانند در آزمایشگاه تهیه شوند، همانند ذرات مغناطیسی که از پلیمرهای سنتتیک مختلف ساخته میشوند مثل بیوپلیمرها و شیشههای متخلخل و یا اینکه بر مبنای مواد مغناطیس معدنی مثل اکسید آهن میباشند (18).
قطر این ذرات در حدود10-0/5 μm است. در آزمایشگاه معمولاً از ذرات کلوئیدی مغناطیسی Fe3O4 (یا ذرات مغناطیسی مشابه مثل ɣFe3O4 یا فریتها) استفاده میشود که سیلیکا در سطح آنها قرار داده شده است (26).
نکته قابل توجه این است که DNA و RNA توسط ذرات مغناطیسی یکسانی جدا میشوند.
برای تخلیص RNA از DNA، با افزودن RNAase یا مادهای آلکیلی مثل NaOH، RNA قبل از جداسازی DNA تخریب میشود و همینطور برای تخلیص RNA، DNA را با DNAase تخریب میکنند (18).
این روش یکی از فراگیرترین و بهترین روشها برای جداسازی نوکلئیک اسید از نمونههای بیولوژیکی است و به عنوان یک روش ساده، سریع و قابل اعتماد برای تخلیص مقادیر کم نوکلئیک اسید از نمونههای بیولوژیکی میباشد.
اهمیت این روش در ویژگیهای ذرات سیلیکای متصل به نوکلئیک اسید و حضور ماده کاتروپیک و به دنبال آن ایجاد اثر کاتروپیک است.
به عبارت ساده اثر کاتروپیک موقعی اتفاق میافتد که یک آنیون کاتروپیک در محلول آبی، در ساختار آب اختلال ایجاد کرده و پیوندهای هیدروفوب و آبگریز را تضعیف کند.
در مفهوم وسیع ماده کاتروپیک برای هر ماده قادر است ساختار دوم، سوم و چهارم نوکلئیک اسیدها و پروتئینها را تغییر دهد در حالی که ساختار اول بیتغییر میماند.
مثلاً در مورد نوکلئیک اسید تاخوردگی رشته باز شده و بهتر در معرض اتصال به سیلیکابیدها قرار میگیرد.
آنیون کاتروپیک با مداخله در پیوندهای ملکولی غیرکووالان همانند پیوندهای هیدروژنی، واندروالس و هیدروفوب، آنتروپی سیستم را زیاد میکند.
مطابق اثر کاتروپیک، در حضور ماده کاتروپیک یک ملکول آب از پیوند فسفودیاستر گروه فسفات اسکلت نوکلئیک اسیدی گرفته میشود و در نتیجه گروه فسفات در معرض قرار گرفته و یک پیوند هیدروفوبیک بین سیلیکا و گروه فسفات تشکیل میشود.
مراحل جداسازی نوکلئیک اسید از ماده اولیه با روش Boom: (شکل 4و5)
- لیز و همگن کردن مواد اولیه: لیز مواد اولیه توسط یک معرف در حضور آنزیمهای تخریب کننده پروتئین صورت میگیرد.
- مخلوط کردن مواد کاتروپیک و سیلیکابیدها درون مواد اولیه (مخلوط کردن ماده اولیه): ماده اولیه همگن، با مقادیر به اندازه کافی زیاد ماده کاتروپیک مخلوط میشود. (ماده کاتروپیک برای اتصال نوکلئیک اسید به سیلیکابیدها)
- مطابق اثر کاتروپیک نوکلئیک اسید آزاد شده تقریباً به طور ناگهانی به سیلیکابیدها متصل خواهد شد و به این ترتیب کمپلکس سیلیکا-نوکلئیک اسید شکل میگیرد.
- شستوشوی سیلیکابیدها: در این مرحله سیلیکابیدها چندین بار شسته میشوند تا آلودگیها و مواد اضافی حذف شوند.
- جداسازی نوکلئیک اسیدهای متصل شده: در این مرحله با کاهش غلظت ماده کاتروپیک، نوکلئیک اسیدها از سیلیکابیدها جدا میشود.
- نوکلئیک اسید شسته و ترجیحاً خشک میشود.
با تغییر شرایط آزمایشگاهی، خصوصاً با تغییر معرفها (ماده کاتروپیک، بافر شستشو و…) جداسازی خالصتری میتوان انجام داد، مثلاً برخی ترکیبات برای تخلیص dsDNA طویل و برخی برای ssRNA کوتاه مناسب هستند. (18،23،24)
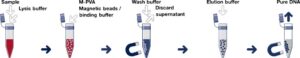
شکل 5: در مرحله اول با افزودن لیزیز بافر، نمونه همگن میشود، سپس ذرات مغناطیسی به آن اضافه شده و اتصال این ذرات و DNA صورت میگیرد.
بافر شستشو را به آن افزوده و به دنبال آن از آهنربا برای جمعآوری ذرات مغناطیسی در یک قسمت از میکروتیوب استفاده میشود، مواد اضافی دور ریخته میشود. در مرحله بعد بافری با مقدار ماده کاتروپیک اضافه شده تا اتصال DNA و ذرات مغناطیسی سست شود و در نهایت با استفاده مجدد از آهنربا DNA خالص جمع شده و مواد اضافی دور ریخته میشود.
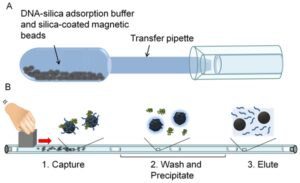
شکل 6 : دو قسمت روش جداسازی DNA بر مبنای ذرات مغناطیسی:
A) بافر جذب DNA-سیلیکا و ذرات مغناطیسی متصل به سیلیکا که از قبل لیوفیلیزه شدند درون لوله وجود دارند. DNA توسط این بافر جذب شده و به ذرات مغناطیسی متصل میشود، بعد از مخلوط شدن وارد پیپت انتقالی شده و در آنجا لوله ابتدا به مدت 30 ثانیه با دست تکان داده میشود تا نمکهای لیوفیلیزه حل شوند و سپس به آرامی به مدت 30 ثانیه مجدداً تکان داده میشود تا DNA به سطح ذرات مغناطیسی متصل شود و سپس محلول با فشار به لولهای با قطر کوچک وارد میشوند.
B) لوله با قطر کوچک کاست استخراج نامیده میشود که توسط شکافهای هوایی به بخشهای مختلفی قسمت شده و محلولهای پردازشگر متفاوتی در هر بخش وجود دارند.
DNA جذب شده به ذرات مغناطیسی پوشیده شده از سیلیکا توسط یک آهنربای بیرونی در هر بخش کشیده شده و در نهایت از بخش انتهایی خارج میشود.
مراحل مشابه مراحل ذکر شده برای جداسازی DNA در لوله با قطر کوچک انجام شده و هر استخراج کامل DNA در 15 دقیقه انجام میشود (25).
کاربردهای جداسازی DNA:
جداسازی DNA و استفاده از DNA خالص در موارد مختلفی کاربرد دارد از جمله:
- تشخیص
- کلونینگ
- توالییابی
- تکثیر
- دورگهسازی DNA
- سنتز cDNA
همچنین امروزه یکسری از تکنیکها به DNA و RNA خالص نیاز دارند، پس روشهایی برای جداسازی مؤثر، کافی و قابل اعتماد نوکلئیک اسیدها از یک مخلوط پیچیده موردنیاز است، همانند:
- تشخیص عفونتهای میکروبی
- پزشکی قانونی
- تشخیص تغییرات ژنتیکی
- Tissue typing & Blood typing (18)
همانطور که قبلاً ذکر شد ذرات مغناطیسی برای جداسازی عوامل بیماریزا (ویروس، باکتری و…) نیز کاربرد دارند که اساس جداسازی در اینها مشابه است، بدین ترتیب به اختصار به چگونگی جداسازی ویروسها میپردازیم.
جداسازی ویروسها:
اخیراً شیوع زیاد ویروسهای ناشناخته همانند ظهور مجدد ویروسهای شناخته شدهای (27) مثل ویروس نیل غربی[25](28)، آنفلوانزای خوکی[26](29) و ویروس ابولا[27] (30) که گمان میرفت تحت کنترل هستند، به یک نگرانی در سراسر جهان تبدیل گشت (8).
با توجه به اینکه تعداد ذرات ویروسی در نمونههای بالینی و محیطی کم است روشی برای تعیین غلظت ویروس موردنیاز است.
تشخیص ویروس میتواند عملکرد به موقع برای جلوگیری از انتشار بیماری را تسهیل کرده و به ارزیابی دقیق بیماری کمک کند.
بسیاری از بیماریهای ویروسی که اخیراً شناخته شدهاند بین انسان و دام مشترک هستند، بنابراین نظارت نه تنها انسان بلکه حیوان نیز ضروری است (31).
ناقلهایی مثل حشرات نیز نقش مهمی در انتقال ویروسهایی مثل ویروس دنگو[28] دارند، پس وکتورهای عفونی شده هم باید کنترل شوند (32).
جداسازی و جمعآوری باکتری و قارچ از نمونههای مایع نسبتاً ساده و با استفاده از سانتریفوژهای نسبتاً کم سرعت انجام میشود اما برای جداسازی و تعیین غلظت ویروسها، اولتراسانتریفوژهای پرسرعت نیاز است که تجهیزات بسیار گرانقیمتی دارند و جداسازی با این روشها حداقل 3 ساعت زمان برده و در نهایت هم عفونتزایی ویروس کم میشود.
همچنین ممکن است طی فرایندهای چندمرحلهای و پیچیده برای تخلیص ویروس، تعدادی از ویروسها از بین بروند و آلودگی متقاطع نمونهها افزایش یابد، بنابراین برای تشخیص و جمعآوری ویروسها روش سادهتری نیاز است.
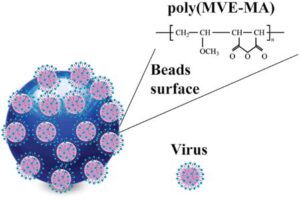
اخیراً گزارش شده که ذرات مغناطیسی پوشیده شده با یک پلیمر آنیونی، پلی(متیل وینیل اتر-مالئیک انهیدرید)[29] میتوانند تشخیص سریع و دقیق ویروسها را تسهیل کنند (شکل 7)
شکل 7: ذرات مغناطیسی که با پلیمر آنیونی POLY(MVE-MA)[30]، دارای یک بار منفی،پوشیده شده و به ویروسها متصل میشود
به دام انداختن و جداسازی ذرات ویروسی توسط ذرات مغناطیسی روش جدیدی است و در این روش از ذرات مغناطیسیای استفاده میشود که ملکولهایی در سطح خود دارند که میتوانند بدون کاهش عفونتزایی ویروس به آن متصل شوند (8).
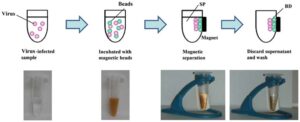
نحوه جداسازی ویروس با استفاده از ذرات مغناطیسی:
در مرحله اول ذرات مغناطیسی مورد نظر به نمونه عفونی شده با ویروس افزوده میشوند، سپس گرماگذاری شده تا اتصال بین آنها برقرار شود.
با استفاده از آهنربا ویروسهای متصل شده به ذرات مغناطیسی جذب آهنربا شده و به کناره ستون میآیند. محلول رویی دور ریخته شده و سرانجام با افزودن بافر مخصوص، ویروسها از ذرات مغناطیسی جدا شده و خالص میشوند (8). (شکل 8).
شکل 8: به دام انداختن ویروس توسط ذرات مغناطیسی پوشیده شده با poly(MVE-MA)
بحث:
MIA و تکنیکهای مبتنی بر مغناطیس نسبت به روشهای سنتی مثل سانتریفوژ، بسیار سادهتر، سریعتر و دقیقتر هستند و با توجه به کاربرد زیادی که دارند کمهزینه هستند.
با استفاده از این تکنیکها میتوان سلولها، عوامل بیماریزائی مثل ویروس، باکتری و ماکروملکولهایی مانند اسیدهای نوکلئیک، پروتئینها، مارکرهای قلبی و توکسینهای مختلف را جدا کرد.
برای جداسازی با این روش نیاز به ذرات مغناطیسی اختصاصی نمیباشد و با توجه به اینکه این ذرات بسیار گران هستند با قرار دادن مارکری متناسب با ماده جداشده، میتوان از این ذرات به طور غیراختصاصی استفاده نمود. (شکل 9)
شکل 9
منابع:
1.Haik, Y., et al. “Magnetic Immunoassay for Rapid Assessment of Acute Myocardial Infarction (AMI).” European Cells & Materials 3 (2002): 41-44.
2.Borlido, L., et al. “Magnetic separations in biotechnology.” Biotechnology advances 31.8 (2013): 1374-1385.
3.Battistini, Luca, et al. “CD8+ T cells from patients with acute multiple sclerosis display selective increase of adhesiveness in brain venules: a critical role for P-selectin glycoprotein ligand-1.” Blood 101.12 (2003): 4775-4782.
4.Patterson, Bruce K., et al. “Detection of HIV-1 DNA and messenger RNA in individual cells by PCR-driven in situ hybridization and flow cytometry.” Science 260.5110 (1993): 976-979.
- Alexey Bersenev on January 12, 2013. FACS versus MACS for stem cell purification
6.Šafařík, Ivo, Lucie Ptáčková, and Mirka Šafaříková. “Large-scale separation of magnetic bioaffinity adsorbents.” Biotechnology Letters 23.23 (2001): 1953-1956.
7.Franzreb, Matthias, et al. “Protein purification using magnetic adsorbent particles.” Applied microbiology and biotechnology 70.5 (2006): 505-516.
8.Sakudo, Akikazu, and Takashi Onodera. “Virus capture using anionic polymer-coated magnetic beads (Review).” International journal of molecular medicine 30.1 (2012): 3-7.
9.Rall JE. Solomon A. Berson. In “Biographical Memoirs”. National Academy of Sciences 1990;59:54-71. ISBN 0-309-04198-8
10.Yetisen, Ali Kemal, Muhammad Safwan Akram, and Christopher R. Lowe. “Paper-based microfluidic point-of-care diagnostic devices.” Lab on a Chip 13.12 (2013): 2210-2251.
11.Rife, J. C., et al. “Design and performance of GMR sensors for the detection of magnetic microbeads in biosensors.” Sensors and Actuators A: Physical 107.3 (2003): 209-218.
12.Shiv Sharma,GaroYessayan,Zachary Nicoll,George Chahwan,Jason Tarantino 2011. Magnetic Bead Technology. University of Massachusetts-Lowell
13.Lenglet, Luc. “Multiparametric magnetic immunoassays utilizing non-linear signatures of magnetic labels.” Journal of Magnetism and Magnetic Materials 321.10 (2009): 1639-1643.
14.Plouffe, Brian D., Shashi K. Murthy, and Laura H. Lewis. “Fundamentals and application of magnetic particles in cell isolation and enrichment: a review.” Reports on Progress in Physics 78.1 (2015): 016601.
15.Molday, R. S., S. P. S. Yen, and A. Rembaum. “Application of magnetic microspheres in labelling and separation of cells.” (1977): 437-438.
16.Coey, John MD. Magnetism and magnetic materials. Cambridge University Press, 2010.
17.Radbruch, Andreas, et al. “High-gradient magnetic cell sorting.” Methods Cell Biol 42.Pt B (1994): 387-403.
18.Berensmeier, Sonja. “Magnetic particles for the separation and purification of nucleic acids.” Applied microbiology and biotechnology 73.3 (2006): 495-504.
19.Sharpe, Paul T. Methods of cell separation. Elsevier, 1988.
20.Szaniszlo, Peter, et al. “Getting the right cells to the array: Gene expression microarray analysis of cell mixtures and sorted cells.” Cytometry Part A 59.2 (2004): 191-202.
18.Berensmeier, Sonja. “Magnetic particles for the separation and purification of nucleic acids.” Applied microbiology and biotechnology 73.3 (2006): 495-504.
21.Watson, R. J., and B. Blackwell. “Purification and characterization of a common soil component which inhibits the polymerase chain reaction.” Canadian Journal of Microbiology 46.7 (2000): 633-642.
22.Berensmeier, Sonja. “Magnetic particles for the separation and purification of nucleic acids.” Applied microbiology and biotechnology 73.3 (2006): 495-504.
23.Vandeventer, Peter E., et al. “DNA Adsorption to and Elution from Silica Surfaces: Influence of Amino Acid Buffers.” The Journal of Physical Chemistry B 117.37 (2013): 10742-10749.
24.Vandeventer, Peter E., et al. “Multiphasic DNA adsorption to silica surfaces under varying buffer, pH, and ionic strength conditions.” The Journal of Physical Chemistry B 116.19 (2012): 5661-5670.
25.Bordelon, Hali, et al. “A magnetic bead-based method for concentrating DNA from human urine for downstream detection.” PloS one 8.7 (2013): e68369.
26.Davies, Martin J., et al. “Isolation of plasmid DNA using magnetite as a solid-phase adsorbent.” Analytical biochemistry 262.1 (1998): 92-94.
27.McMichael, Anthony J. Human frontiers, environments and disease: past patterns, uncertain futures. Cambridge University Press, 2001.
28.Campbell, Grant L., et al. “West nile virus.” The Lancet infectious diseases 2.9 (2002): 519-529.
29.Richt, Juergen A., Richard J. Webby, and Robert E. Kahn. “The pandemic H1N1 influenza experience.” One Health: The Human-Animal-Environment Interfaces in Emerging Infectious Diseases. Springer Berlin Heidelberg, 2013. 269-279.
30.Team, WHO Ebola Response. “Ebola virus disease in West Africa—the first 9 months of the epidemic and forward projections.” N Engl J Med 371.16 (2014): 1481-95.
31.Taylor LH, Latham SM and Woolhouse ME: Risk factors for human disease emergence. Philos Trans R Soc Lond B Biol Sci 356: 983-989, 2001
32.Sakudo A, Onodera T, Shintani H and Ikuta K: Dengue virus presence and surveillance in Okinawa. Exp Ther Med 3: 15-17, 2012.
[1] Magnetic immunoassay
[2] xenobioti c
[3] Magnetic beads
[4] Cell Separation
[5] Magnetic-activated cell sorting
[6] Recovery
[7] Stem Cells
[8] Sussman yalow
[9] Solomon berson
[10] Enzyme-linked immunosorbent assay
[11] Radio immunoassay
[12] Magnetic beads
[13] Gold standard
[14] Rembaum
[15] Selectivity
[16] Heterogeneous
[17] Molday
[18] Microsphere
[19] Separator
[20] Recovery
[21] Circulating tumor cells
[22] Cancer stem cells
[23] Willem Boom
[24] Silica beads
[25] West Nile virus
[26] Swine influenza A virus H1N1
[27] Ebola virus
[28] Dengue virus
[29] POLY(MVE-MA)
[30] poly(methyl vinyl ether-maleic anhydride)
نانوذرات مغناطیسی و کاربرد آنها در تحقیقات پروتئومیکس
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/magnetic-immunoassay
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام