مروری بر کنترل متابولیسم
دکتر محمدرضا ملک، PhD بیوشیمی از مرکز تحقیقات بیوشیمی و بیوفیزیک دانشگاه تهران
مشاور و مدرس سیستمهای مدیریت کیفیت در آزمایشگاههای تشخیص پزشکی
malek.mrm@ut.ac.ir
مقدمه:
طبق تعریف سازمان بهداشت جهانی (WHO)، انسان سلامت، فردی است که از رفاه کامل جسمی، روانی و اجتماعی برخوردار باشد. از نقطه نظر علم بیوشیمی، سلامتی انسان در گرو کیفیت عملکرد سلولهای بدن و طبیعی بودن واکنشها و فرآیندهای شیمیایی مربوط به آنها است. از طرفی فعالیت مطلوب سلولها و ایجاد تعادل و هماهنگی بین واکنشهای مختلف بیوشیمیایی، وابسته به وجود ترکیبات آلی مانند کربوهیدراتها، چربیها، پروتئینها، اسیدهای نوکلئیک و ریزمغذیهایی مانند ویتامینها و مواد معدنی است که در کنار هورمونها و آنزیمهای مختلف، هر یک دارای نقشی کلیدی و منحصر به فرد در کنترل متابولیسم و تعادل انرژی در بدن هستند. بر همین اساس و با توجه به اینکه وجود ترکیبات مختلف آلی و معدنی به میزان متعادل در برنامه غذایی روزانه، بهعنوان یک شرط لازم و پیشنیازی اساسی برای حفظ و نگهداری از سلامت جسمی و روحی، موردنیاز است، رعایت اصل تعادل و تنوع در رژیم غذایی روزانه برای داشتن یک بدن طبیعی و سالم، امری ضروری و غیر قابل انکار است. در این جستار سعی بر این است تا با مروری بر مفاهیم متابولیکی و نحوه کنترل آن، اهمیت تعادل انرژی و تنوع غذایی را با رویکردهای بیوشیمیایی بررسی نماییم.
بدن انسان و نیاز به انرژی، مسئله این است!
بدن انسان برای انجام کارهای مختلف از نشستن روی یک صندلی و انجام فعالیتهای فکری تا پرداختن به فعالیتهای سنگین ورزشی، واکنشهای روحی و هیجانی، مقابله با انواع بیماریها و حتی به هنگام استراحت و خوابیدن نیاز به کسب انرژی دارد. این انرژی از مصرف مواد غذایی مختلف بهعنوان منابع سوختی تأمین میشود. بهطور کلی، بیشتر مواد غذایی شامل سه دسته اصلی کربوهیدراتها، چربیها و پروتئینها هستند که طی مراحل گوناگون به اجزای کوچکتری تجزیه شده و در نهایت سلولهای بدن از آنها بهعنوان سوخت برای تأمین انرژی موردنیاز خود بهرهمند میشوند. از طرفی نیاز به انرژی برای هر یک از اندامها و بافتهای بدن انسان مانند مغز، ماهیچهها، بافت چربی، کلیهها، کبد، قلب، گلبولهای قرمز و سیستم گوارشی بر اساس الگوی متابولیسمی متفاوتی که دارا هستند، متفاوت است، همچنین نیازهای غذایی بسته به شرایط مختلف مانند سیری و گرسنگی، چاقی و لاغری، مواجهه با انواع آسیبهای فیزیکی مانند سوختگی، شکستگی و جراحی، انجام فعالیتهای مختلف ورزشی اعم از قدرتی یا استقامتی و حتی در هنگام استراحت یا خواب عمیق بر اساس تغییرات و سازشهای متابولیسمی متفاوت است؛ بنابراین شناخت مکانیسمهای مختلف متابولیکی در بدن انسان میتواند در انتخاب یک رژیم غذایی متنوع، متعادل و متناسب راهگشا باشد.
متابولیسم یا سوخت و ساز سلولی
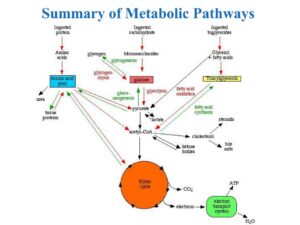
فرآیندی را که طی آن بدن انسان و سلولهای شکلدهنده آن، مواد غذایی مصرفی را به انرژی موردنیاز خود تبدیل مینمایند، متابولیسم یا سوخت و ساز سلولی مینامیم که شامل واکنشهای بسیار پیچیده بیوشیمیایی است (شکل 1).
شکل 1: خلاصهای از مسیرهای متابولیکی در بدن انسان
فرآیند متابولیسم و تغییر و تبدیل انرژی از تعداد زیادی مسیرهای متوالی و متعامل تشکیل شده است که واجد الگوهای مشترکی هستند و از راههای مختلف و متنوعی کنترل میشوند. استخراج انرژی از مواد غذایی شامل سه مرحله است؛ ابتدا مولکولهای بزرگ مواد غذایی مانند کربوهیدراتها، چربیها و پروتئینها به واحدهای کوچکتر سازنده خود یعنی گلوکز، اسیدهای چرب و آمینواسیدها شکسته میشوند. در مرحله دوم مولکولهای کوچک طی واکنشهایی به مولکول استیل کوآنزیم A تبدیل میشوند. مرحله سوم تحت عنوان چرخه کربس یا اسید سیتریک شناخته میشود که طی آن انرژی (ATP) تولید میگردد.
انواع واکنشهای متابولیکی
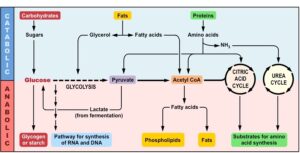
واکنشهای متابولیکی را میتوانیم به دو گروه عمده تقسیم نماییم؛ واکنشهای آنابولیکی که با مصرف انرژی بر ساخت و ساز مولکولها متمرکزند و واکنشهای کاتابولیکی که با فرآیند هضم مواد غذایی و تجزیه مولکولها جهت دریافت انرژی موردنیاز بدن مرتبط هستند (شکل 2). همچنین برخی از مسیرهای متابولیکی بسته به شرایط انرژی سلول میتوانند آنابولیک یا کاتابولیک باشند که بهعنوان مسیرهای آمفیبولیک نام برده میشوند. نکته قابل توجه از نقطه نظر بیوشیمیایی، مجزا بودن مسیرهای تجزیهای و بیوسنتزی به دلایل انرژتیک سلولی است که در تسهیل فرآیند کنترل متابولیسم بدن مؤثر است. جهت برآوردهسازی انرژی موردنیاز سلولها، وجود هماهنگی و یکپارچگی بین مسیرهای متعدد متابولیکی لازم و ضروری است که این ویژگی به شکل کاملاً هوشمندانه در بدن انسان و سایر سیستمهای زنده وجود دارد.
شکل 2: انواع واکنشهای متابولیکی
واکنشهای کاتابولیکی، مسیرهایی هستند که جهت استخراج انرژی از مواد غذایی به کار گرفته میشوند. واکنشهای بیوسنتز کربوهیدراتها، چربیها و پروتئینها که نیازمند به جذب انرژی هستند، واکنشهای آنابولیکی نامیده میشوند.
ATP انرژی آزاد رایج عمومی در بدن انسان
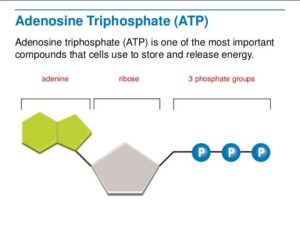
انرژی حاصل از مصرف مواد غذایی به مولکولی به نام آدنوزین تری فسفات (ATP) که شکل رایج و عمومی انرژی آزاد در سیستمهای زیستی است، منتقل میگردد. ATP بهعنوان واحد انرژی اصلی در سلول بوده و مولکولی غنی از انرژی است و انرژی حاصل از هیدرولیز آن برای انجام فرآیندهای مختلف سلولی مورد استفاده قرار میگیرد. هنگامی که آدنوزین تری فسفات (ATP) به آدنوزین دی فسفات (ADP) یا آدنوزین مونو فسفات (AMP) هیدورلیز میشود، مقدار زیادی انرژی آزاد میگردد. این مولکول نوکلئوتیدی است که شامل یک آدنین، یک ریبوز و یک واحد تری فسفات است (شکل 3).
شکل 3: نمایی شماتیک از مولکول آدنوزین تری فسفات (ATP)
واکنشهای کاتابولیسمی، انرژی موردنیاز سلولهای بدن را از مواد غذایی مانند کربوهیدراتها، چربیها و پروتئینها آزاد و آن را به ATP منتقل میکنند. این مولکول غنی از انرژی، نوکلئوتیدی شامل یک آدنین، یک ریبوز و یک واحد تری فسفات است و هنگامی که هیدرولیز میشود، مقدار زیادی انرژی آزاد میگردد که برای پیشبرد واکنشهای مختلف در بدن انسان که محتاج به انرژی آزاد هستند، استفاده میگردد.
سایر ترکیبات فسفاتدار پر انرژی
مولکول آدنوزین تری فسفات تنها ترکیب فسفاتدار پر انرژی نیست. در واقع انرژی آزاد استاندارد هیدرولیز برخی از ترکیبات فسفریله در سیستمهای زیستی مانند فسفوانول پیروات، 1 و 3- بیس فسفو گلیسرات و کراتین فسفات نسبت به ATP بیشتر است. توان حد واسط مولکول ATP در بین سایر مولکولهای فسفریله باعث شده که ATP، شکل انرژی آزاد رایج در بدن انسان و سایر سیستمهای زیستی باشد و انرژی حاصل از کاتابولیسم به این مولکول منتقل گردد. ویژگیهای ساختاری مولکول ATP و محصولات ناشی از هیدرولیز آن باعث شده است که این مولکول بهعنوان دهنده مؤثر گروه فسفریل و دهنده سریع انرژی آزاد عمل نماید.
سوختهای اصلی متابولیک در بدن انسان
بعد از اکسیژن و آب بهعنوان مهمترین عوامل حیات، بدن انسان باید به سایر ترکیبات مانند کربوهیدراتها (قندها)، لیپیدها (چربیها)، اسیدهای چرب، پروتئینها، ویتامینها، مواد معدنی و فیبرها دسترسی داشته باشد. در این بین، کربوهیدراتها، چربیها و پروتئینها که همگی از مواد آلی هستند بهعنوان سه گروه اصلی از مواد غذایی بهشمار میآیند (شکل 4). با مصرف کافی و متعادل این منابع سوختی مهم، انرژی موردنیاز اندامها و سلوهای بدن تأمین میگردد. این سه گروه اصلی که بیشترین حجم مواد غذایی را تشکیل میدهند باید قبل از جذب و استفاده شدن، به واحدهای تشکیلدهنده خود یعنی مونوساکاریدها، اسیدهای چرب و اسیدهای آمینه هیدرولیز شوند.
شکل 4: بهطور کلی، بیشتر مواد غذایی در سه دسته اصلی کربوهیدراتها مانند شکر، قند، شکلات، خرما و عسل بهعنوان کربوهیدراتهای ساده و سیبزمینی، برنج، حبوبات، انواع نان و ماکارونی بهعنوان کربوهیدراتهای پیچیده و غذاهای حاوی نشاسته، انواع گوشت قرمز، گوشت ماهی، گوشت مرغ و تخممرغ بهعنوان گروه پروتئینها و انواع روغنهای جامد و مایع حیوانی و گیاهی، مغزها و لبنیات بهعنوان گروه چربیها طبقهبندی میشوند.
ماده سوختی مهم به نام گلوکز یا قند خون
اکثر انسانها در رژیم غذایی خود از مقادیر قابل توجهی کربوهیدارتهای پیچیده یا نشاستهای استفاده میکنند. این ترکیبات برای اینکه بهوسیله روده قابلیت جذب داشته باشند، باید به قندهای سادهتر یا مونوساکاریدها تبدیل شوند. آنزیم آمیلاز بزاق و پانکراس هیدورلیز ترکیبات نشاستهای را کاتالیز میکنند. مونوساکاریدها مانند گلوکز یا فروکتوز به درون سلولهای روده منتقل شده و سپس وارد جریان خون میشوند. گلوکز به دلایل بیوشیمیایی و ساختاری در بین سایر مونوساکاریدها، یک ماده سوختی مهم بهشمار میآید و اکثر بافتهای بدن به آن نیازمندند. از نظر اهمیت بالینی، گلوکز مهمترین مونوساکارید بوده و قسمت اصلی کربوهیدراتهای مواد غذایی بهصورت گلوکز وارد جریان خون میشوند. این مونوساکارید سوخت اصلی بافتهای بدن انسان و سایر پستانداران است. در مغز، این نیاز اساسی بوده و تنها ماده سوختی است که این اندام تحت شرایط غیر گرسنگی از آن استفاده میکند. در سلولهای قرمز خون نیز گلوکز تنها ماده سوختی است که در همه شرایط مورد استفاده قرار میگیرد. همچنین گلوکز بهعنوان سوخت عمومی جنین شناخته میشود.
سایر مونوساکاریدهای سوختی
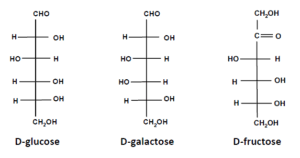
در کنار گلوکز بهعنوان مهمترین و پرمصرفترین منبع سوختی، سایر مونوساکاریدها مانند گالاکتوز و فروکتوز (قند میوه) نیز منابع سوختی مهمی هستند. نکته قابل توجه در این مورد این است که مسیرهای کاتابولیکی برای متابولیزه شدن گالاکتوز و فروکتوز وجود نداشته و لذا این دو قند باید به متابولیتهای گلوکز تبدیل شوند. به عبارت کلی، طی فرآیندهای متابولیکی، تمامی کربوهیدراتها در نهایت به گلوکز یا قند خون تبدیل شده که سوخت و ساز یا متابولیسم آن به دو طریق هوازی و بیهوازی در بدن انجام میشود. هر سه مونوساکارید گلوکز، فروکتوز و گالاکتوز در گروه مونوساکاریدهای 6 کربنی (هگزوزها) قرار میگیرند (شکل 5).
شکل 5: مونوساکاریدها بهعنوان سادهترین کربوهیدراتها، آلدئیدها یا کتونهایی هستند که دارای دو یا چند گروه هیدروکسیل میباشند. مونوساکاریدهای شش کربنی هگزوز نامیده میشوند. این مولکولها دارای چندین کربن نامتقارن بوده و نمادهای D و L نشاندهنده آرایش فضایی دورترین کربن نامتقارن از گروه آلدئیدی یا کتونی هستند. گلوکز و گالاکتوز در گروه آلدوهگزوزها و فروکتوز در گروه کتوهگزوزها طبقهبندی میشوند.
مسیر اصلی متابولیسم گلوکز موجود در رژیم غذایی
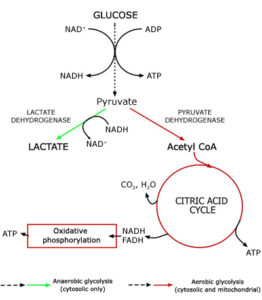
گلیکولیز، مسیر اصلی متابولیسم گلوکز و سایر مونوساکاریدها مانند فروکتوز و گالاکتوز را در رژیم غذایی فراهم میآورد. این فرآیند در انسان و بسیاری از موجودات بهعنوان یک مسیر مهم و اساسی تبدیل انرژی به حساب میآید. در این مسیر متابولیکی که کنترل آن را در سطح بافتهای ماهیچه اسکلتی و کبد میتوان در نظر گرفت، گلوکز تجزیه میشود تا ATP موردنیاز ساخته شود. این مسیر در ماهیچهها انرژی لازم جهت انقباض عضلانی را فراهم میکند و بر اساس نیاز به ATP، تنظیم میگردد. تنظیم مسیر گلیکولیز در بافت کبد نیز بسیار پیچیده است. بافت کبد در کنار بسیاری از اعمال بیوشیمیایی متنوع خود، سطح قند خون را ثابت نگاه میدارد؛ به این شکل که در هنگام افزایش قند خون آن را به شکل گلیکوژن ذخیره میکند و زمانی که سطح قند خون پایین باشد، گلوکز را از محل ذخایر خود به جریان خون رها میسازد تا انرژی موردنیاز بافتهای بدن تأمین گردد. گلیکولیز توالی از 10 واکنش است که در سیتوزول سلول روی میدهد و در نهایت گلوکز به پیرووات تبدیل شده و طی آن مولکولهای ATP تولید میشوند. پیروواتی که در سیتوزول تشکیل میشود به داخل میتوکندری منتقل شده و به طریقه اکسیداتیو به استیل کوآنزیم A دکربوکسیله شده و وارد چرخه اسید سیتریک (چرخه کربس یا چرخه اسید تری کربوکسیلیک) میشود که مسیر نهایی اکسیداسیون کربوهیدراتها، چربیها و پروتئینها و در نهایت تولید ATP است. تحت شرایط بیهوازی مثلاً در هنگام انجام فعالیتهای ورزشی قدرتی، پیرووات به لاکتات تبدیل میگردد (شکل 6).
شکل 6: خلاصهای از فرآیندهای گلیکولیز و چرخه کربس
نقش ویتامینها و مواد معدنی در کنترل متابولیسم
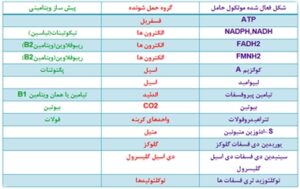
ویتامینها و مواد معدنی، ترکیباتی هستند که وجود آنها جهت انجام فعالیتهای متابولیکی و بیوشیمیایی بدن ضروری بوده و میبایست از طریق رژیم غذایی فراهم شوند. دریافت ناکافی این ترکیبات زمینهساز بیماریهای مختلف شده و زیادهروی در مصرف آنها نیز ممکن است باعث مسمومیت شود. این گروه از ترکیبات دارای نقشهای متفاوت و مهمی از جمله بهعنوان کوآنزیمها و کوفاکتورهای آنزیمی، تنظیم بروز ژن، تمایز سلولی، هوموستاز سلولی، آنتیاکسیدانی، تأمین انرژی، متابولیسم مواد سهگانه (کربوهیدراتها، چربیها، پروتئینها)، تنظیم چرخه سلولی، فعالیت شبه هورمونی و غیره هستند که خود دلیلی بر اهمیت نقش متابولیکی این ترکیبات در تأمین و تعادل انرژی است. از نقطه نظر متابولیسم تأمین انرژی، ویتامینهای گروه B مانند B1 (تیامین)، B2 (ریبوفلاوین)، B3(نیاسین) و B5(اسید پانتوتنیک) در چرخه کربس یا اسید سیتریک دارای نقشهای کلیدی هستند. اشاره شد که ATP بهعنوان واحد انرژی اصلی در سلول بوده و مولکولی غنی از انرژی است؛ به عبارت دیگر ATP یک حامل فعالشده گروههای فسفریل محسوب میشود، زیرا انتقال گروه فسفریل از این مولکول یک فرآیند انرژیزا است. نکته قابل توجه این است که بسیاری از حاملین فعالشدهای که بهعنوان کوآنزیم عمل میکنند از ویتامینهای محلول در آب بخصوص ویتامینهای گروهB مشتق میشوند (شکل 7). انواع دیگری از ویتامینها مانند ویتامینهای A،C،D،E وK نقش کوآنزیمی نداشته و دارای اعمال متفاوت دیگری هستند.
شکل 7: بسیاری از حاملین فعالشده در متابولیسم نقش کوآنزیمی دارند. کوآنزیمها که از ویتامینهای محلول در آب مشتق میشوند، مولکولهای آلی غیرپروتئینی و کوچکی هستند که میتوانند در پیشرفت واکنشها به آنزیمها کمک نموده و عملکرد آنها را تقویت نمایند. از جمله خصوصیات مهم این مولکولها، برخورداری از پایداری ترمودینامیکی است که آنزیمها را قادر میسازد تا جریان انرژی آزاد را تحت کنترل خود درآورند. از طرفی طیف گستردهای از واکنشهای متابولیکی که توسط مجموعه نسبتاً کوچکی از حاملین فعالشده انجام میشود، روند کنترل واکنشهای متابولیکی را تسهیل میبخشند.
منابع سوختی تأمینکننده انرژی در اندامهای مختلف بدن انسان
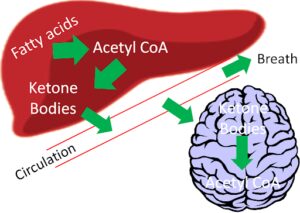
از نقطه نظر بیوشیمیایی، هر یک از اندامهای بدن انسان جهت تأمین انرژی موردنیاز خود از منابع سوختی، به شکل متفاوتی عمل مینمایند؛ بهعنوان مثال در حالت سیری و عدم نیاز به مصرف مواد غذایی، مولکول گلوکز تنها منبع سوختی برای بافت مغز است. در گرسنگیهای طولانی مدت مثل حالت روزهداری، اجسام کتونی که در بافت کبد تولید میشوند تا حدودی جایگزین گلوکز شده و بهعنوان سوخت غالب مغز به کار گرفته میشوند (شکل 8). نکته قابل توجه اینکه مغز از چربیها و اسیدهای چرب بهعنوان منبع سوختی استفاده نمیکند.
شکل 8: به هنگام گرسنگیهای طولانی مدت یا برخی از اختلالات متابولیکی مانند دیابت نوع دو کنترل نشده که غلظت اجسام کتونی تولیدشده در بافت کبد در جریان خون افزایش مییابد، بافت مغز از اجسام کتونی بهعنوان سوخت جایگزین گلوکز استفاده مینماید .
گلوکز، اسیدهای چرب و اجسام کتونی، سوختهای عمده ماهیچههای اسکلتی هستند. ماهیچههای اسکلتی بدن از گلوکز در فعالیتهای ناگهانی و از اسیدهای چرب در حالت استراحت بهعنوان سوختهای ترجیحی استفاده مینمایند. در بافت قلب برخلاف ماهیچههای اسکلتی، ذخیره گلیکوژنی وجود ندارد و اسیدهای چرب منبع اصلی سوخت قلب هستند. البته بافت قلب از اجسام کتونی و همچنین از لاکتات نیز بهعنوان منابع سوختی استفاده مینماید. در بافت چربی، تری آسیل گلیسرولهای ذخیرهشده، بهعنوان منبع مهم سوختی بهشمار میآیند. در کلیهها، ریهها، گلبولهای قرمز و دستگاه گوارش نیز گلوکز بهعنوان منبع سوختی اصلی بهشمار میآید. بافت کبد که نقشی استراتژیک و اساسی در کنترل و یکپارچگی متابولیسم بدن ایفا مینماید، برای تأمین انرژی موردنیاز خود تا حد امکان در مصرف مواد سوختی مانند گلوکز صرفهجویی کرده و فعالیتهای متابولیکی متنوع آن بیشتر در جهت حمایت، پشتیبانی و تأمین انرژی سایر اندامها مثل مغز و ماهیچهها است. به منظور برآورده کردن نیازهای گلوکز سایر اندامها، بافت کبد به سرعت میتواند ذخایر گلیکوژن خود را طی فرآیند گلیکوژنولیز تجزیه نموده و گلوکونئوژنز که فرآیند ساخت گلوکز از پیشسازهای غیر کربوهیدراتی است را انجام دهد، همچنین کبد نقشی مهم در تنظیم متابولیسم چربیها ایفا مینماید. در حالت سیری و عدم نیاز غذایی، اسیدهای چرب سنتزشده در بافت کبد به بافت چربی فرستاده میشوند. در حالت گرسنگی طولانی مدت، اسیدهای چرب توسط کبد به اجسام کتونی تبدیل میشوند.
عدم استفاده بافتهای بدن از آمینواسیدها بهعنوان منابع سوختی
اگرچه پروتئینها بخصوص در بافت ماهیچه از ذخایر سوختی محسوب میشوند، ولی استفاده از این ماکرومولکولها جهت تأمین انرژی موردنیاز بافتهای بدن، تهدیدی جدی برای حیات انسان است، بنابراین مکانیسمهایی هوشمندانهای برای جلوگیری از مصرف آمینواسیدها بهعنوان منابع سوختی در بدن انسان طرحریزی شده است، بهعنوان مثال در طی گرسنگیهای طولانی مدت، مکانیسمهای کنترل متابولیسم، مصرف سوخت را به سمت استفاده بیشتر از چربیها سوق میدهد و با راهکارهایی مانند اکسیداسیون اجسام کتونی در بافت مغز در مجموع به حفظ و نگهداری پروتئینها کمک مینمایند. وجود آمینواسیدها برای سنتز پروتئینها و همچنین بهعنوان پیشساز ترکیبات مهمی دیگر چون پورینها، پیریمیدیدنها و هورمونهایی مانند اپینفرین، تیروکسین و نوروترانسمیترها و غیره ضروری است. برخی از این آمینواسیدها که بافتهای بدن قادر به سنتز آنها نیستند و بهعنوان اسیدهای آمینه ضروری شناخته میشوند، لازم است تا از طریق مصرف مواد غذایی تأمین شوند. بیشتر آمینواسیدهای دریافتی از رژیم غذایی و یا حاصل از تجزیه پروتئینهای بافتی به همراه گلیسرول حاصل از تجزیه تری آسیل گلیسرولها میتوانند در فرآیند گلوکونئوژنز مورد استفاده قرار گیرند. آمینواسیدهایی که تولید استیل کوآنزیم A میکنند، تحت عنوان اسیدهای آمینه کتوژنیک خوانده میشوند. در شرایط روزهداری و گرسنگی طولانی مدت، از استیل کوآنزیم A برای سنتز اجسام کتونی در کبد استفاده میشود. بافت کبد در متابولیسم آمینواسیدهای مواد غذایی یک نقش اساسی ایفا میکند. اولویت استفاده از آمینواسیدها بهجای کاتابولیسم، بهکارگیری آنها در سنتز پروتئینها است؛ بنابراین آمینواسیدها بهجای استفاده بهعنوان یک ماده سوختی به سمت سنتز پروتئینهای موردنیاز بدن هدایت میشوند. نکته قابل توجه اینکه آلفا کتواسیدهای ناشی از تجزیه آمینواسیدها خود از مواد سوختی کبد بهشمار میآیند.
کنترل متابولیسم در حالتهای سیری و گرسنگی
هورمونهای انسولین و گلوکاگون دو تنظیمکننده مهم متابولیسم بدن انسان در شرایط سیری یا حالتی که پس از مصرف مواد غذایی وجود دارد، هستند. در واقع ترشح هورمون انسولین که به روشهای گوناگونی ذخیرهسازی مواد سوختی و سنتز پروتئینها را تحریک میکند پیامآور حالت سیری است. هنگامی که پس از صرف غذا، سطح گلوکز خون افزایش مییابد، ترشح انسولین و افزایش غلظت آن ورود گلوکز به بافت ماهیچه را افزایش داده و باعث تحریک سنتز گلیکوژن در ماهیچهها میشود، همچنین سطح بالای انسولین باعث ورود گلوکز به بافت چربی شده و گلیسرول 3- فسفات موردنیاز در سنتز تری آسیل گلیسرولها را فراهم میآورد. فعالیت انسولین در متابولیسم آمینواسیدها و پروتئینها نیز مؤثر است. این هورمون برداشت آمینواسیدهای شاخهدار مانند والین، لوسین و ایزولوسین را توسط ماهیچهها افزایش داده و ساخته شدن پروتئین در ماهیچهها را تسهیل مینماید. در حالت گرسنگی اولیه و کاهش سطح گلوکز خون، ترشح هورمون گلوکاگون باعث تجزیه ذخایر گلیکوژن شده و به دنبال آن مقادیر زیادی گلوکز از کبد به خون آزاد میشود. ورود گلوکز به ماهیچهها و بافت چربی در پاسخ به سطح پایین انسولین کاهش مییابد. در شرایط سیری و پس از صرف یک وعده غذایی، ذخایر کافی کربوهیدرات وجود دارد و سوخت متابولیکی برای بیشتر بافتهای بدن، گلوکز است. در حالت گرسنگی شدید و روزهداری، گلوکز باید برای استفاده مغز و گلبولهای قرمز که هر دو به مقادیر زیادی وابسته به گلوکز هستند، تقسیم شود؛ بنابراین بافتهایی مانند ماهیچهها و کبد که میتوانند از سوختهای متابولیکی دیگر بهجز گلوکز بهرهمند شوند، از اسیدهای چرب بهعنوان سوخت استفاده میکنند، همچنین، کبد اجسام کتونی را از اسیدهای چرب ساخته و به عضله و سایر بافتها میفرستد.
اهمیت وعده صبحانه در تنظیم متابولیسم بدن
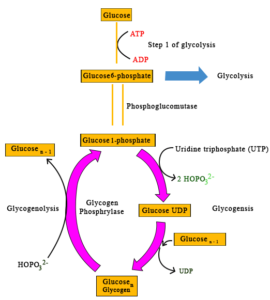
اگرچه اندامهای مختلف بدن به هنگام استراحت و خواب شبانه به مانند روز و بیداری فعال نیستند، ولی کماکان برای ادامه حیات، وظایف خود را به آرامی انجام میدهند؛ بنابراین هر یک از اندامهای بدن مانند مغز، قلب، ریهها، دستگاه گوارش، کبد، کلیهها و حتی ماهیچههای بدن در طول شب و حین خواب جهت انجام اعمال خود به انرژی نیاز دارند. اشاره شد که گلوکز یا قند خون بهعنوان مهمترین منبع سوختی برای سلولهای بدن است و مصرف مقدار کافی و متعادل آن برای تأمین انرژی ضروری است. مولکولهای گلوکز در بافت کبد طی فرایند گلیکوژنز به شکل گلیگوژن ذخیره شده و در زمان نیاز به انرژی، مثلاً بین وعدههای غذایی، هنگامی گرسنگی یا روزهداری و خواب شبانه، زنجیرههای گلیکوژن طی فرآیند گلیکوژنولیز شکسته شده و جهت تأمین انرژی به واحدهای منفرد گلوکز تبدیل میشوند (شکل 9).
شکل 9: خلاصهای از دو فرآیند گلیکوژنز و گلیکوژنولیز
همانطوریکه قبلاً نیز اشاره شد، بهجز حالت گرسنگیهای طولانی مدت، تنها ماده سوختی مغز انسان گلوکز است. از طرفی مغز فاقد هرگونه ذخیره سوختی بوده و بدین ترتیب به ذخیرهای همیشگی از گلوکز نیازمند است. در گرسنگیهای طولانی مدت و یا به هنگام خواب شبانه به دلیل عدم مصرف مواد غذایی و کاهش میزان قند خون و متعاقب آن کاهش ذخایرِ گلیکوژن در بافت کبد، سیستم ایمنی بدن انسان بهطور هوشمندانهای احساس خطر کرده و در مصرف سوخت گلوکز و ذخایر آن صرفهجویی مینماید. به همین دلیل گنجاندن مواد غذایی شیرین مانند عسل و خرما در وعده صبحانه توجیه مناسبی برای افزایش میزان قند خون و تأمین انرژی موردنیاز بدن برای ادامه فعالیتهای روزانه است. بر همین اساس، با حذف اشتباه وعده صبحانه یا مصرف اندک آن که متأسفانه در برخی از رژیمهای غذایی دیده میشود، علاوه بر اینکه انرژی موردنیاز برای سلولهای بدن در طول روز تأمین نمیگردد و باعث خستگی و افت کیفیت کار و فعالیت روزانه افراد میشود، با کاهش یافتن متابولیسم و سوخت و ساز بدن که به دلایل سیستم ایمنی ذکر شد، زمینه برای مصرف بیشتر مواد قندی و شیرینیها در طول روز فراهم شده و در نهایت ریسک ابتلا به چاقی را افزایش میبخشد. علاوه بر این، عدم تأمین سطوح کافی و متعادل از گلوکز در رژیم غذایی روزانه بر کیفیت خواب شب نیز اثر گذاشته و اثرات منفی آن بر فعالیتهای انسان در ساعات بیداری و روز مشاهده خواهد شد. توجه به ساعت بیولوژیک یا ساعت زیستی بدن نیز که کنترلکننده چرخهای از فرآیندهای متابولیکی و بیوشیمیایی مانند ترشح هورمونها، سیری، گرسنگی، خواب و غیره است و تحت عنوان چرخه روزانه یا سیرکادین (Circadian rhythm) نامیده میشود، نیز در روند کنترل متابولیسم و تعادل انرژی حائز اهمیت است. عادت به تغذیه بیبرنامه و صرف وعدههای غذایی بدون توجه به ساعت زیستی بدن، علاوه بر به هم خوردن تعادل هورمونها و اختلال در روند فرآیندهای متابولیکی زمانبندیشده مانند چرخه خواب، زمینهساز چاقی و سایر اختلالات متابولیک است. بدیهی است زمانی که از مصرف مواد غذایی از جمله ترکیبات قندی صحبت میکنیم، اصل بر وجود یک بدن سالم و طبیعی است، چرا که در افرادی که دارای بیماریهای زمینهای مانند دیابت، قلبی و عروق و غیره هستند، الگوی مصرف مواد غذایی متفاوت و با نظر پزشک معالج تعیین میشود؛ بنابراین مطابق با اصل تنوع و تعادل در رژیم غذایی، همانطوریکه مصرف بیش از حد مواد غذایی برای سلامتی انسان خطرآفرین است، مصرف ناکافی نیز با میتواند باعث بروز مشکلات جدی در بدن انسان شود.
کنترل متابولیسم به هنگام کاهش ذخایر گلیکوژن کبدی
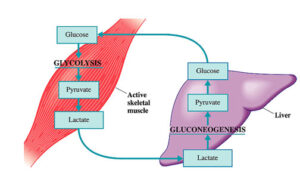
اشاره شد که فرآیند گلیکولیز در بسیاری از موجودات از جمله انسان یک مسیر تبدیل انرژی بوده و طی واکنشهای متوالی جهت تولید ATP، مولکول گلوکز تجزیه و به پیرووات تبدیل میشود، همچنین در شرایط بیهوازی و در برخی میکروارگانیسمها، محصول نهایی لاکتات است که یک نقطه پایانی در متابولیسم بوده و بهعنوان یک منبع انرژی برای برخی اندامها بهشمار میآید. طی فرآیندی به نام گلوکونئوژنز، سنتز گلوکز از منابع غیر کربوهیدراتی مانند لاکتات، آمینواسیدها و گلیسرول میسر میگردد. فرآیند گلوکونئوژنز بخصوص در طی گرسنگیهای طولانی مدت و روزهداری و با توجه به اینکه گلوکز بهعنوان سوخت اصلی مغز است و همچنین سلولهای قرمز خون تنها گلوکز را بهعنوان سوخت مورد استفاده قرار میدهند، بسیار حائز اهمیت است. تعدادی از واکنشهایی که پیرووات را به گلوکز تبدیل میکنند با مسیر گلیکولیز مشترک هستند. جایگاه اصلی گلوکونئوژنز، کبد بوده و وجود آن به حفظ سطح قند خون و تأمین منابع انرژی برای فعالیت اندامهایی چون مغز و عضلات کمک مینماید. ترکیبات اصلی برای فرآیند گلوکونئوژنز در بافت کبد عبارتند از لاکتات و آلانین که در عضلات اسکلتی از پیرووات تولید میشوند. طی فرآیندی تحت عنوان چرخه کوری، لاکتات تشکیل شده در عضلات فعال، توسط کبد به گلوکز تبدیل میشود (شکل 10).
شکل 10: چرخه کوری
عضله اسکلتی در حال انقباض، لاکتات را در اختیار کبد قرار میدهد و این اندام از آن برای سنتز گلوکز استفاده مینماید. این چرخه بخشی از بار متابولیکی عضله را به کبد جابهجا میکند
تعادل انرژی و تنظیم وزن بدن
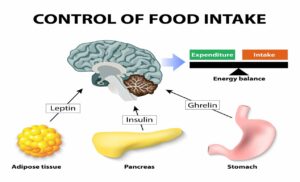
یکی از مهمترین عوامل تهدیدکننده سلامت بشر چاقی و اضافه وزن است که بخصوص در جوامع پیشرفته به یک اپیدمی تبدیل شده است. افزایش مصرف مواد غذایی پرکالری و عدم فعالیت فیزیکی که منجر به عدم تعادل بین کالری دریافتی و کالری مصرفی میشود، از دلایل اصلی بروز چاقی و اضافه وزن است. این کالری اضافی که بهصورت چربی در بدن انسان ذخیره میشود، بهعنوان یک عامل خطر در بروز بیماریهایی مانند دیابت، فشارخون، قلبی و عروقی، انواع سرطان و اختلالات عضلانی و اسکلتی شناخته میشود. تغییر در سبک زندگی و رعایت یک رژیم غذایی متنوع و متعادل در کنار انجام فعالیتهای ورزشی متناسب و مداوم و کنترل هوشمندانه استرس، ابزار مناسبی جهت کنترل سوخت و ساز و ثابت نگهداشتن سطح انرژی و کنترل اشتها در بدن انسان است. بافت چربی که حین چاقی و اضافه وزن افزایش مییابد، از سلولهایی به نام آدیپوسیتها تشکیل یافته که جهت ذخیرهسازی انرژی به بهترین شکل ممکن تخصص یافتهاند. اهمیت وجود این سلولها در این است که با ذخیره کردن انرژی بهصورت مولکولهای چربی باعث میشوند که انسان و سایر جانداران برای کسب انرژی موردنیاز خود، دائماً در حال مصرف مواد غذایی نباشند و این کار در وعدههای زمانی مشخصی در طول شبانهروز انجام شود. نکته مهم و حیاتی در قابلیت ذخیرهسازی انرژی اضافی در بافت چربی این است که در صورت اختلال در این فرآیند، تجمع چربی در سایر بافتهای بدن اتفاق افتاده و منجر به بروز انواع بیماریها مانند کبد چرب میشود که تهدیدکننده جدی برای سلامتی انسان است. بر اساس این رویکرد، به نظر میرسد که وجود بافت چربی در حالت فیزیولوژیک میتواند از تجمع چربی اضافی در سایر سلولها ممانعت کرده و به حفظ تعادل انرژی و عملکرد مطلوب سایر بافتها کمک نماید. در این بین مدیریت سیستم عصبی، سیستم غدد درونریز و سیستم ایمنی بهعنوان سه ضلع یک مثلث و ارتباط و هماهنگی آنها نقش مهمی را در کنترل اشتها، تنظیم تعادل انرژی و وزن بدن انسان ایفا مینمایند. بر همین اساس هنگامی که بدن انسان در حالت گرسنگی قرار دارد و یا زمانی که میزان کالری مصرفشده از کالری دریافتی بیشتر باشد، ترشح هورمونی به نام لپتین که گاهی هورمون سیری نیز نامیده میشود از سلولهای بافت چربی کاهش مییابد. سطوح کاهشیافته هورمون لپتین که میزان ترشح آن توسط بافت چربی، نسبت مستقیم با توده چربی بدن دارد، میتواند باعث افزایش اشتها و میل به مصرف مواد غذایی گردد. این هورمون با ارسال پیام به هیپوتالاموس در مغز اشتها را کنترل نموده و جهت تنظیم میزان انرژی مصرفی در روز، به مغز کمک میکند. از نکات قابل توجه در افرادی که دچار عارضه چاقی هستند، کاهش حساسیت به لپتین و افزایش مقاومت به این هورمون است که باعث ایجاد اختلال در فرآیند انتقال سیگنال شده و به عبارتی، پیام توقفِ خوردن به مغز نمیرسد. این موضوع میتواند زمینهساز بروز سایر بیماریهای متابولیک مانند مقاومت به انسولین یا سندرم متابولیک شود که در آن غلظت قند خون و انسولین به میزان قابل توجهی افزایش مییابد. مصرف متعادل کربوهیدراتها از جمله فروکتوز و ساکارز و کاهش مصرف نوشیدنیهای قندی و چربیهای با ترانس بالا میتواند به تعدیل میزان انسولین و بهبود وضعیت هورمون لپتین کمک نماید.
لازم به ذکر است که دو هورمون انسولین و لپتین در تنظیم هموستازی انرژی و کنترل اشتها نقش مهمی بر عهده دارند. انسولین هورمونی است که توسط سلولهای بتا در لوزالمعده تولید میشود و اصلیترین هورمون جهت ذخیره شدن چربی در بدن است. از طرفی، هورمونی به نام گرلین یا هورمون گرسنگی، هنگامی که معده خالی است، ترشح میشود که عملکرد آن رساندن پیام گرسنگی به هیپوتالاموس مغز است. پایین بودن این هورمون در افراد چاق چه در حالت گرسنگی و چه بعد از صرف غذا، باعث اختلال در ارسال پیام سیری و توقف خوردن به هیپوتالاموس میشود (شکل 11).
شکل 11: نقش هورمونهای لپتین، انسولین و گرلین در تعادل انرژی
کنترل متابولیسم در حین فعالیتهای ورزشی
ورزشکاران جهت عملکرد مطلوب و استفاده بهینه از حداکثر توان بدنی خود نیازمند به انتخاب مواد سوختی مناسب جهت تأمین انرژی موردنیاز ماهیچههای اسکلتی در حین فعالیتهای بدنی اعم از هوازی یا بیهوازی هستند. هوازی یا بیهوازی بودن فعالیتهای ورزشی به نوع واکنشهای متابولیکی که انرژی موردنیاز ماهیچهها را تولید میکنند، مرتبط است. نوع مواد سوختی جهت تأمین انرژی موردنیاز ورزشکار بر اساس شدت و مدت زمان فعالیت ورزشی متفاوت است. از نقطه نظر بیوشیمیایی، فعالیت انقباضی و تأمین انرژی حرکتی ماهیچهها مستلزم اتصال پروتئینهای حرکتی از جمله میوزین به مولکولهای ATP و هیدرولیز آن است. نکته قابل توجه در حین انجام ورزشهای هوازی و استقامتی مانند دوی ماراتن یا ورزشهای بیهوازی و قدرتی مانند دوی 100 متر، نحوه تولید مقادیر لازم از مولکولهای ATP جهت تأمین نیروی کافی برای فعالیت انقباضی ماهیچهها در بازه زمانی مناسب است. همانطوریکه قبلاً نیز اشاره شد، توان حد واسط مولکولهای ATP در بین سایر مولکولهای فسفریله باعث شده که ATP شکل انرژی آزاد رایج در سیستمهای زیستی باشد، ولی این مولکول تنها ترکیب فسفاتدار پر انرژی نیست و ترکیبات دیگری مانند کراتین فسفات (فسفوکراتین) نیز وجود دارند که قادر به انتقال سریع گروه فسفریل به مولکول ADP و تولید ATP هستند. از طرفی ذخایر ATP و کراتین فسفات در ماهیچهها محدود بوده و تنها ظرف چند ثانیه مصرف میشوند، از این رو جهت حفظ سرعت و قدرت عضلانی در طول یک فعالیت ورزشی قدرتی مثل دوی سرعت 100 متر که تنها چند ثانیه زمان لازم دارد، لازم است تا منابع سوختی دیگری بهجز ATP ذخیره شده و کراتین فسفات مورد استفاده قرار گیرند، بر همین اساس، گلیکولیز بیهوازی ذخایر گلیکوژن ماهیچهها و تولید لاکتات میتواند به تولید مقادیر بیشتری از ATP کمک نماید؛ بنابراین، ماده سوختی اصلی در شروع یک فعالیت ورزشی یا در طی ورزشهای بیهوازی، قدرتی و سنگین از گلیکوژن ماهیچهها تأمین میشود. در طی ورزش بیهوازی، ذخایر گلیکوژن کبد و ماهیچه به علت آزادسازی کاتکول آمینها کاهش مییابد. میزان ذخایر گلیکوژن بافت ماهیچه تا حد زیادی به رژیم غذایی وابسته است. انتخاب یک رژیم غذایی با مقادیر کافی از کربوهیدراتها در حفظ مقادیر گلیکوژن ماهیچهها در طول ورزشهای بیهوازی و سنگین مؤثر است؛ در مقابل به جهت مصرف سریع ذخایر ATP و کراتین فسفات و همچنین ایجاد اسیدوز لاکتیک که یک عامل محدودکننده برای پیشرفت گلیکولیز در ورزشهای بیهوازی محسوب میشود، در ورزشهای هوازی و طولانی مدت نیازی به تولید مولکولهای ATP از طریق انجام واکنشهای بیهوازی نیست؛ بهعنوان مثال، یک دونده ماراتن که باید مسافتی حدود 42 کیلومتر را ظرف مدت زمان 2 ساعت طی نماید، به مواد سوختی دیگری نیاز دارد. در فعالیتهای هوازی، بخشی از ATP موردنیاز میبایست از اکسیداسیون کامل گلیکوژن ماهیچه و کبد تأمین شود که باز هم جوابگوی ATP موردنیاز برای یک فعالیت مستمر 2 ساعته نبوده و در اینجا اهمیت بافت چربی و هماهنگی آن با بافتهای ماهیچه و کبد مشخص میشود. تولید ATP موردنیاز برای فعالیتهای ورزشی طولانی مدت مانند دوی ماراتن از اکسیداسیون اسیدهای چرب حاصل از تجزیه چربیها در بافت چربی حاصل میشود (شکل 12). نکته بسیار مهم و حیاتی در حین فعالیتهای طولانی مدت ورزشی، نحوه استفاده ترکیبی بهینه از مواد سوختی است تا علاوه بر برقراری تعادل انرژی و عملکرد مطلوب در طول فعالیت ورزشی، در انتها مقادیر کافی از قند خون در اختیار ورزشکار وجود داشته باشد؛ به عبارت دیگر در حین انجام فعالیتهای ورزشی طولانی مدت و هوازی هیچ سوختی بهطور انحصاری مصرف نشده و بافت ماهیچه از همه منابع سوختی در زمانهای مناسب به شکل بهینه استفاده میکند. سطح پایین قند خون و افزایش ترشح هورمون گلوکاگون نسبت به هورمون انسولین باعث آزاد شدن اسیدهای چرب از بافت چربی و ورود آنها به ماهیچهها میشود. با اکسیداسیون اسیدهای چرب، ورود گلوکز به چرخه کربس کاهش یافته و تعادل غلظت قند خون در پایان فعالیت طولانی مدت ورزشی حفظ میشود.
شکل 12: در ورزشهای قدرتی مانند دوی 100 متر انرژی موردنیاز ورزشکار از ATP ذخیره شده، کراتین فسفات و گلیکولیز بیهوازی ذخایر گلیکوژن ماهیچهها تأمین میشود. در ورزشهای استقامتی مانند دوی ماراتن، منابع اصلی تأمینکننده انرژی ورزشکار از اکسیداسیون ذخایر گلیکوژن عضلات، کبد و اسیدهای چرب مشتق شده از بافت چربی تأمین میگردد؛ بنابراین منابع تأمینکننده انرژی در ورزشکاران، بر اساس شدت فعالیت ورزشی و مدت زمان آن تعیین میشود.
کنترل متابولیسم در حالت تروما
در علم پزشکی هر نوع ضربه، شوک و آسیب که از خارج به بدن وارد شود مانند سوختگی، شکستگی یا جراحت، تروما (Trauma) نامیده میشود. آگاهی از تغییرات متابولیکی و نوع نیازهای تغذیهای در شرایط تروما، در تسریع روند بهبود بیماران از اهمیت بسزایی برخوردار است؛ بهعنوان مثال یکی از تغییرات مهم و حیاتی در حین یک ترومای شدید، کاهش وزن به علت افزایش کاتابولیسم پروتئینهای بافتی است که معمولاً به دنبال استراحتهای طولانی مدت در بستر و به دلیل آتروفی عضلات پدید میآید. این روند باعث ایجاد موازنه منفی نیتروژن در بیماران شده که میبایست در طول دوره نقاهت با انتخاب یک رژیم غذایی مناسب برطرف گردد. نکته قابل توجه این است که علیرغم افزایش تجزیه پروتئینها در طول تروما که خود به دلیل افزایش روند گلوکونئوژنز است، لیکن پروتئینها بهعنوان منبع اصلی تأمین انرژی محسوب نمیشوند. تحت این شرایط نیز به مانند وضعیت گرسنگی شدید، چربیهای موجود در بافت چربی بهعنوان منبع عمده انرژی عمل مینمایند. دانستن این تغییرات متابولیکی به انتخاب یک رژیم غذایی مناسب جهت تسریع روند بهبود بیماران کمک مینماید. انتخاب یک رژیم غذایی مناسب که بتواند پروتئینهای کافی را به بدن بیمار برساند، در بازگرداندن وزن از دست رفته بیمار و ایجاد موازنه مثبت نیتروژن راهگشا خواهد بود. لازم به ذکر است که کمبود آمینواسیدها میتواند منجر به توازن منفی نیتروژن در بدن انسان شود. در این حالت پروتئینهای بیشتری تجزیه میگردد و در نتیجه دفع نیتروژن از جذب آن بیشتر میشود. در بدن انسان برخی از آمینواسیدها که به نام آمینواسیدهای ضروری شناخته میشوند، میبایست از طریق رژیم غذایی دریافت گردند. مابقی آمینواسیدها که غیرضروری هستند در بدن انسان و از حدواسطهای چرخه کربس و سایر مسیرها ساخته میشوند (شکل 13). نیتروژن یک جزء اصلی از آمینواسیدها است و منبع آن برای تمام آمینواسیدها به شکل آمونیاک است. آمینواسیدها که اجزای ساختمانی پروتئینها هستند برای بسیاری از مولکولهای مهم دیگر نیز مانند نوکلئوتیدها و نوروترانسمیترها بهعنوان منبع نیتروژن هستند. اسکلت کربنی آمینواسیدها نیز از مسیر گلیکولیزی، مسیر پنتوز فسفات یا چرخه کربس حاصل میشود. بیوسنتز آمینواسیدها ارتباط تنگاتنگی با تغذیه دارد، زیرا بدن انسان توانایی تولید برخی از آمینواسیدها را ندارد و بنابراین باید مقادیر کافی را از طریق رژیم غذایی مناسب دریافت نماید.
شکل 13: اسیدهای آمینه ترکیباتی هستند که از اتمهای نیتروژن، کربن، هیدروژن و اکسیژن تشکیل میشوند. بدن انسان برای رشد و عملکرد مناسب نیاز به ۲۰ اسیدآمینه متفاوت دارد. ۹ اسید آمینه شامل هیستیدین، ایزولوسین، لوسین، لیزین، متیونین، فنیلآلانین، ترئونین، تریپتوفان و والین بهعنوان اسیدهای آمینه ضروری طبقهبندی میشوند که برخلاف اسیدهای آمینه غیرضروری، بدن قادر به سنتز آنها نبوده و باید از طریق رژیم غذایی و یا مکملهای غذایی دریافت شوند. آرژنین، آمینواسیدی است که در یک فرد بالغ مقادیر کافی آن از طریق چرخه اوره تأمین میگردد ولی این مقدار برای یک کودک در حال رشد کافی نیست و باید از طریق خوراکی تأمین گردد.
بحث و نتیجهگیری
حیات انسان بعد از نیاز به آب و اکسیژن، به مصرف ترکیباتی مانند کربوهیدراتها، چربیها، پروتئینها، فیبرها، ویتامینها و مواد معدنی وابسته است که میبایست از طریق مصرف مواد غذایی مختلف تأمین شوند. فعالیتهای مختلف روزانه اعم از جسمی و فکری و همچنین فعالیت ارگانهای داخلی بدن مانند مغز، قلب، ریهها، کلیهها، کبد، ماهیچهها و غیره نیاز به انرژی دارد. دریافت انرژی موردنیاز فرآیندهای حیاتی با تغذیه متناسب و کافی مبتنی بر اصل تنوع و تعادل مواد غذایی تأمین خواهد شد. عملکرد مطلوب فرآیندهای متابولیکی و سوخت و ساز سلولی که به استفاده از منابع غذایی بهعنوان مواد سوختی و دریافت انرژی موردنیاز از آنها وابسته است، تضمینی بر تندرستی و سلامت جسم و روح در دورانهای مختلف زندگی انسان است. سلولهای بدن انسان جهت انجام فعالیتهای خود و حفظ فرآیندهای حیاتی، از مولکولهای ATP بهعنوان انرژی رایج و عمومی استفاده میکنند. از نقطه نظر ترمودینامیکی، استفاده بهینه از منابع سوختی، جهت تأمین انرژی و حفظ تعادل آن موضوعی مهم و حیاتی است که میتواند به کاهش بینظمی یا آنتروپی در بدن انسان کمک نماید. موضوع عدم تعادل انرژی و زیادهروی در مصرف مواد غذایی و تولید رادیکالهای آزاد و ذخیره شدن بیش از حد انرژی در سلولهای بدن که منجر به چاقی، دیابت، بیماریهای قلبی و عروقی، برخی از انواع سرطانها و غیره میشود تا فقر غذایی به علت تخلیه منابع انرژی بدن که میتواند به اختلالات رشد و نقص سیستم ایمنی منجر شود، امروزه به یک چالش اساسی و تهدیدکننده سلامتی انسان در سطح جهان تبدیل شده است. بر اساس ترکیبات موجود در مواد غذایی، مسیرهای متابولیکی شامل مسیرهای آنابولیکی، کاتابولیکی و آمفیبولیکی در بافتهای بدن تعیین میشوند. افزایش آگاهی ما از نقش مواد سوختی مختلف و تغییرات متابولیسمی طبیعی بدن مانند آنچه در شرایط سیری و گرسنگی و فعالیتهای ورزشی هوازی و بیهوازی اتفاق میافتد، زمینه مناسبی را برای درک بهتر شرایط متابولیسمی بدن در حالتهای غیرطبیعی و بیماری فراهم میآورد. بافتهای کبد و ماهیچههای اسکلتی، انرژی را بهصورت مولکولهای قند و بافت چربی انرژی را بهصورت مولکولهای چربی در خود ذخیره میکنند. قندها و چربیها مهمترین مولکولهای انرژیزا محسوب شده و در کنترل متابولیسم، تعادل انرژی و عملکرد سلولهای بدن دارای نقش کلیدی هستند، لیکن تداوم ذخیرهسازی و بیش و کم هر یک منجر به بر هم ریختن هموستازی کالریک و ایجاد اختلالات متابولیکی خواهد شد، بهعنوان مثال افزایش گلوکز بیش از نیاز سلولها، منجر به بیماری دیابت و افزایش بیش از حد چربی منجر به چاقی و زمینهساز بیماریهای قلبی و عروقی و غیره است، لذا کافی بودن مقدار انرژی دریافتی موجود در رژیم غذایی جهت عملکرد مطلوب اندامهای مختلف بدن و توجه به رعایت اصل تنوع و تعادل غذایی و همچنین تناسب غذایی بر حسب سن، جنس، میزان فعالیت بدنی و سایر شرایط فیزیولوژیکی در کنار سایر پارامترهای سبک زندگی متعادل، ابزاری مهم در کنترل متابولیسم و حفظ تعادل انرژی و در نهایت رفاه جسم و روح انسان است.
References:
- Biochemistry, 6TH Edition, 2007, by Jeremy M. Berg, John L.Tymoczko & Lubert Stryer
- 2. Harper’s Illustrated Biochemistry, 28TH TH Edition, 2009 by Robert K. Murray, David A. Bender, Kathleen M. Botham, Peter J.Kennelly, Victor W.Rodwell, P. Anthony Weil
- Henry’s Clinical Diagnosis and Management by Laboratory Methods, 21TH, 2007 by Matthew R. Pincus Richard A. McPherson
- Tietz Textbook of Clinical Chemistry and Molecular Diagnostics, 4TH Edition, 2006 by Carl A. Burtis, David E Bruns & Edward R Ashwood
متابولیسم کربن و انرژی باکتریهای بیهوازی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام