لیشمانیا و ساز و کارهای گریز از سیستم ایمنی انسان
محسن قماشلویان1– فاطمه اسکندری غریبوند1– دکتر سیدحسین حجازی2– دکتر ناهید اسکندری3
1. دانشجوی کارشناسی ارشد انگل شناسی دانشگاه علوم پزشکی اصفهان
2. عضو هیئت علمی و استاد مرکز تحقیقات پوست و سالک دانشگاه علوم پزشکی اصفهان
3. عضو هیئت علمی گروه ایمنی شناسی دانشگاه علوم پزشکی اصفهان
لیشمانیوز جلدی با تلقیح انگل لیشمانیا به وسیلهی پشه خاکی به انسان ایجاد میشود و سالهاست در کشور ما و بسیاری از نقاط دنیا یک معضل بهداشتی به حساب میآید و تاکنون هزینههای زیادی برای کنترل و پیشگیری از آن صرف گردیده است. زخمهای جلدی ناشی از این بیماری به علت طولانی بودن دورهی ترمیم و جوشگاهی که از خود به جای میگذارند باعث آزار جسمی و روحی مبتلایان میشود و ترس از ابتلا به این بیماری همواره در ساکنان مناطق اندمیک وجود دارد به طوری که محققین این بیماری را در ردیف Social Disease طبقه بندی کردهاند.
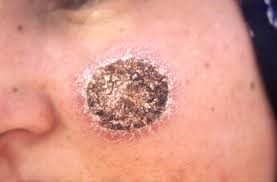
تصویر 1: جوشگاه ناشی از عفونت با انگل لیشمانیا روی صورت بیمار
تحقیقاتی که تاکنون در مورد این بیماری صورت گرفته است بیشتر بر تولید واکسن و داروهای ضد انگلی متمرکز بوده است، از طرف دیگر زخم جلدی لیشمانیا معمولاً زخمی خود محدود است و حتی بدون درمان ضد انگلی بعد از چند ماه بهبود مییابد، بنابراین مشکل اساسی در این زمینه دورهی طولانی زخم و جوشگاه ناشی از آن است که اگر به نحوی این مشکل کنترل شود این بیماری چندان آزار دهنده به نظر نمیرسد. برای رسیدن به این هدف بررسی مکانیسم ایجاد زخم لیشمانیا و عوامل دخیل در ترمیم آن لازم است.
فرآیند ایجاد و ترمیم زخم در لیشمانیوز هر دو به واکنش ایمنی میزبان نسبت به انگل بستگی دارد و سیستم ایمنی اگر چه برای حذف انگل لازم است، خود عامل اصلی ایجاد زخم لیشمانیایی است و شاهد آن عدم وجود زخم در بیماران دارای اشکال لوپوئید و مبتلایان به ایدز میباشد. همچنین بقای انگل در محل جوشگاه زخم تا سالها پس از التیام بیماری نشان میدهد که ترمیم زخم تنها به حذف انگل وابسته نیست و وجود انگل نیز برای ایجاد زخم کافی نیست بلکه نحوهی پاسخ سیستم ایمنی فرد به انگل است که باعث ایجاد زخم میشود.
از آن جا که انگل لیشمانیا یک انگل درون سلولی است و در بدن میزبان مهرهدار، تنها در سلولهای سیستم ایمنی بخصوص ماکروفاژها قادر به ادامهی زندگی و تکثیر است، بنابراین برهمکنش آن با سلولهای مجاور تنها از طریق تغییر رفتار سلولهای ایمنی امکان پذیر است و در واقع ماکروفاژها واسطهای برای مخابرهی پیام انگل به محیط خارج سلول هستند.
طی عفونت با انگل لیشمانیا و متعاقب درمان بیماری، اغلب شاهد یک ایمنی مادامالعمر در برابر گونههای مشابه، بعد از درمان عفونت هستیم. مطالعات صورت گرفته روی موش و انسان پیرامون پاسخ ایمنی علیه لیشمانیا به منظور درک دلایل عدم وجود پیشرفت در تولید واکسن بر علیه این بیماری مفید بوده است. اکثر مطالعات انجام شده روی موشها صورت میگیرد که با تزریق یک دوز بالا (105 ×2 تا 107 ×2 پروماستیگوت در فاز سکون) به صورت زیر جلدی به موش موفق به ایجاد عفونت میشویم.
آنچه حائز اهمیت است این است که اساس واکنشها به این عفونت را زیرمجموعههای سلولهای T کمکی (T helper) تشکیل میدهند و به عبارت دیگر اساس نتایج مطالعات ما در حساسیت یا مقاومت موشهای خالص (inbred) به لشمانیا ماژور هستند.
در سویه های آلوده کننده موش، موشهای BALB/c با تولید سایتوکاینهای Th2 خصوصاً اینترلوکینهای 4 و 10 که در ارتباط با پیشرفت و حساسیت به بیماری هستند به عفونت پاسخ میدهند. در مقابل توانایی ایجاد بهبودی در برابر عفونتهای مقاوم (به عنوان مثال موش C57BL/6) بستگی به القاء Th1 پلاریزه و در نتیجه فعال شدن ماکروفاژ و کشتن انگلها دارد.
به نظر میرسد ساز و کار پاسخهای ایمنی در برابر این انگل بسیار پیچیدهتر است، با این حال پیشرفت روزافزون تحقیقات در زمینه بیماریزایی این انگل کمک بزرگی به درک بهتر مصونیت در برابر لشمانیا نموده و در نتیجه راه را برای کشف یک واکسن مؤثر در برابر این انگل هموار میسازد.
ناکارآمدی سیستم کمپلمان در مقابل لشمانیا
بعد از تلقیح انگل به داخل پوست، انگل با ترکیبات سرم تداخل پیدا میکند. از میان عوامل کارآمد سیستم دفاعی ذاتی میتوان به سیستم کمپلمان اشاره کرد که با بر هم زدن غشاء پلاسمایی سلول هدف به حذف بیماری از ارگانهای بدن کمک میکند. مشخص شده است که پروماستیگوتهای متاسیکلیک انگل توانایی فعال کردن کمپلمان را از هر دو مسیر کلاسیک و آلترناتیو دارا هستند. اپسونیزاسیون پروماستیگوتهای متاسیکلیک انگل به سرعت و تنها ظرف مدت 60 ثانیه بعد از تماس انگل با سرم صورت گرفته و از طریق مجموعه حمله به غشاء (C5b–C9 complex)، غشاء انگل لیز میشود؛ در نتیجه 90% انگلها ظرف مدت 3 دقیقه به کلی نابود میشوند. اما نکته قابل توجه توانایی انگل در ایجاد ساز و کارهایی برای فرار از لیز کمپلمان و مقاومت در برابر آن است:
اولاً، پروماستیگوتهای متاسیکلیک در مقایسه با پروماستیگوتهای پروسیکلیک در برابر لیز با کمپلمان بسیار مقاوم هستند. ضمناً انگلهای داخل سلولی نسبت به لیز در برابر کپلمان حساسیت بسیار پایینی دارند. این مکانیسم به واسطه یک تغییر جزئی در غشاء انگل ایجاد میشود که مانع از قرار گرفتن کمپلکس حمله به غشاء روی غشاء سلول هدف میگردد.
ثانیاً، انگل لشمانیا ماژور قادر به تولید پروتئین کینازهایی است که باعث فسفوریله شدن C3، C5، وC9 و در نتیجه مهار سیستم کمپلمان میشود.
و در نهایت، دو ملکول اصلی سطح انگل، LPG و gp63 واسطههای اتصال C3bi روی سطح انگل هستند. نتیجه فعال شدن کمپلمان در اتصال به C3bi (در میان سایر عوامل کمپلمان) روی سطح انگل، فرایند اپسونیزاسیون است. انگل لشمانیا با استفاده هوشمندانه از این فرایند با افزایش عمل فاگوسیتوز از طریق گیرندههای کمپلمان (CR) از محیط خطر فرار میکند. به محض برخورد انگل با ماکروفاژ، انگل با استفاده از C3bi و به کمک CR3 روی سطح ماکروفاژ و اتصال به آن به آسانی وارد سلول ماکروفاژ میشود. طی این روند فاگوسیت، انگل وارد ماکروفاژ شده و زندگی داخل سلولی اجباری خود را آغاز نموده و به فرم آماستیگوت درمیآید.
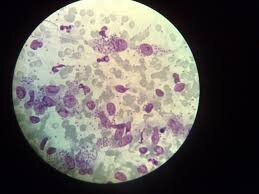
تصویر 2: اشکال آماستیگوتی انگل لیشمانیا که فرم آلوده کننده ماکروفاژ
هستند
ایجاد عفونت
جدا از استفاده انگل از فرآیند اپسونیزاسیون و سیستم کمپلمان و مخفی شدن در سلول میزبان، اجزایی از کمپلمان نظیر C3a و C5a، به عنوان یک جذب کننده پالسهای شیمیایی برای سایر سلولها عمل میکنند. در کنار این عناصر و سایر کموکاینها (مانند MIP-1a ,MIP-2) سلولهای التهابی دیگری نظیر منوسیتها، ماکروفاژها و نوتروفیلها به سمت محل تهاجم انگل در پوست مهاجرت میکنند. حتی اگر ماکروفاژ را به عنوان یک سلول عرضه کننده قوی آنتیژن بشناسیم، عفونت ماکروفاژ به کمک CR3 یک فرآیند خاموش است.
عفونت انگلی ماکروفاژها اجازه فعال شدن سلول را به آنها نمیدهد. از آن مهمتر، انگل به طور مستمر با مهار آزادسازی سایتوکاینهایی مانند IL12 از سلولهای آلوده و به روشهای مختلف دیگر مانع از تحریک آنها میشود. اکنون انگل شروع به تکثیر در سلول نموده تا زمانی که سلول پاره شده و سایر سلولهای اطراف را آلوده کند، بنابراین در این مرحله انگل بدون این که توجه سیستم ایمنی را به خود جلب کند باعث ایجاد آلودگی میشود.
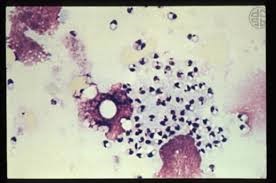
تصویر شماره 3: سیر تکاملی انگل از زمان نیش زدن پشه تا آلوده کردن ماکروفاژ و برقراری عفونت
یکی دیگر از استراتژیهای مهم انگل لشمانیا ماژور در فرار از دست سیستم ایمنی بدن و ایجاد عفونت، ورود به گرانولوسیتها است. اگرچه ماکروفاژ به عنوان سلول میزبان نهایی انگل به شمار میرود، نوتروفیلها جزء اولین سلولهای آلوده شده بعد از مواجهه با انگل هستند. آنها سطح بالایی از MIP-1b را ترشح میکنند که باعث فراخوانی ماکروفاژها به محل آلودگی میشود. ماکروفاژ به نوبه خود به آسانی نوتروفیلهای آلوده را فاگوسیت میکند و در نتیجه باعث ترشح TNF-B میشود، بنابراین لشمانیا با کمک نوتروفیلها به آسانی وارد سلول میزبان نهایی خود میشود.
القای ایمنی حفاظتی
دندرتیک سلها (DC) جزء سلولهای قوی عرضه کننده آنتیژن هستند و دارای نقش اساسی در ساماندهی سلولهای ایمنی T و القای تولرانس میباشند. این سلولها اغلب در مکانهایی مانند پوست که پاتوژنها به طور بالقوه توانایی ورود دارند مستقر میشوند.
مطالعات اولیه نشان داد که دندرتیک سلها جزء سلولهای اصلی عرضه کننده آنتیژن به Tcellها در عفونت با لشمانیا هستند. البته این نکته که کدام زیرگونه از سلولهای دندرتیک (سلولهای لانگرهانس اپیدرم، دندرتیک سلهای پوستی، یا دندرتیک سلهای مقیم غدد لنفاوی) به القای مصونیت در برابر این عفونت کمک میکنند هنوز مورد بحث است.
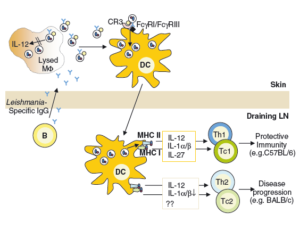
DCهای نابالغ عمدتاً اشکال آماستیگوتی انگل را فاگوسیت میکنند. محققان به تازگی دریافتند که گیرندههای DC برای برداشت لشمانیا با گیرندههای مشابه روی ماکروفاژها متفاوت هستند. ماکروفاژها از CR3 برای فاگوسیتوز انگل بهره میبرند در حالی که DC برای برداشت فرم آماستیگوتی انگل از FCR و به واسطه آنتیبادی استفاده میکند، بنابراین در موشهای فاقد B cell یا FCR کارامد، ما شاهد کاهش تعداد ضایعات آلوده با DC و +CD11c هستیم. نتیجه آن نیز افزایش عفونت و افزایش اندازه زخم است. مطابق با آن معمولاً DCها پس از ایجاد عفونت آلوده میشوند یعنی زمانی که B cellهای اختصاصی علیه لشمانیا حاضر میشوند. (تولید آنتیبادی از کلاس IgG بر علیه لشمانیا) این آنتیبادیها سطح انگل را پوشانده و باعث میشوند تا انگل توسط DC شناسایی شود.
به عبارتی شروع عود ضایعه و متعاقباً درمان آن بلافاصله بعد از آلوده شدن DCها شروع میشود. این مطلب مؤید آن است که DC پس از آلوده شدن از دو طریق به پیشرفت القای ایمنی در برابر انگل کمک میکند:
اول، آلوده شدن DC با سلولهای انگل لشمانیا ماژور منجر به تنظیم فعالیت سلولهای مرتبط با MHC کلاس I و II و بیان ساز و کارهای مرتبط با آنها و سلولهای کمک تحریکی شده و با مهاجرت به سمت غدد لنفاوی منجر به عرضه آنها به سلولهای T میشود.
دوم، سایتوکاینهای آزاد شده از DCها در تمایز سلولهای T و شیفت آنها به سمت Th1 مؤثر است. از طرفی القای ایمنی به واسطه Th1 شدیداً وابسته به IL12 است. اگرچه IL12 ابتدا در ماکروفاژها شناسایی شد، ولی تحقیقات بعدی نشان داد که DCها منبع اصلی تولید IL12 در برابر لشمانیوز هستند. IL 12 و سایر سایتوکاینهای مرتبط (نظیر IL27) که توسط سلولهای DC آلوده ترشح میشوند باعث القاء ایمنی حفاظتی به واسطه Th1 میشوند..
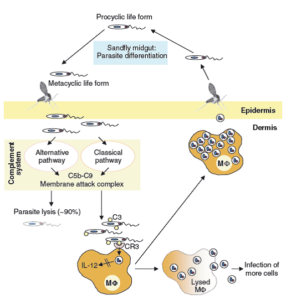
تصویر شماره 4: با تولید آنتیبادیهای اختصاصی، آنتیژنهای انگل توسط دندرتیک سلها شناسایی و به سلولهای T عرضه میشود
ایمنی وابسته به سلول T
در لیشمانیوز جلدی انسانی و تجربی، توسعه مصونیت وابسته به تولید اینترفرون (IFN)- توسط سلولهای T میباشد. IFN گاما تولید شده از سلولهای T با فعال کردن ماکروفاژ و متعاقب آن تولید NO توسط ماکروفاژ منجر به محدود کردن عفونت میشود. ترمیم زخم در لشمانیوز جلدی شدیداً وابسته به تولید سلولهای اختصاصی CD4+ علیه لشمانیا از سلولهای Th1 است. یافتههای اخیر نشان میدهد که اینترفرون گاما توسط سلولهای T CD8+ اختصاصی بر ضد لشمانیا تولید میشود که اصطلاحاً به آنها سلولهای T سایتوتوکسیک تیپ 1 میگویند که میتوانند کمک شایانی به توسعه مصونیت علیه لشمانیا بنمایند.
آیا پاسخهای خاطره به پایداری و ماندگاری انگل وابسته است؟
در غدد لنفاوی موشهایی که به طور بلند مدت دچار عفونت با لیشمانیا ماژور بوده و سپس بهبود یافته بودند، ماکروفاژ و دندرتیک سلهایی مشاهده شدند که هر دو دارای انگلهای زنده بودند. با این حال این تنها DCها بودند که قادر به ایجاد یک پاسخ ایمنی سلولی به واسطه سلولهای T در شرایط آزمایشگاهی بودند. بنابراین DCهای آلوده شده به لشمانیا در غدد لنفاوی (که توانایی بیان سنتز NO برای از بین بردن انگل را ندارند) به عنوان سلولهای میزبان همیشگی انگل شناسایی شدند که ماندگاری انگل در آن سلول باعث حفظ سلولهای T خاطره میشود. ضمن آنکه حضور مداوم IL 12 بر پایداری این مصونیت بسیار کمک کننده است.
هرچند منبع تولید IL 12 در مراحل نهایی بعد از عفونت هنوز به خوبی شناخته نشده است، اما به احتمال قوی DC یکی از این منابع است، بنابراین موشهایی که دارای کمبود IL 12، NO یا اینترفرون گاما هستند مستعد ابتلا به این عفونت میباشند. جالب توجه است در موردIL 10 موشی، از بین رفتن کامل انگلها و بهبود زخمها در گرههای لنفاوی مشاهده میشود که با از دست دادن پاسخهای خاطره همراه خواهد بود. بنابراین به نظر میرسد که تداوم حضور انگلهای باقی مانده در اندامهای لنفاوی ثانویه حیوانات باعث بقای مصونیت میشود.
در مطالعهای که اخیراً صورت گرفته است مشخص شده است که سلولهای +T CD4 که مسئول ایمنی در برابر لشمانیا ماژور هستند به دو دسته تقسیم میشوند:
دسته اول سلولهای T effector وابسته به انگل و دسته دوم تجمعی از سلولهای T خاطرهای مستقل از انگل. این به معنای حضور سلولهای T خاطرهای است که به صورت طولانی مدت و بدون نیاز به حضور انگل وجود دارند، بنابراین در عفونت مجدد با لشمانیا ماژور، این سلولها کارآمد شده و به مقابله با انگل میپردازند.
درمان تجربی با استفاده از DC و استراتژیهای پیشگیرنده
با توجه به اینکه حداکثر تعداد 100 انگل در زمان انتقال طبیعی توسط پشه خاکی آلوده کننده بوده و 90% از انگلها به سرعت توسط سیستم کمپلمان نابود میشوند، شانس زنده ماندن انگل و ایجاد عفونت بسیار ناچیز است، بنابراین از آن جا که میزان موفقیت عفونت به طور قطع شناخته شده نیست، بیشتر واکسیناسیونها در همان مراحل اول بینتیجه باقی میماند، بنابراین موادی که بتوانند کارایی کمپلمان را در لیز کامل انگلها افزایش دهند یا میزان مقاومت آن درصد ناچیز انگلها را در برابر لیز کمپلمانی از بین ببرند میتوانند ابزارهای جالبی برای پیشگیری از عفونت باشند.
مقاومت در برابر عفونت با لشمانیا به واسطه سلولهای T نیز میسر است. از آن جا که سلولهای T اختصاصی علیه لشمانیا یک مصونیت مداوم در فرد ایجاد میکند و از عفونت مجدد با همان گونه جلوگیری به عمل میآورد، ایجاد یک عفونت عمدی روی باسن نوزادان (به منظورجلوگیری از ضایعات پوستی روی صورت بعد از آن) مورد توجه قرار گرفت. این فرایند “لشمانیزاسیون” نامیده شد. با این حال، تولید یک واکسن نوترکیب که به صورت مشابه و بدون حضور انگل زنده بتواند یک مصونیت مشابه ایجاد کند بسیار مطلوبتر خواهد بود. استفاده از آنتیژنهای مختلف بیان شده توسط گونههای لشمانیا و ترکیب آنتیژنهای مختلف آنها برای مواجهه با عفونتهای مختلف نیز ممکن است مؤثر واقع شود.
همانطور که ذکر شد، چندین گروه مطالعه نشان میدهد که آلوده کردن DCها بهترین راه القای عفونت است. استفاده از انگل زنده برای واکسیناسیون بر اساس DC در انسان مشکل ساز است، در نتیجه، DC با پالس آنتیژنی به منظور ایجاد یک مصونیت طولانی مدت مورد توجه قرار گرفت. پالس DC با عصاره انگل و یا پروتئینهای انگلی نوترکیب آزمایش شد. استفاده از ادجوانتهایی مانند اشکال CPG نیز ممکن است عرضه آنتیژن و تحریک تولید IL12 را بهبود بخشیده و ظرفیت تولید واکسن با استفاده از DC را افزایش دهد. با توجه به کار دشوار و هزینهبر جدا سازی DC از سلولهای انسانی، واکسیناسیون بر اساسDC فقط میتواند به عنوان اثبات اصل آزمایش به ما کمک کند.
تولید واکسن بر اساس ترجمه پروتئینهایی که بتوانند DCهای پوست را فعال کنند نیز مطلوب خواهد بود. در اینجا برای دستیابی به القاء ســـلولهای T effector جایگزین شده در پوست، فعال کردن DCهای مستقر در پوست امری ضروری به نظر میرسد. روشهای مختلفی برای اعمال آنتیژن داخل جلدی و یا زیرجلدی همراه با ادجوانت انجام شده است (CPG، IL-12، و …)که البته امیدوار کننده بوده است. از طرفی، ثابت شده است که فعال سازی DC از طریق ادجوانت مسئول اثربخشی واکسیناسیون بوده است. مطالعات آینده باید برای بهره برداری از این استراتژی، آزمایشات را با جزئیات بهتر دنبال کند تا شاهد افزایش موفقیتها و ایجاد یک مصونیت طولانی مدت باشیم.
:References
1.Gordon C. Cook, AlimuddinI.Zumla: Manson’s Tropical Diseases. Saunders, 20th edition, 1996
2.Terabe M, Kuramochi T, Hatabu T, Ito M, Ueyama Y, Katakura K, Kawazu S, Onodera T, Matsumoto Y : Non-ulcerative cutaneous lesion in immunodeficient mice with Leishmania amazonensis infection. Parasitol Int. 1999 Mar;48(1):47-53.
3.von Stebut E, Udey M C. Requirements for Th1-dependent immunity against infection with Leishmania major. Microbes Infect 2004: 6: 1102–1109.
4.Alvar J, Canavate C, Gutierrez-Solar B et al. Leishmania and human immunodeficiency virus coinfection: the first 10 years. ClinMicrobiol Rev 1997: 10: 298–319.
5.World Health Organisation, 2006. http://www.who.int/leishmaniasis/ leishmaniasis_maps/en/index2.html.
6.Coler R N, Reed S G. Second-generation vaccines against leishmaniasis. Trends Parasitol 2005: 21: 244–249.
7.Belkaid Y, Mendez S, Lira R, Kadambi N, Milon G, Sacks D. A natural model of Leishmania major infection reveals a prolonged ‘silent’ phase of parasite amplification in the skin before the onsetof lesion formation and immunity. J Immunol 2000: 165: 969–977.
8.Woelbing F, Lopez Kostka S, Moelle K, et al. Uptake of Leishmania major by dendritic cells is mediated by Fcgamma receptors and facilitatesacquisition of protective immunity. J Exp Med 2006: 203:177–188.
9.Mosser D M, Brittingham A. Leishmania, macrophages and complement: a tale of subversion and exploitation. Parasitology 1997: 115:S9–S23.
10.Sacks D, Sher A. Evasion of innate immunity by parasitic protozoa. Nat Immunol 2002: 3: 1041–1047.
11.von Stebut E, Metz M, Milon G, Knop J, Maurer M. Early macrophage influx to sites of cutaneous granuloma formation is dependenton MIP-1alpha/beta released from neutrophils recruited by mastcell-derived TNFalpha. Blood 2003: 101: 210–215.
12.Belkaid Y, Butcher B, Sacks D L. Analysis of cytokine production by inflammatory mouse macrophages at the single-cell level: selectiveimpairment of IL-12 induction in Leishmania-infected cells. Eur JImmunol 1998: 28: 1389–1400.
13.McDowell M A, Sacks D L. Inhibition of host cell signal transduction by Leishmania: observations relevant to the selective impairment ofIL-12 responses. CurrOpinMicrobiol 1999: 2: 438–443.
14.Banchereau J, Steinman R M. Dendritic cells and the control of immunity. Nature 1998: 392: 245–252.
15.von Stebut E, Belkaid Y, Nguyen B V, Cushing M, Sacks D L, UdeyM C. Leishmania major-infected murine Langerhans cell-like dendriticcells from susceptible mice release IL-12 after infection and vaccinateagainst experimental cutaneous leishmaniasis. Eur J Immunol2000: 30: 3498–3506.
16.Ahuja S S, Reddick R L, Sato N, et al. Dendritic cell (DC)-based antiinfectivestrategies: DCs engineered to secrete IL-12 are a potentvaccine in a murine model of an intracellular infection. J Immunol1999: 163: 3890–3897.
17.Misslitz A C, Bonhagen K, Harbecke D, Lippuner C, Kamradt T, Aebischer T. Two waves of antigen-containing dendritic cells in vivoin experimental Leishmania major infection. Eur J Immunol 2004:
18.Ritter U, Meissner A, Scheidig C, Korner H. CD8 alpha- and Langerinnegativedendritic cells, but not Langerhans cells, act as principalantigen-presenting cells in leishmaniasis. Eur J Immunol 2004: 34:1542–1550.
19.Iezzi G, Frohlich A, Ernst B, et al. Lymph node resident rather than skin-derived dendritic cells initiate specific T cell responses afterLeishmania major infection. J Immunol 2006: 177: 1250–1256.
20.Mattner F, Magram J, Ferrante J et al. Genetically resistant mice lacking interleukin-12 are susceptible to infection with Leishmaniamajor and mount a polarized Th2 cell response. Eur J Immunol1996: 26: 1553–1559.
21.Zahn S, Wirtz S, Birkenbach M, Blumberg R S, Neurath M F, von Stebut E. Impaired Th1 responses in mice deficient in Epstein–Barrvirus-induced gene 3 and challenged with physiological doses ofLeishmania major. Eur J Immunol 2005: 35: 1106–1112.
22.von Stebut E, Ehrchen J M, Belkaid Y, et al. Interleukin 1alpha promotes Th1 differentiation and inhibits disease progression inLeishmania major-susceptible BALB/c mice. J Exp Med 2003: 198:191–199.
23.Reiner S L, Locksley R M. The regulation of immunity to Leishmania major.Annu Rev Immunol 1995: 13: 151–177.
24.Holscher C, Arendse B, Schwegmann A, Myburgh E, Brombacher F. Impairment of alternative macrophage activation delays cutaneousleishmaniasis in nonhealing BALB/c mice. J Immunol 2006: 176:1115–1121.
25.Uzonna J E, Joyce K L, Scott P. Low dose Leishmania major promotes a transient T helper cell type 2 response that is down-regulatedby interferon gamma-producing CD8+ T cells. J Exp Med 2004:199: 1559–1566.
26.Campbell D J, Butcher E C. Rapid acquisition of tissue-specific homing phenotypes by CD4+ T cells activated in cutaneous or mucosallymphoid tissues. J Exp Med 2002: 195: 135–141.
27.Koelle D M, Liu Z, McClurkan C M, et al. Expression of cutaneous lymphocyte-associated antigen by CD8+ T cells specific for a skintropicvirus. J Clin Invest 2002: 110: 537–548.
28.Morales J, Homey B, Vicari A P, et al. CTACK, a skin-associated chemokine that preferentially attracts skin-homing memory T cells.ProcNatlAcadSci U S A 1999: 96: 14470–14475.
29.Radeke H H, Ludwig R J, Boehncke W H. Experimental approaches to lymphocyte migration in dermatology in vitro and in vivo. ExpDermatol 2005: 14: 641–666.
30.Moll H. Epidermal Langerhans cells are critical for immunoregulationof cutaneous leishmaniasis. Immunol Today 1993: 14: 383–387.
31.Blank C, Bogdan C, Bauer C, Erb K, Moll H. Murine epidermal Langerhans cells do not express inducible nitric oxide synthase. EurJ Immunol 1996: 26: 792–796.
32.Stobie L, Gurunathan S, Prussin C, et al. The role of antigen and IL-12 in sustaining Th1 memory cells in vivo: IL-12 is required tomaintain memory/effector Th1 cells sufficient to mediate protectionto an infectious parasite challenge. ProcNatlAcadSci U S A 2000:97: 8427–8432.
33.Scott P. Immunologic memory in cutaneous leishmaniasis. Cell Microbiol 2005: 7: 1707–1713.
34.Tabbara K S, Peters N C, Afrin F et al. Conditions influencing the efficacy of vaccination with live organisms against Leishmania majorinfection. Infect Immun 2005: 73: 4714–4722.
35.Bastrenta B, Mita N, Buitrago R, et al. Human mixed infections of Leishmania spp. and Leishmania–Trypanosomacruzi in a subAndean Bolivian area: identification by polymerase chain reaction/hybridization and isoenzyme. Mem Inst Oswaldo Cruz 2003: 98:
36.Berberich C, Ramirez-Pineda J R, Hambrecht C, Alber G, Skeiky Y A, Moll H. Dendritic cell (DC)-based protection against an intracellularpathogen is dependent upon DC-derived IL-12 and can beinduced by molecularly defined antigens. J Immunol 2003: 170:3171–3179.255–264.
37.urunathan S, Sacks D L, Brown D R, et al. Vaccination with DNA encoding the immunodominant LACK parasite antigen confers protectiveimmunity to mice infected with Leishmania major. J ExpMed 1997: 186: 1137–1147.
38.Zimmermann S, Egeter O, Hausmann S, et al. CpGoligodeoxynucleotidestrigger protective and curative Th1 responses in lethal murineleishmaniasis. J Immunol 1998: 160: 3627–3630.
39.Shah J A, Darrah P A, Ambrozak D R, et al. Dendritic cells are responsible for the capacity of CpGoligodeoxynucleotides to act asan adjuvant for protective vaccine immunity against Leishmaniamajor in mice. J Exp Med 2003: 198: 281–291.
40.Li J, Sutterwala S, Farrell J P. Successful therapy of chronic, nonhealingmurine cutaneous leishmaniasis with sodium stibogluconateand gamma interferon depends on continued interleukin-12 production.Infect Immun 1997: 68: 3225–3230.
41.Schiller M, Metze D, Luger T A, Grabbe S, Gunzer M. Immune response modifiers – mode of action. ExpDermatol 2006: 15: 331–341.
https://www.cdc.gov/dpdx/leishmaniasis/index.html
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام