مروری بر روش فلوسایتومتری
فتانه توسلیان، دانشجوی دکتری تخصصی ایمونولوژی پزشکی، دانشگاه تربیت مدرس، دانشکده پزشکی
دکتر احمد زواران حسینی، استاد گروه ایمونولوژی، دانشگاه تربیت مدرس، دانشکده پزشکی، گروه ایمونولوژی
الهام عبدالهی، دانشجوی دکتری تخصصی ایمونولوژی پزشکی، دانشگاه علوم پزشکی مشهد، دانشکده پزشکی
فلوسایتومتری (Flow Cytometry) روشی است که در آن سلولهای موجود در سوسپانسیون در منطقه تمرکز هیدرودینامیک به صورت جریان لامینار از فلوسل و مقابل نور لیزر عبور کرده و از نظر مشخصات فیزیکی مثل اندازه، داشتن گرانول، شکل و پیچیدگی هسته و نیز از نظر شاخص های موجود در سطح غشا، سیتوپلاسم و هسته با واسطه آنتیبادیهای منوکلونال و پلیکلونالی که با مواد فلورسانس نشاندار شدهاند بررسی میگردند. پرتوهای لیزر بر روی سلولها (متصل به رنگ فلورسنس) متمركز و به آنها برخورد مینمایند و پراکنده میشوند.
پراکندگیها در جهت جلو (FSC)و جانبی(SSC) ثبت میشوند. پرتوهای پراکنده شده پیش از رسیدن به آشکارسازها از طریق فیلترها و آیینهها در جهت صحیح هدایت و توسط تقویت کنندهها، تقویت شده و سپس به آشکارساز میرسند. کاربردهای مختلفی برای فلوسایتومتری وجود دارد که از جمله مهمترین آنها میتوان به ایمیونوفنوتایپینگ لوسمیهای حاد و مزمن، بیماریهای پلاسماسلها، پایش درمان در لوسمیها، تعیین فاکتورهای مؤثر در پیشآگهی، تشخیص بیماریهای نقص ایمنی ارثی و اکتسابی اشاره کرد.
مقدمه
در تکنیکهای وسترنبلات، PCR وReal time نیازمند دسترسی به کل محتوای ژنتیکی سلول و یا محتوای پروتئینی هستیم، بنابراین باید غشای سلول تخریب شود و در نتیجه ما خود سلول را دیگر نخواهیم داشت. اما برخی از تکنیکهای شناسایی پروتئین وجود دارند که بدون از بین رفتن غشای سلول میتوانند در تشخیص سلول محقق را یاری کنند. از جمله این تکنیکها میتوان به فلوسایتومتری و ایمونوفلورسنت اشاره نمود (1). تکنیک فلوسایتومتری، تکنیکی است که سلولها را به طور سوسپانسیون (نه چسبنده) مورد آنالیز قرار میدهد. در حقیقت شرط اصلی در کار با این تکنیک این است که سلولها حتماً به صورت سوسپانسیون باشند، بنابراین نمونههایی که به صورت بافت هستند اگر نیاز به بررسی با فلوسایتومتری دارند باید حتماً به صورت سوسپانسیون درآورده شوند (2).
فلوسايتومتري نقش مهمي در زمينههاي مختلف آسيبشناسي، هماتولوژي، ايمنيشناسي، بيماريهاي عفوني، بررسي پيوند اعضاء، نئوپلازيا و ژنتيك دارد و از طرفي بررسي وقايع چرخه سلولي و نقايص موجود در DNA جهت تشخيص انواع لوسميها و لنفومها بوسيله فلوسيتومتري امكانپذير است. همچنين اين روش در تشخيص بيماريها، تعيين پيشآگهي و همچنین براي ارزيابي درمان بدخيميها كاربرد دارد. فلوسايتومترهاي كلينيكي معمولاً براي استفاده آزمايشگاههاي كلينيكي تنظيم شده است، اما بعضي از آنها ظرفيت جداسازی انتخابي سلولها را Sorting دارا ميباشند كه در كارهاي تحقيقاتي مورد استفاده قرار میگیرند (3).
فلوسیتومتری و آپوپتوز سلولها
آپوپتوز يكي از شكلهاي مرگ سلول ميباشد كه از نظر بيولوژي اهميت زيادي دارد و به همين دليل رديابي و اندازهگيري آپوپتوز در تحقيقات و موارد باليني اهميت پيدا ميكند. سلولهاي در حال آپوپتوز نشانههاي زيادي دارند كه قابل اندازهگيري با فلوسايتومتري ميباشند؛ اين نشانهها عبارتند از تغييرات در غشاء پلاسمائي سلول، تغييرات در نفوذپذيري غشاء پلاسمائي، تغييرات در نفوذپذيري غشاء ميتوكندري، فعالسازي كاسپازها و شكستگيهاي DNA سلولي. شناسايي هر يك از اين تغييرات به تنهايي يا تركيبي از آنها به وسيله فلوسايتومتري، امكان شناسايي و اندازهگيري سلولهاي آپوپتوتيك را از ميان مخلوطي از سلولهاي ديگر فراهم ميكند، همچنين اطلاعات باارزشي درباره مسير مولكولي مرگ سلولها به دست ميآيد (4).
فلوسیتومتری و آنالیز DNA
دسترسي به رنگهای فلورسنتي که به صورت خطی و متناسب با غلظت به DNA سلولي متصل میشوند فلوسایتومتری را برای آنالیز DNA توانمند ساخته است. امروزه تعیین کمی مقدار DNA، شناسایی سلولهای دیپلوئید نرمال در حالت استراحت، شناسايي سلولهايي كه به طور فعال DNA سنتز ميكنند و شناسايي سلولهايي كه در مرحله پیشمیتوز و یا میتوز هستند توسط فلوسايتومتر امكانپذير شده است. هنگامي كه فازهای مختلف چرخه زندگي سلولها مشخص شدند، ميتوان با توأم كردن روشهاي رديابي پروتئینهای مؤثر در چرخه سلولی به وسيله آنتيباديهاي اختصاصي و روش تعيين مقدار DNA، بيان پروتئينها را در فازهاي مختلف زندگي سلولها بررسي كرد.
اضافه نمودن آنالوگ تیمیدین يا بروموداکسی یوریدین به محيط كشت سلولي امكان شناسایی سلولهایی را فراهم ميكند که فعالانه در حال سنتز DNA هستند. با استفاده از روش تعيين مقدار DNA همچنين ميتوان تعداد کروموزومها (هنجار یا ناهنجار) را مشخص كرد. سلولهايي كه به حالت پلوئیدی (برای مثال در مگاکاریوسیتها) و يا آناپلوئیدی (برای مثال در بیماریهای بدخیم) ميباشند نيز با اين روش قابل شناسايي هستند (5).
مزاياي سيستم فلوسايتومتري بر ساير روشهاي اندازهگيري فلورورسانس
1- عینی بودن Objective
2- حساسيت بالا: دستگاه ميتواند تا بيش از هزار مولكول فلوئوروكروم را در سلول مشخص كند
3- سرعت عمل زياد كه بررسي تعداد زيادي سلول را ممكن ميسازد
4- توانايي تشخيص سلولهاي نادر با مشخصات اختصاصي در يك جمعيت هتروژن و ناهمگن
5- توانايي مطالعه سلولهاي زنده فيكس نشده
6- توانايي اندازهگيري معيارهاي همزمان چندين پارامتر و تطابق چند حساسيت هر سلول معلق در مايع
دستگاههای فلوسایتومتر از 3 بخش اصلی تشکیل شدهاند که شامل سیستم پدیدآورندهی جریان (Fluidics System)، سیستم نوری (Optical System) و سیستم الکترونیک و پردازش (Electronics Systems) میباشد (6).
سیستم پدیدآورنده جریان
همانطور که در بالا به آن اشاره شد شرط اول در کار با این تکنیک سوسپانسیون بودن سلولهای مورد بررسی میباشد. در کل سلولهای موجودات مختلف یا به صورت فشرده در یک بافت قرار دارند (مانند اکثر بافتهای بدن) و یا خود در محیطی سوسپانسیون قرار دارند (مانند خون). سلولهای مورد بررسی اگر سلولهای خونی باشند نیازی بهdigestion هضم کردن آنها وجود ندارد. اما اگر به صورت بافت باشند ابتدا باید توسط آنزیمهای مختلف و یا به صورت مکانیکی و یا حتی به هر دو صورت، بافت را هضم نمود تا بتوان از بافت فشرده شده، سوپ سلولی تهیه نمود. آنزیمهای مختلفی جهت هضم بافتها وجود دارد که بسته به نوع بافت، سختی و مواد تشکیلدهنده آن باید نوع مناسب انتخاب شود. البته شایان ذکر است این انتخاب نباید به گونهای باشد که به خود سلول صدمه زده و سبب مرگ آن شود (7).
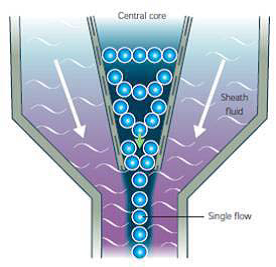
تمركز هيدروديناميك Hydrodinamic Focousing
خصوصيت اصلي يك سيستم فلوسايتومتري اين است كه اندازهگيريها بر روي نمونههاي سلولي كه در دستگاه جريان مييابند، انجام ميشود. اگر از يك لوله جهت انتقال نمونه استفاده شود، سلولها نميتوانند به طور مكرر به نقطه اندازهگيري محل برخورد ليزر به سلول بروند. اگر از لولههاي باريك جهت اطمينان از انتقال تكرارپذير سلولها استفاده شود، احتمال دارد با عبور سلولهاي بزرگتر مسير بسته شود. براي حل اين مشكل از روش تمركز هيدروديناميك Hydrodinamic Focousing كمك گرفته ميشود. در اين روش جريان آرامي از سلولها را به درون جريان حامل سريع ( Sheath fluid) وارد ميكنند. مايع حامل، سلولها را در مركز لوله متمركز ميكند، بنابراين سلولها به طور منظم و در يك مسير مجازي به نقطه اندازهگيري منتقل ميشوند (8،9)
شکل 1- تمرکز هیدرودینامیک در دستگاه فلوسایتومتری نشان داده شده است.
هدف از آمادهسازي نمونه، تهيه يك سوسپانسيون از پارتيكلهاي منفرد است كه به روش خاصي رنگآميزي شدهاند تا در سيستم، بدون ايجاد اختلال در جريان يكنواخت مايع سيال و يا انسداد لوله و منافذ دستگاه عبور كنند. درسيستم فلوسايتومتري، سلولهاي معلق در مايع ايزوتونيك از طريق سيستم حسي با فشار هوا از ظرف حاوي نمونه به لوله مخصـــــــوصي منتقل شده و به يك محفظه خاصي به نام حفره جریان Flow chamber وارد میشوند. مایع پوششی Sheath fluidدر حفره نمونه، يك اثر تمركز هيدروديناميكي ايجاد كرده و نمونه را به داخل جريان ميكشاند كه زيادتر بودن سرعت جريان مايع پوششي نسبت به مايع حاوي نمونه، سبب هدايت سلولها به صورت منفرد و تكتك جهت عبور از سوراخ انتهايي ميشود تا در نقطه خاصي در مقابل اشعه ليزر قرار بگيرد.
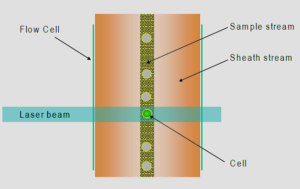
سلول از لوله شيشهاي با سرعتي حدود 5 تا 50 متر در ثانيه از ميان منفذي باريك و از مقابل پرتوي يك يا چند منبع نوري كه غالباً ليزر است، عبور ميكنند. بدين ترتيب امكان جمعآوري اطلاعات مربوط به 5000 تا 50000 سلول در هر ثانيه فراهم ميشود (10).
شکل 2- نحوه حرکت سلولها به صورت تکتک و منفرد از مقابل نور لیزر نشان داده شده است.
بنابراین دو شرط اصلی برای نمونههایی که قرار است با تکنیک فلوسایتومتری بررسی شوند وجود دارند:
1- سوسپانسیون بودن
2 – عبور تکتک از مقابل منبع نوری (11).
سیستم نوری
دومین بخش از دستگاه فلوسایتومتری، سیستم نوری است. این سیستم دو بخش کلی دارد؛ یکی منبع تولید نور و دیگری آینهها و فیلترهای هدایتکننده نور.
انواع مختلفي از منابع نوري براي فلوسايتومتر وجود دارند. در فلوسايتومترهاي مدرن، نور ليزر به عنوان منبع نوري بكار ميرود، ليزر نسبت به جيوه يا لامپهاي ديگر مزايايي دارد كه از آن جمله ميتوان به توليد نور منوكروم تكرنگ و با اندازه نقطهاي بسيار كوچك آن اشاره كرد، اين اندازه نقطهاي بسيار مهم است، زيرا هرچه نور در فضاي كوچكتري محدود شود، ميزان تهييج سلول به حد ماكزيمم نزديكتر ميشود، علاوه بر اين باعث اطمينان از قرار گرفتن تنها يك سلول در برابر نور در هر لحظه ميگردد. بيشترين ليزر مصرفي نيز، ليزر آرگون با طول موج 488نانومتر ميباشد كه با هوا سرد میشود. ليزرهاي ديودي نيز به دليل پايداري مورد استفاده قرار ميگيرند و معمولاً طول موج 635 نانومتر آن مورد استفاده است (12).
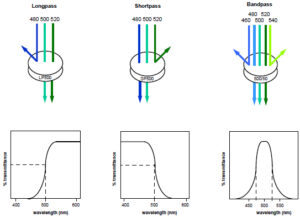
جزء دوم این بخش آینههایی است که در دستگاهها تعبیه شدهاند. این آینهها یا فیلترها نوع خاصی از آینهها هستند که طول موج خاصی را از خود عبور داده و طول موج خاصی را منعکس میکنند. به این گونه فیلترها یا آینهها، Dichroic mirror گفته میشود (13). بسته به اینکه این آینهها چه طول موج خاص را عبور و یا منعکس میکنند به سه دسته تقسیمبندی میشوند:
1- فیلترهای Long Pass: این گونه فیلترها طیف نوری با طول موجهای برابر یا بیشتر از مقدار مشخصی را از خود عبور میدهند و مابقی را منعكس میكنند. به عنوان مثال فیلترBP 500 طیفهای نوری با طول موجهای برابر یا بیشتر از 500 نانومتر را از خود عبور میدهد و طول موجهای كمتر از آن را منعكس میكند.
2– فیلترهای Short Pass: در این فیلترها طیفهای نوری با طول موجهای برابر یا کمتر از مقدار تعیین شده عبور میكنند و غیر از آن منعكس میشوند، برای مثال فیلترSP 500 طیفهای نوری با طول موجهای برابر یا كمتر از 500 نانومتر را از خود عبور میدهد و طولموجهای بیشتر را منعكس میكند.
3- فیلترهای Band Pass: فیلترهایی هستند كه محدوده مشخصی از طیف نوری را از خود عبور میدهند. برای مثال فیلترBP 500/50 طیف نوری بین 475 تا 525 نانومتر را عبور میدهد و غیر از آن را منعكس میكند .(14)
شکل 3- فیلترهای نوری فقط طول موج خاصی را عبور داده و مانع عبور طول موجهای دیگر میشوند. در این شکل نحوه عملکرد فیلترهای Long Pass ,Short Pass ,Band Pass نشان داده شده است
سیستم الکترونیک و پردازش
در این قسمت، سیگـــنالها و ولتاژهای ایجاد شدهی حاصل از برخورد نور لیزر به سلول به دادههای دیجیتالی تبدیل میشـــوند تا به وســــــــیلهی نرم افزار دستگاه قابل تجزیه و تحلیل باشند. سیگنالها در سیستمهای قدیمی به شکل آنالوگ ثبت میشـــــدند در حالی که امروزه یک مبدل آنالوگ به دیجیتال (Analogue to Digital Converter (ADC آنها را به دادههای دیجیتالی تبدیل میکند، به این شكل كه با توجه به كیفیت ثبت سیگنال در آشكارساز برای هر مقدار ولتاژ حجمی از داده كامپیوتری به صورت بایت(Byte) درنظر میگیرد به این معنی كه ولت به بایت تبدیل میشود.
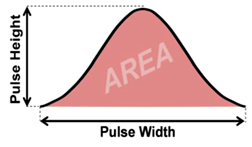
این امر قابلیت بیشتر آنالیز سیگنالها، تقویت و یا تضعیف آنها را میسر میسازد. زمانی که یک سلول از مقابل منبع نوری عبور میکند بر روی تمام آشکارسازها سیگنال ایجاد میکند که همان پالس الکتریکی (ولتاژ) است. بر اساس این که چه میزان از ذره در مقابل منبع نوری قرار گیرد، پالس ایجاد شده میتواند ضعیف یا قوی باشد. چنانچه نمودار ولتاژ بر حسب زمان برای هر سلول رسم شود به صورت یک پالس خواهد بود که واجد یک پیک میباشد. هر پالس دارای ویژگیهای ارتفاع(Height;H) ، پهنا (Width;W) و سطح زیر نمودار (Area;A) است (15).
شکل 4- نمودار ولتاژ بر حسب زمان برای هر سلول به صورت یک پالس خواهد بود که واجد یک پیک میباشد. هر پالس دارای ویژگیهای ارتفاع(Height;H) ، پهنا (Width;W) و سطــــــــح زیر نمودار (Area;A) است.
سرنوشت نور پس از برخورد به سلولها
سلولها پس از مکش توسط دستگاه در منطقهای البته پس از تکتک شدن با لیزر روبرو میشوند. نتیجه برخورد نور لیزر به یك سلول، پراکندگی نور در جهات مختلف است که گاهی با تغییر در طول موج نیز همراه است. در حقیقت زمانی كه نور لیزر به ذرهای برخورد میكند، برخی از پرتوهای لیزر با همان طول موج از جوانب سلول گذشته و در زوایای 2 تا 10 درجه در مقابل سلول پراکنده میشوند كه به آن پراکندگی جلویی (Forward Scatter, FSC) گفته میشود و در حقیقت بیانگر اندازه (Size) سلول است كه میتوان به وسیلهی آن اندازهی سلول را مورد بررسی قرار داد. برخی از پرتوهای لیزر نیز به درون سلول وارد شده و به ساختارهای درونی سلول مثل گرانولها، واكوئلها، هسته و ساختارهای درون سلولی برخورد كرده و در زوایای 10 تا 90 درجه پراكنده میشوند.
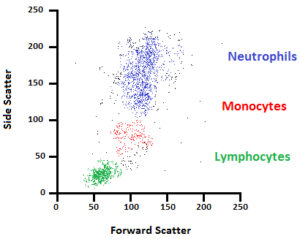
این پراکندگیها كه نشاندهندهی پیچیدگیهای درون سلول هستند، پراکندگی جانبی(Side Scatter,SSC) نام دارد و در حقیقت نشاندهنده میزان گرانولوسیتی سلول است. طول موج پراكندگی جانبی نیز برابر با طول موج تابیده به سلول است. به طور کلی هر ذرهای که از مقابل نور لیزر عبور میکند، دارای یک اندازه و گرانولیتی مشخص است که در نمودارهای فلوسایتومتری قابل ردیابی و نمایش میباشد؛ به طور مثال اگر سلولهای خون محیطی انسان را در دستگاه فلوسایتومتری بررسی کنیم شاهد جمعیتهای مختلف سلولی از جمله مونوسیتها، گرانولوسیتها و لنفوسیتها خواهیم بود که بسته به اندازه و گرانولیتیشان در نمودار فلوسایتومتری قابل تمیز از هم هستند (1).
شکل 5- جمعیتهای مختلف سلولی از جمله مونوسیتها، گرانولوسیتها و لنفوسیت که بسته به اندازه و گرانولیتیشان در نمودار فلوسایتومتری قابل تمیز از هم هستند
اما قابل ذکر است در اکثر موارد نمیتوان سلولها را بر حسب اندازه و گرانولیتی آنها با هم قیاس نمود زیرا بسیاری از آنها شبیه هم هستند و اندازه و گرانولیتی مشابه دارند، به راحتی نمیتوان از روی سایز و اندازه و گرانولیتی یک سلول پی به ماهیت آن برد. یکی از مهمترین کلیدها در رفع این مشکل استفاده از آنتیبادی و آنتیژن و واکنش بین این دو با هم است به طوری که اگر ما بتوانیم برای شناسایی سلول موردنظر خود آنتیبادی اختصاصی علیه آنتیژن را شناسایی و آن آنتیبادی را به رنگی یا فلوروکرومی متصل کنیم خواهیم توانست سلول مورد هدف را شناسایی کنیم، اما این دستگاه به چه شکل میتواند رنگ مورد استفاده را شناسایی کند؟
همان طور که میدانید هر مولکول در اطراف خود دارای الکترونهایی است که در اطراف هسته در حال گردشاند. حال اگر این الکترونها توسط منبع نوری مانند لیزر برانگیخته شوند، از لایه اصلی خود خارج شده و به مدار بالاتر میروند. اما این الکترونها تمایل به ماندن در لایههای بالاتر را نداشته و تمایل دارند به لایه خود حرکت کنند. این برگشت از یک لایه بالاتر به لایه پایینتر با از دست دادن انرژی همراه است. حال اگر این مولکول یک فلورکروم باشد بنابراین انرژی از دست رفته را به شکل نور نمایش خواهد داد (16).
به هنگام آمادهسازی سلولها و اتصال رنگهای گوناگون فلورسنس به سلول، پرتوهای تابیده شده پس از برخورد تغییر طول موج داده و در زوایای 10 تا 90 درجه پراکنده میشوند كه آن را به عنوان پراکندگیهای فلورسنس (Fluorescence Scatter) میشناسند. طول موج بازتابی در این نوع پراكنش با توجه به رنگ فلورسنس به کار رفته متغیر است. سپس طیفهای نوری ایجادشده توسط فیلترها و آیینهها به سمت آشکارسازها (Detector) هدایت شده و سیگنالهای ایجاد شده را ثبت میکنند. این فیلترها یا آشکارسازها که طول موجهای مختلف فلورسنس را دریافت میكنند با توجه به تعدادشان شمارهگذاری میشوند كه معمولاً در بیشتر دستگاههای فلوسیتومتری پرتوهایی با طول موج 520 تا 570 (محدوده سبز =FL1 )، پرتوهایی با طول موج 585 تا620 (محدوده نارنجی =FL2) و پرتوهایی با طول موج 625 تا760 (محدوده قرمز =FL3) را شامل میشوند (17)
در داخل آشکارسازها پرتوها توسط گروهی از تقویتکنندهها، تقویت شده تا بتوانند به یک ولتاژ ساده الکتریکی مبدل شوند و سپس در قسمت الکترونیک به دادههای دیجیتالی تبدیل شده و در انتها، توسط نرمافزارهای مخصوص قابل تجزیه و تحلیل میشوند. البته شایان ذکر است که برخی از پرتوها نیاز به تقویتکنندههای قوی ندارند اما برخی نیاز به تقویت شدن مفصل دارند (17).
آنالیز اطلاعات
Gating
اطلاعات جمعآوری شده توسط فلوسیتومتر را میتوان در بُعد واحدی و یا در دو بعد و یا حتی سه بعد برای تولید یک هیستوگرام رسم نمود. مناطقی از این هیستوگرام را میتوان به صورت مرتب بر اساس شدت فلورسنت از هم جدا کرد. این کار با استفاده از “واحدهای استخراجی” انجام میگیرد که به آنها “گیت” میگویند. پروتکلهای اختصاصی Gating برای شناسایی بیماریها و همچنین اهداف کلینیک و آزمایشگاهی به خصوص در خونشناسی تعریف و ایجاد شده است. رسمها معمولاً در مقیاسهای لگارتیمی ساخته میشوند. از آنجا که طیف رنگهای فلورسنت با هم، همپوشانی دارند سیگنالها در دتکتورها (آشکارسازها) باید از نظر الکتریکی و محاسباتی جدا شوند (18). دادههای گردآوری شده با فلوسیتومتری توسط نرمافزارهای مختلفی مانند WinMD ، Flowjo، Cell quest Pro بررسی میشوند. بعد از اینکه دادهها جمعآوری شدند دیگر نیاز به اتصال دستگاه فلوسیتومتری نیست. به همین دلیل است که بررسیها معمولاً در رایانه جداگانهای انجام میگیرد (1,19).
جداسازي سلولي sorting
بيشترين مورد استفاده از فلوسایتومتری ارزيابي آنتیژنهاي سطحی بیانشده بر روی سلولها ميباشد، اما علاوه بر آن سلولها ممکن است با روشهاي مختلف برای اندازهگیری خصوصیات عملکردی بوسیله فلوسایتومتری مورد بررسی قرار گیرند. ميتوان تغییرات زماني بیان گیرندهها را تعيين كرد يا برهمكنش یک نوع سلول را با سلول دیگر اندازهگیری نمود. بعلاوه، امكان ارزيابي تغییرات در فعالیت آنزیمها و پتانسیل غشایی وجود دارد. همچنین ميتوان آزمایشاتی برای نشان دادن فاگوسیتوز و آزادسازی مولکولهای فعال زيستي (bioactive) انجام داد (20).
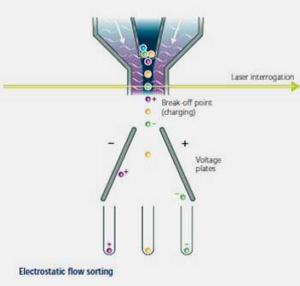
كارآيي اصلي اين جداسازها، جدا كردن جمعيتهاي سلولي دلخواه از ميان جمعيتي هتروژن از سلولها براي مطالعه بيشتر ميباشد. بطور كلي اگر سلول يا ذرهاي داراي خصوصيات منحصر به فردي از نظر فيزيكي يا شيميايي باشد با استفاده از آن خصوصيات ميتوان براحتي آن را شناسايي و توسط flow sorter از ديگر سلولهاي همراه جدا كرد (21).
شکل 6- جدا كردن جمعيتهاي سلولي دلخواه از ميان جمعيتي هتروژن از سلولها توسط دستگاه فلوسایتومتری نشان داده شده است.
نتیجهگیری
روش فلوسیتومتری در سایه افزایش تعداد آنتیبادیها، تترامرها و رنگهای تولید شده برای استفاده در ارزیابی فعالیت سلولها به عنوان یک ابزار مهم در مطالعه سلولهای سیستم ایمنی در آمده است و این امکان را فراهم آورده که انواع سلولهای موجود در نمونه خون یا سلولهای کشت شده به تفکیک مورد ارزیابی قرار بگیرند.
References:
- Shapiro HM. 2005. Practical flow cytometry: John Wiley & Sons
- Zharov VP, Galanzha EI, Shashkov EV, Kim J-W, Khlebtsov NG, Tuchin VV. 2007. Photoacoustic flow cytometry: principle and application for real-time detection of circulating single nanoparticles, pathogens, and contrast dyes in vivo. Journal of biomedical optics 12: 051503–14
- Darzynkiewicz Z, Zhao H. 2014. Cell cycle analysis by flow cytometry. eLS
- Riccardi C, Nicoletti I. 2006. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature protocols 1: 1458-61
- DOLEŽEL J, Bartoš J. 2005. Plant DNA flow cytometry and estimation of nuclear genome size. Annals of Botany 95: 99-110
- Givan AL. 2013. Flow cytometry: first principles: John Wiley & Sons
- Macey MG. 2007. Flow Cytometry: Springer
- Mao X, Lin S-CS, Dong C, Huang TJ. 2009. Single-layer planar on-chip flow cytometer using microfluidic drifting based three-dimensional (3D) hydrodynamic focusing. Lab on a Chip 9: 1583-9
- Mao X, Nawaz AA, Lin S-CS, Lapsley MI, Zhao Y, McCoy JP, El-Deiry WS, Huang TJ. 2012. An integrated, multiparametric flow cytometry chip using “microfluidic drifting” based three-dimensional hydrodynamic focusing. Biomicrofluidics 6: 024113
- Simonnet C, Groisman A. 2005. Two-dimensional hydrodynamic focusing in a simple microfluidic device. Applied Physics Letters 87: 114104
- Lee G-B, Chang C-C, Huang S-B, Yang R-J. 2006. The hydrodynamic focusing effect inside rectangular microchannels. Journal of Micromechanics and Microengineering 16: 1024
- Godin J, Chen C-H, Cho SH, Qiao W, Tsai F, Lo Y-H. 2008. Microfluidics and photonics for Bio-System-on-a-Chip: A review of advancements in technology towards a microfluidic flow cytometry chip. Journal of biophotonics 1: 355
- Perfetto SP, Ambrozak D, Nguyen R, Chattopadhyay P, Roederer M. 2006. Quality assurance for polychromatic flow cytometry. Nature protocols 1: 1522-30
- Chen H-T, Wang Y-N. 2009. Optical microflow cytometer for particle counting, sizing and fluorescence detection. Microfluidics and nanofluidics 6: 529-37
- Herzenberg LA, Tung J, Moore WA, Herzenberg LA, Parks DR. 2006. Interpreting flow cytometry data: a guide for the perplexed. Nature immunology 7: 681-5
- Robert S, Lacroix R, Poncelet P, Harhouri K, Bouriche T, Judicone C, Wischhusen J, Arnaud L, Dignat-George F. 2012. High-sensitivity flow cytometry provides access to standardized measurement of small-size microparticles—brief report. Arteriosclerosis, thrombosis, and vascular biology 32: 1054-8
- Goddard G, Martin JC, Naivar M, Goodwin PM, Graves SW, Habbersett R, Nolan JP, Jett JH. 2006. Single particle high resolution spectral analysis flow cytometry. Cytometry Part A 69: 842-51
- Lo K, Brinkman RR, Gottardo R. 2008. Automated gating of flow cytometry data via robust model‐based clustering. Cytometry Part A 73: 321-32
- Krutzik PO, Nolan GP. 2006. Fluorescent cell barcoding in flow cytometry allows high-throughput drug screening and signaling profiling. Nature methods 3: 361-8
- Ibrahim SF, van den Engh G. 2007. Flow cytometry and cell sorting. In Cell Separation, pp. 19-39: Springer
- Müller S, Nebe-von-Caron G. 2010. Functional single-cell analyses: flow cytometry and cell sorting of microbial populations and communities. FEMS microbiology reviews 34: 554-87
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5939936/
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام