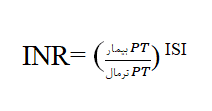روشهای آزمایشگاهی و استانداردهای بینالمللی
در تشخیص اختلالات انعقادی
(بخش دوم)
رویکرد عملی در تشخیص آزمایشگاهی و ملکولی کمبود فاکتور سیزده
(بخش دوم)
اکبر درگلاله1، 2، شادی طبیبیان1، دکتر شعبان علیزاده3، یداله فرشی1، مریم سادات حسینی1، فاطمه روشن ضمیر1
- کارشناس ارشد هماتولوژی و بانک خون، گروه هماتولوژی و بانک خون دانشکده پیراپزشکی، دانشگاه علوم پزشکی تهران، ایران
- دانشجوی دکترای تخصصی هماتولوژی و بانک خون، گروه هماتولوژی و بانک خون دانشکده پیراپزشکی، دانشگاه علوم پزشکی ایران، ایران
- استادیار ، دکترای تخصصی هماتولوژی و بانک خون، گروه هماتولوژی و بانک خون دانشکده پیراپزشکی، دانشگاه علوم پزشکی تهران، ایران
نویسنده مسئول:
- اکبر درگلاله، گروه هماتولوژی و بانک خون دانشکده پیراپزشکی، دانشگاه علوم پزشکی ایران، ایران
بررسی آزمایشگاهی کمبود فاکتور سیزده
سطح آنتیژنی فاکتور سیزده در ضدانعقادهای مختلف مانند هپارین، سیترات و یا [1]EDTA تقریباً یکسان است. سطح سرمی فاکتور سیزده پایینتر از سطح پلاسمایی آن است که دلیل این تفاوت، کاهش زیرواحد A فاکتور سیزده (FXIII-A) در سرم میباشد. همچنین زمانی که غلظت هموگلوبین در حدود 0/5 تا 1 μg/μl باشد تأثیری بر میزان فعالیت فاکتور سیزده بوسیله روش ادغام آمین[2] نمیگذارد. همچنین مشخص شد که هنگامی که بیلیروبین با پلاسمای طبیعی برای ایجاد غلظت تا 0/2 نانوگرم بر میکرولیتر (20 میلیگرم در دسیلیتر) از بیلیروبین مخلوط شود فعالیت فاکتور سیزده در حدود 6% با استفاده از روش ادغام آمین افزایش مییابد ولی در روش فلورسانس حتی در غلظتهای بالای بیلیروبین افزایشی در سطح فعالیت فاکتور سیزده مشاهده نمیشود. فعالیت فاکتور سیزده در انواع مختلف پلاسما مانند پلاسمای تازه، پلاسمای تازه منجمد شده[3] و حتی پلاسمای تاریخ گذشته بانک خون[4] تقریباً مشابه است، اما در صورتی که پلاسما در دمای اتاق به مدت 3 روز نگهداری شود، فعالیت فاکتور سیزده کاهش مییابد. پلاسما را میتوان در غلظت 0/05 مولار سیترات سدیم قرار داده و در دمای 20- درجهی سانتیگراد و 7/1= pH برای 10 تا 12 هفته و یا حتی بیشتر ذخیره کرد، بدون اینکه کاهشی در سطح فاکتور مشاهده شود. هنگامی که دیتیوتریتول[5] به پلاسما اضافه شود منجر به افزایش 2 تا 8 برابری فعالیت فاکتور سیزده در طول مدت ذخیرهسازی نمونه میگردد.
آزمایشهای غربالگری خط اول
آزمایشهای غربالگری خط اول شامل آزمایشهای BT، PT، APTT و شمارش تعداد پلاکت میباشد. اگرچه آزمایشهای PT و APTT معمولترین تستهای انعقادی در آزمایشگاه انعقاد هستند، ولی برای ارزیابی کمبود فاکتور انعقادی بسیار حساس نیستند، با این وجود این آزمایشهای معمول انعقادی باید به عنوان گام نخست در تشخیص آزمایشگاهی اختلالات خونریزیدهنده مورد استفاده قرار گیرد. تمامی این آزمایشهای معمول آزمایشگاهی در بیماران مبتلا به کمبود فاکتور سیزده طبیعی هستند.
زمان پروترومبین (PT)
در طی روند آزمایشگاهی PT، پلاسمای فقیر از پلاکت (PPP) با ترومبوپلاستین[6] (فاکتور بافتی[7]) و کلریدکلسیم مخلوط شده سپس زمان لخته شدن خون اندازهگیری میشود. این آزمایش فاکتورهای انعقادی درگیر در مسیر خارجی (فاکتور VII) و مشترک (فاکتور X، V، II و فیبرینوژن)، آبشار انعقادی را ارزیابی کرده و نیز برای ارزیابی درمان با وارفارین استفاده میشود. به دلیل حساسیت متفاوت معرفهای ترومبوپلاستین تجاری، به منظور حل مشکل تفاوت در نتایج PT در میان آزمایشگاههای مختلف، INR[8] توسط سازمان بهداشت جهانی (WHO) معرفی شده است. تفاوت بین ترومبوپلاستین استاندارد تهیه شده توسط WHO و معرفهای ترومبوپلاستین تجاری به عنوان شاخص حساسیت بینالمللی ([9]ISI) تعریف شده و INR به این روش محاسبه میشود:
زمان ترومبوپلاستین نسبی فعال شده (APTT)
آزمایش APTT طولانی در کمبود فاکتورهای درگیر در مسیر مشترک (X، V، II و فیبرینوژن) و فاکتورهای دخیل در مسیر درونی (XI، IX و VIII) آبشار انعقاد و نیز در طول درمان با هپارین مشاهده میشود. در این آزمایش PPP با معرف APTT (شامل ترومبوپلاستین نسبی و عوامل لختهکننده مانند کائولین[10]، سیلیس میکرونیزهشده [11] ، و اسید الاژیک[12]) و کلریدکلسیم در ºC37 مخلوط شده و سپس زمان تشکیل لخته اندازهگیری میشود.
زمان خونروی (BT)
آزمایش BT اگر چه جزء اولین آزمایشهای غربالگری برای عملکرد پلاکت و سنجش فاکتور فونویلبراند بود ولی از آنجایی که این آزمایش دارای اشکالات متعددی میباشد، امروزه کمتر انجام شده و به عنوان یک آزمایش بالینی توصیه نمیشود. این آزمایش با چندین روش مختلف شامل، روش Duck، Ivy و زمان خونروی Template[13](TBT) انجام میشود. این آزمایش تحتتأثیر عوامل مختلفی از جمله فرد آزمایشکننده، دمای پوست، فشار وریدی، جهت و عمق و وسعت زخم قرار میگیرد. از آنجایی که برخی از عوامل ذکرشده مانند فشار وریدی، جهت، طول و عمق برش در روش TBT استاندارد شده، این روش از میان روشهای مختلف آزمایش زمان خونروی قابل قبولتر میباشد.
شمارش پلاکت
شمارش پلاکت در محدوده 103 ×450-150 بر میکرولیتر میباشد. کاهش در شمارش پلاکت ممکن است با افزایش خطر خونریزی همراه باشد. گرچه اغلب موارد کاهش در تعداد پلاکت شمارش شده به علت کاهش واقعی تعداد پلاکت در خون بوده، ولی ترومبوسیتوپنی کاذب[14] از مشکلات شایع در آزمایشگاه هماتولوژی بوده و ممکن است در اثر عوامل مختلفی روی دهد. از جمله این عوامل میتوان به آگلوتیناسیون پلاکتی، اتصال پلاکت به نوتروفیل و سندرمهای ماکروترومبوسیتوپنی کاذب[15] اشاره کرد، بنابراین بررسی لام خون محیطی در تشخیص این موارد میتواند کمککننده باشد. گرچه آزمایشهای معمول انعقادی در تشخیص بسیاری از موارد کمبود فاکتورهای انعقادی مؤثر هستند، اما نتایج حاصل از این آزمایشها در کمبود فاکتور سیزده طبیعی بوده و بنابراین این آزمایشها قادر به تشخیص کمبود فاکتور سیزده نیستند.
آزمایش حلالیت لخته
آزمایش حلالیت لخته نخستین گام برای تشخیص کمبود فاکتور سیزده بوده و اولین مورد کمبود فاکتور سیزده در سال 1960 توسط این روش تشخیص داده شد. آزمایش حلالیت لخته در محلولهای اوره، اسید استیک یا مونوکلرواستیک اسید (MCA) برای غربالگری کمبود فاکتور سیزده استفاده میشود. آزمایش حلالیت لخته در محیط اوره و مونوکلرواستیک اسید به طور معمول به منظور تشخیص کمبود فاکتور سیزده استفاده میشوند. روش استانداردی برای آزمایش حلالیت لخته وجود نداشته و روشهای مختلف برای انجام این آزمایش معرفی شدهاند. برای انجام این آزمایش، ابتدا 9 حجم از خون با 1 حجم ضدانعقاد سیترات سدیم 3/2٪ مخلوط شده و پس از جدا کردن پلاسما، کلریدکلسیم با یا بدون ترومبین و بافر به پلاسما اضافه میشود و بعد محلول برای تشکیل لخته، 1 ساعت در دمای اتاق یا 37 ºC انکوبه میشود. سپس لختهی ایجاد شده در محلول اوره 5 مولار یا MCA یا اسید استیک معلق شده و سپس در دمای اتاق یا ºC37 انکوبه میشود. در پایان کار، حل شدن لخته به طور منظم در 15 دقیقه، 1 و 24 ساعت مورد بررسی قرار میگیرد. در نمونه دارای کمبود فاکتور سیزده، لخته عموماً در عرض چند دقیقه تا 1 ساعت حل میشود، اما در نمونه فرد طبیعی، لخته حدود یک روز و یا بیشتر پایدار میماند. در روش مبتنی بر اسید استیک، لخته شکل گرفته در محلول استیک اسید معلق شده و سپس به مدت 6 ساعت انکوبه میشود. در روش نیمه کمی برای تشخیص کمبود فاکتور سیزده، نمونه پلاسما با اضافه کردن ترومبین لخته شده، و سپس لخته در رقتهای مختلف محلول اوره و یا MCA معلق میشود. در گذشته، آزمایش حلالیت لخته در محلول MCA برای شناسایی میزان فعالیت فاکتور سیزده انجام میشده است. در این روش، پلاسمای رقیق شده با فاکتور سیزده تهی از فیبرینوژن مخلوط شده، سپس پلاسما با افزودن ترومبین و کلریدکلسیم (CaCl2) لخته میشود و بعد حل شدن لخته به وسیلهی اضافه کردن MCA 1 درصد بررسی میشود.
آزمایش حلالیت لخته روش کیفی بوده و فقط قادر به تشخیص نوع شدید کمبود فاکتور سیزده میباشد. آزمایشهای حلالیت اوره و MCA در صورتی مثبت خواهند شد که سطح فاکتور سیزده پلاسمایی خیلی اندک باشد (تقریباً 1٪)، در حالیکه حساسیت آزمایش حلالیت استیک اسید حدود 2 برابر بیشتر از روش اوره و مونوکلرواستیک اسید میباشد. اگر چه، آزمایش حلالیت استیک اسید حساستر و سریعتر از آزمایش حلالیت در محیط اوره است، اما اختصاصیت کمتری داشته و مشاهده شده است که پلاسمای عادی تقریباً بعد از 4 روز در استیک اسید حل میشود، در حالیکه هرگز در روش حلالیت در اوره این حالت رخ نمیدهد. در روش معمول حلالیت لخته، اگر سطح فاکتور سیزده بیش از 2٪ باشد، ممکن است بیماران مبتلا به کمبود فاکتور سیزده به اشتباه، طبیعی تشخیص داده شود. کمیته بینالمللی ISTH برای تشخیص و طبقهبندی کمبود فاکتور 13 الگوریتمی توصیه کرده که به صورت زیر است:
- آزمایش کمی فعالیت عملکردی فاکتور سیزده به عنوان خط اول برای تشخیص کمبود فاکتور سیزده درخواست میشود. این آزمایش قادر به تشخیص تمامی حالات کمبود فاکتور سیزده میباشد. در نتیجه، اگر فعالیت فاکتور سیزده کاهش یابد، بررسیهای بیشتری برای تشخیص و طبقه بندی کمبود فاکتور سیزده توصیه میشود.
- سطح آنتیژنی فاکتور سیزده (A2B2) در پلاسما اندازهگیری میشود. اگر غلظت آنتیژن آن کاهش یابد، بررسیهای بیشتری برای تعیین کمبود زیرگروه کمبود فاکتور سیزده باید انجام گیرد. ابتدا سطح آنتیژنی زیرواحدهای A و B فاکتور سیزده اندازهگیری میشود. برای شناسایی کمبود فاکتور سیزده نوع پلاکتی، میزان فعالیت و سطح آنتیژنی زیرواحد A فاکتور سیزده در لیزات پلاکت باید انجام گیرد.
- برای تشخیص اتوآنتیبادی علیه زیرواحدهای فاکتور سیزده، روش مخلوط کردن پلاسما[16] و روش اتصالشونده[17] باید انجام شود. روش مخلوط کردن پلاسما و روش اتصالشونده باید به ترتیب برای تشخیص آنتیبادیهای خنثیکننده علیه زیرواحد A و آنتیبادیهای غیر خنثیکننده علیه زیرواحد B انجام گیرد.
- اگر تمام آزمایشهای فوق طبیعی بودند، آزمایشهای تکمیلی مانند ارزیابی اتصال متقاطع فیبرین توسط سدیم دودسیل سولفات-پلیآکریلآمید ([18]SDS-PAGE) انجام میگیرد.
- در نهایت شناسایی مولکولی نقص ژنتیکی فاکتور سیزده توصیه میشود.
آزمایشهای کیفی برای تشخیص کمبود فاکتور سیزده (علل مثبت و منفی کاذب)
در پی نتیجه طبیعی در آزمایشهای انعقادی معمول، کمبود فاکتور سیزده با استفاده از روش کیفی ارزیابی میشود. در این روش پلاسمای بیماران مبتلا، به منظور تشکیل لخته با ترومبین با یا بدون کلسیم انکوبه میشود. سپس لخته در محلول 1% مونوکلرو استیک اسید یا2% استیک اسید یا اوره 5 مولار معلق میشود. حضور فاکتور سیزده در نمونهی پلاسما باعث میشود لخته نامحلول باقی بماند، در حالیکه لیز شدن سریع لخته نشاندهندهی کمبود فاکتور سیزده میباشد. تنها در صورتی که فعالیت فاکتور سیزده در نمونهی پلاسما بسیار پایین (معمولاً صفر یا نزدیک به صفر) باشد نتیجهی این آزمایش مثبت میشود. در بیمارانی که سطح فعالیت فاکتور سیزده بالاتر از محدوده 3-1% باشد، نتیجه آزمایش طبیعی خواهد بود. گرچه براساس نوع محلول لختهکننده و معرف حلکنندهی لخته استفاده شده، حساسیت آزمایش حلالیت لخته متفاوت بوده ولی اکثر آزمایشگاهها از آزمایش حلالیت لخته با استفاده از مونوکلرو استیک اسید استفاده میکنند که در بین روشهای مختلف آزمایش حلالیت لخته، حساسیت کمتری داشته و فقط در موارد شدید کمبود فاکتور سیزده غیرطبیعی میشود.
محدودیتهای آزمایش حلالیت لخته
آزمایش حلالیت لخته استاندارد نبوده و بررسیهای بیشتر الزامی است. حساسیت این آزمایش بسته به سطح فیبرینوژن، معرف استفاده شده برای منعقد کردن خون (یون کلسیم، ترومبین و غیره) و عوامل حلکنندهی لخته (مونوکلرواستیک اسید، استیک اسید و اوره 5 مولار) متفاوت است. بکارگیری ترکیبی از استیک اسید/ترومبین، استیک اسید/کلسیم، و همچنین اوره/کلسیم، و اوره/ترومبین باعث تغییر نسبی در حساسیت آزمایش حلالیت لخته میشود. حساسیت روش اوره/کلسیم مورد تردید بوده و اتفاق نظری در متون در مورد آن وجود ندارد. از طرف دیگر سطح آستانه تشخیصی فاکتور سیزده توسطJakobsen وGodal در سال 1974 حدود 5-3%، توسط Francis در سال 1980 کمتر از 0/5 درصد و توسط Jenning و همکارانش در سال 2003 در حدود 5-1% گزارش شده است. Jennings و همکارانش همچنین گزارش کردند که کاهش فاکتور سیزده به کمتر از 10 درصد موجب غیرطبیعی شدن آزمایش حلالیت لخته به روش ترومبین/استیک اسید میشود که نشاندهنده حساسیت نسبتاً بالای این روش میباشد، در حالیکه حساسیت روش کلسیم/استیک اسید و ترومبین/اوره متوسط است. Francis در سال 1980 گزارش داد که آستانهی سطح شناسایی فاکتور سیزده در پلاسما توسط روش استیک اسید/کلسیم محدود به صفر تا 3 درصد است. اطلاعات گزارش شده توسط Peihong و همکارانش در سال 2014 نشان داد که آزمایش حلالیت لختهی مرسوم در آزمایشگاهها فقط قادر به تشخیص 16 درصد از بیماران با سطح فاکتور سیزده پلاسمایی کمتر از 2% میباشد، در حالی که استفاده از روش ترومبین میتوانست توانایی بیشتری در شناسایی همین بیماران داشته باشد. در این مطالعه، نمونهی با سطح 1% از سطح فاکتور سیزده نیز در روشهای مرسوم دقیقتر از نمونهی با سطح 2% فاکتور سیزده تشخیص داده شد. بیماران مبتلا به هیپرفیبرینولیز باید کنار گذاشته شوند چرا که این وضعیت مانع از شکلگیری و تثبیت لخته خونی میشود. به طور کلی، آزمایش حلالیت لختهی با استفاده از ترومبین به خصوص روش ترکیبی ترومبین/استیک اسید حساستر است. باید در نظر داشت که این روش قادر به افتراق بین فرم شدید بیماری از حالت متوسط یا خفیف، هتروزیگوت از هموزیگوت و فرم اکتسابی از فرم ارثی نیست. در فرم اکتسابی ناشی از مهارکننده ضد فاکتور سیزده، به دلیل مقدار کم مهارکنندهی فاکتور سیزده در اغلب موارد، میزان فعالیت فاکتور سیزده کمتر از 1% کاهش نمییابد، بنابراین موارد با این وضعیت بوسیلهی روشهای غیرحساس تشخیص داده نمیشوند، به علاوه تجویز فاکتور سیزده طی چند هفته قبل از انجام آزمایش حلالیت لخته، نتایج این آزمایش را طبیعی نشان میدهد. با توجه به بالا بودن تعداد بیمارانی که به وسیله آزمایش حلالیت لخته تشخیص داده نشده و یا دیر تشخیص داده میشوند امروزه این روش به عنوان یک آزمایش غربالگری روزمره توصیه نمیشود.
منابع:
- Upreti S, Upreti S, Bansal R, Jeelani N, Bharat V. Types and Frequency of Preanalytical Errors in Haematology Lab. Journal of clinical and diagnostic research: JCDR. 2013;7(11):2491.
- Lippi G, Buonocore R, Musa R, Ippolito L, Picanza A, Favaloro E. The effect of hyperglycaemia on haemostasis testing–a volunteer study. Anaesthesia. 2014.
- Jennings I, Kitchen S, Woods T, Preston F. Problems relating to the laboratory diagnosis of factor XIII deficiency: a UK NEQAS study. J Thromb Haemost. 2003;1(12):2603-8.
- Borhany M, Shamsi T, Moiz B, Hasan K, Hashmi KZ, Ayyub M, et al. Guidelines on the laboratory diagnosis of congenital bleeding disorders in Pakistan. JPMA The Journal of the Pakistan Medical Association. 2012;62(5):477-86.
- Gregory TF, Cooper B. Case report of an acquired factor XIII inhibitor: diagnosis and management. Proc (Bayl Univ Med Cent). 2006;19(3):221.
- Lillicrap D, Nair S, Srivastava A, Rodeghiero F, Pabinger I, Federici A. Laboratory issues in bleeding disorders. Haemophilia. 2006;12(s3):68-75.
- Tripodi A, Caldwell S, Hoffman M, Trotter J, Sanyal A. Review article: the prothrombin time test as a measure of bleeding risk and prognosis in liver disease. Aliment Pharmacol Ther. 2007;26(2):141-8.
- Kamal AH, Tefferi A, Pruthi RK, editors. How to interpret and pursue an abnormal prothrombin time, activated partial thromboplastin time, and bleeding time in adults. Mayo Clin Proc; 2007: Elsevier.
- Horsti J, Uppa H, Vilpo JA. Poor agreement among prothrombin time international normalized ratio methods: comparison of seven commercial reagents. Clin Chem. 2005;51(3):553-60.
- Tripodi A, Chantarangkul V, Martinelli I, Bucciarelli P, Mannucci PM. A shortened activated partial thromboplastin time is associated with the risk of venous thromboembolism. Blood. 2004;104(12):3631-4.
- Kozek-Langenecker S. Management of massive operative blood loss. Minerva Anestesiol. 2007;73(7/8):401.
- Philipp C, Miller C, Faiz A, Dilley A, Michaels L, Ayers C, et al. Screening women with menorrhagia for underlying bleeding disorders: the utility of the platelet function analyser and bleeding time. Haemophilia. 2005;11(5):497-503.
- Michelson AD, Frelinger AL, Furman MI. Current options in platelet function testing. The American journal of cardiology. 2006;98(10):S4-S10.
- Yardumian D, Mackie I, Machin S. Laboratory investigation of platelet function: a review of methodology. J Clin Pathol. 1986;39(7):701-12.
- Harrison P. Platelet function analysis. Blood Rev. 2005;19(2):111-23.
- Marchant K, Corcoran G. The laboratory diagnosis of platelet disorders. An algorithmic approach. Arch Pathol Lab Med. 2002;126:133-46.
- Fadoo Z, Merchant Q, Rehman KA. New developments in the management of congenital Factor XIII deficiency. J Blood Med. 2013;4:65.
- Shanbhag S, Shetty S, Kulkarni B, Ghosh K. An improved, semi quantitative clot based assay for factor XIII. Haemophilia. 2011;17(4):718-20.
- Tahlan A, Ahluwalia J. Factor XIII: Congenital Deficiency Factor XIII, Acquired Deficiency, Factor XIII A-Subunit, and Factor XIII B-Subunit. Arch Pathol Lab Med. 2014;138(2):278-81.
- Lovejoy AE, Reynolds TC, Visich JE, Butine MD, Young G, Belvedere MA, et al. Safety and pharmacokinetics of recombinant factor XIII-A2 administration in patients with congenital factor XIII deficiency. Blood. 2006;108(1):57-62.
- Anwar R, Miloszewski KJ. Factor XIII deficiency. Br J Haematol. 1999;107(3):468-84.
- Ghosh S, McEvoy P, McVerry B. Idiopathic autoantibody that inhibits fibrin monomer polymerization. Br J Haematol. 1983;53(1):65-72.
- Schroedera V, Durrerb D, Meilic E, Schubigerd G, Kohlera HP. Congenital factor XIII deficiency in Switzerland.
- Kamitsuji H, Tani K, Yasui M, Taniguchi A, Taira K, Tsukada S, et al. Activity of blood coagulation factor XIII as a prognostic indicator in patients with Henoch-Schönlein purpura. Eur J Pediatr. 1987;146(5):519-23.
[1] – Ethylenediaminetetraacetic acid
[2] – Amine incorporation assay
[3] -Fresh Frozen Plasma
[4] – Out-dated blood bank plasma
[5] – Dithiothreitol
[6] – Thromboplastin
[7] -Tissue Factor
[8] – International normalized ratio
[9] – International Sensitivity Index
[10] – Kaolin
[11] – Mi- cronized silica
[12] – Ellagic acid
[13] – Template Bleeding Time
[14] – Pseudothrombocytopenia
[15] – Macrothrombocytopenia
[16] – Mixing study
[17] – Binding assay
[18] – Sodium Dodecylsulfate-Polyacrylamide
روشهای آزمایشگاهی و استانداردهای بینالمللی در تشخیص اختلالات انعقادی (بخش اول)
https://medlabnews.ir/%d8%a2%d8%b2%d9%85%d8%a7%db%8c%d8%b4%d9%87%d8%a7%db%8c-%d8%a7%d9%86%d8%b9%d9%82%d8%a7%d8%af%db%8c-ptt-aptt/
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام