تکنیکهای شناسایی جهشها
دکتر مهدی فصیحی رامندی (عضو هیئت علمی دانشگاه علوم پزشکی بقیها…(عج))
زهرا کریمی (مرکز تحقیقاتی زیست سلول پژوهان تدبیر)
دکتر رضا میرنژاد (استاد دانشگاه)
الكتروفورز ژل دناتورهکننده با شيب غلظت
تكنيك الكتروفورز ژل دناتورهکننده با شيب غلظت[1] (DGGE)، كارآمدتر و حساستر از SSCP بوده و بيش از 95% قدرت تشخيص جهشها را دارد، اما راهاندازي آن پيچيده و مشكل است. اساس اين تكنيك بر اين امر استوار است كه در شرايط ثابت محيطي، نقطه ذوب يك قطعه از DNA دو رشتهاي به توالي و تركيب نوكلئوتيدهاي آن بستگي دارد. دو قطعه DNA كه در يك جفت باز با هم اختلاف دارند، ممكن است شرايط ذوب بسيار متفاوتي داشته باشند.
محصول PCR بر روي ژل پلياكريلاميد كه شرايط دناچوراسيون آن از بالا به پايين در حال افزايش است (غلظت اوره و فرماميد از بالا به پايين ژل افزايش مييابد) قرار داده ميشود. در اين حالت، دو قطعه DNA كه در يك جفت باز با هم اختلاف دارند در يك نقطه از ژل دناچوره نميشوند. وقتي مولكولها به سطح بحراني دناتوره برسند، دو رشته DNA شروع به جدا شدن ميكنند. اين نقطه بهعنوان نقطه ذوب عمل ميكند. هرگاه قطعه DNA دناچوره شود، سرعت حركت آن در ژل بهشدت كاهش مييابد، زيرا دو تك رشته حاصل به كمك مولكول سورالن[2] به يكديگر متصل شده و حجم آنها افزايش مييابد، در نتيجه عبور اين تك رشتهها از خلال ماتريكس ژل كند ميشود. مولكول سورالن پس از اتمام PCR به انتهاي مولكول DNA متصل ميشود. اگر هر دو آلل ژن مشابه هم باشند، محصول PCR يك نوع DNA دو رشتهاي خواهد داشت، در نتيجه طي آزمايش DGGE يك باند بر روي ژل مشاهده ميشود. اگر دو آلل حاوي جهش بوده و جهش در هر دو آلل يكسان باشد، محصول PCR شامل يك نوع DNA دو رشتهاي موتانت ميباشد. در اين حالت نيز در ژل الكتروفورز يك باند ديده ميشود، اما محل اين باند با باند DNA سالم ميتواند متفاوت باشد. اگر دو آلل يك ژن از لحاظ جهش نقطهاي با هم تفاوت داشته باشند، محصول PCR بهصورت هترودوپلكس خواهد بود. اين هترودوپلكسها پس از اتمام PCR و با حرارت دادن محصول واكنش بوجود ميآيند.
شيب غلظت عامل دناچورهكننده بايد با توجه به توالي قطعه مورد بررسي تعيين شود و در اصطلاح با توالي قطعه سازگار باشد. قطعات استانداردي وجود دارد كه با استفاده از آنها ميتوان شرايط محيطي را كنترل و تنظيم نمود.
در تكنيك DGGE نيازي به مواد شيميايي سمي و يا راديواكتيو نيست، ولي ابزارهاي پيشرفته لازم است. نوع مشابهي از اين روش به نام TGGE وجود دارد كه در آن از حرارت بهجای غلظت مواد شيميايي در ژل استفاده ميشود. براي واسرشت شدن كامل قطعات حاصل از PCR، از يك ناحيه مصنوعي حاوي بالاترين دماي ذوب به نام clamp استفاده ميشود.
آزمايش كوتاه شدن پروتئين
آزمايش كوتاه شدن پروتئين[3] (PTT) براي يافتن جهشهايي طراحي شده است كه طي آن اندازه پروتئين كدشده توسط ژن كوتاه ميشود (جهشهايي مثل ايجاد كدون خاتمه، تغيير چارچوب و حذف قسمتي از ژن بهخصوص در ژنهاي بزرگ).
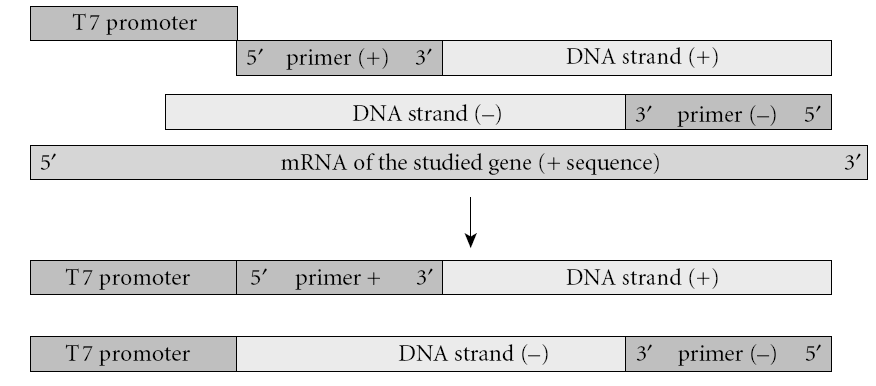
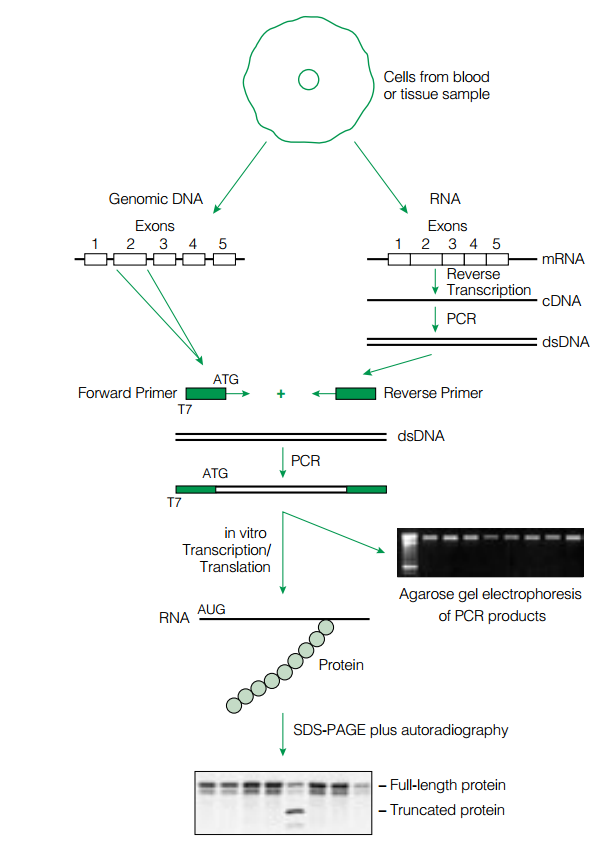
اين روش شامل يك RT-PCR با استفاده از دو پرايمر ميباشد. پرايمر منفی موجب ساخته شدن رشته شده و پرايمر مثبت در انتهاي ′5 خود پروموتر فاژ T7 را به همراه دارد. قطعه RNA به روش RT-PCR تكثير شده و بهصـــــورت in vitro ترجمه ميشود. قطعات ساختهشده، به يك سيستم رونويسي/ترجمه in vitro منتقل ميشوند. اين سيستم كه معمولاً رتيكولوسيت است، حاوي tRNA و اسيدآمينه میباشد. بعضي از اسیدآمینههای اين سيستم توسط راديواكتيو نشاندار شدهاند. بعد از ساخت پپتيد، محلول موجود در لوله بر روي ژل پلياكريلاميد حاوي SDS قرار داده ميشود. الكتروفورز انجام شده و پپتيد بر روي غشاي نيتروسلولزي منتقل ميشود. در اين مرحله وسترن بلات و اتوراديوگرافي انجام شده و اندازه پپتيد حاصل با پپتيد استاندارد و سالم مقايسه ميشود (شکل 1). اين تكنيك بهطور گسترده براي بررسي جهش در ژنهاي (Adenomatous Polyposis Coli )APC، MSH2، MLH1 و ديستروفين بهكار ميرود.
الف:
ب:
شكل 1- اساس تكنيك PTT
الف:mRNA ژن موردنظر با كمك پرايمرهاي (+) و (-) و استفاده از تكنيك RT-PCR تكثير میشوند. قطعه بين دو پرايمر كه در اين مرحله حاوي پروموتر T7 ميباشد، وارد سيستم رونويسي/ ترجمه ميشوند. در اين سيستم، از tRNA حاوي آمينواسيد نشاندار استفاده ميشود.
ب: پيپيدهاي ساختهشده، با استفاده از SDS-PAGE، جدا شده و به روي غشاء منتقل ميشوند. با استفاده از وسترن بلات و اتوراديوگرافي، اندازه قطعات تعيين و با حالت استاندارد مقايسه ميشود
برش شيميايي فاز جامد
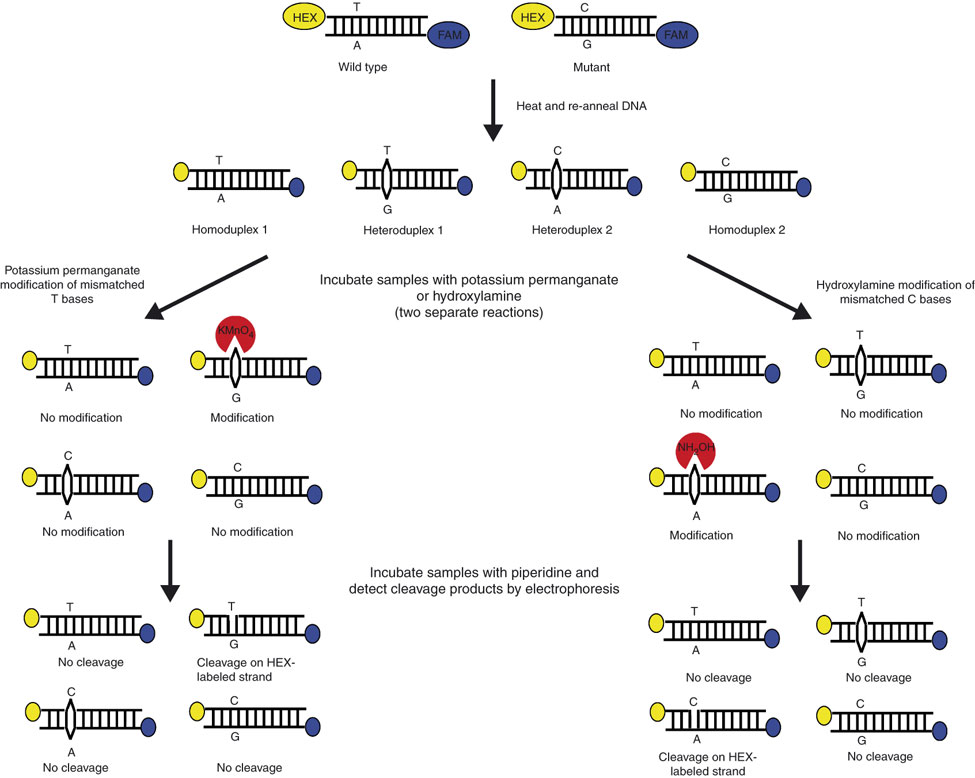
برش شيميايي نوكلئوتيدهاي متصلنشده[4](CCM) يكي از روشهاي انتخابي در تشخيص جهش ميباشد. اين روش قادر به شناسايي تمام جفت نوكلئوتيدهاي متصلنشده و تکرشتهای ميباشد. نوكلئوتيدهاي متصلنشده،[5] ناپايدار بوده و بهشدت مستعد واكنش آنزيمي و شيميايي ميباشند. در اين تكنيك ابتدا از دو ماده شيميايي هيدروكسيلآمين و پرمنگنات پتاسيم، بهمنظور واكنش با بازهاي سيتوزين و تيمين تک رشتهای استفاده ميشود، سپس نمونه با پيپريدين مجاور شده و بازهاي ناجور كه در مرحله قبل تغيير يافتهاند، بريده ميشوند. قطعات حاصل از برش مرحلۀ قبل، بر روي ژل پلياكريلاميد دناچوران الكتروفورز ميشود تا مكان بازهاي جهشیافته مشخص شود (شکل 2). در طول زمان، اين روش تغييراتي كرده است و در نتيجه مزايايي نيز كسب كرده است كه ميتوان به موارد زير اشاره نمود:
- پرمنگنات پتاسيم (KMnO4) جايگزين ماده سمي تترا اكسيد اسميوم (OsO4) شده است.
- اگر هر دو نمونه DNA وحشي و جهشیافته نشاندار شوند، شانس شناسايي جهش دو برابر خواهد شد.
- اين روش حساس بوده و با مقدار نمونه كمتر از 0/1 ميكروگرم نيز ميتوان جهش را شناسايي كرد.
- همه مراحل آزمايش بر روي سطح جامد ذرات سیلیکونی انجام ميگيرد. در نتيجه براي تغييرات و دستكاريهاي بعدي مناسب است.
شکل 2: تصویر شماتیک برش شیمیایی فاز جامد
دو نمونه طبیعی و جهشیافته به کمک آغازگر مستقیم نشاندار شده با HEX (زرد) و آغازگر معکوس نشاندار شده با 6-FAM (آبی) تکثیر شده و از آنها هترودوپلکس تهیه میشود. هترودوپلکس حاصل بر روی فاز جامد سلیکا تثبیت شده و به کمک واکنشهای شیمیایی تغییر میکند. یکی از این نمونهها با هیدروکسیل آمین (بهمنظور تغییر باز ناجور C) و دیگری با پرمنگنات پتاسیم (بهمنظور تغییر شیمیایی باز ناجور T) تیمار میشوند. پیپریدین بازهای تغییریافته را برش داده و رشته DNA از فاز جامد جدا شده و بهصورت کاپیلاری الکتروفورز میشود
اين تكنيك بر اساس تشكيل هترودوپلكس بنا نهاده شده است، بنابراين بهمنظور انجام آزمايش، دو قطعه مكمل نمونه و كنترل را با هم مخلوط كرده، ذوب ميكنند. دوباره با كاهش دما، اين دو رشته به هم متصل ميشوند. اگر توالي اين دو قطعه با هم يكسان نباشد، بر روي هترودوپلكس حاصل، باز متصل نشده و تکرشتهای قرار ميگيرد. بازهاي ناجور C,T مستعد تغييرات و برش شيميايي ميباشند. از آنجا كه همۀ انواع جفتهاي ناجور C,T(CC, CT, CA, TT, TG, TC) در اين روش شناسايي و بريده ميشوند، پس با استفاده از DNA كاوشگر كنترل (وحشي) و جهشیافته، ميتوان همۀ جهشهاي نقطهاي را غربالگري نمود. بهمنظور دو برابر شدن احتمال شناسايي جهش، بهتر است كه هر دو نمونه وحشي و جهشيافته را نشانداركرد. كاوشگر DNA را میتوان بهصورت اوليگونوكلئوتيد مصنوعي ساخت و يا با استفاده از PCR از ژنوم موجود زنده به دست آورد.
مواد لازم برش شیمیایی فاز جامد:
1) TE buffer:
100µl of 1 M Tris-HCl (pH 8.0)
20 µl of 0.5 Methylenediamine-tetraacetic acid (EDTA)
9.88 mL of distilled water
Store the TE buffer at room temperature
2) 4.2 M Hydroxylamine solution:
1.39 g solid hydroxylamine hydrochloride is dissolved in 1.6 mL distilled water
اين محلول را با حدود 1 سيسي دي اتيل آمين به pH=6 برسانيد.
Distilled water to 4ml
Store at –20°C for up to 6 months
3) 3 M tetraethylammonium chloride (TEAC) solution:
49.7 g of tetraethylammonium chloride is dissolved in 100 mL distilled water. Store at 4°C for up to 3 months.
4)1 mM KMnO4 solution:
80mg of KMnO4 is dissolved in 5 mL of distilled water.
µl10 از اين محلول را با µl900 از محلول 3 مولار TEAC مخلوط كنيد تا محلول 1 ميليمولي از KMnO4 بدست آيد. اين محلول بايد تازه باشد.
5) Cleavage-dye solution:
20µl undiluted Piperidine
64µl formamide
16µl dye (50 mg blue dextran per mL)
Store at 4°C for 1 d.
6) Fluorophore 6-FAM and HEX for the 5′ and 3′ primers
7) Tris-borate EDTA (TBE) buffer for electrophoresis (pH = 8.0):
16.2 g Tris base,
8.1 g boric acid,
1.12 g EDTA
1500 mL distilled water,
Store at 25°C.
8) كيت PCR
9) كيت تخليص محصول PCR
10) بستر جامد (Solid support for DNA)
روش انجام كار:
همه مراحل كار بايد در زير هود انجام شود، زيرا مواد مورد استفاده در اين آزمايش از قبيل اكريلاميد، هيدروكسيل آمين، فرماميد و پيپريدين سمي هستند.
آمادهسازی نمونه:
قطعه موردنظر را با استفاده از پرايمرهاي نشاندار شده با فلوروفور PCR نماييد، سپس قطعه حاصل را با كمك كيت تخليص محصول PCR يا به روش برش باند موردنظر از ژل، جدا كنيد. غلظت DNA را با كمك جذب UV در nm260 يا بر روي ژل محاسبه كنيد.
تشكيل هترودوپلكس:
مقدار مساوي از DNA وحشي و جهشیافته را برداشته و در بافر TE مخلوط نماييد. محلول را در ترموسايكلر قرار داده، به مدت 7 دقيقه 99 درجه سلسیوس گرما داده و سپس دما را به ْ65 رسانده و يك ساعت در اين دما نگهداريد. در نهايت به مدت 30 دقيقه در 25 درجه سلسیوس قرار دهيد تا محلول خنك شود.
اتصال هترودوپلكس و همودوپلكس به ذرات سیلیکونی:
- µl1 از DNA هترودوپلكس را به درون دو ميكروتيوب بريزيد (يك ميكروتيوب براي واكنش با پرمنگنات پتاسيم و ديگري براي واكنش هيدروكسيل آمين).
- µl1 از DNA همودوپلكس را به درون دو ميكروتيوب بريزيد (يك ميكروتيوب براي واكنش با پرمنگنات پتاسيم و ديگري براي واكنش هيدروكسيل آمين).
- µl2/5 از سوسپانسيون اتصال ذرات سیلیکونی را به هرکدام از ميكروتيوبها اضافه كرده و 2-1 ساعت در دماي اتاق، بر روي شيكر قرار دهيد.
- با استفاده از µl200 محلول شستشو، ذرات حاوي DNA را دو بار شستشو دهيد.
- ذرات را به مدت 15 دقيقه در هواي آزاد و در دماي 25 درجه سلسیوس قرار داده تا خشك شوند.
واكنش با پرمنگنات پتاسيم:
µl30 از محلول mM1 پرمنگنات در 3 مولار TEAC را به درون دو ميكروتيوب مربوط به پرمنگنات پتاسيم ريخته و به مدت 10 دقيقه در 25 درجه سلسیوس انكوبه كنيد. ميكروتيوبها را در g325 سانتريفيوژ كرده و محلول رويي را بهآرامی با پيپت پاستور برداريد. سپس رسوب را دو بار با µl200 محلول شستشو، شسته و در 15 دقيقه در هواي آزاد خشك نماييد.
واكنش با هيدروكسيل آمين:
µl30 از محلول 4/2 مولار هيدروكسيل آمين در TEAC را به درون دو ميكروتيوب مربوطه ريخته و به مدت 40 دقيقه در 37 درجه سلسیوس انكوبه كنيد. ميكروتيوبها را سانتريفيوژ كرده و محلول رويي را دور بريزيد. سپس رسوب را دو بار با µl200 محلول شستشو، شسته و در 15 دقيقه در هواي آزاد خشك نماييد.
برش با پيپريدين:
µl10 از رنگ برش (Cleavage-dye) را به هر يك از چهار ميكروتيوب اضافه كرده و به مدت 30 دقيقه در دماي 90 درجه سلسیوس قرار دهيد. ميكروتيوبها را بر روي يخ، خنك نموده و سانتريفيوژ كنيد. محلول رويي را بر روي ژل پلياكريلاميد دناچوران 4/25% حاوي 6 مولار اوره، با بافر TBE الكتروفورز نماييد. براي يك قطعه به طول 500 جفت باز، شرايط الكتروفورز شامل 3000 ولت، به مدت 3 ساعت ميباشد.
شناسايي جهش در اين روش بر اساس مقايسه باندهاي ژل همودوپلكس با ژل هترودوپلكس ميباشد. اگر باندي بر روي ژل هترودوپلكس وجود داشته باشد، ولي در ژل همودوپلكس ديده نشود، نشاندهنده وجود جهش در نمونه ميباشد (شکل 3).
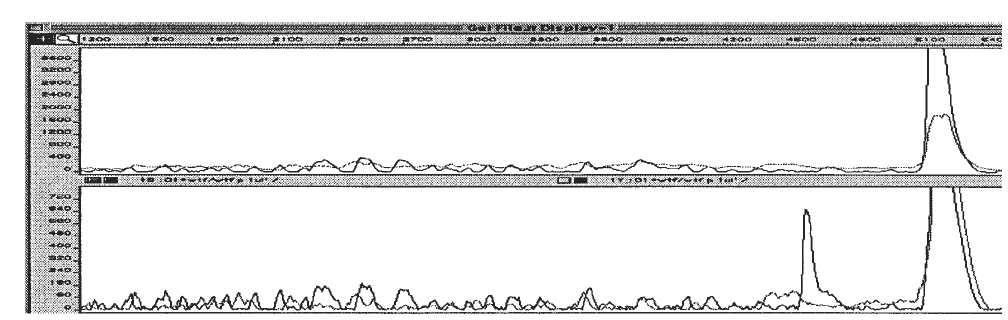
شکل 3: شناسایی جفت باز ناجور TC در یک قطعه 540 نوکلئوتیدی به روش برش شیمیایی
در بالای شکل منحنی مربوط به نمونه کنترل دیده میشود که قله مربوط به برش شیمیایی وجود ندارد، اما در منحنی پایین، قله مربوط به باز ناجور T بهطور قوی دیده میشود
نكات قابلتوجه:
- بر اساس واكنشپذيري بازهاي ناجور RNA و DNA، سه تكنيك به وجود آمده است: روش برش غير راديواكتيو با استفاده از ريبونوكلئاز A، برش آنزيمي باز ناجور (EMC) و نهایتاً برش شيميايي باز ناجور (CCM).
روش آنزيمي برش، بهصورت كيت در دسترس است و در آن آنزيم اندونوكلئاز VII فاژ T4 جفت بازهاي ناجور را برش ميدهد. از مزاياي روش آنزيمي اين است كه واكنش در يك مرحله انجام ميشود. درحالیکه در روش شيميايي واكنش دو مرحلهاي است. همچنين در روش آنزيمي، يك آنزيم همه انواع بازهاي ناجور را شناسايي ميكند، اما در روش شيميايي دو ماده شيميايي موردنياز است.
از معايب روش آنزيمي ميتوان به مواردي از قبيل گران بودن روش، نياز به بهينهسازي تمام شرايط واكنش و وجود باندهاي زمينهاي فراوان كه ناشي از برش بازهاي جور ميباشد، اشاره كرد.
در روش برش با ريبونوكلئاز، به توليد RNA نياز است. از آنجا كه قطعات بریدهشده در اين روش، دو رشتهاي هستند، نتيجه واكنش را بر روي ژل آگاروز ميتوان مشاهده كرد.
- در تكنيكهاي برشي تاكنون مثبت و منفي كاذب گزارش نشده است، با اين وجود بهتر است كه هر دو نمونه حاوي جهش و كنترل، نشاندار شوند تا اگر جهشهاي نادر غيرواكنشي[6] نيز وجود دارند، شناسايي شود. همچنين در اين تكنيكها ميتوان از مواد راديواكتيو بهجای فلوروفور، براي نشاندار كردن استفاده نمود.
- در اين تكنيك، اندازه، غلظت و دماي ذوب هترودوپلكس بايد مدنظر قرار گيرد؛ بهعنوان مثال براي تشكيل هترودوپلكس در قطعۀ غني از C-G، دماي 100 درجه سلسیوس بايد داده شود. بعد از تشكيل هترودوپلكس بايد نمونه بر روي آگاروز الكتروفورز شده و بررسي شود كه چندين باند قوي در ژل وجود نداشته باشد؛ يا نمونه در ژل اسمير نشده باشد.
- اتصال دوپلكسهاي DNA به ذرات سیلیکونی جزء مهمترین قسمت آزمايش ميباشد. اين اتصال در شرايط نمكي حاوي 3 مول TEAC رخ داده و در نتيجه در هنگام تغييرات شيميايي DNA و مراحل شستشو اين اتصال باقي خواهد ماند.
- اندازۀ قطعه مورد آزمايش توسط عواملي از قبيل مشكلات تكنيكي، صحت تشكيل هترودوپلكس و بستر جامد (ذرات سیلیکونی) محدود ميشود. با استفاده از بستر سیلیکونی قطعات تا 500 بازي را ميتوان آزمايش كرد. براي قطعات بزرگتر از فاز مايع بايد استفاده نمود.
- در اصل علاوه بر TEAC از مواد ديگري نيز ميتوان استفاده كرد، اما TEAC نسبت به ديگر مواد، از سميت كمتري برخوردار است، همچنين اين ماده بهتر با DNA واكنش نشان ميدهد. در اين روش TEAC بهعنوان ناپايداركننده دوپلكس عمل كرده و واكنش نوكلئوتيدها را با هيدروكسيلآمين و پرمنگنات پتاسيم افزايش ميدهد.
- محلول پرمنگنات پتاسيم بايد تازه باشد. اگر اين محلول يك روز بماند به رنگ زرد- قهوهاي درآمده و MnO2 رسوب خواهد كرد. واكنش به دما و غلظت سوبسترا بستگي دارد.
- انكوباسيون طولانیمدت ميتواند منجر به واكنش اضافي شده و هترودوپلكس و قطعات DNA را تخريب نمايد. انكوباسيون کوتاهمدت نيز مانع واكنش خواهد شد.
[1]Denaturing gradient gel electrophoresis (DGGE)
[2]Psoralen
[3]Protein truncation test
[4]Chemical Cleavage of Mismatch
[5]Mismatch
[6]unreactive
روشهاي شناسايي سریع عوامل میکروبی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام