سلولهـای بنیادین قلبـی و امید استفاده از آنها در ترمیم قلب به دنبال حمله قلبی
دکتر محمدمهدی امیررسولی متخصص ژنتیک پزشکی و سلولدرمانی
دانشگاه نیوکاسل، انگلستان
چکیده:
امروز دانشمندان علوم سلولهای بنیادین بر این باورند که عضلهی قلبی قادر است نسبتاً قسمتهای ضایعهدیده خود را ترمیم کند هر چند که این روند بسیار کند و کمبازده میباشد. گروههای متفاوت در نقاط مختلف جهــان با استفاده از تکنیکهای رشد سلولی از بافت عضله قلبی انسان و سایر جانداران سلولهایی را جدا کردهاند که قادر به بیان ژنهای سلولهای بنیادین میباشند و میتوانند به گروههای مختلف سلولهای سازنده بافت قلبی متمایز گردند. در این رابطه سلولهای بنیادین قلبی انسان در تحقیقات بالینی (Clinical trials) استفاده شدهاند. نتایج نشان داده است که بیمارانـی که اخیراً حمله قلبــی داشتهاند و سلولهای بنیادین قلبی (تکثیر یافته از نمونه بافت قلبی خود بیمار) را دریافت کردهاند، به مراتب وضعیت مطلوبتری نسبت به بیمارانی که صرفاً درمانهای رایج دارویی را دریافت کردهاند، داشتهاند. با این حال سلولهای بنیادین قلبی احتیاج به تحقیق و مطالعه بیشتری دارند تا اینکه مناسبترین نوع سلول بنیادین قلبی و بهترین شیوه انتقال آنها به بیماران یافت گردد. این مقاله تازهترین یافتهها را در این زمینه به اختصـار توضیح میدهد.
مروری بر سلولهای بنیادین قلبی و توانایی آنها در ترمیم عضله قلب
تحقیقات جدید نشان داده است که قلب پستانداران حاوی تعداد محدودی از سلولهای اولیه یا بنیادین میباشد که قادرند به سلولهای اصلی تشکیل دهنـدهی قلب متمایز گردند.1 سلولهای بنیادین قلبی از گونههای مختلف پستانداران از جمله انسان، موش، میمون، سگ و خوک جدا شدهاند. طبقــهبنـدی سلولهای بنیـــادین قلبی بر اســاس بیــــان ژنهـای مهمی چون ckit , ـ1 Sca و +Abcg2 است که در سطــح خود دارند. اهمیت ایــن ژنهـــا در بیولوژی سلولهـای مزانشیمی به وفور نشـان داده شده است،2;3 به عنـــوان مثــال سلولهای ckit جدا شـده از قلب انسان توانایـی تولید بافت عضلانـی قلبـــی در موشهای با نقص ایمنی را داشتهاند. تحقیقـــات نشان داده است که سلولهـای بنیادین قلبـــی دارای مشخصات سایر سلولهـای بنیــــادین منجملــــه کلونوژن (توانایی تولید کلونی سلولی با حداقل 50 سلول)، مالتـــیپوتنـــسی و توان نوسازی (پرتوانی: توانایی در متمایز شدن به انواع متفاوتی از سلولها) هستند. همچنین این سلولهــــا در محیط آزمایشگــــاه میتوانند به سلولهای عضله صاف، عضله قلب و سلولهای تشکیلدهنده عروق متمایز شوند.4 با این حــــال تحقیقات آزمایشگاهی اولیــــه نشان داده است که تعـــداد سلولهای بنیادین قلبــــی بسیار محدود میباشند به گونهای که به ازای 18000 سلــــول عضله قلب فقط یک سلــــول بنیادین قلبــــی وجـــود دارد.5 همچنیــن تعداد سلولهای بنیادین موجــــود در عضله قلب درشرایط پاتـــولوژیک از جمله بعد از حمله قلبی با شرایط پایدار و یا سلامت قلب متفاوت است؛ به گونهای که میزان سلولهای بنیادین قلب بعد از حمله قلبی در انسان به میزان چشمگیـــری افزایش پیدا میکند.5 مبدأ واقعی سلولهای بنیادین به طور قطع مشخص نیست، بعضی از محققین بر این باورند که این سلولها احتمالاً از بافتهای دیگری چون مغز استخوان و یا سایر بافتها نشأت گرفتهاند.6 تحقیقات زیادی در رابطه با مبدأ اصلی این سلولها با استفاده از بیمارانی که قلب پیونــدی دریافت کردهاند انجام شده است و نتایج نشان داده که تعدادی از سلولهای فرد گیرنده قلب در داخل عضله قلب پیوندی مشاهده شدهاند، به نوعی که سلولهای میزبان پیوند الکترومکانیکی با قلب اهدا کننده ایجاد کردهاند که این نتایج احتمال اینکه سلولهای بنیادین موجود در قلب از سایر بافتها وارد قلب شده باشند را تقویت میکند.7
همانگونه که در بالا اشاره شد سلولهای بنیادین قلبــی با توجه به بیان ژنهای سطحی تقسیمبندی میشوند که شامل گروههای زیر میباشند:
1ـ سلولهای بنیادین قلبی+Sca-l
Sca-l از جمله فاکتورهای مهم در سلولهای بنیادین مزانشیمی جوندگان است ولی هنوز بیان این ژن در انسان در هالهای از ابهام قراردارد و گزارشهای متفاوتی از بیان این ژن در سلولهای انسانی شده است،8;9 با این حال سلولهای بیانکننده این ژن از بافتهای متفاوتی از جمله قلب، کبد، غدد پستان، پوست و عضله اسکلتی جدا شدهاند.9 سلولهای + Sca-l در واکنشهای متفاوتی از جمله نوسازی سلولهای پلوریپوتنت و تمایز به انواع چهارگانه سلولهای قلبی از جمله سلول عضله صاف، سلــول عضله قلبی، سلولهای عروقی و فیبروبلاستهای قلبی دخیل میباشند.9 بعلاوه حدود 93% از سلولهای +Abcg2 (نوع دیگری از سلولهــای بنیادین قلبی) ¯Sca-l+ ، CD45 و –CD34 میباشند. (اهمیـت عدم بیان CD45 و CD34 به این علت است که نشان میدهد سلولهای +Sca-l از گروه سلولهای خونساز مغز استخوان جدا بوده و منشأ متفاوت دارند).10 همچنین بررسی نمونههای آزمایشگاهی از حمله قلبی در جوندگان نشان داده است که بیــان این ژن (Sca-1) بعد از حمله قلبی افزایش پیدا میکند و سلولهای +Sca-l از سایر نقاط قلبی به سمت ضایعه قلبی مهاجرت میکنند تا در ترمیم و تمایز این ناحیه شرکت کنند، لذا گروهی از دانشمندان نشان دادهاند که هرچه میزان بیان Sca-l بیشتر باشد توانایی سلولهای مربوطه در حرکت و تغییر مکان به ناحیه ضایعهدیده بیشتر است.11
2ـ سلولهای +ckit
سلولهای +ckit یا CDll7 گروه دیگری از سلولهای بنیادین قلبی میباشند، این فاکتور در تقسیم سلولی و فعالیت سلولهای بنیادین مزاشیمی نقش مهمی دارد.12سلولهای + ckit اولین سلولهای بنیادین قلبی بودند که شناخته شدند و از جمله مشخصات سلولهای +ckit این است که فاکتورهای ردههای خونــی چون CD45 و CD34 را بیــان نمیکنند که نشان از عـــدم ارتباط این سلولها با ردههای خونی بافت مغز استخوان دارد. همچون سایر سلولهای بنیادین، سلولهای +ckit، کلونوژن پرتوان و قابلیت نوسازی را دارا هستند. در یک تحقیق نشان داده شد که بعد از تزریق سلولهای+ ckit انسان به نمونه آزمایشگاهی حمله قلبی، میزان برونده قلبی در موشها افزایش پیدا کرد که نشانه بهبود نسبی قلب بعد از دریافت سلولهای بنیادین میباشد.12
3ـ سلولهای +Abcg2
قلب در پستانداران بالغ حاوی تعداد محدودی از سلولهای بنیادین خاصی میباشد که توانایی بیان ژنی خاص به نام +Abcg2 را دارا هستند که نام این سلولها (SP) Side population است. این سلولها قادر هستند که تـرکیبات سمــی همچون Hoechst dye را از محیط سلولی خود خارج سازند این مشخصه صرفاً در بعضی از سلولهای بنیادین یافت میشود که قادر به تکثیر و تمایز به سایر سلولهـا میباشند. سلولهای +Abcg2 در قلب جونـــدگان، سایر فاکتورهــای سلولهـــای بنیادین قلبی از جملــه Sca-l و ckit را نیز بیان میکنند. همچنین تحقیقات نشان داده است که بعد از تزریق وریدی سلولهای +Abcg2 در نمونههای آزمایشگاهی حمله قلبــی، تجمع و تکثیر این سلولها در ناحیه ضایعه قلبی حدود 12 برابر بیشتر از نمونههای کنترل بوده است، بعلاوه بررسیهای میکرسکوپیک از ضایعه قلبی نشان داد که این سلولها قادر به تمایز به سلولهای عضله قلبی، سلولهای عضله صاف و سلولهای عروقی میباشند.12
4ـ کاردیواسفیرها ((Csphs) Cardiospheres) و سلولهای جداشده از آنها (Cardiosphere derived cells)
تحقیقات آزمایشگاهی نشان داده است که سلولهای حاصل از کشت بیوپسیهای قلبی انسان و سایر پستانداران قادر به تشکیل ساختارهایی به نام کاردیواسفیــرها هستند. کاردیواسفیرها تجمعات سلولی کروی شکل میباشند که در مرکز این کره به علت شرایط هاپیوکسیا (کمبود اکسیژن) سلولهای بنیادین مثل +c-kit قرار گرفتهاند و در اطراف این کره سلولهای محافظ و یا پشتیبان قرار دارند.13 ساختار هاپیوکسیک مرکزی در کاردیواسفیرها برای تکثیر و رشد و نمو سلولهای بنیادین بسیار مفید است. بعلاوه، از فواید تشکیل کاردیواسفیرها توسط سلولهای بنیادین قلبی، ایجاد محیط کشت سه بعدی (3D) برای این سلولها است که ارتباطات بین سلولی و ترشح و تولید فاکتورهای رشد و تمایز سلولی را بهبود میبخشد،14 به عنوان مثال میزان ترشح فاکتورهای رشد عروق مثل VEGF و فاکتورهای مربوط به تکثیر و تمایز سلولهای بنیـــــــادین مثل Sox2, Nanog در کاردیواسفیرها بیشتر از کشت سلولی تکلایهای است.14 همچنین تزریق کاردیواسفیرها به نمونههای آزمایشگاهی حمله قلبی، میزان بازده قلبی، عروقزایی و ترمیم عضله قلب تحلیل رفته را به مراتب بهتر از سلولهای تکلایهای انجام داده است.
الف)
ب)
شکل 1: الف) مراحل سهگانه از کشت سلولهای CDC از نمونه عضله قلب انسان3
ب) نمونهای از Csph کشت شده در آزمایشگاه از نمونه قلب موش
یکی از مشکلات استفاده از درمان سلولی عضله قلبی بعد از حملـه قلبی این است که سلولهــای تزریق شـــده به بافت قلبــی تحمــل شــرایط سخت و محیــط فاقـــد اکسیــــژن و نکروتیک ناحیهی انفارکت را ندارند. در اکثــر تحقیقــات آزمایشگاهــی و بالینی میزان بقای انواع سلولهای تزریق شده به ناحیه انفارکت کمتر از 5% است، در نتیجه یکی از مهمترین مسائــل درمان سلولــی عضلــه قلبــی، ایجـــاد شرایطــی است که سلولهـا زمان بقای بیشتـــری را در ناحیــه ضایعـــه دیــده داشتــه باشنـــد.
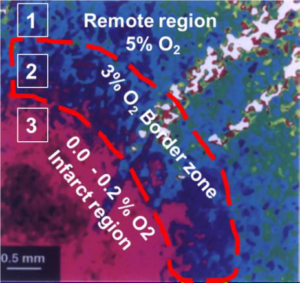
یکی از رهیافتهای مؤثر در این رابطه، کشت سلولهای بنیادین قلبی در شرایط هاپیوکسیک میباشد. شکل 2 میزان اکسیژن بافتی قلب را بعد از حمله قلبی نشان میدهد.
شکل 2: میزان اکسیژن بافتی عضله قلب به دنبال حمله قلبی
درصد اکسیژن در ناحیه سالم قلب (5%) تقریباً با میزان فیزیولوژیک آن در قلب سالم برابری میکند ولی به دنبال حمله قلبی ,قلب بر اساس میزان اکسیژن به سه ناحیه سالم، میانی و ناحیه ضایعه دیده تقسیم میشود. همانگونه که در شکل نشان داده شده است در ناحیه ضایعه دیده (3) میزان اکسیژن میتواند تا صفر نیز کاهش یابد.15
بررسیهای دقیق نشان میدهد که میزان اکسیژن در قلب موش آزمایشگاهی بعد از حمله قلبی به شدت کاهش مییابد به گونهای که در عمق ناحیه ضایعه دیدهی قلب میزان اکسیــژن به 2-0% کاهش مییابد در حالی که میزان اکسیــژن درشرایط فیزیولوژیک برابر با 5% است.15 در شرایط معمول آزمایشگاهی کشت سلول در شرایط اکسیژن اتمسفریک صورت میگیرد (21%)، در نتیجه سلولهای کشت یافته در این شرایط توانایی بقاء، رشد و تمایز در ناحیه صدمــه دیده قلب را که حدوداً 2-0% اکسیژن دارد را ندارند، به همین جهت اگر سلولهای بنیادین قلبی در شرایط هاپیوکسیا کشت داده شوند، احتمالاً مقاومت آنها در شرایط سخت آنوکسیای بافت قلبی ضایعه دیده بیشتر خواهد بود.
در این رابطه گروه ما در دانشگاه نیوکاسل انگلستان نشان داده که کشت این سلولهای در شرایط هاپیوکسیا میزان بیان ژنهای Sca-l ,c-kit و VEGF و Abcg2 را افزایش میدهد و همچنین توانایی این سلولها را در تشکیل عروق افزایش میدهد. شکل 3 قسمتی از نتایج این تحقیق را نشان میدهد. در همین راستا در تحقیقات بعدی این گروه در نظر دارد تأثیر میزان اکسیژن متفاوت و مدت زمان متفاوت بر روی این سلولها را بررسی کنـد تا اینکه بهترین شرایط هاپیوکسیک با مدت زمان کشت منـاسب را بـرای این سلولها معرفــی کنـد. آنچه تحقیقات تاکنــون در رابطــه با سلولهای بنیادین قلبی نشان داده است امید فراوانی در بین محققین و دانشمندان ایجاد کرده است و کماکان تلاش دانشمندان برای استفاده از سلولهای بنیادین برای ترمیم عضله قلبی ادامـــه دارد. امید آن میرود که استفاده از سلولهای بنیادین در آیندهی نزدیک به عنوان روش درمانی سالم و مطمئـــن در کشورمان استفاده گردد.
شکل 3: تأثیر اکسیژن 3% بر میزان عروقزایی سلولهای CDC
سلولهای CDC در شرایط اکسیژن نرمال و 3% کشت داده شدند و سپس سلولها به ناحیه زیرجلدی پهلو به همراه ماتریجل (محیط کمکی برای تزریق سلول در مطالعات قلبی عروقی) تزریق شدند. بعد از 2 هفته نمونهها مورد بررسی میکروسکوپیک قرار گرفت و میزان بیان پروتئین CD31 (مهمترین فاکتور در بررسی تشکیل رگهای خونی جدید) بین دو گروه مقایسه شد. نتایج نشان داد که میزان تشکیل عروق خونی در میلیمترMicrovessel density(MVD) مربع بر اساس بیان CD31 (رنگ قهوهای) در آن دسته از موشهایی که CDC + 3% O2 دریافت کردهاند به مراتب بیشتر از گروه کنترل (CDC+Normoxia) بود. الف و پ) نمونه زیرجلدی از CDC+3% O2، ب و ت) CDC+Normoxia، ث) MVD بین دو گروه سلولی. (* P value<0.05)
:References
1 BARILE, L. et al. Endogenous cardiac stem cells. Prog Cardiovasc Dis, v. 50, n. 1, p. 31-48, ISSN 0033-0620. Disponível em: <
2 Endogenous cardiac stem cells. Prog Cardiovasc Dis, v. 50, n. 1, p. 31-48, 2007 Jul-Aug 2007. ISSN 0033-0620.
3 CHIMENTI, I. et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res, v. 106, n. 5, p. 971-80, Mar 2010. ISSN 1524-4571.
4 JOHNSTON, P. V. et al. Engraftment, differentiation, and functional benefits of autologous cardiosphere-derived cells in porcine ischemic cardiomyopathy. Circulation, v. 120, n. 12, p. 1075-83, 7 p following 1083, Sep 2009. ISSN 1524-4539.
5 LINKE, A. et al. Stem cells in the dog heart are self-renewing, clonogenic, and multipotent and regenerate infarcted myocardium, improving cardiac function. Proc Natl Acad Sci U S A, v. 102, n. 25, p. 8966-71, Jun 2005. ISSN 0027-8424.
6 BEARZI, C. et al. Human cardiac stem cells. Proc Natl Acad Sci U S A, v. 104, n. 35, p. 14068-73, Aug 2007. ISSN 0027-8424.
7 QUAINI, F. et al. Chimerism of the transplanted heart. N Engl J Med, v. 346, n. 1, p. 5-15, Jan 2002. ISSN 0028-4793.
8 SPANGRUDE, G.; BROOKS, D. Mouse strain variability in the expression of the hematopoietic stem cell antigen Ly-6A/E by bone marrow cells. Blood, v. 82, n. 11, p. 3327-32, Dec 1993. ISSN 0006-4971.
9 HOLMES, C.; STANFORD, W. L. Concise review: stem cell antigen-1: expression, function, and enigma. Stem Cells, v. 25, n. 6, p. 1339-47, Jun 2007. ISSN 1066-5099.
10 OH, H. et al. Cardiac progenitor cells from adult myocardium: homing, differentiation, and fusion after infarction. Proc Natl Acad Sci U S A, v. 100, n. 21, p. 12313-8, Oct 2003. ISSN 0027-8424.
11 YE, J. et al. Sca-1+ cardiosphere-derived cells are enriched for Isl1-expressing cardiac precursors and improve cardiac function after myocardial injury. PLoS One, v. 7, n. 1, p. e30329, 2012. ISSN 1932-6203. >.
12 EDLING, C.; HALLBERG, B. c-Kit–a hematopoietic cell essential receptor tyrosine kinase. Int J Biochem Cell Biol, v. 39, n. 11, p. 1995-8, 2007. ISSN 1357-2725.
13 KHAITAN, D. et al. Establishment and characterization of multicellular spheroids from a human glioma cell line; Implications for tumor therapy. J Transl Med, v. 4, p. 12, 2006. ISSN 1479-5876.
14 LI, T. S. et al. Cardiospheres recapitulate a niche-like microenvironment rich in stemness and cell-matrix interactions, rationalizing their enhanced functional potency for
15 RUMSEY, W. L. et al. Oxygen pressure distribution in the heart in vivo and evaluation of the ischemic “border zone”. Am J Physiol, v. 266, n. 4 Pt 2, p. H1676-80, Apr 1994. ISSN 0002-9513.
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام