بررسي ارتباط مولكولي جهش حذف 1100delC ژن CHEK2
و ابتلا به سرطان پستان
منیژه جلیلوند١، رضا نجفیپور1، محمد شکاری2، صفرعلی علیزاده1، نسرين كريمي3، مانا علومی3*
1: دپارتمان بیوشیمی و ژنتیک، مرکز تحقیقات سلولی و مولکولی، دانشگاه علوم پزشکی قزوین
2: دپارتمان ژنتیک پزشکی، دانشکده پزشکی، دانشگاه علوم پزشکی هرمزگان
3: دپارتمان بیولوژی مولکولی، انستیتو پاستور ایران
نویسنده مسئول: مانا علومی3*دپارتمان بیولوژی مولکولی، انستیتو پاستور ایران
چکیده
زمينه و هدف: سرطان پستان شایعترین بدخیمی است که منجر به مرگ خانمهای مبتلا میشود. فاکتورهای ژنتیکی نقش مهمی در بروز سرطان پستان دارند، از جمله این فاکتـورهای ژنتیکی، ژن CHEK2(checkpoint kinase 2) است که بهعنوان يك ژن سركوبگر تومور نقش مهمی در ترمیم DNA آسیبدیده دارد. جهش در ژن CHEK2 سبب از دست رفتن اين ويژگي ميشود. یکی از جهشهای ژن CHEK2، جهش حذف 1100delC است که در تعدادی از جمعیتهای دنیا با افزایش ریسک ابتلا به سرطان پستان ارتباط دارد. در اين مطالعه ارتباط بين جهش حذف 1100delC ژن CHEK2 و ريسك ابتلا به سرطان پستان در جمعيت زنان موردمطالعه ايرانی بررسی شد.
روش كار: در این مطالعه پس از بررسی و استخراج اطلاعات پاتولوژیکی بیماران بخش جراحی بیمارستان میلاد تهران، 38 زن مبتلا به سرطان پستان زیر 45 سال و 62 زن مبتلا به سرطان پستان بالای 45 سال بههمراه 100 نفر گروه شاهد داراي شرايط سني مشابه وارد مطالعه شدند. پس از اخذ فرم رضایتنامه و گرفتن 5 سيسي خون كامل و استخراج DNA، با استفاده از پرایمرهای اختصاصی، جهش حذف 1100delCژن CHEK2 با روش Allelic-Specific PCR مورد بررسی و ارتباط آن با افزایش ریسک ابتلا به سرطان پستان در بیماران مورد ارزیابی قرار گرفت.
يافته ها: جهش حذف 1100delC ژن CHEK2 در هيچكدام از گروه بيماران خانم مبتلا به سرطان پستان و افراد شاهد در جمعیت موردمطالعه در این تحقیق مشاهده نگردید.
نتیجهگیری: مطالعه حاضر آشکار ساخت که ارتباط معناداري بين افزایش استعداد ابتلا به سرطان پستان و حامل بودن جهش حذف باز C اگزون 10 ژن CHEK2 در جمعیت موردمطالعه وجود نداشت.
كلمات كليدي: سرطان پستان، CHEK2، جهش حذف 1100delC
مقدمه
سرطان پستان شایعترین سرطان در میان زنان در سراسر جهان و اولین علت مرگومیر ناشی از سرطان در بین زنان است. 23% از کل موارد جدید سرطان پستان و 14% از مرگومیر ناشی از سرطان مربوط به سرطان پستان است. بر اساس آمارهاي سازمان جهاني بهداشت، از هر 8 تا 10 زن يك نفر دچار سرطان پستان ميشود (1). در کشور ما ایران، آمارها نشان میدهند که از هر 10 تا 15 زن احتمال ابتلاي يك نفر به سرطان پستان وجود دارد. سن بروز سرطان پستان در زنان ايران يك دهه كمتر از كشورهاي توسعهیافته است (1). مطالعات قبلی در مورد سرطان پستان، میانگین سنی افراد مبتلا به سرطان پستان در ایران را 48 سال در مقابل 55 سال در کشورهای دیگر گزارش دادهاند (2).
از نظر علت، سرطان پستان يك بيماري بهشدت هتروژن است كه در اثر تأثیر متقابل عوامل محيطي و وراثتي ايجاد ميشود (1). در زمان بلوغ تحت اثر هورمونهای استروژنی و به دنبال تكثير اپیتلیوم پستان و ايجاد لوبولهای پستان بهصورت کلونال، چنانچه قبل از توسعه لوبولها، یک سلول پیشساز لوبولار جهش مستعد کننده سرطان را کسب کند، همه سلولهای لوبول کامل، این جهش را كسب خواهند کرد كه منجر به افزايش خطر ابتلا به سرطان پستان ميشود (3). مطالعات محققین نشان میدهند که این بیماری در خویشاوندان درجه یک فرد شاخص فراوانی بیشتری دارد که این موضوع نقش فاکتورهای ژنتیکی در بروز این سرطان را نشان میدهد (3). اکثر موارد سرطان پستان بهصورت تکگیر دیده میشود، ولي بعضی موارد در اثر جهش ژنهای بازدارنده تومور¹ رخ ميدهند كه در جلوگیری از سرطان پستان نقش مهمی دارند (1). این ژنها مشتمل بر ²ATM،TP53 ،CHEK2،NBS1(Nibrin) ،BRAC1 و BRAC2 هستند که در شماری از سرطانهای پستان میزان بالایی از ناپایداری ژنومی (Genomic Instability) را نشان میدهند (1, 3, 4).
ناپایداری DNA به علت تغییر در مسیرهای مولکولی تنظیمکننده تکثیر سلولی، تمایز، آپوپتوز و ترمیم DNA اتفاق میافتد (1). در عمل ژنهای بازدارنده تومور معمولاً در سيگنالينگ سلولي كه چرخه سلولی را كنترل ميكند، مشاركت دارند يا در پاسخ به آسيب DNA از جمله شكست دورشتهای DNA، در عمل ترميم آن داراي نقش هستند (5). ترمیم شکستهای DNA دو رشتهای بهوسیله نوترکیبی همساخت بدون خطا (Homologous Recombination)، با استفاده از شبکهای از پروتئینهای دخيل نشانگان های سرطان پستان همانند ATM،TP53 ،CHEK2،NBS1(Nibrin) ،BRCA1 و BRCA2 رخ میدهد.
- Tumor suppressor genes
- Ataxia telangiectasia mutated
این مسئله نشان میدهد که نقص در ترمیم شکستهای DNA دو رشتهای ميتواند با استعداد ژنتیکی ابتلا به سرطان پستان مرتبط باشد (1). تاريخچه خانوادگي سرطان پستان با سن شروع زودهنگام غیرمعمول در ارتباط است كه علاوه بر سرطان پستان با سرطان تخمدان، تومورهاي دوجانبه فراوان و گاهی سرطان پستان در مردان همراهی نشان میدهد (5).
ژن CHEK2 بهعنوان یکی از ژنهای سرکوبگر تومور نقش مهمی در ترمیم DNA و حفظ پایداری کروموزوم دارد (4). این ژن به طول 50 کیلو باز دارای 14 اگزون بر روی کروموزوم 22 در ناحیه 22q12.1 قرار دارد (4). ژن CHEK2، پروتئین هستهای سرین/ ترئونین کیناز با نام CHEK2 (OMIM -604373) به طول 546 آمینواسید را کد میکند. فعال شدن این پروتئین در پاسخ به آسیب DNA مانع از ورود سلول به میتوز و بروز سرطان خواهد شد (8-6).
در پاسخ به آسیب DNA دو رشتهای یا آسیبهای رونویسی، پروتئين كيناز 3056 رزيدويي ATM، با تغيير در كنفورماسيون كروماتين فعال ميشود. زمانی که ATM فعال شد، سوبستراهاي متعددي را از جمله پروتئينهاي P53، NBS1(Nibrin)، CHEK2 و BRCA1 را فسفريله و فعال ميكند. CHEK2 يك كيناز ميانجي است و وقتیکه توسط ATM فسفريله و فعال شد، با انتقال پيام ATM سبب فسفريله و فعال شدن تعداد زیادی از سوبستراهای بالادست خود شامل تومور ساپرسور P53، پروتئینهای خانواده CDC25 و سرین 988 ژنBRCA1 ميشود. این سوبستراها که در چرخه سلولی دخیل هستند و کیفیت ترمیم آسیب DNA را افزایش میدهند، سبب افزایش یکپارچگی و تمامیت ژنوم میشوند، بنابراین جهش در ژن CHEK2 سبب از دست رفتن این ویژگی و آسیب به DNA میگردد (4, 5, 9, 10).
جهش حذف 1100delC ژن CHEK2 يكي از جهشهاي اين ژن است كه با حذف يك نوكلئوتيد C در منطقه 1100 ژن CHEK2 همراه است، از نوع جهشهاي تغيير چارچوب است که ایجاد این جهش باعث تغییر عملکرد این ژن در مسیر ترمیم DNA میشود. تغییر عملکرد به دنبال این جهش سبب ایجاد کدون خاتمه در کدون 381 (381X) بدنبال حذف تک باز سیتوزین در موقعیت 1100 میشود. در ادامه پروتئین تولیدشده ناپایدار میگردد که نقص عملکرد کینازی ژن CHEK2 را به دنبال دارد (11). مطالعات مختلفی در سراسر جهان به بررسی ارتباط بین جهش ژن CHEK2 و افزایش ریسک ابتلا به سرطان پستان پرداخته است اما در خیلی از قومیتها و جمعیتها نیاز به این نوع مطالعات هنوز وجود دارد (18-12).
بر اساس جستجوهاي صورتگرفته در سایتهای NCBI، SID و Google به نظر ميرسد تاکنون در جمعیت زنان ایرانی هیچ مطالعه ای در خصوص جهش حذف 1100delC ژن CHEK2 و افزایش ریسک ابتلا به سرطان پستان انجام نشده است، لذا مطالعه حاضر بهمنظور بررسی این موضوع در جمعیت زنان ایرانی طراحی و اجرا شده است.
روش بررسي:
در این مطالعه مورد- شاهدي 100 بیمار خانم مبتلا به سرطان پستان بخش جراحی بیمارستان میلاد تهران که اطلاعات پاتولوژیکی مورد نظر شامل درجه توموري، مرحله توموري، سن و نتایج هیستوپاتولوژی از پرونده بالینی آنها استخراج و ثبت گردیده بود، به همراه 100 نفر گروه كنترل سالم داراي شرايط سني مشابه که عدم وجود تومور پستان در تمام آنها با روش ماموگرافی تائید شده بود، وارد مطالعه شدند.
معيار انتخاب اين تعداد نمونه بر اساس مطالعات مشابه پيشين بود (12-11)، اطلاعات پاتولوژیکی کامل بیماران مورد مطالعه توسط پاتولوژیست به تأیید رسیده بود. نمونههای بیماران در محدوده زمانی تیرماه سال 1390 لغایت تیرماه 1392 به مدت دو سال جمعآوری شدند.
ابتدا از بیماران و افراد شاهد پس از دریافت رضایتنامه، 5 سيسي خون کامل محیـــطی در لوله خلأ حاوي K2-EDTA گرفته شد. DNA نمونه خونها با استفاده از کیت استخراج DNA (Qiagen; USA) جداسازی شد. DNA استخراجشده نمونه ها تا موقع مصرف در فریزر 80- نگهداری گردیـد. واکنــش Allelic-Specific PCR با استفاده از پرایمرهای اختصاصی استفاده شده در مطالعه پيشين انجام شد (16).
در افراد نرمال پرایمرهای پيشرو (Forward)و پسرو (Reverse) با تكثير قطعه هدف در اگزون 10، قطعه bp537 را تکثیر میكنند. در افراد بیمار حامل این جهش، پرایمر پيشرو (Forward) با پرایمر جهشزا (Mutant) ایجاد محصول bp200 مینماید (جدول شماره 1).
هر واکنش Allelic-Specific PCR شامل 5 پیکومول از هر يک از پرايمرها، 0/2 واحد از آنزيم Taq پليمراز، 8 ميكرومولار دزاكسي نوكلئوتيد تريفسفات (dNTP)، 2/5 ميکروليتر بافر PCR (10X)، 1/5 ميكرومولار كلريد منيزيم (MgCl2) و 20-50 نانوگرم DNA بود که با ddH2O به حجم نهايی µl25 میرسيد. شرایط واکنش Allelic-Specific PCR در جدول شماره 2 آمده است.
جدول شماره 1- توالي پرايمرهاي مورداستفاده در بررسي جهش حذف 1100delC ژن CHEK2
|
Results |
Detected fragment | Exon on request |
Sequence |
|
Negative |
537bp | Exon10 | Forward(CHEK2ex10f):5′-GCA AAA TTA AAT GTC CTA ACT TGC-3′ |
| Exon10 |
Reverse(CHEK2ex10r):5′-GGC ATG GTG GTG TGC ATC-3′ |
||
|
Positive |
200bp | Exon10 | Forward(CHEK2ex10f):5′- GCA AAA TTA AAT GTC CTA ACT TGC -3′ |
| Exon10 |
Reverse(CHEK2delCr):5′-TGG AGT GCC CAA AAT CAT A-3′ |
|
1100delC جهش Allelic-Specific PCR جدول شماره 2- شرایط دمایی واکنش |
|||
مرحله |
C° دما | مدت |
تعداد چرخه |
|
1 |
94 | 10 دقيقه Denaturation | 1
|
| 2 | 94 |
25 ثانيه Denaturation |
29 |
| (52)58-50 |
30 ثانيه Annealing |
||
|
72 |
35 ثانيه Extension |
||
|
3 |
72 |
5 دقيقه Final Extension
|
1 |
پس از انجام واكنش Allelic-Specific PCR، محصول PCR با اســتفاده از ژل آگارز 1/5 درصد و رنگ ژلرد (Gel Red; UK) الكتروفورز گرديد. در ژل الکتروفورز محصول PCR با اندازههای 537 و 200 بازی ردیابی میشدند. نتایج بدست آمده با استفاده از نرمافزار SPSS 17.0 و 3.5.4 Epi- Info و تست آماري كاياسكوئر و آزمون فيشر مورد تجزیهوتحلیل قرار گرفت و P-values کوچکتر از 0/05 بهعنوان نتايج معنیدار منظور شدند.
يافته ها:
تعداد 100 بیمار خانم با تشخیص سرطان پستان که مارکرهای ER، PR، Ki67 و HER2 در آنها اندازهگیری شده بود وارد مطالعه شدند. ميانگين سني بیماران 10/64±48/06 بود. 58 نفر از خانمهاي بيمار و 32 نفر از خانمهای شاهد داراي سابقه خانوادگي سرطان پستان بودند. 4 نفر از خانمهاي بيمار و 5 نفر از خانمهاي شاهد موردمطالعه مجرد بودند. 96% بیماران واجد توموري با تشخيص كارسينوماي مجرايي تهاجمی1 بودند که 73% داکتال کارسینوما و 23% داکتال کارسینومای NOS2 بودند و 4% واجد توموري با تشخيص كارسينوماي لپكي3 تهاجمی بودند.
- Invasive Ductal Carcinoma
- NOS (Not Otherwise Specified)
- Invasive Lobular Carcinoma
نتايج بررسي هيستوپاتولوژيكي انواع كارسينوم در بيماران خانم زير 45 سال و بالاي 45 سال معنیدار نبود (جدول 3). نتايج بررسي درجه (Grade) و مرحله (Stage) نمونههاي پاتولوژيك بيماران خانم زير 45 سال و بالاي 45 سال به ترتيب در نمودارهای شماره 1 و 2 قید شدهاند. مرحله توموري IIA شایعترین مرحله در ميان تومورها بود (جدول 3). اختلاف بین دو گروه نیز معنیدار نیست. همچنين نتايج بررسي درجه و مرحله نمونههاي پاتولوژيك بيماران خانم زير 45 سال و بالاي 45 سال به ترتيب در نمودارهای شماره 1 و 2 قيد شدهاند.
جدول شماره 3- یافتههای كلينيكوپاتولوژيك در 100 بيمار موردمطالعه سرطان پستان
|
سرطان پستان بعد از 45 سالگي |
سرطان پستان قبل از 45 سالگي | |||||
| P value | درصد | تعداد | P value | درصد |
تعداد |
|
|
|
هيستولوژي سرطان پستان | |||||
| 0/63 | 62/9 | 39 | 0/56 | 89/4 | 34 |
داكتال كارسينوم |
|
0/60 |
32/3 | 20 | 0/13 | 7/8 | 3 | NOS داكتال كارسينوم |
| 0/54 | 4/8 | 3 | 0/58 | 2/6 | 1 |
لوبولار كارسينوم |
|
درجه بدخيمي (grade) |
||||||
|
0/58 |
3/2 | 2 | 0/53 | 5/3 | 2 | I |
| 0/73 | 17/7 | 11 | 0/65 | 28/9 | 11 |
II |
|
0/88 |
79/3 | 49 | 0/80 | 65/8 | 25 | III |
|
مرحله بدخيمي(stage) |
||||||
|
0/87 |
14/6 | 9 | 0/87 | 15/7 | 6 | Ia |
| 0/50 | 3/2 | 2 | 0 | 0 | 0 |
Ib |
|
0/93 |
53/2 | 33 | 0/87 | 44/7 | 17 | IIa |
| 0/35 | 6/5 | 4 | 0/30 | 23/6 | 9 |
IIb |
|
0/93 |
12/9 | 8 | 0/44 | 7/8 | 3 | IIIa |
| 0/63 | 3/2 | 2 | 0/69 | 2/6 | 1 |
IIIb |
|
0/58 |
3/2 | 2 | 0/53 | 5/2 | 2 | IIIc |
| 0/50 | 3/2 | 2 | 0 | 0 | 0 |
IVa |
|
بروز گيرنده استروژني (ER) |
||||||
|
0/99 |
54 | 34 | 0/98 | 50 | 19 | + |
| 0/99 | 46 | 28 | 0/98 | 50 | 19 |
– |
|
|
بروز گيرنده پروژستروني(PR) |
|||||
|
0/87 |
50 | 31 | 0/79 | 39 | 15 |
+ |
| 0/88 | 50 | 31 | 0/83 | 61 | 23 |
– |
|
بروزKi67 |
||||||
|
0/97 |
17 | 11 | 0/92 | 68 | 26 | + |
| 0/97 | 83 | 51 | 0/98 | 32 | 12 |
– |
|
|
بروز Her2/neu | |||||
|
0/90 |
50 | 0/83 | 13 | 5 |
+ |
|
| 0/71 | 12 | 0/63 | 87 | 33 |
– |
|
همچنين نتايج استخراجشده بررسي بیومارکرهاي بيماران خانم مبتلا به سرطان پستان در جدول شماره 3 ذكر گرديده است. بيوماركر ER در گروه زیر 45 سال 19 مورد (50%) مثبت بود و در گروه بالای 45 سال 34 مورد (54%) مثبت بود (جدول 3) که اختلاف بین دو گروه معنیدار نیست. بروز PR نیز در گروه زیر 45 سال 15 مورد (39%) و در گروه بالای 45 سال 31 مورد (50%) بود (جدول 3) که اختلاف بین دو گروه معنیدار نیست. در مورد ki-67 نیز در گروه زیر 45 سال 26 مورد (68%) مثبت و در گروه بالای 45 سال 50 مورد (80%) مثبت بود (جدول 3) که اختلاف بین دو گروه معنیدار نبود. در مورد Her2/neu نیز در گروه زیر 45 سال 33 مورد (87%) منفی و 5 مورد مثبت (13%) بودند. در گروه بالای 45 سال 51 مورد (83%) منفی و 11 مورد (17%) مثبت بودند (جدول 3) که اختلاف بین دو گروه معنیدار نبود.
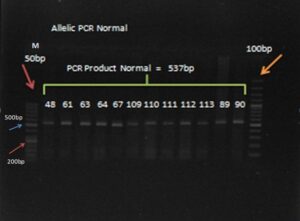
پس از انجام Allelic-Specific PCR برای کلیه نمونههای بیمار و شاهد و الکتروفورز محصول PCR، کلیه نمونه ها دارای باندهای bp537 بود و محصول PCR دارای باند bp200 در هیچکدام از نمونه های بیمار و شاهد مشاهده نشد (شکل شماره 1).
شکل 1- محصول PCR نشاندهنده هموزیگوت نرمال: قطعه 537bp (48-90) پرایمر اختصاصی جهش 1100delC CHEK2 – M: DNA Ladder 50bp
بحث و نتیجهگیری
در تمام دنیا سرطان پستان شایعترین سرطان در میان زنان است (19, 20). در حدود 23% از موارد مرگومیر ناشی از سرطان، به دلیل سرطان پستان است (21). سالانه 35000 مورد مرگ بر اثر سرطان پستان در دنیا اتفاق میافتد. سرطان پستان با شیوع بیش از 1 میلیون مورد جدید در سال، حدود 23% از کل موارد جدید ابتلا به سرطان را شامل میشود (20, 22). برطبق مستندات انجمن سرطان آمریکا، از سال 1990 به بعد، مرگ حاصل از سرطان پستان رو به کاهش است و این امر به دلیل تشخیص سریعتر و درمان بهتر است. همچنین 6/8% از کل موارد سرطان در زنان و مردان و 19% از تمام موارد سرطان در زنان سرطان پستان است (21, 22). میانگین سن تشخیص سرطان پستان در کشورهای غربی 56 سال و در ایران 45 سال است. مطالعات نشان دادند که میزان بروز سرطان در ایران در حدود 51000 مورد در سال است. در مجموع میزان بروز سرطان پستان در ایران پایینتر از اروپا و ایالات متحده برآورد شده است (3-1, 22).
جهش در ژن CHEK2 در تعدادی از قومیتها و جمعیتها، با افزايش خطر ابتلا به سرطان پستان در ارتباط بوده است (4, 8, 9, 16, 25-23) یکی از جهشهای ژن CHEK2، جهش حذف 1100delC ژن CHEK2 است که در تعدادی از جمعیتهای دنیا سبب افزایش ریسک ابتلا به سرطان سینه میگردد (16, 26). در این مطالعه جهش حذف 1100delC ژن CHEK2 در هیچکدام از دو گروه بیماران مبتلا به سرطان پستان و افراد شاهد یافت نشد. یافتههای این مطالعه، اولین گزارش از بررسی ارتباط بین جهش حذف 1100delC ژن CHEK2 و ریسک افزایش ابتلا به سرطان پستان در ایران میباشد.
برخلاف مطالعات صورتگرفته در ساير نقاط که جهش 1100delC ژنCHEK2 بهعنوان جهش افزایشدهنده ریسک ابتلا به سرطان پستان مطرح است، در این مطالعه با بررسی ژنوتایپ خانمهای بیمار و سالم جهت جهش 1100delC، هیچکدام حامل این جهش نبوده که به نظر میرسد بين حامل بودن ژن CHEK2 و افزایش ریسک ابتلا به سرطان پستان در جمعیت موردمطالعه ایرانی مشابه سایر کشورهای آسیایی، هیچ ارتباطی وجود ندارد. البته در مطالعهای بر روی سل لاین پانکراتیت در چین با جهش 1100delC و افزایش ریسک ابتلا به سرطان پانکراتیت ارتباط مشاهده شد (27). طبق بررسیهای بعملآمده، جهش 1100delC تاکنون در جمعیت کشورهای آسیایی گزارش نشده است. در مطالعات صورتگرفته در کشورهای آسیایی شامل کره (28)، چین (29)، ژاپن (30) و کشورهای جنوبی شبهقاره هند (31)، جهش 1100delC با افزایش ریسک ابتلا به سرطان پستان ارتباط ندارد. در مطالعه صورتگرفته در کشور همسایه ایران، تركيه خانمهای با یا بدون سابقه خانوادگی ابتلا به سرطان پستان حامل جهش 1100delC، دارای افزایش ریسک دوبرابری ابتلا به سرطان پستان هستند و عدم وجود این جهش در جمعیت موردمطالعه اثر محافظتی در پیشگیری از ابتلا به سرطان پستان دارد (32).
در بررسیی که در اروپا و آمريكاي شمالي انجام شد ارتباط مشابهي از شيوع ريسك تقریباً دوبرابري ابتلا به سرطان پستان در افراد حامل جهش 11oodelC مشاهده شد (33). بالاترین شیوع جهش 1100delC در بین بیماران مبتلا به سرطان پستان در کشور فنلاند (6/8%) یافت شده است (34). در سوئد این جهش با فراوانی 5/1% سبب ابتلا به سرطان پستان زودرس میگردد؛ به عبارتی افراد حامل اين جهش 12 سال زودتر نسبت به افراد سالم شانس ابتلا به سرطان پستان دارند (18). البته فراواني اين جهش در جمعیت نيويورك كمتر گزارش شده است (35). درکشورهای هلند، انگلستان و آلمان این جهش با فراوانی کمتری گزارش شده است (8, 36).
این جهش در بيماران مبتلا به سرطان پستان خانوادگي و افراد سالم در جمعيت اسپانيا مشاهده نشد (37). در خانوادههای لهستانی نشان داده شده است كه نزديك به نصف از افراد مبتلا به سرطان پستان که حامل جهش 1100delC هستند، همچنين سرطان كولوركتال دارند (38). نتایج فوق به وجود ارتباط قوي بين جهش 1100delC و افزايش ريسك ابتلا به سرطان پستان دلالت دارد، لذا در بعضی از جمعیتهای اروپایی عنوان شده است که میتوان آناليز جهش1100delC را بهعنوان يك ماركر افزايش ريسك ابتلا به سرطان پستان در جمعيت مبتلايان به سرطان پستان قبل از آناليز كل ژنوم مطرح نمود (16)، اما با توجه عدممشاهده جهش 1100delC در جمعیت موردمطالعه ایران و همچنین عدممشاهده این جهش در کشورهای آسیایی، این نکته به ذهن میآید که جهش حذف 1100delC در افراد مبتلا به سرطان پستان در اقوام آسیایی وجود ندارد که این مطالعه تائیدکننده مطالعات پیشین صورت گرفته در آسیا است.
با توجه به بررسی مطالعات گذشته، در ارزیابی اطلاعات پاتولوژیکی و زیستشناسی مولکولی بيماران مبتلا به سرطان پستان، تومورهای مرتبط با جهش BRCA1 ویژگیهای تهاجمی شامل بروز زودرس، درجه بالای تومور، گیرنده استروژن (ER) و گیرنده پروژسترون (PR) منفی و سرعت تکثیر بالا را نشان میدهند (39, 40)، همچنين در مطالعات پيشين بين مرحله بالا و درجه پايين و سايز تومور و بروز سرطان پستان در سنين پايين ارتباط مشاهده شده است (41, 42). در بحث بيوماركرها هم بروز HER2/neu و ki-67 در بيماران مبتلا، ارتباطي با بروز سرطان پستان زودرس ندارد اما گیرندههای استروژن و پروژسترون مثبت با بروز سرطان پستان در سنين بالا مرتبط نشان داده شدهاند (44-41).
با بررسي عوامل پاتولوژيك چنین استنباط میگردد که ويژگيهاي تهاجمي، شامل بروز زودرس، درجه و مرحله بالاي تومور، محتوای وابستگی هورمونی سرطان پستان همانند گیرنده استروژن (ER) و گیرنده پروژسترون (PR) منفی و سرعت تکثیر بالاي تومورها قبل و بعد از سن باروری، ارتباطی با افزایش استعداد ابتلا به سرطان پستان در حاملين جهش حذف 1100delC ژن CHEK2 در خانمهاي ایرانی مبتلا به سرطان پستان ندارد. همچنین در بررسي نتايج پاتولوژیکی بیماران اين مطالعه بین عوامل درجه هیستولوژیک پايين و مرحله توموري بالا با بروز سرطان پستان در سنين پايين ارتباطي مشاهده نشد.
با توجه به عدم وجود اختلاف معنادار در مشخصات پاتولوژیکی و سن بیماران در جمعیت موردمطالعه ایران، بهنوعی شاید بتوان گفت بین عوامل هیستوپاتولوژیک مبتلایان سرطان پستان در هر یک از این دو گروه سنی زیر 45 سال و بالای 45 سال و حامل بودن جهش حذف 1100delC ژن CHEK2 ارتباطی وجود ندارد و این حذف بزرگ بهعنوان عامل مستعد کننده افزایش ریسک ابتلا به سرطان پستان در هیچکدام از دو گروه موردمطالعه یافت نشد.
از محدوديتهاي اين مطالعه تعداد پايين نمونههاي موردمطالعه بود كه امکان دارد افزایش تعداد نمونههای موردمطالعه، احتمال یافتن جهش حذف 1100delC ژن CHEK2 را بهعنوان فاکتور افزایشدهنده ریسک ابتلا به سرطان سینه بالا ببرد.
از محدودیتهای ديگر مطالعه حاضر فراوانی کمتر بیماران مبتلا به سرطان پستان دوطرفه (10 از 100) است که امکان دارد با افزایش ریسک ابتلا به سرطان پستان به دلیل این حذف ژنی مرتبط باشد. در مطالعه موردبررسی این ارتباط در مورد جهش 1100delC مشاهده شده است (17). اگرچه ممکن است افزایش تعداد نمونههای موردمطالعه، احتمال یافتن جهش حذف bp5395 ژن CHEK2 را بهعنوان فاکتور افزایشدهنده ریسک ابتلا به سرطان سینه بالا ببرد، اما شاید این جهش در بعضی از قومیتهای ایرانی اساساً وجود نداشته باشد، بااینوجود شاید انجام مطالعه مشابه با تعداد نمونه بیشتر بتواند مفید و گامی در جهت تشخیص سریعتر بیماران مبتلا به سرطان پستان به دلیل جهش حذف 1100delC ژن CHEK2 باشد. البته با توجه به سایر مطالعات صورتگرفته در آسیا و نبود ارتباط بین این جهش و افزایش ابتلا به سرطان پستان شاید بتوان بهنوعی گفت که هیچگونه ارتباطی در جمعیتهای آسیایی مبتلا به سرطان پستان و این جهش نیست.
با توجه به نقش پررنگ ژن CHEK2 در تسهیل روند سرکوب تومورزایی سلولهای پستان از طریق ترمیم DNA آسیبدیده و احتمال نقش پیشبینیکنندگی در سوق دادن سلولها به سمت توموری شدن و یا وخیمتر شدن شرایط سلول تومور، بررسی سایر جهشهای ژن CHEK2 پیشنهاد میگردد. احتمال ارتباط بین سایر جهشهای ژن CHEK2 و ریسک افزایش ابتلا به سرطان پستان مطرح است.
References:
- Noori DM, Tabarestani S. Molecular Genetics, Diagnosis and Treatment of Breast Cancer: Review Article. Journal of Sabzevar University of Medical Sciences 2010;17:74-87.
- Dvarnia B, Mehdipour P, Atri M, al e. The Association between BRAC1 expression and Breast Cancer tumor genesis. Journal of Ardabil university of medicine Scienes. 2012;12(2):132-9.
- Keshavarzi F, Javadi G, Nafisi N, al e. Identification of BRCA1 and BRCA2 mutations in a number of Iranian patients with early onest breast cancer or a breast cancer family history. Breast disease Journal. 2009;2(2):15-24.
- Nevanlinna H, Bartek J. The CHEK2 gene and inherited breast cancer susceptibility. Oncogene 2006;25:5912-9.
- Strachan T, Read A. Human molecular genetics. BIOS Scientific. Oxford; 1996.
- Moore KL, Dalley AF, Agur AM. Clinically oriented anatomy: Lippincott Williams & Wilkins; 2013.
- Liu C, Wang Y, Wang Q-S, Wang Y-J. The CHEK2 I157T variant and breast cancer susceptibility: a systematic review and meta-analysis. Asian Pac J cancer prev. 2012;13(4):1355-60.
- Consortium CBCC-C. CHEK2 1100delC and Susceptibility to Breast Cancer:ACollaborative Analysis Involving 10,860 Breast Cancer Cases and 9,065 Controls from 10 studies. AmJHumGenet. 2004;74:1175-82.
- Desrichard A, Bidet Y, Uhrhammer N, Bignon Y-J. CHEK2 contribution to hereditary breast cancer in non-BRCA families. Breast Cancer Res. 2011;13(6):R119.
- Chen L, Nievera CJ, Lee AY-L, Wu X. Cell cycle-dependent complex formation of BRCA1· CtIP· MRN is important for DNA double-strand break repair. Journal of Biological Chemistry. 2008;283(12):7713-20.
- Cybulski C, WokoŁorczyk D, Huzarski T, Byrski T, Gronwald J, Górski B, et al. A large germline deletion in the Chek2 kinase gene is associated with an increased risk of prostate cancer. Journal of medical genetics. 2006;43(11):863-6.
- Mohelnikova-Duchonova B, Havranek O, Hlavata I, Foretova L, Kleibl Z, Pohlreich P, et al. CHEK2 gene alterations in the forkhead-associated domain, 1100delC and del5395 do not modify the risk of sporadic pancreatic cancer. Cancer epidemiology. 2010;34(5):656-8.
- ElAmrani A, Moumad K, Attaleb M, Benhassou M, Försti A, Ennaji MM, et al. Absence of CHEK2 1100delC, R145W and I157T Mutations in Breast Cancer in a Moroccan Population. Journal of Cancer Research and Treatment. 2014;2(1):6-9.
- Bayram S, Akkız H, Topaktaş M. CHK2 1100delC, IVS2+ 1G> A and I157T mutations are not present in hepatocellular cancer cases from a Turkish population. Gene. 2013;512(2):232-6.
- Bayram S, Topaktaş M, Akkız H, Bekar A, Akgöllü E. CHEK2 1100delC, IVS2+ 1G> A and I157T mutations are not present in colorectal cancer cases from Turkish population. Cancer epidemiology. 2012;36(5):453-7.
- Rashid M, AJakubowska, al e. German population with infrequent CHEK2 1100delC and minor association with early-onset and familial breast cancer. European Journal of Cancer. 2005;41:2896-903.
- Iniesta MD, Gorin MA, Chien L-C, Thomas SM, Milliron KJ, Douglas JA, et al. Absence of CHEK2* 1100delC mutation in families with hereditary breast cancer in North America. Cancer genetics and cytogenetics. 2010;202(2):136-40.
- Margolin S, Eiberg H, Lindblom A, Bisgaard ML. CHEK2 1100delC is prevalent in Swedish early onset familial breast cancer. BMC cancer. 2007;7(1):163.
- Parkin DM. International variation. Oncogene. 2004;23(38):6329-40.
- Stewart S, King J, Thompson T, Friedman C, Wingo P. A cancer mortality surveillance United States, 1990-2000. MMWRSurveill Summer. 2004;53(SS03):101-8.
- Habibi A. Epidemiological aspects of cancer in Iran. Int Surg. 1985;70(2):105-8.
- Sajadi A, Nouraie M, Mohagheghi M, Mousavi-Jarrahi A, Malekezadeh R, Parkin D. Cancer occurrence in Iran in 2002,an international perspective. Asian Pac J Cancer Prev. 2005;6(3):359-63.
- Cybulski C, Wokołorczyk D, Huzarski T, Byrski T, Gronwald J, Górski B, et al. A deletion in CHEK2 of 5,395 bp predisposes to breast cancer in Poland. Breast cancer research and treatment. 2007;102(1):119-22.
- Cybulski C, Górski B, Huzarski T, Byrski T, Gronwald J, Dębniak T, et al. CHEK2-positive breast cancers in young Polish women. Clinical cancer research. 2006;12(16):4832-5.
- Steven A, Henry T. CHEK2 Mutation and Hereditary Breast Cancer. Journal of Clinical Oncology. 2007;25:6-7.
- Bąk A, Janiszewska H, Junkiert-Czarnecka A, Heise M, Pilarska-Deltow M, Laskowski R, et al. A risk of breast cancer in women-carriers of constitutional CHEK2 gene mutations, originating from the North-Central Poland. Hereditary cancer in clinical practice. 2014;12(1):10.
- Ndawula Jr C, Yang X, Gong X, Jin J. CHK21100delC, I157T, IVS2+ IG> A, BRCA1 and BRCA2 Mutation Analysis in JF305: A Pancreatic Cancer Cell Line. Journal of Biosciences and Medicines. 2014;2(01):58.
- Choi DH, Cho DY, Lee MH, Park HS, Ahn SH, Son BH, et al. The CHEK2 1100delC mutation is not present in Korean patients with breast cancer cases tested for BRCA1 and BRCA2 mutation. Breast cancer research and treatment. 2008;112(3):569-73.
- Song C, Hu Z, Yuan W, Di G, Shen Z, Huang W, et al. CHEK2 c. 1100delC may not contribute to genetic background of hereditary breast cancer from Shanghai of China]. Zhonghua yi xue yi chuan xue za zhi= Zhonghua yixue yichuanxue zazhi= Chinese journal of medical genetics. 2006;23(4):443-5.
- Bell DW, Kim SH, Godwin AK, Schiripo TA, Harris PL, Haserlat SM, et al. Genetic and functional analysis of CHEK2 (CHK2) variants in multiethnic cohorts. International Journal of Cancer. 2007;121(12):2661-7.
- Rajkumar T, Soumittra N, Nancy NK, Swaminathan R, Sridevi V, Shanta V. BRCA1, BRCA2 and CHEK2 (1100 del C) germline mutations in hereditary breast and ovarian cancer families in South India. Asian Pacific Journal of Cancer Prevention. 2003;4(3):203-8.
- Domagala P, Wokolorczyk D, Cybulski C, Huzarski T, Lubinski J, Domagala W. Different CHEK2 germline mutations are associated with distinct immunophenotypic molecular subtypes of breast cancer. Breast cancer research and treatment. 2012;132(3):937-45.
- Meijers-Heijboer H, van den Ouweland A, Klijn J, Wasielewski M, de Snoo A, Oldenburg R, et al. Low-penetrance susceptibility to breast cancer due to CHEK2* 1100delC in noncarriers of BRCA1 or BRCA2 mutations. Nature genetics. 2002;31(1):55-9.
- Vahteristo P, Bartkova J, Eerola H, Syrjäkoski K, Ojala S, Kilpivaara O, et al. A CHEK2 genetic variant contributing to a substantial fraction of familial breast cancer. The American Journal of Human Genetics. 2002;71(2):432-8.
- Offit K, Pierce H, Kirchhoff T, Kolachana P, Rapaport B, Gregersen P, et al. Frequency of CHEK2* 1100delC in New York breast cancer cases and controls. BMC medical genetics. 2003;4(1):1.
- Meijers-Heijboer H, Wasielewski M, Wagner A, Hollestelle A, Elstrodt F, van den Bos R, et al. The CHEK2 1100delC mutation identifies families with a hereditary breast and colorectal cancer phenotype. The American Journal of Human Genetics. 2003;72(5):1308-14.
- Osorio A, Rodríguez‐López R, Díez O, de la Hoya M, Ignacio Martínez J, Vega A, et al. The breast cancer low‐penetrance allele 1100delC in the CHEK2 gene is not present in Spanish familial breast cancer population. International journal of cancer. 2004;108(1):54-6.
- Myszka A, Karpinski P, Slezak R, Czemarmazowicz H, Stembalska A, Gil J, et al. Irrelevance of CHEK2 variants to diagnosis of breast/ovarian cancer predisposition in Polish cohort. Journal of applied genetics. 2011;52(2):185-91.
- Oldenburg R, Meijers-Heijboer H, Cornelisse C, Devilee P. Genetic susceptibility for breast cancer: how many more genes to be found? Critical reviews in oncology/hematology. 2007;63(2):125-49.
- Chappuis PO, Nethercot V, Foulkes WD, editors. Clinico–pathological characteristics of BRCA1‐and BRCA2‐related breast cancer. Seminars in surgical oncology; 2000: Wiley Online Library.
- Sidoni A, Cavalier A, Bellezza G, Scheibel M, Bucciarelli E. Breast cancer in young women: clinicopathological features and biological specificity. Breast cancer research and treatment. 2003;12(4):247-50.
- Hung H, Neven P, Drijkoningen M, Paridaens R, Wildiers H, Limbergen V, et al. Hormone receptors do not predict the Her2/neu status in all age groups of women with an operable breast cancer. Annals of oncology. 2005;16:1755-61.
- Zheng W, Zhen J, Ma L, Meng F, Huang L, Ma D. Comparison of Her-2/neu, Er and PCNA expression in premenopausal and postmenopausal patients with breast carcinoma. APMIS. 2005;113(3):175-81.
- Kadivar M, Rezaee M, Jadidfard R, Joulaee A. Evaluation of Histopathology and Biologic Markers in Premenopausal (under 40 years) and Postmenopausal (over 60 years) Women with Breast Cancer in Hazrat-e-Rasoul and Atieh Hospitals. Iran universtiy of Medical Sciences. 2010;72(17):49-57.
ژنومیکس و کاربرد آن در تشخیص بیماریها (2)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام