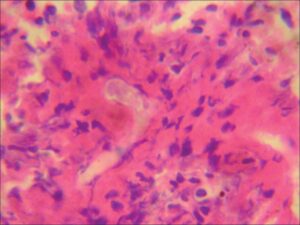
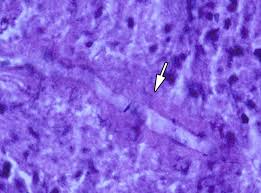
زایگومایکوزیس
دکتر محمد قهری
مقدمه
زایگومایکوزیس اغلب دارای پیشآگهی ضعیفی است که مربوط به وضعیتِ نوتروپنی، درمان ایمیونوساپرسیو، بدخیمیها، بیماریهای مزمنی مانند دیابت و نارسائی کلیوی و مقاومت نسبیِ عوامل آن نسبت به داروهای ضدقارچی است. زایگومایکوزیس عفونت قارچی فرصتطلبِ حاد با سیر سریع است و شامل انواع مختلفی از عفونتهائی است که تحت عنوان موکورمایکوزیس است و توسط گونههای مختلف راستهی موکورالها شامل جنسهای رایزوپوس، موکور، رایزوموکور و آبسیدیا و انتوموفتورومایکوزیس میباشد. انتوموفتورومایکوزیس نیز شامل عفونتهای ناشی از راستهی انتوموفتورالها است. در اینجا واژهی زایگومایکوزیس برای تمام عفونتهائی که بوسیلهی قارچهائی که تحتعنوان زیگومیست شناخته میشوند، انتخاب شده است.
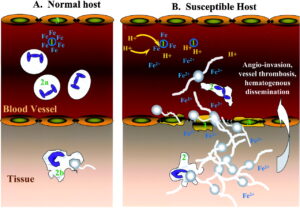
زایگومیستهای موکوراسئوس به لحاظ فیلوژنتیکی در همه جا به یکدیگر ارتباط دارند و مسئول طیف وسیعی از عفونتهائی هستند که اگرچه تا اندازهای ناشایع هستند اما اغلب مهلک میباشند. این بیماری در افرادی که سیستم ایمنی آنها بدلائل مختلف دچار اختلال شده است استقرار مییابد. علائم بیماری ظاهراً ارتباطی با عامل قارچی ایجادکنندهی آن نداشته و در همهی موارد مشترک میباشد. بسته به محل ورود عامل بیماری، بینی، صورت، مغز، ریه، دستگاه گوارش، پوست و سایر ارگانها درگیر میشوند. موکورالها تمایل به تهاجم به عروق خونی دارند که در نتیجه در عفونتهای ناشی از آنها آمبولی و نکروز نسوج مشاهده میشوند.
بسیاری از اوضاع کیفی اندوهبار مربوط به عفونتهای این قارچها در نتیجهی تهاجم به عروق خونی و انفارکتوس بافتی در ارگانهای مختلف است. واکنش بافتی ناشی از تهاجم قارچی از نوع چرکی بوده و واکنشهای گرانولومائی معمولاً دیده نمیشوند. عفونت بیشتر در بیماران دیابتی، بچههای مبتلا به سوءتغذیه، بیماران دچار سوختگیهای شدید و وسیع، مبتلایان به لوسمی، لنفوم و سایر بیماریهای ناتوانکننده و همچنین در موارد درمان با داروهای ایمونوساپرسیو، سیتوتوکسینها، کورتیکوستروئیدها و یا بعد از جراحی و تروما دیده میشوند.
نوع دیگری از عفونت زایگومایکوزیس که توسط اعضاء راستهی انتوموفتورالها ایجاد میشود معمولاً در بیمارانی دیده میشود که در مناطق گرمسیری زندگی میکنند. این دسته از عفونتها معمولاً مزمن، زیرجلدی و محدود و بدون تهاجم به عروق خونی هستند و دارای پیشآگهی بهتری نسبت به عفونتهای ناشی از زایگومیستهای موکوراسئوس هستند.
| تاکسونومی عوامل زایگومایکوزیس |
| سلسله قارچها
شاخهی زیگومایکوتا ردهی زایگومیستها راستهی موکورالها خانوادهی موکوراسه آبسیدیا کوریمبیفرا آپوفیزومایسس الگنس موکور اینسیدوس موکور راسموزوس موکور سیرسینلوئیدس رایزوموکور پوسیلوس رایزوپوس آریزوس رایزوپوس آزیگوسپوروس رایزوپوس میکروسپوروس واریتهی میکروسپوروس رایزوپوس میکروسپوروس واریتهی ریزوپودیفرمیس خانواده کانینگهاملاسه کانینگهاملا برتولشیا خانواده ساکسنهآ ساکسنهآ وازیفرمیس راستهی انتوموفتورالها خانوادهی انتوموفتوراسه کونیدیوبولوس کوروناتوس کونیدیوبولوس اینکانگروس خانوادهی بازیدیوبولاسه بازیدیوبولوس راناروم |
مشخصهی زایگومایکوزیس حضور هایفیهای بدون دیوارهی عرضی و یا دارای دیوارهی عرضی بصورت متفرق و پراکنده، شفاف، پهن، با قطر متنوع و دارای یک طرح انشعابی نامنظم در مقاطع بافتشناسی است که در ترکیب با تهاجم و ترومبوز عروق خونی و نیز انفارکتوس و نکروز بافتی دیده میشود. قارچهای انتوموفتوراسئوس با گرانولوم و رسوب شفاف ائوزینوفیلیک در اطراف هایفی مشاهده میشوند. هایفیهای زیگومیستها با رنگآمیزی گوموری متنامین سیلور (GMS) بصورت ضعیف رنگ میگیرند. رنگآمیزی هماتوکسیلن ائوزین (H&E) در اکثر موارد برای نمایان ساختن هایفی زیگومیستها بهترین رنگ میباشد.
عوامل و انتشار بیماری
عوامل اصلی موکورمایکوزیس در انسان، رایزوپوس آریزوس، رایزوپوس اوریزا، آبسیدیا کوریمبیفرا، و در موارد دیگری آبسیدیا راموسا، رایزوپوس رایزوپدوفورمیس و رایزوموکور پوسیلوس میباشند. در مواردی نیز گونههائی از جنسهای ساکنهآ (Saksenaea)، آپوفیزومایسس (Apophysomyces) ، و کانینگهاملا بعنوان عوامل ایجادکنندهی موکورمایکوزیس نام برده شدهاند.
گونههای مذکور که عامل عفونت انسانی هستند، در همه جا وجود داشته و بر روی مواد قندی به سرعت رشد نموده و معمولاً تولید کنیدیهای غیرجنسی (اسپورانژیوسپور) میکنند. کنیدیها براحتی در فضا پخش میشوند. رشد سریع ارگانیسم، مقاومت آن به گرما، و ساکارولیتیک بودن آن را بعنوان دلائلی برای ایجاد بیماری در انسان میدانند. در ابتلاء به بیماری، سن و نژاد تأثیری نداشته و مهمترین مسئله حضور بیماری زمینهای است.
بیماری رینوسربرال (بینی- مغزی) اغلب همراه با اسیدوز در بیماران دیابتی میباشد. عفونت ریوی بیشتر در مبتلایان به لوسمی و لنفوم دیده میشود و بیماری گوارشی بیشتر در مبتلایان به سوء تغذیه بخصوص کودکان دچار کواشیورکور مشاهده میشود. بیماریهای کبد، نارسائی کلیه، توبرکلوزیس، درمان با کورتیکوستروئیدها، داروهای سیتوتوتکسیک، آنتیبیوتیکها و داروهای ضد سرطان همگی میتوانند زمینهساز موکورمایکوزیس باشند.
علائم بالینی
موکورمایکوزیس حادترین عفونت قارچی شناخته شده است. عفونت رینوسربرال در بیماران اسیدوتیک معمولاً در طی یک هفته یا کمتر منجر به مرگ میشود. تمایل خاص ارگانیسم به ایجاد عفونت و بیماری در مبتلایان به اسیدوز مانند دیابت کنترل نشده، اسهال، و اورمی و یا دریافتکنندگان آسپرین مورد بحث و مطالعه است. موکورمایکوزیس طیفی از انواع بیماریها را نشان میدهد که بستگی به نوع بیماری زمینهای و محل ورود ارگانیسم دارد.
موکورمایکوزیس رینوسربرال
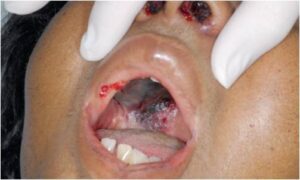
عفونتی حاد با سیر سریع است و بیشتر در بیماران دیابتی با دیابت کنترل نشده دیده میشود. عامل بیماری عمدتاً از جنس رایزوپوس است و در کشتها اکثراً رایزوپوس آریزوس جدا میشود. بیماران از نظر سنی بیشتر در محدودهی 16 تا 75 سال دیده میشوند. عفونت از حفرات بینی یا سینوسهای پارانازال شروع میشود. در مواردی مشاهده میشود که شروع بیماری از کام یا حلق باشد. در محل ضایعه سلولیت شدیدی ایجاد میشود. ابتدا بینی، سپس چشم، مغز و احتمالاً مننژ گرفتار میشوند. ترشحات بینی در ابتدا غلیظ و سپس خونی میشوند و مناطق نکروتیک سیاه قرمز رنگی در روی حفرات و تیغهی میانی بینی ظاهر میشوند. با تراشیدن ضایعات بینی بوسیلهی اسکالپل و آزمایش میکروسکپی با پتاس میسلیومها دیده شده و تشخیص ثابت میشود.
در تصاویر رادیولوژی از سینوسهای پارانازال، کدورت و سطح مایع در سینوسها مشخص است. سلولیت شدید چشمی در این مرحله پیشآگهی بدی دارد و نشاندهندهی تهاجم قارچ به چشم و سیستم عصبی مرکزی است. در این حالت درد کرهی چشم، افتالموپلژی، پتوزیس (پائین افتادگی پلک)، محدودیت حرکات چشم وجود داشته و بیمار دید خود را از دست میدهد. آزمایش ته چشم ممکن است طبیعی بوده و یا اتساع وریدها و یا ترومبوز شریانها مشاهده گردیده و میسلیومها در حال عبور در داخل زجاجیه دیده میشوند. بیحسی نواحیی که از شاخهی اول و دوم تریژومو (عصب سه قلو) عصب میگیرند و نیز فلج عصب صورتی دیده میشود.
با پیشرفت بیماری، قارچ عروق خونی بزرگ را مورد حمله قرار داده و به دنبال آن انفارکتوس و مناطق نکروتیک در مغز ایجاد میگردد. سرانجام بیمار دچار لتارژی (حالت خوابآلودگی) و کوما شده و در طی 7 تا 10 روز فوت میکند. افزایش فشار داخل جمجمه میتواند منجر به تشنج گردد. بطور کلی تب وجود ندارد.
افزایش گلبولهای سفید تا حدود 10 تا 30 هزار دیده میشود و قند خون معمولاً بالا است. تغییرات مایع نخاع متغیر بوده و اختصاصی نیست. عفونت میتواند به ریهها و سایر ارگانها انتشار یابد. میزان مرگومیر بطور کلی 80 تا 90 درصد میباشد ولی با استفاده از آمفوتریسین B پیشآگهی بهتر است. موارد نادری از این بیماری بصورت موکورمایکوزیس مزمن بینی در افرادی که سالم بوده و زمینهی مساعدکننده نداشتهاند گزارش گردیده که در آنها ضایعات بصورت تومورهائی بوده که از میسلیوم تشکیل شده و توسط واکنش گرانولومائی احاطه شدهاند.
دکتر امامی و همکاران 12مورد موکورمایکوزیس رینوسربرال را در بیماران با دیابت کنترل نشده گزارش کرده بودند که در 9 مورد از آنها گونهای رایزوپوس و در یک مورد گونهای موکور بعنوان عامل بیماری تشخیص داده شده بودند. گاهی اوقات موکورمایکوزیس مغزی بدون علائم بالینی بوده و بعد از گرفتاری بینی و یا به دنبال تروما گزارش گردیده است. در بیماران دیابتی علاوه بر بینی ممکن است گوشها محل ورود قارچ باشند.
آشنائی با مشخصات قارچشناسی گونههای بیماریزا
آبسیدیا کوریمبیفرا/ Absidia corymbifera
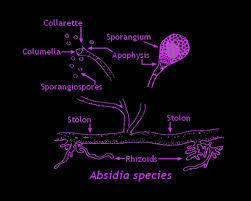
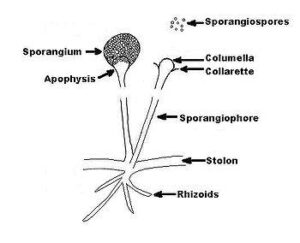
جنس آبسیدیا با تمایز یافتن هایفی به استولونهای کمانی شکل که در فواصل بین گرهها برآمده شده و اسپورانژیوفورهائی متعدد از آن بوجود میآیند، مشخص میشود. ریزوئیدها نیز در محل گرهها در تماس با محیط کشت پدید میآیند. این منظره گونههای آبسیدیا را از جنس رایزوپوس متمایز میسازد. در رایزوپوس، اسپورانژیومها از محل مقابل گرهها برمیخیزند. اسپورانژیومها نسبتاً کوچک، صاف، گلابی شکل، یا نخودی شکل هستند و توسط یک آپوفیز قیفی شکل مشخصی حمایت میشوند. این ویژگی جنس آبسیدیا را از جنسهای موکور و رایزوموکور متمایز میسازد. موکور و رایزوموکور دارای اسپورانژیومهای بزرگ، صاف و بدون آپوفیز میباشند. جنس آبسیدیا دارای 21 گونهی عمدتاً خاکزی است و آبسیدیا کوریمبیفرا تنها گونهی عامل ایجاد بیماری در انسان و حیوانات میباشد.
آبسیدیا راموزا که قبلاً بعنوان یک گونهی پاتوژن در نظر گرفته میشد اکنون بعنوان یک سینونیم برای آبسیدیا کوریمبیفرا در نظر گرفته میشود. آبسیدیا کوریمبیفرا بعنوان یک عامل نسبتاً نادر زایگومایکوز انسانی شناخته میشود و اغلب اوقات بعنوان پاتوژن حیوانی گزارش میشود. هرچند که احتمالاً مسئول اولین مورد گزارش شده از زایگومایکوز ریوی در انسان بوده است (Furbringer 1876) و گاهگاهی از این ناحیه (ریهها) گزارش میگردد. همچنین بعنوان عامل مسبب در یک مورد مننژیت بدنبال جراحت سر (Mackenzie, Soothill and Millar 1988) و نیز از موارد عفونتهای پوستی در بیماران دارای سیستم ایمنی شایسته (Roger et al. 1989) و هم در بیماران لوکمیک (Lopes et al. 1995) و ایدزی (Chavanet et al. 1990, Hopwood et al. 1992) گزارش شــــــده اســت.
همچـــنین از 2 مورد عفونــــــــــــــــــت کلیوی در بیماران ایدزی (Smith, Bustamante and Gilmor 1989, Torres-Rodriguez et al. 1993) و یک مورد از زایگومایکوز رینوسربرال (بینی مغزی) در یک بیمار نوتروپنیک گزارش شده است (Manso et al. 1994). آبسیدیا کوریمبیفرا دارای انتشار جهانی و اغلب مرتبط با خاک و مواد گیاهی در حال فساد است.
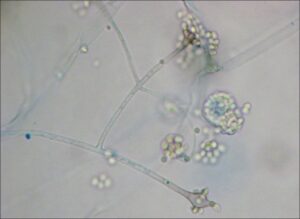
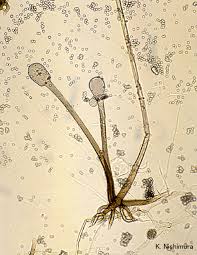
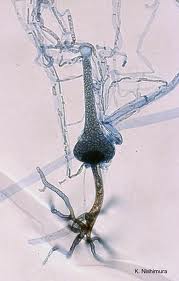
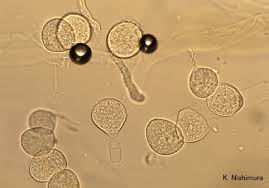
تصویر شماتیک از جنس آبسیدیا
منظره میکروسکپی آبسیدیا: 1- ریزوئید، 2- گره (node)، 3- اسپورانژیوفور، 4- اسپورانژیوم
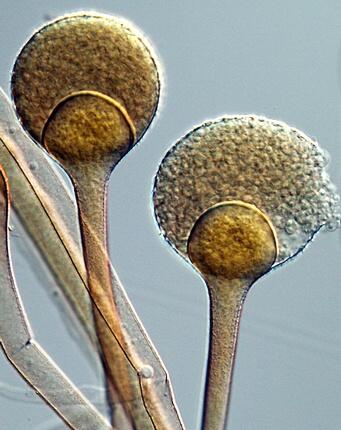
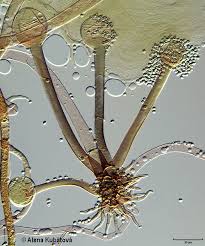
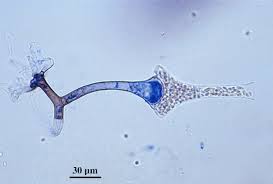
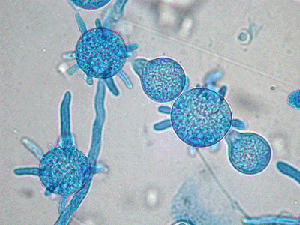
آبسیدیا کوریمبیفرا
آبسیدیا کوریمبیفرا، به اسپورانژیوم گلابی شکل توجه نمائید
کلنیها دارای رشد سریع، کرکی و پرزی و در ابتدا سفید رنگ و سپس به رنگ خاکستری کمرنگ میباشد و تا یک و نیم سانتیمتر از سطح محیط کشت بطرف بالا میآیند. اسپورانژیوفورها شفاف تا کمی پیگمانته، ساده یا گاهی اوقات منشعب هستند که در گروههای 3تائی و یا بصورت حلقه و پیچهای تا 7تائی از استولونها جدا میشوند. ریزوئیدها بصورت خیلی مختصر ایجاد میشوند و ممکن است پیدا کردن آنها مشکل باشد و گاهی تنها با کمک آزمایش میکروسکوپی (استرئومیکروسکوپ) کلنی در سطح آگار میتوان به وجود آنها پی برد. اسپورانژیومها کوچک و به قطر 10 تا 40 میکرون هستند و نوعاً گلابی شکل با کولوملای مخروطی شکل و آپوفیز برجسته و آشکار، اغلب با یک زائدهی کوتاه در قسمت بالائی میباشند.
اسپورانژیوسپورها دارای اشکال متنوعی از کروی شکل تا بیضی کشیده و به ابعاد 3 تا 7 در دو و نیم تا چهار و نیم میکرون و به صورت شفاف تا خاکستری کمرنگ با دیوارهی صاف هستند. زایگوسپورها با وجود استرینهای سازگار با یکدیگر ایجاد میشوند و به رنگ قرمز مایل به قهوهای، با دیوارهی ضخیم و به ابعاد 60 تا 100 در 45 تا 80 میکرون میباشند. ایزولهها وابسته با تیامین هستند و دمای مطلوب برای رشد آنها 35 درجه و حداکثر دمای قابل تحمل برای رشد آنها 48 تا 52 درجهی سانتیگراد است. کلیدهای تشخیص آزمایشگاهی شامل رشد در دمای 40 درجه و اسپورانژیومهای کوچکِ گلابی شکل با کولوملای مخروطی شکل و آپوفیزهای واضح و مشخصِ این قارچ است.
آپوفیزومایسس الگنس/ Apophysomyces elegans
این قارچ زیگومیستی به لحاظ مرفولوژیک شباهت زیادی به آبسیدیا کوریمبیفرا دارد، دارای اسپورانژیوفورهائی با آپوفیزهای قیفی شکل و یا زنگی شکل میباشد و کلوملای نیمه کروی (hemispherical)، در قسمت نزدیک به رأس اسپورانژیوفور (subepical) قسمتی دارای ضخامت و پیگمانتاسیون آشکار و مشخصی است بطوریکه لومن اسپورانژیوفور را دچار فشردگی میکند، همچنین سلولهای پایهی مشخص (foot cell) از خصوصیات دیگر این قارچ میباشد. آپوفیزومایسس الگنس ممکن است در منظرهی ظاهریِ کلنی و نیز در عدم تشکیل کونیدی در محیطهای کشت معمولی شبیه به ساکسنهآ وازیفرمیس (S. vasiformis) باشد. آپوفیزومایسس الگنس بعنوان یک پاتوژن در بیماران دارای سیستم ایمنی شایسته پدیدار شده است و معمولاً عفونتهای مهاجم بافت نرم در جراحات ناشی از سوختگی و یا زخمهای آلوده شده با خاک ایجاد میکند.
گزارشهای دیگری مربوط به عفونتهای کلیه و مثانه و دیوارهی شکم و استئومیلیت وجود دارد. شگـــــــــفت آنکه تنها در یک بیمار با زمینهی دیابتی (Wieden et al. 1985) عفونت با این قارچ گزارش شده و در حقیقت در تمام موارد دیگرگزارش شده عفونت در افراد دارای ایمنی شایسته اتفاق افتاده است و تلقیح تروماتیک قارچ از طریق پوست مهمترین فاکتور مستعدکننده بوده است. آپوفیزومایسس الگنس یک قارچ خاکزی است که بیشتر در نواحی گرمسیری و نیمهگرمسیری جهان منتشر است و اولین بار از نمونههای خاک در شمال هند و سپس از شمال استرالیا جدا شده است. کلنیهای این قارچ رشد سریعی دارند و در ابتدا سفید کرم رنگ هستند که با بالغتر شدن کلنی به رنگ زرد نخودی تبدیل میشوند، دارای کرک و پرز بوده و پشت کلنی پیگمانتاسیون ندارد.
کلنی از هایفیهای عریض، با دیوارههای عرضی اندک و پراکنده (coenocytic) که مشخصهی قارچهای زیگومیستی است تشکیل میشود. اسپورانژیوفورها غیرمنشعب، مستقیم یا خمیده، و به سمت رأس کمکم باریک میشوند و به طول تا 200 میکرون میرسند و در نزدیکی آپوفیز دارای پهنای 3 تا 5 میکرون هستند. در کلنیهای جوان به رنگ شفاف و با گذشت زمان و بالغ شدن کلنی پیگمانتاسیون زرد مایل به قرمز قهوهای تا قهوهای در آنها پیدا میشود و در قسمت نزدیک به رأس ضخامت آشکاری در حدود 10 تا 16 میکرون در زیر آپوفیز پیدا میکنند. اسپورانژیوفورها با زاویهی قائمه از هایفی هوائی جدا شده و اغلب یک قطعهی پایهای دارای دیوارهی عرضی مشابه با “foot cell” که عموماً در گونههای آسپرجیلوس دیده میشود، دارند.
ریزوئیدها دارای دیوارهی نازک، نیمهشفاف و بطور آشکاری غیرمنشعب هستند. اسپورانژیومها محتوی اسپورهای متعددی هستند که کوچک و به قطر 20 تا 50 میکرون است و نوعاً گلابی شکل هستند. این اسپورها در ابتدا شفاف و سپس به هنگام بلوغ به رنگ زرد مایل به قرمز قهوهای دیده میشوند. کلوملا نیمکرهای شکل و آپوفیزها بصورت متمایزی قیفی شکل و یا زنگی شکل میباشند. اسپورانژیوسپورها دارای دیوارهی صاف، عمدتاً دوکی یا مستطیلی شکل (oblong) و گاهی کروی مانند و به ابعاد 3 تا 4 در 5 تا 6 میکرون، نیمهشفاف تا زرد مایل به قرمز قهوهای میباشند. این قارچ در دمای 26 و 37 و 42 درجهی سانتیگراد دارای رشد خوبی است و کلیدهای تشخیص آزمایشگاهی برای آن شامل رشد سریع در 42 درجهی سانتیگراد (thermotolerant) و تشکیل اسپورانژیومهای “cocktail glass” در محیطهای کشت فقیر میباشد.
منظره کلنی در آپوفیزومایسس الگنس: کلنی رشد سریعی دارد، ابتدا سفید و با گذشت زمان سفید کرم تا زرد نخودی با حالت کرکی دارد و پشت کلنی بیرنگ است
آپوفیزومایسس الگنس: اسپورانژیوم بالغ با آپوفیزهای مشخص قیف شکل
زیگومیستها یک ردهی قارچی نسبتاً ساده و ابتدائی با رشد سریع و انتشار وسیع و خاکزی هستند و عمدتاً جزو ساپروبهای موجود در بقایای گیاهی و خاک میباشند. بسیاری از گونههای آن آلودهکنندههای محیطی هستند و اغلب موجب فساد مواد غذائی میگردند. برخی از آنها را بعنوان منابع غذائی در کشورهای خاور دور مورد استفاده قرار میدهند و تعداد کمی از آنها پاتوژنهای گیاهی، بیماریزا برای حشرات و تعداد بسیار کمتری برای انسان بیماریزا هستند.
برخی از گونهها ترموفیلیک بوده و قادر هستند که در دمای بالاتر از ۴۰ درجه سانتیگراد رشد کنند. هایفی آنها سنوسیتیک و عمدتاً فاقد دیوارهی عرضی است بطوریکه به این وسیله از سایر قارچهای ریسهدار متمایز میشوند. فقدان دیوارهی عرضی برای این قارچها دارای مزایا و معایبی است؛ بدین معنی که فقدان دیوارهی عرضی هرچند که بوسیلهی جذب و نقل مکان آزادانهی مواد غذائی و نیز ارگانلهای داخل سلولی بین نواحی رشدی، رشد و اسپورولاسیون آنها را آسانتر میکند، اما از طرف دیگر هنگامیکه عناصر درون هایفی در معرض صدمات فیزیکی قرار میگیرند آسیبپذیری و متعاقب آن مرگ سلولی را راحتتر فراهم میکنند.
در مقایسه، در قارچهای عالیتر متعلق به ردهی بازیدیومیستها و آسکومیستها که دارای دیوارهی عرضی هستند در هنگام آسیب منافذ بین ساختمانهای مجاور هم مسدود میشود و بنابراین از مرگ کل رشتهی قارچی جلوگیری میشود. شاید بدین علت است که در موارد زیگومایکوز انسانی شناسائی ارگانیسم از طریق کشتهای قابلاعتماد در کمتر از ۵۰ درصد موارد گزارش شده در تاریخچه امکانپذیر بوده است. در حال حاضر طبقهبندی و شناسائی قارچهای زیگومسیستی بر اساس حالات غیرجنسی یا آنامورف آنها صورت میگیرد که بوسیلهی تولید اسپورانزیوم و اسپورانژیوسپورها مشخص میگردد.
عفونتهای ناشی از قارچهای راستهی موکورالها
اکولوژی و انتقال
اکثر زیگومیستها انتشار جغرافیائی وسیعی دارند و از سوبستراهای متنوعی بعنوان منابع غذائی استفاده میکنند. تمام پاتوژنهای این گروه در برابر حرارت مقاوم بوده و قادر به رشد در دماهای بالاتر از ۳۷ درجه میباشند. اعضاء راستهی موکورالها بر روی گیاهان، مواد غذائی، میوهها و سبزیجات در حال فساد، خاک و فضولات حیوانی یافت میشوند. اغلب آنها بویژه گونههای مختلف جنس رایزوپوس بسرعت در سوبستراهای حاوی مقادیر زیادی از کربوهیدراتها رشد میکنند. اسپورانژیوسپورها به شکل ذرات هوابرد بداخل محیط آزاد میشوند و با سطوح مختلف تماس پیدا میکنند. از لحاظ بالینی مهمترین فرم کلینیکی فرم رینوسربرال و فرم ریوی است که مربوط به استنشاق اسپورانژیوسپورها از طریق مجاری تنفسی میباشد.
عفونتهای بیمارستانی در نتیجهی حضور اسپورانژیوسپورها و هایفیهای قارچ بعنوان آلودهکننده در سیستمهای تهویه مطبوع و وسایل و البسهی مربوط به مراقبت از زخمها و جراحات مطرح میباشند. پریتونیت بدنبال دیالیز صفاقی، عفونتهای منتشره بعد از انفوزیون مایعات آلوده، عفونت پوست بعد از استفاده از کاتتر داخل وریدی و سایر عفونتهای مربوط به کاربرد اجسام خارجی نظیر دریچههای مصنوعی قلب، و لنزهای تماسی نیز گزارش میشوند. عفونتهای بیمارستانی ناشی از قارچهای موکوراسئوس به اندازهی عفونتهای ناشی از گونههای آسپرجیلوس شایع نیستند و بسیاری از گزارشها مربوط به بیمارانی هستند که دچار بدخیمیهای خونی میباشند. انتقال عفونت بصورت فرد به فرد وجود ندارد.
فاکتورهای خطر
بیماریهای زمینهای نسبت به سایر فاکتورها نظیر سن، جنس و نژاد در توسعه و گسترش عفونتهای مربوط به زیگومیستها بسیار مهم است. میزان عفونت در زنان و مردان با یکدیگر برابر است. عفونتهای ناشی از قارچهای موکوراسئوس در نوزادان تازه متولد شده تا سنین کهولت دیده میشود. در بچهها در مقایسه با گروههای دیگر بصورت عجیبی عفونت زیگومیستی بدون علت زمینهای به نسبت بیشتری دیده میشود. فاکتورهای مستعدکننده شامل دیابت ملیتوس خوب کنترل نشده میباشد بخصوص اگر وضعیت کتواسیدوزیس وجود داشته باشد. افزایش غلظت گلوکز رشد سریع زیگومیست را تحریک میکند. میزان رشد آنقدر سریع است که گوئی این قارچها زمانی برای ایجاد تیغهی میانی در هایفیهای خود در اختیار ندارند و یا اینکه نیازی به تشکیل تیغهی عرضی ندارند.
اسیدوز متابولیک یا هایپرگلیسمی، درمان با کورتیکوستروئید، درمان با داروهای ایمیونوسوپرسیو برای پیوند اعضاء یا مغز استخوان، نوتروپنی، درمان با دفروکسامین برای برداشت اضافه بار آهن و آلومینیم از جمله فاکتورهای مستعدکننده هستند. اثرات درمان با دفروکسامین در پاتوژنز عفونتهای ناشی از قارچهای موکوراسئوس از اواخر دههی 1980 به اینطرف شناخته شده است. در یک مطالعهی مروری که توسط R.D. Baker در سال 1971 انجام شده در 36 درصد از 255 مورد عفونت مربوط به قارچهای موکوراسئوس، دیابت یک فاکتور مستعدکننده شناخته شده است.
در مطالعات مروری بعدی دیابت فاکتور مستعدکننده در 40 تا 46 درصد موارد شناخته شده است. لوسمی و لنفوم در 15 تا 21 درصد موارد، تومور بافتهای جامد یا نارسائی کلیوی در 5 درصد موارد، و حالتهای متفرقهی دیگر در 20 درصد موارد بعنوان فاکتورهای خطر مساعدکننده در نظر گرفته شدهاند و در این مطالعات 9 درصد از موارد، بیماری زمینهای خاص و ثابت شدهای نداشتهاند. فاکتور خطر دیگری که در سالهای اخیر شناخته شد عفونت HIV است. در یک مرور بر روی 28 مورد زایگومایکوزیس در این گروه از بیماران 16 تا از 22 بیمار معتادان تزریقی بودهاند که در افراد HIV منفی بعنوان فاکتور خطر شناخته شده است.
طغیانهای کوچک مربوط به عفونتهای رایزوپوس میکروسپوروس واریتهی ریزوپودیفرمیس Rhizopus microspores var. rhizopodiformis را با بانداژهای الاستوپلاست آلوده شده مرتبط دانستهاند. از این بانداژها در ژوژنوستومی استفاده شده است. در یک مرور مربوط به عفونتهای جلدی موکوراسئوس ۱۵ مورد به استفاده از سوزنهای آلوده در محلهای کاتتریزاسیونهای عروقی یا بافتی (۸ مورد)، محلهای تزریق انسولین (۳ مورد) و محلهای بیوپسی (۳مورد) ارتباط داشتهاند. همچنین آبسلانگهای چوبی که از آنها بعنوان آتل برای محلهای کانولاسیون شریانی یا وریدی در بخش نوزادان در اطفال نارس استفاده کردهاند بعنوان منبع عفونتهای ناشی از رایزوپوس میکروسپوروس شناخته شدهاند.
سرانجام میتوان گفت که میزبانان دارای سیستم ایمنی دستنخورده (سالم) نیز میتوانند دچار عفونت با این قارچها شوند. جراحات لوکال قبل از حضور عفونت نیز داکومنته شده است که دامنهی آن از عفونتهای پوستی تا عفونتهای رینوسربرال و منتشره متفاوت است.
دادههای بدست آمده از حیوانات آزمایشگاهی نشان داده است که درمان با دفروکسامین، دیابت و نوتروپنی بطور واضحی برای عفونتهای مربوط به اعضای موکورالها فاکتور مستعدکننده میباشند. حیواناتی که تحت درمان با دفروکسامین بودهاند را با رایزوپوس آریزوس و Rhizopus microspores var. rhizopodiformis بصورت تجربی آلوده کردهاند، مشاهده شده است که میزان بقای آنها کاهش پیدا کرده است. زیگومیستها در شرائط آزمایشگاهی (in vitro) حساسیت با درجات متغیری نسبت به دفرکسامین دارند.
رشد رایزوپوس میکروسپوروس و کانینگهاملا برتولتیا Cunninghamella bertholletiae با دفرکسامین تحریک میشود در حالیکه دفرکسامین رشد رایزوپوس آریزوس، آبسیدیا کوریمبیفرا، و موکور سیرسینلوئیدس را به تأخیر انداخته یا خنثی میسازد. درمان با کورتیکوستروئید فاکتور مساعدکنندهای برای زیگومیستها است اما عفونت مربوط به رایزوپوس آریزوس را مساعدت نمیکند.
ماکروفاژهای برونکوآلوئلار موشهای نرمال قادر به کنترل و مهار جوانه زدن اسپورانژیوسپورهای رایزوپوس آریزوس هستند اما این ماکروفاژها در موشهای دیابتیک این توانائی را ندارند. نوتروفیلهای انسان و مواد و محصولات آنها قادر به کشتن هایفی رایزوپوس آریزوس هستند که این مسئله تا حدودی حساسیت بیماران نوتروپنیک به زیگومیستها را توجیه میکند.
فاکتورهای ویرولانس
عفونت زایگومیستی در افراد سالم بندرت اتفاق میافتد مگر اینکه محل ورود قارچ متعاقب یک تروما فراهم شده باشد. این نکته بیانگر این است که موقعی که یکی از مکانیسمهای دفاعی میزبان تغییر میکند فاکتورهای ویرولانس قارچی بطور مؤثری عمل خواهند کرد.
بیماری زمینهای، راه ورود و اشکال کلینیکی
به نظر میرسد که وضعیت کتواسیدوز افراد را نسبت به عفونتهای سینوس مستعد میکند. بدخیمیها، نوتروپنی مفرط و درمان با کورتیکوستروئید اغلب با عفونتهای ریه و عفونتهای منتشره مرتبط هستند. نیمی از 59 مورد مرتبط با درمان با دفروکسامین در گزارش Boelaert و همکاران، عفونتهای منتشره و بعد از آن بعنوان دومین فرم شایع وضعیت رینوسربرال بوده است. در بین فاکتورهای خطر برای عفونت منتشره غلبهی بیشتر مربوط به بدخیمیهای هماتولوژیک است. آسیب سدهای فیزیکی مانند پوست، مجاری گوارشی و ریوی در معتادان تزریقی و در نوزادان بعنوان عوامل خطر اصلی شناخته شده است.
عفونتهای منتشره از محل دستگاه گوارشی در بچههای مبتلا به سوءتغذیه، سوءجذب، یا اسهال اتفاق میافتد و در بالغین در افرادی که زخم پپتیک دارند و یا در آبنرمالیتیهای رودهای بعد از اعمال جراحی، تروما، بیماری التهابی و یا در بیماران با بیماری زمینهای کبدی اتفاق میافتد. عفونتهای دستگاه گوارش گاهی اوقات با هضم مواد غذائی آلوده شده همراه بوده است. در گیرندگان پیوند ارگانهای جامد، زیگومیستها در 1 تا 9 درصد بیماران در زمان متوسط 60 روز (دامنهی آن از 2 روز تا 4 سال متفاوت است) بعد از پیوند موجب عفونت شدهاند. استفاده از کورتیکوستروئید و دیابت ملیتوس بترتیب بعنوان فاکتورهای مستعدکننده با 10 و 5 مورد فراوانی از 14 موردی بودهاند که در سال 1986 مرور شدهاند. در گیرندگان پیوند تمام فرمهای کلینیکی بیماری را میتوان دید. در بیماران مبتلا به ایدز شایعترین فرم کلینیکی شامل عفونتهای کلیوی (7 مورد)، جلدی، سینوسی- چشمی و مغزی (هر کدام 5 مورد) بودهاند (Van den Saffele, et al. 1996 & Nagy-Agren, et al. 1995).
سوء مصرف داروهای تزریق وریدی بطور روشنی بعنوان عامل مستعدکننده برای عفونت مغزی عمل میکند. در بین 16 بیمار معتاد تزریقی HIV مثبت، 4 نفر عفونت مغزی داشتند، این فرم از بیماری در افراد معتاد تزریقی HIV منفی 16 از 19 مورد بوده است. بطور مشخص درگیری گانگلیای بازال در طول مدت عفونت موکوراسئوس مغزی در افراد معتاد تزریقی HIV منفی دیده شده است. در یک مطالعهی مروری بر روی 111 مورد زیگومیکوز جلدی فاکتورهای موضعی شامل جراحی (17%)، سوختگیها (16%)، تروماهای مربوط به وسایل نقلیه موتوری (12%)، استفاده از انواع سوزنها (13%)، زخمهای چاقو (3%)، گزش حشرات و عنکبوت (3%)، و انواع دیگر تروماها یا لزیونهای پوستی (23%) بودهاند.
علیرغم این واقعیت که محلهای ورود اولیهی عامل زیگومیستی پوست بوده و بیماران از لحاظ سیستم ایمنی سالم بودهاند، انتشار عوامل اتیولوژیک و یک پیامد مرگبار در برخی از بیماران همچنان اتفاق میافتد. این مسئله بویژه اگر با استفاده از روشهای تشخیصی نامناسب تشخیص با تأخیر صورت گیرد و یا این عقیده (ی اشتباه!) که قارچ رشد کرده در محیط کشت یک آلودهکننده است حقیقت بیشتری به خود میگیرد. عفونتهای پوست همچنین در بین افرادیکه از قبل مبتلا به بیماریهای دیگری بودهاند، دیده میشود.
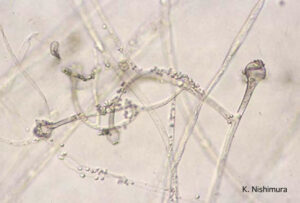
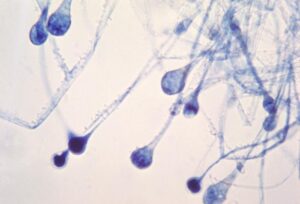
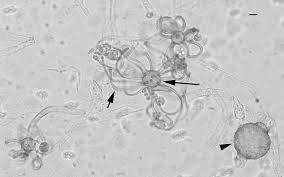
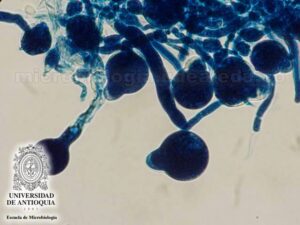
اسپورانژیومهای جوان در موکور
موکور: ورود به مغز از طریق عروق خونی
موکور پوسیلوس: تهاجم به دریچهی قلب
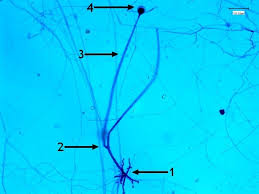
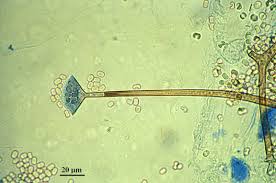
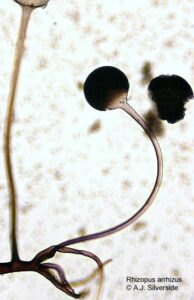
ساختمان میکروسکپی رایزوپوس
ساختمان اسپوانژیوم، اسپورانژیوفور و ریزوئید در رایزوپوس آریزوس
عوامل اتیولوژیک و اشکال بالینی
یکی از بزرگترین مشکلات مربوط به عفونت زیگومیستی شناسائی ارگانیسم مسبب است. هنگام مرور تاریخچهی پزشکی و بویژه مطالعهی گزارشهای قدیمیتر متوجه میشویم که اطلاعات مربوط به عوامل اتیولوژیک اغلب از قلم افتاده است و تنها یافتههای هیستوپاتولوژیک هستند که از تشخیص زایگومایکوزیس حمایت میکنند. در یک مطالعهی مروری بر روی 361 موردی که مابین ســـــــالهای 1958 تا 1985 گزارش شده است Espinel-Ingroff و همکاران تنها 156 مورد را یافتند که در آنها شناسائی عوامل (129 مورد مربوط به موکورالها و 27 مورد مربوط به انتموفتورالها) گزارش شده بود.
در بین این عوامل گونههای رایزوپوس شایعترین ارگانیسم (95 مورد) و بعد از آن گونههای موکور (19 مورد) بیشترین فراوانی را داشتند. حتی هنگامیکه شرائط شناسائی ارگانیسمها فراهم شده باشد، توضیح جزئیاتی که برای حصول اطمینان از صحت شناسائی ضروری است معمولاً وجود ندارد.
گونههائی که زمانی بعنوان آلودهکننده در نظر گرفته میشدند از قبیل آپوفیزومایسس الگنس اکنون بعنوان عوامل اتیولوژیک عفونت شناخته و گزارش میشوند. هر چند که برخی از گونهها بصورت بیشتر شایع در ارتباط با فرمهای کلینیکی خاصی مطرح هستند (رایزوپوس آریزوس و عفونت رینوسربرال) اما اکثر این قارچها میتوانند سبب طیف وسیعی از عفونتهای مختلف شوند، بنابراین شناسائی دقیق ارگانیسم امری ضروری است. در بین موکورالها اعضاء خانواده موکوراسه اکثر اوقات درگیر بیماریهای انسانی هستند. رایزوپوس آریزوس (با نام قدیمی رایزوپوس آریزا: Rhizopus aryzae) شایعترین عامل فرمهای رینوسربرال است. واریتهی ریزوپودیفرمیس رایزوپوس میکروسپوروس Rhizopus microspores var. rhizopodiformis مسئول ۱۰ تا ۱۵ درصد از عفونتهای انسانی است که در ابتدا عفونتهای جلدی و گوارشی (معدی– رودهای) ایجاد میکند. این گونهها معمولاً با عفونتهای بیمارستانی زایگومایکوزی مرتبط هستند.
علیرغم این واقعیت که آبسیدیا کوریمبیفرا اغلب بعنوان عامل شایع عفونت موکوراسئوس در انسان شناخته شده است اما در تاریخچهی پزشکی به گزارشهای کمتری از آن برخورد میکنیم. جالب است که بدانیم که این قارچ بعنوان ارگانیسم عامل در ۵ مورد از ۱۷ مورد عفونت در بیماران ایدزی شناخته شده است که ۳ مورد آن عفونتهای فوکال کلیوی، یک مورد اولسراسیون فارنژیال و یک مورد عفونت جلدی بوده است. تا قبل از سال ۱۹۹۳ رایزوموکور پوسیلوس Rhizomucor pusillus در 12 مورد از اشکال مرگبار زایگومایکوزیس بعنوان عامل مقصر شناخته شده است که شامل 3 مورد بینی- صورتی (rhinofacial)، 6 مورد عفونت منتشره و 3 مورد عفونت ریوی بوده است. واریتهی میکروسپوروس از ارگانیسم رایزوپوس میکــــــــــــروسپوروس و همچنین رایزوپوس آزیگوسپوروس Rhizopus azygosporus بندرت از لزیونهای انسانی جدا شدهاند.
رایزوپوس میکروسپوروس واریتهی ریزوپودیفرمیس
رایزوپوس میکروسپوروس واریتهی میکروسپوروس
رایزوپوس میکروسپوروس واریتهی الیگوسپوروس
گونههای موکور بعنوان عوامل کمیاب بیماری منتشره مطرح میباشند اما از لزیونهای پوستی، اندوکاردیت و آرتریت جدا میشوند. تا قبل از سال ۱۹۸۵ تنها ۷ مورد از عفونتهای مربوط به کانینگهاملا برتولتیا (Cunninghamella bertholletiae) گزارش شده بود، اما از این تاریخ به بعد گزارشهای متعددی به اهمیت این قارچ بعنوان یک عامل عفونتهای ریوی و منتشره در بیماران ایمیونوسوپرس اشاره میکنند. این عفونتها پیشآگهی شدیدی داشته و تنها 3 مورد از 21 بیمار جان سالم بدر برده و زنده ماندهاند. 2 مورد از عفونت پوستی مفصلی (cutaneoarticular) در بیماران مبتلا به ایدز ثبت شده که توسط کانینگهاملا برتولتیا ایجاد شده است.
کانینگهاملا برتولتیا: اسپورانژیوم، اسپورانژیوفورمنشعب و اسپورانژیوسپور
کانینگهاملا برتولتیا: اسپورانژیوم، اسپورانژیوفور و اسپورانژیوسپور و هایفیهای فراخ بدون تیغهی میانی
آپوفیزومایسس الگنس Apophysomyces elegans و ساکسنهآ وازیفرمیس Saksenaea vasiformisاز لزیونهای پوست و استخوان متعاقب جراحتهای تروماتیکی مکانیکی یا سوختگیها جدا شدهاند. هر دو اینها همچنین با عفونتهای دیگر در میزبانان سالم (بلحاظ سیستم ایمنی) مرتبط بودهاند، از جمله مواردی از زایگومایکوز رینوسربرال مهاجم حاد که توسط آپوفیزومایسس الگنس و ساکسنهآ وازیفرمیس ایجاد شده و عفونت منتشرهای که بوسیلهی ساکسنهآ وازیفرمیس پدید آمده است. هر دو این قارچها اغلب عفونتهائی در بیماران ساکن مناطق گرمتر ایجاد میکنند. آپوفیزومایسس الگنس بخوبی در خاکهای گرم رشد میکند و چندین مورد از عفونتهای منتسب به آن در حوادث جادهای گزارش شده است. قابل توجه است که بدانیم که این عفونتها عمدتاً در میزبانان سالم اتفاق میافتند.
ساکسنهآ وازیفرمیس: اسپورانژیوم فلاسکی شکل
ساکسنهآ وازیفرمیس: اسپورانژیوم فلاسکی شکل
کوکرومایسس رکورواتوس Cokeromyces recurvatus قادر به کلونیزه کردن سطوح مخاطی است و موجب سیستیت مزمن میشود و احتمالاً با یک مورد عاقبت مرگبار در یک فرد دیابتی که زخم پپتیک سوراخ شده داشته، مرتبط بوده است. (Munipali B, et al. 1996) این قارچ یک پاتوژن فرصتطلب میباشد.
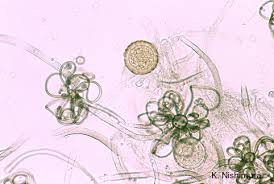
نمای اسپورانژیوم و اسپورانژیوسپورها در کوکرومایسس رکورواتوس
نمای اسپورانژیوم و اسپورانژیوسپورها در کوکرومایسس رکورواتوس
عفونتهای ناشی از قارچهای راستهی انتوموفتورالها
اپیدمیولوژی و انتقال بازیدیوبولوس راناروم Basidiobolus ranarum
عفونتهای مربوط به بازیدیوبولوس راناروم بهطور عمده در نواحی گرمسیر آسیائی (هند، اندونزی و میانمار)، آفریقائی (اوگاندا، نیجریه، کامرون، توگو، ساحلعاج، سودان، سنگال، سومالی و کنیا)، آمریکای جنوبی (عمدتاً در برزیل)، آمریکای شمالی (مکزیک) و در استرالیا دیده میشود. یک مورد مشخص در انگلستان در بیماری مشاهده شد که سابقه برخورد با ارگانیسم در اندونزی را داشته است.
ارگانیسم قارچی در گیاهان در حال فساد، خاک و بهعنوان ساپروب در محتویات رودهای خزندگان حشرهخوار مختلفی مثل بزمجهها و آفتابپرست (chameleon)، دوزیستهایی مانند وزغ و پستاندارانی از قبیل خفاشها، کانگوروها و کانگوروهای متوسطالقامه گردن قرمز (wallabies) وجود دارد. نظر بر این است که راه ورود ارگانیسم از طریق پوست متعاقب گزش حشره، خراشیدنها و برشهای کوچک است. به این دلیل است که بیشترین نمای این عفونتها در بچهها در قسمت رانها و سرینهای آنها دیده میشود. بندرت تاریخچهای از سابقهی ترومای قبلی وجود دارد. بیماران معمولاً بیماری زمینهای آشکار و مشخصی ندارند، هرچند که موارد کمیابی در افراد دارای سیستم ایمنی مختلشده شرح داده شده است که عفونتهایی شبیه عفونتهای ناشی از قارچهای موکوراسئوس را تقلید میکنند.
موردی از بیماری به دنبال تزریق درونماهیچهای نیز گزارش شده است. عفونتهای ناشی از بازیدیوبولوس راناروم بیشتر در کودکان (80 درصد موارد در افراد کمتر از 20 سال) و با نسبت جنسی مذکر به مؤنث 3:1 دیده میشود.
کلنی بازیدیوبولوس راناروم
بلاستوکونیدیای بازیدیوبولوس راناروم
کنیدی در حالت تولید هایفی و کونیدیوفور
عفونت پوستی ناشی از بازیدیوبولوس
توانائی تحمل سرما توسط بازیدیوبولوس راناروم بسیار کم بوده و در حرارتهای پائین بهسرعت از بین میرود، ولی انتشار آن در مناطق گرمسیر و نیمهگرمسیر وسیع و جهانی است. انتموفتورومایکوزیس بازیدیوبولا اغلب بیماری کودکان بوده و در حدود نیمی از بیماران را کودکان زیر ۱۰ سال تشکیل میدهند.
علائم بالینی
عفونت بهصورت یک ندول زیرجلدی آغاز میشود که بهتدریج بزرگ میشود. محل ورود قارچ ناشناخته است ولی در چند مورد نیش پشه و یا دیگر حشرات قبل از شروع علائم موردتوجه بیمار بوده است که این مسئله ممکن است نشاندهندهی احتمال دخالت بندپا در انتقال این بیماری باشد. ورود قارچ از طریق دستگاه گوارش نیز احتمالاً میتواند صورت گیرد. تورم زیرجلدی، دارای قوامی سخت با حاشیه مشخص و بدون درد است هرچند که احتمال خارش ضایعه نیز وجود دارد. توده قابللمس بوده و اگرچه اتصالی به تاندونهای عضلات زیرین نداشته و آزادانه حرکت میکند ولی به پوست پوشاننده خود متصل است.
پوست ناحیه مبتلا آتروفیه گشته، بدون رنگ و یا پررنگتر از نواحی مجاور مشاهده میشود. ضایعه زخمی نگشته و رشد آن بدون وقفه ادامه مییابد بطوریکه میتواند شانه، بازوها، قسمت فوقانی تنه، صورت، گردن، ران و نشیمنگاه را بهطور کامل گرفتار سازد. در موارد اندکی گرفتاری اعضاء داخلی نظیر کبد، روده و عضلات گزارش شده است. در پارهای از موارد شواهدی دال بر احتمال ابتلای ریه، کام، دهان و سینوسها وجود داشته ولی تاکنون درگیری غدد لنفاوی ناحیه مربوطه و انتشار بیماری از طریق خون و یا لنف گزارش نشده است. در موارد معدودی عفونت بهطور ناگهانی و خودبهخودی فروکش نموده ولی در اغلب موارد نیاز به درمان با یدور پتاسیم و آمفوتریسین B دارد.
تشخیص افتراقی
تاریخچه بیماری به همراه نتایج آسیبشناسی بهقدر کافی اختصاصی هستند که موجب تشخیص شوند ولی بههرحال جهت تأئید تشخیص، کشت از ضایعه ضرورت دارد. از جمله بیماریهایی که در تشخیص افتراقی باید در نظر گرفته شوند میتوان از بدخیمیها، آبسههای چرکین، الفنتیازیس و عفونتهای کرمی نام برد. بیماری شایع دیگری که در برخی از کشورهای آفریقائی نظیر اوگاندا وجود داشته و با انتموفتورومایکوزیس بازیدیوبولا اشتباه میشود زخم بورولی میباشد که بهوسیله ارگانیسم چربیدوستی بنام مایکوباکتریوم اولسرانس ایجاد میشود. زخم بورولی نیز بهآرامی انتشار یافته و مناطق وسیعی از بافت زیرجلدی را مبتلا میسازد.
پیشآگهی و درمان
پیشآگهی انتوموفتورومایکوزیس بازیدیوبولا غالباً خوب بوده و در بین متجاوز از یکصد و پنجاه مورد شناخته شده و گزارش شده تنها تعداد ناچیزی منجر به فوت شده است. در پارهای از موارد بیماری بهطور خودبهخود بهبود یافته ولی درمان غالباً ضروری است. درمان با نیستاتین و گریزئوفولوین ناموفق بوده است، یددرمانی روش موفقی است که در طی آن از یدور پتاسیم به میزان روزانه ۳۰ میلیگرم به ازای هر کیلوگرم وزن بدن در یک تا سه دوز استفاده شده و به مدت ۶ الی ۱۲ ماه تجویز میگردد. در مواردی که یددرمانی مؤثر باشد مراحل بهبود با کاهش ضخامت لایه ائوزینوفیلی اطراف میسلیوم و محو شدن تدریجی رشتههای میسلیوم توأم بوده و اگرچه بعد از تأثیر دارو تا مدتی گرانولوم توبرکلوئیدی در محل ضایعه باقی میماند ولی بافت نکروزه بهتدریج فیبروز میشود.
آسیبشناسی
پوست روی ضایعه آتروفیه بوده و بندرت زخمی میشود، توده زیرجلدی قوامی سخت داشته، ضخیم بوده، از بافت فیبروزه تشکیل شده و گاهی دارای کانونهای زردرنگ نکروزه است و تودههای میسلیوم درون ترشحات آنها وجود دارند. مقاطع آسیبشناسی انواع انتوموفتورومایکوزیس اعم از بازیدیوبولا و کونیدیوبولا کاملاً یکسان میباشند. عناصر میسلیال به قطر ۱۰ الی ۴۰ میکرون وجود داشته ولی داخل گرانولوم محو و کمرنگ مشاهده میشوند. لایه ضخیم ائوزینوفیلی و خاصیت اتوفلورسنت میسلیوم کمک ارزشمندی جهت پیگیری و تشخیص محل میسلیوم مینماید. این قارچها اصولاً در کلیه روشهای رنگآمیزی بسیار ناچیز رنگ گرفته و تنها وجود غلاف ائوزینوفیلی محل آنها را مشخص میسازد. میسلیوم در این قارچها دارای تعداد متغیری تیغه میانی است. از آنجا که گونههای مورتیرلا نیز در بافت ایجاد غلاف ائوزینوفیلی میکنند، تشخیص قطعی فقط با کشت نمونه میسر است.
تشخیص آزمایشگاهی
به دلیل پیشآگهی وحشتناک زایگومایکوزیس کمترین تردید نسبت به عفونت در یک بیمار در معرض خطر میباید منجر به تهیه بیوپسی برای به دست آوردن نمونههای بافتی بهمنظور انجام آزمایش مستقیم میکروسکپی، بررسی هیستولوژیک و کشت گردد. از طرف دیگر به علت اینکه قارچهای مسئول اینگونه عفونتها ممکن است بهعنوان عوامل آلودهکننده حضور داشته باشند، عوامل زیگومیستی که در محیطهای کشت رشد میکنند بدون نشان دادن هایفیهای پهن در بافتها یا نمونهها تفسیر مشکلی خواهند داشت، مگر اینکه نمونه مربوط به یک فرد دیابتی و یا نوتروپنیک باشد. یک کشت مثبت از نظر زیگومیست مربوط به نمونه خلط، تراشههای پوست، یا ترشحات بینی در حضور عوامل مستعدکننده و یا آزمایش مستقیم از نمونه بیشتر معنیدار خواهد بود.
از نمونه بیوپسی لام مستقیم تهیه شده و با پتاس ۱۰ درصد مورد آزمایش قرار میگیرد. در اینجا عناصر میسلیومی پهن، منشعب و دارای تیغههای میانی مشاهده میشوند. در داخل سلولهای میسلیوم انکلوژنهای داخل سیتوپلاسمی وجود داشته و دیواره سلول نیز بهصورت درخشنده و دولایه دیده میشود.
آزمایش مستقیم
نمونهها باید از محلها یا نقاطی که به نظر میرسد عفونی هستند، تهیه شوند. در فرم رینوسربرال تراشههای بینی و آسپیرههای سینوسها را به دست میآورند. برای عفونتهای درگیرکنندهی ریه، خلط یا مایع لاواژ برونکوآلوئلار سانتریفیوژ شده مفید است. از هر محلی، بیوپسی از بافتهای عفونی نکروتیک باید تهیه شود. نمونهها را بعد از آمادهسازی به کمک چند قطره پتاس ۱۰درصد مورد آزمایش میکروسکپی قرار میدهند. هایفیهای پهن به قطر ۷ تا ۱۵ میکرون که دارای دیوارههای میانی بهصورت پراکنده هستند معمولاً دیده میشوند. سلولهای متورم به قطر تا ۵۰ میکرون و هایفیهای تغییرشکل یافته اغلب مشاهده میشوند.
انشعابات هایفیها با آنچه در گونههای آسپرجیلوس دیده میشود متفاوت است. در اینجا انشعابات اغلب با زاویه ۹۰ درجه نسبت به هایفی اصلی دیده میشود. در صورت مشاهده تظاهرات دیگر از قبیل هایفیهای نازکتر با قطر کمتر از ۵ میکرون یا انشعابات با زوایای تندتر، تشخیص رد نمیشود، این مسئله در صورت عدم مشاهده هایفی نیز صادق است زیرا عناصر قارچی اغلب بهصورت پراکنده در بافت وجود دارند. اشکال غیرمعمولی زیگومیستها همچنین شامل اشکال مخمری موکور سیرسینلوئیدس M. circinelloides میباشد که میتواند در نمونههای مایع با پاراکوکسیدیوئیدس برازیلینسیس اشتباه گرفته شود.
روشهای کشت
نمونههای بیوپسی را بر روی محیط سابورودکستروزآگار و یا هر محیط فاقد سیکلوهگزامید میتوان کشت داد. مطالعات مکرر نشان داده که کشت مقاطع بزرگتر از مواد بیوپسی شده نتایج بهتری داشته و کلنیهای قارچ سریعتر از کشت مقاطع کوچک بر روی محیط قابلمشاهده میگردند. در دمای مطلوب ۲۵ الی ۳۰ درجه سانتیگراد و در مدت ۴۸ الی ۷۲ ساعت کلنیهای قارچ مشاهده شده و در عرض ۴ روز قطر آنها به ۷ سانتیمتر میرسد.
تمام قارچهای مسبب زایگومایکوزیس را میتوان در محیطهای کشت استاندارد آزمایشگاهی بدون سیکلوهگزامید کشت داد. از آنتیبیوتیکها در محیط کشت میتوان استفاده کرد، بخصوص در مواردی که با نمونههای آلوده نظیر ترشحات بینی یا خلط سروکار داریم. بهعوض اکسوداهای سطح ضایعه کشت از خود بافت برای افتراق دادن بین کلونیزاسیون از عفونت و همچنین بالا بردن شانس جدا کردن قارچ، ارجح است. نمونهی مایعات را باید در سطح پلیت بهصورت گسترده کشت داد و نمونههای بافت را باید خرد و ریزریز کرده و سپس کشت داد، نمونه بافت هموژنیزه برای کشت مناسب نیست بنابراین از هموژنیزاسیون باید اجتناب کرد زیرا تخریب هایفیها احتمال جداسازی قارچ در کشت را کاهش خواهد داد. طبق گزارش برخی از محققین قرار دادن یک تکه از نان استریل بدون هیچگونه محافظتکننده بر روی سطح آگار و تلقیح نمونه بر روی آن، شانس جداسازی زیگومیستها در کشت را افزایش میدهد.
اغلب در ۴۰ در صد موارد نتایج کشت منفی به دست میآیند. در مواردی که نتایج کشت منفی است و نتایج هیستولوژی مثبت است تکرار نمونهبرداری مفید است. رشد این قارچها سریع است و کلنی معمولاً بعد از ۲۴ ساعت انکوباسیون در دمای ۲۵ الی ۳۷ درجه سانتیگراد قابل رؤیت است. قابلذکر است که تشخیص و یا رد زایگومایکوزیس را نمیتوان به عهدهی کشت به تنهائی بنا نهاد و آن بستگی دارد به شواهد و مدارکی که به کمک کلینیسین و میکروبیولوژیست، هر دو به دست آمده باشد. بعد از جداسازی، شناسایی قارچ اغلب نیازمند به کمک یک مایکولوژیست است.
انتقال ایزولههای استریل (عقیم) به سالینآگار یا به پلیتهائی که حاوی آب غنیشده با محلول ۱% عصاره مخمر استریل شده (به کمک فیلتر) باشند، میتواند کمک کند تا ساختمانهای مشخصهی اسپورزائی که برای شناسایی موردنیاز هستند بوجود آید. گاهی اوقات تنها راه شناسایی برخی از اعضاء این دسته از میکروارگانیسمها به دست آوردن زایگوسپور آنها است. برای تحریک اسپورزائی در گونههای بازیدیوبولوس استفاده از محیط کشت حاوی گلوکوزامین هایپوکلراید و هیدرولیزات کازئین توصیه شده است.
هیستولوژی
در طول عفونتهای حاد مرتبط با قارچهای موکوراسئوس، به علت تهاجم قارچ به عروق خونی، بافت حالت نکروتیک، هموراژیک، یا رنگپریده دارد. تهاجم قارچ منجر به ترومبوز، نکروز و انفارکتوس بافتی میشود و در اکثر موارد التهاب دیده نمیشود. رنگآمیزی بهوسیله هماتوکسیلن – ائوزین یا PAS صورت میگیرد، رنگآمیزی نقره با استفاده از رنگ GMS ناپایدار و بیثبات است. هایفیهای بههمپیچیده، پهن، با انشعابات نامنظم مشاهده میشوند. ممکن است مقداری هایفی باریک نیز دیده شوند اما فاقد انشعابات دوشاخهای (dichotomous) هستند که بهطور مشخصی مرتبط با آسپرجیلوس است.
دیواره میانی ندرتاً مشاهده میشود درحالیکه در آسپرجیلوس بهخوبی و بهوضوح قابلمشاهده است. مقاطع عرضی هایفیهای بزرگ در بافت، شبیه سلولهای مخمری هستند و این منظره البته مشابه آنچه که در عفونتهای آسپرجیلوسی است دیده میشود. عناصر قارچی معمولاً به عروق خونی و بافتهای مجاور تهاجم مییابند.
پدیدهی اسپلندور -هوپلی
در عفونتهای مزمن ناشی از قارچهای موکوراسئوس و در تقریباً در تمام عفونتهای مرتبط با اعضاء انتوموفتورالها یک پروسه التهابی مزمن با آبسههای کوچک که توسط یک واکنش بافتی گرانولوماتوزی محاصره شده است میتواند دیده شود. واکنش ائوزینوفیلیک قوی اطراف هایفیها غالباً مشاهده میشود (فنومن اسپلندور –هوپلی) که از نظر اندازه متغیر است و بین ۲ تا ۶ میکرون ضخامت دارد. هایفیهای پهن و نامنظم به قطر ۴ تا ۳۰ میکرون با دیوارهای نازک و تیغه میانی به تعداد کم میتوان مشاهده کرد. هیچگونه تهاجم به عروق خونی یا انفارکتوس بافتی آنطور که در عفونتهای حاد وجود دارد در اینجا دیده نمیشود.
قارچشناسی بازیدیوبولا
تقریباً تمامی زیرگونههای بازیدیوبولوس راناروم در دمای ۳۰ درجه بهسرعت رشد میکنند ولی قابلیت رشد آنها در دمای ۳۷ درجه متغیر است. کلنی این قارچ مسطح و پهنشده، چیندار، شیاردار، مومی و به رنگ خاکستری میباشد و میسلیومهای آنها پهن و بزرگ بوده و با گذشت زمان و شروع اسپورزائی دارای تیغههای میانی میگردند. بعد از ۷ الی ۱۰ روز تعداد زیادی زایگوسپور، کلامیدوکونیدیا و اسپورانژیولا ایجاد میشود. قطر زایگوسپور بین ۲۰ تا ۵۰ میکرون بوده و دارای دیواره ضخیمِ مواج و یا صاف است. اکثر قارچهای جداشده از عفونتهای انسانی توانایی تولید زایگوسپور را داشته و به این علت آنها را گونههای هاپتوسپوروس و یا مریستوسپوروس نامیدهاند. این کلنیها دارای بویی مشابه بوی استرپتومیسسها میباشند هرچند که این ویژگی ثابت نبوده و همچنین بوی ایجادشده توسط کلنیهای معطر نیز یکسان نمیباشند.
زایگوسپورهای این قارچ دارای زائده منقارمانند برجستهای میباشد که به یکطرف آنها متصل بوده و نشانگر بقایای لولههای جنسی در هم ادغامشده میباشند. اسپورانژیوسپورهای تولیدشده حاصل یک اسپورانژیوم تکسلولی هستند. در ابتدا قسمت رأسی میسلیوم برندهی اسپورانژیوم بزرگ شده و سپس بهسرعت تبدیل به وزیکولی در زیر اسپورانژیوم میشود که به آن اسپورانژیولا میگویند. اسپورها از قسمت بالای ناحیه متورم شده درحالیکه قطعهای از ناحیه سر وزیکول به آنها متصل گشته بیرون آمده و به عبارت دیگر دارای زائده باقیماندهای از وزیکول میباشد. بعد از بوجود آمدن اسپور، از قسمت متورم زیر اسپورانژیوم و یا وزیکول (اسپورانژیولا) مایعی جریان پیدا میکند که درواقع اسپور را به جلو میراند و دور میکند و از ویژگیهای جنس بازیدیوبولوس است. ممکن است از کونیدیای خارج شده اولیه مجدداً اسپورهای ثانویه تولید گردند.
اپیدمیولوژی و انتقال کونیدیوبولوس کوروناتوس Conidiobolus coronatus
عفونتهای مربوط به کونیدیوبولوس کوروناتوس از بخشهای گرمسیری آفریقا (بهطور عمده از کامرون و نیجریه ولی همچنین از چاد، زئیر، کنیا، جمهوری آفریقای مرکزی، گینه) و آمریکا (کستاریکا، جزایر کارائیب، کلمبیا، برزیل) گزارش شده است. ارگانیسم قارچی در چوبهای پوسیده، خردههای گیاهی، بر روی حشرات و در مجاری گوارشی بزمجهها و غوکها وجود دارد. تغییر و تنوع فصلی برای حضور کونیدیوبولوس کوروناتوس در خاک وجود دارد، حداکثر حضور این قارچ در ماههای سپتامبر و اکتبر ثبت شده است که بیانگر تأثیر شرایط آب و هوائی در بقای اسپور است و ممکن است توضیحدهندهی توزیع جغرافیائی عفونتهای حاصله از این ارگانیسم نیز باشد.
عقیده بر این است که اسپور قارچ از طریق استنشاقی وارد بدن شده و سپس از طریق مخاط زخمی شدهی بینی تهاجم بافتی خود را آغاز میکند. نسبت ابتلای مذکر به مؤنث ۱۰ به یک است و بیماری در بین جوانان شیوع بیشتری دارد، عفونت در بین کودکان نادر است. فاکتور مستعدکنندهی شناختهشدهای برای عفونت وجود ندارد.
اپیدمیولوژی و انتقال کونیدیوبولوس اینکانگروس (C. incongruous)
تنها چند مورد از عفونت ناشی از این قارچ از ایالات متحده گزارش شده است.
دامنهی بیماریها
زایگومایکوزیس خود را بهصورت یک طیف وسیع از انواع بیماریهای کلینیکی نشان میدهد که این انواع بستگی به وضعیتهای زمینهای میزبان و راههای ورود قارچ به بدن دارند. بیماری میتواند به فرم حاد که یکی از رعدآساترین انواع عفونتهای قارچیِ شناخته شده است دیده شود. فرمهای منتشره یا فرم رینوسربرال در افراد نوتروپنیک، یا در افرادی که سیستم ایمنی آنها سرکوب میشود و یا در بیماران دیابتی میتواند سالها بهصورت مزمن باقی بماند.
چشماندازی از تهاجم عروقی زایگومیستها
زایگومایکوزیس
Espinel Ingroff و همکارانش در یک مرور بر روی 361 مورد زایگومایکوزیس، بیماریهای حاد و مزمن رینوسربرال را در 49% آنها نشان دادند. همچنین در 11% از آنها عفونتهای جلدی، در 11% عفونتهای دستگاه گوارش، در 11% زایگومایکوز ریوی، در 6% بیماری منتشره و در 9% عفونتهای متفرقه شناسایی گردید.
زایگومایکوزیس رینوسربرال حاد
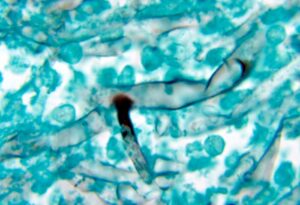
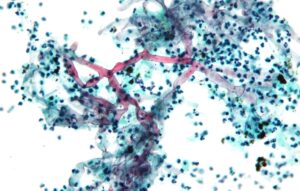
این عفونت در سطح جهان دیده میشود و برتریِ جنسی یا نژادیِ شناخته شدهای در شیوع و بروزِ آن وجود ندارد. عفونت از سطح مخاط بینی شروع میشود و به سمت کام، سینوسهای پارانازال، حدقه، صورت و مغز توسعه مییابد. علائم معمول زایگومایکوز رینوسربرال، همان علائم سینوزیت حاد باکتریال است که با تب و سردرد در نواحی پیشانی یا نواحی پشت حدقه چشم خود را نشان میدهد. ترشحات غلیظِ خونی یا چرکی که معمولاً از یکطرف بینی خارج میشود در ۵۰ درصد موارد وجود دارد. در این مرحله یک آزمایش مستقیم میکروسکپی از ترشحات بینی اغلب هایفیهای پهن و نامنظم قارچ را نشان میدهد که این مشاهدات تشخیص را تائید مینماید. (به تصویر زیر توجه فرمائید)
منظرهی هایفیهای فراخ و نامنظم زیگومیست
در صورت موفق بودن نتیجهی کشت، اغلب رایزوپوس آریزوس رشد خواهد کرد. درگیری ِ بعدی، بافتهای مجاور در همان سمت بینی مبتلا شده است. احساس درد در صورت و ادم در روزهای بعد و زخمی شدن پوست اطراف بینی دیده میشود. حالت اولسراسیون سیاهرنگ نکروتیک در قسمت میانی کام سخت قابلمشاهده خواهد بود. در آزمایش رادیولوژی ابتلاء فک فوقانی و سینوسهای اتموئید را با نمای ابری شده و سطح هوا-مایع خواهیم دید. گسترش عفونت به چشم شایع است و در صورت وقوع با پیشآگهی ضعیفی مواجه خواهیم بود. درد در ناحیهی حدقه، حالت دیپلوپی، افتالموپلژی، بیرونزدگی چشم (proptosis)، ادم پلک، التهاب ملتحمه و زخمی شدن قرنیه قابل مشاهده هستند. آزمایش ته چشم (فوندوسکوپیک) ممکن است یافتههای نرمالی را نشان دهد.
گشاد شدن سیاهرگهای شبکیه، انسداد شریان شبکیهای و حتی هایفی قارچ را درون مایع زجاجیه ممکن است بتوان دید. قارچ تمایل بیشتری به تهاجم به عروق خونی و اعصاب نسبت به عضلات دارد. این امر منجر به انفارکتوس در نواحی مورد تهاجم و انتشار به طرف مغز میگردد. توسعه عفونت از سینوسها به سمت مغز بستگی به موقعیت و توالی حوادث (تهاجم، ترومبوز، انفارکتوس بافت مغز) دارد. از دست دادن فعالیت اعصاب جمجمهای بهویژه در جفت سوم، پنجم و هفتم و کند شدن فعالیت مغزی ممکن است دیده شود. ترومبوز شریان کاروتید داخلی نیز همراه با همیپلژی (فلج یک طرف بدن) نیز دیده میشود.
اسکنهای CT و یا تصاویر MRI در مشخص کردن وسعت آسیب و عفونت کمککننده هستند و ممکن است راهنمای خوبی برای رزکسیون جراحی (درصورتیکه انجام آن ممکن باشد) باشند. جدا از سینوسهای آبنرمال، علائم استئومیلیت یا تخریب استخوان، لزیونهای تودهای، علائم انفارکتوس و انسداد را میتوان مشاهده کرد. آزمایش میکروسکپی و کشت از مایع مغزی نخاعی کمکی به تشخیص نمیکند. سستی و بیحالی (لتارژی)، تشنج و کوما از عوارض معمول گرفتاری مغزی هستند. وقوع مرگ در عرض یک تا ده روز در موارد درماننشده و یا مقاوم در برابر درمان بسیار شایع است.
از بین 108 مورد عفونت رینوسربرال که توسط بیکر (Baker) در سال 1971 مطالعه شده است تمام 44 نفری که در آنها علائم بیماری در ظرف کمتر از 14 روز ظاهر شدند فوت کردند و در مقایسه با آنها 11 نفر از 30 نفری که دورهی بیماری آنها طولانیتر بوده است (از 3 هفته الی 10 سال) دچار مرگ شده بودند. افرادی که وضعیت بهتری داشتند کسانی بودند که در آنها تهاجم به عروق خونیِ بزرگ صورت نگرفته و یا به گرفتاری مغزی دچار نشده بودند.
اسکار و نکروز ناحیه کام
شناخت و توجه به وقوع حوادثِ متوالی، مشاهدهی ادم صورتی یکطرفه (غیر قرینه)، مشکل ناگهانی تاری دید چشم، دیپلوپی، در یک فرد دیابتیک یا در یک بیمار نوتروپنیک و یا در یک بیمار تحت درمان با دفروکسامین و بالاخره در یک فرد دریافت کننده بافت پیوندی باید ما را هشیار سازد تا آزمایشات دقیقی را برای علائم اولیهی زایگومایکوز رینوسربرال انجام دهیم.
زایگومایکوز ریوی
در بیماران گرانولوسیتوپنیک عفونت میتواند اشتباهاً بهعنوان آسپرجیلوزیس تهاجمی تشخیص داده شود. بیماران دارای تب با منشاء ناشناخته هستند و ارتشاح ریوی در آنها نسبت به آنتیبیوتیکهای وسیعالطیف مقاوم و بدون پاسخ باقی میماند. عکس (رادیوگرافی) ریه غیراختصاصی است و برونکوپولمونری سریعاً پیشرونده را نشان میدهد.
حالت سفتشدگی (consolidation) قطعهای یا لوبی و علائم کاویتاسیون با تظاهرات هلال هوا
(air crescent sign) و بندرت پلورال افیوژن، عفونت آسپرجیلوسی را خاطرنشان میسازد. تشکیل توپ قارچی مشابه آسپرجیلوما میتواند دیده شود و به علت تهاجم عروقی و ترومبوز، هموپتیزی که بالقوه مرگبار است (بهویژه در بیمارانی که دچار ترومبوسیتوپنی هستند) ممکن است وجود داشته باشد. تهاجم به بافتهای مجاور، دیافراگم، فیستولها (برونکوآرتریال، برونکوپلورال، یا برونکوکوتانئوس) میتواند سیر عفونت را پیچیدهتر نمایند. تشخیص زایگومایکوز ریوی نیاز به درجه بالائی از شک و تردید و مدیریت بسیار قوی از جهت پیشآگهی ضعیفِ آن دارد.
اسکنِ CT میتواند وسعت عفونت را نشان داده و تحت راهنمایی آن بیوپسیهای استرئوتاکسیک یا آسپیراسیون سوزنی را میتوان انجام داد. لاواژ برونکوآلوئلار و بسته به وضعیت بیمار و شمارش پلاکت وی بیوپسیهای ترانس برونشیال یا brushing، یا بیوپسی از ریه با توراکوستومی یا توراکوتومی باید انجام گیرند.
درمانِ کافی بلافاصله باید شروع گردد که شامل درمان ضد قارچی، رزکسیون جراحی (در صورت امکان) و حفظ فونکسیون ایمنی بیمار است، در غیر این صورت بیماری بهسرعت به سمت مرگ پیش میرود. در بین 49 مورد زایگومایکوزیس که توسط بیکر (Baker) موردبررسی قرار گرفته تنها 3 مورد از آنها زنده ماندهاند و اکثر بیماران در طی ماه نخست بعد از شروع بیماری فوت کردهاند. زایگومایکوز ریوی میتواند بهعنوان بخشی از عفونت منتشره یا رینوسربرال دیده شود که در این صورت پیشآگهی بیماری بسیار وخیمتر خواهد بود.
عفونتهای منتشره
تظاهرات بالینی عفونت منتشره زایگومایکوز متنوع است و این تنوع انعکاسی از تهاجم قارچ به عروق و انفارکتوس بافتی در ارگانهای مختلف است. بیماری نادر است اما در افرادی اتفاق میافتد که سیستم ایمنی آنها یا در اثر کهولت سن تضعیف شده و یا توسط داروها سرکوب شده است و یا در بیمارانی که به بیماریهای زمینهای مبتلا هستند ممکن است دیده شود. اگرچه 11 مورد از 185 موردی که توسط Ingram و همکارانش گزارش شدهاند فاکتورهای خطر شناختهشدهای نداشتهاند. علائم ظاهری بیماری غیراختصاصی هستند بااینحال به گرفتاری سیستم نورولوژیک، یا دستگاه تنفس و یا دستگاه گوارشی اشاره میکنند.
در بین 113 موردی که مورد آنالیز قرار گرفتند 61% از آنها دارای تب، 45% دارای رالهای تنفسی یا صدای خسخس (rhonchi) و کمتر از 20% از آنها هپاتواسپلنومگالی، کوما و کنفوزیون و سایر علائم نورولوژیک (فلج یا بیحسی)، لزیونهای پوستی یا احساس کشش در ناحیه شکمی داشتهاند. تا قبل از مرگ بندرت تشخیص این عفونت موردتردید قرار گرفته است. تشخیص دقیق بستگی به آزمایش هیستولوژیک و کشت از بافتهای عفونیشده دارد. عامل اتیولوژیک بندرت بهصورت دقیق گزارش شده و اعضاء فامیلهای موکوراسه و کانینگهاملاسه غالباً از کشتها جدا میشوند.
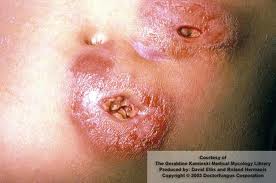
زایگومایکوز جلدی
عفونت پوست میتواند یک علامت از حضور عفونت منتشره باشد و از طریق کشت و آزمایش هیستولوژی بافتی میتوان به تشخیص دقیق دست یافت. لزیونهای پوستی ندولار هستند که ناحیه مرکزی اکیموتیک و ناحیه پیرامونی رنگپریده دارند. حواشی نکروز غالباً واضح و مشخص است و معمولاً اولسراسیون وجود ندارد. زایگومایکوز جلدی همچنین میتواند یک پروسهی لوکالیزه باشد که به دنبال یک جراحت تروماتیک پدید آمده است و یا در اثر البسهی آلودهی جراحی و یا کلونیزاسیون مربوط به اسکارهای سوختگی شدید و توسعهیافته رخ داده باشد. سیر تکامل پروسهی عفونی میتواند بهصورت مزمن طی شود مانند ظاهر شدن یک آبسه در ناحیه مغبنی که بعد از ۲ سال در مجاورت ناحیه اینسیزیون پیوند کلیه پدید آمده باشد.
لزیونها میتوانند آرام و کند باشند و تقریباً بهطور خودبهخودی بهبود یابند و یا به سمت بافت زیر جلد توسعهیافته و بهسرعت پیشرونده شوند. سفتی محیطی و تغییر شکل ضایعه نیز شایع است. گاهی رشد کپک را میتوان در حاشیهی زخم مشاهده کرد. تشخیص نیازمند کشت و آزمایش هیستولوژیک از مقاطع بافتی است تا تهاجم قارچ به بافت زنده را نشان دهد. آزمایش مستقیم و کشت از تراشههای سطحی ضایعه و یا نمونهبرداری با سواب اغلب نتایج منفی خواهد داد. پیودرما گانگرونوزوم اغلب یک یافتهی نادر است.
در یک مطالعه بر روی ۱۱۱ مورد زایگومایکوز جلدی، محلهای عفونت جلدی شامل سر و گردن (۱۴%)، ناحیه توراکس (۱۴%)، ناحیه پشت (۹%)، یک یا هر دو دست (۲۴%)، یک یا هر دو پا (۳۱%) بوده است. بالاترین نسبت مرگومیر (۳۲% در مقابل ۱۵%) مرتبط با عفونتهایی که در قسمتهای مرکزیتر بدن قرار داشتهاند بوده که احتمالاً به علت نزدیکی با ساختمانهای حیاتی و مشکلات بیشتر در دبریدمانهای مؤثر ضایعات مربوطه بوده است.
موکورومایکوز جلدی در بیمار مبتلا به ALL
این حقیقت که حدود نیمی از بیماران مبتلا به زایگومایکوز جلدی فاقد بیماری زمینهای شناخته شدهای بودهاند موجب نمیشود که پیشآگهی بیماری را بهبود ببخشد. میزان مرگومیر در این بیماران حتی بالاتر (۳۱%) از بیماران دیابتیک (۱۴%) و یا سایر بیماریهای مستعد کننده (۱۷%) بوده است. بااینحال پیشآگهی عفونتهای جلدی بهتر از سایر فرمهای کلینیکیِ زایگومایکوز است. در یک مطالعهی جدید از ۱۱۶ مورد زایگومایکوز میزان مرگومیر مرتبط با بیماری برای عفونتهای جلدی ۱۶% بوده و برای عفونتهای رینوسربرال ۶۷%، در مورد عفونتهای ریوی ۸۳% و در مورد عفونتهای منتشره یا عفونتهای دستگاه گوارشی برابر ۱۰۰% بوده است.
عفونت دستگاه گوارش
Ingram و همکاران در مطالعه بر روی 185 مورد زایگومایکوز منتشره 16 مورد را با ابتلاء گوارشی شرح دادند که در آنها عفونت در ابتدا از طریق دستگاه گوارش شروع شده، بدین معنی که از طریق روده یا عفونت کبدی بیماری منتشر شده بود. یک مورد پریتونیت مرتبط با تهاجم قارچ به دیواره ایلئوم در یک بیمار که بهطور مستمر تحت دیالیز صفاقی قرار داشته گزارش گردیده است. علائم بیماری متنوع است و به وسعت لوکالیزاسیون عفونت بستگی دارد. مشکلات و شکایات غیراختصاصی شکمی، اسهال، مدفوع خونی و هماتمز میتوانند جزو سوابق بیمار باشند. ابتلای ارگانهای مجاور ممکن است و پیامد بیماری بستگی به وسعت آسیب عروقی دارد. عفونت گاستریک را میتوان بهآسانی از طریق گاستروسکپی و بیوپسی از لزیونهای زخمی شده که هایفیهای فراخ و نامنظمی را نشان میدهد آشکار ساخت. معمولاً به علت خونریزی حجیم یا پرفوراسیون، مرگ شایع است.
سایر عفونتها
هر بافتی ممکن است دچار عفونت شود خواه این درگیری در اثر مجاورت با بافت عفونی باشد و یا در اثر انتشار خونی حاصل شود. باید توجه ویژهای به عفونتهای کلیه، استئومیلیت، ضایعات جلدی مفصلی و عفونتهای قلبی در بیماران و یا بیماران ایدزی داشت. عفونتهای رنال در افراد سالم نادر است. اخیراً دو مورد شرح داده شده که یکی از آنها توسط آپوفیزومایسس الگنس ایجاد شده که علیرغم نفروکتومی و درمان با آمفوتریسین B پیامد مرگ را به دنبال داشته است. استئومیلیت عمدتاً از طریق عفونت بافت مجاور شرح داده میشود اما همچنین میتواند متعاقب تلقیح خونی یا از طریق آلودگی مستقیم بعد از یک جراحت خراش دهنده واقع شود.
آرتریت ناشی از کانینگهاملا برتولشیا در یک بیمار مبتلا به ایدز متعاقب ضربه و کوفتگی ناحیهی ران شرح داده شده است، بیمار بعد از 15 روز بستری در بیمارستان به علت خونریزی زیاد ناشی از پرفوراسیون شریان فمورال علیرغم دبریدمان آبسه و درمان با آمفوتریسین B فوت کرده است. عفونت سیستم اعصاب مرکزی محدود به توسعهی عفونتهای بینی یا سینوسهای پارانازال نیست، به نظر میرسد که در معتادان تزریقی لزیونهای گانگلیای بازال متعاقب تلقیح درون رگی قارچ رخ میدهد.
عفونتهای مربوط به انتموفتورالها”
اکثر گونههای مربوط به این دسته از قارچها برای حشرات بیماریزا هستند
سه گونه در ارتباط با بیماریهای انسانی شناخته شدهاند: بازیدیوبولوس راناروم، کونیدیوبولوس کوروناتوس و کونیدیوبولوس اینکانگروس.
عفونتها همچنین بهعنوان بازیدیوبولومایکوزیس و کونیدیوبولومایکوزیس موسوم هستند. برخلاف قارچهای موکوراسئوس، در اینجا وضعیت کلینیکی مزمن است و اغلب کند و آرام میباشند و این عفونتها تهدیدکنندهی حیات نیستند مگر در مواردی که با عفونتهای منتشره در اثر آنها مواجه شویم. اشکال هیستولوزیک آنها نیز شبیه یکدیگر است اما نماهای بالینی متفاوت میباشند.
عفونتهای ناشی از بازیدیوبولوس راناروم
فرم بالینی که دیده میشود یک تودهی زیرجلدی منفرد، بدون درد، یکطرفه و با حدود مشخص است که معمولاً قسمت باسن یا ران را مبتلا میکند، اما میتواند در سایر نواحی مانند بازو، گردن، صورت، یا در تنه دیده شود. بیماری بهصورت یک ندول منفرد شروع میشود که بهطور پیشرونده رشد میکند. تورم اغلب به حالت سخت شبیه چوب مشاهده میشود. لزیونهای توسعهیافته میتوانند دردناک باشند، بهویژه هنگامیکه نواحی پرینه یا اطراف رکتال را گرفتار کرده باشند. رنگ و نمای ظاهری پوست نرمال و یا اریتماتوس است. هیچگونه اولسراسیون وجود ندارد و توده به قسمتهای عمقیتر نچسبیده هرچند که ابتلای عضلات نیز شرح داده شده است.
گاهی اوقات بزرگ شدن غدد لنفاویِ محلی دیده میشود، کشت از نمونههای بیوپسی که از این محلها تهیه شده، قارچ را نشان میدهد. فقدان سینوسهای تخلیهکننده چرک و ترشحات، غیاب حالت چسبندگی به ساختمانهای مجاور و زیرین و فقدان توسعهی عفونت به سمت استخوان بهراحتی موجب تشخیص افتراقی از مایستوما میگردد. عفونت دستگاه گوارش یک لوکالیزاسیون غیرمعمول است.
عفونتهای ناشی از کونیدیوبولوس کوروناتوس
عفونت از مخاط بینی شروع میشود و بهصورت پیشرونده به نواحی مجاور دوطرفه شامل بینی، گونهها، لب فوقانی، بافتهای پارانازال و حلق توسعه مییابد. ادم نواحی عفونیشده را تحتتأثیر قرار میدهد و موجب بدشکلی قابلتوجه در چهره میشود. علاوه بر تغییرات آشکار در ظاهر، بیمار ممکن است از انسداد بینی، ترشحات بینی و خونریزی از بینی شکایت داشته باشد. تهاجم به فارنکس ممکن است موجب دیسفاژی شود. لزیون معمولاً استخوانها را درگیر نمیکند اما انسداد سینوسهای اتموئید ماگزیلری میتواند سینوزیت باکتریال و درد ایجاد کند. تهاجم عقدههای لنفاوی لوکال شرح داده شده است.
سیر تکمیل عفونت آهسته است و در طول سالها انجام میگیرد. تمایلی برای اینکه این توده به حالت زخمی تبدیل شود و یا زگیلی شکل شود وجود ندارد، هرچند که اولسراسیون کام نرم توضیح داده شده و نیازمند جراحی است. توده معمولاً به داخل درم لنگر میاندازد. معمولاً تب وجود ندارد و علائم بیولوژیک عفونت دیده نمیشود. شمارش سلولهای خونی و آزمایشهای بیوشیمی نرمال هستند. تشخیص بهوسیله کشت و آزمایش هیستولوژیک بافتهای بیوپسی شده انجام میگیرد. انتشار عفونت نادر است. در یک مورد انتشار عفونت در یک بیمار ۶۴ ساله گیرنده پیوند کلیه اتفاق افتاد که در اثر حضور ضایعات در ریهها، قلب، مغز و کلیهها فوت کرد.
کونیدیوبولوس کوروناتوس
عفونتهای ناشی از کونیدیوبولوس اینکانگروس
سه مورد عفونت مربوط به کونیدیوبولوس اینکانگروس شرح داده شده که یک مورد از آن در یک بیمار با نقص ایمنی رخ داده است. در این بیمار عفونت اولیه ریوی بعد از گسترش به پریکارد و قلب بهسرعت موجب مرگ شده است. دو مورد دیگر در یک پسربچه 15 ماهه و در یک زن 20 ساله روی داده که هیچگونه بیماری زمینهای نداشتهاند. عفونتی که در زن 20 ساله رخ داد در ابتدا موجب درگیرکردن ریهها شد و بعد انتشار به بافتهای مجاور و سرانجام به علت هموپتیزی شدید موجب مرگ گردید. پسربچه بعد از رزکسیون جراحی و درمان دوماهه با آمفوتریسین B بالاخره زنده ماند.
اگر ارگانیسم کشت شود بهآسانی زایگومایکوز مربوط به قارچهای موکوراسئوس تشخیص داده میشود، هرچند که در مقاطع بافتشناسی برخی واکنشهای مشخص بافتی نظیر واکنش اسپلندور- هوپلی (رسوب مواد ائوزینوفیلیک در اطراف هایفی قارچ) را میتوان مشاهده نمود.
پدیده اسپلندور – هوپلی در اطراف هایفیهای بدون دیواره عرضی و پهن مربوط به انتموفتورالها
غلاف ائوزینوفیلیک در اطراف هایفی بهخوبی مشاهده میشود
درمان و پیشگیری
درمان زایگومایکوز حاد نباید به تأخیر افتد. پیشآگهی ضعیف مربوط به این دسته از عفونتها درمان تهاجمی که شامل رزکسیون جراحی، توأم با درمان ضد قارچی و کنترل فاکتورهای مساعدکننده بهویژه اسیدوز است را ایجاب میکند. در مورد عفونتهای مزمن درمان معمولاً بر اساس استفاده از داروهای ضدقارچی به تنهائی صورت میگیرد. درصورتیکه نیاز به جراحی پلاستیک باشد تا زمانی که عفونت کاملاً رفع نشده باید به تأخیر افتد.
درمان زایگومایکوز حاد
بهترین شکل اداره چنین بیمارانی شامل درمان جراحی تهاجمی در ترکیب با استفاده از دارودرمانی با آمفوتریسین B و در صورت امکان کنترل فاکتورهای زمینهای است. میزان بقاء 85% در مواقعی گزارش میشود که بیماران بهسرعت و بهموقع با ترکیبی از جراحیهای مکرر و آمفوتریسین B درمان شده باشند. فاکتور کلیدی برای پیشآگهی بهتر در این دسته از عفونتها تشخیص بهموقع و سریع و درمان تهاجمی است که ارتباط عالی مابین پزشک، جراح، پاتولوژیست و مایکولوژیست را میطلبد.
جراحی
اسکنهای CT و یا MRI ممکن است کمک کنند که تا چه وسعت و میزانی از بافت برداشته شود و همچنین تأثیر و کارایی درمان را پایش کنند. جراحی میتواند شامل رزکسیون بافتهای دچار انفارکتوس، دبریدمان وسیع یا درناژ مناسب سینوسها شود. دبریدمان ممکن است بهصورت روزانه برای چند روز تکرار شود. در مواقعی که محلهای درگیری عفونت برای دبریدمان جراحی در دسترس نیستند اغلب مرگ اتفاق میافتد. در موارد نادری عفونتهای لوکالیزه شده که زود تشخیص داده شدهاند بهوسیله جراحی به تنهائی قابل درمان هستند. درصورتیکه محلهای دیگری از عفونت وجود داشته باشند استفاده از آمفوتریسین B عاقلانه خواهد بود.
درمان ضدقارچی
اطلاعات مربوط به حساسیت نسبت به داروهای ضدقارچی در قارچهای موکوراسئوس محدود است. روشهای تست ضدقارچی برای قارچهای کپکی به آن صورت استاندارد شده نیستند. ارتباط و همبستگی بین نتایج تستها در شرایط آزمایشگاهی با پیامدهای کلینیکال در مورد ایزولههای مسئول عفونتهای مهاجم هنوز بحثبرانگیز هستند. فعالیت داروهای ضد قارچی علیه عوامل زایگومایکوز در شرایط آزمایشگاهی نمیتواند بهوسیله پزشکان بهراحتی مورداستفاده قرار گیرد و باید از دوزاژ مناسب و جراحی وسیع بهرهگیری نمایند. در حقیقت علیرغم غلظتهای پائین مربوط به حداقل دوز مهارکننده (MIC) که در برخی موارد ثبت شده است، آمفوتریسین B ممکن است در فرآیند درمان عفونت مؤثر نباشد و حساسیت به این دارو در شرایط آزمایشگاهی لزوماً با درمان موفقیتآمیز همبستگی نداشته باشد. فلوسیتوزین علیه این رده از قارچها تأثیری ندارد و تجویز نمیشود.
ایتراکونازول فعالیت اندکی علیه زیگومیستها دارد و تنها 23 درصد از 30 ایزوله که با این دارو تست شدند با مقدار1µ/ml از این دارو مهار شدند و 73 درصد دیگر با دوز 10µ/ml مهار گردیدند؛ بنابراین علیرغم این مسئله که داروهای ضدقارچی جدید در حال حاضر در دسترس قرار گرفتهاند اما همچنان آمفوتریسین B یک داروی انتخابی برای درمان زایگومایکوز حاد میباشد. آمفوتریسین B معمولاً در دوزهای بالا یعنی معادل 1.5mg/kg/d تجویز میشود. هنگامیکه بیمار به وضعیت پایدار رسید از دوزهای پاییـــــــــنتر یعنی معادل 1-0/8 mg/kg/d استفاده میشود و درمان از حالت روزانه بهصورت روز در میان میتواند جایگزین شود.
مقدار دقیق طول درمان و دوز کلی موردنیاز از دارو تعریف نشده است. یک درمان مطلوب معمولاً به حداقل 8 تا 10 هفته نیاز دارد یعنی تا زمانی که تب، علائم و شواهد عفونت از بین رفته باشند. دوز کلی دارو 2 تا 4 گرم است. تصور میشود که اضافه کردن ریفامپین فعالیت ضدقارچی آمفوتریسین B را افزایش میدهد اما کارایی آن در شرایط داخل بدن نیاز به اثبات دارد. در بیمارانی که داروی معمولی آمفوتریسین B پاسخ نمیدهد تنها جایگزین آن فرمولاسیونهای لیپیدی آمفوتریسین B هستند، هرچند که هنوز دادههای کمی در این خصوص در دسترس هستند. 3 مورد از 5 بیمار مبتلا به زایگومایکوز بینی مغزی بهصورت موفقیتآمیزی با فرمولاسیون لیپیدی آمفوتریسین B با دوزهای بین 1 تا 3 میلیگرم به ازای هر کیلو وزن بدن در روز ( 3/5-1 mg/kg/d) و به مدت 3 تا 35 هفته درمان شدند.
روشهای تکمیلی
کنترل اسیدوز یا وضعیت هایپرگلیسمی در یک بیمار دیابتیک سهم مهمی در بهبود عفونت دارد. در بیمارانی که تحت درمان با کورتیکوستروئیدها هستند قطع مصرف دارو و یا حداقل اقدام به کاهش دوز دارو توصیه شده است. تعداد گرانولوسیتهای خون باید به مقادیر نرمال برسد که یا بهصورت خودبخودی و یا بعد از تزریق فاکتورهای رشد هماتوپوئتیک از قبیل G-CSF و یا GM-CSF صورت میگیرد که در این صورت به کنترل عفونت کمک میکند. در تمام بیماران مبتلا به بدخیمیهای هماتولوژیک بدون القاء بهبودی، معالجه عفونت قارچی حاصل نمیشود. روشهای دیگری شامل تجویز اینترفرون گاما و اکسیژن پرفشار مطرح شدهاند، البته شواهدی مبنی بر اینکه اکسیژن پرفشار در کنترل عفونت اثر مفیدی داشته باشد وجود ندارد.
پیشگیری از زایگومایکوز حاد
زایگومایکوز میتواند در بیمارانی که تحت درمان تجربی با آمفوتریسین B هستند ایجاد شود و تا این زمان هیچگونه روش ثابتشده و مؤثری برای جلوگیری از وقوع زایگومایکوز حاد وجود ندارد؛ بنابراین روشهای استاندارد پیشگیری باید بکار گرفته شوند مانند محدود کردن منابع آلودگی در محیط بیماران در معرض خطر نظیر آنچه در مورد آسپرجیلوس توصیه شده و یا بکار برده میشوند (کنترل دستگاههای تصفیه هوا، اجتناب از عملیات ساختمانی اعم از نوسازی یا بازسازی در نزدیکی واحدهای هماتولوژی یا پیوند ارگان). کنترل و پایش دقیق بیماران دیابتی و استفاده مناسب از کورتیکوستروئیدها و دسفروکسامین نیز میتوانند موجب محدود کردن تعداد وقایع عفونی شوند و در نهایت آموزش و تربیت بهتر پزشکان و میکروبیولوژیستها موجب جلوگیری از تأخیرهای دراماتیک در تشخیص و درمان چنین عفونتهایی میگردد.
درمان زایگومایکوز مزمن
جراحی
رزکسیون جراحی به تنهائی برای کنترل عفونتهای ایجاد شده در اثر بازیدیوبولوس یا کونیدیوبولوس مؤثر نیست. جراحی پلاستیک بعد از دوران طولانی درمان با داروهای ضدقارچی و استرلیزاسیون ضایعه در نظر گرفته میشود.
درمان ضدقارچی
به دلیل شیوع کم اینگونه عفونتها برای قارچهای انتموفتوراسئوس درمان بهخوبی تعریف نشده است. دوزاژ دارو، طول مدت درمان و حتی بهترین داروی ضدقارچی که بتوان انتخاب کرد مشخص نیست. روش درمانی استاندارد با یدید پتاسیم (30mg/kg/d) از مدتها قبل روشی انتخابی برای عفونتهای مزمن قارچهای بازیدیوبولوس و کونیدیوبولوس بوده است. از زمان کشف آزولها بهبودی نسبی در وضعیت بیماران پدید آمده است، کتوکونازول یا ایتراکونازول موجبات معالجه کامل را فراهم نکردند و کارایی فلوکونازول نیز از معالجه کامل تا بهبودی نسبی و تا نقص درمان متفاوت است. آمفوتریسین B بندرت برای عفونتهای مزمن تجویز میشود.
در موارد نادر عفونتهای منتشره که بهوسیله کونیدیوبولوس اینکانگروس ایجاد میشوند روش درمانی احتمالاً مشابه راهکاری است که برای قارچهای موکوراسئوس در نظر گرفته میشود. اگرچه فقط یکی از 3 بیمار در یک مطالعه با آمفوتریسین B و جراحی معالجه شده و زنده ماندند، در یکی از این موارد مهلک قارچ در شرایط آزمایشگاهی نسبت به آمفوتریسین B و فلوسیتوزین مقاومت نشان داده بود، اگرچه کونیدیوبولوس و بازیدیوبولوس معمولاً نسبت به این دارو حساس هستند.
منابع:
- قارچشناسی پزشکی جامع، تألیف دکتر فریده زینی، دکتر امیرسیدعلی مهبد، دکتر مسعود امامی، انتشارات دانشگاه تهران، چاپ دوم، 1383
- Clinical Mycology, Elias J. Anaissie, CHURCHILL LIVINGSTONE, 2009
- Topley & Wilson’s Microbiology and Microbial Infections, Vol 4 : Medical Mycology, 9th ed. ARNOLD, 1998
- Anaissie E J. Clinical Mycology, 2003 churchill livingstone
نتایج آزمایشهای قارچ شناسی را چگونه گزارش کنیم؟
https://emedicine.medscape.com/article/222551-overview
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام