مروری بر توکسوکاریازیس
قسمت اول
نگار اسدی1، دکتر شهرام خادم وطن 2
1- کارشناس ارشد انگلشناسی دانشگاه علوم پزشکی ارومیه
2- دانشیار انگلشناسی دانشگاه علوم پزشکی ارومیه
مقدمه:
توکسوکاریازیس انسانی، عفونت انگلی مشترک میان انسان و حیوان با انتشار جهانی است. توکسوکاراها در سلسله حیوانات، شاخه نماتودا، راسته آسکاریدیدا و خانواده توکسوکاریدا قرار میگیرند. عوامل سببی توکسوکاریازیس، توکسوکارا کنیس و توکسوکارا کتی، از شاخه نماتودها هستند که به ترتیب در سگها و گربهها یافت میشوند [1]. امروزه سگها و گربهها مهمترین حیواناتی در سطح جهان هستند که در محیط و حتی داخل خانههای انسانها زندگی میکنند و در صورتی که عفونت از طریق این حیوانات به انسان منتقل شود نشانههای کلینیکی آن از حالات بیعلامت تا موارد لوکالیزه (موارد چشمی و عصبی) و نیز موارد سیستمیک (لاروهای مهاجر احشایی) متفاوت خواهد بود. بیماری در بین سگها و گربههای سراسر جهان انتشار وسیعی دارد و موارد کشفنشده عفونتهای انسانی ناشی از لارو این کرمها احتمالاً بهمراتب بیش از موارد گزارششده از کشورهای مختلف است [2].
تاریخچه توکسوکارا:
گونههای جنس توکسوکارا متعلق به شاخه کرمهای گرد موسوم به نماتودها هستند. در سال 1782، ورنر، کرم گردی را در سگ شرح داد و آن را آسکاریس کنیس نامید. بعدها جانسون متوجه شد که آنچه را که ورنر، آسکاریس کنیس نامیده است، درواقع عضوی از جنس توکسوکارا است که در سال 1905 توسط استیلز شرح داده شده است. فولبرون حدس زد که لاروهای توکسوکارا میتوانند باعث ایجاد ندولهای گرانولوماتوز در انسان شوند. در سال 1947 پرلینگیرو و گیورگی موردی را در یک پسربچه دوساله در فلوریدا که علائم کلاسیک گرانولومای ائوزینوفیلیک نکروزه داشت، شرح دادند و این احتمالاً اولین مورد بیماری توکسوکاریازیس انسانی بوده است. کمپل ویلدر اولین شخصی بود که در سال 1950 توکسوکاریازیس در انسانها را شرح داد. در مقالهای که او منتشر کرد وجود گرانولومای چشمی در افراد دارای بیماری اندوفتالمیتیس و Coat’s disease شرح داده شد. دو سال بعد، بیور، وجود لارو توکسوکارا در گرانولومهای خارجشده از مواردی مشابه بیماران کمپل ویلدر را شرح داد [3].
چرخه زندگی:
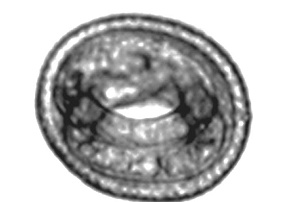
تخمها هنگام دفع در مدفوع نارس بوده و تحت شرایط مطلوب محیطی لاروهای مرحله سوم درون تخم تشکیل میشوند. میزبانهای طبیعی نظیر سگها معمولاً قبل از تولد، آلودگی را از مادرانی که تخم عفونی (شکل 1) حاوی لارو مرحله دوم را دارند، دریافت میکنند. لاروهای بیرونآمده از تخم به دیواره روده نفوذ کرده و شروع به مهاجرت در بافتهای احشایی نظیر ریهها، کبد و کلیهها کرده (شکل 2) و در مادههای آبستن با عبور از جفت سبب آلودگی جنین، قبل از تولد میشوند. همچنین، تولهسگها یا بچهگربهها ممکن است با خوردن لاروها به همراه شیر یا بهوسیله خوردن تخمها، آلوده شوند که یک نوع مهاجرت ریوی شبیه آسکاریس صورت میگیرد. مادههای بالغ پس از گذشت 5-4 هفته از شروع عفونت، در ایلئوم تخم تولید میکنند که با مدفوع دفع میشوند. موش و جوجه با خوردن تخمهای عفونی، بهعنوان میزبان پاراتنیک عمل میکنند و لاروهای مرحله دوم به بافتهای مختلف حمله میکنند. توسعه بیشتر این لاروها زمانی اتفاق میافتد که میزبانهای پاراتنیک توسط میزبانهای قطعی خورده شوند. انسان با خوردن تصادفی تخمها آلوده میشود. لارو مرحله دوم در روده از تخم خارج شده و با عبور از دیواره روده، مهاجرت احشایی خود را آغاز میکند، ولی توسعه بیشتر انجام نمیگیرد.
شکل 1: تخم توکسوکارا کنیس
شکل 2: لارو توکسوکارا کنیس در بافت کبد موش آزمایشگاهی آلوده
بیماریزایی:
درجه و زمان بروز واکنش بستگی به میزان دوز عفونت دارد. در مطالعات تجربی حضور این لاروها در مغز چشمگیر بوده است. علائم بارز عفونت لاروهای مهاجر احشایی شامل تب، علائم ریوی [4]، بزرگی کبد [5] و ائوزینوفیلی است. میزان و شدت آسیبها معمولاً وابسته به تعداد لاروهای واردشده و مکان نهایی استقرار آنها است. در مبتلایان عوارض عصبی مختلفی گزارش شده است و در مواقعی که تعداد لارو در مغز زیاد باشد مرگ میزبانان را به همراه خواهد داشت (شکل 3). بسیاری از موارد عفونت نیز به دلیل زودگذر بودن علائم تشخیص داده نشده و یا به اشتباه تشخیص داده میشوند. بیشترین مکان تهاجم لاروها در بدن، کبد است، اما هیچ بافتی از تهاجم آنها نمیتواند مصون باشد. حضور لاروها در چشم باعث ایجاد التهاب حفره داخلی چشم و یا شبکیه میشود و یا باعث آسیب گرانولوماتوزی چشم میگردد. این آسیبها میتواند منجر به کوری چشم گردند. بروز ضایعات و آسیبهای ناشی از لاروهای مهاجر احشایی از ریه، کبد، کلیه، ماهیچهها و بافتهای عصبی [6] گزارش شده است. آسیبهای چشمی معمولاً بهواسطه تهاجم تنها یک لارو ایجاد میشود. بیماری چشمی ناشی از لارو توکسوکارا به نام التهاب داخل چشم نماتودی (Ocular Larva Migrans) نامیده میشود [7].
شکل 3: لارو توکسوکارا کنیس در بافت مغز موش آزمایشگاهی آلوده
نشانههای بالینی لارو مهاجر احشايي
لارو مهاجر احشايي (Visceral larva migrans) که اولین بار توسط بيور (Beaver) و همکاران در سال 1952 توصيف شد، با ائوزينوفيلي پايدار، لکوسيتوز، تب، هپاتومگالي و پيکا (خاکخوری) مشخص ميشود [8]. این لاروها عمدتاً در بین کودکان 5 ساله دیده میشود [9].
بيماران ممکن است با طيف گستردهاي از تظاهرات مراجعه کنند، چرا که لارو ميتواند از طريق خون به اغلب اعضاي بدن منتقل شود. ارتشاح کبد منجر به هپاتومگالي ميشود. تظاهرات ريوي شامل برونشيوليت حاد، آسم و پنوموني است و تقریباً نيمي از بيماران داراي علائم ريوي، در راديوگرافي قفسه سينه شواهد ارتشاح ريوي دارند [10]. ميوکارديت [11] و درگيري دستگاه عصبي مرکزي نيز گزارش شدهاند. تظاهرات عصبي شامل تشنج، مننگوانسفاليت و اختلالات رفتاري است. بررسي اتوپسي بيماران مبتلا به توکسوکارياز عصبي، گرانولومهاي متعدد متشکل از لارو را در دستگاه عصبي مرکزي نشان ميدهد. معمولاً ائوزینوفیلی را بهعنوان یکی از ویژگیهای قابلمشاهده در آلودگی با کرمهای انگلی در نظر میگیرند و این مسئله در مورد توکسوکاراها بهعنوان یک ویژگی غالب جلبتوجه میکند، ولی با این حال بهنظر میرسد که انگل از مقاومت بالایی در تقابل با این سلول دفاعی برخوردار باشد. برای تأیید این مطلب، بیان اینترلوکین-5 در موشها افزایش داده شد و به تبع آن تعداد ائوزینوفیلهای خون محیطی افزایش یافت که در نتیجه این افزایش، کرم نکاتور برازیلینسیس از بدن موش حذف گردید، در حالی که بر تعداد لاروهای توکسوکارا کنیس بیتأثیر بود. نکته جالبتوجه این بود که زمانی که موشهای مذکور توسط نکاتور برازیلینسیس به همراه آنتیژنهای دفعی ترشحی لاروهای توکسوکارا کنیس آلوده شدند، زمان زنده ماندن نکاتور به میزان زیادی افزایش یافت. از سوی دیگر در موشهایی که نقص در تولید IL-5 داشتند، تغییری در زمان بقای لارو مشاهده نشد، در حالی که آسیب ریوی در مقایسه با گروه کنترل که از میزان کافی IL-5 برخوردار بودند، کاهش یافته بود [12].
نشانههای بالینی لارو مهاجر چشمی ocular larva migrans (OLM):
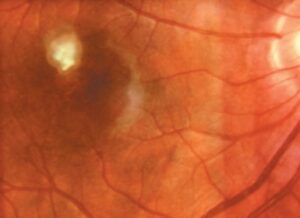
لارو مهاجر چشمی معمولاً در کودکان 5 تا 10 ساله اتفاق میافتد و افزایش مقدار ایمونوگلوبولینها را در خون ندارد. این بیماران اغلب شواهدی از نشانههای عمومی عفونت نشان نمیدهند و تنها یک چشم آنها گرفتار است. نشانههای چشمی اغلب به شکل اختلال در بینایی و استرابیسم (ناشی از گرفتاری ماکولا و از بین رفتن دید مرکزی) است [13]. لاروها اندوفتالمی و گرانولوماتوز مزمن یکطرفه یا Retinitis (التهاب شبکیه) ایجاد میکنند [14]. گرانولومای موجود سبب انحراف یا حتی جدا شدن شبکیه میشود و کوری شایع است. ممکن است Papillitis (التهاب نقطه کور شبکیه) وجود داشته باشد که منجر به Glaucoma (آبمروارید) میشود (شکل 3). این خطر وجود دارد که ضایعه موجود با رتینوبلاستوما اشتباه شده و چشم طی عمل جراحی تخلیه شود. با وجود این، ضایعات چشمی در توکسوکاریازیس مهم بوده و همیشه یکطرفه است [15].
شکل 4: بخشی از شبکیه کودک مبتلا به OLM
تشخیص:
ظن بر وجود بیماری لارو مهاجر احشایی در انسان در ابتدا بر اساس نشانههای بالینی و نیز برخی آزمایشهای روزمره مطرح میشود. بالا بودن تعداد ائوزینوفیلها در خون محیطی (بیش از 30 درصد)، همراه با بزرگی کبد و نشانههای غیراختصاصی ریوی در کودکی که با حیوانات خانگی تماس نزدیک داشته و یا سابقه خاکخواری داشته است، شواهد تشخیصی مطمئنی بهحساب میآیند. آنمی فقر آهن در نیمی از موارد و نیز افزایش نسبی میزان ایمنوگلوبولینهای IgG، IgM و IgE مشاهده میشود [16]، از طرفی شاهد افزایش در میزان آنتیبادیهای IgG علیه گروههای خونی A و B هستیم و شیوع آنمی همولیتیک در نوزاد زنان دارای عفونت توکسوکارایی میتواند بالاتر باشد. تستهای کبدی معمولاً طبیعی هستند. رادیوگرافی ریه معمولاً طبیعی است، ولی میتواند حاوی تغییراتی مشابه آسم باشد. از آنجایی که لارو توکسوکارا در بدن انسان به بلوغ نمیرسد، لذا بررسی مدفوع در تشخیص توکسوکاریازیس فاقد ارزش است. بیوپسی از کبد میتواند برای تشخیص مورد استفاده قرار گیرد، ولی با در نظر گرفتن تهاجمی بودن این روش و نیز احتمال پایین بودن بار بیماری که شانس تشخیص توسط بیوپسی را پایین میآورد، این روش نیز معمولاً در تشخیص کاربرد ندارد. از روشهای دیگر میتوان به واکنش زنجیرهای پلیمراز، سیتیاسکن و سونوگرافی اشاره کرد. بهترین روش قابل انجام در اکثر مواقع روشهای ایمنولوژیکی است که عموماً از واکنشهای آنتیژن و آنتیبادی استفاده میکند. روشهایی نظیر هماگلوتیناسیون، فلوکولاسیون و فیکساسیون کمپلمان برای تشخیص بیماری بهکار رفتهاند، ولی حساسیت و ویژگی بالایی ندارند. از تکنیک وسترن بلات نیز میتوان بهره برد، ولی به دلیل هزینههای بالا کاربرد روزمره ندارد. امروزه کیتهای تجاری با روش الایزا که از آنتیژنهای دفعی ترشحی لارو مرحله دوم در جهت تشخیص آنتیبادی علیه این انگلها استفاده میکنند به علت سهولت روش کار و قیمت مناسبتر، کاربرد فراوانی دارند و از حساسیت و ویژگی قابل قبولی نیز برخوردار هستند. برای به دست آوردن این آنتیژنها از کشت لاروهای مرحله دوم توکسوکارا کنیس استفاده میشود که روشی بسیار مطمئن برای به دست آوردن لاروها است، چرا که هر لارو روزانه مقدار قابلتوجهی از این آنتیژن (بر اساس میزان پروتئین تا 200 pg/Day) را در محیط آزاد میکند. با این حال در کشورهایی که آلودگی با سایر کرمهای منتقله از راه خاک بهصورت بومی مطرح است، در مورد حساسیت و ویژگی کافی این روشها تردید وجود دارد و احتمال واکنشهای متقاطع بسیار زیاد است [17].
درمان:
آلبندازول درمان انتخابی توکسوکاریوزیس است. بیماران در دوره 5 روزه آلبندازول را دریافت میکنند [18]. دوز 400 میلیگرم آلبندازول دوبار در روز به مدت 5 روز در حال حاضر برای درمان توصیه میشود [7]. تیابندازول در درمان عفونت ناشی از تهاجم لاروها مؤثر بوده و اثرات ضدالتهاب و ضددرد نیز دارد. دوز دارو در گزارشهای مختلف بین 25 تا 50 میلیگرم کیلوگرم وزن بدن/ روزانه برای مدت 5 تا 10 روز بوده است. پس از چهار هفته میتوان یک دوره درمان مجدد را شروع کرد. در مجموع، مطالعات بیشتری لازم است تا انتخابی بودن این دارو بهعنوان درمان سندروم لارو مهاجر احشایی تأیید شود. چنانچه در بیماران نشانههایی از گرفتاری میوکارد یا اختلالات تنفسی وجود داشته باشد و یا در صورت درمان نشانههای بالینی تشدید شود، مصرف کورتیکواستروئیدها، برای سرکوب تظاهرات شدیدآلرژی عفونت ضروری است. OLM با جراحی (ویترکتومی)، شیمیدرمانی انترولمینتیک یا کورتیکواستروئیدها درمان میشود [7, 14-13].
منابع:
1. Romero Núñez, C., et al., Prevalence and risk factors associated with Toxocara canis infection in children. The Scientific World Journal, 2013. 2013.
2. Kwon, N.-H., et al., The prevalence and diagnostic value of toxocariasis in unknown eosinophilia. Annals of hematology, 2006. 85(4): p. 233-238.
3. Beaver, P., et al., Chronic eosinophilia due to visceral larva migrans: report of three cases. Pediatrics, 1952. 9(1): p. 7-19.
4. Kuziemski, K., et al., Lung manifestation of visceral larva migration syndrome due to Toxocara canis infection. Pneumonologia i alergologia polska, 1999. 67(11-12): p. 554-557.
5. Hartleb, M. and K. Januszewski, Severe hepatic involvement in visceral larva migrans. European journal of gastroenterology & hepatology, 2001. 13(10): p. 1245-1249.
6. Magnaval, J.-F., et al., Human Toxocara infection of the central nervous system and neurological disorders: a case-control study. Parasitology, 1997. 115(5): p. 537-543.
7. Despommier, D., Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clinical microbiology reviews, 2003. 16(2): p. 265-272.
8. Rayes, A.A., et al., Human toxocariasis and pyogenic liver abscess: a possible association. The American journal of gastroenterology, 2001. 96(2): p. 563-566.
9. Worley, G., et al., Toxocara canis infection: clinical and epidemiological associations with seropositivity in kindergarten children. Journal of Infectious Diseases, 1984. 149(4): p. 591-597.
10. Arango, C.A., Visceral larva migrans and the hypereosinophilia syndrome. Southern medical journal, 1998. 91(9): p. 882-883.
11. Prunier, F., et al., Loffler’s fibroblastic endocarditis. A report of a case complicating toxocarosis. Archives des Maladies du Coeur et des Vaisseaux, 2001. 94(3): p. 226-230.
12. Dent, L.A., et al., Interleukin-5 Transgenic Mice Show Enhanced Resistance to Primary Infections with Nippostrongylus brasiliensis but Not Primary Infections withToxocara canis. Infection and immunity, 1999. 67(2): p. 989-993.
13. Dinning, W., et al., Toxocariasis: a practical approach to management of ocular disease. Eye, 1988. 2(5): p. 580.
14. Small, K.W., et al., Surgical management of retinal traction caused by toxocariasis. American journal of ophthalmology, 1989. 108(1): p. 10-14.
15. Monshizadeh, R., M.T. Ashrafzadeh, and S. Rumelt, Choroidal neovascular membrane: a late complication of inactive Toxocara chorioretinitis. Retina, 2000. 20(2): p. 219-220.
16. Schantz, P.M., D. Meyer, and L.T. Glickman, Clinical, serologic, and epidemiologic characteristics of ocular toxocariasis. The American journal of tropical medicine and hygiene, 1979. 28(1): p. 24-28.
17. Schantz, P.M., Toxocara larva migrans now. The American journal of tropical medicine and hygiene, 1989. 41(3_Part_2): p. 21-34.
18. Stürchler, D., et al., Thiabendazole vs. albendazole in treatment of toxocariasis: a clinical trial. Annals of Tropical Medicine & Parasitology, 1989. 83(5): p. 473-478.
استرانژیلوئیدس در بیمار مبتلا به ضعف ایمنی
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام