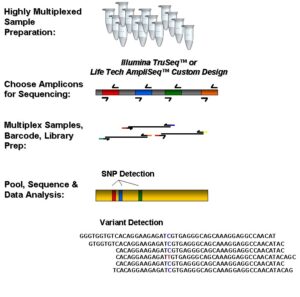
انکوژن ها
شاهین اسعدی، الهام علیزاده میلانی، دانشجویان ژنتیک مولکولی
دکتر سیدعلی رحمانی، متخصص ژنتیک پزشکی، استادیار دانشگاه
دکتر سعید قربیان متخصص ژنتیک مولکولی، استادیار دانشگاه
انکوژن چیست؟
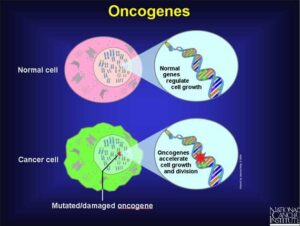
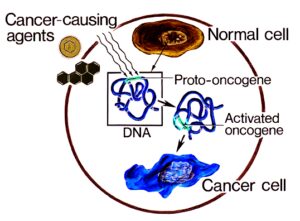
انکوژن شکل جهش یافته یک ژن طبیعی سلولی به نام پروتوانکوژن است که در گسترش سرطان شرکت میکند. پروتوانکوژنها رشد و تمایز سلولی را کنترل میکنند. بیشتر آنها در طول تکامل گونهها حفظ شدهاند؛ این مطلب نشان دهنده اهمیت نقش آنها در فرایندهای اساسی سلولی میباشد. جهشهایی که در پروتوانکوژنها رخ داده و آنها را به انکوژن تبدیل میکنند اختلالاتی را در رشد و تمایز سلولی ایجاد میکنند که غالباً در سلولهای سرطانی دیده میشوند.
انکوژن نوعی ژن سرطانی است در حالیکه همه ژنهای سرطانی در نتیجه وقوع جهش ایجاد میشوند. انکوژنها ژنهای منحصر به فردی هستند که بوسیله جهشهای تغییر دهنده و نه حذف کنندهی فعالیت پروتئینهای ساخته شده توسط آنها ایجاد میشوند.
پروتئینهایی که توسط انکوژنها ساخته میشوند در مقایسه با محصولات پروتئینی ساخته شده توسط پروتوانکوژن مربوطه فعالیت بیوشیمیایی بیشتری دارند. محصول بیشتر پروتوانکوژنها آنزیم است. به دلیل تغییر تمایل آنها به سوبسترا یا عدم تنظیم فعالیت آنها اشکال انکوژنی این آنزیمها فعالیت بیشتری دارند. به جهشهایی که موجب فعال شدن پروتوانکوژنها و تبدیل آنها به انکوژن میشوند جهشهای فعال کننده میگویند.
کشف ژنهای سرطانی قابل انتقال:
انکوژنها اولین ژنهای سرطانی بودند که کشف شدند. در واقع مفهوم انکوژن اولین ویرایش مفهومی بود که در نهایت به تئوری ژنی سرطان منتهی شد. انکوژنها ابتدا به عنوان اجزاء درونی ویروسهای سرطانزا شناسایی شدند. امروزه متخصصین سرطان شناسی مولکولی شجرهنامه علمی خود را به ویروس شناسان پیشگام اوائل قرن 20 میلادی میرسانند. مشاهدات آزمایشگاهی اولیه که کشف انکوژنها را پایه گذاری کرد قبل از عصر زیستشناسی مولکولی بود. در سال 1908 willhelm Ellerman و Olaf Bang نشان دادند که یک عصاره عبور داده شده از فیلتر که فاقد سلول و باکتری میباشد میتواند باعث انتقال لوسمی در بین جوجهها شود.
در آن زمان لوسمی به عنوان سرطان شناخته نمیشد، لذا این کار تأثیر کمی داشت. دو سال بعد Peyton Rouse دریافت که سارکومای جوجه میتواند به دفعات به وسیله عصاره توموری فاقد سلول از حیوانی به حیوان دیگر منتقل شود. عامل این بیماری در عصاره سلولی ویروس (RSV) بود که جزء اولین ویروسهای حیوانی بود که جدا شده بود. کشف انکوژنهای ویروسی مثل RSV برای اولین بار باعث شد که یک عامل ایجاد کننده سرطان از منظر ژنتیک مورد مطالعه قرار گیرد. ژن P53 که در بیشتر سرطانهای انسانی دچار جهش میشود به واسطه همراهی فیزیکی آن با پروتئین ویروسی SV40 در سلولهای محیط کشت شناسایی شد.
انکوژنهای فعال:
انکوژنهایی که اغلب در رشد و گسترش سرطانهای انسانی شرکت دارند به وسیله ویروسها منتقل نمیشوند بلکه در نتیجه جهشهای سوماتیک در پروتوانکوژنها ایجاد میگردند. انتقال افقی سرطان به وسیله عصاره سلولی حاوی ویروس RSV بیانگر روشهای کسب انکوژنها توسط سلولهای انسانی نیست، با وجود این ویروسهایی مانند RSV اطلاعات مهمی درباره اینکه شبیه چه انکوژنهایی هستند و یا اینکه چگونه تغییرات سلولی را به راه میاندازند، ارائه میکنند.
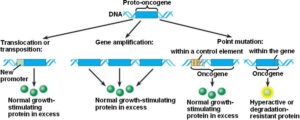
فعال شدن پروتوانکوژنها از طریق تکثیر ژنی:
در سلولهای سالم پروتوانکوژنها به صورت ژنهای تک نسخه هستند؛ به این معنی که یک مکان ژنی (لوکوس) واحد و تنها یک نسخه از هر اگزون و اینترون و توالیهای تنظیمی دارد. به دلیل طبیعت دیپلوئیدی ژنوم انسانی در هر سلول دو نسخه از هر انکوژن وجود دارد که هر کدام روی یک کروموزوم قرار گرفتهاند. با تکثیر یک قطعه کروموزومی تعداد نسخههای یک ژن افزایش مییابد که موجب افزایش بیان ژن میشود. واحد DNA ژنومی که تکثیر میشود آمپلیکون نام دارد. اندازه آمپلیکونها متغیر است ولی تقریباً 105 تا 106 جفت باز میباشد. آمپلیکونها به صورت واحدهای تکراری پشت سر هم قرار گرفتهاند.
در صورتی که تعداد نسخهها زیاد باشد یا اندازه آمپلیکون بزرگ باشد ناحیه تکثیر شده را میتوان با روشهای میکروسکوپی و سیتوژنتیک مشاهده کرد.
نواحی تکثیر شده ژنوم میتوانند به صورت اجسام خارج کروموزومی به نام double minute وجود داشته باشد. این ساختارها کوچک و شبیه کروموزوم هستند ولی سانترومر ندارند. این اجسام میتوانند به کروموزومها ملحق شوند. ناحیه الحاقی را غالباً میتوان با روشهای سیتوژنتیکی با استفاده از رنگهایی که الگوهای نواربندی کروموزومی را آشکار میکنند به شکل نواحی که بصورت همگن رنگ میشوند تشخیص داد.
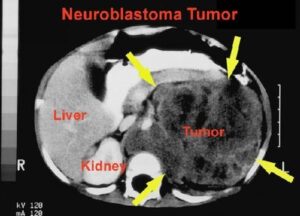
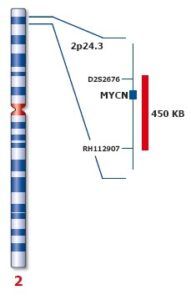
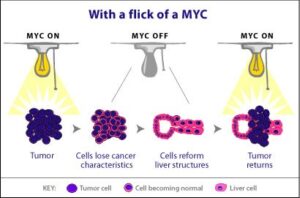
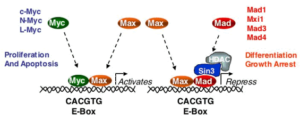
در نتیجه تکثیر، ژن MYC از شکل پروتوانکوژن به انکوژن تبدیل میشود. مهمترین پیامد تکثیر N-MYC رشد نوروبلاستوما است. نوروبلاستوماها تومورهایی هستندکه از سلولهای عصبی نابالغ ایجاد میشوند. این تومورها منحصراً در کودکان ایجاد میشود. تکثیر قطعه ژنومی روی بازوی کوتاه کروموزوم شماره 2 بصورت (2p24) که حاوی مکان ژنی N-MYC است در 25% نوروبلاستوماها قابل تشخیص میباشد. میزان تکثیر N-MYC در نوروبلاستوماها متغیر است، بطوریکه در برخی از این سرطانها 250 نسخه از این ژن یافت میشود. میزان تکثیر N-MYC با مرحله بیماری و مستقلاً با سرعت گسترش و پیامد بیماری ارتباط دارد. این یافتهها نشان میدهند که تکثیر N-MYC مستقیماً در پیشرفت نوروبلاستوما نقش دارد.
تصویر رادیولوژی از تومور نوروبلاستوما در اطراف کلیه
ژنهای تکثیر یافته MYC علاوه بر نوروبلاستوماها در تعدادی از تومورها بطور رایج دیده میشوند. اولین توموری که در آن تکثیر C-MYC مشاهده شد لوسمی میلوسیتی بود. تکثیر C-MYC به وفور در سرطان گردن رحم و ریه مشاهده میشود.
در سرطانهای سلولهای کوچک ریه ازدیاد یکی از سه ژن MYC یعنی C- MYC, N-MYC و L-MYC دیده میشود.
ازدیاد C-MYC در حدود 20 تا 30 درصد کارسینوماهای سینه مشاهده شده است و به نظر میرسد نتایج بالینی نامطلوبی داشته باشد.
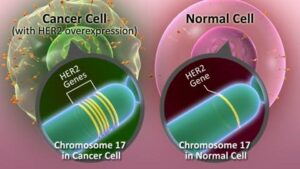
ژن دیگری که عمدتاً در بسیاری از سرطانها تکثیر میشود ERBB2 است که HER2/neu نیز نامیده میشود. ازدیاد ERBB2 در بخش وسیعی از سرطانهای سینه و تخمدان و نیز آدنوکارسینوماهای معده و کلیه و غدد بزاقی دیده میشود. اولین بار ERBB2 به عنوان همولوگ سلولی انکوژن VERBB2 شناخته شد که توسط رتروویروسی بنام ویروس لوسمی اریتروبلاستیک ماکیان حمل میشود. تقریباً در همان زمان یک انکوژن بنام NEU از یک رده سلولی نوروبلاستومای رت با روش ترانسفورماسیون in vitro جداسازی شد، حال آنکه ژن HER2 بدلیل شباهت آن با ژن شناخته شده قبلی شناسایی گردید که در سطح سلول یک پروتئین سیگنالی بنام گیرنده اپیدرمال فاکتور رشد انسانی را میسازد. تلاشهایی برای تعیین مکان کروموزومی این ژنها و تعیین توالی آنها صورت گرفت که نشان میدهند دو ژن ERBB2 و HER2/neu در واقع یک ژن هستند.
تغییرات ژنتیکی که موجب فعال شدن ERBB2 میشوند جزو شایعترین جهشهای سوماتیکی هستند که در سرطان سینه دیده میشوند. این تغییرات در 15 تا 25% تومورهای مورد مطالعه مشاهده شدهاند. اغلب این تغییرات از نوع تکثیر ژنی هستند که موجب افزایش بیان ژن میشوند.
آمپلیکونهایی که در سرطانهای مختلف مکان ژنی ERBB2 را بطور کامل در بر میگیرند متفاوتند ولی ناحیهای به طول 280 کیلوباز در همه آنها مشترک است. این آمپلیکون مرکزی علاوه بر ERBB2 چند لوکوس دیگر را نیز شامل میشود ولی مطالعات ژنتیکی بطور قطع پیشنهاد میکنند که افزایش بیان ERBB2 گزینش کلونال را موجب میشود. نواحی تکثیر یافته عمدتاً شامل 20 نسخه از آمپلیکون ERBB2 میباشند ولی تا 500 نسخه هم یافت شده است.
این ژن پروتئینی را رمز میکند که بعنوان گیرنده سطح سلولی عمل میکند و پیامهای رشد را انتقال میدهد. فعال شدن این پروتوانکوژن به واسطه تکثیر ژنی موجب بیان بیش از حد گیرنده ERBB2 و در نتیجه حساسیت بالای سلول به گیرندههای رشد میشود. تکثیر ژن ERBB2 در سرطان سینه یک نشانگر تشخیصی مفید است. در حالیکه تکثیر ژن ERBB2 با ویژگیهای بیماری مانند اندازه تومور ارتباطی ندارد ولی با گسترش سلولهای سرطانی به غدد لنفاوی موضعی که یک بیومارکر تشخیصی منفی مستقل است، ارتباط دارد.
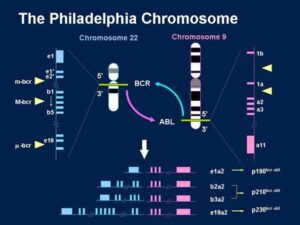
فعالیت انکوژنها در لوسمی میلوئید مزمن و کروموزوم فیلادلفیا:
فعال شدن یک پروتوانکوژن به وسیله یک جابجایی که علامت مشخصه بیماری است به بهترین وجه توسط لوسمی میلوئید مزمن (CML) بررسی میشود. در 95% بیماران مبتلا به CML سلولهای سرطانی یک نوع کروموزوم خاص بنام کروموزوم فیلادلفیا دارند. این نام به خاطر شهری است که اولین بار در سال 1960 این کروموزوم در آنجا شناسایی شده است و با بررسیهای دقیق سیتوژنتیکی در سال 1973 مشخص شد که از یک جابجایی دو سویه بین کروموزومهای شماره 9 و 22 ایجاد میشود.
5% باقیمانده بیماران مبتلا به CML که کروموزوم فیلادلفیا را نشان نمیدهند جابجاییهای کروموزومی پیچیدهتری دارند ولی نواحی کروموزومی درگیر در این بیماران مشابه 95% دیگر است. بعد از کشف و شناسایی کروموزوم فیلادلفیا در بیماران CML این کروموزوم در 5-3% کودکان و 40-30% افراد بزرگسال مبتلا به لوسمی لمفوسیتی حاد (ALL) نیز مشاهده شده است. لوسمی میلوئید مزمن از سلولهای اجدادی سلولهای خونی ناشی میشود و در سرتاسر جریان خون محیطی و مغز استخوان پخش میشود. این لوسمی تمام گروههای سنی را تحت تأثیر قرار میدهد ولی در افراد پیر و سالخورده شایعتر است.
نکته جالب این است که تنها فاکتور محیطی شناخته شده که فرد را مستعد ابتلا به CML میکند قرار گرفتن در معرض پرتوهای یونیزان است. ممکن است ترمیم شکستگی دو رشتهای DNA که بوسیله پرتوهای یونیزان ایجاد میشوند باعث شکل گیری اتفاقی کروموزوم فیلادلفیا شود. در بیشتر موارد هیچ فاکتوری وجود ندارد که فرد را مستعد ابتلا به CML نماید و در نتیجه علت جابجایی اولیه مشخص نیست.
کشف انکوژنها در عصر ژنومیک:
شناسایی اغلب انکوژنهایی که میشناسیم قبل از تکمیل پروژه ژنوم انسانی صورت گرفته است. نمونههای انکوژنی که پیش از این درباره آنها بحث شد براساس همولوژی آنها با ژنهایی که توسط رتروویروسهای سرطانزا حمل میشدند یا توانایی آنها در تحریک تشکیل کلونی در یک آزمایش ترانسفورماسیون in vitro جدا سازی شدند. این انکوژنهای اولیه به این دلیل که در بسیاری از سرطانها نقش داشتند شناسایی نشدند، بلکه شناسایی آنها بواسطه ویژگیهای منحصر به فردی بود که شناختن آنها را با ابزارهای موجود در آن زمان آسان مینمود. با آنکه این یافتهها نمونههایی بودند برای درک چگونگی تأثیر ژنها در بروز سرطان، ژنهایی که شناسایی میشدند لزوماً در شکل گیری تعداد قابل توجهی از سرطانها شرکت نداشتند.
انتشار اولین پیشنویس توالی ژنوم انسانی در سال 2000 روشهای جدید و مؤثری را برای بررسی ژنوم سلولهای سرطانی ارائه کرد. اکنون موقعیت ساختار و توالی هر ژن انسانی به آسانی در دسترس است. این اطلاعات به همراه پیشرفتهای بیشتر در تکنولوژی تعیین توالی DNA بررسی مستقیم ژنهای جهش یافته در سلولهای سرطانی را آسان کرده است. اکنون یافتن انکوژن فرآیندی سیستماتیک است که به انفورماتیک یعنی مطالعه و پردازش حجم وسیعی از اطلاعات متکی است. در عصر ژنومیک انکوژنهای جدید بر اساس ویژگیهای فردی یا شانس شناسایی نمیشوند، بلکه مبنای شناسایی فرکانس جهش پذیری آنها در سرطانها است.
PIK3CA نمونهای از انکوژنهایی است که به کمک ژنومیک سرطان شناسایی شدهاند. این انکوژن عضو خانواده ژنهای سازنده لیپیدکینازهایی بنام فسفاتیدیل اینوزیتول 3-کیناز میباشد. در دهه 1980 وقتی مشخص شد که فعالیت PI3K با محصول پروتئینی انکوژنهای ویروسی مثل C-SRC در ارتباط است آنزیمهای PI3K برای اولین بار مورد توجه انکولوژیستها قرار گرفت. آنزیمهای PI3K در مسیرهای انتقال پیامی که در هموستازی بافتی مثل تکثیر و مرگ و حرکت سلولی نقش دارند شرکت میکنند. نقشهای شناخته شده لیپیدکینازها در فرآیندهای سلولی وابسته به سرطان و ارتباط آنها با انکوژنهای ویروسی شناخته شده اساس بررسیهای وسیع ژنهای این خانواده را تشکیل میدهد. بعنوان مثال گروهی از دانشمندان به رهبری Victor Velculescu در دانشگاه Johns Hopkins با کمک دانش بیوانفورماتیک
8 عضو خانواده PI3K را شناسایی کردند که این 8 ژن از لحاظ توالیهای رمزگذار با هم شباهت داشتند.
هر یک از ژنهای شناخته شده PI3K در انتهای کربوکسیل خود یک دامنه کینازی دارند. این محققین اقدام به تعیین توالی 117 اگزونی کردند که در کل دامنه کینازی تک تک اعضای خانواده PI3K را در گروهی از تومورهای کلورکتال رمز مینمودند. در یک عضو خانواده بنام PIK3CAجهشهای بازگشتی شناسایی شد.
اغلب جهشهایی که در حین تشکیل تومور کلورکتال روی میدهند تغییرات تک نوکلئوتیدی از نوع جهشهای معنیدار میباشند.
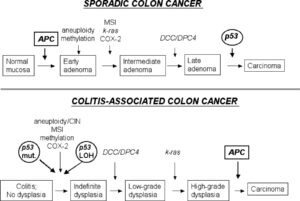
فعال شدن پروتوانکوژنها و تومورزایی:
چگونه انکوژنها با ترتیب تغییرات ژنتیکی که زیرمبنای تومورزایی را میسازند هماهنگ میشوند؟ انکوژنهای شرکت کننده در سرطان کلورکتال اطلاعات خوبی به ما میدهند. تغییرات ژنتیکی که غالباً در این تومورها روی میدهند با مراحل بالینی و پاتولوژیک بیماری ارتباط مستقیم دارند. در بیشتر سرطانهای کلورکتال فعال شدن انکوژنها به چشم میخورد. اولین خانواده ژنی که با سرطانهای کلورکتال همراه هستند اعضای فعال شده خانواده RAS میباشند. تغییرات تک نوکلئوتیدی در N-RAS و K-RAS در حدود 50% سرطانهای کلورکتال دیده شدهاند.
در بین آسیبهای پیش سرطانی فرکانس جهش در ژن RAS در آدنوماهای بزرگتر از 1cm برابر با سرطانهای مهاجم میباشد. در مقابل در آدنوماهای کوچکتر از 1cm جهش در RAS به ندرت دیده میشود. این یافته ها حاکی از این است که جهشهای RAS در هنگام پیشرفت آدنوما لازمند.
:REFERENCESE
1.Bishop,J.M.Enemies within: the genesis of retrovirus oncogenes.Cell 1981.
2.Epstein,M.A.Historical background.Philos.Trans.R.Soc.Lond.B.Biol.Sci 2001.
3.Garraway,L.A.&Sellers,W.R.Lineage dependency and lineag-survival oncogenes in human cancer.Nat.Rev.2006.
4.Mitelman,F.,Johansson,B.&Mertens,F. The impact of translocations and gene fusions on cancer causation.Nat.Rev.Cancer 2007.
5.Rowley,J.D.Chromosome translocations: Dangerous liaisons revisited.Nat.Rev.cancer 2001.
6.Sawyers,C.L.Chronic myeloid leukemia.N.Engl.J.Med.1999.
7.Schwab,M.Oncogene amplification in solid tumors.Semin.Cancer Biol.1999.
8.Thomas,R.K.et al.High-throughput oncogene mutasion profiling in human cancer.Nat.Genet.2007.
9.Weinberg,R.A.the cat and mouse games that genes, viruses, and cells play.Cell.1997.
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام