الفبای عفونتهای جنسی
دکتر فاطمه مافی
دکترای علوم آزمایشگاهی
مقدمه
عفونتهای منتقلشونده از طریق رابطه جنسی sexually transmitted infections(STIS) همانگونه که از نامشان پیداست از طریق رابطه جنسی منتقل میشوند و یکی از عوامل مهم مرگومیر بهحساب میآیند. برای برخی از این عفونتها درمان قطعی وجود دارد و در مورد بقیه باید اقدامات پیشگیرانه به عمل آید.
میزان شیوع بسیاری از عفونتهای منتقلشونده از طریق رابطه جنسی در امریکا و سراسر جهان در حال افزایش است و در حال حاضر صدها میلیون نفر مبتلا به این بیماریها میباشند. روشهای آزمایشگاهی نقش مهمی در تشخیص این بیماریها دارند و کارکنان آزمایشگاهی باید با دستورالعملها و روشهای جدید این آزمایشها آشنا گردند.
محتوی:
برای تشخیص STIS روشهای دقیق و حساس موردنیاز است تا بتوان براساس آن آنتیبیوتیک مناسب را انتخاب کرده و سیکل استمرار انتقال بیماری را قطع نمود. در این مقاله به بررسی تستهای آزمایشگاهی در خصوص علل متداول باکتریال، ویرال و انگلی STIS میپردازیم. همچنین درخصوص تظاهرات بیماری همچون سرویسیت، اورتریت، بیماری اولسراتیو ژنیتال، ویروس نقص ایمنی انسانی، هپاتیت ویروسی، پاپیلوما ویروس انسانی و واژینیت بحث خواهیم نمود. همچنین بهطور خلاصه درخصوص پیشرفتهای اخیر درزمینه تشخیص و مدیریت STIS شامل الگوریتمهای تشخیصی جدید، پیشرفتهای روشهای آزمایش و چالشهای جدید درخصوص مقاومت به داروهای ضدمیکروبی مطالبی خواهد آمد.
خلاصه:
روشهای تشخیصی و دستورالعملهای درمانی STIS بهسرعت در حال تغییر میباشند. تغییرات اپیدمیولوژیک، پیشرفت درمانهای جدید و توسعه روشهای تشخیصی منجر به تغییر در روشهای آزمایشگاهی و نهایتاً تغییر در مدیریت بیماری شدهاند. روشهای مولکولی، درمان شخصی شده و رژیم درمانی را برای گونهها یا سوشهای برخی از STIS تسهیل کرده است.
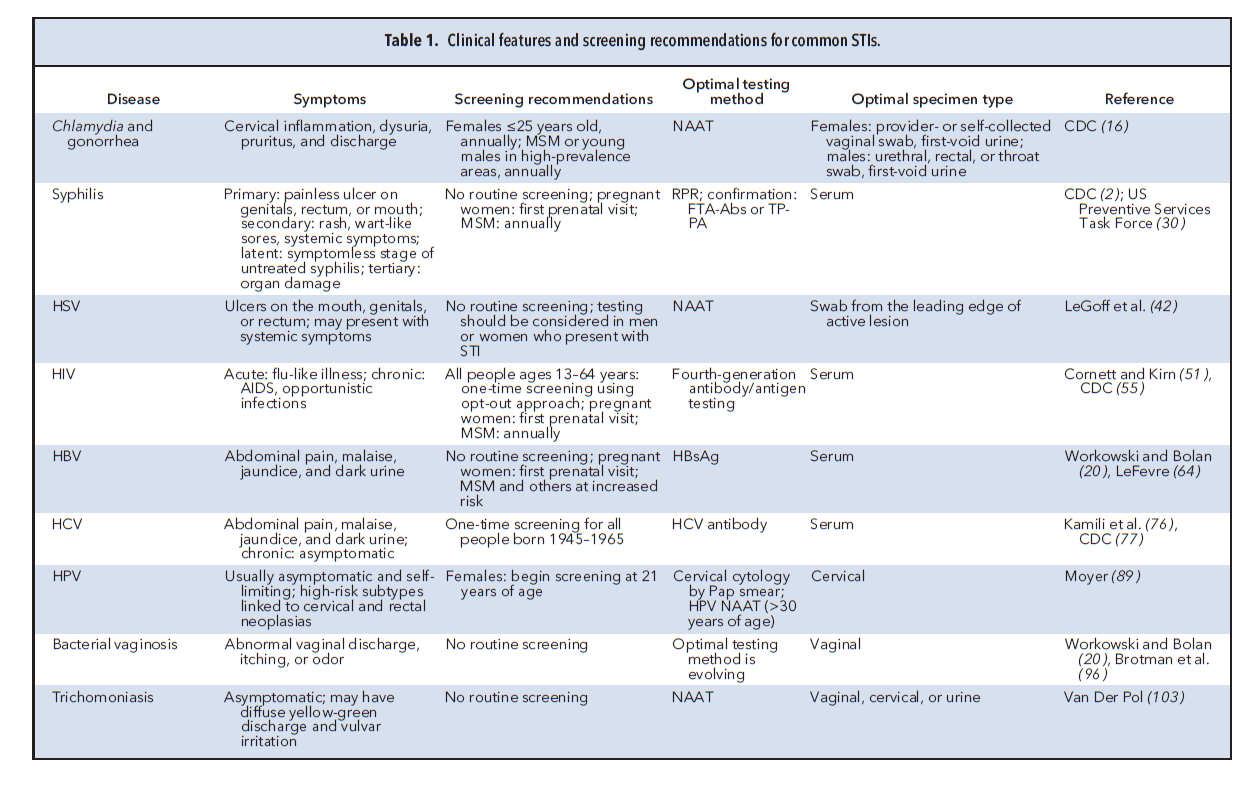
در امریکا بیش از 100 میلیون نفر مبتلا به STIS هستند و سالانه حدود 20 میلیون ابتلای جدید رخ میدهد. بار مالی بیماریهای جنسی قابلتوجه بوده و قریب به 16 میلیارد دلار در سال تخمین زده میشود (1). علیرغم اینکه بسیاری از این بیماریها قابل پیشگیری و درمان هستند، اما میزان مرگومیر همچنان بالا میباشد. مقاومت به درمان با آنتیبیوتیکها بهسرعت در حال گسترش است و شیوع بسیاری از بیماریهای جنسی برای اولین بار در طی یک دهه اخیر در حال افزایش میباشد، معذلک روشهای مولکولی جدید و بکارگیری داروهای جدید به تشخیص سریع و درمان مؤثر این بیماریها کمک کرده است. در این مقاله به شرح بیماریهای جنسی که برای آزمایشگاهیان اهمیت دارند خواهیم پرداخت. خلاصهای از بیماریها و عوامل آنها در جدول یک آمده است.
سرویسیت و اورتریت
التهاب سرویکس با اگزودای چرکی اندوسرویکال مشخص میگردد که بهراحتی منجر به خونریزی سرویکس میشود. علائم اورتریت شامل دیزوری، خارش مجرا و ترشح میباشد. سرویسیت و اورتریت بهطور معمول توسط کلامیدیا تراکوماتیس یا نایسریا گونوروآ ایجاد میشوند، همچنین مایکوپلاسما ژنیتالیکوم هم میتواند موجب اورتریت گردد.
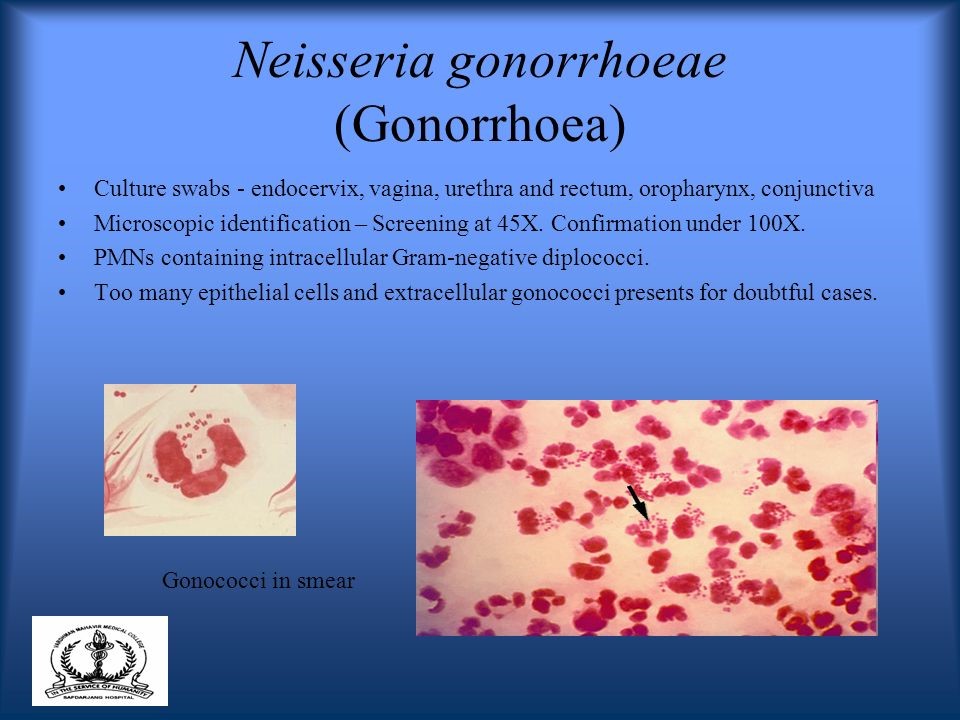
کلامیدیا و گونوروآ
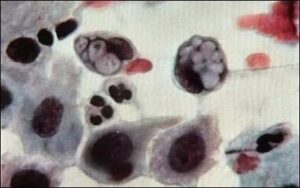
کلامیدیا تراکوماتیس و نایسریا گونوروآ باکتریهای گرم منفی داخل سلولی هستند که در آمریکا بهطور معمول بهعنوان عامل ایجاد عفونتهای منتقلشونده از راه تماس جنسی گزارش میشوند. کلامیدیا شایعترین عامل عفونت در افراد زیر 24 سال است و شیوع آن در زنان دو برابر مردان میباشد (2). گرچه بسیاری از عفونتهای گنوکوکی و کلامیدیایی بدون علامت هستند، اما عوارض شدیدی همچون التهاب لگن، حاملگی اکتوپیک و عقیمی میتوانند داشته باشند. عفونت از طریق تماس واژینال، آنال یا دهانی میتواند منتقل شود. علاوه بر این نایسریا گونوروآ میتواند در نوزادانی که از مادران آلوده متولد میشوند ایجاد عفونت چشمی بنماید.
Chlamydia trachomatis
اقدامات مؤثر پروفیلاکسی سبب شده که عفونت چشمی در نوزادان در امریکا بهشدت کاهش پیدا کند، اما در کشورهای در حال توسعه میزان آن همچنان بالا میباشد (3).
غربالگری
بنا به توصیه CDC تمام زنان زیر 25 سال که از نظر جنسی فعال میباشند باید بهطور سالانه از نظر ابتلا به عفونت کلامیدیا و گونوروآ غربالگری شوند (4)، علاوه بر این تمام زنان حامله زیر 25 سال به هنگام اولین ویزیت پیش از تولد باید از نظر این دو عامل عفونی مورد آزمایش قرار گیرند. آزمایش در سهماهه سوم باید برای زنان پرخطر تکرار گردد تا احتمال عوارض تولد نوزاد آلوده کاهش یابد (2).
غربالگری مردان جوان در مناطقی که شیوع عفونت بالاست و نیز در مردان همجنسگرا توصیه میشود (5). میزان شیوع عفونت کلامیدیا و گونوروآ در بین مردان در سالهای اخیر افزایش یافته است (6). این افزایش ممکن است به خاطر تغییر روش غربالگری باشد. اکنون توصیه میشود که نواحی غیرژنیتال همچون حلق و مقعد هم مورد آزمایش واقع شوند، زیرا شیوع عفونت در این نواحی در بین مردان همجنسگرا بالا است (9-7).
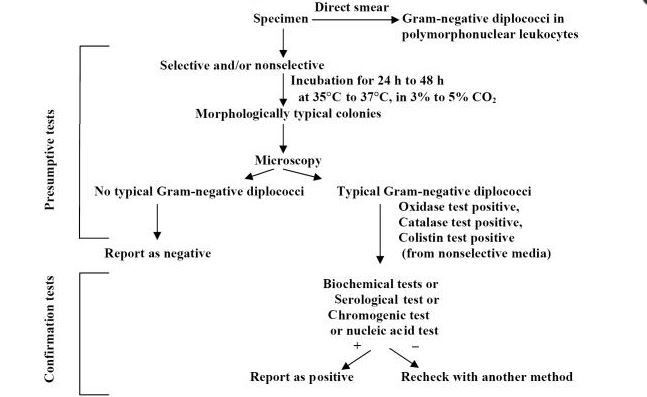
نمونه مناسب برای غربالگری زنان از نظر عفونت، سواب واژینال میباشد که توسط خود فرد یا کارکنان بهداشتی در محیط درمانی گرفته میشود. تهیه نمونه توسط خود فرد میزان غربالگری را در بین زنان افزایش داده و مطالعات نشان میدهند که حساسیت و ویژگی تهیه نمونه توسط خود بیمار با تهیه نمونه توسط کارکنان بهداشتی قابل مقایسه میباشد (12-10). نمونههای قابلقبول دیگر شامل ادرار اول وقت و سواب آندوسرویکال میباشند. در غربالگری مردان جهت گنوکک و کلامیدیا، از نمونه ادرار اول وقت و سواب ترشح مجرا استفاده میشود. آزمایش هر دو عفونت توسط روش Nucleic Acid Amplification Tests (NAATS) میسر میباشد و این رویکرد مزایای بیشماری نسبت به روش کشت و یا آنتیژن دارد. NAATS به لحاظ حساسیت تشخیصی و آنالیتیکال در تشخیص عفونتهای گنوکک و کلامیدیا برتری خود رانشان داده است (15-13). بیشتر کیتهای تجاری موجود برای نمونههای واژن، مجرا، سرویکس و ادرار تأییدیه FDA را دریافت کردهاند. آزمایشهای NAAT هنوز تأییدیه FDA را برای نمونههای حلق و رکتوم دریافت نکردهاند، اما بسیاری از آزمایشگاهها رأساً نسبت به صحهگذاری آزمایشهای NAAT برای نمونههای مذکور اقدام نمودهاند (16).
گرچه حساسیت NAATS در مقایسه با کشت جهت تشخیص نایسریا گونوروآ و کلامیدیا تراکوماتیس بیشتر است، اما گاهی کشت این پاتوژنها ضرورت مییابد. در حال حاضر در موارد تجاوز به پسربچهها و مواجهه extragenital دختران، انجام کشت توصیه میشود. علاوه بر این تعدادی از آزمایشگاهها باید بهمنظور پایش تغییرات اپیدمیولوژیک و الگوی مقاومت آنتیبیوتیکی توان خود را برای کشت نایسریا و کلامیدیا استمرار بخشند (16). کشت کلامیدیا تراکوماتیس نیازمند کشت سلولی برای تکثیر ارگانیسم میباشد (15). برای به دست آوردن مقدار کافی از سلولهای اپیتلیال، نمونهبرداری تهاجمی ضرورت دارد و نمونه باید بلافاصله به محیط کشت سلولی تلقیح گردد. سلولهای آلوده در مجاورت آنتیبادیهای کلامیدیایی انکوبه میشوند تا حضور ارگانیسم شناسایی گردد. این فرآیند از نظر تکنیکی پیچیده بوده و روشهای مورد استفاده در آزمایشگاههای مختلف تفاوت زیادی باهم دارند (17)، بنابراین کشت برای اکثر آزمایشگاهها روش قابل انجامی محسوب نمیشود و تنها در مراکز بهداشتی مجهز قابل انجام میباشد. کشت نایسریا گونوروآ هم بهواسطه سختگیر بودن باکتری مشکلاتی دارد. نمونه باید با سوابی جمعآوری شود که دسته آن پلاستیکی یا فلزی باشد چراکه چوب یا پنبه اثر مهاری بر رشد باکتری دارد. همچنین برای زنده ماندن باکتری نیاز به محیط ترانسپورت خاصی میباشد، علاوه بر این برای رشد باکتری محیط انتخابی و غنیشده و نیز افزایش co2 در محیط ضروری است.
درمان
برای جلوگیری از انتقال بیماری به افراد دیگر و نوزادان و همچنین پیشگیری از عوارض و عواقب عفونت ضرورت دارد که عفونتهای کلامیدیایی و گنوککی درمان مناسب دریافت کنند. درمان انتخابی عفونت کلامیدیایی آزیترومایسین یا داکسیسیکلین میباشد که هر دو بهطور مؤثر میتوانند عفونت را ریشهکن کنند (18)، اما به خاطر ظهور سوشهای مقاوم نایسریا گونوروآ در سالهای اخیر درمان آن تغییراتی پیدا کرده است. ظهور سوشهای مقاوم به تتراسیکلین و سوشهایی که MIC آنها نسبت به سفکسیم افزایش یافته است سبب شد که اخیراً CDC درمان ترکیبی با سفتریاکسون و آزیترومایسین را پیشنهاد کند (20و 19و2)، که البته این درمان علیه عفونت همزمان غیرکمپلیکهی کلامیدیا هم مؤثر است. اگر بعد از این درمان هنوز عفونت پابرجا ماند باید تست حساسیت آنتیبیوتیکی برای گنوکک بعمل آید.
مایکوپلاسما ژنیتالیوم
حدود 20% موارد اورتریت غیرگنوککی و غیرکلامیدیی در مردان توسط باکتری مایکوپلاسما ژنیتالیوم ایجاد میشود که راه انتقال این باکتری هم از طریق تماس جنسی میباشد (21). پاتوژنز مایکوپلاسما ژنیتالیوم در زنان نامشخص است، گرچه نسبت وقوع آن در زنانی که سرویسیت دارند بهمراتب بیشتر از دیگران است (23و22).
آزمایشهای تشخیصی مایکوپلاسما ژنیتالیوم چالش بزرگی است، چراکه رشد این باکتری در محیط کشت تا 6 ماه به طول میانجامد و آزمایشگاههای معدودی وجود دارند که بتوانند کشت آن را انجام دهند، لذا در این خصوص استفاده از NAAT ترجیح دارد. گرچه تاکنون هیچ آزمایشی برای مایکوپلاسما ژنیتالیوم تأئیدیه FDA را دریافت نکرده است، لذا در افرادی که اورتریت پایدار یا عودکننده غیرگنوکوکی دارند ممکن است عامل عفونت این باکتری باشد که ناشناخته باقی میماند، لذا با توجه به این مشکل تشخیصی تصمیمگیری در مورد افراد مشکوک به ابتلا به مایکوپلاسما ژنیتالیوم عمدتاً برمبنای وجود علائم بیماری و رد تشخیص سایر عوامل عفونی میباشد.
مطالعات نشان میدهند که داکسیسیکلین برای درمان این عفونت نسبتاً بیتأثیر است و درمان با آزیترومایسین موفقتر میباشد (25و 24)، اما مقاومت به آزیترومایسین سریعاً در حال گسترش است و در برخی مطالعات محدود مشخص شده که در موارد شکست درمانی استفاده از moxifloxacin مؤثر بوده است (27و26).
بیماری اولسراتیو ژنیتال
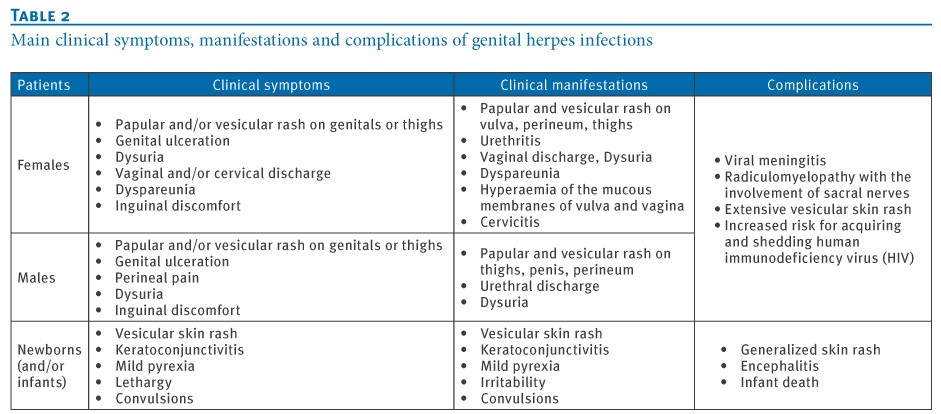
اولسرهای ژنیتال از نظر اتیولوژی ممکن است عفونی و یا غیرعفونی باشند. بیشتر موارد این اولسرها در آمریکا بهواسطه عفونت با ویروس هرپس سیمپلکس (HSV) یا سیفلیس به وجود میآیند. سایر عوامل با شیوع کـــــــــمتر شامل شانــکروئید (هموفیلوس دوکرهئی)، گرانولوما اینگواینال (کلبسیلا گرانولوماتیس) و لنــــــــــــــــــــفـــوگرانولومـــا ونــروم (serovar L1 ,L2 ,L2a or L3 of Chlamydia trachomaits) میباشند. وجود اولسرهای ژنیتال ریسک ابتلا و انتقال (HIV) را افزایش میدهد (29و28). ازآنجاکه اغلب عوامل مختلفی بهطور همزمان موجب اولسر میشوند، تشخیص عامل ایجادکننده معمولاً دشوار میگردد.
سیفلیس
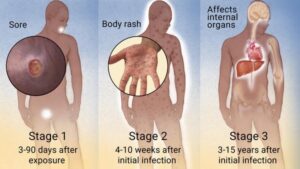
سیفلیس که توسط باکتری ترپونما پالیدوم ایجاد میشود برحسب علائم بالینی به سه مرحله اولیه، ثانویه و ثالثیه تقسیمبندی میگردد. عفونت بدون علامت را سیفلیس نهفته مینامند و توسط آزمایش سرولوژی قابل تشخیص میباشد، علاوه بر این امکان ابتلای سیستم اعصاب مرکزی در هر یک از مراحل بیماری وجود دارد که به آن نوروسیفلیس میگویند.
مراحل سه گانه سیفلیس
آزمایشهای غربالی و تشخیصی
غربالگری سیفلیس بهطور روتین در آمریکا توصیه نمیگردد چراکه قدرت پیشبینی مثبت آن (PPV)positive predictive value برای افراد بدون علامت پایین است (30). ازآنجاکه بیشتر موارد اولیه و ثانویه سیفلیس در مردان همجنسباز تشخیص داده میشود، لذا غربالگری سیفلیس باید در این افراد و سایر افرادی که ریسک بالایی دارند انجام گردد (2). انتقال عفونت از مادر به جنین از طریق جفت میتواند منجر به مردهزایی، هیدروپس فتالیس یا تولد زودهنگام گردد. انجام غربالگری سیفلیس برای تمامی زنان جامعه در اولین معاینه پیش از تولد توصیه میگردد. در زنانی که ریسک بالایی دارند و یا در مناطقی زندگی میکنند که میزان عفونت بالاست و یا اینکه قبلاً آزمایش نشدهاند، انجام آزمایش در سهماهه سوم حاملگی هم ضروری است. انجام این غربالگری به این جهت است که در صورت وجود عفونت تبعات بسیار سنگینی برای نوزاد وجود دارد (20).
آزمایشهای سرولوژیک سیفلیس به دو گروه ترپونمایی و غیرترپونمایی تقسیم میشوند. تستهای ترپونمایی عبارتند از (TP-EIA) enzyme T.pallidum، (TP-PA) particle agglutination T.pallidum و
(FTA-Abs) Fluorescent Treponemal Antibody Absorption اینها آزمایشهای تأئیدی هستند که آنتیبادیهای ضد اجزاء سلولی ترپونما را آشکار میکنند. علیرغم اینکه این تستها دارای حساسیت و ویژگی بالایی هستند، اما کار زیادی میبرند و ضمناً برای پیگیری عفونت مناسب نیستند چرا که بعد از درمان هم مثبت باقی میمانند. تستهای غیرترپونمایی شامل VDRL و RPR میباشند که وجود آنتیبادی علیه یک آنتیژن با ماهیت کاردیولیپین– لستین را شناسایی میکنند. این آنتیبادی در پاسخ به عفونت سیفلیس ایجاد میشود. گرچه این آزمایشها فاقد حساسیت هستند، اما سریع و ارزان میباشند و برای غربالگری عفونت فعال و پایش پاسخ به درمان بکار میآیند. در بیمارانی که ظن بیماری سیفلیس در آنها بالاست جهت آزمایش باید رقیقسازی سرم هم انجام شود، چرا که پدیده پروزون در این آزمایشها مشاهده میگردد ( 32 و 31 ).
در بیشتر مراکز، غربالگری اولیه با آزمایشهای غیرترپونمایی انجام میشود و برای تأئید تشخیص از تستهای ترپونمایی استفاده میگردد (33).
پیشرفتهای اخیر در اتوماسیون انجام تستهای سرولوژیک ترپونمایی تغییر پارادایمی در الگوریتم تستهای تشخیصی سیفلیس ایجاد کرده است. با پدید آمدن امکان انجام EIA اتوماتیک و کاهش هزینه انجام آن، برخی آزمایشگاهها الگوریتم تشخیصی را معکوس کردهاند، یعنی ابتدا تست ترپونمایی را انجام میدهند و درصورتیکه نتیجه مثبت باشد اقدام به انجام تست غیرترپونمایی میکنند (34). باید توجه داشت که شیوع پایین سیفلیس در آمریکا اثر تعیینکنندهای در PPV این الگوریتم دارد و ممکن است منجر به ابهام در مدیریت بیماران گردد (35).
ویروس هرپس سیمپلکس
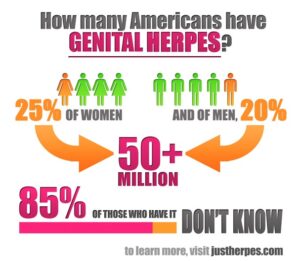
عفونت هرپس تناسلی که توسط (HSV-1) و (HSV-2) ایجاد میشود، شایعترین عفونت تناسلی در سرتاسر جهان بهحساب میآید. در آمریکا شیوع سرمی seroprevalence، درخصوص HSV-2 در میان بالغین و بزرگسالان 17% میباشد (36). گرچه در سالهای اخیر سروپروالنس HSV-2 کاهش یافته است، اما سروپروالنس HSV-1 بهویژه در میان زنان جوان و مردان همجنسباز افزایش نشان میدهد (38و37). با توجه به اینکه عفونت تناسلی HSV اغلب بدون علامت و یا تحتبالینی میباشد، بسیاری از عفونتها ناشناخته باقی میمانند.
تشخیص بالینی هرپس تناسلی فاقد حساسیت و ویژگی است، بنابراین روشهای آزمایشگاهی برای تشخیص آن ضرورت مییابد. در گذشته کشت ویروس، آزمایش طلایی برای تشخیص هرپس بود اما زمانبر بودن و حساسیت پایین در مقایسه با روشهای مولکولی از محبوبیت آن کاسته است (39). آزمایش PCR از سواب ضایعه در فردی که ضایعات فعال دارد حساسیت بالایی خواهد داشت (41 و 40)، اما اگر در فردی که ضایعات فعال ندارد نتیجه منفی باشد وجود بیماری نهفته را نمیتوان رد نمود. در زمان تهیه این مقاله سه روش مولکولی برای تشخیص دیانای HSV در ضایعات تناسلی و دهانی تأئیدیه FDA را دریافت کردهاند. میزان تشخیص با این روشها از کشت ویروس بالاتر است (42).
روش سرولوژی هم برای HSV-1 و HSV-2 وجود دارد. آنتیبادیها در چند هفته اول عفونت ایجاد میشوند و بهطور نامحدود باقی میمانند. وجود آنتیبادی IgG برای تشخیص HSV فعال کاربرد ندارد و از طرفی IgM هم ارتباطی با جدید بودن عفونت ندارد و ضمناً اختصاصی نوع (Type Specific) هم نیست (20).
ویروس نقص ایمنی انسانی (HIV)
حدود 1/2 میلیون نفر در آمریکا و 35 میلیون نفر در سراسر جهان به HIV مبتلا هستند (43 و 20). در سالهای اخیر میزان تشخیص HIV در حد 15 در صدهزار نفر ثابت مانده است که اکثریت قریب بهاتفاق موارد جدید هم در مردان و بهویژه مردان همجنسباز می باشد (44). عفونت HIV شامل دو نوع HIV-1 و HIV-2 میباشد.
HIV-1 شایعتر بوده و قریب به 95% موارد ابتلا را در سطح جهان شامل میشـــود. گرچه HIV-2 هم از نقاط مختلف گزارش شده است اما در مقایسه با HIV-1 نادر است. HIV-2 بومی غرب افریقا بوده و عامل مهم عفونت در این منطقه و مناطقی که از نظر تاریخی با آن مرتبط هستند مانند پرتغال، اسپانیا، هند و برزیل میباشد (45).
HIV از طریق تماس با مایعات آلوده بدن همچون خون، منی، ترشحات واژینال و شیر منتقل میشود و بیشتر موارد آلودگی از طریق تماس جنسی میباشد (44). عفونت HIV بعد از یک مرحله کوتاه حاد تبدیل به سندرم مزمنی میشود که باعث کاهش لنفوسیتهای تی با شاخص CD4 میگردد که نهایتاً منجر به ایدز و افزایش خطر ابتلا به عفونتهای فرصتطلب میگردد.
غربالگری و تشخیص
توصیه CDC این است که تمام افراد 13 تا 64 سال از نظر HIV غربالگری شوند. به این افراد گفته میشود که از نظر HIV مورد غربالگری قرار خواهند گرفت مگر آنکه خودشان امتناع نمایند (46).
غربالگری وسیع HIV باعث میشود که تشخیص عفونتهای HIV سریعتر انجام شده و لذا انتشار آن محدودتر شده و امکان درمان سریع با داروهای ضدویروس را فراهم میسازد. علاوه بر این HIV یک عامل مهم عفونتهای پیش از تولد است و در آمریکا سالانه حدود 7800 نوزاد از مادران مبتلا به HIV متولد میشوند (47)، لذا CDC توصیه میکند که همه زنان باردار در ابتدای بارداری و علاوه بر آن کسانی که در معرض خطر بیشتر هستند در سه ماهه سوم هم از نظر HIV آزمایش شوند (49و48). زنان حاملهای که در آنها تست HIV مثبت باشد داروهای ضدویروس دریافت کرده و در هنگام زایمان هم تدابیر ویژهای اتخاذ میگردد تا خطر انتقال عفونت به نوزاد کاهش یابد (50).
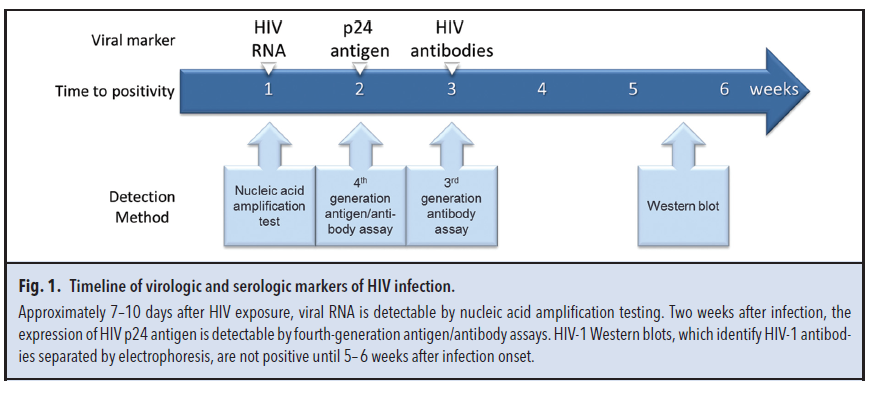
CDC اخیراً الگوریتم تشخیص آزمایشگاهی HIV را به روز کرده است. گام نخست این الگوریتم غربالگری با یک کیت نسل چهارم ایمونواسی آنتیبادی/آنتیژن است. در این روش تسـت سرولوژی برای HIV-1 و HIV-2 و همچنین آزمایـــش ویرولوژیک برای تشخیص آنتیژن HIV P24 بهطور توأمان انجام میشود. در روش سنجش نسل سوم شناسایی P24 در کار نبود، لذا آزمایش با کیت نسل چهارم دوره پنجره را برای تشخیص عفونتهای حاد از تقریباً یک ماه (با روش نسل سوم) به 15 تا 20 روز کاهش میدهد (شکل 1) (52و51). ارزیابی روش ترکیبی نشاندهنده حساسیت 89 تا 99/9 درصد و ویژگی 99/5 درصد برای تشخیص HIV شامل عفونتهای حاد میباشد (54 و 53).
آزمایشهای متعددی با تأئیدیه FDA وجود دارند که تشخیص اولیه HIV را در کمتر از 30 دقیقه میسر میکنند. بیشتر این کیتها از نسل سوم هستند. اکنون توصیه میشود که همه نتایج مثبتی که با روشهای سریع به دست میآیند از ابتدا با روش نسل چهارم تأئید گردند (55).
اگر نتیجه روش غربالگری منفی بود آزمایش بیشتر ضروری نیست. نمونههایی که نتیجه آنها مثبت است در مرحله دوم باید از نظر افتراق آنتیبادی HIV-1 و HIV-2 مورد آزمایش قرار گیرند (55). این افتراق از آن جهت اهمیت دارد که سوشهای HIV-2 بهطور طبیعی به بسیاری از داروهای آنتی رتروویرال مقاوم هستند و درمان آنها دشوار میباشد (56).
آزمایش افتراقی ایمونواسی مزایای متعددی نسبت به روش تأئیدی وسترن بلات دارد؛ از جمله این مزایا سرعت بیشتر، هزینه کمتر و تشخیص سوشهای HIV-2 میباشد.
اگر نتیجه آزمایش افتراقی منفی یا مبهم بود نمونه توسط آزمایش NAAT HIV-1 بررسی میگردد تا RNA ویروس شناسایی شود.
اگر آزمایش NAAT HIV-1 مثبت باشد نشانگر عفونت حاد HIV-1 بوده و اگر منفی باشد بیانگر واکنش مثبت کاذب در تست غربالگری میباشد (55).
درمان
درمان افراد آلوده به HIV پیچیده بوده و نیازمند پایش میزان بار ویروسی، شمــــــارش CD4 Tcell و آزمایش مقاومت HIV به داروهای آنتیرتروویرال میباشد. برای کسب اطلاعات بیشتر درخصوص درمان HIV شما را به دستورالعملهای درمان HIV ارجاع میدهیم (57).
هپاتیت ویروسی
هپاتیت توسط عوامل مختلف عفونی و غیرعفونی ایجاد میشود. هپاتیت ویروسی اغلب الگوی آسیب هپاتوسلولار دارد و در آن ASTو ALT افزایش شدید نشان میدهند (10 تا 20 برابر بالاتر از حد مرجع). علائم معمول در هپاتیت ویروسی حاد شامل بیقراری، تب، تهوع، استفراغ، زردی و ادرار تیره میباشد. ویروس هپاتیت B(HBV) از طریق تماس جنسی منتقل میشود درحالی که ویروس هپاتیت C (HCV) معمولاً از این طریق انتقال نمییابد (59 و 58)، معذلک گزارشهای اخیر از افزایش شیوع HCV در مردان همجنسگرا در اروپا و آمریکا حکایت میکنند (63-60)، لذا CDC انتقال جنسی HCV را پدیدهای نو تلقی میکند.
ویروس هپاتیت B
در کشورهای توسعه یافته انتقال جنسی مهمترین راه انتقال ویروس هپاتیت B بهحساب میآید. ویروس از طریق سطوح مخاطی که در معرض خون یا مایعات بدن آلوده قرار گرفتهاند بهراحتی منتقل میشود. عفونت با این ویروس معمولاً خودبخود بهبود مییابد، اما در معدودی از افراد بزرگسال منجر به هپاتیت مزمن، سیروز و کارسینوم هپاتوسلولار میگردد. عوامل افزایش خطر شامل ارتباط جنسی با افراد متعدد، سکس مقعدی و تزریق وریدی مواد مخدر میباشند. HBV در مناطقی از آسیای شرقی و افریقای تحت صحرا شدیداً اندمیک میباشد (8%<) در حالی که شیوع آن در آمریکا زیر 2 % است (64).
شیوع هپاتیت ویروسی در زنان حامله و غیرحامله تفاوتی ندارد (65). زنانی که در اواخر حاملگی دچار هپاتیت B شدهاند و یا اینکه ناقل مزمن آن هستند با احتمال بیشتری عفونت را به جنین منتقل میکنند که فرجام آن میتواند هپاتیت برقآسا، هپاتیت ملایم و یا هپاتیت مزمن باشد، لذا تمام زنان باردار باید در سه ماهه اولیه حاملگی از نظر هپاتیت B آزمایش شوند و اگر خطر ابتلا در آنها بالا بود، پس از زایمان هم آزمایش تکرار شود (66).
تشخیص
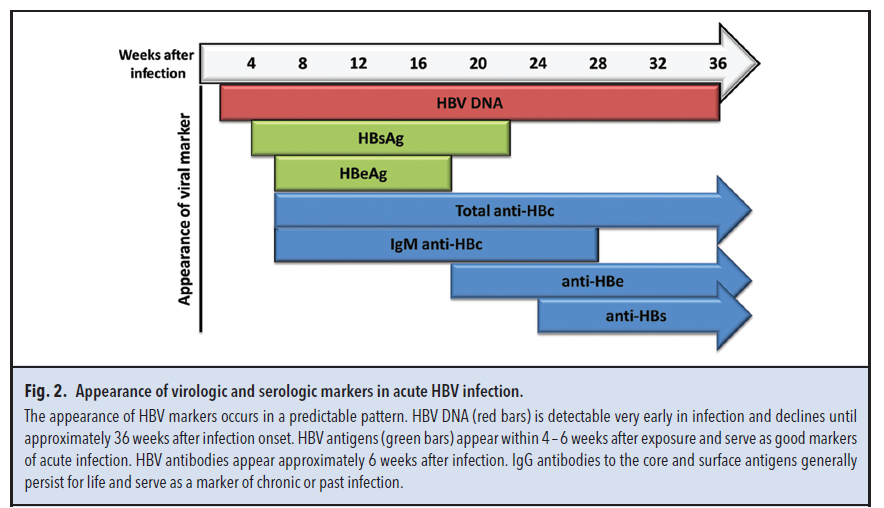
آزمایش سرولوژیک برای تشخیص HBV حاد یا مزمن به کار میرود (شکل 2). در افراد بخصوص مانند بیماران پیوندی، شاخصهای سرولوژیک در طبقهبندی خطر فعال شدن HBV بعد از سرکوب ایمنی میتوانند مفید واقع شوند. خوانندگان گرامی را برای دریافت اطلاعات بیشتر به دستورالعملهای منتشره در این مورد ارجاع میدهیم (67).
آنتیژن سطحی هپاتیت B (HBsAg) و آنتیژن (HBeAg) هفتهها تا ماهها پس از شروع عفونت در خون فرد ظاهر میشوند و احتمالا در خون فردی که دارای علائم بوده و به دنبال درمان است حضور خود را حفظ میکنند.
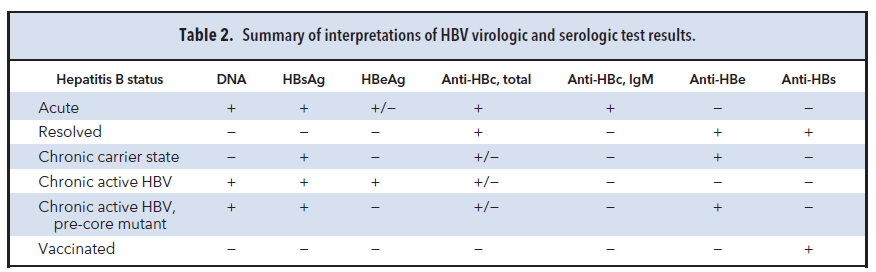
HBsAg هم در عفونت حاد و هم در عفونت مزمن وجود دارد، لذا حضور یک آنتیبادی از جنس IgM علیه آنتیژن مرکزی هپاتیت B (anti-HBc-IgM) به افتراق فرم حاد از مزمن کمک میکند (جدول 2). در عفونت حاد total anti-HBc و IgM – anti-HBc هردو مثبت هستند اما در عفونت مزمن IgM – anti-HBc منفی میباشد (جدول 2). کاهش سطح HBeAg و افزایش HBeAb نشانگر فروکش کردن مرحله حاد بیماری میباشد. در عفونت مزمن حضور همزمان HBeAg و HBV DNA بیانگر تکثیر ویروس و عفونت فعال میباشد. آنتیبادی علیه HBsAg یعنی anti-HBs در افرادی که بهبود یافتهاند مشاهده میشود و تنها آنتی بادیی است که در واکسیناسیون علیه HBV باید دیده شود.
پیشگیری
آنچه باعث کاهش شدید وقوع عفونت HBV میشود، افزایش واکسیناسیون و جلوگیری از انتقال عفونت از مادر به جنین است. کمیته مشورتی ایمنسازی (ACIP) توصیه میکند که تمام نوزادان به هنگام تولد، تمام کودکان و بالغین که قبلاً واکسینه نشدهاند و همه بزرگسالانی که قبلاً واکسینه نشدهاند و خطر ابتلا دارند باید واکسینه گردند (69و68). در سال 2010 پوشش واکسیناسیون هپاتیت B در بین افراد 19 تا 49 سال 42% و در بین پرسنل درمانی 63/2% بود که از مقدار هدفگذاری شده یعنی 90% بسیار پایینتر بود (70). علیرغم شیوع پایین آن میزان وقوع عفونت حاد HBV از سال 2000 تاکنون 62% کاهش داشته است (71).
دستورالعملهای فعلی درمان HBV در جای دیگر موردبحث قرار گرفتهاند (72).
ویروس هپاتیت C
بیش از سه میلیون نفر در آمریکا دچار عفونت مزمن HCV هستند و شیوع جهانی آن در حال افزایش میباشد. عفونت مزمن HCV پیامدهای ناگواری بهواسطه افزایش سیروز، کارسینوم هپاتوسلولار و نارسایی کبدی در پی دارد. ارتباط HCV با رفتارهای جنسی پرخطر باعث شده که CDC آن را بهعنوان یک عفونت نوظهور در میان عفونتهای انتقالیابنده از طریق تماس جنسی طبقهبندی کند (20).
ازآنجاکه واکسن مؤثری علیه HCV وجود ندارد، لذا تلاشهای فعلی بر اقدامات غربالگری و درمان مؤثر متمرکز میباشد. پیشرفتهای متعدد اخیر در این زمینه ممکن است سرانجام مبتلایان به این عفونت را بهبود بخشد.
غربالگری
در گذشته غربالگری افرادی همچون معتادان تزریقی که در معرض خطر بالای ابتلا به HCV بودند، توصیه میشد، اما باید توجه داشت که عفونت مزمن HCV اغلب بدون علامت بوده و مبتلایان ممکن است از وجود آن بیخبر باشند (73)، لذا CDC در حال حاضر توصیه میکند که همه کسانی که بین سالهای 1945 و 1965 متولد شدهاند حتی در غیاب عوامل مخاطرهآمیر حداقل یکبار مورد آزمایش قرار بگیرند. مشخص گردیده که افرادی که در این گروه سنی قرار دارند احتمال مواجههشان با HCV تقریباً شش برابر بیش از سایر گروههای سنی میباشد. (75و74).
شناسایی مبتلایان به HCV با یک آزمایش ایمونواسی آغاز میگردد که آنتیبادی ضد HCV را ده هفته پس از مواجهه با ویروس آشکار میسازد (76). روشهای Robust enzyme IAS، کمیلومینهسانس و rapid IAS برای تشخیص آنتیبادی ضد HCV برای مقاصد بالینی وجود دارند. برای اطلاع از خصوصیات عملکرد این روشها به مقالهای که توسط Kamili و همکارانش نوشته شده است مراجعه فرمایید (76).
به لحاظ تاریخی روش (RIBAS) recombinant immunoblot assay برای افتراق نتایج مثبت کاذب EIA (که در آن RIBA منفی میشود) از نتایج مثبت واقعی EIA (که در آن RIBA مثبت میشود) مورد استفاده بوده است، ولی در حال حاضر استفاده از این روش محدود شده و دیگر در امریکا در دسترس نمیباشد. در شخصی که شدیداً مشکوک به HCV است اما نتیجه تست آنتیبادی منفی است و یا کسی که تست آنتیبادی وی مثبت است، تأئید تشخیص به کمک NAAT انجام میشود که در آن RNA HCV شناسایی میگردد (77).
وقتیکه تشخیص HCV محرز شد باید ژنوتایپهای آن (زیرگروههای 1 تا 6) مشخص گردند، چرا که در انتخاب درمان مناسب تأثیرگذار خواهد بود.
درمان
درمان عفونت HCV قبلاً مبتنی بر استفاده از اینترفرون بود ولی اکنون بهسوی استفاده از داروهای ضدویروسی میل کرده است. این درمان جدید میزان پاسخ ویرولوژیک را افزایش و اثرات جانبی درمان را کاهش داده است. پزشکان سریعاً از درمان با داروهای ضدویروس استقبال کردهاند و لذا مدیریت و درمان HCV هم برای کلینیسینها و هم آزمایشگاهیان بهسرعت در حال تحول است (80-78).
ویروس پاپیلومای انسانی
بیش از 100 زیرگروه از ویروسهای پاپیلومای انسانی (HPVS) وجود دارند که میتوانند در سطوح اپیتلیال یا مخاطی انسان ایجاد عفونت نمایند. بیش از 40 تا از این زیرگروهها میتوانند عفونت دستگاه تناسلی ایجاد کنند. زیرگروه 6 و 11 اغلب همراه با زگیلهای تناسلی هستند و زیرگروههای 16، 18، 31، 33،35، 39، 45، 51، 52، 56، 58، 59، 66 و 68 با نئوپلازیهای دهانه رحم و رکتوم مرتبط میباشند (81).
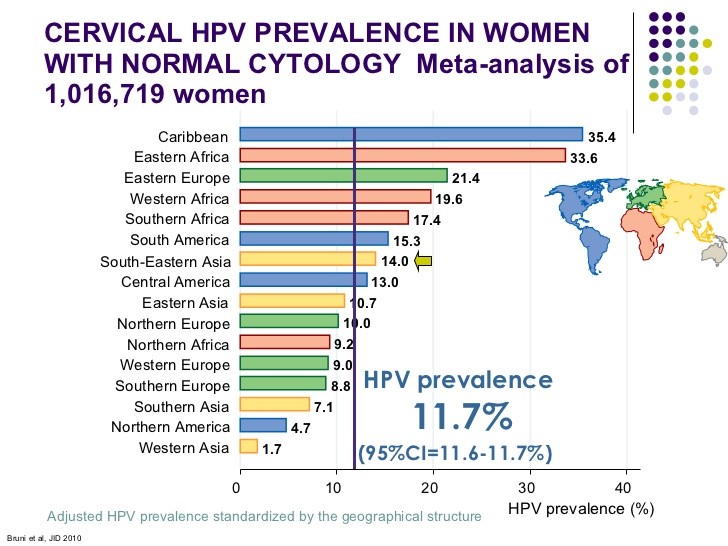
میران عفونت HPV در آمریکا و در سراسر جهان بالا بوده و در مجموع شیوع آن 10/4% برآورد میشود (82).
میزان شیوع زیرگروههای پرخطر و کمخطر هر دو در زنان زیر سی سال بیشتر میباشد (2). تقریباً سالانه نیم میلیون سرطان دهانه رحم تشخیص داده میشود. زیرگروه 16 و 18 به ترتیب در 50 و 20 درصد موارد سرطان سرویکس مشاهده میشوند (83).
عفونت با HPV معمولاً بدون علامت و خودمحدودشونده است.
اگر علامتی وجود داشته باشد ممکن است به شکل ضایعات برجسته در ناحیه تناسلی تظاهر نماید. سرطان سرویکس که از HPV نشأت میگیرد بهصورت سیتولوژی غیرطبیعی در غربالگری پاپاسمیر یا خونریزی نامنظم واژینال جلوه میکند. HPV از طریق تماس با مخاط آلوده منتشر میشود، بنابراین ارتباط جنسی واژینال و مقعدی مهمترین عوامل خطرزا در انتقال این ویروس میباشند (84).
غربالگری
وقوع سرطان سرویکس از زمان شروع غربالگری وسیع در آمریکا و سایر ممالک توسعه یافته در حال کاهش میباشد (86و85). علیرغم این کاهش، یک بررسی در سال 2012 نشان داد که 11/4% زنان در 5 سال گذشته مورد غربالگری قرار نگرفتهاند (87). غربالگری سیتولوژیک سرویکال جهت شناسایی سرطان مهاجم سرویکس از آغاز 21 سالگی توصیه میگردد. در حال حاضر غربالگری سالیانه توصیه نمیشود بلکه هر سه سال یکبار تا رسیدن به 65 سالگی انجام آزمایش غربالگری توصیه میشود. در سن 30 و بالاتر غربالگری میتواند شامل آزمایش NAAT برای زیرگروههای پرخطر HPV باشد. برای انجام آزمایش HPVمیتوان از سوابی که برای سیتولوژی بکار رفته استفاده کرد و یا یک سواب دیگر تهیه نمود و یا اینکه از باقیمانده
محلول آزمایش سیتولوژی مبتنی بر محیط مایع استفاده نمود (20). نمونه سیتولوژی لایه نازک مبتنی بر محیط مایع برای تشخیص HPV تأئیدیه FDA را دارا میباشد.
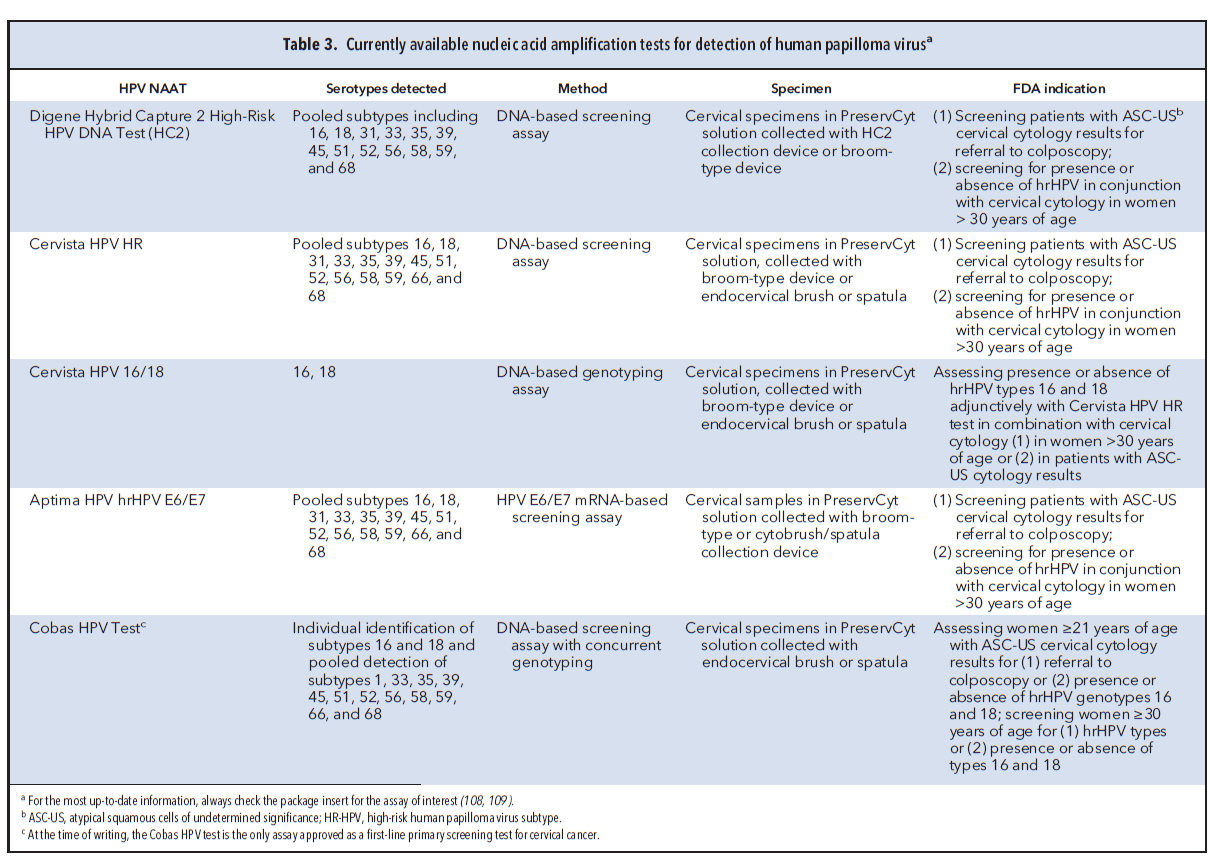
آزمایشهای NAAT HPV برای زیرگروههای انکوژنیک HPV هم دارای تأئیدیه FDA میباشند. در جدول 3 جزئیات NAATS HPV موجود قابل مشاهده میباشند. بخاطر بالا بودن NPV(negative predictive value)غربالگری همزمان، زنانی که همزمان توسط پاپ اسمیر و آزمایش HPV غربال میشوند هر 5 سال یکبار نیاز به تکرار آزمایش دارند (90،98).
پیشگیری
با انجام واکسیناسیون میتوان از سرطان سرویکس ناشی از عفونت HPV پیشگیری نمود. ACIP توصیه میکند که دختران و پسران 11 و 12 ساله با یکی از انواع واکسن HPV که در بازار هستند واکسینه شوند (91،92). این واکسنها زیرگروههای 16 و 18 را که انکوژنیک هستند پوشش میدهند و نوع چهار ظرفیتی واکسن هم وجود دارد که زیرگروه 6 و 11 را هم که عامل زگیل تناسلی هستند، در بر میگیرد. جدیداً واکسن 9 ظرفیتی هم تأیید شده که سایر زیرگروههای پرخطر که مسئول 15% از سرطانهای سرویکس میباشند را هم شامل میشود (92). واکسن 4 و 9 ظرفیتی برای استفاده در مردان تأئید شدهاند.
واکسیناسیون HPV برای نوجوانان دختر از سال 2006 و برای پسران نوجوان از سال 2011 توسط ACIP توصیه شده است، ولی تعداد افرادی که در آمریکا این واکسن را دریافت کردهاند از عدد هدف که 80% میباشد کمترند (93). اطلاعات CDC نشان میدهد که 57/3% از دختران 13 تا 17 سال حداقل یک دوز از سه دوز توصیهشده واکسن را دریافت کرده و تنها 37/6% هر سه دوز را دریافت نمودهاند. پوشش واکسن در پسران از این هم کمتر است. 34/6% یک دوز و 13/9% هر سه دوز را دریافت کردهاند (94).
واژینیت
واژینیت یکی از موارد معمول عفونت ژنیکولوژیک بهویژه در زنان در سن بارداری میباشد. مشخصه واژینیت ترشحات، خارش و بوی غیرطبیعی واژینال میباشد. در حالی که اکثر موارد واژینیت ناشی از کاندیدا است، تعداد زیادی هم ممکن است توسط عفونتهای منتقلشونده از راه تماس جنسی چون واژینوز باکتریایی و تریکوموناس ایجاد شوند.
واژینوز باکتریال
واژینوز باکتریال (BV) در اثر از بین رفتن گونههای لاکتوباسیل و رشد سایر باکتریها و به هم خوردن فلور باکتریایی طبیعی واژن ایجاد میشود (95). واژینوز باکتریایی معمولترین علت مراجعه زنان با شکایت ترشحات واژینال به پزشک میباشد. علت عدم تعادل میکربی که موجب واژینوز باکتریال میشود محل بحث و مناقشه است، اما مسلم است زنانی که دچار واژینوز باکتریال میشوند بیشتر در معرض ابتلا به سایر عفونتهای منتقله از راه تماس جنسی میباشند (97،96).
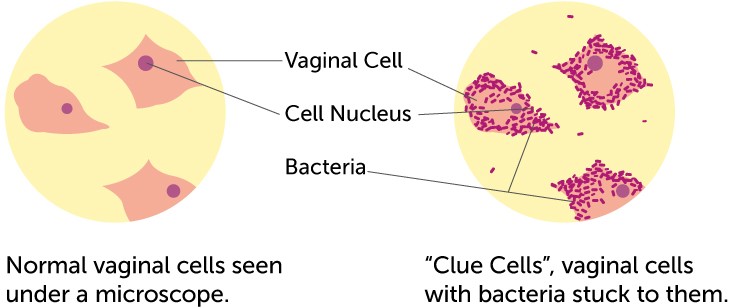
تشخیص واژینوز باکتریال با مشاهده ویژگیهایی که موسوم به Amsel Criteria میباشند محرز میگردد. این تشخیص حداقل با سه علامت یا نشانه شامل وجود سلولهای clue (اپیتلیالهای پوشیده از باکتری)، ترشحات مشخص واژینال، بوی ماهی یا PH کمتر از 4/5 ترشح محرز میگردد. اگرچه ازلحاظ تاریخی رنگآمیزی گرم ترشحات استاندارد طلایی برای تشخیص واژینوز باکتریال تلقی میگردد، ولی امروزه کمتر از آن استفاده میشود. در رنگآمیزی گرم وجود آرایش ویژه باکتریهای مولد واژینوز دیده میشود. حساسیت و ویژگی Amsel Criteria در مقایسه با رنگآمیزی گرم به ترتیب 70 و 90% است (99).
علیرغم این موضوع استفاده از خصوصیات بالینی جهت تشخیص واژینوز باکتریایی متداولتر از رنگآمیزی گرم است چرا که روش رنگآمیزی زمان، هزینه و تجربه بیشتری لازم دارد. آزمایشهای مولکولار فعلی برای تشخیص واژینوز باکتریال تصویر ناقصی از این عفونت را ارائه میدهند، چراکه بر حضور یا غیبت چند میکروارگانیسم خاص تأکید دارند و در ضمن اثبات حضور این میکروارگانیسمها برای اثبات تشخیص کافی نیست و باید با علائم بالینی مطابقت داده شود. به دلیل نقش داشتن ارگانیسمهای مختلف در واژینوز باکتری، انجام کشت کمکی به تشخیص آن نمیکند.
به لحاظ افزایش خطر ابتلا به سایر بیماریهای منتقلشونده از طریق تماس جنسی، درمان زنان علامتدار توصیه میشود. برای درمان، مترونیدازول موضعی یا خوراکی و یا کلیندامایسین موضعی استفاده میشود (20).
تریکوموناس واژینالیس
تریکومونیاسیس که مجرای اوروژنیتال را درگیر میکند توسط تکیاخته تریکوموناس واژینالیس ایجاد میشود. این بیماری از معمولترین عوامل غیرویروسی عفونتهای جنسی است که شیوع آن در زنان آمریکایی 3/1% و در زنان سیاهپوست آمریکایی 13/3% میباشد (2). گرچه در بیشتر مواقع بدون علامت است اما گاهی ترشح زرد مایل به سبز و سوزش و ناراحتی vulvar مشاهده میگردد. آلودگی با این ارگانیسم عوارض سوئی دارد و میتواند موجب زایمان زودرس، پارگی قبل از موعد کیسه آب و تولد نوزاد کموزن گردد (100).
حتی در مناطقی که شیوع بیماری بالا است، دادههای کمی دال بر ضرورت غربالگری آن وجود دارد. غربالگری تریکوموناس بهعنوان آزمایشهای قبل از تولد در زنان بدون علامت توصیه نشده است (20،103-101)، اما به لحاظ عواقب سوء آن بر روی جنین، در زنانی که علائم ابتلا وجود دارد باید آزمایشهای لازمه انجام پذیرفته و درمان مناسب به عمل آید.
آزمایشهای تشخیصی برای تریکوموناس معمولاً در جوار آزمایشهای کلامیدیا و گونوروآ انجام میشوند. تشخیص تریکوموناس در گستره مرطوب بهوسیله میکروسکوپ روشی مناسب و ارزان است و لذا انجام آن متداول میباشد. حساسیت این روش کم است و تنها 60 تا 70 درصد موارد را شناسایی میکند (104).
استاندارد طلایی برای تشخیص تریکوموناس آزمایش مولکولیNAAT است که حساسیت و ویژگی آن 95 تا 100 درصد است.
آزمایش NAAT که تأئیدیه FDA را دارد برای آزمایش نمونههای واژن، سرویکس و ادرار زنان و نیز ادرار مردان بکار میرود. برای افزایش حساسیت میتوان مواردی که آزمایش گستره مرطوب آنها منفی است را با روش NAAT پیگیری نمود (107)، علاوه بر این روش سریع آنتیژنی هم با تأئیدیه FDA وجود دارد که حساسیت آن کمتر بوده و قابلیت استفاده بر بالین بیمار را دارا میباشد.
نتیجهگیری
روشهای تشخیصی و راهکارهای درمانی برای عفونتهای جنسی بهسرعت در حال تحول میباشند. این تحولات در کنار تغییرات اپیدمیولوژیک، ایجاد داروهای جدید و پیشرفت روشهای تشخیصی منجر به تغییرات اساسی در تشخیص آزمایشگاهی و درمان بیماری میشوند. روشهای مولکولی، شخصی کردن درمان و پایش درمان را برای برخی سوشها و گونههای عفونتهای جنسی تسهیل نموده است، لذا آگاهی و درک روشهای آزمایشی برای تشخیص صحیح و بهموقع این عوامل عفونی ضرورت دارد.
منبع:
The ABCs of STIs:
An Update on Sexually Transmitted Infections
Melanie L. Yarbrough1 and Carey-Ann D. Burnham1*
Clinical Chemistry 62:6
811–823 (2016)
1 Department of Pathology and Immunology, Washington University School of Medicine,
St. Louis, MO 63110.
* Address correspondence to this author at: Department of Pathology and Immunology,
Washington University School of Medicine, 660 S Euclid Ave, Saint Louis, MO 63110.
E-mail cburnham@path.wustl.edu.
Received January 8, 2016; accepted March 11, 2016.
Previously published online at DOI: 10.1373/clinchem.2015.240234
© 2016 American Association for Clinical Chemistry
سندرم نقص ایمنی اکتسابی (ایدز)
سیفیلیس: ظهور دوبارهی یک دشمن قدیمی
برای دریافت پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام