مراحل تأئيد صلاحيت آزمايشگاه در كشور هند
دكتر محمد كريمي
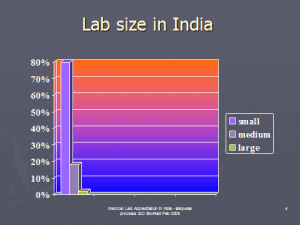
در كشور هندوستان بيش از صد هزار آزمايشگاه پزشكي وجود دارد. حدود 80% آنها كوچك، 18% متوسط و كمتر از 2% آزمايشگاه بزرگ محسوب ميگردند.
برنامه تأئيد صلاحيت در مورد آزمايشگاههاي بزرگ و متوسط كاربرد دارد،؛ چرا كه:
- آنها ميتوانند هزينه تأئيد صلاحيت را بپردازند.
- قادر به حفظ الزامات كيفي هستند.
- تحت نظارت مشاورين صاحب صلاحيت ميباشند.
- تكنولوژي پيشرفته دارند.
- از پيمانكاران خارج سازماني ميتوانند استفاده كنند.
اما با اين اوصاف آزمايشگاههاي كوچك چون قادر به تأمين هزينههاي مالي و نيروي انساني لازم نخواهند بود لذا در مواجهه با استقرار نظام تأئيد صلاحيت يكي از عواقب زير را خواهند پذيرفت:
- زيرمجموعه آزمايشگاههاي بزرگ يا متوسط گردند.
- خودشان در هم ادغام شوند و يك مجموعه بزرگ ايجاد كنند.
- و يا در صورت عدم تأئيد شدن تعطيل شوند.
آزمايشگاه پزشكي در هندوستان براي كسب صلاحيت بايد ده گام ذيل را پشت سر بگذارد:
گام اول
يك نسخه از استاندارد IS/ISO 15189 را از سازمان استانداردهاي هند تهيه كند.
گام دوم
يك نسخه از مدرك NABL – 112 را از آدرس www.nabl-india.org دانلود نمايد.
گام سوم
از سايت گوگل نمونههايي از نظامنامه كيفيت ISO 15189 براي يك بخش را دانلود كند.
گام چهارم
اصطلاحات و تعاريف بخش 3 در صفحه يك IS/ISO 15189 را مطالعه كرده و خوب درك كند.(متن ذيل) هفده اصطلاح در پاورقيهاي آن وجود دارد كه بايد به مفهوم اين اصطلاحات بينالمللي در تمامي مراحل مستندسازي توجه داشت.
|
3 اصطلاحات و تعاريف (Terms and definitions) در اين استاندارد، اصطلاحات و تعاريف زير بكار ميروند:
1-3 تأييد صلاحيت (Accreditation) روش اجرايي كه بر اساس آن يك نهاد مجاز، رسماً تشخيص ميدهد كه يك نهاد يا فرد، صلاحيت انجام وظايف خاصي را دارد.
2-3 صحت اندازهگيري (Accuracy of measurement) نزديكي توافق ميان نتيجة اندازهگيري و مقدار واقعي اندازه ده (Measurand) ميباشد.
3-3 محدودة مرجع بيولوژي (Biological reference interval) محدودة مرجع محدوده %95 مركزي توزيع مقادير مرجع ميباشد.
يادآوري 1– اين اصطلاح جايگزين اصطلاحات غلط مانند “حدود طبيعي” شده است. يادآوري 2- به طور قراردادي معمول است كه محدوده مرجع را محدوده %95 مركزي توزيع مقادير معني كنند. در موارد خاص، يك اندازه ديگر يا محل نامتقارن محدوده مرجع ميتواند مناسبتر باشد .
4-3 آزمايش (Examination) مجموعهاي از عمليات با هدف تعيين مقدار يا مشخصات يك مقوله است. يادآوري– در بعضي تخصصها (مثل ميكروب شناسي) يك آزمايش مجموعه فعاليتهايي است شامل چندين آزمون، مشاهده يا اندازهگيري
5-3 توانمندي آزمايشگاه (Laboratory capability) منابع فيزيكي، محيطي و اطلاعاتي، كاركنان، مهارتها و تجارب كه براي انجام آزمايشهاي درخواستي موجود ميباشند.
يادآوري– بازنگري توانمندي آزمايشگاه ميتواند شامل نتايج قبلي مقايسههاي بين آزمايشگاهي يا ارزيابيهاي كيفي بيروني يا اجراي برنامههاي آزمايشي آزمايشها و يا تمامي آنها، جهت تعيين عدم قطعيتهاي اندازهگيري، حدود تشخيص (Limits of detection)و غيره باشد.
6-3 رئيس آزمايشگاه (Laboratory director)
فرد يا افرادي كه صلاحيت لازم براي پذيرفتن مسئوليتها و اختيارات اداره آزمايشگاه را دارند. يادآوري1– در اين استاندارد فرد يا افراد اشاره شده مجموعاً به عنوان رئيس آزمايشگاه ناميده ميشوند. يادآوري2– در رابطه با آموزش و صلاحيت استفاده از مقررات ملي، منطقهاي و محلي مجاز است.
7-3 مديريت آزمايشگاه (Laboratory management) فرد يا افرادي كه فعاليتهاي آزمايشگاه را تحت رهبري رئيس آزمايشگاه، مديريت ميكنند.
8-3 اندازهگيري (Measurement) مجموعه عملياتي با هدف تعيين مقدار يك كميت است.
9-3 آزمايشگاه پزشكي (Medical laboratory) آزمايشگاه باليني (Clinical laboratory) آزمايشگاهي كه آزمايشهاي زيست شناسي (Biological)، ميكروب شناسي (Microbiological)، ايمني شناسي (Immunological)، شيميايي (Chemical)، ايمني- خون شناسي (Immunohaematological)، خون شناسي (Haematological)، فيزيك حياتي (Biophysical)، سلول شناسي (Cytological)، آسيب شناسي (Pathological)و ديگر آزمايشها را روي مواد به دست آمده از بدن انسان به منظور فراهم كردن اطلاعات براي تشخيص، پيشگيري و درمان بيماريها يا ارزيابي سلامت انسانها انجام ميدهد و مجاز است خدمات مشاورهاي را در تمام زمينههاي بررسي آزمايشگاهي شامل تفسير نتايج و توصيه در جهت اقدامات تشخيصي بيشتر ارائه دهد. يادآوري– اين آزمايشها همچنين شامل روشهاي اجرايي براي تعيين، اندازهگيري يا توصيف وجود يا فقدان مواد يا ريز جانـــــــداران (Micro organisms) مختلف ميباشند. تسهيلاتي كه فقط جمعآوري يا آماده سازي نمونهها و يا ارسال و توزيع آنها را بر عهده دارند به عنوان آزمايشگاه پزشكي يا باليني شناخته نميشوند ولي ميتوانند بخشي از يك سيستم يا شبكه بزرگتر آزمايشگاهي به شمار آيند.
10-3 روشهاي اجرايي بعد از آزمايش (Post -examination procedures) مرحله بعد از تجزيه (Post analytical phase) فرآيندهايي كه به دنبال آزمايش صورت ميگيرند كه شامل بازنگري، قالب بندي و تفسير، مجوزهاي صدور، گزارش و ارسال نتايج و ذخيره سازي نمونههاي آزمايش شده ميباشند.
11-3 روشهاي اجرايي قبل از آزمايش (Pre -examination procedures) مرحله قبل از تجزيه (Pre analytical phase) مراحلي كه شروع آن به ترتيب زماني از درخواست پزشك شامل درخواست رسمي آزمايش، آماده سازي بيمار، جمعآوري نمونه اوليه، انتقال نمونه به داخل آزمايشگاه ميباشد و خاتمه آن هنگامي است كه روشهاي انجام آزمايش آغاز ميشود.
12-3 نمونه اوليه (Primary sample) نمونه (Specimen) مجموعه يك يا چند جزء كه در ابتدا از يك سيستم گرفته ميشود. يادآوري– در برخي از كشورها از اصطلاح نمونه بجاي نمونه اوليه (يا قسمتي از نمونه) استفاده ميشود و آن نمونهاي است كه جهت ارسال و يا دريافت توسط آزمايشگاه به قصد انجام آزمايش تهيه ميشود.
13-3 كميت (Quantity) ويژگي يك پديده، جسم يا ماده كه بتوان آن را به طور كيفي تشخيص داد و به طور كمي مقدار آن را تعيين كرد.
14-3 سيستم مديريت كيفيت (Quality management system) سيستم مديريتي كه سازمان را بر اساس كيفيت، هدايت و كنترل ميكند.
يادآوري– در اين استاندارد،”كيفيت” به تعاريف مربوط به هر دو موضوع صلاحيت فني و مديريتي اطلاق شده است.
15-3 آزمايشگاه ارجاع (Referral Laboratory) آزمايشگاه بيروني كه نمونه براي تكميل يا تأييد روش اجرايي آزمايش و گزارش نتيجه به آنجا ارسال ميشود. (آزمايشگاههاي ارجاع با آزمايشگاههاي مرجع كه اهداف و تعاريف جداگانهاي دارند متفاوت ميباشند).
16-3 نمونه (Sample) يك يا چند جزء گرفته شده از يك سيستم كه به منظور فراهم كردن اطلاعات درباره آن سيستم بكار ميرود و اغلب اساس تصميم گيري در مورد سيستم يا محصول آن ميباشد. مثال: حجمي از سرم كه از حجم بزرگتر همان سرم، برداشته ميشود.
17-3 قابليت رديابي (Traceability) قابليت ارتباط دادن مقدار يك استاندارد يا نتيجه يك اندازهگيري با مراجع ملي يا بينالمللي، از طريق زنجيره پيوستهاي از مقايسهها كه همگي عدم قطعيت معيني دارند.
18-3 درستي اندازهگيري (Trueness of Measurement) نزديكي توافق بين ميانگين مقادير به دست آمده از نتايج چند سري اندازهگيري با مقدار واقعي آن كميت ميباشد. . 19-3 عدم قطعيت اندازهگيري (Uncertainty of measurement) پارامتري وابسته به نتيجه يك اندازهگيري كه ميزان پراكندگي مقادير را به طور منطقي در ارتباط با اندازه ده مشخص ميكند.
|
گام پنجم
تمامي 15 عبارتي كه تحت عنوان الزامات مديريت آمده است را مطالعه كرده و بخوبي درك كند.
|
4 الزامات مديريتي 1-4 سازمان و مديريت 1-1-4 آزمايشگاه پزشكي يا سازماني كه آزمايشگاه بخشي از آن است بايد از نظر قانوني قابل شناسايي باشد.
2-1-4خدمات آزمايشگاه پزشكي، شامل خدمات مشاورهاي و تفسير مناسب بايد طوري طرحريزي شود كه نيازهاي بيماران و كليه كاركنان باليني مسئول مراقبت از بيماران را برآورده كند.
3-1-4 آزمايشگاه پزشكي (كه از اين پس”آزمايشگاه”خوانده ميشود) بايد الزامات مربوط به اين استاندارد را هنگام انجام كار در محلهاي دائمي خود يا در مكانهاي ديگر كه آزمايشگاه مسئوليت آن را دارد رعايت كند.
4-1-4مسئوليتهاي كاركنان آزمايشگاه كه درگير يا تأثيرگذار بر آزمايش نمونههاي اوليه ميباشند بايد مشخص شود تا بتوان تقابل منافع را شناسايي كرد. بهتر است ملاحظات مالي و سياسي (مثل انگيزهها) روي آزمون تأثير نگذارد.
5-1-4 مديريت آزمايشگاه بايد مسئوليت طراحي، اجرا، نگهداري و بهبود سيستم مديريت كيفيت را بر عهده داشته باشد و بايد موارد زير را شامل شود: الف) پشتيباني مديريت از تمام كاركنان آزمايشگاه با دادن منابع و اختيارات مناسب كه وظايف خود راانجام دهند. ب) تمهيداتي كه اطمينان دهد مديريت و كاركنان آن از هر گونه فشار و اثرات سوء مالي و تجاري داخلي و بيروني كه ممكن است اثر نامطلوب بر كيفيت كار داشته باشند، عاري هستند. ج) خط مشيها و روشهاي اجرايي براي اطمينان از محافظت اطلاعات محرمانه. د) خط مشيها و روشهاي اجرايي كه بر اساس آن بتوان از دخالت در هر نوع فعاليتي كه باعث كاهش اعتماد به صلاحيت، بيطرفي، قضاوت و يا انسجام عملياتي شود، اجتناب كرد. ه) ساختار سازماني و مديريتي آزمايشگاه و رابطه آن با هر سازماني كه ممكن است با آن مرتبط باشد. و) مسئوليتها، اختيارات و روابط تعيين شده ميان كليه كاركنان. ز) آموزش كافي تمام كارمندان و نظارت متناسب با تجارب و سطح مسئوليت آنها توسط افراد با صلاحيت و آشنا با هدف، روشهاي اجرايي و ارزيابي نتايج روشهاي انجام آزمايش مربوطه. ح) مديريت فني كه مسئوليت كلي عمليات فني و فراهم كردن منابع موردنياز جهت حصول اطمينان از كيفيت لازم روشهاي اجرايي آزمايشگاهي را دارا باشد. ط) انتصاب يك مدير كيفيت (يا هر عنواني كه باشد) با مسئوليتها و اختيارات محول شده به وي جهت سرپرستي و اطمينان از برآوردن الزامات سيستم مديريت كيفيت كه او بايد مستقيماً به سطحي از مديريت آزمايشگاه كه تصميمها در مورد خط مشي و منابع آزمايشگاه در آن سطح گرفته ميشود، گزارش دهد. ي) تعيين جانشينهايي براي تمام كارهاي كليدي، با در نظر گرفتن اين كه در آزمايشگاههاي كوچكتر افراد ميتوانند بيشتر از يك مسئوليت كاري داشته باشند و تعيين جانشين براي هر كاري ممكن است عملي نباشد.
6-1-4 مديريت آزمايشگاه بايد اطمينان دهد كه فرآيندهاي ارتباطي مناسبي در داخل آزمايشگاه ايجاد شده است و آن ارتباط براساس اثربخشي سيستم مديريت كيفيت ميباشد.
2-4 سيستم مديريت كيفيت 1-2-4 خط مشيها، فرآيندها، برنامهها، روشهاي اجرايي و دستورالعملها بايد مستند شوند و به اطلاع كليه كاركنان مربوطه رسانده شوند. مديريت بايد مطمئن شود كه مدارك تفهيم و به اجرا گذارده ميشوند.
2-2-4 سيستم مديريت كيفيت بايد شامل كنترل كيفي داخلي و شركت در مقايسههاي بين آزمايشگاهي سازمان يافته مانند برنامههاي ارزيابي كيفي برون سازماني باشد ولي محدود به آنها نشود.
3-2-4 خط مشيها و اهداف سيستم مديريت كيفيت بايد در بيانيه خط مشي كيفيت با اختيار رياست آزمايشگاه تعيين و در نظام نامه كيفيت مستند شود. اين خط مشي بايد به آساني در دسترس كاركنان مربوطه قرار گرفته، بايد مختصر و شامل موارد زير باشد:
الف) دامنه خدمتي كه آزمايشگاه قصد ارائه آن را دارد. ب) بيانيه مديريت آزمايشگاه درباره استاندارد خدمات آن آزمايشگاه ج) اهداف سيستم مديريت كيفيت د) الزامي درباره اينكه كليه كاركنان درگير با فعاليتهاي آزمايش، خود را با مستند سازي كيفيت آشنا ساخته و خط مشيها و روشهاي اجرايي را همواره اجرا كنند. ه) تعهد آزمايشگاه نسبت به رويه حرفهاي خوب، كيفيت آزمايشهاي آن و سازگار با سيستم مديريت كيفيت و) تعهد مديريت آزمايشگاه در مورد سازگاري با اين استاندارد
4-2-4 يك نظام نامه كيفيت بايد سيستم مديريت كيفيت و ساختار مستندسازي را كه در سيستم مديريت كيفيت بكار ميرود، تشريح كند. نظامنامه كيفيت بايد شامل روشهاي اجرايي پشتيباني كننده از جمله روشهاي اجرايي فني باشد يا به آنها ارجاع دهد. نظام نامه كيفيت بايد ساختار مستند سازي در سيستم مديريت كيفيت را ارائه دهد. وظايف و مسئوليتهاي مديريت فني و مدير كيفيت شامل مسئوليت آنها در مورد حصول اطمينان از سازگاري با اين استاندارد بايد در نظام نامه كيفيت تعريف شود.
كليه كاركنان بايد براي استفاده و كاربرد نظام نامه كيفيت و كليه مدارك ارجاع شده و الزاماتي در جهت اجراي آنها، آموزش داده شوند. نظامنامه كيفيت بايد تحت مسئوليت و اختيار فردي كه توسط مديريت آزمايشگاه به عنوان مسئول كيفيت منصوب شده است به روز نگه داشته شود. ]به 5-1-4 (ط) رجوع شود[ فهرست عناوين نظام نامه كيفيت براي يك آزمايشگاه پزشكي ميتواند موارد زير باشد: الف) مقدمه ب) تعريف آزمايشگاه پزشكي، هويت قانوني، منابع و وظايف اصلي آن ج) خط مشي كيفيت د) آموزش و تحصيلات كاركنان ه) تضمين كيفيت و) كنترل مدارك ز) نگهداري و بايگاني سوابق ح) شرايط محيطي و فضاي كار ط) مديريت تجهيزات، معرفها و يا مواد مصرفي مربوطه ي) صحه گذاري روشهاي اجرايي آزمايشها ك) ايمني ل) جنبههاي زيست محيطي] به عنوان مثال: نقل و انتقال، دفع پسماندها و مواد مصرفي، به اضافه، و مجزا از موارد (ح) و (ط)[ م) تحقيق و توسعه (در صورت لزوم) ن) فهرست روشهاي اجرايي آزمايشها س) دستورالعملهاي مصوب درخواست (Request Protocols) نمونه اوليه، جمعآوري و جابجايي نمونههاي آزمايشگاهي ع) صحه گذاري نتايج ف) كنترل كيفي (شامل مقايسههاي بين آزمايشگاهي) ص) سيستم اطلاعات آزمايشگاه ق) گزارش دهي نتايج ر) رسيدگي به شكايات و اقدامات انجام شده ش) ارتباطات و ساير تعاملات با بيماران، متخصصين بهداشت، آزمايشگاههاي ارجاع و تأمين كنندگان ت) مميزيهاي داخلي ث) اصول اخلاقي (به پيوست ج رجوع شود) 5-2-4 مديريت آزمايشگاه بايد برنامهاي را ايجاد و برقرار كند كه بطور مرتب كاليبراسيون و عملكرد مناسب تجهيزات، معرفها و سيستمهاي تجزيهگر را پايش كرده و نشان دهد. همچنين بايد يك برنامه ثبت شده و مدون براي كاليبراسيون و نگهداري پيشگيرانه داشته باشد (به 2-3-5 رجوع شود) كه حداقل توصيههاي كارخانه سازنده را دنبال كند.
3-4 كنترل مدارك 1-3-4 آزمايشگاه بايد روشهاي اجرايي تعريف، مدون و نگهداري كند تا تمام مدارك و اطلاعات (اعم از منابع دروني و بيروني) كه تشكيل دهنده مستندات كيفيت آزمايشگاه ميباشند را كنترل كند. يك رونوشت از هر يك از اين مدارك كنترل شده بايد جهت مراجعه بعدي بايگاني شود و مدير آزمايشگاه بايد مدت نگهداري را تعيين كند. اين مدارك كنترل شده مجاز است در هر رسانه مناسبي نگهداري شوند اعم از كاغذي يا غير كاغذي. مقررات ملي، منطقهاي و محلي مربوط به نگهداري مدارك ميتوانند مورد استفاده قرار گيرند.
يادآوري– در اين متن”مدرك”هرگونه اطلاعات يا دستورالعمل شامل بيانيههاي خط مشي، كتابهاي درسي، روشهاي اجرايي، مشخصات، جداول كاليبراسيون، محدودههاي مرجع بيولوژيك و مآخذ آنها، نمودارها، پوسترها، اطلاعيهها، يادآوريها، نرم افزارها، نقشهها، طرحها و مدارك با منشأ بيروني مثل مقررات، استانداردها و روشهاي اجرايي آزمايش ميباشند.
2-3-4 روشهاي اجرايي بايد براي اطمينان از موارد زير بكار گرفته شوند: الف) تمام مداركي كه به عنوان جزئي از سيستم مديريت كيفيت به كاركنان آزمايشگاه ابلاغ ميشوند، قبل از صدور توسط كاركنان مجاز تأييد و بازنگري شوند. ب) فهرستي كه به آن دفترچه كنترل مدارك نيز گفته ميشود و مشخص كننده ويرايشهاي معتبر جاري و چگونگي توزيع آنها است، نگهداري شود. ج) فقط نسخههاي مجاز جاري از مدارك متناسب، جهت استفاده فعال در مكانهاي مربوطه در دسترس باشد. د) مدارك توسط كاركنان مجاز به طور ادواري بازنگري و در صورت لزوم تجديد نظر و تأييد شوند. ه) مدارك نامعتبر يا منسوخ در اسرع وقت از تمام محلهاي مورد استفاده جمعآوري شوند، در غير اين صورت اطمينان حاصل شود كه به طور ناخواسته مورد استفاده قرار نگيرند. و) مدارك منسوخ كه نگهداري يا بايگاني شدهاند به طور مناسب شناسايي شوند تا از استفاده ناخواسته آنها پيشگيري شود. ز) هرگاه در سيستم كنترل مدارك آزمايشگاه، اصلاح مدارك به صورت دستنويس تا هنگام صدور مجدد مجاز باشد، روشهاي اجرايي و مسئولين مربوطة مجاز براي انجام اين اصلاحات تعريف شوند، اصلاحات به وضوح علامت گذاري، امضاء و تاريخ گذاري شوند و يك مدرك تجديد نظر شده مجدداً در اسرع وقت به طور رسمي صادر شود. ح) روشهاي اجرايي ايجاد شوند كه چگونگي تغييرات و كنترل مداركي كه در سيستم رايانهاي نگهداري ميشوند را شرح دهد.
3-3-4 تمام مدارك مربوط به سيستم مديريت كيفيت بايد به طور انحصاري قابل شناسايي بوده كه شامل موارد زير ميباشند: الف) عنوان ب) ويرايش يا تاريخ بازنگري جاري، يا شماره بازنگري يا تمام اينها ج) تعداد صفحات (در صورت كاربرد) د) اختيار براي صدور ه) شناسه ماخذ
4-4 بازنگري قراردادها 1-4-4 هرگاه يك آزمايشگاه براي ارائه خدمات آزمايشگاهي پزشكي قراردادي را منعقد ميكند، بايد روشهاي اجرايي براي بازنگري قراردادها ايجاد و برقرار نگه دارد. خط مشيها و روشهاي اجرايي مربوط به اين بازنگريها كه منجر به تغيير در ترتيبات آزمايشها يا قراردادها ميشود بايد اطمينان دهد كه: الف) الزامات و از جمله روشهايي كه به كار خواهند رفت، به حد كفايت تعريف، تدوين و تفهيم شدهاند. (به 5-5 رجوع شود) ب) آزمايشگاه توانمندي و منابع لازم را براي برآوردن الزامات دارد. ج) روشهاي اجرايي مناسب انتخاب شده، قادرند الزامات قرارداد و نيازهاي باليني را برآورده سازند. (به 5-5 رجوع شود)
با رجوع به قسمت (ب) بازنگري توانمندي بهتر است مشخص كند كه آزمايشگاه از منابع فيزيكي، انساني و اطلاعاتي لازم برخوردار است و نيز كاركنان آزمايشگاه مهارتها و تخصصهاي لازم را براي انجام آزمايشهاي درخواست شده دارند. بازنگري همچنين ممكن است در برگيرنده نتايج شركت در برنامههاي تضمين كيفيت برون سازماني قبلي با استفاده از نمونههايي با مقادير معلوم، به منظور تعيين عدم قطعيتهاي اندازهگيري، حدود آشكارسازي، حدود اطمينان و غيره باشد.
2-4-4 سوابق بازنگريها، از جمله هرگونه تغييرات مهم و مذاكرات مرتبط بايد نگهداري شود. (به 4-13-3 رجوع شود)
3-4-4 بازنگري بايد همچنين هر كاري كه توسط آزمايشگاه، ارجاع ميشود را پوشش دهد. (به 4-5 رجوع شود) 4-4-4 مشتريان (به عنوان مثال: پزشكان باليني، سازمانهاي مراقبت بهداشتي، شركتهاي بيمه درماني، شركتهاي دارويي) بايد از هر گونه انحرافي از مفاد قرارداد آگاه شوند.
5-4-4 اگر قراردادي، پس از شروع كار نياز به اصلاح داشته باشد، در همان فرآيند بازنگري قرارداد بايد تكرار شود و هرگونه اصلاحات انجام گرفته بايد به طرفهاي ذيربط اطلاع داده شود.
5-4 آزمايش توسط آزمايشگاههاي ارجاع 1-5-4 آزمايشگاه بايد يك روش اجرايي مستند مؤثر براي ارزيابي و انتخاب آزمايشگاههاي ارجاع و همچنين مشاورين ارائه دهنده نظر مشورتي در مورد آسيب شناسي بافتي (Histopathology)، سلول شناسي (Cytology) و رشتههاي تخصصي مرتبط، داشته باشد. مديريت آزمايشگاه در صورت لزوم با استفاده از توصيه دريافت كنندگان خدمات آزمايشگاه بايد مسئول انتخاب و پايش كيفيت آزمايشگاههاي ارجاع و مشاورين باشد و بايد مطمئن شود كه آزمايشگاه يا مشاورين ارجاع، صلاحيت انجام آزمايشهاي درخواست شده را دارند.
2-5-4 هماهنگي با آزمايشگاههاي ارجاع بايد به صورت دورهاي بازنگري شود تا اطمينان دهد كه: الف) الزامات، شامل روشهاي اجرايي قبل از آزمايش و بعد از آزمايش به حد كفايت تعريف، تدوين و تفهيم شدهاند. ب) آزمايشگاه ارجاع، توانايي بر آوردن الزامات را داشته، همچنين هيچگونه تقابل منافع وجود ندارد. ج) انتخاب روشهاي اجرايي آزمايش، براي استفاده مورد نظر، مناسب ميباشند. د) مسئوليتهاي طرفين براي تفسير نتايج آزمايش به وضوح تعيين شدهاند. سوابق اين بازنگريها بايد براساس الزامات ملي، منطقهاي يا محلي نگهداري شوند.
3-5-4 آزمايشگاه بايد اسامي ثبت شده تمام آزمايشگاههاي ارجاع مورد استفاده را نگهداري كند. اسامي ثبت شده تمام نمونههايي كه به آزمايشگاه ديگري ارجاع شده است بايد نگهداري شوند. نام و نشاني آزمايشگاهي كه مسئول نتيجه آزمايش است بايد در اختيار دريافت كنندگان خدمات آزمايشگاهي قرار گيرد. دو نسخه از گزارش آزمايشگاه، يكي در سوابق بيمار و ديگري در بايگاني دائمي آزمايشگاه بايد نگهداري شود.
4-5-4 آزمايشگاه ارجاع دهنده و نه آزمايشگاه ارجاع بايد مسئول حصول اطمينان از دريافت نتايج و يافتههاي آزمايشگاه ارجاع توسط شخص درخواست كننده آزمايش باشد. اگر آزمايشگاه ارجاع دهنده، گزارش را تهيه ميكند، اين گزارش بايد شامل تمام عناصر ضروري نتايج گزارش شده توسط آزمايشگاه ارجاع باشد، بدون ايجاد تغييراتي كه بتواند در تفسير باليني اثر بگذارد. مقررات ملي، منطقهاي و محلي مجاز است بكار گرفته شود. به هر حال نيازي نيست كه گزارش آزمايشگاه ارجاع دهنده شامل تمام كلمات و ساختار گزارش آزمايشگاه ارجاع باشد، مگر اينكه قوانين يا مقررات ملي محلي، آن را الزام كرده باشد. رياست آزمايشگاه ارجاع دهنده ممكن است صلاح بداند علاوه بر آنچه كه آزمايشگاه ارجاع گزارش كرده است، نكات تفسيري اضافي در مورد بيمار و شرايط محيطي پزشكي محلي ارائه دهد. نويسنده اين نكات اضافه شده بهتر است به طور واضح مشخص شود.
6-4 تداركات و خدمات برون سازماني 1-6-4 مديريت آزمايشگاه بايد خط مشيها و روشهاي اجرايي براي انتخاب و استفاده از خدمات برون سازماني، تجهيزات و اقلام مصرفي خريداري شده تاثيرگذار بر كيفيت خدمات را تعريف و مستند كند. اقلام خريداري شده بايد همواره نيازمنديهاي كيفي آزمايشگاه را برآورده سازد. مقررات ملي، منطقهاي يا محلي ممكن است سوابق اقلام خريداري شده را الزام كند. بايد معيار و روشهاي اجرايي براي بازرسي، قبول/ رد و ذخيره سازي مواد مصرفي وجود داشته باشد.
2-6-4 تجهيزات خريداري شده و اقلام مصرفي تأثيرگذار بر كيفيت خدمات، تا زمان تصديق انطباق آنها با مشخصات استاندارد يا الزامات تعريف شده براي روشهاي اجرايي مربوطه، نبايد مورد استفاده قرار گيرند. اين امر ممكن است با انجام آزمايش روي نمونههاي كنترل كيفي و تصديق اين كه جوابها قابل قبول هستند محقق شود. مستندات انطباق تأمين كننده با سيستم مديريت كيفيت آن نيز ممكن است براي تصديق مورد استفاده قرار گيرد.
3-6-4 بايد يك سيستم كنترل موجودي براي اقلام وجود داشته باشد. سوابق كيفي مناسبي از خدمات برون سازماني، اقلام و محصولات خريداري شده بايد ايجاد و براي مدت زمان مشخصي، همان گونه كه در سيستم مديريت كيفيت تعريف شده است نگهداري شوند. اين سيستم بايد شامل سوابقي از سري ساختهاي تمام معرفهاي مربوطه، كاليبراتورها و مواد كنترلي، تاريخ دريافت در آزمايشگاه و تاريخ شروع استفاده از مواد باشد. تمامي اين سوابق كيفي بايد براي بازنگري مديريت آزمايشگاه در دسترس باشند.
4-6-4 آزمايشگاه بايد تأمين كنندگان معرفها، اقلام و خدمات داراي اهميت خاص كه بر كيفيت آزمايشها اثر ميگذارند را ارزيابي و سوابق مربوط به اين ارزيابيها و فهرست آنهايي كه مورد تأييد واقع شدهاند را نگهداري كند.
7-4 خدمات مشاورهاي كاركنان متخصص آزمايشگاه ذيربط بايد توصيه خود را در مورد انتخاب نوع آزمايشها و استفاده از خدمات شامل دفعات تكرار و نوع نمونههاي موردنياز، ارائه كنند. در موارد مقتضي، تفسير نتايج آزمايشها بايد ارائه شود. بهتر است جلسات مستند شده منظمي بين كاركنان متخصص و كاركنان باليني، در مورد استفاده از خدمات آزمايشگاه و به منظور مشاوره در مورد موضوعات علمي برقرار باشد. كاركنان متخصص بهتر است در بازديدهاي باليني (Clinical rounds)شركت كنند، تا بتوانند توصيههاي اثربخش در موارد عمومي و همچنين در موارد خاص ارائه كنند.
8-4 حل و فصل شكايات آزمايشگاه بايد خط مشي و روشهاي اجرايي براي حل و فصل شكايات يا ساير بازخوردهاي دريافت شده از پزشكان، بيماران و ديگر گروهها داشته باشد. در صورت لزوم، سوابق شكايات و رسيدگي به آنها و اقدامات اصلاحي كه توسط آزمايشگاه انجام شده است، بايد نگهداري شود. (رجوع شود به ط 4-13-3)
يادآوري– آزمايشگاهها ترغيب ميشوند كه بازخوردهاي مثبت و منفي استفاده كنندگان از خدمات آزمايشگاهي را ترجيحاً به روش نظام يافته دريافت كنند. (مثل نظرسنجيها)
9-4 شناسايي و كنترل عدم انطباقها 1-9-4 مديريت آزمايشگاه بايد خط مشي و روش اجرايي بكار گيرد كه بتواند هر گونه مغايرت بين جنبهاي از آزمايشها با روشهاي اجرايي مربوطه يا با نيازمنديهاي مورد توافق سيستم مديريت كيفيت يا پزشكان درخواست كننده را مشخص كند. اين خط مشي و روشهاي اجرايي بايد اطمينان دهند كه: الف) كاركنان مسئول براي حل مشكل تعيين ميشوند. ب) اقداماتي كه قرار است انجام شود معين ميشوند. ج) اهميت پزشكي آزمايشهاي نامنطبق در نظر گرفته شده و در موارد مقتضي پزشك درخواست كننده مطلع ميشود. د) در صورت لزوم آزمايشها متوقف شده و از ارسال گزارشها جلوگيري ميشود. ه) اقدام اصلاحي سريعاً انجام ميگيرد. و) در صورت لزوم نتايج آزمايشهاي نامنطبق گزارش داده شده، فراخوان و يا به طور مناسب شناسايي ميشوند. ز) مسئوليت اجازه شروع مجدد آزمايشها تعيين ميشود . ح) هر جزء از عدم انطباق مستند و ثبت ميشود، با استفاده از اين سوابق كه در دورههاي زماني مشخص و منظم توسط مديريت آزمايشگاه بازنگري شده است، جهتگيريها معلوم و اقدام پيشگيرانه آغاز ميشود.
يادآوري– فعاليتها يا آزمايشهاي نامنطبق در زمينههاي مختلف بسياري واقع ميشود و ميتواند به روشهاي بسيار متفاوتي شناسايي شوند، شامل شكايات پزشكان، شاخصهاي كنترل كيفي، كاليبراسيون تجهيزات، بررسي مواد مصرفي، پيشنهادات كاركنان، بررسي گزارش و گواهينامه، بازنگريهاي مديريت آزمايشگاه و مميزيهاي داخلي و برون سازماني.
2-9-4 اگر مشخص شود كه آزمايشهاي نامنطبق ميتوانند تكرار شوند يا آن كه شكي در مورد سازگاري آزمايشگاه با خط مشي و روشهاي اجرايي مندرج در نظام نامه كيفيت وجود دارد، بايد فوراً روشهاي اجرايي براي شناسايي، مستند سازي و حذف علل ريشهاي اجرا شود. (رجوع شود به 4-10) 3-9-4 در صورت وقوع عدم انطباقها، آزمايشگاه بايد روشهاي اجرايي جهت صدور نتايج، تعريف و اجرا كند، كه شامل بازنگري اين گونه نتايج باشد. اين رويدادها بايد ثبت شوند.
10-4 اقدام اصلاحي 1-10-4 روشهاي اجرايي براي اقدام اصلاحي بايد شامل فرآيند بررسي جهت تعيين علت يا علل زيربنايي مشكل باشد. اين بررسيها بايد برحسب تناسب به اقدامات پيشگيرانه منجر شود. اقدام اصلاحي بايد متناسب با اندازه مشكل و خطرات احتمالي باشد.
2-10-4 مديريت آزمايشگاه بايد هرگونه تغييرات موردنياز براي روشهاي اجرايي عملياتي حاصل از بررسيهاي اقدامات اصلاحي را مستند و اجرا كند.
3-10-4 مديريت آزمايشگاه بايد نتايج هرگونه اقدام اصلاحي صورت گرفته را پايش كند، تا اطمينان حاصل شود كه آنها براي فائق آمدن بر مشكلات مشخص شده، مؤثر بودهاند.
4-10-4 هرگاه شناسايي عدم انطباق يا بررسي اقدام اصلاحي ترديدي در سازگاري با خط مشيها و روشهاي اجرايي يا سيستم مديريت كيفيت ايجاد كند، مديريت آزمايشگاه بايد اطمينان يابد كه حوزههاي كاري مربوطه طبق بند 4-14 مميزي ميشوند. نتايج اقدامات اصلاحي بايد براي بازنگري به مديريت آزمايشگاه ارائه شوند.
11-4 اقدام پيشگيرانه 1-11-4 موارد نيازمند بهبود و منشأهاي بالقوه عدم انطباقها، اعم از فني يا مربوط به سيستم مديريت كيفيت بايد شناسايي شوند. در صورتي كه اقدام پيشگيرانهاي ضروري باشد بايد برنامههايي براي اين اقدام تهيه، اجرا و پايش شود تا احتمال بروز اين عدم انطباقها كاهش يابد و از فرصتهاي پيش آمده براي بهبود بخشيدن استفاده شود.
2-11-4 روشهاي اجرايي براي اقدامات پيشگيرانه، بايد شامل مبادرت به انجام اين اقدامات و اعمال كنترل براي حصول اطمينان از اثربخشي آنها باشد.
يادآوري 1– اقدام پيشگيرانه علاوه بر بازنگري روشهاي اجرايي عمليات، ممكن است مستلزم تحليل دادهها نيز باشد كه شامل تحليل روند و مخاطرات و نتايج آزمون كفايت تخصصي ميشود.
يادآوري 2– اقدام پيشگيرانه به جاي آن كه واكنشي نسبت به شناسايي اشكالات يا شكايات باشد فرآيندي است كه از پيش براي شناسايي فرصتهاي بهبود انجام ميشود.
12-4 بهبود مداوم 1-12-4 تمام روشهاي اجرايي عملياتي بايد در فواصل زماني معين توسط مديريت آزمايشگاه به طور نظاممند، همانطور كه در سيستم مديريت كيفيت تعريف شده است، بازنگري شود تا هرگونه منشأ بالقوه عدم انطباق يا ديگر فرصتهايي كه براي بهبود در سيستم مديريت كيفيت و يا فعاليتهاي فني وجود دارد شناسايي شود. برنامههاي اجرايي براي بهبود بايد به نحو مقتضي ايجاد و تكوين، مستند و اجرا شوند.
2-12-4 بعد از اقدام منتج از بازنگري به عمل آمده، مديريت آزمايشگاه بايد اثربخشي اقدام را از طريق بازنگري متمركز يا مميزي در حوزه مورد نظر ارزيابي كند.
3-12-4 نتايج اقدام پس از بازنگري، بايد به مديريت آزمايشگاه براي بازنگري و اجراي هر گونه تغييرات موردنياز در سيستم مديريت كيفيت ارائه شود.
4-12-4 مديريت آزمايشگاه بايد شاخصهاي كيفي را براي پايش و ارزيابي نظاممند مشاركت آزمايشگاه در مراقبت از بيمار استقرار دهد. وقتي اين برنامه، فرصتهاي بهبود را شناسايي كرد، مديريت آزمايشگاه بدون در نظر گرفتن محل وقوع، بايد آنها را اعمال كند. مديريت آزمايشگاه بايد اطمينان يابد كه آزمايشگاه پزشكي در فعاليتهاي بهبود كيفي كه با حوزههاي مرتبط و نتايج مراقبت از بيمار سر و كار دارند، شركت ميكند.
5-12-4 مديريت آزمايشگاه بايد دسترسي به فرصتهاي مناسب تحصيلي و آموزشي را براي همه كاركنان آزمايشگاه و استفاده كنندگان مرتبط از خدمات آزمايشگاهي فراهم كند.
13-4 سوابق فني و كيفيت 1-13-4 آزمايشگاه بايد روشهاي اجرايي را براي شناسايي، جمعآوري، فهرست كردن، دسترسي، ذخيره سازي، نگهداري و وارهايي ايمن سوابق كيفيت و فني برقرار و اجرا كند.
2-13-4 كليه سوابق بايد خوانا بوده و طوري ذخيره شوند كه به آساني قابل بازيابي باشند. سوابق ممكن است روي هر واسط مناسبي بنابر الزامات قانوني ملي، منطقهاي يا محــــــــــــــلي نگهداري شود (رجوع شود به يادآوري 4-3-1) تسهيلات بايد محيط مناسبي را براي جلوگيري از آسيب، خرابي، مفقود شدن يا دسترسي غيرمجاز فراهم كند.
3-13-4 آزمايشگاه بايد خط مشي براي تعيين مدت زمان نگهداري سوابق مختلف مربوط به سيستم مديريت كيفيت و نتايج آزمايشها داشته باشد. مدت نگهداري بايد براساس ماهيت آزمايش يا براي هر يك از سوابق به طور خاص تعيين شود. مقررات ملي، منطقهاي و محلي مجاز است به كار گرفته شوند. اين سوابق ممكن است شامل موارد زير ولي نه محدود به آنها باشد: الف) فرمهاي درخواست (شامل نمودار بيمار يا سابقه پزشكي فقط در صورتي كه به عنوان فرم درخواست استفاده شوند). ب) نتايج آزمايش و گزارشها ج) خروجيهاي چاپي تجهيزات د) روشهاي اجرايي آزمايش ه) برگهها يا دفترچههاي كار آزمايشگاه و) سوابق پذيرش ز) فعاليتهاي كاليبراسيون و ضرايب تبديل ح) سوابق كنترل كيفيت ط) شكايات و اقدامات انجام شده ي) سوابق مميزيهاي داخلي و برون سازماني ك) سوابق ارزيابي كيفي برون سازماني/ مقايسههاي بين آزمايشگاهي ل) سوابق بهبود كيفيت م) سوابق نگهداري تجهيزات، شامل سوابق كاليبراسيون داخلي و برون سازماني ن) مدارك مربوط به هر سري از اقلام، گواهيهاي اقلام، برگههاي ضميمه بستهها س) سوابق اتفاقات/ حوادث و اقدامات انجام شده ع) سوابق آموزشي و صلاحيت كاركنان
14-4 مميزيهاي داخلي 1-14-4 به منظور تصديق آنكه عمليات همچنان سازگار با الزامات سيستم مديريت كيفيت ميباشد، مميزيهاي داخلي كليه عناصر سيستم اعم از فني و مديريتي بايد در فواصل زماني تعيين شده توسط خود سيستم انجام شود. مميزي داخلي بايد به طور پيشرونده اين عناصر را مورد توجه قرار دهد و بر حوزههايي كه براي مراقبت بيمار اهميت حياتي دارد، تأكيد كند.
2-14-4 مميزيها بايد توسط مدير كيفيت يا كاركنان واجد شرايط منتخب وي، به طور رسمي برنامه ريزي، سازمان دهي و انجام شوند. كاركنان نبايد فعاليتهاي خود را مميزي كنند. روشهاي اجرايي براي مميزيهاي داخلي بايد تعريف شده و مستند باشند و شامل انواع مميزي، تعداد انجام آنها، روشهاي كار و مدارك مورد نياز باشند. در صورت ملاحظة كمبودها يا فرصتهاي بهبود آزمايشگاه بايد اقدامات پيشگيرانه يا اصلاحي مناسب را در محدودة زماني مورد توافق مستند كند و به اجرا در آورد. عناصر اصلي سيستم مديريت كيفيت به طور معمول بهتر است هر دوازده ماه يك بار مورد مميزي داخلي قرار گيرند.
3-14-4 نتايج مميزيهاي داخلي براي بازنگري بايد به مديريت آزمايشگاه تحويل داده شود.
15-4 بازنگري مديريت 1-15-4 مديريت آزمايشگاه به منظور حصول اطمينان از تداوم مناسب و اثربخش پشتيباني از مراقبت بيمار و مطرح كردن هرگونه تغيير يا بهبود لازم، بايد سيستم مديريت كيفيت آزمايشگاه و كليه خدمات پزشكي مربوطه، شامل آزمايش و فعاليتهاي مشاورهاي را بازنگري كند. نتايج بازنگري بايد به شكل طرحي در آيد كه دربرگيرندة اهداف، مقاصد و برنامههاي اجرايي باشد. يك دوره معمول براي اجراي بازنگري مديريت، هر دوازده ماه يك بار است. 2-15-4 بازنگري مديريت بايد دربرگيرنده موارد زير، ولي نه محدود به آنها، باشد: الف) پيگيري بازنگريهاي مديريت قبلي ب) وضعيت اقدامات اصلاحي انجام گرفته و اقدام پيشگيرانه لازم ج) گزارشهاي دريافت شده از كاركنان مديريتي و سرپرستي د) نتيجه مميزيهاي داخلي اخير ه) ارزيابيهاي انجام گرفته بوسيله سازمانهاي بيروني و) نتايج ارزيابيهاي كيفي برون سازماني و ساير انواع مقايسههاي بين آزمايشگاهي ز) هرگونه تغيير در حجم و نوع كار انجام شده ح) بازخورد، شامل شكايات و ساير عوامل مرتبط از پزشكان، بيماران و ساير طرفها ط) شاخصهاي كيفي براي پايش مشاركت آزمايشگاه در رابطه با مراقبت از بيمار ي) عدم انطباقها ك) پايش زمان گردش كار ل) نتايج فرآيندهاي بهبود مداوم م) ارزيابي تأمين كنندگان
به هنگام استقرار سيستم مديريت كيفيت فواصل زماني بين بازنگريها بهتر است كوتاهتر در نظر گرفته شود، اين امر امكان انجام اقدام سريع در پاسخ به حوزههاي شناسايي شده نيازمند اصلاح در سيستم مديريت كيفيت يا ساير فعاليتها را ميسر خواهد كرد.
3-15-4 كيفيت و مناسب بودن مشاركت آزمايشگاه در مراقبت از بيمار تا حد امكان بايد هدفمندانه ارزيابي و پايش شود.
يادآوري– دادههاي موجود بنا بر نوع آزمايشگاه يا محل آن تفاوت ميكند (مثل بيمارستان، درمانگاه يا آزمايشگاه ارجاع)
4-15-4 يافتهها و اقدامات حاصل از بازنگري مديريت بايد ثبت و كاركنان آزمايشگاه بايد از اين يافتهها و تصميمات اتخاذ شده به عنوان نتايج بازنگري مطلع شوند. مديريت آزمايشگاه بايد مطمئن شود كه اقدامات مطرح شده در مدت زمان توافق شده و مناسب اجرا شده است.
|
گام ششم
تمامي 8 عبارت مربوط به الزامات فني را مطالعه و درك نمايد
| 5 الزامات فني
5-1 كاركنان 1-1-5 مديريت آزمايشگاه بايد داراي يك طرح سازماني، خط مشي و شرح شغل كاركنان باشد كه صلاحيت و مسئوليتهاي تمام آنان را تعريف كند.
2-1-5 مديريت آزمايشگاه بايد سوابق مدارك مرتبط تحصيلي و حرفهاي، آموزش و تجربه و صلاحيت تمام كاركنان را نگهداري كند. اين اطلاعات بايد به سهولت در دسترس كاركنان مربوطه قرار گيرد و ممكن است شامل موارد زير باشد:
الف) گواهينامه يا پروانه كار، در صورت لزوم ب) سوابق (References) شغلي قبلي ج) شرح شغل د) سوابق آموزشهاي مداوم و دستاوردها ه) ارزيابي صلاحيتها و) قيد اتفاقات ناخواسته يا گزارش حوادث ساير سوابق مرتبط با سلامتي كاركنان كه قابل دسترسي براي افراد مجاز ميباشد، ميتواند شامل سوابق مواجهه با خطرات شغلي و ايمن سازي آنان باشد.
3-1-5 آزمايشگاه بايد توسط شخص يا اشخاصي اداره شود كه مسئوليت اجرايي داشته و صلاحيت بر عهده گرفتن مسئوليت خدماتي كه ارائه ميشوند را دارا باشند.
يادآوري– در اين جا صلاحيت به مفهوم نتيجه حاصل از تحصيلات دانشگاهي پايه، تحصيلات تكميلي و مستمر، همچنين آموزش و تجربه سالهاي متمادي در آزمايشگاه پزشكي ميباشد.
4-1-5 مسئوليتهاي رئيس آزمايشگاه يا افراد منتخب بايد شامل موارد حرفهاي، علمي، مشاورهاي يا راهنماييهاي سازماني، اداري و آموزشي باشد. اين موارد بايد در ارتباط با خدماتي كه آزمايشگاه ارائه ميدهد باشند. رئيس آزمايشگاه يا افراد منتخب براي هر وظيفه بهتر است آموزش و سابقه مناسب داشته باشند تا بتوانند مسئوليتهاي زير را انجام دهند: الف) ارائه راهنمايي به كساني كه خواهان اطلاعاتي درباره انتخاب آزمايشها، استفاده از خدمات آزمايشگاه و تفسير دادههاي آزمايشگاه هستند. ب) در موارد مقتضي و مرتبط، انجام وظيفه به عنوان يك عضو (اعضاء) فعال از كاركنان پزشكي به آنهايي كه خدمات ارائه ميشود. ج) ايجاد ارتباط و عملكرد مؤثر (در صورت لزوم با تنظيم قرارداد)، با: -1 نمايندگيهاي قانون گذاري و اعتبار بخشي مربوطه -2 مأموران اداري مربوطه -3 جامعه ارائه دهنده مراقبتهاي بهداشتي -4 جمعيت بيماران دريافت كننده خدمات د) تعريف، اجرا و پايش استانداردهاي عملكرد و بهبود كيفيت خدمت يا خدمات آزمايشگاه پزشكي ه) استقرار سيستم مديريت كيفيت (برحسب نياز، رئيس و كاركنان حرفهاي آزمايشگاه بهتر است به عنوان اعضاي انجمن و كميتههاي مختلف بهبود كيفيت مشاركت كنند) و) پايش تمام كارهايي كه به منظور توليد دادههاي قابل اعتماد در آزمايشگاه انجام ميشوند. ز) اطمينان از وجود تعداد كافي كاركنان واجد شرايط با آموزش و تجربه كافي مستند شده، كه بتوانند نيازهاي آزمايشگاه را برآورده سازند. ح) برنامه ريزي، هدف گذاري، توسعه و تخصيص منابع متناسب با محيط پزشكي ط) فراهم نمودن ساختار اداري كارا و اثربخش خدمات آزمايشگاه پزشكي شامل برنامهريزي و كنترل بودجه با مديريت مالي پاسخگو، هماهنگ با وظايف سازماني همان مسئوليتها ي) ارائه برنامههاي آموزشي براي كاركنان پزشكي و آزمايشگاهي و مشاركت در برنامههاي آموزشي سازمان ك) برنامه ريزي و هدايت تحقيق و توسعه، متناسب با امكانات ل) انتخاب و پايش تمام آزمايشگاههاي ارجاع، از نظر كيفيت خدمات م) استقرار يك محيط ايمن آزمايشگاهي براساس روش كاري مناسب و مقررات قابل اجرا ن) توجه و رسيدگي به هر نوع شكايت، درخواست يا پيشنهاد از طرف استفاده كنندگان از خدمات آزمايشگاه س) اطمينان از روحيه خوب كاركنان
رئيس آزمايشگاه نيازي نيست كه تمام مسئوليتها را شخصاً انجام دهد. اگر چه رئيس آزمايشگاه همواره مسئول كليه عمليات و مديريت آزمايشگاه به منظور اطمينان از كيفيت خدمات ارائه شده به بيماران ميباشد.
5-1-5 بايد منابع انساني كافي و مناسب براي انجام كارهاي موردنياز و فعاليتهاي ديگر مربوط به سيستم مديريت كيفيت مهيا باشد. 6-1-5 كاركنان بايد آموزشهايي مختص به تضمين كيفيت و مديريت كيفيت در رابطه با خدمات ارائه شده ببينند. 7-1-5 مديريت آزمايشگاه بايد به كاركنان براي انجام وظايف خاص تفويض اختيار كند كه شامل نمونهگيري، آزمايش و به كار بردن انواعي از دستگاههاي خاص از جمله استفاده از رايانهها در سيستم اطلاعاتي آزمايشگاه نيز ميشود. (به پيوست ب رجوع شود).
8-1-5 خط مشيهايي بايد ايجاد شود كه تعيين كند، چه كساني مجاز هستند از سيستم رايانه استفاده كنند، چه كساني مجاز هستند به دادههاي مربوط به بيمار دسترسي داشته باشند و به چه كساني اختيار وارد كردن و يا تغيير نتايج مربوط به بيمار، اصلاح صورتحسابها يا تغيير برنامههاي رايانهاي داده شده است (به پيوستهاي ب و ج رجوع شود).
9-1–5 بايد يك برنامه آموزشي مداوم براي كاركنان در تمام سطوح فراهم شود.
10-1-5 كاركنان بايد جهت جلوگيري از اتفاقات نامطلوب يا محدود كردن اثرات آنها آموزش ببينند.
11-1-5 صلاحيت هر فرد در انجام وظايف محوله پس از دريافت آموزش و بعد از آن بصورت ادواري بايد مورد ارزيابي قرار گيرد. در زمان مقتضي آموزش و ارزيابي مجدد بايد انجام شود.
12-1-5 كاركناني كه قضاوتهاي تخصصي در رابطه با آزمايشها انجام ميدهند بايد سابقه نظري و عملي مربوطه و همچنين تجربه روزآمد داشته باشند. قضاوتهاي تخصصي ميتواند به صورت نظرات، تفسيرها، پيشبينيها، شبيه سازيها و الگوها و مقادير ابراز شوند و بهتر است مطابق مقررات ملي، منطقهاي و محلي باشند. كاركنان بايد در پيشرفتهاي تخصصي يا ساير ارتباطات حرفهاي به صورت منظم شركت كنند.
13-1-5 اصل محرمانه بودن اطلاعات مربوط به بيماران بايد توسط تمام كاركنان رعايت شود.
2 -5 شرايط محيطي و فضاي كار 1-2-5 آزمايشگاه بايد فضايي در اختيار داشته باشد كه كارها بدون ايجاد خلل در كيفيت آنها، روشهاي اجرايي كنترل كيفيت، ايمني كاركنان يا خدمات مراقبت از بيماران در آنجا بتواند انجام شود. رياست آزمايشگاه بايد كفايت فضاي كاري آزمايشگاه را تعيين كند. منابع بايد در حد موردنياز براي پشتيباني از فعاليتهاي آزمايشگاه باشد. منابع آزمايشگاه بايد در شرايط عملي و كاركردي مطمئن نگهداري شوند . پيش بينيهاي مشابهي بهتر است براي جمعآوري نمونه اوليه و آزمايشها در مكانهايي به جز محل دائمي آزمايشگاه اعمال شود.
2-2-5 آزمايشگاه بايد به منظور كارآ بودن عمليات و تأمين حداكثر آسايش براي شاغلين و حداقل صدمات و بيماريهاي ناشي از كار، طراحي شده باشد. بيماران، كاركنان و ملاقات كنندگان بايد از خطرات شناخته شده محافظت شوند.
3-2-5 وقتي كه امكانات جمعآوري نمونههاي اوليه وجود دارد، علاوه بر شرايط بهينه جمعآوري نمونههاي اوليه بايد ملاحظاتي براي ناتوانيهاي بيماران، راحتي و حريم خصوصي آنها در نظر گرفته شود.
4-2-5 طراحي و محيط آزمايشگاه بايد متناسب با فعاليتهايي باشد كه در آنجا انجام ميشود. محيطي كه در آن جمعآوري نمونههاي اوليه يا آزمايشها و يا هر دو انجام ميشود نبايد به گونهاي باشد كه نتايج آزمايشها را بياعتبار كند، يا بر كيفيت موردنياز اندازه گيريها اثر سوء بگذارد. تسهيلات آزمايشگاهي براي آزمايشها، بهتر است انجام آنها را به نحو صحيح ميسر سازد. اينها شامل ولي نه محدود به منابع انرژي، نور، تهويه، آب، امكانات براي دفع زباله و ضايعات و شرايط محيطي ميشوند. آزمايشگاه بهتر است روشهاي اجرايي جهت بررسي عدم تأثير سوء محيط بر عملكرد تجهيزات و جمعآوري نمونه داشته باشد.
5-2-5 آزمايشگاه بايد شرايط محيطي را برحسب نياز با توجه به مشخصات مربوطه و يا در جايي كه امكان تأثير بر كيفيت نتايج وجود داشته باشد، پايش، كنترل و ثبت كند. به مواردي چون استريل بودن، گرد و غبار، اثرات الكترومغناطيس، تشعشع، رطوبت، تامين برق، ميزان دما، صدا و ارتعاشات بهتر است توجه شود تا متناسب با فعاليتهاي فني مربوطه باشند.
6-2-5 بايد جداسازي مؤثر بين بخشهاي آزمايشگاه كه در جوار يكديگرند و فعاليتهاي ناهمخوان دارند انجام شود. اقداماتي بايد صورت گيرد تا از آلودگي متقابل (Cross- Contamination)جلوگيري شود. مثال: جايي كه روشهاي آزمايش ايجاد خطر ميكنند (مايكوباكتريولوژي (Mycobacteriolog)، راديونوكلئيد (Radionuclides)، و غيره)، جايي كه عدم جداسازي ميتواند بر فعاليتها تأثير بگذارد، مانند تكثير اسيد نوكلئيك (Nucleic acid)، وقتي محيطي لازم است كه موجبات آرامش و انجام كار بدون وقفه را فراهم سازد مانند آزمايش آسيب شناسي سلولي (Cytopathology screening)، يا زماني كه كار نياز به شرايط محيطي كنترل شده دارد مانند سيستمهاي بزرگ رايانهاي.
.7-2-5دسترسي و استفاده از فضاهايي كه بر كيفيت آزمايشها اثر ميگذارند بايد تحت كنترل باشند. اقدامات مناسب بايد صورت گيرد تا نمونهها و منابع از دسترسي غيرمجاز حفاظت شوند.
8-2-5 سيستمهاي ارتباطي در آزمايشگاه بايد متناسب با اندازه و پيچيدگي امكانات آزمايشگاه باشند و انتقال پيامها را به طور مؤثر ميسر سازند.
9-2-5 شرايط و فضاهاي ذخيره سازي مربوطه بايد به نحوي باشد كه از يكپارچگي مداوم نمونهها، اسلايدها، بلوكهاي بافت شناسي (Histology blocks)، ريزجانداران (Micro-organisms)نگهداري شده، مدارك، پروندهها، سيستم نامهها، تجهيزات، معرفها، ملزومات آزمايشگاه، سوابق و نتايج، اطمينان حاصل شوند.
10-2-5 فضاهاي كاري بايد تميز و درست نگهداري شوند. نگهداري و دفع مواد خطرزا بايد به وسيله مقررات مربوطه مشخص شود.
اقداماتي بايد انجام گيرد تا از كاخداري (Housekeeping) خوب آزمايشگاه اطمينان حاصل شود. براي رسيدن به اين نتيجه روشهاي اجرايي خاص و آموزش كاركنان ممكن است لازم باشد.
3-5 تجهيزات آزمايشگاه يادآوري– در اين استاندارد، تجهيزات آزمايشگاه، بر حسب كاربرد شامل لوازم، مواد مرجع، مواد مصرفي، معرفها و سيستمهاي تجزيهگر ميشود.
1-3–5 آزمايشگاه بايد به تمام لوازم ضروري كه براي ارائه خدمات پيشبيني شده است مجهز شود (شامل جمعآوري نمونه اوليه، آماده سازي و فرآوري نمونه، انجام آزمايش و ذخيره سازي) در مواردي كه آزمايشگاه نياز به استفاده از تجهيزاتي خارج از كنترل دائمي خود دارد، مديريت آزمايشگاه بايد اطمينان يابد كه الزامات اين استاندارد برآورده شدهاند. هنگام انتخاب تجهيزات، بهتر است مصرف انرژي و امحاء آن در آينده مورد توجه قرار گيرد (حفاظت محيط زيست). 2-3 -5 بايد مشخص شود كه تجهيزات (به محض نصب و استفاده روزمره) از عملكرد لازم برخوردار بوده و با مشخصات آزمايشهاي مربوطه مطابقت دارد. مديريت آزمايشگاه بايد برنامهاي را ايجاد كند كه صحيح بودن كاليبراسيون و عملكرد لوازم، معرفها و سيستمهاي تجزيهگر را به طور منظم پايش كرده و نشان دهد. همچنين بايد يك برنامه ثبت شده و مدون براي نگهداري پيشگيرانه (رجوع شود به 4-2-5) داشته باشد كه حداقل توصيههاي كارخانه سازنده را دنبال كند. زماني كه دستورالعملهاي كارخانه سازنده، كتابچه راهنماي كاربران و يا ساير مدارك در دسترس باشند، مجاز است بر حسب تناسب براي برآوردن تمام يا بخشي از اين الزام از آنها در جهت انطباق با استانداردهاي مربوطه يا تعيين الزامات كاليبراسيون دورهاي استفاده شود.
3-3-5 هر يك از تجهيزات بايد به طور انحصاري برچسب زده، علامتگذاري شده يا به گونه ديگري شناسايي شود.
4-3-5 سوابق هر يك از تجهيزات مؤثر بر انجام آزمايشها بايد نگهداري شود. اين سوابق بايد حداقل شامل موارد زير باشند: الف) شناسه دستگاه ب) نام كارخانه سازنده، شناسه نوع و شماره سريال يا ساير مشخصههاي انحصاري ج) فرد رابط با كارخانه سازنده و شماره تلفن او در صورت لزوم د) تاريخ دريافت و تاريخ آغاز بهره برداري ه) محل استقرار فعلي، در صورت لزوم و) شرايط در زمان دريافت (به عنوان مثال، نو، كار كرده يا تعمير شده) ز) دستورالعملهاي كارخانه سازنده در صورت دسترسي، يا ارجاع به محل نگهداري آنها ح) سوابق كاركرد تجهيزات كه قابل استفاده بودن آنها را تأييد كند ط) سرويس و نگهداري انجام شده و برنامه ريزي آينده آن ي) خرابي و نقص كاركرد، تغيير يا تعمير تجهيزات ك) پيشبيني تاريخ جايگزيني، در صورت امكان
سوابق كاركرد اشاره شده در بند (ح) بهتر است شامل رونوشت گزارشها/ گواهينامه تمام كاليبراسيونها و/ يا تصديقهايي كه داراي تاريخ ، زمان و نتايج تنظيمها، معيارهاي پذيرش و تاريخ مقرر كاليبراسيون بعدي و/ يا تصديق، به همراه دفعات بازرسيهاي انجام شده در فواصل نگهداري /كاليبراسيون باشد تا برحسب تناسب تمام يا قسمتي از اين الزام را برآورده سازد. دستورالعملهاي كارخانه سازنده مجاز است براي ايجاد معيارهاي پذيرش، روشهاي اجرايي و دفعاتي كه نگهداري يا كاليبراسيون يا هر دوي آنها مورد تصديق قرارگرفته است، برحسب تناسب به منظور برآوردن تمام يا قسمتي از اين الزام مورد استفاده قرار گيرد. اين سوابق بايد نگهداري شده و در طول عمر دستگاه يا هر دوره زماني لازم كه بر اساس مقررات ملي، منطقهاي و يا محلي تعيين مي شود به آساني قابل دسترسي باشند.
5-3-5 تجهيزات فقط بايد توسط افراد مجاز به كار گرفته شوند. دستورالعملهاي روزآمد جهت استفاده و نگهداري تجهيزات (شامل هرگونه كتابچه راهنما يا دستورات مرتبط با استفاده از دستگاه كه توسط كارخانه سازنده ارائه شده است) بايد به آساني در دسترس كاركنان آزمايشگاه باشد.
6-3-5 تجهيزات بايد در شرايط كاري ايمن نگهداري شوند. اين موضوع بايد انجام آزمايش ايمني الكتريكي، قسمتهاي متوقف كننده فوري دستگاه و جابجايي (Handling) و وارهايي ايمن مواد شيميايي، راديواكتيو و بيولوژيكي توسط افراد مجاز را در برگيرد. دستورالعملها يا مشخصههاي كارخانه سازنده يا هر دو، برحسب تناسب بايد مورد استفاده قرار گيرند.
7-3-5 هرگاه مشخص شود كه تجهيزي دچار نقص شده است، بايد از سرويس خارج و به وضوح برچسب زده و تا زماني كه تعمير شده و به وسيله كاليبراسيون، تصديق يا آزمون، اثبات شود كه معيارهاي پذيرش را برآورده ميكند، به طور مناسب نگهداري شود. آزمايشگاه بايد اثر اين نقص را بر آزمايشهاي قبلي انجام شده مورد بررسي قرار دهد و روشهاي ذكر شده در بند 4-9 را به كار گيرد. آزمايشگاه بايد اقدامات منطقي را براي ضد عفوني تجهيزات قبل از بكارگيري، تعمير و يا از رده خارج كردن آنها انجام دهد.
5-3-8 فهرستي از اقدامات انجام شده در جهت كاهش آلودگي دستگاه بايد به كاربر دستگاه ارائه شود. آزمايشگاه بايد فضاي مناسب براي تعميرات و وسايل محافظت شخصي فراهم كند.
9-3-5 هرگاه عملي باشد، تجهيزات تحت كنترل آزمايشگاه كه نياز به كاليبراسيون يا تصديق دارند بايد برچسب زده يا به نوعي كد گذاري شوند تا وضعيت كاليبراسيون يا تصديق و تاريخ نياز به كاليبراسيون يا تصديق مجدد را نشان دهند.
10-3-5 هرگاه تجهيزاتي از كنترل مستقيم آزمايشگاه خارج يا تعمير يا سرويس شود، آزمايشگاه بايد اطمينان يابد كه آن تجهيز قبل از بكارگيري مجدد در آزمايشگاه، بررسي شده و كاركرد رضايتبخش آن به اثبات رسيده است.
11-3-5 هرگاه رايانهها يا تجهيزات آزمايشگر خودكار براي جمعآوري، پردازش، ثبت، گزارش، ذخيره سازي يا بازيافت دادههاي آزمايش مورد استفاده قرار ميگيرند، آزمايشگاه بايد اطمينان يابد كه:
الف) نرم افزارهاي رايانهاي، شامل آنچه در ساختار تجهيزات بكار رفته است، مستند شده و صحه گذاري مناسب و كافي براي استفاده از آنها صورت گرفته است. ب) روشهاي اجرايي به منظور حفظ انسجام هميشگي دادهها ايجاد و مستقر شده است. ج) رايانهها و تجهيزات خودكار جهت اطمينان از عملكرد صحيح با در نظر گرفتن شرايط لازم كاري و محيطي به منظور حفظ انسجام دادهها، نگهداري و مورد استفاده قرار ميگيرند. د) برنامههاي رايانهاي و معمول به حد كافي از دسترسي، تغيير يا تخريب اتفاقي يا توسط افراد غيرمجاز، محافظت ميشوند.
12-3-5 آزمايشگاه بايد روشهاي اجرايي براي جابجايي، نقل و انتقال، ذخيره سازي و استفاده ايمن از تجهيزات داشته باشد تا از آلودگي و فرسايش آنها پيشگيري شود.
13-3-5 هرگاه در كاليبراسيونها مجموعهاي از ضرايب تصحيح حاصل شود، آزمايشگاه بايد روشهاي اجرايي داشته باشد تا اطمينان يابد كه نسخههايي از ضرايب تصحيح قبلي به درستي روزآمد شدهاند.
14-3-5 تجهيزات، شامل سخت افزار، نرم افزار، مواد مرجع، مواد مصرفي، معرفها و سيستمهاي تجزيهگر بايد از تغيير يا دست كاريهايي كه ممكن است نتايج آزمايشها را بياعتبار كند، محافظت شوند.
بايد از تغيير يا دست كاري هايي كه ممكن است نتايج آزمايش ها را بي اعتبار كند، محافظت شوند.
4 -5 روشهاي اجرايي قبل از آزمايش 5-4-1 فرم درخواست بايد شامل اطلاعات كافي براي شناسايي بيمار و درخواست كننده مجاز و نيز حاوي دادههاي باليني مرتبط باشد. الزامات ملي، منطقهاي و محلي بايد بكار گرفته شود. فرم درخواست يا معادل الكترونيكي آن بهتر است داراي فضاي كافي براي موارد زير و نه محدود به آنها باشد: الف) مشخصه منحصر به فرد بيمار ب) نام يا ديگر مشخصه منحصر به فرد پزشك يا فرد ديگري كه قانوناً مجاز به درخواست آزمايشها يا استفاده از اطلاعات پزشكي از جمله مقصد گزارش مي باشد. در فرم درخواست نشاني پزشك درخواست كننده بهتر است به عنوان قسمتي از اطلاعات فرم مذكور وجود داشته باشد. ج) نوع و منشأ محل تشريحي نمونه اوليه، بر حسب تناسب د) آزمايشهاي درخواست شده ه) اطلاعات باليني مربوط به بيمار كه توصيه ميشود حداقل شامل جنسيت و تاريخ تولد به منظور انجام تفسيرها باشد. و) تاريخ و زمان جمعآوري نمونه اوليه ز) تاريخ و زمان دريافت نمونهها توسط آزمايشگاه
ساختار فرم درخواست (به عنوان مثال: الكترونيكي يا كاغذي) و نحوه ارتباط درخواست ها با آزمايشگاه بهتر است طي مذاكره با استفاده كنندگان از خدمات آزمايشگاه تعيين شود.
5-4-2 دستورالعملهاي خاص براي جمعآوري و جابجايي مناسب نمونههاي اوليه بايد به وسيله مديريت آزمايشگاه، مستند شده و استقرار يابد (به بند 4- 4-2رجوع شود) و در دسترس مسئول جمعآوري نمونه اوليه قرار گيرد. كتابچه راهنماي جمعآوري نمونههاي اوليه بايد حاوي اين دستورالعملها باشد.
5-4-3 كتابچه راهنماي جمعآوري نمونه اوليه بايد شامل موارد زير باشد: الف) رونوشتهايي از، يا ارجاع به: 1) فهرست آزمايشهاي قابل ارائه توسط آزمايشگاه 2) فرمهاي رضايت، در صورت كاربرد 3) اطلاعات و دستورالعملهاي تهيه شده جهت ارائه به بيماران در رابطه با چگونگي آماده سازي خود قبل از جمعآوري نمونه اوليه 4) اطلاعات براي استفاده كنندگان از خدمات آزمايشگاهي در رابطه با معيارهاي كاربردي پزشكي و انتخاب مناسب روشهاي اجرايي موجود
ب) روشهاي اجرايي براي: 1) آماده سازي بيمار (به عنوان مثال: دستورالعملهايي براي مراقبت كنندگان و نمونه گيران خون) 2) شناسايي نمونه اوليه 3) جمعآوري نمونه اوليه (به عنوان مثال: خونگيري، سوراخ كردن پوست، خون، ادرار و ديگر مايعات بدن)، با شرح در مورد ظروف نمونههاي اوليه و هرگونه افزودنیهاي لازم
ج) دستورالعملهايي براي: 1) تكميل فرم درخواست يا درخواست الكترونيكي 2) نوع و مقدار نمونه اوليهاي كه جمعآوري ميشود. 3) زمان مخصوص جمعآوري، در صورت لزوم 4) هر نوع نياز به جابجايي خاص بين زمان جمعآوري و زمان دريافت توسط آزمايشگاه (الزامات حمل و نقل، سرد نگه داشتن، گرم نگه داشتن، تحويل فوري و غيره) 5) برچسب گذاري نمونههاي اوليه 6) اطلاعات باليني (به عنوان مثال: سابقه مصرف داروها) 7) شناسايي قطعي و مشروح بيماري كه نمونه اوليه او جمع آوري شده است. 8) ثبت مشخصات فردي كه نمونه اوليه را جمعآوري ميكند. 9) وارهايي ايمن موادي كه در جمعآوري استفاده ميشود.
د) دستورالعملهايي براي: 1) ذخيره سازي نمونههاي آزمايش شده 2) محدودههاي زماني براي درخواست ساير آزمايشها 3) ساير آزمايشها 4) تكرار آزمايش به دليل اشكال در انجام آزمايش يا آزمايشهاي بيشتر بر همان نمونه اوليه
5-4-4 كتابچه راهنماي جمعآوري نمونه اوليه بايد بخشي از سيستم كنترل مدارك باشد. (به بند 4-3-1 رجوع شود)
5-4-5 نمونههاي اوليه به طور معمول بايد توسط فرم درخواست، به فرد مشخصي قابل رديابي باشند. نمونههاي اوليه فاقد شناسه مناسب نبايد توسط آزمايشگاه پذيرفته يا پردازش شوند. هرگاه عدم قطعيتي در شناسايي نمونه اوليه يا ناپايداري در اجزاي مورد تجزيه نمونه اوليه (مايع مغزي- نخاعي، تكه برداري و غيره) وجود داشته و يا نمونه اوليه غير قابل جايگزين يا حياتي باشد، آزمايشگاه مجاز است تصميم بگيرد كه در ابتدا نمونه را پردازش ولي نتايج را منتشر نكند تا پزشك درخواست كننده يا شخص مسئول جمعآوري نمونه اوليه، مسئوليت شناسايي و پذيرش نمونه يا ارائه اطلاعات مناسب يا تمام اين موارد را به عهده بگيرد. در اينگونه موارد، امضاي فردي كه مسئوليت شناسايي نمونه اوليه را به عهده ميگيرد بهتر است روي فرم درخواست ثبت شود، يا از طريق فرم درخواست قابل رديابي باشد. اگر اين الزام به هر دليل برآورده نشده و آزمايش انجام شود، فرد مسئول در گزارش بهتر است مشخص شود. نمونههايي كه براي آزمايشهاي بعدي كنار گذاشته ميشوند (بعنوان مثال: پادتنهاي ويروسي، متابوليتهاي (Metabolites) مرتبط با نشانگان (Syndrome) باليني) نيز بهتر است قابل شناسايي باشند.
5-4-6 آزمايشگاه بايد نقل و انتقال نمونهها را به آزمايشگاه پايش كند تا نمونهها اين گونه حمل شوند: الف) در محدوده زماني مناسب با توجه به ماهيت آزمايشهاي درخواست شده و مقررات آزمايشگاه مربوطه ب) در محدوده دماي مشخص شده در كتابچه راهنماي جمعآوري نمونههاي اوليه و با نگهدارندههاي معين براي اطمينان از انسجام نمونهها ج) به نحوي كه از ايمني حمل كننده، عموم مردم و آزمايشگاه دريافت كننده، منطبق با الزامات قانوني ملي، منطقهاي و محلي اطمينان حاصل شود.
5-4-7 تمام نمونههاي اوليه دريافت شده بايد در يك دفتر فهرست، برگه كاري، رايانه يا ديگر سيستمهاي مشابه ثبت شود. تاريخ و زمان دريافت نمونهها و نيز مشخصات مأمور دريافت كننده بايد ثبت شود.
5-4-8 معيار قبول يا رد نمونههاي اوليه بايد تعيين و تدوين شود. اگر نمونههاي اوليه مشكلدار پذيرش شدهاند، در گزارش نهايي ماهيت مشكل بايد مشخص، و در موارد مقتضي در تفسير نتايج احتياط لازم بعمل آيد.
5-4-9 آزمايشگاه بايد به طور دورهاي حجم موردنياز نمونه خون (همچنين ساير نمونهها مانند مايع مغزي- نخاعي) را مورد بازنگري قرار دهد تا اطمينان يابد كه مقدار ناكافي يا بيش از اندازه، نمونه جمعآوري نميشود.
5-4-10 كاركنان مجاز بايد به صورت نظاممند درخواستها و نمونهها را بازنگري كنند و تصمیم بگيرند كه چه آزمايشهايي انجام و چه روشهايي براي آنها به كار گرفته شود.
5-4-11 آزمايشگاه بايد، در صورت ارتباط موضوعي، يك روش اجرايي مدون براي دريافت، برچسب گذاري، پردازش و گزارش دهي نمونههاي اوليهاي كه توسط آزمايشگاه دريافت شده و آنهايي كه مشخصاً با عنوان “فوری” (Urgent) علامت گذاري شدهاند، داشته باشد. اين روش اجرايي بايد جزئيات هرگونه برچسب گذاري خاص فرمهاي درخواست و نمونههاي اوليه، شيوه انتقال نمونه اوليه به محل انجام آزمايش در آزمايشگاه، هرگونه نحوه پردازش سريع مورد استفاده و هر نوع ضوابط گزارش دهي خاص كه از آنها پيروي ميكند را شامل شود.
5-4-12 بخشهاي برداشته شده از نمونهها نيز بايد نسبت به نمونه اوليه اصلي قابل رديابي باشند.
5-4-13 آزمايشگاه بايد خط مشي مكتوبي در ارتباط با درخواستهاي شفاهي انجام آزمايش داشته باشد.
5-4-14 نمونهها بايد به مدت مشخص شده، تحت شرايطي كه از پايداري خواص نمونه اطمينان حاصل ميشود نگهداري شوند تا تكرار آزمايش پس از گزارش نتيجه آزمايش يا انجام آزمايشهاي ديگر مقدور باشد.
5-5 روشهاي اجرايي آزمايش يادآوري- بعضي از موارد ذيل ممكن است در تمام رشتهها در حيطه طب آزمايشگاهي كاربرد نداشته باشد.
5-5-1 آزمايشگاه بايد روشهاي اجرايي انجام آزمايش، از جمله براي انتخاب /برداشتن بخشهايي از نمونه را، بكار گيرد كه نيازهاي استفاده كنندگان از خدمات آزمايشگاه را برآورده ساخته و متناسب با آزمايشها باشد. روشهاي اجرايي ارجح، آنهايي هستند كه در كتابهاي معتبر/ قابل قبول، متون يا مجلات بازنگري شده، يا در راهنماهاي بینالمللي، ملي يا منطقهاي منتشر شدهاند. اگر روشهاي اجرايي درون آزمايشگاهي (In-house) (روشهايي كه در داخل آزمايشگاه براي يك آزمايش طراحي ميشوند)، مورد استفاده قرار ميگيرند، بايد كاملاً مدون و به طور مناسب جهت استفاده موردنظر صحه گذاري شده باشند.
5-5-2 آزمايشگاه به منظور تأييد تناسب روشهاي انجام آزمايش با كاربرد موردنظر، بايد فقط از روشهاي اجرايي معتبر استفاده كند. صحه گذاري بايد از گستردگي لازم براي تأمين نيازهاي كاربرد يا دامنه كاربرد موردنظر برخوردار باشد. آزمايشگاه بايد نتايج به دست آمده و روش اجرايي استفاده شده براي صحه گذاري را ثبت كند.
شيوه و روشهاي اجرايي انتخاب شده، قبل از استفاده در آزمايشهاي پزشكي، بايد ارزيابي و رضايت بخش بودن نتايج حاصل از آن تأييد شود. روشهاي اجرايي بايد در ابتدا و در دورههاي زماني مشخص توسط مدير آزمايشگاه يا فرد منتخب بازنگري شوند. اين بازنگريها معمولاً ساليانه انجام ميشوند. بازنگريها بايد مستند شوند.
5-5-3 تمام روشهاي اجرايي بايد مدون و در محل كار در دسترس كاركنان مربوطه باشند. روشهاي اجرايي مدون و دستورالعملهاي لازم بايد به زبان ساده و قابل درك براي كاركنان آزمايشگاه در دسترس باشند. استفاده از كارت فايلها (Card files)يا سيستمهاي مشابه كه اطلاعات كليدي در آنها خلاصه شدهاند به عنوان مرجع سريع در ميز كار مورد قبول هستند مشروط بر آن كه كتابچه راهنماي كامل به عنوان مرجع نيز در دسترس باشد. كارت فايلها يا سيستمهاي مشابه بايد منطبق با كتابچه راهنماي كامل باشند. اين گونه روشهاي اجرايي خلاصه شده بايد بخشي از سيستم كنترل مدارك باشند.
روشهاي اجرايي بايد براساس دستورالعملهاي كاربري (به عنوان مثال: دستورالعملهاي داخل بسته بندي) نوشته شده توسط كارخانه باشند مشروط بر آنكه با بندهاي 5-5-1 و 5-5-2 مطابقت داشته و شرح آنها همان گونه كه در آزمايشگاه بكار میروند به زبان رايج قابل درك براي كاركنان آزمايشگاه نوشته شده باشند. هرگونه انحرافي بايد بازنگري و مستند شود. اطلاعات بيشتري كه ممكن است براي انجام آزمايشها موردنياز باشد نيز بايد مدون شوند. هر نوع ويرايش جديد در كيتهاي آزمايشگاهي با تغييرات عمده در مورد معرفها يا روشهاي اجرايي بايد از نظر كارايي و متناسب بودن براي كارهاي موردنظر بررسي شوند. هرگونه تغيير در روش انجام كار مانند ساير روشهاي اجرايي بايد تاريخ گذاري و استفاده از آن مجاز شود. مستند سازي علاوه بر شناسههاي كنترل مدارك، در موارد مقتضي بهتر است شامل موارد زير نيز باشد: الف) هدف از آزمايش ب ) اصول روش اجرايي مورد استفاده در آزمايشها ج ) مشخصههاي عملكردي (به عنوان مثال: خطي بودن (Linearity)، دقت، صحت بيان شده به صورت عدم قطعيت اندازهگيري، حدود تشخيص (Detection limit)، محدوده اندازهگيري (Measuring interval)، درستي اندازهگيري (Trueness of measurement)، حساسيت تجزيهاي (Analytical sensitivity) و اختصاصي بودن تجزيهاي (Analytical specificity)) د ) سيستم نمونههاي اوليه (به عنوان مثال: پلاسما، سرم، ادرار) ه) نوع ظرف و افزودنيها و) تجهيزات و معرفهاي موردنياز ز) روشهاي اجرايي كاليبراسيون (قابليت رديابي از نظر اندازه شناسي) ح) مراحل روشهاي انجام كار ط) روشهاي اجرايي كنترل كيفيت ي) تداخل كنندهها (به عنوان مثال: ليپمي(Lipaemia) ، هموليز (Haemolysis)، بيليروبينمي(Bilirubinemia) ) و واكنشهاي متقاطع ك) اصول روش اجرايي براي محاسبه نتايج از جمله عدم قطعيت اندازهگيري ل) محدودههاي مرجع بيولوژيك م) محدوده قابل گزارش در نتايج آزمايش ن) مقادير هشداردهنده /بحراني، برحسب تناسب ز) تفسير آزمايشگاهي س) هشدارهاي ايمني ش) منابع بالقوه تغيير پذيري
كتابچه راهنماي الكترونيك مشروط بر آنكه حاوي اطلاعات فوقالذكر باشد قابل قبول است. توصيه ميشود همان الزامات كنترل مدارك نيز در مورد كتابچه راهنماي الكترونيك لحاظ شود. رئيس آزمايشگاه بايد مسئول حصول اطمينان از كامل، جاري بودن و بازنگري جامع محتويات روشهاي اجرايي آزمايشها باشد.
5-5-4 مشخصههاي عملكردي هر روش اجرايي كه در انجام يك آزمايش مورد استفاده قرار ميگيرد، بايد به آن روش اجرايي مربوط باشد.
5-5-5 محدوده مرجع بيولوژيك بايد به طور دورهاي بازنگري شود. اگر باور منطقي آزمايشگاه اين باشد كه ديگر يك محدوده خاص براي جمعيت مرجع مناسب نيست، آنگاه بايد بررسي صورت گرفته و متعاقب آن در صورت لزوم اقدام اصلاحي انجام شود. محدوده مرجع بيولوژيك بايد هنگامي كه آزمايشگاه يك روش اجرايي آزمايش يا يك روش اجرايي قبل از آزمايش را تغيير ميدهد، بر حسب تناسب بازنگري شود.
5-5-6 آزمايشگاه بنا به درخواست بايد فهرست روشهاي اجرايي آزمايشهاي جاري خود، از جمله الزامات نمونههاي اوليه و مشخصهها و الزامات عملكردي مربوطه را تهيه و در دسترس استفاده كنندگان از خدمات آزمايشگاهي قرار دهد.
5-5-7 اگر آزمايشگاه قصد داشته باشد كه روش اجرايي انجام يك آزمايش را تغيير دهد به نحوي كه نتايج يا تفسيرهاي آنها تغيير قابل ملاحظهاي داشته باشد، بايد قبل از اعمال تغييرات، اثرات آن براي استفاده كنندگان از خدمات آزمايشگاه، به طور مكتوب توضيح داده شود.
يادآوري– اين الزام ميتواند به راههاي مختلف بسته به شرايط محلي برآورده شود. بعضي روشها عبارتند از: نامه مستقيم، خبر نامههاي آزمايشگاه يا درج آن در بخشي از گزارش آزمايش.
5-6 تضمين كيفيت روشهاي اجرايي آزمايش 5-6-1 آزمايشگاه بايد سيستمهاي كنترل كيفيت داخلي را كه دستيابي به كيفيت موردنظر نتايج را مورد تصديق قرار ميدهد، طراحي كند. مهم است كه سيستم كنترل مزبور، اطلاعاتي را براي كاركنان فراهم كند كه به وضوح و آساني قابل درك باشند تا آنها را مبناي تصميمات فني و پزشكي قرار دهند. توصيه ميشود به حذف اشتباهات در فرآيند انجام امور مربوط به نمونهها، درخواستها، آزمايشها، گزارشها و غيره توجه خاص شود.
5-6-2 آزمايشگاه بايد عدم قطعيت نتايج را هر جا كه مربوط و ممكن باشد تعيين كند. اجزاء عدم قطعيت كه حائز اهميت هستند بايد مدنظر قرار گيرند. منابعي كه در عدم قطعيت مشاركت دارند، ممكن است شامل نمونه برداري، آماده سازي نمونه، انتخاب قسمتي از نمونه، كاليبره كنندهها، مواد مرجع، مقادير ورودي، تجهيزات مورد استفاده، شرايط محيطي، شرايط نمونه و تغييرات مربوط به كاربر باشند.
5-6-3 بايد برنامهاي براي كاليبراسيون سيستمهاي اندازهگيري و تصديق درستي آنها طراحي و اجرا شود كه از قابل رديابي بودن نتايج حاصله به يكاهاي SIو يا ارجاع به ثابت طبيعي (Natural constant) و ساير مراجع، اطمينان حاصل شود. وقتي كه هيچ كدام از اينها امكان يا ارتباط موضوعي نداشته باشند، به منظور كسب اطمينان از نتايج بايد راههاي ديگري بكار گرفته شود كه شامل، ولي نه محدود به موارد زير ميباشند: الف) شركت در برنامه مناسبي براي مقايسههاي بين آزمايشگاهي ب) استفاده از مواد مرجع مناسب داراي تأييديه، براي نشان دادن خصوصيات هر ماده ج) آزمايش يا كاليبراسيون توسط يك روش اجرايي ديگر د) سنجشهاي از نوع “نسبتي” (Ratio)يا “كسري” (Reciprocity) ه) استانداردها يا شيوههاي توافق متقابل كه به طور شفاف ايجاد، مشخص، توصيف شده و مورد موافقت تمام گروههاي ذيربط قرار گرفتهاند. و) تدوين اظهار نامهها در خصوص معرفها، روشهاي اجرايي يا سيستم آزمايش وقتي كه امكان رديابي به وسيله تأمين كننده يا كارخانه سازنده مهيا شود.
5-6-4 آزمايشگاه بايد در مقايسههاي بين آزمايشگاهي از جمله آنهايي كه توسط طرحهاي ارزيابي كيفيت برون سازماني ترتيب داده شدهاند شركت كند. مديريت آزمايشگاه بايد نتايج ارزيابيهاي كيفيت برون سازماني را پايش كرده و هر گاه ضوابط كنترلي برآورده نشده باشد در انجام اقدامات اصلاحي شركت نمايد. برنامههاي مقايسه بين آزمايشگاهي بايد اساساً با ISO/IEC Guide 43-1 مطابقت داشته باشند. برنامههاي ارزيابي كيفيت برون سازماني، تا حد امكان، بهتر است چالشهاي باليني مرتبطي، شبيه به نمونههاي بيمار فراهم كنند و بر كل فرآيند آزمايش، از جمله روشهاي قبل و بعد از آزمايش اثر كنترلي داشته باشند.
5-6-5 هرگاه برنامه رسمي مقايسه بين آزمايشگاهي موجود نباشد، آزمايشگاه بايد ساز و كاري براي تعيين مقبوليت روشهاي اجرايي كه به گونهاي ارزيابي نشدهاند، ايجاد كند. در صورت امكان اين ساز و كار بايد از مواد چالش برانگيز از بيرون آزمايشگاه، مانند نمونههاي تعويض شده با ساير آزمايشگاهها استفاده كند. مديريت آزمايشگاه بايد نتايج حاصل از ساز و كار مقايسه بين آزمايشگاهي را پايش و در انجام و ثبت اقدامات اصلاحي شركت كند.
5-6-6 در مورد آزمايشهاي انجام شده با روشهاي اجرايي يا تجهيزات متفاوت يا در آزمايشگاههاي مختلف، يا تمام اينها، بايد ساز و كار مشخصي براي تصديق قابل قياس بودن نتايج در طي دورههاي متناسب باليني وجود داشته باشد. اين تصديق بايد متناسب با مشخصههاي روش اجرايي يا دستگاه در محدودههاي زماني معين انجام شود.
5-6-7 آزمايشگاه بايد نتايج حاصل از اين مقايسهها را مستند، ثبت و برحسب تناسب بر اساس آنها سريعاً عمل كند. بايد در مورد مشكلات يا نواقص شناسايي شده، اقدام و سوابق اقدامات نگهداري شوند.
5-7 روشهاي اجرايي بعد از آزمايش 5-7-1 كاركنان مجاز، بايد نتايج آزمايشها را به طور نظاممند بازنگري و انطباق آنها را با اطلاعات باليني بيمار ارزيابي كرده و اجازه صدور نتايج را بدهند.
5-7-2 ذخيره سازي نمونههاي اوليه و ساير نمونههاي آزمايشگاهي بايد مطابق با خط مشي تأييد شده باشد.
5-7-3 وارهايي ايمن نمونههايي كه ديگر براي آزمايش موردنياز نميباشند بايد طبق مقررات محلي توصيههاي مديريت پسماند انجام شود.
5-8 گزارش دهي نتايج 5-8-1 مديريت آزمايشگاه بايد مسئول تعيين ساختار گزارشها باشد. ساختار فرم گزارش (الكترونيكي يا كاغذي) و نحوه برقراري ارتباط از طرف آزمايشگاه بهتر است طي مذاكره با استفاده كنندگان از خدمات آن تعيين شود.
5-8-2 مديريت آزمايشگاه و درخواست كننده مشتركاً مسئول اطمينان از دريافت گزارش توسط افراد با صلاحيت در محدوده زماني توافق شده ميباشند .
5-8-3 نتايج بايد خوانا، بدون اشتباه در متن باشد و به افراد مجاز به دريافت و استفاده از اطلاعات پزشكي گزارش شود. گزارش بايد شامل، ولي نه محدود به موارد زير باشد: الف) شناسه واضح و عاري از ابهام آزمايش، در صورت لزوم با ذكر روش اندازهگيري ب) شناسه آزمايشگاه صادر كننده گزارش ج) شناسه منحصر به فرد و مكان استقرار بيمار و در صورت امكان، مقصد گزارش د) نام و ساير مشخصات منحصر به فرد درخواست كننده و آدرس او ه) تاريخ و زمان جمعآوري نمونه اوليه در صورت دسترسي و مؤثر بودن آن در مراقبت از بيمار و زمان دريافت توسط آزمايشگاه و) تاريخ و زمان صدور گزارش، چنانچه در گزارش درج نشده باشد، بايد در صورت نياز به سهولت قابل دسترسي باشد. ز) عضو و منشأ نمونه (يا نوع نمونه اوليه) ح) نتايج آزمايشهاي گزارش شده در يكاهاي SI يا قابل رديابي به يكاهاي SI (بهISO 31 رجوع شود) در صورت كاربرد ط) محدوده مرجع بيولوژيك، در صورت كاربرد ي) تفسير نتايج در صورت لزوم ك) پيشنهادات ديگر (به عنوان مثال: كيفيت يا كفايت نمونه اوليه كه ممكن است نتايج را تحت تأثير قرار دهند، نتايج/ تفسيرهاي آزمايشگاههاي ارجاع، استفاده از روشهاي ابداعي). گزارش بهتر است آزمايشهايي كه به عنوان بخشي از برنامه ابداعي ميباشند و براي آنها ادعاي خاصي در جهت انجام اندازهگيري وجود ندارد را مشخص كند و در صورت كاربرد، توصيه ميشود اطلاعات مربوط به حد آشكارسازي و عدم قطعيت اندازهگيري آن براساس درخواست اعلام شود. ل) مشخصات فرد مجاز صادر كننده گزارش م) نتايج اوليه و اصلاح شده، در صورت ارتباط ن) در صورت امكان، امضاء يا مجوز صادر يا كنترل كننده گزارش
يادآوري 1- در ارتباط با قسمت (ط) در بعضي شرايط، ميتوان جدولها يا فهرستهاي محدودههاي مراجع بيولوژيك را درمحل دريافت گزارش، بين تمام استفاده كنندگان از خدمات آزمايشگاهي توزيع كرد.
يادآوري 2- مقررات ملي، منطقهاي و محلي ممكن است، درج نام و محل آزمايشگاه انجام دهنده آزمايش (يا ارجاعي) را درگزارش نهايي الزام كند.
5-8-4 برحسب تناسب، در شرح آزمايشهاي انجام شده و نتايج آنها بهتر است از واژهها (Vocabulary)و قواعد (Syntax)توصيه شده به وسيله يك يا بيشتر از سازمانهاي زير پيروي شود: – شوراي بينالمللي استاندارد سازي هماتولوژي (ICSH) (International Council for Standardization in Haematology) – انجمن بينالمللي هماتولوژي (ISH) (International Society of Haematology) – فدراسيون بينالمللي شيمي باليني و طب آزمايشگاهي (IFCC) (International Federation of Clinical Chemistry and Laboratory Medicine) – اتحاديه بينالمللي شيمي محض و كاربردي (IUPAC) (International Union of Pure and Applied Chemistry) – انجمن بينالمللي ترومبوزيس و هموستازيس (ISTH) (International Society of Thrombosis and Haemostasis) – كميته اروپايي استاندارد سازي (CEN) (European Committee for Standardisation)
برحسب تناسب در شرح و نتايج بهتر است از فهرست واژههاي پيشنهاد شده توسط يك يا بيشتر از سازمانهاي زير پيروي شود: – اتحاديه بينالمللي بيوشيمي و بيولوژي مولكولي (IUBMB) (International Union of Biochemistry & Molecular Biology) – اتحاديه بينالمللي انجمنهاي ميكروبيولوژيكي(IUMS) (International Union of Microbiological Societies) – اتحاديه بينالمللي انجمنهاي ايمنولوژيكي (IUIS) (International Union of Immunological Societies) – SNOMED بينالمللي) كالج پاتولوژيستهاي آمريكايي( – سازمان بهداشت جهاني (WHO) (World Health Organization)
5-8-5 در صورتي كه كيفيت نمونه اوليه براي انجام آزمايش نامناسب باشد و يا بتواند نتيجة آزمايش را تحت تأثير قرار دهد بايد در گزارش درج شود. . 5-8-6 رونوشتها يا پروندههاي نتايج گزارش شده بايد توسط آزمايشگاه نگهداري شوند به نحوي كه بازيابي سريع اطلاعات امكان داشته باشد. مدت زماني كه اطلاعات گزارش شده نگهداري ميشوند ممكن است متفاوت باشد، اگرچه كه نتايج گزارش شده بايد تا زماني كه از نظر پزشكي ايجاب ميكند يا از لحاظ ملي، منطقهاي يا محلي الزام ميشوند قابل بازيابي باشند.
5-8-7 آزمايشگاه بايد روشهاي اجرايي براي مطلع كردن فوري پزشك (يا ديگر كاركنان پزشكي مسئول مراقبت از بيمار) در زماني كه نتايج آزمايش براي موارد خاص بحراني در» محدود ه هشدار دهنده «يا »بحراني« قرار ميگيرند، داشته باشد. اين موضوع شامل نتايج دريافت شده از نمونههايي كه براي آزمايش به آزمايشگاههاي ارجاع فرستاده شدهاند نيز ميشود.
5-8-8 به منظور تأمين نيازهاي باليني محلي، آزمايشگاه بايد موارد خاص بحراني و محدودههاي»هشدار دهنده/ بحراني« را با توافق پزشكاني كه از خدمات آزمايشگاه استفاده ميكنند تعيين كند. اين موضوع تمام آزمايشها شامل مقادير اسمي و عددي را در بر ميگيرد.
5-8-9 درمورد نتايجي كه به عنوان يك گزارش موقتي ارسال شدهاند، گزارش نهايي بايد هميشه براي درخواست كننده فرستاده شود.
5-8-10 سوابق اقدامات انجام شده در پاسخ به نتايج واقع در محدودههاي بحراني بايد نگهداري شوند. اينها بايد شامل تاريخ، زمان، فرد مسئول در آزمايشگاه، فرد مطلع شده و نتايج آزمايش باشند. هرگونه مشكل در تأمين اين الزام، بايد ثبت و در طي مميزيها بازنگري شود .
5-8-11 مديريت آزمايشگاه، با مشورت درخواست كنندگان، بايد زمان گردش كار انجام هر آزمايش را تعيين كند. زمان گردش كار بايد منعكس كننده نيازهاي باليني باشد. در صورت تأخير در انجام آزمايش بايد جهت اطلاع به درخواست كننده يك خط مشي وجود داشته باشد. زمان گردش كار و همچنين هرگونه بازخورد از طرف پزشكان در اين ارتباط، بايد توسط مديريت آزمايشگاه پايش، ثبت و بازنگري شود. هرگاه لازم باشد، براي حل مشكلات شناسائي شده بايد اقدام اصلاحي انجام گيرد. اين بدان معني نيست كه همه تأخيرهاي آزمايشها را بايد به كاركنان باليني اطلاع داد، بلكه اين تنها در شرايطي لازم است كه تأخير، بر مراقبت از بيمار تأثير بگذارد. اين روش اجرايي لازم است با همكاري بين كاركنان باليني و آزمايشگاه اجرا شود.
5-8-12 هرگاه لازم باشد نتايج آزمايش از يك آزمايشگاه ارجاع توسط آزمايشگاه ارجاع دهنده رونويسي شود بايد روشهاي اجرايي براي تأييد صحت تمام رونوشتها موجود باشد. . 5-8-13 آزمايشگاه بايد روشهاي اجرايي مدون و واضحي براي صدور نتايج آزمايش داشته باشد، شامل جزئيات اينكه چه كسي مجاز است نتايج را به چه كسي اعلام كند. روشهاي اجرايي همچنين بايد حاوي راهنماهايي براي تحويل مستقيم نتايج به بيماران باشد.
5-8-14 آزمايشگاه بايد خط مشيها و برنامههايي داشته باشد كه مطمئن شود نتايجي كه توسط تلفن يا ساير وسايل الكترونيكي منتشر ميشوند فقط به گيرندههاي مجاز ميرسند. نتايجي كه شفاهاً اعلام ميشوند، بايد متعاقباً يك گزارش كامل مدون به دنبال داشته باشند.
5-8-15 آزمايشگاه بايد خط مشي و روشهاي اجرايي مكتوب در مورد تغيير گزارشها داشته باشد. در صورت تغيير، سوابق بايد زمان، تاريخ و نام شخصي كه مسئول اين تغيير است را نشان دهد. در صورت تغيير گزارش، نوشتههاي اصلي بايد خوانا و روشن باقي بمانند. سوابق الكترونيكي اصلي بايد نگهداري و تغييرات توسط روشهاي ويرايشي مناسب، طوري به سابقه اضافه شوند كه گزارش به روشني تغيير را نشان دهد.
5-8-16 نتايجي كه براي تصميم گيري باليني در دسترس و مورد بازنگري قرار گرفتهاند بايد يك جا در گزارشهاي بعدي ثبت و به روشني مشخص شود كه بازنگري شدهاند. اگر سيستم گزارش دهي نميتواند اصلاحات يا تغييرات را بپذيرد، از يك شرح عمليات مميزي (Audit log) بايد استفاده شود .
|
گام هفتم
تمامي عبارات مربوط به NABL – 112 به دقت مطالعه شود. اين مدرك الزامات ملي/ محلي را مطرح ميكند.
NABL – 112 انواع آزمايشگاهها را توضيح ميدهد، تمامي عناصر 23گانه (الزامات مديريتي و الزامات فني) را با توجه به قوانين و الزامات ملي شرح ميدهد و در ضميمه شماره يك آن تستهاي روتين و تخصصي را در هر بخش توضيح ميدهد.
گام هشتم
نظامنامه سيستم كيفيت خود را بر اساس الزامات IS/ISO 15189 و NABL – 112 تهيه كنيد.
گام نهم
پس از اجراي سيستم كيفيت خود و جلسه بازنگري مديريتي حداقل يك مميزي داخلي انجام داده و تأثير اقدامات اصلاحي را مستند سازد.
اينك يك نسخه پذيرش از مديريت NABL دريافت نموده و آن را بدقت تكميل كرده و پس از واريز هزينه مربوطه ارسال نمايد.
سه مرحله تأئيد صلاحيت توسط NABL
مرحله 1: بررسي نظامنامه سيستم كيفيت توسط بررسي كننده ارشد NABL
مرحله 2: بازديد و ارزيابي مقدماتي توسط بررسي كننده ارشد از آزمايشگاه (يك روز)
مرحله سوم: ارزيابي نهايي توسط تيم NABL (دو روز يا بيشتر)
پس از ارزيابي نهايي:
- گزارش جامع از آزمايشگاه تهيه ميشود.
- اعضاي كميته فنيNABL گزارش و توصيهها را بررسي ميكنند.
- نتيجه تأئيد صلاحيت را به اطلاع آزمايشگاه ميرسانند.
- آزمايشگاههايي كه تأئيد صلاحيت شدهاند بايد بطور دورهاي تحت نظارت باشند و بطور ساليانه بايد مبلغي را بپردازند.
برای دانلود فایلpdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام