مروري بر آزمايش اسپرموگرام
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفي: کارشناس ارشد ميكروب شناسي، دانشگاه علوم پزشكي جندي شاپور اهواز
محمد علیمحمدی: کارشناس ارشد بیوشیمی بالینی، دانشگاه آزاد اسلامي واحد اراک
آزمایش اسپرم. ناباروري به عدم توانايي بچهدار شدن در نتيجه ارتباط جنسي محافظت نشدهي هتروسكسوال يك زوج در طي 12 ماه اطلاق ميگردد. تستهايي وجود دارند كه در مردان و يا زنان قابل انجام بوده كه به تشخيص علت ناباروري كمك مينمايند. تستهاي تشخيص ناباروري در مردان شامل موارد زير ميباشند:
- بررسي مايع مني (بررسي دو نمونه به فاصله حداقل يك ماه از هم)
- بررسي وضعيت اندوكراين (در صورت نياز كلينيكي) مانند FSH
- جستجوي آنتيباديهاي ضد اسپرم
- آزمايش ادرار پس از انزال (Post-ejaculatory urinalysis)
- كشت ادرار و مايع مني
- وازوگرافي
- اولتراسونوگرافي كيسه بيضه (اسكروتال)
- بيوپسي بيضه
- اندازهگيري قدرت نفوذ اسپرم (SPA) (Sperm penetration assay)
- اولترا سونوگرافي پروستات، سمينال وزيكل و مجراي انزال از طريق ركتال (اين تست در صورتي كه تحرك اسپرمها در غياب هرگونه علت شناخته شدهاي كمتر از 30% باشد، حجم مايع مني كمتر از 1 ميليليتر باشد و درد ناحيه پرينه در هنگام انزال وجود داشته باشد، انجام ميشود).
ارزيابي كلينيكي ناباروري در مردان
از بين تستهاي ذكر شده در بالا، ما در اين مبحث به تست Semen analysis ميپردازيم.
ساير اسامي اين آزمــــــــــــــــايش شامل Sperm examination, Seminal cytology وSemen examination ميباشد. اين آزمايش به دليل سهولت تهيه نمونه، يكي از پر كاربردترين آزمايشات در زمينه تشخيص و درمان ناباروريها ميباشد.
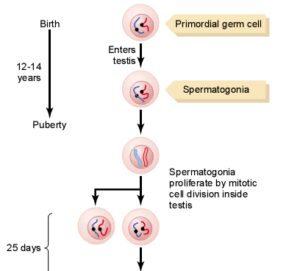
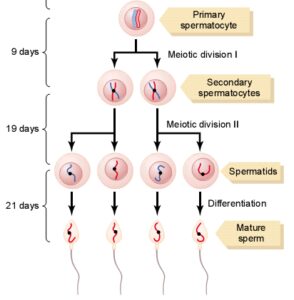
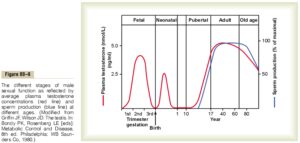
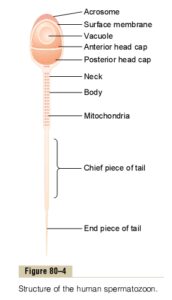
مايع مني طبيعي تركيبي از اسپرماتوزوئيدهاي شناور در ترشحات بيضهها و اپيديديم ميباشد كه در زمان انزال با ترشحات پروستات، كيسههاي مني و غدد بولبواورترال مخلوط ميشوند. تركيب نهايي مايعي چسبنده است كه مايع انزالي را تشكيل ميدهد. توليد اسپرمها تقريباً 3 ماه طول ميكشد. مراحل توليد اسپرمها در تصوير زير آمده است.
توليد اسپرمها در اوايل سن بلوغ (حوالي سن 14 سالگي) شروع شده و به تدريج رو به افزايش گذاشته؛ به طوري كه در بزرگسالي (حوالي سن 40 سالگي) به بيشترين مقدار خود رسيده و پس از ثابت ماندن آن براي يك دوره 30- 20 ساله، در حوالي سن 80 سالگي مجدداً رو به كاهش ميگذارد.
جمعآوري و تحويل نمونه:
نمونه حداقل بايد 48 ساعت بعد (اما نه بيش از 7 روز) از پرهيز جنسي جمعآوري شود. جهت ارزيابي اوليه بايد دو نمونه گرفته شود. فاصله بين دو جمعآوري نبايد كمتر از 7 روز و يا بيش از 3 هفته باشد. در صورتي كه نتايج اين دو ارزيابي به طور فاحشي با همديگر اختلاف داشته باشند، بايد نمونههاي بيشتري گرفته شوند. نمونه بايد حداكثر در طي يك ساعت پس از نمونهگيري به آزمايشگاه تحويل داده شود.
وقتي در آزمايش اول، تحرك اسپرمها به طور غيرطبيعي پايين باشد (كمتر از 25 درصد اسپرمها تحرك پيشرونده سريع را نشان بدهند)، فاصله بين جمعآوري و آزمايش نمونه دوم بايد تا حد امكان كوتاه باشد. چون ميزان تحرك اسپرمها با گذشت زمان كاهش مييابد. نمونه بايد از طريق خود تحريكي (Masturbation) گرفته شود. انزال در ظرفي تميز و دهان گشاد از جنس شيشه و يا پلاستيك بايد انجام شود (ظروف پلاستيكي ميزان تحرك اسپرمها را كاهش ميدهند). محدوده طبيعي پارامترهاي اسپرم توسط سازمان جهاني بهداشت در سال 1992 ارائه شده و عموماً از اين محدودهها استفاده مينمايند.
مايع شدن (Liquifaction):
مايع مني طبيعي در ابتدا به حالت ژلهاي بوده و در طي 60 دقيقه در حرارت اتاق سيال ميشود. ممكن است اين اتفاق در طي 15 دقيقه نيز رخ دهد. سيال نشدن كامل در طي 60 دقيقه بايد گزارش شود و يك يافته غيرطبيعي ميباشد.
منظره (Appearance):
نمونه طبيعي، ظاهري يكنواخت، خاكستري و نيمه كدر دارد.
حجم (Volume):
حجم مايع مني به طور طبيعي بين 5- 2 ميليليتر ميباشد.
ويسكوزيته (Viscosity):
پس از سيال شدن نمونه بايد آن را به داخل يك پيپت 5 ميليليتري دهان گشاد كشيد و سپس اجازه چكيدن به آن را داد. بايد طول رشته تشكيل شده را برآورد و گزارش نمود. نمونه مني طبيعي به صورت قطرات كوچك مجزا از پيپت رها ميشود. در ويكوزيتي طبيعي، طول رشتههاي تشكيل شده بيشتر از 2 سانتيمتر ميباشد.
pH:
pH نمونه بايد در طي حداكثر يك ساعت پس از نمونهگيري سنجيده شود. pH نمونه مايع مني طبيعي در محدوده 8/5- 7/2 ميباشد.
شمارش اسپرمها (Sperm count):
شمارش اسپرمها با استفاده از لام نئوبار و يا با استفاده از دستگاههاي مخصوص آناليز اسپرم صورت ميگيرد. شمارش طبيعي اسپرمها در محدوده 200- 20 ميليون در ميليليتر ميباشد. تعداد بسيار پايين و يا بسيار بالاي اسپرمها ميتواند با ناباروري در ارتباط باشد. شمارش اسپرمها ميتواند از يك روز به روز ديگر فرق نمايد. بنابراين بهتر است كه اين تست، دو مرتبه تكرار شده و در صورت لزوم، نمونه سومي هم به مدت سه هفته پس از آزمايشات قبلي گرفته و آزمايش تكرار شود.
داروهاي ضد سرطان، آزاتيوپرين، سيمتيدين، استروژنها، كتوكونازول و متيل تستسترون ممكن است موجب كاهش تعداد اسپرمها شوند. توليد مايع مني وابسته به عملكرد بيضهها بوده و بررسي مايع مني در حقيقت بررسي عملكرد بيضهها ميباشد. توليد ناكافي اسپرمها در مواردي از قبيل نارسايي اوليه گنادها (سندروم كلاين فلتر، عفونت، دريافت اشعه و يا اوركيدكتومي) و يا نارسايي ثانويه گنادها (ايجاد شده به وسيله بيماريهاي هيپوفيزي) ديده ميشود.
در صورت كاهش تعداد اسپرمها، ممكن است تست قروكتوز درخواست شود. در حالت طبيعي، سطح فروكتوز مايع مني، بيش از mg/dl 150 ميباشد.
بررسي حركت اسپرم (Motility):
بررسي حركت اسپرمها با استفاده از بررسي روي لام و يا توسط دستگاههاي مخصوص آناليز اسپرم صورت ميگيرد. در موارد طبيعي بايستي بيش از 50 درصد اسپرمها داراي حركت پيشرونده و يا بيشتر از 25 درصد اسپرمها داراي حركت پيشرونده سريع در طي 60 دقيقه پس از جمعآوري نمونه باشند.
تحرك اسپرمها ممكن است به صورت زير نيز بيان شود:
كلاس A: حركت پيشرونده سريع
كلاس B: حركت پيشرونده كند
كلاس C: حركت غير پيشرونده
كلاس D: بدون حركت
در صورت كاهش تحرك اسپرمها به ويژه زماني كه اسپرمها به صورت تودهاي (Clumping) كنار هم قرار گرفته باشند، ممكن است تست بررسي آنتيبادي ضد اسپرم در مرد درخواست شود.
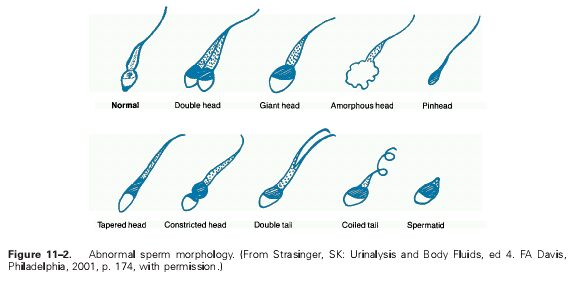
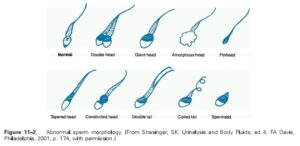
مرفولوژي اسپرمها (Morphology):
بررسي مرفولوژي اسپرمها با استفاده از بررسي روي لام و يا توسط دستگاههاي مخصوص آناليز اسپرم صورت ميگيرد. در موارد طبيعي بايد بيش از 30 درصد اسپرمها داراي شكل طبيعي باشند. براي بررسي مرفولوژي اسپرمها ابتدا يك اسمير (گسترش) تهيه شده و سپس از رنگآميزي پاپانيكولائو استفاده ميشود.
زنده بودن اسپرمها (Vitality):
در موارد طبيعي بايد بيش از 75 درصد اسپرمها زنده باشند.
چنانچه نتايج حاصل از بررسي مايع مني، طبيعي گزارش شوند و همچنان مسئله ناباروري در زوج مطرح باشد، تست بررسي آنتيبادي هاي ضد اسپرم در زن بايد انجام شود.
تعريف برخي اصطلاحات مورد استفاده در آزمايش مايع مني:
- نورموزوسپرمي (Normozoospermia): مايع مني طبيعي مطابق با مقادير رفرانس
- اليگوزوسپرمي (Oligozoospermia): تعداد اسپرمهاي كمتر از محدوده طبيعي
- آستنوزوسپرمي (Asthenozoospermia): ميزان تحرك كمتر از حد طبيعي اسپرمها
- تراتوزوسپرمي (Teratozoospermia): ميزان مرفولوژي كمتر از حد طبيعي اسپرمها
- اليگوآستنوتراتوزوسپرمي (Oligoasthenoteratozoospermia): تعداد، تحرك و مرفولوژي كمتر از حد طبيعي اسپرمها
- آزوسپرمي (Azoospermia): فقدان اسپرمها در مايع مني (كه تقريباً در 2% از مردان نابارور مشاهده ميشود).
- آاسپرمي (Aspermia): فقدان مايع مني
يك آزمايش طبيعي مايع مني به تنهايي براي بررسي ناباروري مردان كافي نبوده و بايد اسپرمها در مجاورت ترشحات سرويكال قرار گرفته (آزمايش Sims-Hunter) و سپس از نظر بقا بررسي شوند.
بررسيهاي باكتريولوژيكي (Bacteriological analysis):
در شرايط طبيعي مايع مني يك محيط استريل ميباشد. در برخي موارد مشكوك به عفونت در مايع مني، ممكن است كشت مايع مني از نظر باكتريهاي هوازي و يا غير هوازي درخواست گردد.
بررسيهاي بيوشيميايي (Biochemical analysis):
آزمايش فروكتوز به عنوان يك ماركر براي سمينال وزيكل، آزمايشات روي، اسيد سيتريك و يا اسيد فسفاتاز به عنوان ماركرهايي براي پروستات و كارنيتين و آلفا- گلوكوزيداز به عنوان ماركرهايي براي اپيديدم از جمله بررسيهاي بيوشيميايي مايع مني ميباشند. فروكتوز مايع مني، عملكرد ترشحي كيسههاي مني را منعكس مينمايد.
آنتيباديهاي ضد اسپرماتوزوئيدها (ASA) (Antispermatozoal antibody):
اسامي ديگر اين آزمايش شـــــــــــــامل Sperm agglutination and inhibition، Sperm antibodies، Antisperm antibodies و Infertility screen ميباشد.
آزمايش بررسي آنتيباديهاي ضد اسپرم، يك تست غربالگري ناباروري براي تشخيص آنتيباديهاي ضد اسپرم ميباشد. اين آنتيباديها عليه آنتيژنهاي اسپرم بوده و با اختلال در عملكرد اسپرمها از قبيل تحرك اسپرمها، نفوذ در موكوس سرويكال و نفوذ در اسپرم، منجر به كاهش باروري ميگردند كه در موارد شديد، تزريق درون سيتوپلاسمي اسپرم (ICSI) (Intracytoplasmic sperm injection) تنها راه درمان است. اين آزمايش معمولاً در زوجهاي نابارور مورد استفاده قرار گرفته و ممكن است در خون مردان مبتلا به انسداد مجاري وابران (efferent) (يك عامل شايع در ايجاد تعداد اسپرمهاي پايين و يا تحرك ضعيف) و همچنين در 70- 30 درصد مرداني كه قبلا وازكتومي داشتهاند يافت گردد. بازجذب اسپرمها از مجاري مسدود شده منجر به تشكيل اتو آنتيباديهايي عليه آنتيژنهاي اسپرمها ميگردد كه منجر به واكنشهاي ايمني ميگردد.
آنتيباديهاي از نوع IgA عليه دم اسپرمها موجب كاهش تحرك اسپرمها و كاهش قدرت نفوذ آنها به درون موكوس سرويكال ميگردد. آنتيباديهاي از نوع IgG عليه اسپرمها موجب بلوكه شدن واكنش اسپرم- تخمك ميگردد. تيترهاي بالاي اتوآنتيباديهاي از نوع IgG معمولاً با دژنراسيون بيضهها متعاقب وازكتومي در ارتباط ميباشد كه نشان دهنده اين نكته است كه چرا 50 درصد مردها حتي پس از بازگرداندن موفقيت آميز وازكتومي، همچنان نابارور باقي ميمانند.
معمولاً تيتر بالاي آنتيباديهاي عليه اسپرم در مردان، يك فاكتور قوي به نفع ناباروري در اين افراد ميباشد. براي تيتر پايين اين آنتيباديها اهميتي ذكر نشده است. آنتيباديهاي ضد اسپرم در سرم تقريباً 20 درصد از خانمها يافت ميگردد. با اين وجود، اغلب اين خانمها، حامله ميشوند، بنابراين اهميت اين آنتيباديها در خانمها روشن نشده است.
آنتيباديهاي ضد اسپرم همچنين در اسپرم مردان نابارور و سرويكال موكوس زنان نابارور يافت شده است.
:References
1-WHO Task force on methods for the regulation of male fertility. 2001.
2-Tietz Textbook of Clinical Chemistry and Molecular Diadnosis. 2006; Fourth Edition.
3-Harrisons principles of internal medicine. 2005; 16th Edition.
4-Harrisons principles of internal medicine. 2005; 16th Edition.
5-Guyton AC and Hall JE. Textbook of medical physiology. 2006; 11th Edition.
6-Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
7-A Manual of Medical Laboratory Technology. Patel A.H. Navaneet Publication . 1994.
8-Henrys Clinical Diagnosis and Management by Laboratory Methods. 2007; Twenty-First Edition.
https://www.webmd.com/infertility-and-reproduction/guide/what-is-semen-analysis
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام