ژندرمانی و کاربرد وکتورها
الهام پوییده1، دکتر احسان عارفیان2، دکتر عباس اخوان سپهی 3
1- کارشناس ارشد میکروبیولوژی. دانشکاهآزاد اسلامی. واحد علوم تحقیقات، تهران، ایران .dr.pouide@gmail.com
2- استادیار بخش ویروسشناسی، دانشکده زیستشناسی، پردیس علوم پایه، دانشگاه تهران، تهران، ایران.arefian@ut.ac.ir
3- استاد گروه میکروبیولوژی، دانشکده علوم زیستی، دانشگاه آزاد اسلامی واحد تهران شمال، تهران، ایران.
مقدمه:
ژندرمانی شامل وارد کردن یک ژن به داخل یک سلول برای رسیدن به نوعی اثر درمانی با انتقال نسخههای واجد عملکرد ژن است. هدف از ژندرمانی بهبود بخشیدن به سلامت بیمار از طریق اصلاح تیپ جهشیافته است، برای این منظور ورود ژنهای طبیعی به سلولهای پیکری (سوماتیک) الزامی است. استفاده از روش ژندرمانی در شرایط زیر لازم است:
- جهت جبران یک ژن جهشیافتهی سلولی که در اثر جهش، عملکرد آن ژن از بین رفته است؛ مانند درمان بیماری مغلوب اتوزومال فنیل کتونوریا. این بیماری یک نقص ژنتیکی است که باعث تجمع فنیلآلانین در مایعات بدن و سیستم عصبی شده و اختلالاتی در مغز و پوست ایجاد میکند.
- جایگزین نمودن یا غیرفعال کردن یک ژن جهشیافتهی غالب که فرآورده یا فرآوردههای غیرطبیعی آن سبب بیماری میشود؛ مانند بیماری هانتینگتون که در اثر جهش در ژن هانتینگتون ایجاد شده و در بزرگسالی حرکات غیرارادی، اختلالات شناختی و روانی ایجاد میکند.
- رسیدن به اثری فارموکولوژیک جهت مقابله با یک ژن یا ژنهای جهشیافتهی سلولی که عملکرد آنها در بدن باعث ایجاد بیماری میشود، مانند مبتلایان به بیماری اکتسابی سرطان.
خصوصیات ژن انتقالیافته
ژن انتقالیافته اغلب بخشی از DNA است که همراه با عناصر تنظیمی به سلول هدف وارد میشود. این عناصر تنظیمی باید بهگونهای انتخاب شوند که بتوانند ژن انتقالیافته را به میزان کافی در سطح سلول هدف رونویسی کرده و به پیامهای تنظیمکنندگی ضروری پاسخ دهند.
خصوصیات سلول هدف:
سلول هدف باید نیمهعمر طولانی و توانایی تکثیر بالایی داشته باشد تا اثر زیستی انتقال ژن دوام یابد. سلولهای هدف ایدهآل، سلولهای بنیادی یا اجدادی با قابلیت همانندسازی بالا مانند سلول مغز استخوان و سلولهای اندوتلیال هستند.
همچنین سلول هدف باید دارای پروتئینها و لیگاندهای لازم برای انتقال باشد.
روشهای انتقال ژن
- روش اول: وارد کردن ژن به سلولهای کشت دادهشده از بیمار در خارج از بدن و سپس وارد کردن سلولها به بدن بیمار پس از انتقال ژن است.
- روش دوم: تزریق مستقیم ژن به داخل بافت یا مایع خارج سلولی موردنظر از طریق ناقلهای ویروسی و غیرویروسی. لازم به ذکر است استفاده از ناقلهای غیرویروسی در مراحل مقدماتی است.
ناقلهای ویروسی:
ناقل ایدهآل برای ژندرمانی باید ویژگیهای زیر را داشته باشد:
- بیخطر باشد.
- بهراحتی ساخته شود.
- بهآسانی وارد بافت هدف گردد.
- سبب بروز مادامالعمر ژن در سطوح مناسب شود.
تاکنون انواع مختلفی از ویروسها جهت ژندرمانی بررسی شدهاند. برخی از مهمترین آنها عبارتند از:
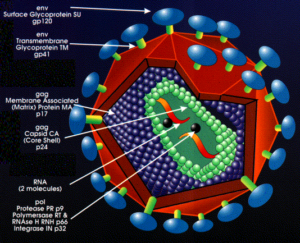
1: (RV)Retroviruses: این دسته از ویروسها قابلیت کپیبرداری از ژنوم تکرشتهای RNA را بهصورت نسخهی دو رشتهای DNA دارند.RV تنها حامل انتخابی است که فقط سلولهای در حال تقسیم را آلوده میکند. این ویژگی برای درمان تومورها بسیار حائز اهمیت است.
حاملهای طراحیشده بر اساس لنتی ویروسها (Lenti virus) مانند ویروسHIV میتوانند سلولهای ارگانهای مختلف مانند قلب، کبد، مغز و عضلات را آلوده کنند. تنها ایراد ممکن در استفاده از این گروه ویروسها، ایمنی زیستی پایین و از دست رفتن توانایی تکثیر در رتروویروسها است که منجر به کاهش تیتر ویروس در بافت هدف میشود.
2: Adeno Viruses(AD): ویروسهایی با ژنوم DNA دو رشتهای هستند که در انسان عفونتهای ریوی، گوارشی و تنفسی ایجاد میکنند. اهمیت این گروه از ویروسها در آسانی تولید، ایجاد ایمنی نسبی، امکان خالصسازی و تغلیظ در مقادیر بالا و قابلیت ژنرسانی به سلولهای خاموش علاوه بر سلولهای در حال تقسیم است.
اصلاحات متعددی جهت رفع مشکلات این دسته صورت گرفته که منجر به توسعهی نسل سوم آدنوویروسها شده است. این گروه حاملهای وابسته به یاور (Helper dependent vector) خوانده میشوند.
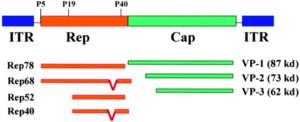
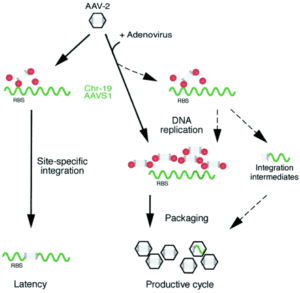
3: Adeno Associated viruses(AAV): ویروسهایی کوچک با DNA تکرشتهای هستند که میتوانند مواد ژنتیکی خود را در جایگاه خاصی در کروموزوم 19 وارد کنند.
گرچه 90% از جمعیت انسانی، آنتیژنهای این ویروس را در خون خود دارند، اما هیچ بیماریزایی عمدهای از این ویروس گزارش نشده است.
در مقایسه با سایر حاملهای ویروسی، این گروه از نظر فضایی پایداری بالایی داشته و نسبت به حرارت، شرایط اسیدی، شویندهها و حلالها مقاوم هستند. AVV قادر به آلوده کردن گسترهی وسیعی از سلولها است. بیان ژن توسط این گروه با ورود اپیزومهای ویروس به سلول هدف، سبب میشود تا احتمال ایجاد موتاسیون ناشی از ورود ژنوم ویروسی به کروموزوم انسانی به حداقل میزان ممکن برسد. ویژگیهای متعدد AVV سبب شده تا امروزه این حامل برای کاربردهای ارتوپدی، ژندرمانی در استخوان، غضروف، رباط و جراحیهای سر و صورت حائز اهمیت قرار گیرد.
4: Herpes simplex viruse (HSV): ویروسهایی با DNA دورشتهای هستند که میتوانند سلول را عفونی کرده و سپس در سلولهای نورونی در فاز نهفته باقی بمانند. این ویژگی، HSV را برای ژنرسانی به نورونها مناسب کرده است. مکانیسم عفونی این ویروس، احتمال جهشزایی را در آن کاهش داده است، همچنین HSV قادر به پذیرش و حمل قطعات بزرگ DNA است.
روشهای غیرویروسی:
1: تزریق DNA برهنه: این روش سادهترین و کمهزینهترین روش غیرویروسی است که با شیوههای مختلفی صورت میگیرد:
الف- ژنرسانی هیدرودینامیک: تزریق حجم زیادی از DNA برهنه به سیاهرگ.
ب- تزریق حجم کم DNA برهنه به بزرگ سیاهرگ زیرین
ج- تزریق درون عضلهای DNA پلاسمیدی
2: ژنرسانی به کمک امواج الکتریکی (Electro poration): در این روش از پالسهای کوتاه با ولتاژ بالا جهت انتقال ژن به درون سلول استفاده میشود. این شوک الکتریکی یک روزنهی موقت در غشاء سلولی ایجاد کرده و مولکول DNA را از عرض غشاء عبور میدهد.
3: تفنگ ژنی (Gene gun): در این روش DNA را با ذرات طلا پوشش داده و سپس آن را درون وسیلهای میگذارند که به ژن نیرو وارد میکند و آن را به درون سلول نفوذ میدهد.
4: ژنرسانی با امواج صوتی (sono portion): با استفاده از فرکانسهای اولتراسونیک، انتقال DNA به درون سلول انجام میشود. منافذی که توسط انرژی صوتی ایجاد میگردد، یکپارچگی غشاء را از بین برده و سبب میشود DNA نقلمکان کند.
5: ژنرسانی با میدان مغناطیسی (magneto fection): این روش «انتقال اسیدهای نوکلئیک به هستهی سلول تحت میدان مغناطیسی» است. حاملهای اسیدهای نوکلئیک با نانوذرات مغناطیسی کمپلکس تشکیل داده و به محیط کشت اضافه میشوند، سپس با قرار دادن یک میدان مغناطیسی در بخش تحتانی بافت کشت دادهشده، DNA تحریک میشود تا در تماس نزدیک با لایهی سلولی قرار گرفته و وارد سلول شود.
6: الیگونوکلئوتیدها: از الیگونوکلئوتیدهای سنتزی برای غیرفعال کردن ژنهایی که در روند یک بیماری نقش دارند، استفاده میشود. این گروه با توقف رونویسی از ژن معیوب یا استفاده از SirNA برای تخریب توالیهای MRNA معیوب و توقف بیان ژن، عمل میکند.
7: لیپوپلکس و پلیپلکس: پلیمرهایی از لیپیدهای طبیعی با بار منفی یا خنثی هستند که بهعنوان پوشش بار مثبت DNA و محافظت از آن در محیط بیولوژیکی و طی ورود به سلول بهکار میروند. مشکل عمدهی این دسته، فعالسازی سریع سیستم ایمنی ذاتی و افزایش سایتوکینهای پیشالتهابی است.
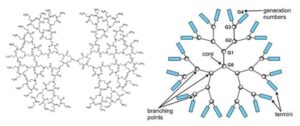
8: دندریمرها: ماکرومولکولهایی با شاخههای جانبی متعدد و شکل کروی هستند که بار الکتریکی مثبت دارند و بهطور موقت به اسیدهای نوکلئیک متصل شده و در انتقال آنها نقش دارند. کمپلکس تشکیل شده توسط اندوستیوز وارد سلول میشود.
9: باکتوفکشن (Bctofection): انتقال اسیدهای نوکلئیک توسط باکتریها به درون سلول جهت ژندرمانی را باکتوفکشن میگویند. اغلب باکتریهای قابل استفاده در این روش عبارتند از: لیستریا، سالمونلا، شیگلا، سودوموناس و استافیلوکوک
گرچه این روش بسیار ساده و کاربردی است، اما احتمال ارتباط میان باکتری و سلول میزبان، ریسک آن را بالا برده است.
رهیافتهای موفقیتآمیز در درمان سرطان:
ژندرمانی برای درمان سرطانها از چندین راهکار کلی استفاده میکند:
- ارتقاء سیستم ایمنی برای مقابله با پیشرفت سرطان
- استفاده از ژنهای عمومی یا اختصاصی سرکوبکنندهی تومور (53p)
- شکستن MRNAهای کدکننده انکوژنی از طریق RNAI
- القای تکثیر لیتیک در سلولهای سرطانی و لیز نمودن آن
- بیان پروتئینهای ضد رگزایی
- استفاده از MiRNA برای تنظیم عملکرد ژنهای دچار اختلال
ژندرمانی و افقهای پیش رو
در سال 1990 وقتی برای اولین بار، استفاده از ژندرمانی جهت درمان بیماریهای لاعلاج با موفقیت همراه شد، نوید آیندهای درخشان را میداد، اما استفاده از این روش بسیار سخت و زمانبر بود. گرچه وکتورهای ویروسی کارآیی قابلتوجهی از خود نشان دادهاند، اما هنوز از نظر ایمنی و سایر ملاحظات تحت بررسی متخصصین هستند. اکنون بعد از گذشت 29 سال از شروع ژندرمانی، تا حدودی شواهد بالینی مورد انتظار بدست آمده و آیندهی موفقتری را نوید میدهد. گرچه حاملهای پلاسمیدی و لیگاندهای لیپیدی متعددی برای انتقال ژنها به درون سلول طراحی شدهاند، اما هنوز برای یافتن یک حامل تمام عیار و قابل استفاده، راهی طولانی در پیش است. حیطهی دیگری از ژندرمانی که همچنان نیازمند مطالعات دقیقتر است، غلبه بر اثرات سمی حاملهای ژنی بر روی سلولها و بافتهاست.
با توجه به اینکه همهی بیماریهای ژنتیکی ارثی نیستند، بسیاری از صفات بیولوژیکی و فنوتیپهای بیماری، تحت اثر پارامترهای اپیژنیک و بروز تغییراتی در هیستونها، کروماتین و DNA رخ میدهد. بهنظر میرسد این اهداف در آیندهی ژندرمانی مورد توجه بیشتری قرار گرفته و آیندهای روشن در درمان بیماریهای وخیم و لاعلاج بسازند.
References:
1.Calvet CY, André FM, Mir LM. Dual
therapeutic benefit of electroporation-mediated
DNA vaccination in vivo: Enhanced gene transfer
and adjuvant activity. Oncoimmunology 2014;29(3):
28540-8.
2-46. Ibraheem D, Elaissari A, Fessi H. Gene
therapy and DNA delivery systems. Int J Pharm
2014;459(1):70-83.
3- H Sum C, Wettig S, A Slavcev R. Impact of
DNA vector topology on non-viral gene therapeutic
safety and efficacy. Curr Gene Ther
2014;14(4):309-29.
4-Gupta G, Arora S, Singh S, Singh N.
Advances in magnetofection magnetically guided
nucleic acid delivery: a review. J Pharm Technol
2013;1(7):19-29.
5-Guo P, Haque F, Hallahan B, Reif R, Li H.
Uniqueness, advantages, challenges, solutions, and
perspectives in therapeutics applying RNA
nanotechnology. Nucleic Acid Ther 2012;22(4):226-
6-Yu S, Wesselingh S, et al. Increase in DNA
vaccine efficacy by virosome delivery and coexpression
of a cytolytic protein. ClinTransl
Immunol 2014;3(6):e18.
7-Miravet S, Ontiveros M, Piedra J, Penalva C,
Monfar M, Chillón M. Construction, Production,
and Purification of Recombinant Adenovirus
Vectors.Adenovirus. New York: Springer; 2014.
- 159-73.
8-Abootalebi N, Niroumand U, Ebrahimi N, et al.
Magnetic properties and antimicrobial effect of
amino and lipoamino acid coated iron oxide
nanoparticles. Minerva Biotecnol 2016;28(4):177-
86.5
9-Bauer G, Anderson JS. Principles of Gene
Therapy.Gene Therapy for HIV. New York:
Springer; 2014. p. 1-8.
10-Shaw A, Cornetta K. Design and potential of
non-integratinglentiviral vectors. Biomedicines
2014;2(1):14-35.
11-Yang Y, Meng H, Peng Q, Yang X, Gan R,
Zhao L, et al. Downregulation of microRNA-21
expression restrains non-small cell lung cancer cell
proliferation and migration through upregulation of
programmed cell death 4. Cancer Gene Ther
2014;In press.
نقش ترانسپوزونها در پروکاریوتها (3)
تکنیکهای بررسی برهمکنشهای پروتئین- پروتئین در تحقیقات پروتئومیکس
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام