ارتباط سرطان سر و گردن با ویروس پاپیلوما و بررسی تنوع ژنوتیپی آن در مردان مبتلا به ضایعات دهانی در سال 93 در تهران
الهام پوییده1، دکتر احسان عارفیان2، دکتر علیاصغر دلدار3، دکتر عباس اخوان سپهی4
1- کارشناس ارشد میکروبیولوژی. دانشگاه آزاد اسلامی. واحد علوم تحقیقات، تهران، ایران
2- استادیار بخش ویروسشناسی، دانشکده زیستشناسی، پردیس علوم پایه، دانشگاه تهران
3- استادیار گروه ژنتیک دانشگاه مالک اشتر، تهران، ایران
4- استاد گروه میکروبیولوژی، دانشکده علوم زیستی، دانشگاه آزاد اسلامی واحد تهران شمال
چکیده:
هدف مطالعه: سرطان سلول سنگفرشی حدود 93% از سرطانهای حفرهی دهانی را تشکیل میدهد. یکی از عوامل ایجادکنندهی این سرطان، ویروس پاپیلومای انسانی است که تنوع ژنوتایپی گوناگونی دارد. تعیین ژنوتیپهای شایع پاپیلوما در ایجاد سرطان دهان میتواند در کنترل و جلوگیری از انتقال آن نقش داشته باشد.
مواد و روشها: 35 نمونه بافت پارافینه از بخش کنسر بیمارستان امام خمینی تهران تهیه شده و پارافینزدایی گردید، برای شناسایی ژنوتیپهای 6-16-18-33-34 با کمک نرمافزار AlleleID 7، 1 پرایمر سنس و 3 پرایمر آنتیسنس دژنره طراحی گردید. نمونهها PCR شده و سپس محصول واکنش بر روی ژل آگارز، الکتروفورز شد. نمونههای HPV مثبت تعیین سکانس شده و نتایج توالییابی توسط Blast تعیین هویت شدند.
نتایج و نتیجه گیری: 5 نمونهی HPV مثبت به دست آمد که 2 نمونه HPV تایپ 6 و 3 نمونه HPV-16 بودند. HPV-6 عامل مولد زگیل تناسلی است که از طریق تماس پوست با پوست یا روابط دهانی- تناسلی انتشار مییابد. انتشار ویروس در مردان 2% بیشتر از زنان است. بالاترین استعداد ابتلا به بیماری در سنین بین 30 تا 45 سال و پس از آن بالای 60 سال است. همچنین نمونههایHPV مثبت در شهر تهران نسبت به شهرستانهای اطراف بیشتر بوده است.
کلیدواژهها: کارسینوم سلول سنگفرشی، ویروس پاپیلومای انسانی، واکنش زنجیرهای پلیمراز
مقدمه:
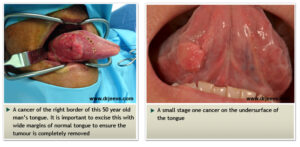
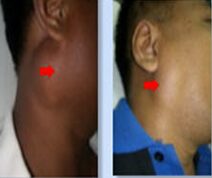
سرطان دهان، از کنترل خارج شدن رشد و تکثیر سلولهای سنگفرشی دهان است که «کارسینوم اسکواموس» نامیده میشود و در ابتدا بهصورت ضایعات پیشسرطانی مشاهده میشود (49-47-23-1). این بیماری اغلب لثه، غدد بزاقی، لب، غدد لنفاوی گردن، لوزهها، گونهها، فک و زبان را درگیر کرده و سبب لق شدن دندانها، بدشکلی صورت، گلودردهای مداوم، اختلال در بلع، زخمهای سفید و دیرخوبشونده در دهان و گوشدردهای طولانیمدت میشود (52-48-21-17).
عوامل متعددی از قبیل مصرف سیگار و الکل، روابط جنسی دهانی- تناسلی، سابقهی سرطان، دندان خراب، نور خورشید، رژیم غذایی فاقد میوه و سبزی تازه و سن بالای 40 سال، شانس ابتلا به سرطان را افزایش میدهد (57-44-35-19-11).
پاپیلوماویروس از خانوادهی ویروسهای DNAدار دورشتهای، دارای 100 ژنوتیپ مختلف است که تمایل بسیاری به سلولهای پوششی پوست و سلولهای مخاطی دارد، بنابراین در پوست طبیعی افراد سالم بهوفور یافت میشود و حتی میتواند سبب بروز انواع سرطانها از جمله سرطان دهان گردد (31-25-22-10-4).
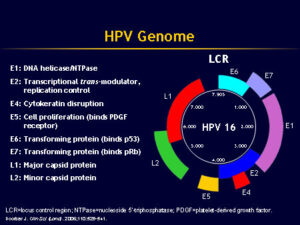
شکل 1: ساختار ژنوم ویروس پاپیلوما
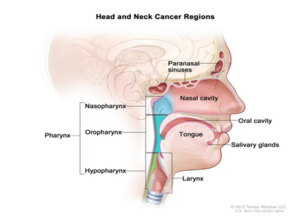
اگر ضایعات پیشسرطانی در مراحل اولیهی عفونت تشخیص داده نشود، از لحاظ مورفولوژیکی، ضایعهی خوشخیم به بدخیم تبدیل میشود. (28-17)، لذا تشخیص بهموقع عفونت ویروسی میتواند در جلوگیری از پیشرفت ضایعات مؤثر باشد. اگرچه ویروس پاپیلوما ژنوتیپهای مختلفی دارد، اما تمام ژنوتیپهای آن نمیتوانند سبب بروز سرطان سر و گردن شود. این ویروسها میتوانند نواحی گوناگونی را آلوده کرده و سبب بروز سرطان سر و گردن شوند که در شکل نشان داده شده است.
شکل 2: نواحی مختلفی که توسط ویروس پاپیلوما آلوده میشوند
اربابی و همکاران با بررسی نمونههای بزاق دهان و استفاده از روش PCR–RT، فقط ژنوتیپهای 16 و 18 را در ارتباط با سرطان دهان شناسایی کردند (5). مشهدی، هراتیان و نیک اخلاق با همکارانشان نیز در آزمایشهایی جداگانه و با استفاده از روش PCR، نتیجهی مشابهی بدست آوردند (31-22-21) .در اسپانیا لاماس و همکارانش تنها ژنوتیپ 16 را از نمونهی بیماران جدا کردند (39-38-37). در هند نیز گوت-هی توانست ژنوتیپ 18 را از بیماران جدا کند (28-13-7).
در آرژانتین، آنیلس و همکارانش استخراج ژنوتیپ 6 و 16 را در نمونههای بیماران گزارش کردند (62-16-3-2).
با توجه به اهمیت پاپیلوما ویروس در ایجاد سرطان دهان، این تحقیق برپایهی شناسایی ژنوتیپهای شایع این ویروس در ایجاد بیماری در بین مراجعهکنندگان به بیمارستان امام خمینی تهران انجام گرفته است تا شاید گامی در جهت شناسایی بهموقع و پیشگیریکننده از سرطان دهان برداشته شود.
مواد و روشها:
نمونهبرداری
در این مطالعهی توصیفی- تحلیلی 35 نمونه بلوک پارافینی که دارای بافت کافی بود از بین پروندههای مردان موجود در بخش کنسر در بیمارستان امام خمینی تهران انتخاب شدند. این نمونهها از سراسر کشور جمعآوری شده و به این مرکز انتقال یافته بودند و همگی مربوط به سال 93 بودند. بیماران مراجعهکننده نیز از 15 تا 75 ساله بودهاند. اسلایدهای میکروسکوپی مورد بررسی قرار گرفت و وجود سرطان در بافتها تأیید گردید.
استخراج DNA و PCR
نمونهها بهوسیلهی دستگاه میکروتوم به قطر 0/9 میلیمتر برش زده شد و به مدت یک شب در دمای محیط قرار گرفت، سپس بافتها پارافینزدایی شدند. برای این کار از بافر Deparaffinization، اتانل، بافر لیزکننده و پروتئاز در مراحل مختلفی استفاده شد و سانتریفیوژ انجام گرفت. در مرحلهی پایانی نمونهها توسط بافر Elution Buffer از ستون جدا شده و محلول محتوی DNA سریعاً به فریزر و دمای 20- درجه سانتیگراد انتقال یافت.
برای تعیین مقدار و کیفیت DNA استخراجشده از روش الکتروفورز استفاده شد. باندهای حاصل از DNA در هر نمونه که دارای کمترین کشیدگی و کاملاً واضح بود، کیفیت مطلوب DNA را نشان میداد.
شکل 3: دستگاه الکتروفورز
بهمنظور انجام واکنش زنجیرهای پلیمراز (PCR) بر روی نمونهها، ابتدا 5 پرایمر سنس و 13 پرایمر آنتیسنس بر اساس پروتئینهای اولیهی E6 و E7 طراحی گردید. سپس پرایمرها دژنره شده و در نهایت یک پرایمر سنس و سه پرایمر آنتیسنس به دست آمد. توالی پرایمرهای مورداستفاده در جدول شماره 1 آمده است.
جدول 1- پرایمرهای لازم برای تکثیر و شناسایی نمونههای HPV پرخطر
| توالی | وضعیت |
| GCN CAG GGH YWH AAY AAT GG | پرایمر سنس |
| GCC MAR SGG AAA CTG ATC | پرایمر آنتیسنس RIP |
| GCG ACC CAA TGC AAA TTG GT | پرایمر آنتیسنس RS |
| CGW CCH ARD GGR WAY TGR TC | پرایمر آنتیسنس RFG |
در مرحله بعد مخلوط PCR در حجم 25 میلیلیتر به شرح زیر تهیه شده و درون تیوبهای ml0/2 z استریل آماده گردید (جدول 2).
جدول 2- اجزای PCR و مقادیر آن
| مقادیر (ml) | ترکیبات |
| 1 | پرایمر سنس |
| 1 | پرایمر آنتیسنس |
| 12/5 | Master mix |
| 100 نانوگرم | DNA الگو |
| تا حجم نهایی 25 | H2O استریل |
سپس فرآیند PCR شامل مراحل زیر انجام گرفت:
- مرحلهی اول شامل 94 درجه سانتیگراد به مدت 5 دقیقه
- مرحلهی دوم شامل 40 چرخهی سهمرحلهای مشتمل بر:
- 94 درجه سانتیگراد به مدت 45 ثانیه
- 54 درجهی سانتیگراد به مدت 45 ثانیه
- 72 درجهی سانتیگراد به مدت 1 دقیقه
- مرحلهی سوم شامل 72 درجه سانتیگراد به مدت 7 دقیقه
بعد از پایان فعالیت دستگاه، فرآوردههای PCR به دستگاه الکتروفورز انتقال یافته و سرانجام نتایج پس از رنگآمیزی با اتیدیوم بروماید با استفاده از نورافشان اشعهی فرابنفش مورد بررسی قرار گرفتند.
شکل 3: تصویر نمونههای مثبت روی ژل در ناحیهی bp492
توالییابی و آنالیز نتایج:
نتایج نشان داد که از 35 نمونه تحت بررسی، تنها 5 نمونه مثبت شدند. محصول PCR در نمونههای مثبت برحسب نوع ژنوتایپ ویروس، برای HPV-6 دارای طولی معادل 435 و برای HPV-16 طولی معادل 492 جفت باز داشتند. مثبت شدن این نمونهها نشان میداد بروز سرطان سر و گردن با حضور ویروس پاپیلوما در ارتباط است.
با انجام مراحل تعیین توالی ژنی، ژنوتیپهای ایجادکنندهی سرطان سر و گردن در بین ژنوتیپهای موردمطالعهی 6-11-16-18-33 و 34 مورد بررسی قرار گرفتند. همتراز کردن نمونههای مثبت توسط نرمافزار MEGA5 انجام گردید. تعیین توالی نوکلئوتیدی محصول PCR نیز توسط شرکت ژن فناوران انجام گرفت. پس از انجام PCR و توالییابی ژنی، پروندههای بیماران بررسی و اطلاعات دموگرافیک موردنیاز استخراج و با استفاده از نرمافزارSPSS مورد تجزیه و تحلیل قرار گرفت.
نتایج:
در مطالعهی حاضر که جهت بررسی ژنوتیپهای شایع پاپیلوما ویروس در ایجاد سرطان دهان بر روی 35 بیمار انجام گرفت، 5 نمونه پس از انجام PCR و الکتروفورز مثبت شدند. توالیهای نوکلئوتیدی نمونههای مثبت پس از توالییابی توسط نرمافزار +Blast در NCBI مورد بررسی قرار گرفتند. پس از انجام بررسیها نتایج زیر بدست آمد:
CCCACCACGAAGATCACTGCTTGTTCTGTGGTAGATACCACACGCAGTACCAACA
TGACATTATGTGCATCCGTAACTACATCTTCCACATACACCAATTCTGATTATAA
AGAGTACATGCGTCATGTGGAAGAGTATGATTTACAATTTATTTTTCAATTATGT
AGCATTACATTGTCTGCTGAAGTAATGGCCTATATTCACACAATGAATCCCTCTGT
TTTGGAAGACTGGAACTTTGGGTTATCGCCTCCCCCAAATGGTACATTAGAAGA
TACCTATAGGTATGTGCAGTCACAGGCCATTACCTGTCAAAAGCCCACTCCTGA
AAAGGAAAAGCCAGATCCCTATAAGAACCTTAGTTTTTGGGAGGTTAATTTAAAA
GAAAAGTTTTCTAGTGAATTGGATCAGTTCCCCCTTGGGCAAAAAATTGTCCTTTTTTTC
شکل 4: توالیهای بدست آمده از بیماران مربوط به تایپ 6 پاپیلوما
GATCACTGCTTGTTCTGTGGTAGATACCACACGCAGTACCAAGGAGGAATATGATTT
ACAGTTTATTTTTCAACTGTGCAAAATAACCTTAACTGCAGACGTTATGACATACAT
ACATTCTATGAATTCTACTATTTTGGAGGACTGGAATTTTGGTCTACAACCTCCCCCA
GGAGGCACACTAGAAGATACTTATAGGTTTGTAACATCCCAGGCAATTGCTTGTCAA
AAACATACACCTCCAGCACCTAAAGAAGATCCCCTTAAAAAATACACTTTTTGGGAA
GTAAATTTAAAGGAAAAGTTTTCTGCAGACCTAGATCAGTTTCCTTTAGGACGCAA
ATTTTTACTACAAGCAGGATTAAAGGCCAAACCAAAATTTACATTAGGAAAACGAA
AAGCTACACCCACCACCTCATCTACCTCTACAACTGCTAAACGCAAAAAACGTAAGC
TGTAAGTATTGTATGTGTGTTGAATTAGTGTTGTTTGTTGTTTATATGTTTGTAT
GTGCTTCAGTTCCCCCTTGGGCA
شکل 5: توالیهای بهدستآمده از بیماران مربوط به تایپ 16 پاپیلوما
نمونههای مثبت حاوی ژنوتیپهای 16 و 6 بودند که 1 نمونه HPV6 و 2 نمونه HPV16 بود.
بحث:
امروزه مطالعه بر روی سرطان سلول سنگفرشی بهعنوان شایعترین تومور حفرهی دهانی و ارتباط آن با فاکتورهای مختلف، اساس تحقیقات گستردهای در سراسر دنیا است (41-35-17-9-5). در این مطالعه تنوع ژنوتیپی گونههای پاپیلوما ویروس در ارتباط با سرطان دهان مورد بررسی قرار گرفت، سپس ارزیابی حضور ویروس پاپیلومای انسانی توسط روش PCR انجام شد تا حضور ویروس در DNA بیماران بهصورت مثبت یا منفی تعیین گردد. مزیت مهم روش PCR نسبت به سایر روشها و دلیل انتخاب آن در این مطالعه، اختصاصی بودن و حساسیت بالای این روش میباشد که با استفاده از DNA بهراحتی قابل انجام است (48-39-18).
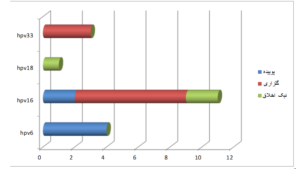
در سال 1383 گلزاری و همکارانش در دانشگاه زاهدان ارتباط بین ژنوتیپهای مختلف پاپیلوما و سرطان سر و گردن را مورد بررسی قرار دادند. آنها بلوکهای پارافینی بافت سرطانی 50 بیمار را تهیه کرده و برای تشخیص ژنوتیپهای 16-18-33-31-6 و 11 آنها را بررسی کردند. از بین این نمونهها 7 نمونه HPV+ شد که 4 نمونه ژنوتیپ 16 و سه نمونه ژنوتیپ 31 بودند.
این آمار شباهت زیادی به آمار موجود در کشورهایی مانند آمریکا و ژاپن و کشورهای اروپایی داشت. در حالی که به دلیل شباهت نژادی بین مردم ایران و شبهقاره هندوستان انتظار میرفت شباهت بیشتری بین آمارهای ایران با هندوستان وجود داشته باشد (26). این در حالی است که در تحقیق اخیر که بر روی 35 بیمار و برای بررسی همان ژنوتیپها انجام داده شد، حضور ژنوتیپ 31 گزارش نشده و در عوض ژنوتیپ 6 یافت شد. گلزاری در تحقیق خود اشارهای به جنسیت نداشته و نمونههای جمعآوریشده نیز فقط از یک استان بوده است.
در سال 1386 نیک اخلاق و همکارانش در بیمارستان امام خمینی اهواز بر روی 176 بیمار مبتلا به سرطان سر و گردن تحقیق کردند. آنها 176 نفر را هم بهعنوان گروه کنترل انتخاب نمودند. افراد گروه کنترل دارای پاتولوژی خوشخیم بودند. پس از انجام PCR تنها 3% از نمونهها HPV+ شدند. در سه بیمار ژنوتیپ 16 و در دو بیمار ژنوتیپ 18 گزارش شد.
بررسیهای بیشتر در اهواز نشان داد که نقش سیگار، ژنتیک و نیز تابش مستقیم نور خورشید همراه با فاکتورهای شغلی در ایجاد این بیماری نقش مؤثرتری دارد و تأثیر عوامل ویروسی ناچیز گزارش شد (50)، در حالی که در تحقیق کنونی از بین 35 بیمار، تنها 5 نمونهی مثبت آن هم با ژنوتیپ های 6 و 16 گزارش شده است. البته با توجه به شرایط زیستمحیطی موجود در اهواز انتظار میرود همچنان تابش مستقیم نور خورشید بیشترین عامل بروز بیماری باشد.
نمودار 1: مقایسه تحقیقات کنونی با تحقیقات قبلی و بررسی فراوانی تایپهای مختلف ویروس با استفاده از SPSS
در سال 1388 هراتیان و همکارانشان در انستیتو پاستور تهران بر روی افراد مبتلا به نقص اتوزومال آنمی فالکونی بررسیهایی را انجام دادند تا حضور ژنوتیپهای 16 و 31و 18 پاپیلوما را بهعنوان بالاترین ریسک فاکتورها در بروز سرطان سر و گردن در این بیماران بررسی کنند. از پرایمرهای MY11a و GP5 بهعنوان پرایمرهای فوروارد و از MY09a و GP6 بهعنوان پرایمرهای ریورس استفاده کردند. از سلولهای حفرهی دهانی این افراد نمونهبرداری شد و PCR انجام گرفت (30). در بین گروه اول 14 مورد و در گروه دوم 11 مورد HPV+ بودند. در خون تمام این افراد آنتیبادی علیه پاپیلوما ویروس وجود داشت. این نتایج نشان داد افراد مبتلا به سندرم فالکونی بهشدت در معرض ابتلا به عفونتهای ناشی از HPV هستند و در این میان خطر ابتلا به ژنوتیپهای 16 و 18 در این افراد بیشتر است (30).
این در حالی است که در تحقیق اخیر از 4 پرایمر استفاده شده که فقط یکی فوروارد و بقیه ریورس بودند. ضمناً افراد تحت بررسی در این تحقیق مبتلا به آنمی نبودند و فقط از سرطان دهان رنج میبردند. همچنین برای طراحی پرایمرها در تحقیق اخیر از پروتئینهای اولیهی E6 و E7 استفاده شد. در تحقیقات هراتیان اشارهای به جنسیت نشده، اما نمونههای جمعآوریشده مربوط به سراسر کشور بوده است که از این بابت با تحقیق اخیر متفاوت میشود.
در سال 1391 مشهدی عباس و همکارانشان در دانشگاه علوم پزشکی اصفهان مطالعهای توصیفی- تحلیلی انجام دادند تا ارتباط بین دو نشانگر P53 و p63 را با ویروس پاپیلومای انسانی در ضایعات دیسپلاستیک حفرهی دهان بررسی کنند. آنها 40 نمونه بلوک پارافینی تهیه کردند که 30 نمونه هیستوپاتولوژی دیسپلاستیک و 10 نمونه موکوسل بودند.
پس از انجام PCR، دادهها با استفاده از نرمافزار SPSS تحلیل شدند. آنها از دو پرایمر GP5 و GP6 استفاده کردند. گرچه شدت و درصد بروز این دو فاکتور در دو گروه بیماران متفاوت بود ولی آنها هیچ ارتباط معناداری بین این فاکتورها با پاپیلومای انسانی در حفرهی دهانی پیدا نکردند (46)، در حالیکه در تحقیقات اخیر بر روی 35 نمونه بیمار بررسی انجام شده و از 4 پرایمر استفاده گردیده است. پس از الکتروفورز نمونهها با کمک نرمافزار MEGA5، نمونهها با هم مقایسه شده و از روش تعیین توالی ژنی، ژنوتیپ نمونهها را یافته و حضور ژنوتیپهای مختلف بررسی گردیدند. از این تحقیق نمیتوان آمار دقیقی برای کل کشور ارائه داد، زیرا افراد تحت آزمایش، تنها جمعیت 35 نفری بوده و نمونههای جمعآوری شده نیز مربوط به یک سال بوده است. همچنین تمام بیماران مبتلا به سرطان دهان در شهر تهران نیز به بیمارستان امام مراجعه نکردند تا آمار دقیقی از آنان به دست آید.
در سال 1392 اربابی کلاتی و همکاران در دانشگاه زاهدان با بررسی بزاق دهان 100 مرد سالم از دو گروه سیگاری و غیرسیگاری حضور ویروس پاپیلومای انسانی با ژنوتیپهای 16 و 18 را بررسی کردند. آنها پس از نمونهبرداری از بزاق افراد DNA آنها را با روش RT-PCR استخراج کردند. گرچه افراد تحت آزمایش فقط از یک جنس انتخاب شده بودند، اما نتایج حاکی از آن بود که بین مصرف سیگار و حضور ژنوتیپهای 16 و 18 پاپیلوما ویروس هیچ ارتباط معناداری وجود ندارد. لازم به ذکر است این آمار در کشورهای دیگر مانند ژاپن و آمریکا با ایران متفاوت بوده است.
در سال 2008 سیلویا لاماس و همکارانش در مادرید اسپانیا با استفاده از روش RT-PCR بر روی 200 بیمار بررسی انجام دادند. آنها از پرایمرهای اختصاصی برای E6 استفاده کردند. ژنوتیپهای 6،11،16 و 31 در نمونهها یافت شد که بالاترین آمار مربوط به ژنوتیپ 16 بود. (39 -38-37)
با توجه به اينکه پاپيلوما ويروس در سطح پوست به مقدار بسيار فراواني يافت میشود، میتواند عامل بروز سرطانهای بسياري از جمله سرطان پوست، دهان، ريه، دهانه رحم و … باشد، لذا تحقيقات وسيعي در سراسر دنيا بر روي آن صورت گرفته است. اين تحقيقات بيشترين ميزان شيوع بيماري را در کشورهاي آفريقايي مثل سودان و گینهی نو و پس از آن در آمريکا و هندوستان نشان داد (56-35-27-25-18-16-9). ژنوتیپهاي 16،18، 31، 33، 35 در اين کشورها بيشتر از بقیهی ژنوتیپها در سرطان دهان و پيشرفت آن دخالت میکردند، اما در همين ميان شایعترین ژنوتیپها، ژنوتیپ 16 و پس از آن 18 بود (61-44-53-29-16-7). در این کشورها از حدود 3 تا 4% از افراد سیگاری ژنوتیپهای 16 و 18 پاپیلوما به دست آمده است(5)، این در حالی است که تحقیقات اخیر بر روی بافت سرطانی انجام شده، نمونهها نیز مربوط به دو جنس مرد و زن هستند. روش مورد استفاده نیز متفاوت است.
در سال 2012 در آمریکا آدام جی.کیمپل در آزمایشی مقایسهای دقت روشهای مختلف تشخیصی را برای یافتن پاپیلوما ویروس در نمونههای بیماران مورد بررسی قرار داد و نتایج زیر را گزارش کرد (48-39- 18). برطبق این مقایسه بهترین روش برای بررسی ژنوتیپهای مختلف پاپیلوما روش PCR و RT-PCR است. با توجه به این بررسی و آزمایشهای انجامشده در ایران، در این تحقیق نیز از روش PCR استفاده شد.
اما نتیجهی بدست آمده در این مطالعه کاملاً مشابه نتایج آنیلیس و همکارانش در آرژانتین است. گرچه آنان از روش RFLP-PCR و پرایمرهای My11 و My09 استفاده کردند ولی توانستند ژنوتیپهای 16 و 6 را در نمونهها بیابند.
البته تفاوتهای بدست آمده در نتایج حاصل میتواند به تفاوتهایی از جمله تغییر در شرایط جغرافیایی، نوع تغذیه، رعایت بهداشت دهان و دندان، مصرف یا عدم مصرف سیگار، قرار گرفتن در معرض مستقیم تابش خورشید و آلودگی هوا نیز مربوط باشد. در هر حال وجود ژنوتیپ 6 از ویروس پاپیلوما در نمونههای مثبت بیماران اشاره به راههای دیگر انتقال ویروس دارد.
HPV 6 عامل بروز زگیل تناسلی است که انتقال آن از طریق پوست به پوست و یا از طریق ارتباط دهانی- تناسلی صورت میگیرد و با هر روش آمیزشی قابلانتقال است. زگیل تناسلی نیز بهطور قابلرؤیت در تمام افراد بروز نمیکند، بلکه فقط 1 تا 5 درصد از افراد مبتلا به زگیل تناسلی، آلودگی قابلمشاهده دارند، بنابراین افراد آلوده بدون هیچ علامتی میتوانند سبب انتشار ویروس شوند. از سوی دیگر پس از بررسی پراکندگی و شیوع بیماری بین زنان و مردان، تعداد زنان مبتلا کمتر از مردان به دست آمد.
مطابق با این مطالعه، 5 نفر مرد با ژنوتیپهای HPV+ شناسایی شدند. این در حالی است که تاکنون هیچ نوع بررسی در ایران بر روی جنسیت افراد و آلودگی با ویروس پاپیلوما صورت نگرفته تا میزان فراوانی پاپیلوما ویروس را در هر دو جنس بررسی کند. گرچه در سودان نتایج بهدست آمده توسط بابیکر و همکارانش نشان داد تعداد زنان مبتلا به سرطان دهان در اثر آلودگی با HPV نسبت به مردان بیشتر است، اما شیوع پاپیلوما به عوامل مختلفی از قبیل نحوهی زندگی، عادات تغذیهای، شرایط آب و هوایی و حتی آمیزش جنسی بستگی دارد، لذا نتایج بدست آمده برای کشورهای دیگر قابل استناد نمی باشد (47-23-11-7).
همچنین نمونههای HPV+ از نظر محل سکونت نیز مورد بررسی قرار گرفتند. بیشترین آمار مربوط به شهر تهران و سپس اسلام شهر بود. آخرین تحقیقات انجام شده توسط فاضلی و همکارانش در سال 83، سیر تکاملی سرطان دهان را نشان داده ولی به گستردگی و شیوع آن در شهرهای مختلف اشارهای نداشته است. از آن زمان تاکنون بررسیهای مجدد آماری انجام نشده است. حال با توجه به رشد بیماری و حضور ژنوتیپهای HPV در نمونههای بیماران، انجام بررسیهای بیشتر ضروری است.
ضمناً در این مطالعه فراوانی بیماری سرطان دهان در بین گروههای سنی مختلف نیز مورد بررسی قرار گرفت. طبق این تحقیق در افراد با سن کمتر از 30 سال هیچ نمونه مثبتی یافت نشد. ضمناً بیشترین آمار مبتلایان مربوط به گروههای سنی 30 تا 45 سال است (سه نمونهی مثبت). یک نمونه مثبت نیز از فردی بالای 60 سال به دست آمد. این در حالی است که با افزایش سن و کاهش قدرت سیستم ایمنی بدن، شانس ابتلا به انواع سرطانها افزایش مییابد. لازم به ذکر است در هیچکدام از پژوهشهای انجامشده در ایران تاکنون سن افراد مورد بررسی قرار نگرفته بود.
نتیجهگیری:
با توجه به اطلاعات بدستآمده، HPV6 و HPV16 در بروز سرطان دهان نقش دارند. شیوع HPV6 نیز با زگیل تناسلی مرتبط است که انتشار آن را از طریق روابط دهانی- تناسلی سریعتر و آسانتر میسازد. همچنین وجود ویروس پاپیلوما در افراد 30 تا 45 سال نسبت به سایر گروهها بیشتر گزارش شده است.
References:
1 -Adelstein D.J. and Rodriguez C.P. Human papillomavirus: Changing paradigms in oropharyngeal cancer. CurrOncolRep ;12(2): 115-120 .2010.
2– Al-Swiahb J.N., Huang C.-C., Fang F.-M., Chuang H.-C., Huang H.-Y., Luo S.-D., Chen C.-H., Chen C.-M. andChien C.-Y. Prognostic impact of p16, p53, epidermal growth factor receptor, and human papillomavirus in oropharyngeal cancer in a betel nut-chewing area.Arch Otolaryngol;136(5): 502-508 .2010.
3-American Cancer Society.Cancer Facts & Figures 2014. Atlanta, Ga: American CancerSociety; 2014.
4-Ang KK, Harris J, Wheeler R, et al. Human papillomavirus and survival of patients withoropharyngeal cancer. N Engl J Med.;363:24–35. 2010.
5-Arbabi Kalate F,Nosrat Zehi T, Bameri Z ,Rigi M.Detection of salivary human papilloma viruses 16 and 18 in smoker men in an Iranian population by pcr:A PILOT STUDY.2014
6-VanMonsjou HS, Balm AJ, van den Brekel MM &Wreesmann VB .Oropharyngealsquamous cell carcinoma: a unique disease on the rise? Oral Oncol, Vol. 46, pp. 780-785.2010
7-ANGIERO, F. et al. Frequency and role of HPV in the progression ofepithelial dysplasia to oral cancer.Anticancer Res, v. 30, n. 9, p. 3435-40,2010.
8-Baumann JL, Cohen S, Evjen AN, Law JH, Vadivelu S, Attia A et al .Humanpapillomavirus in early laryngeal carcinoma. Laryngoscope, Vol. 119, pp. 1531-1537.2011.
9-BouletG,HorvathC,Broeck DV, Sahebali S, BogersJ.Human papilloma virus:E6 and E7 oncogenes.Int J Biochem cell B 2007:39(11):2006-2011
10-Chaturvedi A, Engels E, Pfeiffer R, et al. Humanpapillomavirus and rising oropharyngeal cancerincidence in the United States. J ClinOncol2011.
11-Chaudhary AK, Singh M, Sundaram S, Mehrotra R. Role of humanpapillomavirus and its detection in potentially malignant andmalignant head and neck. Head Neck Oncol 2009.
12– Chow L.T., Broker T.R. and Steinberg B.M. The natural history of human papillomavirus infections of the mucosal epithelia.APMIS ;118(6-7): 422-449 .2010.
98
13-D’souza G, Agrawal Y, Halpern J, et al. Oralsexual behaviors associated with prevalent oralhuman papillomavirus infection.;.199:1263–9.2009.
14-D’Souza G, Kreimer AR, Viscidi R, et al. Case-control study of humanpapillomavirus and oropharyngeal cancer. N Engl J Med;356:1944–1956.2007.
15– D’Souza G, Zhang HH, D’Souza WD, Meyer RR, Gillison ML. Moderate predictive value of demographic and behavioral characteristics for a diagnosis of HPV16-positive and HPV16-negative head and neck cancer. Oral Oncol. 2010;46:100-4.
16-Duray A, Descamps G, Arafa M, Decaestecker C, Remmelink M, Sirtaine N et al .Highincidence of high-risk HPV in benign and malignant lesions of the larynx.Int JOncol, Vol. 39, pp. 51-59.2011.
17-Effiom OA, Adeyemo WL, Omitola OG, Ajayi OF, Emmanuel MM, GbotolorunOM . Oral squamous cell carcinoma: a clinicopathologic review of 233 cases in Lagos, Nigeria. J. Oral. Maxillofac. Surg. 66:1595-9.2008.
18-Esquenazi D, BussolotiFilho I, CarvalhoMda G, Barros FS.The frequency of human papillomavirus findings in normal oral mucosa of healthy people by PCR.Braz J Otorhinolaryngol.;76(1):78–84. 2010.
19-Fakhry C, Westra WH, Li S, Cmelak A, Ridge JA, Pinto H, et al. Improved survival of patients with human papillomavirus- positive head and neck squamous cell carcinoma in a prospective clinical trial. J Natl Cancer Inst. 2008.
20– Friedrich R.E., Sperber C., Jäkel T., Röser K. and Löning T. Basaloid lesions of oral squamous epithelial cells and their association with HPV infection and p16 expression. Anticancer Res ;30(5): 1605-1612 .2010.
21-Furniss C.S., McClean M.D., Smith J.F., Bryan J., Applebaum K.M., Nelson H.H., Posner M.R. and Kelsey K.T. Human papillomavirus 6 seropositivity is associated with risk of head and neck squamous cell carcinoma, independent of tobacco and alcohol use. Ann Oncol;20(3): 534-541.2009.
22-Fazeli Z, Abadi A,et al.death rate of head and neck cancer in Iran .2014.
23– Galan-Sanchez F. and Rodriguez-Iglesias M.A. Comparison of human papillomavirus genotyping using commercial assays based on PCR and reverse hybridization methods. APMIS ;117(10): 708-715 .2009.
24-Gillison M, Broutian T, Pickard R, et al.Prevalence of oral HPV infection in the UnitedStates,. JAMA 2012;307:693–703.2009-2010.
25-Gillison M.L., D’Souza G., Westra W., Sugar E., Xiao W., Begum S. and Viscidi R. Distinct risk factor profiles for human papillomavirus type 16 – positive and human papillomavirus type 16 – negative head and neck cancers. J Natl Cancer I ;100(6): 407-420 .2008.
26-Gillison ML, Broutian T, Pickard RKL, Tong Z, Xiao W, Kahle L, et al. Prevalence of oral HPV infection in the United States, 2009-2010. JAMA.;307(7):693–703. 2012.
27-Golzari S ,keykhabi M : consideration of different serotypes of HPV related to mouth in Iran carcinoma,2004
28– Goon P.K.C., Stanley M.A., Ebmeyer J., SteinsträsserL., Upile T., Jerjes W., Manuel Bernal-Sprekelsen M., Görner M. and Sudhoff H.H. HPV & head and neck cancer: a descriptive update. Head Neck Oncol;2009.
29-Hannisdal K, Schjolberg A, De Angelis PM, Boysen M & Clausen OP . Humanpapillomavirus (HPV)-positive tonsillar carcinomas are frequent and have afavourable prognosis in males in Norway. ActaOtolaryngol, Vol. 130, pp. 293-299.2011.
30– Heath S, Willis V, Allan K, et al: Clinically significant human papilloma virusin squamous cell carcinoma of the head and neck in UK practice.ClinOncol (R CollRadiol) 24(1):e18–e23.2012,
31-Haratian k ,ph.DMohseni meybodi A, ph.D, DETECTION OF High risk human papilloma virus DNA sequences in head and neck squamous cell carcinoma in IRAN FANCONI ANEMIA PATIENTS.virology department ,Pasteur institute of Iran .2009
32-Hocking JS, Stein A, Conway EL, et al: Head and neck cancer in australiabetween 1982 and 2005 show increasing incidence of potentially HPVassociatedoropharyngeal cancers. Br J Cancer, 104(5):886–891. 2011.
33-ISHIBASHI, M. et al. The prevalence of human papillomavirus in oralpremalignant lesions and squamous cell carcinoma in comparison tocervical lesions used as a positive control. Int J ClinOncol, v. 16, n. 6, p.646-53, 2011.
34-JALOULI, J. et al. Prevalence of viral (HPV, EBV, HSV) infections in oralsubmucous fibrosis and oral cancer from India.ActaOtolaryngol, v. 130,n. 11, p. 1306-11, 2010a.
35– JAYAPRAKASH, V. et al. Human papillomavirus types 16 and 18 in epithelial dysplasia of oral cavity and oropharynx: a meta-analysis, 1985-2010. Oral Oncol, v. 47, n. 11, p. 1048-54, 2011.
36-JEMAL, A. et al. Global cancer statistics.CA Cancer J Clin, v. 61, n. 2,p. 69-90Lambert R, Sauvaget C, de Camargo Cancela M, Sankaranarayanan R:Epidemiology of cancer from the oral cavity and oropharynx. EurJGastroenterolHepatol . 23(8):633–641., 2011.
37-Johnson-Obaseki S, McDonald JT, Corsten M, et al: Head and neck cancerin Canada: Trends 1992 to 2007. Otolaryngol Head Neck Surg,147(1):74–78.2012.
38-Koppikar P, de Villiers E, Mulherkar R. Identification of human papillomavirusesin tumors of the oral cavity in an Indian community. Int J Cancer;113:946–50. 2005.
39-Kreimer AR, Chaturvedi AK: HPV-associated oropharyngeal cancers–arethey 40-Laantri N, Attaleb M, Kandil M, Naji F, Mouttaki T, Dardari R et al . Humanpapillomavirus detection in moroccan patients with nasopharyngeal carcinoma.Infect Agent Cancer, Vol. 6, pp. 3.2011.
41– Lace MJ, Anson JR, Klussmann JP, et al.Human papillomavirus type 16 (HPV-16)genomes integrated in head and neck cancersand in HPV-16-immortalized humankeratinocyte clones express chimeric virus-cellmRNAs similar to those found in cervicalcancers. J Virol 2011;85:1645–54.2011.
42-Lajer CB, Garnaes E, Friis-Hansen L, et al. Therole of miRNAs in human papilloma virus(HPV)-associated cancers: bridging betweenHPV-related head and neck cancer and cervicalcancer. Br J Cancer. 2012.
43-Lambert R, Sauvaget C, de Camargo Cancela M, Sankaranarayanan R:Epidemiology of cancer from the oral cavity and oropharynx. Eur JGastroenterolHepatol 2011, 23(8):633–641.
44-Lassen P .The role of Human papillomavirus in head and neck cancer and the impacton radiotherapy outcome.RadiotherOncol. [Research Support, Non-U.S. Gov’tReview], Vol. 95, No. 3, pp. 371-80.2010.
45-Lee S Y, Cho N H, Choi E C, Baek S J, Kim W S, Shin D. H. et al. Relevance of humanpapilloma virus (HPV) infection to carcinogenesis of oral tongue cancer. Int. J. OralMaxillofac. Surg., Vol. 39, pp. 678–683.2010.
46-Lill C, Kornek G, Bachtiary B, et al: Survival of patients with HPV-positiveoropharyngeal cancer after radiochemotherapy is significantly enhanced.Wien KlinWochenschr, 123(7–8):215–221.2011.
47-Machado J, Reis PP, Zhang T, et al: Low prevalence of humanpapillomavirus in oral cavity carcinomas. Head Neck Oncol 2010.
48-Mannarini L, Kratochvil V, Calabrese L, Gomes Silva L, Morbini P, Betka J, etal.Human Papilloma Virus (HPV) in head and neck region: review of literature. ActaOtorhinolaryngol Ital. [Review], Vol. 29, No. 3, pp. 119-26.2009
49-Mashhadi Abbas Moshref : P53 and P63 Markers and their relation with HPV in mouth carcinoma , . medical university – Isfahan . 2012.
50-Menedenhall WM, Werning JW, Pfister DG. Treatment of head and neck cancer.In:DeVita VT, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice ofOncology. 9th ed. Philadelphia, Pa: Lippincott Williams & Wilkins;:729–780. 2011.
51-NasmanA ,Attner P , Hammarstedt L , Du J , Eriksson M , Giraud G . et al : Incidence of human papillomavirus ( HPV ) positive tonsillar carcinoma in Stockholm , Sweden : an epidemic of viral – induced carcinoma ? Int J Cancer ; 125 : 362 – 6 . 2009.
52-Nguyen NP, Chi A, Nguyen LM, Ly BH, Karlsson U, Vinh – Hung V. Human papillomavirus-associated oropharyngeal cancer: a new clinical entity. QJM . 2010;103:229-36.
53-Nick AkhlaghS,Saki N ,et.al.Different serotypes of papilloma virus in neck and head cancl in Imam Khomeini hospital in Ahvaz.2007.
54-PANNONE, G. et al. Evaluation of a combined triple method to detectcausative HPV in oral and oropharyngeal squamous cell carcinomas:p16 immunohistochemistry, Consensus PCR HPV-DNA, and in situhybridization. Infect Agent Cancer, v. 7. n. 4, 2012.
55-Pulte D, Brenner H: Changes in survival in head and neck cancers in thelate 20th and early 21st century: a period analysis. Oncologist 2010,15(9):994–1001.
56-Sartor MA, Dolinoy DC, Jones TR, et al.Genome-wide methylation and expressiondifferences in HPV(1) and HPV(-) squamouscell carcinoma cell lines are consistent withdivergent mechanisms of carcinogenesis.Epigenetics.2011.
57-Scapoli L , Palmieri A , Rubini C , Martinelli M , Spinelli G, Ionna F , et al : Low prevalence of Human papilloma virus in squamous – cell carcinoma limited to oral cavity proper . Mod pathol;22(3):366-72 . 2009.
58-Schymura MJ, Anderson RN, Yankey D, Edwards BK: Annual Report to theNation on the Status of Cancer, 1975-2009, featuring the burdenand trends in human papillomavirus (HPV)-associated cancersand HPV vaccination coverage levels. J Natl Cancer Inst,105:175–201.2013.
59-St Guily JL, Jacquard AC, Pretet JL, et al.Human papillomavirus genotype distribution inoropharynx and oral cavity cancer in France—the EDiTH VI study. JClinVirol 2011.
60– Sturgis EM, Ang KK: The epidemic of HPV-associated oropharyngealcancer is here: Is it time to change our treatment paradigms? J NatlComprCancNetw, 9(6):665–673.2011.
61-Sudhoff HH, Schwarze HP , Winder D , Steinstraesser L , Gorner M , Stanley M, et al . Evidence for a causal association for HPV in head and neck cancers .Eur Arch Otorhinolaryngol;268:1541-7.2011.
62-Sudhoff HH, Schwarze HP, Winder D, et al: Evidence for a causalassociation for HPV in head and neck cancers. Eur Arch Otorhinolaryngol, 268(11):1541–1547.2011.
63-Syrjanen S: The role of human papillomavirus infection in head and neck12] Silva KC, Rosa ML, Moyse N, Afonso LA, Oliveira LH,Cavalcanti SM. Risk factors associated with human papillomavirusinfection in two populations from Rio de Janeiro, Brazil. MemInstOswaldo Cruz 2009; 104(6): 885-91cancers. Ann Oncol.2010.
64-Turner DO, Williams-Cocks SJ, Bullen R, Catmull J, Falk J, Martin D, et al. High-risk human papillomavirus (HPV) screening and detection in healthy patient saliva samples: a pilot study. BMC Oral Health.2011..
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام