طبقهبندی انواع واکسنها
محمدحسین مبلغ حسینی
کارشناس علوم آزمایشگاهی، کارشناس ارشد ژنتیک مولکولی
در این مقاله واکسنها در چهار نسل طبقهبندی شده و برای هر کدام خلاصهای از مکانیسم و مزایا و معایب ذکر گردیده است.
اولین واکسیناسیون توسط ادوارد جنر پدر علم ایمنولوژی در سال 1796 علیه آبله انجام گرفت.
موفقیت واکسن در ریشهکنی عفونت به چندین عامل بستگی دارد:
- عامل عفونت حالت نهفته ایجاد نکند.
- عامل عفونت دستخوش تغییرات و تنوع آنتیژنیک نشود.
- عامل عفونت با پاسخهای ایمنی میزبان، تداخل نکند.
نسل اول:
میکروارگانیسم زنده ضعیف شده یا کشته شده را شامل میشوند. در تهیه این نوع واکسن تمامی قسمتهای میکروب موردنیاز و ضروری است. بعد از تزریق این نوع واکسن، علائم خفیف تا متوسط بیماری پدیدار میشود و یا اینکه بدون علامت است. بهتر است در دو یا چند نوبت یادآور، تزریق شود.
مزایا: از بروز تعداد زیادی از بیماریهای عفونی و خطرناک و کشنده جلوگیری میکنند تا جایی که در بعضی از موارد، بیماری ریشهکن شده است (مثل فلج اطفال).
معایب: احتمال دارد پس از مصرف این نوع واکسنها، فرم ضعیفشده میکروبی به حالت اکتیو درآمده و باعث ایجاد عفونت پایدار و نسبتاً خطرناک شود.
اکثر این نوع واکسنها باعث تحریک ایمنی همورال میشوند و بر ایمنی سلولی تأثیر چندانی ندارند.
نسل دوم یا واکسنهای زیر واحد (subunit):
شامل اجزای پروتئینی و یا مخلوط چند آنتیژن پروتئینی نوترکیب میکروب است. در این نوع واکسن هیچ ژنومی وارد سلول میزبان نمیشود و تحریک سیستم ایمنی، منحصراً توسط پروتئین تزریق شده انجام میگیرد.
مزایا: نسبت به نسل اول، کمخطر هستند و عوارض جانبی کمی دارند.
معایب: احتمال دارد که پروتئین مدنظر ما، از نظر شکل فضایی (کونفورماسیون) دچار تغییراتی شود و با شکل اصلی پروتئین متفاوت باشد و در نتیجه توسط سیستم ایمنی، بهدرستی شناخته نشده و پاسخ مناسب تولید نشود.
نسل سوم یا DNA واکسنها:
در این نوع از واکسنها از DNA نوترکیب استفاده میشود که باعث ایجاد عفونت در میزبان نمیشوند. علاوه بر بیماریهای عفونی، در درمان برخی از تومورها هم بکار گرفته شدهاند.
مکانیسم عمل: قطعه DNA موردنظر درون یک DNA حلقوی (معمولاً پلاسمید) وارد شده و سپس به بدن میزبان تزریق میشود. سیستمهای رونویسی و ترجمه سلول میزبان، از قطعه DNA موردنظر، پروتئینهای مزبور را میسازد و در سطح سلول میزبان بیان میشود. سیستم ایمنی میزبان اینها را به عنوان آنتیژن بیگانه تلقی نموده و علیه این پروتئینها پاسخ میدهد. هر دو ایمنی همورال و سلولی فعال شده و پاسخ شروع میشود. در ادامه، ما شاهد بروز سلولهای خاطرهای با طول عمر نسبتاً بالا خواهیم بود که در مغز استخوان و یا غدد لنفاوی ساکن خواهند شد و در مواجهه بعدی، پاسخ سریع و قویتری خواهند داد.
در طراحی این نوع واکسنها، دانشمندان در بعضی موارد، دو یا چندین آنتیژن را در یک DNA واکسن قرار میدهند تا پاسخ ایمنی، بر ضد چندین پاتوژن تحریک شود.
از بدو پیدایش این نوع واکسنها، در مورد انواع بیماریهای عفونی و غیرعفونی مثل هپاتیت، آنفلوانزای H1N1، malaria،Ebula، Dengue fever، HIV، سرطان ناشی از HPV و CML کارآزماییهایی انجام شده است.
مزایا: بهراحتی تهیه و فرآوری میشوند.
خطر تکثیر عامل پاتوژن وجود ندارد.
نیاز به چرخه سرما ندارند در نتیجه هزینه نگهداری کمتری دارند.
نسبت به تغییرات دمایی مقاومترند.
با تزریق مقدار کمی از آنتیژن، پاسخ ایمنی وسیعی ایجاد میشود که هم تحریک ایمنی همورال و هم ایمنی سلولی را به دنبال خواهد داشت.
معایب: احتمال ادغام ژن موردنظر با ژنوم میزبان وجود دارد (در قسمت نسل چهارم توضیح داده میشود).
احتمال بروز ANA (آنتیبادیهای ضد اجزای هسته) وجود دارد.
فقط در مورد آنتیژنهای پروتئینی قابل استفاده است.
احتمال دارد سیستم ایمنی به این آنتیژنها حالت تحمل (tolerance) ایجاد کند.
جهت رسیدن به تیتر بالای آنتیبادی محافظتی، نیاز است که تزریق در چندین نوبت انجام گیرد.
نسل چهارم یا mRNA واکسنها یا واکسنهای ژنتیکی:
این نوع واکسنها که از پیدایش آنها زمان زیادی نگذشته است، جهت درمان تعدادی از بیماریهای عفونی و تومورال بکار گرفته شدهاند. اولین بار در سال 1990 ولف و همکاران آنها را جهت بیان پروتئینهای اگزوژن در موش بکار بردند.
مزایا: فرایند ساخت این نوع واکسن بهمراتب سریعتر انجام میگیرد و اجزاء و مراحل کمتری دارد و سریعتر به مرحله بالینی میرسد.
رونویسی آزمایشگاهی از ژنوم موردنظر جهت تولید mRNA همان ژنوم، بهراحتی و در زمان کم، امکانپذیر است.
قیمت تمامشده آن، ارزانتر از انواع دیگر واکسنها است.
عملکرد بالایی دارند.
معایب: احتمال دارد که بعد از ورود mRNA به داخل سلول و تکثیر قطعه موردنظر، سلول را به سمت آپوپتوز ببرد و یا اینکه سلول مذکور، سرطانی شود.
احتمال دارد که قطعه mRNA واردشده به داخل سلول میزبان، توسط آنزیم RT (ترانس کریپتاز معکوس) به یک قطعه مکمل از نوع DNA تکرشتهای رونویسی شود و سپس همین DNA تکرشتهای به DNA دو رشتهای تبدیل شده و وارد ژنوم میزبان شود و بهصورت ماندگار در ژنوم میزبان باقی مانده و از سلول مادری به سلولهای دختری منتقل شود. البته محل ورود هم متفاوت است؛ یعنی در قسمتهای عملکردی است یا غیر عملکردی.
احتمال دارد که پس از تزریق mRNA واکسن، توسط اندونوکلئازهای سلولهای میزبان تخریب شود.
احتمال دارد جهت ورود به داخل سلول، چالشهایی را در پی داشته باشد؛ چون هم mRNA دارای بار منفی است و هم غشای سلولی بار منفی دارد.
بعد از تزریق واکسن حاوی mRNA، با توجه به اینکه تعداد mRNAهای واردشده به سلول میزبان، تحت کنترل نیست و الگوی مشخصی ندارد، احتمال دارد تعداد بسیار زیادی از آنها بهصورت یکجا وارد یک سلول واحد شوند و وارد مسیری شوند که این قطعه mRNA تبدیل به Si RNA شود (Si RNAها جزء RNAهای مداخلهگر (interfering RNA) هستند که غیرکدکننده هستند و میتوانند به توالیهای تقریباً مکمل با mRNAهای داخل سلول میزبان متصل شوند و باعث میشوند که بیان یک ژن فعال، پس از رونویسی غیرفعال شود، در نتیجه بر عملکرد طبیعی سلول میزبان اختلال وارد میشود) و به همین علت امکان آپوپتوز و یا سرطانی شدن سلول و یا تغییر عملکرد سلول محتمل میشود.
نکته: بعضی از دانشمندان بر این باورند که تغییرات ذکر شده در بالا، لحظهای و گذرا هستند و ماندگاری دائمی ندارند و تعدادی هم میگویند که این مطالب فقط احتمال است و تاکنون شواهد مستدل و قوی مشاهده نشده است و اینها را فقط فرض و احتمال در نظر میگیرند.
گزینههای مؤثر در شروع پاسخ ایمنی برای انواع mRNA واکسنها:
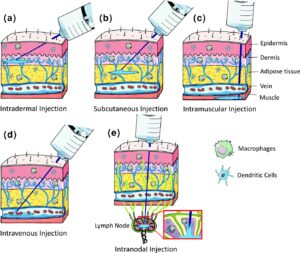
الف) راه ورود واکسن: مسیرهای تزریق mRNA واکسنها نقش مهمی در اثربخشی آن دارد. معمولاً از طریق oral،nasal ، intradermal، sub cotaneous،Intramuscular، intravenous، intravaginal، intratumoral انجام میگیرد. پاسخهای ایمنی هم بسته به راه ورود متفاوت خواهد بود چون سلولهای گیرنده و عرضهکننده آنتیژن (APCs) بر اساس موقعیت آناتومیکی متفاوت هستند؛ مثلاً در درم از نوع لانگرهانس، در مناطق دیگر از نوع دندرتیک (DCs) و یا ماکروفاژ و یا B cell و یا سلولهای اپیتلیال و یا سلولهای اندوتلیال هستند (شکل 1). میزان جذب و ماندگاری در محل تزریق یا محل ورود واکسن هم مهم است. هر قدر سرعت جذب کمتر باشد، احتمال تخریب ناخواسته mRNA در محل تزریق وجود دارد. وجود سلولهای چربی، سلولهای عضلانی، تعداد گرههای لمفاوی، تعداد سلولهای مخاطی و … همگی در روند پاسخ ایمنی تأثیرگذار هستند.
شکل 1
ب) ادجوانتها: در تهیه واکسنها، از انواع متفاوتی از ادجوانت استفاده میشود که بهترین عملکرد را داشته باشند.
گریزی به واکسنهای تولیدشده برای مقابله با کووید – 19 که بر پایه تکنولوژی mRNA هستند:
از ابتدای پاندمی ویروس کووید– 19، کشورهای زیادی سعی کردند واکسن مناسب جهت پیشگیری را طراحی کرده و به مرحله عرضه برسانند. ده هفته پس از مشخص شدن توالی SARS COV-19، یک mRNA واکسن تولیدشده توسط لوری و همکارانش، در یک داوطلب بهطور بالینی استفاده شد. آنها قبلاً در مورد تهیه واکسن برای خانواده کرونا ویروس کارهایی را انجام داده بودند، مثلاً پروتئین S، انولوپ و نوکلئوکپسید از جمله مواردی بودند که در مورد آنها کار کرده بودند. پروتئین S بیشتر مورد توجه بود چون مسئول ورود به داخل سلول میزبان است. آنها سعی کردند واکسنی بر پایه پروتئین S طراحی کنند که اولاً بهعنوان پروفیلاکسی علیه کووید– 19 بکار گرفته شود، ثانیاً طوری باشد که اگر بعد از ورود ویروس کووید– 19 به بدن میزبان تزریق شود، حالت رقابتی داشته باشد. به عبارت سادهتر، میل ترکیــبی این واکسن به ACER-2 (گیرنده آنزیم مبدل آنژیوتانسین-2) بافت ریه بیشتر از ذره ویروسی وارد شده باشد. در نتیجه بجای ورود ذره ویروسی (ژنوم ویروس) بداخل میزبان، پروتئین S واکسن تزریقی به ACER متصل شده و وارد سلول شود تا اجازه ورود ژنوم ویروس به سلولهای ریه را ندهد. در واقع به عنوان یک عامل محافظتی عمل میکند. پس این نوع واکسن یک گزینه مناسب برای بیمارانی خواهد بود که در مراحل ابتدایی ورود کووید– 19 باشند نه در مراحل پیشرفتهتر.
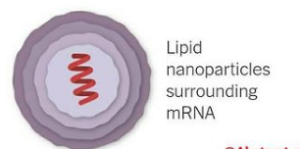
دانشمندان mRNA پروتئین S (spike) کووید– 19 را به بدن میزبان تزریق میکنند. mRNA تزریقی به حالتی است که توسط نانوذرات لیپیدی احاطه شده است (این ذرات لیپیدی نقش محافظتکنندگی و حملکنندگی را دارند) (شکل 2). بعد از ورود به داخل سلول میزبان، سیستم پروتئینسازی داخل سلول، پروتئین S را تولید میکند. وقتی که این پروتئینها از سطح سلول بیان میشوند، سلولهای CTL اختصاصی، تحریک و تکثیر میشوند و پاسخ ایمنی اختصاصی را شروع میکنند. از طرفی، بازوی دیگر ایمنی اکتسابی، سلولهای B شروع به تولید آنتیبادی اختصاصی علیه پروتئین S میکند. در هر دو حالت، شاهد پیدایش سلولهای خاطرهای در هر دو رده B cell و T cell (T folicular helper) و plasma cellهایی با طول عمر بالا خواهیم بود که در صورت ورود پارتیکلهای کووید– 19 به بدن، مناسبترین پاسخ ایمنی ثانویه در کمترین زمان و بالاترین افینیته، پدیدار خواهد شد.
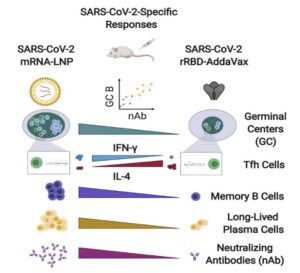
شکل 2 شکل 3
در شکل 3 انواع پاسخهای ایمنی بعد از تزریق واکسن mRNA بر ضد کووید– 19 به موش نشان داده شده است
از طرفی دانشمندان در طراحی mRNA علیه کووید– 19 سعی دارند پروتئین S حاصل از mRNA واکسن طوری باشد که نواحی مراکز زایگر (germinal center) موجود در فولیکولهای ثانویه در گرههای لمفی تقویت شود و تولید حداکثری و قوی از آنتیبادیهای اختصاصی انجام گیرد. تشکیل مراکز زایگر در موش، بعد از روز هفتم مشاهده شد.
البته ناگفته نماند که ویروس کووید– 19 با توجه به خصوصیت ذاتی ویروس بودنش، احتمال جهش دارد. این ویروس در طی جهش، پروتئینهای نو تولید میکند. تعدادی از سازندگان واکسن ضد کووید– 19 بر این موضوع اصرار دارند که واکسن تولیدی آنها علیه ویروسهای جهشیافته که واریانت متفاوتی هم دارند، مؤثر است ولی عدهای از دانشمندان هم این موضوع را رد میکنند. البته اگر از دیدگاه ژنتیک ویروس نگاه کنیم، بستگی به این دارد که جهش انجامیافته در کدام قسمت ژنوم ویروس انجام گرفته است.
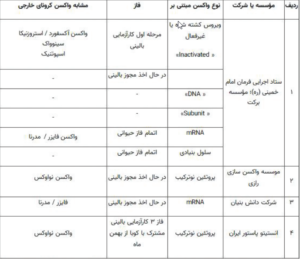
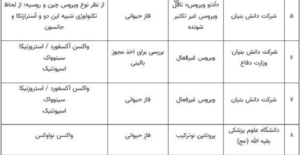
در کشور خودمان نیز تعدادی از شرکتهای دانشبنیان و داروسازی از همان روزهای اول شروع به تحقیق و آمادهسازی واکسن مناسب کردند. آنها طراحی و تولید واکسنهای نسل اول و دوم و سوم و چهارم را شروع کردهاند و در فازهای حیوانی استفاده شده و بعضیها هم در مرحله بالینی اولیه قرار دارند. جدول زیر در تاریخ هفده دی ماه سال جاری چاپ شده است که نشانگر کارهای ارزشمند دانشمندان و فرزندان ایرانی است.
تحلیل نویسنده: بیاییم از منظری متفاوت به ویروسها نگاه کنیم. ویروسها ذراتی هستند که علائم حیاتی یک میکروارگانیسم زنده را ندارند، انگل داخل سلولی اجباری هستند و از خودشان چیزی ندارند جزء معدودی اطلاعات ژنتیکی. این ذرات کاملاً به میزبانهای خود وابستهاند؛ در واقع سلول میزبان را به بردگی میگیرند و از او به نفع بقای خود استفاده ابزاری میکنند. پس بقا و تکثیر ویروس وابسته به بقای میزبانش است. پس منطقاً، یک ذره ویروس نباید میزبان خود را از بین ببرد چون با مرگ میزبان، حکم نابودی خود را امضاء کرده است. از طرفی، سلولهای میزبان و سیستم ایمنی و فیزیولوژی میزبان هم بنا به حکم هموستاز و تعادل فیزیولوژیکی بدن، با بر هم زنندگان نظم عمومی بدن مقابله میکنند و علیه آنها پاسخهایی دارند و میخواهند که عامل برهمزننده نظم را از بین ببرند. در واقع هر دو طرف میخواهد در چرخه حیات باقی بمانند. حال اگر سیستم ایمنی و فیزیولوژیکی میزبان، در کمال صحت و آمادهباش باشد، عامل بیرونی و درونی مختلکننده هموستاز نمیتواند حیات میزبان را تهدید کند و باعث مرگ میزبان شود.
References:
- Plotkin S. History of vaccination. Proc Natl Acad Sci U S A 2014;111(34):12283–7.
Clem AS. Fundamentals of vaccine immunology. J Glob Infect Dis2011;3(1):73–78.
2.Riedel S. Edward Jenner and the history of smallpox and vaccination. Proc (Bayl Univ Med Cent)2005;18(1):21–5.
3.TopleyWWC. Topley and Wilson’s microbiology and microbial infections. 10thed. London: wiley; 2005.
4.Plotkin SA. Vaccines: The Fourth Century. Clin vaccine immunol 2009;16(12):1709–19.
5.Plotkin S. History of vaccination. Proc Natl Acad Sci U S A 2014;111(34):12283–7.
6.Clem AS. Fundamentals of vaccine immunology. J Glob Infect Dis2011;3(1):73–78.
7.Riedel S. Edward Jenner and the history of smallpox and vaccination. Proc (Bayl Univ Med Cent)2005;18(1):21–5.
8.TopleyWWC. Topley and Wilson’s microbiology and microbial infections. 10thed. London: wiley; 2005.
9.Plotkin SA. Vaccines: The Fourth Century. Clin vaccine immunol 2009;16(12):1709–19.
10.Bernadette F, Matthew PM, Natalie AH, Thomas HS, Colleen EL, David BW.Clinical applications of DNA vaccines: Current progress. Clin Infect Dis 2011;53(3):296-302.
11.Fındık A, Çiftci A. Bacterial DNA vaccines in veterinary medicine: A review. J Vet Adv2012;2(4):139-48.
12.Teimourpour R, Sadeghian A, Meshkat Z, Esmaelizad M, Sankian M, Jabbari AR. Construction of a DNA vaccine encoding Mtb32C and HBHA genes of mycobacterium tuberculosis. Jundishapur J Microbiol2015;8(8):e21556.
13.Baghani A, Safdari H, Teimourpour R, MeshkatZ. Designing and construction Pcdna3.1 Vector Encoding Cfp10 Gene ofMycobacterium tuberculosis. Jundishapur J Microbiol 2015;8(10):e23560.
14.Mirshahabi H, Meshkat Z, Soleimanjahi H, Mohamad Hassan Z. Construction a DNA vaccine containing human papillomavirustype 16 early genes as a potential vaccine for cervicalcancer prevention and therapy. Iran J Pathol 2009;4(2):65-70.
15.Kutzler MA, Weiner DB. DNA vaccines: Ready for prime time? Nat Rev Genet2008;9(10):776-88.
16.Allen, C.D.C., Okada, T., and Cyster, J.G. (2007). Germinal-center organizationand cellular dynamics. Immunity27, 190–202.
17.Amanat, F., and Krammer, F. (2020). SARS-CoV-2 Vaccines: Status Report.Immunity52, 583–589.
18.Amanat, F., Stadlbauer, D., Strohmeier, S., Nguyen, T.H.O., Chromikova, V.,McMahon, M., Jiang, K., Arunkumar, G.A., Jurczyszak, D., Polanco, J., et al. (2020). A serological assay to detect SARS-CoV-2 seroconversion in humans.Nat. Med.26, 1033–1036.
19.Anderson, E.J., Rouphael, N.G., Widge, A.T., Jackson, L.A., Roberts, P.C.,Makhene, M., Chappell, J.D., Denison, M.R., Stevens, L.J., Pruijssers, A.J.,et al.; mRNA-1273 Study Group (2020). Safety and Immunogenicity ofSARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N. Engl. J. Med.,NEJMoa2028436.
20.Baumjohann, D., Okada, T., and Ansel, K.M. (2011). Cutting Edge: Distinctwaves of BCL6 expression during T follicular helper cell development.J. Immunol.187, 2089–2092.
21.Botta, D., Fuller, M.J., Marquez-Lago, T.T., Bachus, H., Bradley, J.E.,Weinmann, A.S., Zajac, A.J., Randall, T.D., Lund, F.E., Leo ́n, B., andBallesteros-Tato, A. (2017). Dynamic regulation of T follicular regulatory cell re-sponses by interleukin 2 during influenza infection. Nat. Immunol.18,1249–1260.
22.Corbett, K.S., Edwards, D., Leist, S.R., Abiona, O.M., Boyoglu-Barnum, S.,Gillespie, R.A., Himansu, S., Sch€afer, A., Ziwawo, C.T., DiPiazza, A.T., et al. (2020a). SARS-CoV-2 mRNA Vaccine Development Enabled by PrototypePathogen Preparedness. bioRxiv. 2020.06.11.145920.https://doi.org/10.1101/2020.06.11.145920.
23.Corbett, K.S., Flynn, B., Foulds, K.E., Francica, J.R., Boyoglu-Barnum, S.,Werner, A.P., Flach, B., O’Connell, S., Bock, K.W., Minai, M., et al. (2020b).Evaluation of the mRNA-1273 Vaccine against SARS-CoV-2 in NonhumanPrimates. N. Engl. J. Med.383, 1544–1555
24.Akbarzadeh A, Rezaei-Sadabady R, Davaran S et al (2013) Liposome: classification, preparation, and applications. Nanoscale Res Lett 8:102
25.Alberer M, Gnad-Vogt U, Hong HS et al (2017) Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial. Lancet 390:1511–1520
26.Ambegia E, Ansell S, Cullis P et al (2005) Stabilized plasmid–lipid particles containing PEG-diacylglycerols exhibit extended circulation lifetimes and tumor selective gene expression. Biochim et Biophys Acta (BBA)—Biomembr 1669:155–163
27.Anderson BR, Muramatsu H, Nallagatla SR et al (2010) Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res 38:5884–5892
28.Awasthi S, Hook LM, Pardi N et al. (2019) Nucleoside-modified mRNA encoding HSV-2 glycoproteins C, D, and E prevents clinical and subclinical genital herpes. Sci Immunol 4:eaaw7083
29.Bahl K, Senn JJ, Yuzhakov O et al (2017) Preclinical and clinical demonstration of immunogenicity by mRNA vaccines against H10N8 and H7N9 influenza viruses. Mol Ther 25:1316–1327
30.Basak JM, Verghese PB, Yoon H et al (2012) Low-density lipoprotein receptor represents an apolipoprotein E-independent pathway of Aβ uptake and degradation by astrocytes. J Biol Chem 287:13959–13971
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام