نایسریا گونوره Neisseria gonorrhoeae
بیماریزایی، نمونهبرداری، تشخیص آزمایشگاهی
نویسندگان:
فروهش تهرانی- هما*، جوادی- عبدالرضا **، وثوق- هومن**، صرافنژاد- عبدالفتاح***، مهدوی- سعید****، صباغی– سعید****،
یونسی- سارنگ****، طاهری امین- مهدی****، غریب دوست- محسن****، کنعانی- پرویز*****، حسینی- احمد*****
*میکروبیولوژیست، **پاتولوژیست، ***ایمونولوژیست، **** دکترای حرفهای علوم آزمایشگاهی، ***** متخصص علوم آزمایشگاهی
همکاران آزمایشگاه پاتوبیولوژی نور: گیلدا وحیدی، سمیرا رضایی دوست مطلق، ساحل کهنروز، کیوان مجیدی
همکاران آزمایشگاه نیلو: شیما معینی، مونا محمدی، سوگند پارسا، درنا مستوفی، سعید دلشاد
همکاران آزمایشگاه سعید: محدثه عباسی، نویده رستمی، علی معزی، سعید بختیاری
همکاران آزمایشگاه آزادی: سامره مقدسی، میثم پیشباز
همکاران آزمایشگاه رسالت: مهری اختری، حسن عربیزاده، رضا داورزنی
همکاران آزمایشگاه بیمارستان نیکان: ثریا حاجیزاده، حوریسا حصیمی، میثاق تمزار
همکاران آزمایشگاه بیمارستان بوعلی: مریم برخورداری، الناز صفری، محمد سعید
همکاران آزمایشگاه بیمارستان امام حسین: معصومه فرومند، زهرا موسی کاظم، عاطفه نوروزی، ساجده اسماعیلی
هدف از این نوشتار تشخیص آزمایشگاهی نایسریا گونوره Neisseria gonorrhoeae عامل بیماری سوزاک Gonorrhea بهوسیله کشت از نمونههای مختلف کلینیکی است. باید توجه داشت، آنچه مهم است، انجام نمونهبرداری صحیح است تا بتوان باکتری را در محیط کشت مناسب بهدست آورد.
با بررسی نمونههای ترشحات مجرا، واژن و رسوب ادرار بیماران مراجعهکننده به آزمایشگاههای آزادی، پاتوبیولوژی نور، نیلو، سعید، رسالت و آزمایشگاه بیمارستانهای نیکان، بوعلی، امام حسین در سال 1398 از 1200 نمونه ترشحات دستگاه تناسلی و رسوب ادرار جمعاً 25 مورد (2/1%) نایسریا گونوره با آزمایش میکروسکوپی و کشت تشخیص داده شد.
این میزان جداسازی میتواند بیانگر طیف بیشتری از شیوع بیماری در جامعه باشدکه چنانچه روشهای نمونهبرداری مناسب بهکار گرفته شوند به تشخیص بیماری و شناسایی افراد ناقل و درمان بیماران کمک مؤثری خواهد نمود.
نایسریا گونوره Neisseria gonorrhoeae که تحت عنوان گونوکک Gonococcus در شکل مفرد یا Gonococci گونوکسی بهصورت جمع نامیده میشود، دیپلوکک گرم منفی است که اولین بار توسط Albert Neisser در سال 1878 میلادی بهعنوان عامل اصلی بیماری سوزاکGonorrhoea تشخیص داده شد. او دیپلوکک گرم منفی را در نمونه ترشحات چرکی از مجرای مرد 35 ساله و همچنین بیمار زن با نشانههای کلاسیک عفونت ادراری ناشی از این باکتری مشاهده نمود.
در سال 1882 میلادی Loeffler و Leistikow موفق شدند باکتری را در محیط کشت، رشد دهند.
در سال 1883، Max Bockhart با تلقیح باکتری در دستگاه تناسلی یک مرد سالم ثابت نمود که باکتری جداشده بهوسیله Albert Neisser عامل اصلی بیماریی است که تحت عنوان سوزاک نامیده میشود. علیرغم اینکه بیمار در روزهای بعد تظاهرات بیماری را نشان داد ولی محققین مشکوک بودند که آیا سیفلیس و سوزاک یک بیماری هستند و یا دو بیماری جداگانه؛ زیرا John Hunter محقق قرن 18 در سال 1767 میلادی با تلقیح ترشحات بیماری که علاوه بر ابتلا به سوزاک، به سیفلیس نیز مبتلا بود بهطور اشتباه پیشنهاد کرده بود که سوزاک و سیفلیس یک بیماری هستند. محققین زیادی برای رد نظریه Hunter کار کردند؛ از جمله Ricord که سرانجام نایسریا گونوره را عامل بیماری سوزاک معرفی نمود. اطلاق واژه گونوره Gonorrhoea توسط Galen از لغت یونانی Gonos به معنی دانه و Rhoe به معنی جریان انجام گرفت که به معنی جریان دانهها در ترشحات چرکی مردان بود.
مرفولوژی و مولکولهای سطحی
جنس نایسریا کوکسیهای گرم منفی هستند که به شکل دیپلوکک مشابه دانههای قهوه یا لوبیا مشاهده میشوند. داخل سلولی اختیاری بوده، بدون اسپور و هوازی اجباری هستند. اکسیداز مثبت (سیتوکروم C اکسیداز) و کاتالاز مثبت و دارای حرکت Twitching هستند. از 11 گونه در جنس نایسریا که انسان را کلونیزه میکنند، تنها دو گونه پاتوژن واقعی هستند: نایسریا گونوره و نایسریا مننژیتیدیس (عامل مننژیت باکتریایی).
بر روی سطح نایسریا گونوره، زوائد مویی شکل پیلی، پروتئینهای سطحی با عملکردهای متعدد و قندهایی که Lipooligosaccharide (Los) نامیده میشوند، وجود دارد. پیلی سبب چسبیدن، حرکت و واسطه تبادل DNA است. پروتئینهای Opa مانند پورین با سیستم ایمنی بدن واکنش دارند. Los یک اندوتوکسین است و سبب تحریک سیستم ایمنی میشود. هر سه آنها آنتیژنیک بوده و دارای تغییرات آنتیژنیک نیز هستند. بیشترین تغییرات آنتیژنیک در پیلی مشاهده میشود. پیلی پروتئینهای Opa، پورینها و حتی Los دارای مکانیسمهایی هستند که از ایجاد پاسخهای ایمنی جلوگیری کرده و عفونت بدون نشانه را بوجود میآورند.
رشتههای پروتئینی متحرک که پیلی تیپ IV نامیده میشود سبب چسبیدن و تحرک در میان سطوح مخاطی میشوند.
برای ورود به سلول میزبان نیز باکتری بعد از اتصال توسط پیلی در سطوح مخاطی نفوذ میکند. پیلی یک فاکتور ویرولانس برای نایسریا گونوره است، زیرا بدون آن باکتری قادر به ایجاد عفونت نیست. جهت تحرک ابتدا باکتری از پیلی خود به مشابه یک قلاب استفاده کرده و پس از گسترش از سطح سلول به ماده مورد نظر میچسبد، سپس انقباض پیلی، سلول را به سمت جلو میکشد. این نوع حرکت تحت عنوان Twitching نامیده میشود.
نایسریا گونوره قادر است تا 100/000برابر وزن خودش را بکشد، زیرا پیلی آن یکی از قویترین موتورهای بیولوژیک است. پروتئینهای PilF و PilT Atpase مسئول گسترش و انقباض پیلی تیپ 4 هستند. پیلی با عملکرد اتصالی خود در تجمع میکروکلنی و تولید بیوفیلم نیز نقش دارد. پروتئینهای سطحی که Opa نامیده میشود برای اتصال به رسپتورهای سیستم ایمنی و جلوگیری از پاسخ ایمنی بهکار گرفته میشوند. حداقل 13 پروتئین Opa وجود دارد و در بسیاری موارد جابجایی (Permutation) از پروتئینهای سطحی، تشخیص نایسریا گونوره و دفاع علیه آن را بهوسیله سلولهای ایمنی مشکل میسازد.
(Los) Lipooligosacharide مشابه لیپو پلیساکارید سایر باکتریهای گرم منفی است ولی وزن کمی دارد. ساختار آن یک زنجیر جانبی از کربوهیدرات است که به لیپید A در غشاء خارجی که پوشاننده دیواره سلولی است، متصل میشود. Los بهعنوان اندوتوکسین سبب تحریک تولید التهاب میشود.
تغییرات آنتیژنیک Antigenic Variation
نایسریا گونوره میتواند از طریق پروسهای به نام تغییرات آنتیژنیک از سیستم ایمنی فرار نماید. در این پروسه باکتری با حاصل تغییرات ژنتیکی (Recombination)، شاخصهای آنتیژنیک خود (مکان اتصال آنتیبادیها) مانند پیلی تیپ 4 (Type IV) که سطوح آن را میپوشاند، تغییر میدهد. این تغییرات علاوه بر پیلی در Los نیز بوجود میآید، هرچند که پیلی بیشترین تغییرات آنتیژنیک را به دلیل بازسازی کروموزومی نشان خواهد داد.
ژن Pils مثالی از این توانایی تنظیم مکرر به دنبال ترکیب با ژن PilE است که تخمین زده میشود بیشتر از 100 واریانت از پروتئین PilE بهوجود آورد. این تغییرات سبب بقا در مکان عفونت، توانایی گریز از سیستم ایمنی به دلیل عدم تولید آنتیبادی اختصاصی و همچنین عدم تولید واکسن مؤثر علیه آن میشود. این باکتری همچنین توانایی دریافت DNA جدید از طریق پلاسمید را نیز دارد. این امر از طریق پیلی Type IV و پروتئینهای Pil Q و Pil T انجام میشود. این پروسه اجازه میدهد تا نایسریا گونوره با کسب DNA جدید، ژنهای جدیدی را پخش کند و با پوشش خود با پروتئینهای سطحی متفاوت، از توسعه حافظه ایمونولوژیک جلوگیری نماید. همچنین سبب مقاومت آنتیبیوتیکی و اشکال در روند تولید واکسن شود.
تغییرات فاز Phase Variation
تغییرات فاز مشابه تغییرات آنتیژنیک است اما بهجای تغییر در سطح ژنتیکی، ترکیبات مولکولها را تغییر میدهد و سبب خاموش و یا روشن کردن ژنها میشود و با وارد کردن و یا حذف بازها در ژنوم ارگانیسم پدیدار میشود (Frame shift). پروتئین Opacity یا Opa ناشی از تغییرات فاز است. هر زمان که باکتری تکثیر یابد، ممکن است چندین پروتئین Opa در طی موتاسیون به وجود آمده و یا از بین برود و این بدان معنی است که ژنهای Opa متفاوتی در هر لحظه ترجمه میشود. پیلی هم از نظر آنتیژنیک و هم فاز متغیر است. Frame shift در ژنهای PilF و Pil c بهوجود آمده و بهطور مؤثری گسترش پیلی را خاموش میسازد؛ بهخصوص در مواردی که به وجود آن نیاز نیست، مانند بعد از کلونیزاسیون و هنگامی که نایسریا گونوره مستقر شده و میتواند در سلول زنده بماند.
پایداری نایسریا گونوره در بدن
بعد از تهاجم و انتقال درونسلولی گونوککها از طریق سلولهای اپیتلیال، در زیر مخاط مستقر میشوند و در این مکان توسط نوتروفیلها مورد حمله قرار میگیرند. اگرچه پیلی و پروتئینهای سطحی Opa ممکن است با فاگوسیتوز تقابل کنند، اما اکثر گونوککها به درون نوتروفیلها وارد میشوند، از این رو ترشحات شخص عفونیشده حاوی نوتروفیلهای زیادی همراه با گونوککهای فاگوسیتشده است. در نوتروفیلها انفجار اکسیداتیو از رادیکالهای اکسیژن در فاگوزوم سبب از بین رفتن گونوککها میشود، اما بخش بااهمیتی از گونوککها قادرند به دلیل عملکرد آنزیم کاتالاز خود که میتواند این رادیکالهای اکسیژن را غیرفعال سازد، در برابر انفجار اکسیداتیو مقاومت کرده و در فاگوزوم تکثیر نمایند.
تحقیقات Stohl و Seifert نشان داد که یک پروتئین باکتریایی به نام Rec A که واسطه ترمیم DNA آسیبدیده است، نقش مهمی در زنده ماندن گونوککها دارد. با پروسهTransformation باکتری دریافتکننده، DNA را از گونوکک دیگری بدست میآورد.
بیماریزایی
نشانههای عفونت با نایسریا گونوره متفاوت و بستگی به مکان عفونت دارد. بسیاری از عفونتها نیز ممکن است بدون نشانه باشند. در مردانی با علائم بیماری، نشانههای اولیه عفونت دستگاه ادراری تناسلی شامل اورتریت (التهاب مجرا)، سوزش در هنگام ادرار کردن (dysuria)، تکرر ادرار و خروج ترشحات چرکی از نوک آلت تناسلی است. ترشحات ممکن است بوی بد داشته باشد. اگر عفونت درمان نشود اسکار در مجرا بوجود آمده و سبب اشکال در دفع ادرار میشود.
عفونت ممکن است در مجرا به ساختارهای مجاور مانند بیضهها و پروستات وارد شده و سبب عفونت در این ارگانها شود. (epididymitis, orchitis, prostatit). مردانی که به عفونت با نایسریا گونوره مبتلا میشوند ریسک بالاتری برای ابتلا به سرطان پروستات دارند. در زنان نشانههای عفونت دستگاه ادراری شامل افزایش ترشحات واژینال، سوزش هنگام ادرار کردن، تکرر ادرار، درد هنگام تماس جنسی و همچنین سیکل ماهیانه غیرنرمال است. بیماری التهابی لگن ناشی از بالا رفتن نایسریا گونوره از طریق دهانه رحم (Cervix) اندومتریوم و لولههای فالوپ در Peritoneum صفاق بهوجود میآید. التهاب لولههای فالوپ و ایجاد اسکار در آن میتواند منجر به ناباروری و افزایش ریسک حاملگی خارج رحمی (ectopic) شود.
بیماری التهابی لگن در 20-10% زنان عفونیشده با نایسریا گونوره بهوجود میآید. باید توجه داشت بر اساس روش انجام آمیزش جنسی ممکن است عفونت حلق (فارنژیت)، عفونت مقعدی (Anus/Rectum) و یا پروکتیت (proctitis) به وجود آید.
در عفونتهای مربوط به زایمان (perinatal) اولین تظاهرات، عفونت ملتحمه چشمConjunctivitis در نوزاد است که تحت عنوان Neonatal Conjunctivitis یا Ophthalmia neonaturum نامیده میشود. این عفونت در هنگام تولد نوزاد از کانال زایمان مادر مبتلا به سوزاک کسب میشود. عفونت چشم میتواند منجر به اسکار قرنیه و یا سوراخ شدن آن و در نهایت کوری شود. تورم ملتحمه در طی 5-2 روز پس از تولد بهوجود آمده و شدید است.
عفونت چشمی گونوککی نوزادان Gonococcul ophthalmia neonaturum با استفاده از اریترومایسین در چشم نوزاد در هنگام تولد جلوگیری میشود. نیترات نقره در بسیاری از کشورها از جمله آمریکا استفاده نمیشود. عفونت منتشر گونوککی در هنگامیکه نایسریا گونوره وارد جریان خون میشود بهوجود میآید و اغلب در مفاصل جایگزین شده و با ایجاد راش Rash سبب
Dermatitis arthritis syndrome میگردد. این سندرم منجر به درد مفاصل arthritis و التهاب تاندون (Tenosynovitis) میشود و همچنین درماتیت بدون خارش و درد نیز بوجود میآید. عفونت پخششونده و بیماری التهابی لگن در زنان، بعد از سیکل ماهیانه به دلیل ایجاد رفلاکس در طی این دوره بهوجود میآید. در موارد نادری عفونت پخششونده ممکن است سبب مننژیت و یا عفونت دریچههای قلب (آندوکاردیت) شود.
انتقال Transmission
نایسریا گونوره با انجام آمیزش جنسی از طریق واژن، دهان یا مقعد انتقال مییابد. در بزرگسالان انتقال از طریق غیر آمیزش جنسی محتمل نیست ولی در نوزادان عفونت در طی زایمان در حین عبور از کانال زایمان مادر بهوجود میآید.
عفونت بدون نشانه در طیف زیادی وجود دارد از این رو پیشنهاد میشود زنان باردار از نظر گونوره آزمایش شوند. بهنظر میرسد نایسریا گونوره میتواند به اسپرماتوزوآ بچسبد. مطالعات اخیر نشان میدهد به غیر از وجود آنها در اسپرمهای متحرک، نایسریا گونوره میتواند توسط پیلی به پروتئینهای اسپرم چسبیده و در مایع سمینال حرکت کند. معمولاً بیمار مرد مبتلا به سوزاک متوجه نشانههای بیماری در خود خواهد شد ولی در اکثر زنان نشانههای سوزاک با عفونتهای مثانه و یا واژن اشتباه میشود.
در مردان اگرچه نشانههای بیماری معمولاً بین 5-2 روز بعد از کسب عفونت ظاهرمیشود اما ممکن است این علائم بعد از 30 روز مشاهده شوند. در زنان علائم معمولاً 10 روز بعد از کسب عفونت بهوجود میآید. نشانهها و تظاهرات این بیماری مشابه سایر عوامل ایجادکننده بیماریهای منتقله از طریق جنسی (STD) Sexually Transmitted Disease از جمله کلامیدیا Chlamydia است، لذا آزمایش همزمان برای این عوامل نیز پیشنهاد میشود.
نحوه ایجاد عفونت
پس از انتقال، اولین قدم، چسبیدن به سلولهای اپیتلیال موجود در سطوح مخاطی مکان عفونت است. به دنبال چسبیدن توسط پیلی و انقباض آن، باکتری به سمت غشاء سلولهای اپیتلیال کشیده میشود. در این پروسه پروتئینهای سطحی آن مانند پروتئینهای Opacity بهطور مستقیم دخالت دارند. عملکرد بعدی تکثیر و تولید میکروکلنی است. در هنگام کلونیزاسیون، دارای قدرت Transcytose (انتقال درونسلولی) از میان موانع اپیتلیالی است و این امر میتواند به راه یافتن آن به جریان خون کمک کند. در طی رشد و کلونیزاسیون، نایسریا گونوره رهاسازی سایتوکائینهاChemokines را که توانایی افزایش التهاب را دارند از سلولهای ایمنی میزبان تحریک میکند. تولید سایتوکائینها منجر به تجهیز ماکروفاژها و نوتروفیلها میشود. این سلولهای فاگوسیتوز، پاتوژنها را حذف مینمایند، اما نایسریا گونوره با تولید تدریجی بسیاری از مکانیسمها اجازه مییابد در درون این سلولهای ایمنی زنده بماند.
تشخیص آزمایشگاهی نایسریا گونوره
انتخاب نمونه، جمعآوری و انتقال
روشهای انتخاب نمونه و جمعآوری و جداسازی آن بستگی به تکنیکهای مورد استفاده در آزمایشگاه و همچنین سن، جنس و رفتار جنسی بیمار دارد. برای جمعآوری نمونه از سوابهای داکرون یا Rayon باید استفاده شود زیرا سواب از جنس کلسیم آلژینات ممکن است برای گونوککها سمیت داشته باشد. سوابهای پنبهای نیز به دلیل اینکه اسیدهای چرب از رشد گونوکک جلوگیری مینمایند، نباید استفاده شود ولی میتوان جهت به حداقل رساندن اثرات جلوگیریکنندگی مواد ناشناخته در نمونه و همچنین در سواب، بلافاصله پس از نمونهبرداری سواب بر روی محیط کشت تلقیح شود و یا در محیط انتقالی قرار داده شود.
روش جمعآوری نمونه کلینیکی برای تشخیص آزمایشگاهی سوزاک
نمونهبرداری در موارد زیر صورت میگیرد:
1- تشخیص عفونت ناشی از نایسریا گونوره
از نظر خصوصیات تشخیص، بیماران دارای نشانههای زیر هستند:
زنان: درد در هنگام ادرار کردن، ترشحات واژینال، خونریزی واژینال در فاصله بین دو سیکل ماهیانه
مردان: ترشحات غیرمعمول از نوک آلت، درد در هنگام ادرار کردن، دردناک بودن یا تورم بیضهها
نوزادان: عفونت ملتحمه
2- غربالگری سوزاک:
انجام آزمایش سالی یک بار در زنان دارای فعالیت جنسی زیر 25 سال و یا بیشتر از 25 سال و افرادی که در معرض خطر این بیماری منتقله از طریق جنسی هستند، افراد باردار و افرادی که تصمیم به بارداری دارند، توصیه میشود.
در مردان دارای فعالیت جنسی، آزمایش سالانه توصیه میشود.
غربالگری در تشخیص و درمان سوزاک و جلوگیری از پخش عفونت به دیگران اهمیت دارد.
- برای اطمینان از نتایج درمان، تکرار آزمایش در حدود سه ماه بعد از درمان کامل بیماری انجام میشود.
آزمایش غربالــــــــــــــــــــگری بیمـــــــــاری ســــــــــوزاک بر اساس پیـــشنهــــــــــــــاد CDC و
ACOG (American college of obstetricians and Gynecologist) و سایر سازمانهای مرتبط انجام میگیرد. بعضی از سازمانها سن غربالگری را 24 سال و یا کمتر پیشنهاد کردهاند.
ریسکفاکتورهای عفونت با نایسریاگونوره شامل موارد زیر است:
- ابتلای قبلی به عفونت با نایسریا حتی اگر بیمار درمان شده است.
- ابتلا به سایر بیماریهای STD بهویژه HIV
- دارا بودن شریک جنسی جدید یا چندین شریک جنسی
- ابتلای یکی از شرکای جنسی به STD
- عدم استفاده از کاندوم و یا استفاده نادرست از آن
- انجام رابطه جنسی برای پول یا مواد مخدر
- اعتیاد به مواد مخدر
- محکومیت در زندان
نحوه نمونهبرداری:
ترشح مجرا Urethral specimen
در مردان ترشحاتی که از دستگاه تناسلی خارج میشود بهترین نمونه برای نشان دادن نایسریا گونوره است. اگر بیمار فاقد ترشح است با فشار دادن نوک آلت و مشاهده مجرا، توسط یک سواب مخصوص داخل مجرایی Intra urethral باریک که با آب مرطوب شده، به اندازه 4-3 سانتیمتر وارد مجرا شده و به آهستگی چرخانده شده و بهآرامی نمونهبرداری میشود. در بیماران بعد از سن بلوغ نیز اگر ترشحات وجود ندارد به همین نحو نمونهبرداری میشود. این سواب نمونه مناسبی برای تهیه لام، کشت بر روی محیط مناسب و یا قرار دادن در محیط انتقالی برای ارسال به سایر آزمایشگاهها است. برای افزایش شانس مشاهده ارگانیسم، نمونه باید قبل از ادرار کردن و یا از بیمارانی تهیه شود که ادرارشان را حداقل به مدت 2 ساعت تخلیه نکرده باشند. بیمار نیز نباید آنتیبیوتیک مصرف کرده باشد.
ادرار Urine
بیمار حداقل 2 ساعت قبل از جمعآوری نمونه نباید ادرار کرده باشد زیرا شانس مشاهده ارگانیسم افزایش مییابد. برای نمونهبرداری ادرار از ظرف جمعآوری ادرار استفاده میشود. 15-10 میلیلیتر اول ادرار نمونه مناسبی است. ادرار جهت آزمایشهای تشخیص مولکولی، هم در بیماران زن و یا مرد مورد استفاده قرار میگیرد.
نمونههای دستگاه تناسلی زنان Cervical and Vaginal specimen
نمونهبرداری از سرویکس از زنان جوان و همچنین بزرگسال برداشت میشود. عفونت گونوککی در دختران قبل از سن بلوغ فقط واژن را دربر میگیرد. از این رو نمونهبرداری از واژن در این گروه سنی انجام میشود. وقتی بیمار دارای ترشحات مجرا نیز هست، نمونهبرداری از این مکان نیز باید انجام شود. برای نمونهبرداری از سرویکس، speculum را ابتدا با آب مرطوب نموده و سپس وارد واژن میشود تا دهانه یا گردن رحم مشاهده شود. سپس سواب را به اندازه 3-1 سانتیمتر وارد کانال اندوسرویکس نموده به مدت 30-10 ثانیه بچرخانید تا ترشحات جذب سواب شوند.
در نمونهبرداری از واژن، ترشحات واژینال کاملاً برداشت میشود. نمونههای شستشوی واژن در مورد دختران قبل از سن بلوغ نمونه بسیار مناسبی است. اگر امکان شستشو وجود ندارد، یک سواب پنبهای استریل را در قسمت خلفی دیواره واژن کشیده و اجازه دهید ترشحات جذب سواب شود. همانند سواب مجرا، از سواب واژینال و سرویکال ابتدا گسترش (smear) تهیه شده و سپس مستقیماً به محیط کشت تلقیح شده و میتواند جهت انتقال به سایر آزمایشگاهها به محیط انتقالی (Transport) نیز منتقل شود.
در مورد مشکوک بودن به همزمانی یا همراه بودن کلامیدیا تراکوماتیس با نایسریا گونوره ابتدا باید نمونه سرویکال برای نشان دادن نایسریا گونوره برداشت شود، زیرا نایسریا در ترشحات اندوسرویکس و کلامیدیا تراکوماتیس در سلولهای اپیتلیال سرویکس وجود دارد. در زنان علاوه بر عدم مصرف آنتیبیوتیک، عدم استفاده از کرم واژینال و یا دوش حداقل 24 ساعت قبل از نمونهبرداری اهمیت دارد زیرا میتواند در نتایج تأثیر داشته باشد.
CDC (Centers for disease control and prevention) غربالگری برای زنان باردار در سنین 25 سال و بالاتر را که در ریسک ابتلا به گونوره هستند، در طی سه ماه اول بارداری و یا اولین ویزیت توسط پزشک پیشنهاد میکند و زنان بارداری که هنوز در ریسک ابتلا هستند در سه ماهه سوم مجدداً آزمایش شوند. افرادی که بیماری سوزاک در آنان تشخیص داده میشود پس از درمان، سه ماه بعد باید مورد آزمایش قرار گیرند.
CDC برای مردانی که رابطه جنسی با مردان دارند غربالگری سالانه را پیشنهاد میکند. هرچند مراکز بهداشتی در مورد مردان هتروسکسوال دارای فعالیت جنسی، غربالگری روتین را پیشنهاد نمیکند، ولی در جوامعی که شیوع بالایی وجود دارد غربالگری باید انجام شود.
نمونههای حلقی و مقعدی Oropharyngeal, Rectal
نمونههای حلقی و مقعدی فقط برای کشت مناسب هستند زیرا روشهای غیرکشت نتایج خوبی نداشته است. برای نمونههای مقعدی از سواب و یا ترجیحاً آنوسکوپ Anoscope استفاده میشود. سواب به اندازه 3-2 سانتیمتر وارد کانال مقعد شده، چرخانده میشود تا از غدد رودهای Crypts داخل حلقه آنال نمونهبرداری شود. بعد از 10 ثانیه سواب بهآرامی خارج میشود. باید دقت شود سواب با مواد مدفوعی آغشته نشود.
برای نمونهبرداری از حلق، سواب استریل روی قسمت خلفی Posterior pharynx و لوزهها کشیده میشود.
از نوزادان، آسپیره نازوفارنکس برداشته میشود.
عفونت چشم Conjunctiva
ترشحات چرکی در مورد عفونت چشم نوزادان Ophthalmia neonoturum و ورم ملتحمه (Conjunctivitis) در بزرگسالان نمونهبرداری میشود.
برای نمونهبرداری با استفاده از سواب استریل، ترشحات و یا چرک بهدقت برداشته میشود. با سواب دوم که با سرم فیزیولوژی استریل مرطوب شده، بر روی ملتحمه عفونیشده کشیده میشود. این سواب میتواند در محیط انتقالی (ترانسپورت) قرار داده شود.
مایعات استریل بدن:
هنگامی که بیمار دارای نشانههای عفونت سیستمیک و یا پخششونده است،خون و مایع مفاصل نمونه مناسبی برای کشت است. برای نمونهبرداری ابتدا پوست با محلول Povidone-iodine (بتادین) 2-1% و یا 10% ضدعفونی میشود. اگر محلول تنتور ید استفاده میشود، با الکل 70% پاک شود. آسپیراسیون پلورال، پریکاردیال، پریتونئال و سینویال نمونههایی هستند که برای تشخیص گونوره استفاده میشوند. در این موارد باید از سوزنهای فاقد هپارین استفاده شود.
انتقال نمونهها
به دلیل تنوع نمونهها، روش انتقال بستگی به نوع نمونه دارد. در صورت استفاده از سیستمهای تجاری باید دستورالعمل کارخانه سازنده پیگیری شود.
بهطور ایدهآل نمونه باید بلافاصله پس از نمونهبرداری بر روی محیط کشت تلقیح شود تا به زنده ماندن گونوککها و جداسازی آنها کمک نماید. اگر محیط کشت باید به آزمایشگاه دیگری انتقال داده شود، پلیتها نباید بیش از 5 ساعت در دمای اتاق نگهداری شوند، بهعلاوه پلیتها باید در شرایط غنی از Co2 با استفاده از جار شمعدار (Candle jar) و سایر سیستمهای تولیدکننده Co2 قرار گیرند.
اگر به آزمایشگاهی با فاصله دورتر باید ارسال شوند، نمونه در محیطهایی که در یک سیستم تولیدکننده Co2 قرار دارند، تلقیح شده و به مدت 24-18 ساعت گرمخانهگذاری شده و رشد قابل مشاهده قبل از ارسال بررسی شود.
سیستمهای تجاری مولد Co2 شامل JEMBEC (Becton/Dickinson) و In Tray GC (Biomed Diagnostic) چنانچه در دسترس باشند زنده ماندن این ارگانیسمها را برای مدت طولانیتری نسبت به سایر سیستمها حفظ مینمایند.
انتقال کشتها:
چندین سیستم انتقالی مناسب برای انتقال کشتها و انجام تستهای حساسیت دارویی وجود دارند:
انتقال با استفاده از روش انجماد:
کلنیهای کشت 24 ساعته در محیط BHI broth حاوی 20% گلیسرول قرار داده شده و در ویالهای (Cryovial) درپیچدار گذاشته میشوند. سوسپانسیون برای انجماد در یکی از روشهای حمام یخ خشک، فریزر 70- درجه سانتیگراد و یا نیتروژن مایع قرار داده میشود. برای ارسال از شرایط استفاده از یخ خشک و بر طبق دستورالعمل انتقال مواد خطرناک استفاده میشود.
محیط ترانسپورت بدون نیاز به انجماد:
1- محیطهای انتقالی حاوی سواب شامل ذرات زغال (Charcoal) و یا بدون آن مانند:
Starswab/starplex scientific/PROBACT Transport swab system, med-ox Diagnostics, copan transport swab/
برای کمک به زنده ماندن گونوککها به مدت 12-6 ساعت در دمای اتاق مناسب هستند. کشت غلیظی در محیطهای انتقالی باید انجام شود؛ بهویژه اگر زمان طولانیتری باید در محیط ترانسپورت قرار گیرند.
2- پلیت JEMBEC حاوی محیط Mertin-Lewis Agar در پلیتهای پلیاتیلن چهارگوش حاوی یک لایه داخلی که همانند قرصهای مولد Co2 یک اتمسفر مناسب برای کشت را فراهم میسازد.
3- محیط Intray GC medium نیاز به انکوباسیون قبل از استفاده دارد.
محیط شکلات آگار با انکوباسیون قبل از استفاده
تستهای تشخیصی
بلافاصله پس از نمونهبرداری با سواب از مجرا، سرویکس، واژن و یا رکتوم حداقل 2 عدد لام تهیه میشود. برای تهیه لام، سواب باید بهآرامی بر روی لام در یک مساحت 1 سانتیمترمربع غلطانده شود تا مرفولوژی باکتری حفظ گردد.
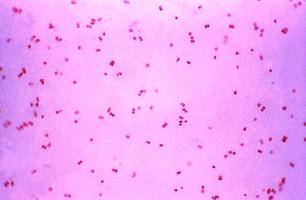
در رنگآمیزی گرم از گسترش تهیهشده از مجرای بیماران با نشانههای بالینی، معمولاً دیپلوککهای گرم منفی داخل سلولی به شکل دانههای لوبیا و یا کلیه یا قهوه درون گلبولهای سفید پلیمورفونوکلئر مشاهده میشوند. این امر دلالت بر تشخیص احتمالی نایسریا گونوره دارد. وجود دیپلوککهای گرم منفی خارج سلولی باید بهوسیله کشت یا روشهای مولکولی تأیید شوند. تفسیر اسمیر اندوسرویکال بیماران زن یا نمونه رکتال بسیار مشکل است زیرا با سایر دیپلوککها و کوکوباسیلهای گرم منفی مانند Moraxella، Kingella و گونههای آسینتوباکتر ممکن است اشتباه شوند. حساسیت و اختصاصیت برای اسمیرهای مجرا به ترتیب 90 تا 95% و برای اسمیر اندوسرویکال 50 تا 70% حساسیت و 90% اختصاصیت گزارش شده است. بههرحال قابل اعتماد بودن آزمایشهای میکروسکوپی بستگی به کیفیت نمونه و تجربه شخص آزمایشکننده دارد.
بر اساس مطالعات اخیر، رنگآمیزی از لام مجرا در مناطقی که شیوع گونوره کم است، کارآمد نیست.
کشت Culture
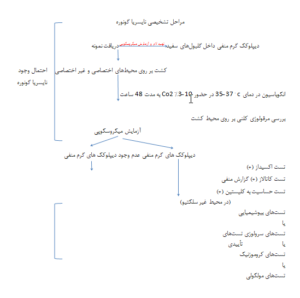
متدهای اخیر آزمایشگاهی برای تشخیص عفونت نایسریا گونوره شامل جداسازی و تشخیص عامل بیماری بر اساس شکل 1 است. جداسازی از کشت برای تست حساسیت دارویی اهمیت زیادی دارد و همچنین در موارد مراقبت بیماری، مشکلات درمانی و خصوصیات آن در همهگیریها نیز کاربرد دارد.
محیطها و شرایط کشت
نمونههای اولیه باید بر روی یک محیط شکلات آگار و محیطهای آگار حاوی مواد ضد میکربی که میتوانند از رشد باکتریهای کومنسال و قارچها جلوگیری نمایند، کشت داده شوند. مواد ضد میکربی در محیطهای Modified Thayer Martin، Martin-lewis و محیط Newyork city شامل وانکومایسن، کلیستین، تریمتوپریم لاکتات و مواد ضد قارچ مانند نیستاتین، Anisomycin و یا Amphotericin B است. بعضی انواع سخترشد و یا پُرنیاز مانند انواع نیازمند به Arginine hypoxanthine و Uracil به غلظت وانکومایسین و یا تریمتوپریم سولفامتوکسازول که در محیطهای سلکتیو مورد استفاده قرار میگیرد، بیشتر حساس هستند. انواعی که از رشدشان در محیطهای سلکتیو جلوگیری میشود، باید در محیطهایی با غلظت کمتری از آنتیبیوتیک رشد نمایند.
انواع آتیپیک مانند انواع حساس به وانکومایسین باید به آزمایشگاههای رفرانس جهت تأیید تشخیص ارسال شوند، بنابراین یک برنامه ارزیابی کیفیت که بهطور دورهای طیف جداسازی باکتری را در محیطهای سلکتیو و غیرسلکتیو مقایسه میکنند، موردنیاز است. پلیتها پس از کشت در انکوباتور 35 تا 37 درجه سانتیگراد و در اتمسفر حاوی Co2 (3 تا 7%) و رطوبت به مدت 48 ساعت قرار داده میشوند. پلیتها نباید بیشتر از 48 ساعت در انکوباتور قرار داد شوند زیرا در طی انکوباسیون طولانی ممکن است اتولیز بهوجود آید و کلنیها در محیطهای مایع که برای انجام تستهای بعدی بهکار برده میشوند، بهسختی حل شوند. باکتری بهدستآمده برای تستهای افتراقی باید بر روی محیط Non selective مانند شکلات آگار کشت شود زیرا یک کشت 24-18 ساعته برای تستهای تشخیصی بعد لازم است.
کشت تازه نایسریا گونوره حداقل 2 شکل از 4 شکل کلنی را که تحت عنوان T1,T2,T3,T4 نامیده میشود را خواهد داشت. T1 فرم غالب کلنیها در کشتهای تازه است ولی در کشتهای مکرر کلنیهای T3 مشاهده میشوند و دیگرT1 وجود نخواهد داشت. کلنیهای نایسریا شفاف هستند ولی کلنیهای پیگماندار قهوهای بعد از 48 ساعت انکوباسیون به دنبال اتولیز سلولها بهوجود میآید.
ذخیرهسازی طولانیمدت
کشت نایسریا گونوره برای نگهداری به مدت طولانی در فریزر 80- در نیتروژن مایع (196- درجه سانتیگراد) و یا بهصورت لیوفلیزه نگهداری و ذخیره میشود. برای این منظور از کشتهای 24-18 ساعته استفاده میشود. برای آماده کردن کشت برای انجماد، سوسپانسیون باکتری در محیط BHI broth به همراه 20% گلیسرول تهیه میشود. در روش لیوفیلیزه، سوسپانسیون در 2% Skim milk تهیه شده و در ویال لیوفیلیزه در حجم کم تقسیم میشود. وقتی از روش لیوفیلیزه استفاده میشود، یکی از ویالها قبل از لیوفیلیزه کردن مورد آزمایش قرار میگیرد تا از زنده بودن و خالص بودن کشت اطمینان حاصل شود. کشتهای لیوفیلیزه در دمای .4 درجه سانتیگراد و یا در حرارت اتاق نگهداری میشوند.
برای اطمینان از زنده بودن باکتری در مدت زمان طولانی بهویژه کشتهای باکتری رفرانس، باید هر 5 سال یک بار مجدداً Subculture شوند. کشتهای رفرانس که بهعنوان کنترل مورد استفاده قرار میگیرند بهتر است در محیطهای مایع متعددی ذخیره شوند. تا از ذوب و انجماد آنها جلوگیری شود.
تشخیص احتمالی نایسریا گونوره
تشخیص احتمالی نایسریا گونوره بر اساس رنگآمیزی گرم از ترشحات مجرا و یا ترشحات اندوسرویکال و مشاهده دیپلوککهای گرم منفی داخل سلولی و همچنین جداسازی دیپلوکک گرم منفی اکسیداز مثبت قادر به رشد بر روی محیط سلکتیو انجام میگردد. (شکل 1)
در تست اکسیداز از محلول 1% تترا متیل پارافنیلن دیآمین دیهیدروکلراید استفاده میشود که بهطور تجاری بهصورت دیسک اکسیداز وجود دارد و یا در آزمایشگاه تهیه میشود. برای انجام تست، یک قطره از معرف روی یک فیلتر کاغذی و یا در نوک سواب پنبهای گذاشته میشود، سپس با استفاده از لوپ پلاستیکی و یا پلاتینیوم و یا اپلیکاتور چوبی از کشت برداشت کرده و روی فیلتر و یا نوک سواب قرار داده میشود. وجود رنگ بنفش تیره در طی 10 ثانیه نشانه وجود آنزیم اکسیداز و تست مثبت است.
تست کاتالاز (با استفاده از آب اکسیژنه 3%) و تست Superoxol (آب اکسیژنه و یا هیدروژن پراکساید 30%) نیز از دیگر تستهای سریع برای تشخیص نایسریا گونوره است. برای انجام تست یک قطره از معرف در مرکز لام تمیز قرار داده میشود و با استفاده از اپلیکاتور چوبی از کشت نایسریا برداشت و در آب اکسیژنه حل میشود، ایجاد حباب در مدت 1 تا 2 ثانیه نشانه واکنش مثبت است. معرف کاتالاز و اکسیداز روزانه جهت اطمینان از کیفیت با باکتریهای اکسیداز و یا کاتالاز مثبت و منفی آزمایش میشود.
تستهای تأییدی Confirmatory test
جهت تأیید نایسریا گونوره تستهای بیوشیمیایی، سرولوژیک، کالریمتریک و روشهای اسیدنوکلئیک مورد استفاده قرار میگیرند. ممکن است بیشتر از یک سیستم برای تأیید تشخیص موردنیاز باشد.
تستهای بیوشیمیایی
نایسریا گونوره میتواند بر اساس توانایی رشد بر روی محیطهای مناسب سلکتیو و غیر سلکتیو و تولید اسید از گلوکز، لاکتوز، سوکروز، فروکتوز از سایر گونههای نایسریا، گونههای موراکسلا و Kingella افتراق داده شود.
سایر تستها شامل احیای نیترات، تولید پلیساکارید از سوکروز و تولید DNase است که در جدول 1 نشان داده میشوند. برای مشاهده تخمیر کربوهیدراتها از محیطCTA (Cystine Trypticase Agar) با 1% کربوهیدرات بهطور جداگانه استفاده میشود. این تست به اندازه کافی حساس نیست، بهعلاوه تفاوت بین نایسریا گونوره و N.cinerea با استفاده از محیط CTA امکانپذیر نیست. از طرفی کنترل کیفی خالص بودن قندها نیز باید انجام شود.
تست سریع کربوهیدرات، یک تست غیروابسته به رشد برای نشان دادن تولید اسید از کربوهیدراتها بهوسیله نایسریا گونوره است. این تستهای سریع اختصاصیت 99% تا 100% دارند و نسبت به محیط قندی CTA حساسیت بیشتری دارند.
برخی از تستهای تجاری، سایر خصوصیات بیوشیمیایی مانند تولید آنزیمها شامل DNase و احیای نیترات را نیز نشان میدهند. در همه تستها باید کنترل کیفی انجام شود.
Chromogenic Enzyme Substrate
این تستها بر اساس حضور آنزیمهای کروموژنیک است، از این رو نیازمند کشت غلیظ از ارگانیسم رشدیافته روی محیطهای سلکتیو است تا گونهها را تشخیص دهد. آنزیمهایی که بهوسیله این سیستمها نشان داده میشوند شامل موارد زیر است:
B Galactosidase, Gamma glutamylaminopeptidase, Prolyl-hydroxyprolyl Aminopeptidase
این متدها بهطور تجاری در دسترس هستند:
Gonochek II, EY laboratories, Gonocheck II, TCS, Biosciens Ltd, UK-Identicult-Neisseria, Adam scientific
Bacticard Neisseria, Remel inc.
این سیستمها در مواردی که سایر گونههای نایسریا به دلیل رشد در محیطهای اختصاصی نایسریا و استفاده از کربوهیدرات ممکن است با نایسریا گونوره اشتباه شوند، اهمیت دارند.
باید توجه داشت هیچیک از تستهای تأییدکننده برای تشخیص نایسریا گونوره حساسیت و اختصاصیت 100% ندارند و لذا تشخیص نباید بر اساس نتایج فقط یک تست باشد.
تستهای سرولوژیک:
تست فلوروسنت آنتیبادی:
آنتیبادی مونوکلونالFluoreseein isothiocyanate در تست تأییدی کشت، (Trinity Biotech Plc Ireland) بهطور اختصاصی با N.gonorrhoeae واکنش نشان میدهد. آنتیبادی بهطور اختصاصی به هر دو پروتئین 1A و 1B (پروتئینهای غشای خارجی و یا پورین) متصل میشود.
در روش رنگآمیزی فلورسنت انواع کشت مثبت نایسریا گونوره به شکل دیپلوککهای لوبیایی شکل و یا به شکل کلیه و به رنگ سبز مشاهده میشوند. اگرچه گزارش شده که این تست اختصاصیت 100% برای تشخیص نایسریا گونوره دارد، ولی اتصال غیر اختصاصی FC به ارگانیسمهای غیروابسته مانند S.aureus مشاهده شده است؛ بنابراین فقط دیپلوککهای گرم منفی اکسیداز مثبت باید تست شوند. علیرغم آنکه حساسیت این روش 99% است، باید از یک تست جایگزین تأییدی در مواردی که نتایج منفی غیر قابل انتظار وجود دارد، استفاده شود.
تستهای کوآگلوتیناسیون Coagglutination test
تستهای آگلوتیناسیون میتوانند بر روی محیطهای کشت اولیه انجام شوند، بنابراین نتایج یک روز زودتر از تستهایی که نیاز به Subculture دارند، فراهم میشود. بعضی از این تستها نیازمند سلولهای تازه و زنده هستند. سوسپانسیون باکتری جوشانده شده و سپس با آنتیبادی مونوکلونال متصل میشود که این آنتیبادیها اپیتوپهای مقاوم به حرارت روی پروتئین Por 1 غشاء خارجی را نشان میدهند و همچنین با معرف Reagent اختصاصی آن واکنش میدهند. کوآگلوتیناسیون با معرف Reagent تست نشاندهنده نتایج مثبت است.
نتایج مثبت کاذب (False positive) واکنش متقاطع (Cross-reaction) با سایر گونههای نایسریا مانند N.meningitidis، N.lactamica،N.cinerae، K.denitrifirans و همچنین نتایج منفی (False negative) برای تستهای کواگلوتیناسیون گزارش شده است؛ بنابراین تستهای دیگری نیز در صورت وجود شرایط زیر باید انجام شود:
* باکتری که بهنظر میرسد نایسریا گونوره باشد با Reagent واکنش ندهد و یا نتایج دوپهلو داشته باشد.
* نتایج مثبت در مورد باکتری بدستآمده از مناطق خارج دستگاه تناسلی از بیماری با ریسک کم
* و بالاخره نتایج مثبت از باکتری بدستآمده از کودکان
دو تست کوآگلوتیناسیون تجاری وجود دارد:
Karo Bio Diagnostic AB (Sweden) Phadebact GC OMN
Gono Gen (New Horizons Diagnostic, (USA).
تستهای رنگسنجی Colourimetric Test
Gono Gen II (New Horizon Diagnostic) به مرحله حرارت دادن در تستهای کوآگلوتیناسیون نیاز ندارند. در این تست مرحله خوانش آگلوتیناسیون نیز وجود ندارد و در عوض محلولی از کمپلکس آنتیژن-آنتیبادی از فیلتر عبور کرده و ظهور نقطه قرمز بر روی فیلتر نشاندهنده واکنش مثبت است، مانند Gono Gen این تست نیاز به کشت خالص و زنده باکتری ندارد.
روشهای نوکلئیک اسید با Amplification و یا بدون آن
روشهای تشخیص مولکولی امکان تشخیص سریع و اختصاصی پاتوژنهای پُرنیاز و یا سخترشد و یا انواعی که کشت آنها میسر نیست را فراهم مینماید. این روشها برای تشخیص پاتوژنهای منتقله از طریق تماس جنسی سریع هستند و حساسیت و اختصاصیت بالایی دارند. روشهای مولکولی برای جداسازی این نوع باکتریها در نمونههای ادرار و سواب واژینال که برای کشت مناسب نیستند، کاربرد دارد، بهعلاوه برای بیمار نیز مشکلی ایجاد نمینماید. سیستمهای مولکولی برای تشخیص نایسریاگونوره و کلامیدیا تراکوماتیس در دسترس هستند و در بعضی آزمایشگاهها تکنیکهای مولکولی همراه با کشت انجام میشود.
روشهای مولکولی در مورد تشخیص نایسریا گونوره بهویژه در نمونههایی که ممکن است به دلیل انتقال درازمدت و یا تماس با درجه حرارت نامناسب حاوی باکتری زنده نباشد، کاربرد دارند، ولی برخلافC.trachomatis عملکرد روشهای نوکلئیک اسید در مورد N.gonorrhoeae چنانچه سیستم انتقالی مناسبی استفاده شده باشد، برتری چندانی ندارد.
باید توجه داشت روشهای مولکولی برای بررسی پس از درمان بیماران مبتلا به گونوره مناسب نیست، زیرا DNA ممکن است چندین هفته پس از درمان موفقیتآمیز هنوز وجود داشته باشد، بههرحال در مورد Pace 2 (Gen probe) گزارش شده است که تست مناسبی برای ارزیابی پس از درمان گونوره به مدت 6 روز پس از درمان عفونت تناسلی است. روشهای خیلی حساس Amplification ممکن است مشکلات آلودگی متقابل Cross-contamination داشته باشند و از این رو احتیاط زیادی باید برای حذف عوامل تداخلکننده انجام شود.
طراحی مناسب مکان کار و عملکردهای مناسب و احتیاطآمیز و یا استفاده از سیستم اتومیک، ریسک موارد نتایج مثبت کاذب ناشی از آلودگی متقاطع Cross-contamination را کاهش میدهد. پرایمر برای آمپلیفیکاسیون DNA نایسریا گونوره ممکن است واکنش متقاطع با DNA سایر گونههای نایسریای غیربیماریزا داشته باشد، بنابراین تستهای تأییدی جهت حذف نتایج مثبت کاذب باید انجام شود. این امر هنگامی که این تستها در جمعیتهایی که در آن میزان شیوع پایین است بهکار برده میشوند اهمیت دارد.
متدهای نوکلئیک اسید مناسب برای تأیید نتایج کشت
سیستمهای (DNA probe Accuprobe/Genprobe) برای تأیید نتایج کشت استفاده میشود.
سیستمAccu probe یک DNA probe تکرشتهای Chemiluminescent را استفاده مینماید که با RNA ریبوزومی (rRNA) نایسریا گونوره همخوانی دارد. هیبریدDNA/RNA از یک کشت مثبت با استفاده از Luminometer نشان داده میشود. در مقایسه با روش سریع تولید اسید و تستهای کوآگلوتیناسیون، تستDNA probe اختصاصیت و حساسیت بیشتری دارد.
پرایمر اختصاصی برای روش PCR در منابع توضیح داده شده است. این متدها حساسیت بیشتری دارند، هرچند که اختصاصیت آنها بستگی به انتخاب پرایمر دارد. برای تشخیص انواعی که نیاز به یوراسیل، سیترولین و پرولین دارند در مناطقی که هرچند شیوع بالایی از آنها وجود دارد، استفاده از پرایمرهای هدف پلاسمیدی استفاده نمیشود زیرا آنها بدون پلاسمید هستند. کیتهای تجاری تشخیصی نیز موجود هستند ولی پرهزینهاند.
روشهای Amplification
PCR:
حساسیت و اختصاصیت واکنش PCR بستگی به پرایمرهای مورد استفاده و وجود مواد ممانعتکننده در نمونهها دارد. در حال حاضر تستهای کاملاً اتوماتیک مانند COBAS Amplicor CT/NG Roche Diagnostic System و تستهای نیمه اتوماتیک Amplicor CT/NG Roche Diagnostic System در بعضی کشورها وجود دارند. در این روشها هدف، توالی ژن DNA methyl-Transferase برای نشان دادن نایسریا گونوره است. برای جستجوی حضور مواد جلوگیریکننده، کنترل داخلی DNA هدف برای Coamplification در هر واکنش در دسترس است. حساسیت و اختصاصیت روشهای PCR در بسیاری از منابع ارزیابی شده است. برای برداشت نمونههای واژن و یا سرویکال از سواب داکرون موجود در کیت Amplicor PCR collection ساخت Roche Diagnostic System USA استفاده شده و در لولههای مرطوب و یا خشک انتقال داده میشود.
روش Multiplex PCR برای Coamplification نایسریا گونوره و کلامیدیا تراکوماتیس بهکار میرود و حساسیت آن 92/3% در مقایسه با روش کشت برای بدست آوردن نایسریا گونوره از نمونه مجرا است. روش Real-Time PCR در مقایسه با PCR به زمان کوتاهتری نیاز دارد.
یک روش Multiplex qualitative Real Time PCR که نایسریا گونوره و کلامیدیا تراکوماتیس را نشان میدهد و همچنین حاوی یک کنترل داخلی نیز هست، وجود دارد.
بعضی نمونهها ممکن است اثر ممانعتکنندگی برای PCR داشته باشند. بر این اثر ممانعتکنندگی با یکی از روشهای زیر میتوان غلبه کرد:
- استفاده از روش خالصسازی DNA برای نمونهها (بعضی از کیتهای خالصسازی بهطور تجاری در دسترس هستند Qiagen/ontario)
- رقیقسازی نمونههای ادرار
- تکرار آمپلی فیکاسیون با استفاده از نمونه دیگری از ادرار
Ligase Chain Reaction
این روش که به اختصار LCR (Ligase Chain Reaction) نامیده میشود (LCR uriprobe, Abbott laboratories) از پروبهایی استفاده میکند که ژنهایopa و pil را برای تشخیص نایسریا گونوره در نمونههای ادرار، واژینال و اندوسرویکال هدف میگیرند. مراحل آمپلیفیکاسیون شامل یک سیکل افزایشیافته درجه حرارت برای DNA denaturation و تبدیل آن به یک رشته منفرد است و یک سیکل درجه حرارت پایین برای Annealing از پروبهای مجاور به هدفها و GAP filling با DNA polymerase در حضور deoxyguanosin triphosphate و اتصال Ligation پروبها باLigase وجود دارد. آمپلیکنهای اتصالیافته، گرفته شده و بهوسیله روش فلورسنس Immunoassay نشان داده میشوند. اختصاصیت و حساسیت LCR برای نشان دادن در نمونههای متفاوت از 97/3% تا 100% از سالهای 2003 بوده است.
(SDA) Strand Displacement Amplification system
SDA یک سیستم ایزوترمال آمپلیفیکاسیون است. سیستم نیمهاتوماتیک
BD probe Tec ET system,Becton/Dickinson برای همزمان نشان دادن N.gonorrhoeae و Chlamydia trachomatis کاربرد دارد.
آمپلیفیکاسیون بر اساس توالی نوکلئیک اسید Nucleic acid sequence-based amplification (NASBA)
این روش یک سیستم ایزوترمال آمپلیفیکاسیون اسید نوکلئیک است که بهThermal Cycler نیاز ندارد.
(Organon Teknika Boxtel,Netherlands) Nuclisens Basisc kit
آمپلی فیکاسیون RNA و عملکردهای آن را نشان میدهد. کیت حاوی ریجنت برای استخراج RNA و آمپلیفیکاسیون آن و یک پروب نشاندارشده با Ruthenium برای نشان دادن electrochemiluminescent آمپلیکنها است.
این سیستم برای نشان دادن 16 sr RNA نایسریا گونوره در نمونههای دستگاه تناسلی ارزیابی شده است.
تستهای بدون نیاز به آمپلیفیکاسیون
تست Pace 2 NG (Gen-probe/USA) یک پروب اسید نوکلئیک منفرد را برای نشان دادن rRNA نایسریا گونوره در نمونههای اندوسرویکال استفاده میکند، درحالیکه در Pace 2C (Gen-probe/ USA) یک پروب ترکیبی Combination برای نشان دادن نایسریا گونوره و کلامیدیا تراکوماتیس در یک روش استفاده میشود. نتایج مثبت در Pace 2C نیازمند آزمایشهای بیشتری است. با استفاده از تستهای ویژه Pace 2NG و Pace 2CT افتراق بین نایسریا گونوره و کلامیدیا تراکوماتیس انجام میشود. تست Pace 2NG اسید نوکلئیک را در مدت 2 ساعت در نمونههای بیماران تشخیص میدهد.
سواب و محیط ترانسپورت موجود در کیت جمعآوری Pace برای جمعآوری و انتقال نمونه به آزمایشگاه استفاده میشود. نمونهها در دمای اتاق پایدار هستند. این تست دارای اختصاصیت بالایی برای نشان دادن N.gonorrhoeae در نمونههای ادراری- تناسلی endocervical و urogenital است؛ اما در نمونههای حلقی و نمونههای رکتال در بیماران با ریسک بالا حساسیت کمتری دارد. عملکرد Pace 2C مشابه با Pace 2NG در نشان دادن نایسریا گونوره در نمونههای اندوسرویکال است. حساسیت و اختصاصیت و مثبت و منفی بودن آن در ارائه نتایج در روش Pace 2C به ترتیب 96/3%، 98/8%،92/2%، 99/4% است.
(Digene corporation,USA Hybrid capture II) تســـت ترکیبی DNA probe اســــــــــــــــت که یک Signal amplification را برای نشان دادن نایسریا گونوره و کلامیدیا تراکوماتیس در یک نمونه بهکار میبرد. برای تهیه نمونه در این روش براش اندوسرویکال ارزش بیشتری نسبت سواب داکرون برای جمعآوری نمونه دارد.
تستهای سرولوژیک
تست سرولوژیک با اختصاصیت و حساسیت بالا برای تشخیص عفونت جدید گونوککی با استفاده از نشان دادن آنتیبادی اختصاصی نایسریا گونوره و یا آنتیژن آن در نمونه بیماران وجود ندارد.
تعیین تیپ در نایسریا گونوره Typing N.gonorrhoeae
تفاوت بین سویهها در موارد اپیدمیولوژی و پزشکی قانونی و همچنین در بررسی همهگیریها، ارزیابی گسترش موارد مقاوم به مواد ضد میکربی و پیگیری انتقال انواع خاص نایسریا گونوره در جامعه استفاده میشود. در بسیاری از کشورها تعیین تیپ در نایسریا گونوره در آزمایشگاههای رفرانس انجام میشود.
روشهای تایپینگ که برای افتراق سویه به کار میرود شامل موارد زیر است:
Auxotyping(A) serotyping(s) plasmide profile(f) pro B sequencing, opa typing PFGE pulsed-field Gel electrophoresis, Ribotyping, Amplified ribosomal DNA restriction.
روشهای مولکولی subtyping به همراه جمعآوری اطلاعات اپیدمیولوژیک میتواند برای مطالعه الگوی انتقال بیماری در جامعه و تشکیل شبکه بیماریهای آمیزشی استفاده شود.
رایجترین متدهای تعیین تایپ شامل A، S و P است. A بر اساس الگوی نیاز غذایی ارگانیسم است و S نیازمند استفاده از آنتیبادی مونوکلونال علیه اپیتوپ پروتئین I است. هر دوی این روشها آسان بوده و نیاز به وسایل اختصاصی ندارند. P تیپ افتراق دهنده است که بتالاکتاماز پلاسمیدی و مقاومت با واسطه پلاسمیدی تتراسایکلین را تفکیک میکند.
توانایی تعیین تایپ A ، S و P جهت تفاوت سویهها برای بررسی مقاومت به آنتیبیوتیک در نایسریا گونوره نشان داده شده است. آنالیز پلاسمید فقط برای انواعی که مقاومت به پلاسمید را دارا هستند، انجام میشود. در ترکیب A با S سطح بالاتری از تفاوتها نشان داده میشود. کاربرد این سه روش معیاری برای مراقبت در سطح ملی را فراهم میکند.
یکی از موارد خطا در مورد S غیر قابل تایپ بودن بعضی از انواع است. مشکل دیگر در دسترس نبودن ریجنت مونوکلونال S است.
برای حل کردن مشکلات سروتایپینگ، پروتئین 1 یا پورین میتوانند بهعنوان روش جایگزین در تعیین توالی DNA در ژن Por B که آنتیژنهای سوماتیک را کدگذاری میکنند، استفاده شوند. تعیین توالی DNA به دلیل سروتایپینگ همه انواع قابل تیپبندی مزیت بیشتری نسبت به روشهای مرسوم سروتایپینگ دارد.
Opa typing میتواند برای بررسی همهگیریها و ایجاد شبکه برای بیماریهای جنسی بهکار رود ولی از معایب آن فقدان الگوهای استاندارد بین آزمایشگاهی است.
سایر روشها نیز شامل PFGE، Ribotyping و آنالیزAmplified ribosomal-DNA دارای مشکلات استاندارد کردن روشها هستند.
PFGE قدرت بیشتری در تمایز انواع نایسریا گونوره دارد ولی از معایب آن وجود بعضی قطعات بزرگ در الگوی اتصال PFGE است که بهخوبی حل نمیشوند.
روش فلورسنت Fluorescent amplified fragment length polymorphism عملکردی مشابه باopa typing دارد.
تست حساسیت ضد میکربی
جداسازی باکتری در محیط کشت و انجام تست حساسیت دارویی اطلاعات مفیدی را در مورد درمان و کنترل عفونت امکانپذیر میسازد. در بعضی از کشورها اگر میزان شیوع مقاومت به آنتیبیوتیک بیشتر از 3% باشد آن آنتیبیوتیک در درمان استفاده نمیشود، درحالیکه بر اساس پیشنهاد WHO میزان 5% مقاومت قابل قبول است. محیط مورد استفاده، محیط پایه GC Agar است که به آن 0/05 گرم نیترات فریک، 0/1 گرم Cocarboxylase، 0/5 گرم Glutamine و 200 گرم گلوکز در یک لیتر آب اضافه میشود.
آنتیبیوتیکهای پیشنهادی شامل سیپروفلوکساسین، Spectinomycin، نسل سوم سفالوسپورینها (سفتریاکسون) و همچنین Cefixime و پنیسیلین و تتراسایکلین است (اگرچه مقاومت به این دو آنتیبیوتیک سطح بالایی دارد).
در عفونتهای همزمان کلامیدیا تراکوماتیس و نایسریا گونوره، داکسیسایکلین و آزیترومایسین و یا اریترومایسین نیز استفاده میشوند ولی ممکن است با ایجاد فشار انتخابی بر روی نایسریا گونوره سبب پایدار شدن انواع مقاوم شوند.
مقاومت نایسریا گونوره به آنتیبیوتیکها از شروع سال 1940 میلادی موردتوجه قرار گرفت. علیرغم اینکه گونوره بهخوبی با پنیسیلین درمان شده بود، اما بهتدریج نیاز به دوزهای بالاتری برای درمان مؤثر افزایش یافت. در سال 1970 میلادی موارد نایسریا گونوره مقاوم به پنیسیلین و تتراسایکلین در منطقه جغرافیایی اقیانوس آرام پدیدار شد، سپس این انواع مقاوم به هاوایی، کالیفرنیا و بقیه ایالتهای آمریکا و همچنین اروپا پخش شدند. گروه دارویی fluoroquinolones که سیپروفلوکساسین در این گروه قرار دارد آخرین خط دفاعی بود، اما بهزودی مقاومت به این آنتیبیوتیک نیز پدیدار شد. از سال 2007 درمان استاندارد شامل سفالوسپورینهای نسل سوم مانند سفتریاکسون است که بهنظر میرسد آخرین خط دفاعی باشد.
در سالهای اخیر سویهای از نایسریا گونوره که تحت عنوان Ho41 نامیده میشود با سطح بالایی از مقاومت به سفتریاکسون در ژاپن کشف شده است. تستهای آزمایشگاهی نشان داد که علاوه بر اینکه به غلظت بالایی از سفتریاکسون مقاومت دارد، به سایر آنتیبیوتیکها نیز مقاوم است. در نایسریا گونوره ژنی وجود دارد که مقاومت به هر آنتیبیوتیکی که بهتنهایی برای درمان گونوره بهکار رود را ارائه میدهد. به دلیل تمایل زیاد جهت انتقال ژنتیکی در این باکتری، نایسریا گونوره مقاوم به دارو یک مشکل بهداشتی محسوب میشود.
نحوه گزارشدهی Reporting
جهت گزارش لازم است تستهای تأییدی و افتراقی در سطح گونه برای ارائه نتایج نهایی انجام شود.
گزارش Neisseria gonorrhoeae isolated: به معنای آن است که تستهای تأییدی برای تشخیص انجام شده است.
گزارش بهصورت تشخیص احتمالی: Presumptive Neisseria gonorrhoeae هنگامی ارائه میشود که در مشاهده میکروسکوپی از لام تهیهشده از ترشحات مجرای مردان و یا ترشحات اندوسرویکس زنان دیپلوکک گرم منفی داخل سلولی وجود دارد.
Gram Negative intracellular Diplococci
و یا در محیط کشت دیپلوکک گرم منفی اکسیداز مثبت رشد کرده است.
Gram Negative oxidase positive Diplococcus isolated.
در مواردی که پزشک گزارش تشخیص احتمالی نایسریا گونوره را دریافت میکند، میتواند تستهای تأییدی را بهخصوص در موارد پزشکی قانونی درخواست نماید.
برنامههای کنترل کیفی
برنامههای کنترل کیفی برای اطمینان از محیط، معرف، وسایل و پرسنل آزمایشگاه بر اساس دستورالعمل باید انجام شود.
مواردی که لام مثبت و کشت منفی است نشانه اثرات مهارکنندگی محیط کشت و عدم استفاده از محیطهای سلکتیو است. حساسیت گونوکک به غلظتهای تریمتوپریم و وانکومایسین موجود در محیط سلکتیو نیز باید مورد بررسی قرار گیرد.
در تهیه اتمسفر Co2 با استفاده از جار شمعدار، از شمع سفید بدون بو استفاده شود، زیرا بخار حاصل از سوختن شمعهای رنگی و یا معطر میتواند برای گونوکک سمیت داشته باشد.
در صورت استفاده از کیتهای تجاری باید به مجوز وزارت بهداشت توجه شود. مقایسه دورهای متدهای مولکولی و یا سایر روشهای جایگزین با کشت باید انجام گردد تا نتایج مثبت یا منفی کاذب بررسی شود.
N.gonorrhoeae ATCC 49226 برای کنترل آنتیبیوتیکها استفاده میشود.
بعضی از آنتیبیوتیکها از جمله تتراسایکلین به نور حساس هستند و باید در تاریکی نگهداری شوند.
برای نشان دادن بتالاکتاماز در مورد نایسریا گونوره تولیدکننده پنیسیلیناز از دیسک نیتروسفین استفاده میشود.
نمودار 1
Table1- Supplemental tests that permit differentiation between Neisseria gonorrhoeae and related species
| Superoxol | Polysaccharide from sucrose | Nitrate reduction | Acid from | |||||
| Lactose | Fructose | Sucrose | Maltose | Glucose | Species | |||
|
Strong(4+) positive,explosive |
– | – | – | – | – | -# | +* | Neisseria gonorrhoeae |
| Weak(2+) positive | – | – | – | – | – | + | + | Neisseria meningitides |
| – | – | + | – | – | – | – | + | Kingella denitrificans |
| Weak(2+) positive | – | – | – | – | – | – | – | Neisseria cinerea |
| Weak(2+) positive | – | – | – | – | – | + | + | Neisseria subflava biovar
subflava |
| Weak(2+) positive | – | – | – | + | – | + | + | Neisseria subflava biovar flava |
| Weak(2+) positive | + | – | – | + | + | + | + | Neisseria subflava biovar perflava |
| Weak(2+) positive | + | – | – | + | + | + | + | Neisseria sicca |
| Weak(2+) positive | + | + | – | + | + | + | + | Neisseria mucosa |
| Weak(2+) positive | + | – | – | – | – | – | – | Neisseria flavescens |
+* most strains positive;
+# most strains negative;
References:
1-Workowski, K and Balon G . Sexually Transmitted Diseases Treatment Guidelines
CDC MMW R 64 (RR3): 1-137 (on-line information Available online at http://www.cdc.gov/mmwr/preview/mmwrhtml/rr6403a 1.html Accessed March 2016
2-Detailed STD facts-Gonorrhea
www.cdc.gov 26 september 2017
3-Quillin, Sarah jane, Seifert H steven
Neisseria gonorrhoeae host adaptation and pathogenesis
Nature Reviews Microbiology 16(4): 226-290 12 feb 2018
4-Debrah A.williamson, Christopher K. fairley, Benjamin, P. Howde Trends and Risk factors for Antimicrobial-Resistant Neisseria gonorrhoeae Melbourne, Australia 2007 to 2018
American Society for Microbiology.
aac.dsm.org/content/63/10/21221-19
5-British Association for sexual Health and HIV 2019
National guideline for the Management of infection with Neisseria gonorrhoeae 2019
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام