بیومارکرها در مری بارت
دکتر بهناز بهفر
متخصص آناتومیکال و کلینیکال پاتولوژی
چکیده:
مری بارت (BE) مهمترین عامل خطر برای آدنوکارسینوم مری (EAC) است و میزان وقوع آن و سرطان مرتبط با آن در حال افزایش است. شواهد حاکی از آن است که روشهای غربالگری و نظارت فعلی در این مورد ناکافی هستند و لذا نیاز به روشهای مؤثرتر و مقرونبهصرفهتر وجود دارد. با شناخت بهتر سرطان و بهویژه آدنوکارسینوم مری، بیومارکرهای ژنتیکی متعددی شناسایی شدهاند که میتوانند به تشخیص بهتر و طبقهبندی ریسک بیماران کمک کنند. در این مقاله شواهد موجود درخصوص بیومارکرهای BE را بررسی نموده و به برخی از موانع موجود بر سر راه استفاده بالینی آنها اشاره میکنیم.
مقدمه:
مری بارت (BE) مهمترین فاکتور خطر ابتلا به آدنوکارسینوم مری (EAC) است. گرچه اکثریت این بیماران به آدنوکارسینوم مبتلا نمیشوند، ولی در مورد آن عده که مبتلا میگردند، چنانچه تشخیص زودهنگام بهعمل نیاید عواقب وخیمی خواهد داشت. برای شناسایی هرچه زودتر تغییرات پیشسرطانی استراتژی غربالگری و نظارت آندوسکوپی در کشورهای غربی اتخاذ شده است؛ اما این رویکرد میتواند منجر به انجام تعداد زیادی عملیات آندوسکوپی گردد که هم به لحاظ هزینه و هم تحمل بیمار مشکلآفرین خواهد بود. اینکه کدام بیمار به نظارت آندوسکوپی نیازمند است و برای کدام بیمار این اقدام ضرورتی ندارد، هسته مرکزی رویکردی است که بسیاری از تحقیقات جدید بر روی آن تمرکز کردهاند. کشف بیومارکرهای جدید برای EAC به طبقهبندی بهتر ریسک بیماران کمک میکند. مطالعات بیشتر درخصوص ارزیابی بهتر بیماران در معرض خطر در حال انجام است و همراه با روشهای جدید نمونهبرداری از سلولها، استفاده از بیومارکرهای مولکولی نقش مهمی را در برنامههای نظارتی بیماران BE ایفا خواهد کرد. در این مقاله شواهد موجود در مورد بیومارکرهای BE را بررسی نموده و مشکلاتی که بر سر راه ورود آنها به کاربرد بالینی وجود دارد را بهطور خلاصه متذکر خواهیم شد.
غربالگری و نظارت بر BE در حال حاضر
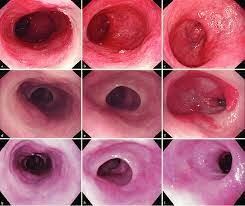
متاپلازی اپیتلیوم سنگفرشی مطبق نرمال مری به اپیتلیوم استوانهای را در قسمت انتهایی مری تحت عنوان مری بارت BE تعریف میکنند. این تغییر پاتولوژیک احتمالاً بهواسطه بیماری رفلاکس معده- مری GERD مزمن ایجاد میشود، اما عوامل خطر متعددی در ایجاد آن نقش دارند. از سال 1990 شیوع BE و سرطان مرتبط با آن در کشورهای غربی افزایش یافته است (1). تخمین زده میشود که BE بین یک تا شش درصد جمعیت عمومی را مبتلا میکند (4-2). در صورتی که EAC در مراحل اولیه تشخیص داده نشود، میزان مرگ ناشی از آن در طی 5 سال بالاتر از 80% است؛ اما روند تبدیل BE به سرطان اجتنابناپذیر نیست. درواقع نرخ تبدیل BE به EAC سالانه حدود 33 صدم درصد است که نشان میدهد بخش عمدهای از کسانی که BE دارند به EAC مبتلا نخواهند شد (5). در بدترین حالت BE بهطور مرحلهای به دیسپلازی خفیف low grade و بعد دیسپلازی شدید high grade و نهایتاً آدنوکارسینوم تبدیل میشود. در بهترین حالت هم ممکن است BE به همان شکل نهفته و بدون علامت تا پایان عمر باقی بماند. تشخیص اینکه هر بیمار ممکن است به کدام گروه تعلق داشته باشد گام مهمی بهسوی استراتژی نظارتی مؤثرتر خواهد بود.
در حال حاضر در انگلستان و آمریکا فقط برای بیمارانی که علائم GERD مزمن و ریسکفاکتورهای خاص دارند غربالگری BE انجام میشود. تشخیص BE در طی برنامه غربالگری یا بهطور تصادفی با مشاهده اپیتلیوم استوانهای بر اساس شاخصههای Prague و آنالیز هیستوپاتولوژیک انجام میشود. استراتژی درمانی یا نظارتی در مبتلایان BE به اندازه منطقه بارت و خصوصیات هیستوپاتولوژیک آن بستگی دارد. ویژگیهای مهم هیستوپاتولوژیک شامل درجه دیسپلازی و حضور متاپلازی رودهای است که در حال حاضر در انگلیس برخلاف آمریکا پیشنیاز تشخیص نیست، گرچه متاپلازی رودهای میتواند به افزایش خطر تبدیل به سرطان دلالت کند.
همانگونه که قبلاً ذکر شد، تبدیل BE به بدخیمی نسبتاً پایین است، بهویژه در BE غیردیسپلاستیک که نرخ تبدیل سالیانه بین دوازده صدم درصد تا 16 صدم درصد است (6). با توجه به فاکتورهای پیشگفت، تکرار آندوسکوپی در فواصل بین 2 تا 5 سال انجام میشود ولی با توجه به نرخ پایین تبدیل BE به سرطان، نحوه نظارت فعلی زیر سؤال میرود، اگرچه برخی مطالعات حاکی از شواهد مثبت این راه نظارت بر بقای بیمار هستند (7)، برخی مطالعات نیاز به این گونه نظارت را زیر سؤال میبرند (8) و برخی نتیجهگیری میکنند که رویکرد فعلی برای شناسایی زودهنگام EAC اثر اندکی بر میزان مرگ بیماران دارد (9)، لذا مطالعات جهت اتخاذ استراتژی مؤثرتر نظارت در حال انجام است و بیومارکرهای جدید BE در این راستا میتواند در برنامههای روزآمد غربالگری نقش داشته باشند.
بیومارکرهای پیشنهادی برای BE
در طی دو سه دهه گذشته دانش ما از سرطان و نحوه ایجاد آن پیشرفت قابلملاحظهای داشته است. تکثیر سلولهای سرطانی و فرار آنها از انهدام، بهواسطه یک مزیت رقابتی است که معمولاً توسط موتاسیون ژنتیکی بدست میآورند.
بافتهای پیشسرطانی نظیر BE محصول این تغییرات ژنتیکی بوده و سلولهای تومورال میتوانند از آن نشأت بگیرند. سلولهای اپیتلیال بهطور تدریجی از طریق متاپلازی و دیسپلازی به EAC تبدیل میشوند (10). این پیشرفت خطی به سمت سرطان در سرطانهای دیگری همچون کولون، سینه، پروستات، سرویکس و مثانه نیز معمول است. سرعت ایجاد سلول سرطانی از ضایعات اولیه متغیر است و بین سالها تا دههها طول میکشد، لذا شناسایی ضایعات پیشآهنگ فرصت ایدهآلی را جهت تشخیص و درمان بیماری قبل از گسترش سرطان فراهم میسازد. این مطلب اساس تعدادی از برنامههای غربالگری موفق همچون روده و معده است، ولی همانطور که قبلاً ذکر شد برنامههای فعلی مراقبت از BE و EAC اثر اندکی بر روی مرگومیر دارند (9). برای توسعه برنامههای مراقبتی بهتر درخصوص سرطان و بهویژه EAC، تمایل روزافزونی برای درک تغییرات سرطانی سلولها در سطح مولکولی بچشم میخورد. درک و شناسایی این تغییرات میتواند به استراتژیهای متمرکزتری در پیشگیری سرطان منجر شده و مشکلات تشخیص بیش از حد را در غربالگری انبوه جمعیت کاهش دهد، بنابراین بیومارکرها در BE دو نقش اساسی دارند؛ نخست کمک به تشخیص و کاهش بیمارانی که نیاز به آندوسکوپی خواهند داشت و دوم پایش بیماران و برآورد دقیقتر خطر ابتلا به EAC.
بیومارکرهای غربالگری
تشخیص BE بهوسیله آندوسکوپی و بررسی هیستوپاتولوژیک سلولهای اپیتلیال مری انجام میشود؛ اما تکنولوژیهای پیشرفته همچون پلتفرمهای مبتنی بر آنالیز بیان ژن، اپیژنیک، پروتئومیکس و (SNP) Single Nucleotide Polymorphism امکانات بیشتری جهت کشف بیومارکرها در BE و EAC فراهم کردهاند (11). بیومارکری که بیش از همه برای غربالگری BE مورد مطالعه واقع شــــــده Trefoil factor 3 (TFF3) است. کارآزماییهایی برای ارزیابی TFF3بهعنوان بیومارکی که از طریق ایمونوهیستوشیمی قابل شناسایی هست، انجام شده است که روش نمونهبرداری استفاده از یک وسیله کمتهاجمی به نام Cytosponge بوده است (14-12). این وسیله توسط بیمار بلعیده میشود و سلولها را در قسمت انتهایی مری به خود جذب میکند و سپس توسط رشتهای که به آن وصل است بالا کشیده میشود. در مجموع این وسیله کاربری ساده داشته و توسط بیمار هم بهخوبی تحمل میشود و میتوان آن را در سطح وسیع بکار گرفت. در سلولهای بدستآمده از مری وجود TFF3 بهعنوان بیومارکر مورد بررسی قرار میگیرد و لذا حضور یا عدم حضور مری بارت مشخص میشود (13).
مطالعات انجام شده تاکنون مقدار حساسیت این روش را حدود 80% نشان میدهند که در صورتی که محدوده و محیط مری بارت بیش از 3 سانتیمتر باشد، مقدار حساسیت تا 87% افزایش مییابد. اگر بیمار دو بار این وسیله را ببلعد میزان حساسیت به حدود 90% میرسد. امکان استفاده از همین تکنولوژی برای غربال سایر بیومارکرهای بالقوه BEنیز وجود دارد. در مطالعهای که در سال 2017 توسط Chettouh و همکارانش انجام شد، 18 ژن که در مری بارت دچار موتاسیون میشوند مورد شناسایی قرار گرفت (14). این روش جدید به همراه تکنیکهای ژنتیکی بهنظر میرسد که بتواند جانشین ارزشمندی بهجای روش متداول آندوسکوپی در بررسی مری بارت باشند. این رویکرد را میتوان در مورد طیف وسیعتری از بیماران که دچار رفلاکس معده- مری هستند و امکان پیشرفت به سوی مری بارت و آدنوکارسینوم در آنها وجود دارد، بهکار گرفت (15).
بیومارکرهای نظارتی و پایش
بیومارکرهای بالینی وسیله بینهایت مفیدی در طبقهبندی و افتراق بافتهای مختلف هستند، بهویژه آنکه جنبه عینی داند و دچار خطاهای تفسیری نمیشوند و لذا پایه مستحکمتری برای تصمیمگیری تشخیصی فراهم میسازند. همانگونه که قبلاً گفته شد، تشخیص دیسپلازی در سلولهای اپیتلیال مری یک امر سوبژکتیو است. یک بیومارکر بهتر میتواند گسترش ابتدایی فرآیند سرطان را شناسایی نموده و سنجش عینیتری از روند پیشرفت بیماری را ارائه دهد؛ اما علیرغم شناسایی هزاران بیومارکر در سرطانهای مختلف، انتقال این اکتشافات به حیطه عمل بالینی دشوار است. مطالعات جاری پیشنهاد میکنند که تغییرات ژنتیکی وسیعی در بیشتر سرطانهای پیشرفته رخ میدهد (16).
بافتهای مری بارت و آدنوکارسینوم مری هم از این قاعده مستثنی نیستند و دادههای حاصـــــــل از high density SNP arrays و توالییابی اگزون حاکی از موتاسیونهای متعدد در ژنهای مختلف است (18،17). ژنهای سلولهای اپیتلیال در مری بارت ممکن است با مکانیسمهای مختلف تخریب شده یا دچار موتاسیون شوند. غیرطبیعی شدن محتوای DNA و از دست دادن هتروزیگوزیتی (LOH) مانند آنوپلوئیدی و تتراپلوئیدی از ویژگیهای شناختهشده بیولوژی سلولهای سرطانی هستند که در BE و EAC هم رخ میدهند و منجر به موتاسیونهایی میشوند که ژن سرکوبکننده تومور P53 را غیرفعال میکنند (19).
موتاسیونهایر یک ژن سرکوبکننده تومور دیگر بنام P16 نیز در مراحل اولیه تغییرات بارت دیده میشود و منجر به تکثیر کلونال میگردد (20)، اما از آنجا که P16 در مراحل اولیه گسترش سرطان ظاهر میگردد و در مراحل مختلف دیسپلازی دیده نمیشود، لذا بنظر نمیرسد که بتواند بیومارکر خوبی برای مری بارت باشد (11، 21). بیومارکرهای جالب دیگر برای مری بارتcyclin A and D هستند که ظهور آنها نشانگر غیرفعال شدن P105-Rb است. بهویژه در یک مطالعه نشان داده شده که حضور cyclin D در بیمار مبتلا به بارت نشانگر افزایش خطر پیشرفت به سوی EAC است، اما این یافته در مطالعه دیگری که تعداد بیشتری از افراد را شامل میشد، تأیید نگردید. (22). نکته حائز اهمیت این است که مقدار قابلتوجهی از این موتاسیونها در مرز بافت BE و EAC کشف شدهاند (در همان بیمار) و لذا میتوان نتیجه گرفت تغییرات ژنتیکی در افراد در معرض خطر را میتوان قبل از ایجاد بدخیمی کشف کرد. درعینحال موتاسیونهای زیادی هم وجود دارد که فارغ از مرحله بیماری ایجاد میشوند. ارزیابی بیشتر تنوع ژنتیکی در سال 2016 توسط Martinez و همکارانش انجام شد که طی آن در بیماران با مری بارت غیردیسپلاستیک سیر تکاملی کلونال مورد بررسی قرار گرفت (23). با استفاده از تکنیک FISH مشخص شد که موزائیسم کلونال بهتنهایی یک پیشگوی قوی برای ایجاد ســــــرطان است، بهویــــــــــــــــــــــــــــــــــــــــــــــــــژه سنجش single-probe diversity (MYC and CEP7) بهترین پیشبینیکننده پیشرفت سرطان است و ناهنجاری P16 از این جهت ارزش کمتری را دارد.
این مطالعه با مطالعه قبلی همخوانی دارد که طی آن مشخص شده بود که واگرایی ژنتیکی در گروهی از بیماران که بیماری آنها غیرپیشرونده میباشد باثبات است درحالیکه در گروه پیشرونده 48-24 ماه قبل از پیشروی بیماری بیثباتی قابلتوجهی در تنوع ژنتیکی فرد دیده میشود (24). همچنین در مطالعه قبلی که با استفاده از تکنیک FISH انجام شده بود، مشخص شد که مشاهده آنوپلوئیدی کروموزومهای 7 و 17 که شامل p53 هم میشود با پیشرفت بیماری از IM به LGD و از LGD به HGD تناسب دارد (25، 26).
یک بررسی مهم که در سال 2014 توسط Weaver و همکارانش انجام شد حاکی از آن است که موتاسیونهای مشترکی در نمونههای BE، HGD و EAC مشاهده میشود (27). گرچه همین موتاسیونها در نمونههای غیردیسپلاستیک هم دیده میشود و اهمیت آن در ایجاد آدنوکارسینوم مری نامشخص است.
در همان مطالعه موتاسیونهای دیگری از جمله در ABCB1، CNTNAP5، MYO18B، TP53 و SMAD4 هم مشاهده شد که تنها دو مورد اخیر خطر ابتلا به سرطان را ایجاد میکنند. گرچه حضور SMAD4 بهروشنی خطر سرطان را نشان میدهد، اما تنها در 13% بافت EAC مشاهده میگردد. مسئله بسیار مهم افتراق HGD از EAC است چرا که سرنوشت اقدام درمانی را مشخص میکند. در این مطالعه موتاسیون TP53 در HGD (72%) و هم EAC (69%) دیده شد، ولی تنها در یک مورد نمونه غیردیسپلاستیک (2/5%) یافت گردید. مطالعات قبلی هم نشان داده بودند که خطر پیشرفت به سمت EAC در نمونههایی که اختلال در ژن TP53وجود دارد بهطور قابلملاحظهای افزایش مییابد. در کنار سایر موتاسیونهای LOH بر روی کروموزوم r9p، پنلی که شامل p53 هم باشد بهترین پیشگوی تبدیل BE به EAC تا به امروز خواهد بود (11).
پنلهای بیومارکر که موتاسیونهای متعددی را شامل شوند میتوانند ارزیابی جامعتری از طبقهبندی ریسک ارائه دهند.
آینده بیومارکرها: ورود به حوزه کاربرد بالینی
برای آنکه برنامههای نظارت و غربالگری مری بارت بهتر شوند میبایست هدفمندی آنها افزایش یابد. بیومارکرها پتانسیل تأمین این هدف را دارند اما با توجه به اینکه ناهمگونی آنها در پروفایل ژنتیکی بیمارانی که به سمت سرطان پیش میروند بسیار است، لذا تعیین بیماران کمریسک استراتژی دستیافتنیتری محسوب میگردد (28، 29). شناسایی بیماران کم ریسک سبب میشود که اقدامات تشخیصی و درمانی به سمت بیماران پرخطر متمرکز گردد و بقیه از آندوسکوپیهای مکرر غیرضروری نجات یابند. با توجه به اینکه نتایج برخی مطالعات حاکی از نتایج مأیوسکننده غربالگری و نظارت در بیماران BE و EAC است، لذا استفاده از تکنولوژیهای جدید نظیر Cytospone را میتوان مدنظر قرار داد. همانطور که قبلاً گفته شد با استفاده از این روش میتوان افراد بسیاری را تحت پوشش قرار داد که در غیر این صورت حتماً نادیده گرفته خواهند شد.
با استفاده از Cytosponge میتوان به غربالگری BE پرداخت، ضمن آنکه با بررسی بیومارکرها بهطور همزمان میتوان به تخمین خطر پیشرفت بهسوی سرطان اقدام کرد. درخصوص تأثیر آن بر درمان میتوان گفت که غربالگری مستمر و سنجش بیومارکرها شاید بتوانند اساس بیولوژیک عود BEو EAC را پس از درمان مشخص کنند که بر آن مبنا شاید بتوان موتاسیونهای خاصی را هدف درمان قرار داد. البته مطالعات بسیاری جهت مشخص ساختن اهداف احتمالی درمان ضرورت دارد (29).
نتیجه
اگر پزشکی بتواند احتمال پیشرفت بیماری به سمت سرطان را بر اساس ویژگیهای مولکولی بافت دریابد درخصوص نوع و زمان درمان راحتتر میتواند تصمیم بگیرد. از طرف دیگر میتوان مشخص کرد که چه کسانی اصلاً نیاز به درمان ندارند و لذا نظارت بر بیماری را شخصیسازی نمود. افزایش موتاسیونهای ژنتیکی بهطور پلکانی ویژگی همه سرطانها است؛ اما تعداد و تنوع آن در BEو EAC بیشتر است.
دادههای امیدوارکنندهای حاکی از توصیه استفاده از پانلهای بیومارکری برای مری بارت هستند. تمرکز به اهداف ویژه در غربالگری مری بارت، انجام غربالگری را مؤثرتر، ارزانتر و غیرتهاجمیتر خواهد کرد. ما تا حدود زیادی از درک کامل عوامل تغییرات انکوژنیک در EAC به دور هستیم و لذا ارائه آزمایشهای روتین در این زمینه نیازمند حل مشکلات مالی و پشتیبانی است؛ اما در پرتو یافتههای اخیر میتوان امیدوار بود که بیومارکرهایی شناسایی شوند که به کمک آنها بتوانیم پیشرفتهای اساسی در برنامههای غربالگری و نظارتی فعلی داشته باشیم.
این مقاله ترجمهای است از:
Biomarkers in Barrett’s oesophagus
J Lab Precis Med 2018;3:90
منابع:
- Kadri SR, Lao-Sirieix P, O’Donovan M, et al. Acceptability and accuracy of a non-endoscopic screening test for Barrett’s oesophagus in primary care: cohort study. BMJ 2010;10:341:c4372.
- Ronkainen J, Aro P, Storskrubb T, et al. Prevalence of Barrett’s esophagus in the general population: an endoscopic study. Gastroenterology 2005;129:1825-31.
- Zagari RM, Fuccio L, Wallander MA, et al. Gastrooesophageal reflux symptoms, oesophagitis and Barrett’s oesophagus in the general population: Loiano- Monghidoro study. Gut 2008;57:1354-9.
- Hayeck TJ, Kong CY, Spechler SJ, et al. The prevalence of Barrett’s esophagus in the US: estimates from a simulation model confirmed by SEER data. Dis Esophagus 2010;23:451-7.
- Desai TK, Krishnan K, Samala N, et al. The incidence of oesophageal adenocarcinoma in non-dysplastic Barrett’s oesophagus: a meta-analysis. Gut 2012;61:970-6.
- Hvid-Jensen F, Pedersen L, Drewes AM, et al. Incidence of adenocarcinoma among patients with Barrett’s esophagus. N Engl J Med 2011; 365:1375-83.
- Rubenstein JH, Sonnenberg A, Davis J, et al. Effect of a prior endoscopy on outcomes of esophageal adenocarcinoma among United States veterans. Gastrointest Endosc 2008;68:849-55.
- Corley DA, Mehtani K, Quesenberry C, et al. Impact of endoscopic surveillance on mortality from Barrett’s esophagus–associated esophageal adenocarcinomas. Gastroenterology 2013;145:312-9.e1.
- Reid BJ. Genomics, endoscopy, and control of gastroesophageal cancers: a perspective. Cell Mol Gastroenterol Hepatol 2017;3:359-66.
- Zeki S, Fitzgerald RC. Targeting care in Barrett’s oesophagus. Clin Med (Lond) 2014;14:s78-83.
- Ong CA, Lao-Sirieix P, Fitzgerald RC. Biomarkers in Barrett’s esophagus and esophageal adenocarcinoma: predictors of progression and prognosis. World J Gastroenterol 2010;16:5669-81.
- Fitzgerald RC, Reid BJ. Early diagnosis of gastroesophageal cancers and the cytosponge: a work in progress. Cell Mol Gastroenterol Hepatol 2017;4:447.
- Ross-Innes CS, Debiram-Beecham I, O’Donovan M, et al. Evaluation of a minimally invasive cell sampling device coupled with assessment of trefoil factor 3 expression for diagnosing Barrett’s esophagus: a multi-center case– control study. PLoS Med 2015;12:e1001780.
- Chettouh H, Mowforth O, Galeano-Dalmau N, et al. Methylation panel is a diagnostic biomarker for Barrett’s oesophagus in endoscopic biopsies and non-endoscopic cytology specimens. Gut 2018;67:1942-9.
- Riley T, Ang Y. Methylation panel as a diagnostic biomarker in Barrett’s oesophagus: a comprehensive biomarker panel in a population-based screening programme? J Lab Precis Med 2018;3:37.
- Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing. N Engl J Med 2012;366:883-92.
- Dulak AM, Schumacher S, van Lieshout J, et al. Gastrointestinal adenocarcinomas of the esophagus, stomach and colon exhibit distinct patterns of genome instability and oncogenesis. Cancer Res 2012;72:4383-93.
- Dulak AM, Stojanov P, Peng S, et al. Exome and wholegenome sequencing of esophageal adenocarcinoma identifies recurrent driver events and mutational
complexity. Nat Genet 2013;45:478-86.
- Reid BJ, Levine DS, Longton G, et al. Predictors of progression to cancer in Barrett’s esophagus: baseline histology and flow cytometry identify low-and high-risk patient subsets. Am J Gastroenterol 2000;95:1669-76.
- Galipeau PC, Cowan DS, Sanchez CA, et al. 17p (p53) allelic losses, 4N (G2/tetraploid) populations, and progression to aneuploidy in Barrett’s esophagus. Proc Natl Acad Sci 1996;93:7081-4.
- Wong DJ, Paulson TG, Prevo LJ, et al. p16INK4a lesions are common, early abnormalities that undergo clonal expansion in Barrett’s metaplastic epithelium. Cancer Res 2001;61:8284-9.
- Murray L, Sedo A, Scott M, et al. TP53 and progression from Barrett’s metaplasia to oesophageal adenocarcinoma in a UK population cohort. Gut 2006;55:1390-7.
- Martinez P, Timmer MR, Lau CT, et al. Dynamic clonal equilibrium and predetermined cancer risk in Barrett’s oesophagus. Nat Commun 2016;7:12158.
- Li X, Galipeau PC, Paulson TG, et al. Temporal and spatial evolution of somatic chromosomal alterations: a case-cohort study of Barrett’s esophagus. Cancer Prev Res (Phila) 2014;7:114-27.
- Timmer MR, Sun G, Gorospe EC, et al. Predictive biomarkers for Barrett’s esophagus: so near and yet so far. Dis Esophagus 2013;26:574-81.
- Pacha A, Rygiel AM, Westra W, et al. Su1181 A diagnostic DNA fish biomarker assay identifies HGD or EAC in Barrett esophagus. Gastroenterol 2012;142:S-445.
- Weaver JM, Ross-Innes CS, Shannon N, et al. Ordering of mutations in preinvasive disease stages of esophageal carcinogenesis. Nat Genet 2014;46:837-43.
- Ross-Innes CS, Chettouh H, Achilleos A, et al. Risk stratification of Barrett’s oesophagus using a nonendoscopic sampling method coupled with a biomarker
panel: a cohort study. Lancet Gastroenterol Hepatol 2017;2:23-31.
- Secrier M, Li X, De Silva N, et al. Mutational signatures in esophageal adenocarcinoma define etiologically distinct subgroups with therapeutic relevance. Nat Genet 2016;48:1131-41.
مری بارت و ضرورت ارتقاء تستهای تشخیصی
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام