مری بارت و ضرورت ارتقاء تستهای تشخیصی
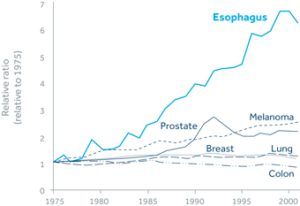
بر اساس گزارش مؤسسه ملی سرطان، افزایش شیوع سرطان مری (EC) از همه سرطانها در آمریکا بیشتر است (شکل 1).
شیوع این سرطان که زمانی نادر بود از سال 1970 تاکنون بیش از 500% افزایش یافته است.(1) هرساله در امریکا 17990 مورد جدید از این بیماری گزارش میشود. سرطان مری بسیار کشنده بوده و طول عمر 5 ساله آن 17% است.(2) مهمترین علت افزایش سرطان مری در آمریکا و کشورهای غربی افزایش بیماری رفلاکس (GERD) و مری بارت (BE) در میان مردم است.
تصویر 1- رشد سرطان مری در سالهای 1975 تا 2000 در آمریکا
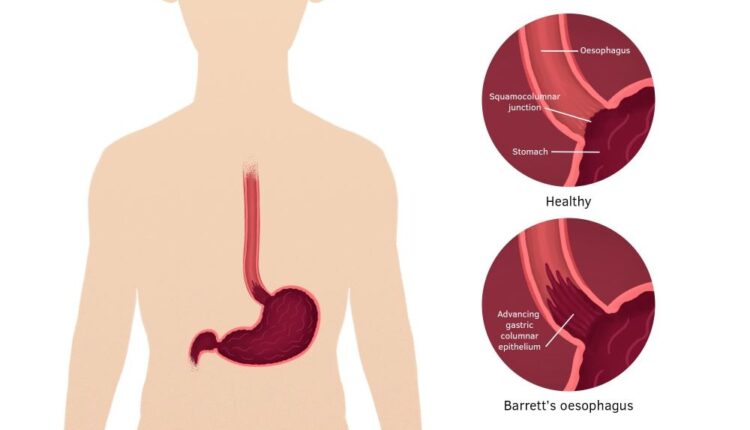
طبق گزارش انجمن آندوسکوپی گوارشی آمریکا، GERD که در نتیجه ورود اسید معده به داخل مری ایجاد میشود، بیش از 30 میلیون نفر از مردم آمریکا را مبتلا کرده است. در مواجهه مزمن و طولانی جدار مری با اسید، سلولهای پوششی مری تغییر میکنند تا بتوانند در برابر اسید مقاومت کنند. در این پروسه سلولهای سنگفرشی مطبق جدار مری به سلولهای استوانهای تبدیل میشوند و نیز در بین آنها سلولهای گابلت ظاهر میگردند. وجود سلولهای گابلت در بین اپیتلیوم بعنوان مشخصه مری بارت در نظر گرفته میشود (شکل 2).
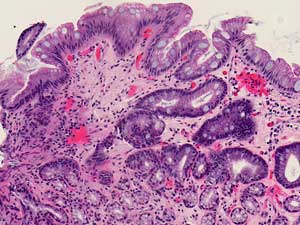
تصویر 2- رنگآمیزی هماتوکلسین- ائوزین از بیوپسی مری بارت که سلولهای استوانهای را به همراه سلولهای گابلت نشان میدهد
تعداد مبتلایان به مری بارت در آمریکا حدود 17 میلیون نفر برآورد میشود،(3) گرچه تعداد مواردی که به طور بالینی تأیید شدهاند حدود 3 تا 4 میلیون نفر است.(4) مری بارت یک وضعیت پیشسرطانی تلقی شده و عامل خطر جهت ابتلا به سرطان مری میباشد، گرچه در عمل فقط درصد اندکی از مبتلایان به مری بارت به سرطان مری مبتلا میشوند. شاید بتوان تغییرات بارت را عمل محافظت از مری تلقی کرد.
درجهبندی ریسک، راههای تشخیصی فعلی
مشکلی که متخصصین گوارش با آن مواجه هستند این است که بتوانند مشخص کنند کدام گروه از مبتلایان به بارت در معرض ریسک ابتلا به سرطان مری بوده و کدام گروه به سرطان مبتلا نمیشوند. این فقدان قطعیت در درجهبندی ریسک سبب میشود که پایش اندوسکوپیک بیماران کمریسک هم مانند بیماران در معرض خطر باشد درحالیکه گروه کمخطر نیاز به پایش مکرر ندارند. از طرف دیگر بسیاری از مبتلایان به سرطان مری قبلاً جهت GERD یا بررسی مری بارت آندوسکوپی نشدهاند؛ به بیان دیگر اگر ملاک موفقیت پایش کاهش تعداد سرطان مری باشد، برنامه فعلی پایش موفق نبوده است.
اقدام تشخیصی جهت مبتلایان به GERD و بارت، آندوسکوپی قسمت فوقانی دستگاه گوارش میباشد.
در طی این فرآیند متخصص گوارش جداره مری را با آندوسکوپ بررسی کرده و از نقاط مشکوک بیوپسی تهیه میکند. بیوپسی تهیه شده توسط پاتولوژیست با یک میکروسکوپ نوری دیده میشود. با دیدن سلولهای گابلت در بافت مری، تشخیص بارت محرز میگردد. این تغییرات میتواند همراه با دیسپلازی یا بدون آن باشد. مراحل ایجاد سرطان مری به ترتیب از متاپلازی خوشخیم (BM) شروع شده، به تدریج به دیسپلازی درجه پایین (LGD) و سپس دیسپلازی درجه بالای (HGD) و نهایتاً آدنوکارسینوم مری (EC) ختم میشود. گرچه احتمالاً تبدیل متاپلازی خوشخیم به ادنوکارسینوم کم است اما از آنجاییکه درمان ادنوکارسینوم محدودیت دارد لذا تشخیص زودهنگام بسیار مهم است. راهکار فعلی انجمن گوارش آمریکا این است که برحسب تشخیص اولیه پاتولوژیست، باید در فواصل سه ماه تا 5 سال آندوسکوپی همراه با بیوپسی انجام شود.(5)
اگر در بیوپسی EC یا HGD دیده شود درمانهایی همچون radio frequency ablation ,cryoablation برش مخاط مری یا جراحی ازوفاگوستومی انجام میشود.(5و6)
درمانهای ablative، سلولهای جدار داخلی مری که دارای سلولهای بدخیم است را از بین میبرد و لذا امکان رشد سلولهای سالم فراهم میشود.
بهترین روشی که متداول است RFA میباشد که توسط انجمن گوارش آمریکا جهت درمان HGD توصیه شده است. این روش برای درمان HGD مؤثر و کمخطر است. از طرفی استفاده از RFA برای درمان (LGD) هم در حال مقبولیت یافتن است.
یکی از چالشهای درمان LGD با RFA این است که در روش استاندارد پاتولوژی قطعیت چندانی برای تشخیص LGD وجود ندارد. وقتی لامهای LGD توسط پاتولوژیستهای متخصص در دستگاه گوارش بررسی میشود بسیاری از آنها غیردیسپلاستیک تشخیص داده میشوند که نیازی به درمان با RFA ندارند.
تصمیمگیری جهت بیمار در حال حاضر بر اساس لام پاتولوژی انجام میشود که این روش دارای قطعیت نیست و تا حدودی بسته به نظر شخص بررسی کننده دارد و لذا نمیتوان پیشبینی کرد کدام بیمار به سرطان مبتلا خواهد شد.(7و8)
مشکل دیگری که بررسی پاتولوژی دارد مواردی است که نمونه بعنوان غیرقابل تشخیص و ناکافی قلمداد میشود که نیاز به آندوسکوپی و بیوپسی مجدد پیش میآید.
در برخی موارد مهم جهت تشخیص P53 از ایمونوهیستوشیمی استفاده میشود، معالوصف p53 تنها در زیرمجموعهای از بیماران که به سمت HGD/EC پیش میروند زیاد میشود و لذا هیچ بیومارکری وجود ندارد که بتواند مری بارت را بدرستی تشخیص دهد و یا ریسک را برآورد نماید، علاوه بر این روشهای هیستوپاتولوژی استاندارد، بیوپسی بافت را بعنوان یک سیستم تعامل سلولها و بافت نمیبیند لذا اطلاعات زیادی را از دست میدهد. مجموعه این عوامل سبب میشود تا بیماران کمریسک در گروه پرریسک و برعکس طبقهبندی شوند.
راه جدید ” بیولوژی سیستم بافتی”
راهکار جدید ارزیابی بیوپسی از بیماران بارت باید بتواند اطلاعات سلولی و مولکولی بیشتری از بافت ارائه نموده و اطلاعات عملی به پزشک بدهد تا در مورد بیمار اقدام مقتضی صورت گیرد.
این استراتژی جدید بیوپسی را به عنوان یک مجموعه از انواع سلولهای واکنشگر شامل سلولهای اپیتلیال پیشسرطانی، سلولهای بنیانی بالقوه سرطانزا، سلولهای ایمنی نظیر ماکروفاژها و سلولهای استرومال مثل فیبروبلاستها و سلولهای اندوتلیال میبیند (شکل 3).9
تصویر 3- روش بیولوژی سیستمهای بافتی در آزمایش آناتومیک پاتولوژی و مری بارت
اساس کار تصویربرداری فلورانس چندکاناله از اسلاید، سنجش کمی بیومارکرهای کلیدی سیستم بافتی در کنار بررسی مرفولوژی بافت و همچنین استخراج اطلاعات از بافت بر اساس معیارهای مشخص میباشد.
بیومارکرهای متعدد اپیتلیال، ایمنی و استرومال با ایمونوفلورسانس نشاندار شده و روی یک اسلاید واحد از بیوپسی مری بارت به نمایش درمیآیند (شکل 3A). برنامه کامپیوتری، بافت را به سلولها، اجزای داخل سلولی و اجزای بافتی مثل غدد و استروما تقسیم میکند (شکل 3B). سنجش بیومارکرها و مرفولوژی صدها سلول و سنجش روابط بیولوژیک پیچیده آنها، سلولهای پرریسک را در داخل بافت مشخص مینماید (شکل 3C). این راهکار میتواند برای پیشبینی ایجاد سرطان در مبتلایان به مری بارت به کار رود. در این راهکار ساختمان بافت (مرفولوژی) بستر مناسبی برای ظهور بیومارکرهای فنوتیپی فراهم میسازد. ارزیابی همزمان بیومارکرهای سلولهای متعدد اپیتلیال، ایمنی و آسترومال در یک بیوپسی شانس ایجاد وسائل تشخیصی بهتر را برای پزشک و بیمار مبتلا به بارت افزایش میدهد. به کارگیری کامپیوتر و هوش مصنوعی در روی نمونه بافتی، استخراج هزاران مورد اطلاعاتی را فراهم میسازد که با روش استاندارد و مطالعه چشمی قطعاً امکانپذیر نیست. این اطلاعات سپس به کمک شاخصهایی قابل تبدیل به تستهای ارزشمند تشخیصی و پروگنوستیک میباشند. این راهکار جدید منجر به بهبود تشخیص بارت شده و نیز میتواند جهت پایش برگشت بارت پس از درمانهای ablation به کار رود.
بهبود روشهای تشخیص منجر به بهتر شدن عاقبت بیمار و در نتیجه کاهش وقوع سرطان مری خواهد شد. همچنین ارزیابی بهتر ریسک موجب میشود که پایش غیرضروری برای بیماران کمریسک انجام نشود و بلکه بیماران پرخطر به اندازه کافی تحتنظر باشند و به سوی درمان هدایت شوند. این امر به نوبه خود پایش آندوسکوپیک را کارآتر ساخته و هزینهها را کاهش میدهد.
References:
- Pohl H, Welch, HG. The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence. J Natl Cancer Inst. 2005; 97(2):142-146
- ACS. Cancer Facts & Figures 2013. American Cancer Society 2013.
- Hayeck TJ, Kong C, Spechler S.J, Gazelle G S, Hur C. The prevalence of Barrett’s esophagus in the US: estimates from a simulation model confirmed by SEER data. Dis Esophagus. 2010;23(6):451-457
- Market assessment from Cernostics, Inc. Extrapolation of data from Geisinger Health System, Danville, PA, Electronic Health Record Data on patients with Barrett’s esophagus from 2003-2012.
- Spechler SJ, Sharma P, Souza R, Inadomi JM, Shaheen NJ. American Gastroenterological Association medical position statement on the management of Barrett’s esophagus. Gastroenterology .2011;140:1084-1091.
- DeVault KR, Castell DO. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. Am J Gastroenterol.2005;100:190-200.
- Reid BJ, Haggitt RC, Rubin CE, et al. Observer variation in the diagnosis of dysplasia in Barrett’s esophagus. Hum Pathol. 1988;19(2):166-178.
- Montgomery E, Bronner MP, Goldblum JR et al. Reproducibility of the diagnosis of dysplasia in Barrett esophagus: a reaffirmation. Hum Pathol. 2001;32(4):368-378.
- Gough A, Lezon T, Faeder J, et al. High content analysis and cellular and tissue systems biology: a bridge between cancer cell biology and tissue-based diagnostics. In The Molecular Basis of Cancer (ed. Mendelsohn, J. et al. Feb 19, 2014).
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام