استفاده از سفیدکنندهها (وایتکس) برای رسوب باکتریهای اسیدفست
دکتر حمید زارع
پیشزمینه: در کشورهای کمتر توسعهیافته کمبود منابع انسانی و اشکال در روشهای تشخیصی مشکل بزرگی بر سر راه تشخیص سل میباشد. گرچه روش اسمیر مستقیم قابل اتکا است اما حساسیت آن بسیار متغیر است. برای افزایش حساسیت روش مستقیم دیدن باکتری، محققین راههای مختلفی را امتحان کردهاند، از جمله این راهها تغلیظ باسیلهای اسیدفست بهوسیله سفیدکنندههای تجاری است.
این مطالعه به بررسی روشهای مختلف تشخیص مایکوباکتریوم توبرکولوز میپردازد.
روشها: از 340 مراجعهکننده در ابوجای نیجریه، سه نمونه خلط در دو روز پیاپی جمعآوری شد. آزمایش دید مستقیم بر روی تمام نمونهها انجام شد و سپس از هر بیمار یک نمونه بهطور راندم انتخاب شده و آزمایش تغلیظ با سفیدکننده و کشت در محیط L.J بعمل آمد.
نتایج: آزمایش مستقیم در 28/8% و آزمایش پس از تغلیظ در 30/3% موارد از نظر باسید اسیدفست مثبت بودند. در مقایسه با نتایج کشت موارد مثبت واقعی با روش مستقیم 26/5% و با روش تغلیظ 27/1% بود، گرچه میزان ویژگی بین این دو روش معنیدار نبود (P=0.548) ولی اختلاف در حساسیت معنی داشت (p=0.004).
نتیجه: بر اساس این مطالعه تغلیظ با سفیدکننده حساسیت آزمایش میکروسکوپی باسیل سل را افزایش میدهد ولی ویژگی تغییری نمیکند.
در تشخیص موارد جدید سل ریوی، هر اسمیر تغلیظ شده با سفیدکننده از نظر حساسیت سه برابر اسمیر مستقیم ارزش دارد و در ضمن خطر آلودگی پرسنل را از بین میبرد.
مقدمه
سل ریوی در کشورهای کمتر توسعهیافته بهویژه در افریقا بهواسطه گسترش سریع HIV ، افزایش یافته است. بیماری HIV با اختلال در سیستم ایمنی سلولی فرصت رشد را برای باسیل سل فراهم میکند. علاوه بر این HIV میتواند باعث شود که خلط مثبت بطور کاذب کاهش یابد.1 و 2 و 3
سل توسط هر یک از اعضای خانواده کمپلکس مایکوباکتریوم توبرکلوز (شامل مایکوباکتریوم توبرکلوز، مایکوباکتریوم بویس، مایکوباکتریوم آفریکنوم، مایکوباکتریوم کاپارا، مایکوباکتریوم میکروتی، مایکوباکتریوم کانتی و مایکوباکتریوم پینیدی) میتواند ایجاد شود. روشهای ناکارآمد و کمبود نیروی انسانی دو نقطه ضعف مهم کشورهای کمتر توسعهیافته در تشخیص سل میباشد. بیشترین روش مورداستفاده برای تشخیص سل اسمیر مستقیم است. این روش ساده و ارزان بوده و ویژگی بالایی برای باسیل سل دارد.
در 1995، سازمان بهداشت جهانی مقرر کرد تا سال 2005 حداقل 70% موارد اسمیر مثبت را شناســایی کند.5 متأسفانه این هدف محقق نگردید که بخشی از عدم توفیق به خاطر تشخیص ناصحیح بود.6
محققین میزان حساسیت اسمیر مستقیم را در بعضی موارد بین 20 تا 60 درصد و در مواردی تا 80% گزارش کردهاند.7 و 8 و 9 و 10 و 11 و 12 و 13 و 14 و 15
این یافتهها منجر به این شد که تکنیکهای جانشین برای بهبود حساسیت اسمیر مستقیم جستجو شود و لذا روشهای بهتری پیشنهاد گردد. یکی از این روشها هضم و تغلیظ خلط با استفاده از سفیدکنندههای خانگی (هیپوکلریت سدیم) بجای سود (هیدروکسید سدیم) است. این روش شفافیت اسید را افزایش داده و مشاهده باسیل را آسانتر میکند.16 برای دستیابی به این مزایا از سانتریفوژ و رسوب دادن خلط استفاده میشود. استفاده از سفیدکننده در رسوب باسیل سل توسط صاحبنظران مختلف جهت تشخیص باسیل سل در کشورهای کمتر توسعه یافته مطالعه شده است.6 و 17 و 18
در مطالعات بعملآمده هیچ مورد استفاده از محیط کشت L.J در نیجریه گزارش نشده است.19 و 20 در یک گزارش منتشرشده از نیجریه از سیستم BACTEC استفاده شده که در آن هم گونههای کمپلکس مایکوباکتریوم توبرکلوز قابل تفکیک نبوده است.21 علاوه بر این بیشتر تحقیقات منتشرشده به مقایسه روش سانتریفوژ کردن یا رسوب دادن با سفیدکننده و روش مستقیم پرداختهاند و به مقایسه با روش کشت کمتر پرداخته شده است.13 و 22 و 23 و 24 همچنین در مروری که اخیراً توسط Cattamanchi و همکارانش بعمل آمده است اعتبار این مطالعات به چالش کشیده شده است،18در نتیجه مطالعه فعلی به مقایسه نتایج حاصله از رسوب با سفیدکننده در کمتر از یک ساعت و روش اسمیر مستقیم و کشت پرداخته است. این مطالعه حساسیت، ویژگی، PPV و NPV روش رسوب با هیپوکلریت سدیم در مقایسه با روش اسمیر مستقیم و کشت بر روی محیط L.J را گزارش کرده است.
روشها
بیماریابی
340 بیمار از درمانگاههای دولتی به مرکز پزشکی زانکلی ارجاع شدند. مراجعین شامل 192 مرد و 148 زن در بازه سنی 10 تا 64 سال بودند که در فاصله نوامبر 2004 تا جولای 2005 پذیرش شدند. آن عده که نتوانستند در دو روز متوالی سه نمونه خلط بدهند و نیز کسانی که واکسن سل زده بودند از مطالعه حذف شدند.
جمعآوری نمونه
تمامی 340 نفر سه نمونه خلط در طی دو روز متوالی ارائه کردند. در مجموع 1020 نمونه خلط جمعآوری شد و نمونه اول در روز مراجعه بیمار به مرکز تهیه شده و نمونه دوم را در منزل تهیه میکرد. نحوه جمعآوری صحیح خلط از جمله تهیه صبحگاهی و قبل از مسواک زدن به بیماران آموزش داده شد. نمونه سوم به هنگام مراجعه مجدد بیمار جهت تحویل نمونه دوم در همان مرکز پزشکی زانکلی تهیه میگردید. دو نمونهای که در مرکز پزشکی تهیه میشد در فضای باز و با تهویه کافی بود. از تمام نمونههای جمعآوری شده آزمایش مستقیم میکروسکوپی بعمل آمد و بطور تصادفی یک نمونه برای تغلیظ با هیپوکلریت سدیم و یک نمونه جهت انجام کشت در محیط L.J انتخاب میگردید.
آزمایش اسمیر مستقیم
اسمیرهایی به ابعاد یک در دو سانتیمتر از قسمت چرکین خلط تهیه شده و بر روی هات پلیت °85 سانتیگراد به مدت دو تا سه دقیقه فیکس میشد، سپس با رنگ زیل نلسون (1% کاربول فوشین و یکدهم درصد مالاشیت گرین یا متیلن بلو) رنگآمیزی میشد.
تغلیظ با هیپوکلریت سدیم
حجم مساوی از سفیدکننده تجاری (هیپوکلریت سدیم 5%) و باقیمانده خلط مخلوط میگردید. ظرف نمونه کاملاً بسته شده و به مدت 20 ثانیه بشدت با دست تکان داده میشد. سپس ظرف را با زاویه 45 درجه به مدت نیم ساعت در دمای اتاق (18 تا 30 درجه سانتیگراد) قرار میدادند. رسوب ایجادشده را به کمک پیپت پاستور جدا کرده و یک قطره آن را بر روی لام انتقال میدادند. از این رسوب یک اسمیر به ابعاد یک در دو سانتیمتر تهیه میشد. پس از خشک کردن اسمیر در هوا با حرارت فیکس شده و رنگآمیزی ذیل- نلسون انجام میشد.
آزمایش میکروسکوپی و تفسیر
لام مستقیم به همراه لام تغلیظ شده با عدسی 100 و توسط تکنسین ماهر بررسی میشد. تکنسین نسبت به ارتباط لامها بیاطلاع بود، درصورتیکه نتیجه دو لام مغایر بود بررسی مجدد بعمل میآمد. تفسیر نتایج لام بر اساس مندرجات جدول 1 انجام میشد. بیماری از نظر TB اسمیر مثبت تلقی میشد که حداقل 1 تا 9 باسیل اسیدفست با عدسی 100 در لام خلط وی دیده شود.
جدول 1
شکل 1
عفونتزدایی خلط (روش تغییریافته (Petroff، کشت و جداسازی مایکوباکتریوم توبرکلوز
از بین سه نمونه خلط بیمار یکی بهطور تصادفی جهت کشت در محیط L.J انتخاب میشد. حجم مساوی از سود 4% به 5 میلیلیتر از خلط در داخل یک لوله درپیچدار 30 میلیلیتری اضافه میشد. درب لوله بهخوبی بسته شده و جهت هضم خلط تکان داده میشد و پس از آن به مدت 15 دقیقه در دمای اتاق قرار میگرفت. در این فاصله باز هم چند نوبت محتویات لوله مخلوط میگردید. سپس نمونه برای مدت 15 دقیقه با دور 3000 سانتریفوژ میشد. بعد از آن محلول رویی را دور ریخته و رسوب را در 15 میلیلیتر سرم فیزیولوژی استریل حل کرده و مجدداً با همان شرایط بالا سانتریفوژ میکردند.
مجدداً مایع رویی را دور ریخته و رسوب را در سطح شیبدار محیط L.J کشت داده و در دمای °2 ±37 سانتیگراد قرار میدادند. در طی سه روز اول از نظر رشد آلودگی، محیطها بطور روزانه بررسی میشدند. در طی شش تا ده هفته آینده محیطها از نظر رشد مایکوباکتریوم توبرکلوز بطور مستمر بررسی میشدند؛ بهعنوان نمونه کنترل مثبت از کشت م. توبرکلوز و بهعنوان نمونه کنترل منفی از تلقیح آب مقطر استریل استفاده میشد. با آزمایش احیای نیترات، کاتالاز حساس به حرارت و رنگآمیزی ذیل- نلسون ماهیت گونه مایکوباکتریوم تایید میشد.
تجزیه و تحلیل آماری
نسبتهای حساسیت، ویژگی، NPV و PPV با استفاده از تعاریف استاندارد تعیین شد.25 نتایج حاصله با استفاده از نگارش 11 نرمافزار Stata بررسی شده و P-Value<0.05 از نظر آماری قابل اهمیت تلقی شد.
ملاحظات اخلاقی
رضایت شفاهی از شرکتکنندگان گرفته شد و کمیته اخلاقی مرکز پزشکی زانکلی نیز بر رعایت قوانین اخلاقی صحه گذاشتند.
نتایج
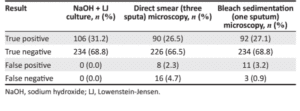
در میان 340 مراجعهکننده، 28/8 درصد افراد با استفاده از اسمیر مستقیم و 30/3% با استفاده از روش تغلیظ از نظر باسیل اسیدفست مثبت بودند. (جدول 2). در مقایسه با روش کشت بر روی محیط L.J که استاندارد طلایی این کار است 26/5% از نمونههای اسمیر مستقیم و 27/1% از نمونههای تغلیظ شده، مثبت واقعی بودند (جدول 3). این مقایسه حساسیت و ویژگی دو روش را نشان میدهد (جدول 4)، درحالیکه ویژگی دو روش تفاوت معنیداری ندارد (P=0.548) اما تفاوت در حساسیت آنها قابلتوجه است (P=0.004) که نشان میدهد روش تغلیظ با سفیدکننده حساستر است. همچنین اختلاف PPV معنیدار نیست (P=0.542) اما اختلاف در NPV معنیدار است (P=0.003) که این تفاوت بیانگر دقیقتر بودن روش تغلیظ در شناسایی منفیهای واقعی است.
جدول 2
جدول 3
جدول 4
بحث
در این مطالعه این نتیجه بدست آمد که تغلیظ با هیپوکلریت در مقایسه با اسمیر مستقیم حساسیت را افزایش میدهد، اما ویژگی تغییری نمیکند. این بررسی در موافقت با مطالعاتی است که روش تغلیظ را در برابر کشت مقایسه کردهاند.10 و 19 و 20
روش اسمیر مستقیم علیرغم محدودیتهایی که دارد اساس تشخیص سل در کشورهای کمتر توسعهیافته باقی مانده است. در 14 مطالعهای که قبلاً انجام شده بود، روش مستقیم حساسیت کمی داشت اما در این مطالعه حساسیت بیشتری را نشان داده است. گرچه این بهبود قابلتعمیم نیست چرا که کار در یک آزمایشگاه تحقیقاتی انجام شده که در مقایسه با آزمایشگاههای روتین وقت بیشتری برای آزمایش صرف شده است.
محدودیت دیگر اسمیر مستقیم نیاز به تهیه سه نمونه از سوی بیمار است که احتمال انصراف وی را در پی دارد. بسیاری از بیماران توانایی صرف هزینه جهت آمد و شد مکرر به مراکز درمانی را ندارند،26 بنابراین جای تعجب ندارد که هدفگذاری سازمان بهداشت جهانی جهت تشخیص 70% موارد اسمیر مثبت تا سال 2005 تحقق نیابد چرا که عمده وسیله تشخیص سل در کشورهای درحال توسعه همانا اسمیر مستقیم است. از جمله مزایای روش تغلیظ با هیپوکلریت سدیم کفایت فقط یک نمونه خلط است که هم بار کاری آزمایشگاه را کاهش میدهد و هم زمان آماده کردن جواب تسریع میگردد. علاوه بر این ایمنی کار با نمونه افزایش یافته و از نظر هزینه مقرونبهصرفه و روش کار ساده میباشد ضمن آن که محلول سفیدکننده حتی در نقاط دورافتاده کشورهای توسعهنیافته در دسترس است، درحالیکه هیدروکسید سدیم به این راحتی قابل دسترس نیست. یک مطالعه نشان داده که 20 دقیقه استفاده از هیپوکلریت سدیم 3% بطور کامل خلط حاوی م. توبرکلوز را استریل میکند،27 اما در یک مطالعه قبلی میزان استریلیزاسیون بعد از 15 دقیقه و سه ساعت استفاده از هیپوکلریت سدیم 5% فقط 93/6% اعلام شده بود.28 در هر حال استفاده از هیپوکلریت سدیم میزان خطر مواجهه تکنسین را با باسیل سل بشدت کاهش میدهد.
محدودیتها
این مطالعه در یک آزمایشگاه تحقیقاتی انجام شده است که مشابه شرایط آزمایشگاه روتین در الزام به انجام کار زیاد در محدوده زمانی کوتاه نیست، لذا انجام این تحقیق تحت تأثیر فشار زمان و محدودیت وقت نبوده است. پیشنهاد میشود که مطالعه مشابهی در یک آزمایشگاه روتین نیز انجام شود.
توصیهها
این مطالعه استفاده از هیپوکلریت سدیم را در آزمایش خلط از نظر سل توصیه میکند چرا که حساسیت را افزایش داده و بار کاری را کاهش میدهد، علاوه بر اینکه ایمنی بیشتری برای کارکنان فراهم میسازد.
نتیجهگیری
در جاهایی که میزان شیوع سل بالا است استفاده از روش تغلیظ با هیپوکلریت سدیم حساسیت تشخیص و ایمنی پرسنل را در مواجهه با میکروب سل افزایش میدهد. شواهد نشان میدهند که یک اسمیر تهیه شده با این روش حساستر از سه اسمیر مستقیم در تشخیص سل ریوی است. این روش تشخیصی میزان شناسایی موارد جدید سل را در مناطق روستایی افزایش میدهد.
منابع:
- World Health Organization. Global tuberculosis control: Surveillance, planning,
financing. WHO Report 2005 [homepage on the Internet]. c2014 [updated 2014;
cited 2014 Jul 9]. Available from: http://www.who.int/tb/publications/global_
report/2005/en/; now available from: http://www.hst.org.za/sites/default/files/
tb2005who.pdf.
- Harries AD, Maher D, Nunn P. An approach to the problems of diagnosing and
treating adult smear-negative pulmonary tuberculosis in high-HIV-prevalence
settings in sub-Saharan Africa. Bull World Health Organ. 1998;76(6):651–662.
PMID: 10191561.
- Cantwell MF, Binkin NJ. Impact of HIV on tuberculosis in sub-Saharan Africa: A
regional perspective. Int J Tuberc Lung Dis. 1997;1(3):205–214. PMID: 9432365.
- Perkins MD. New diagnostic tools for tuberculosis. Int J Tuberc Lung Dis. 2000;4(12
Suppl 2):S182–S188. PMID: 11144551.
- Dye C, Hosseini M, Watt C. Did we reach the 2005 targets for tuberculosis control?
Bull World Health Organ. 2007;85(5):325–420. PMID: 17639221.
- Steingart KR, Ng V, Henry M, et al. Sputum processing methods to improve the
sensitivity of smear microscopy for tuberculosis: A systematic review. Lancet
Infect Dis. 2006;6(10):664–674. PMID: 17008175, http://dx.doi.org/10.1016/
S1473-3099(06)70602-8
- James A, Abba SU, Ibrahim A, et al. Improving the case detection of pulmonary
tuberculosis by bleach microscopy method in the North West of Nigeria. JMLD.
2013;4(3):34–37.
- Angeby KA, Alvarado-Gálvez C, Pineda-García L, et al. Improved sputum
microscopy for a more sensitive diagnosis of pulmonary tuberculosis. Int J Tuberc
Lung Dis. 2000;4(7):684–687. PMID: 10907772.
- Bruchfeld J, Aderaye G, Palme IB, et al. Sputum concentration improves diagnosis
of tuberculosis in a setting with a high prevalence of HIV. Trans R Soc Trop Med
Hyg. 2000;94(6):677–680. PMID: 11198655, http://dx.doi.org/10.1016/S0035-
9203(00)90230-X
- Farnia P, Mohammadi F, Zarifi Z, et al. Improving sensitivity of direct microscopy
for detection of acid-fast bacilli in sputum: Use of chitin in mucus digestion. J Clin
Microbiol. 2002;40(2):508–511. PMID: 11825964, http://dx.doi.org/10.1128/
JCM.40.2.508-511.2002
- Gebre N, Karlsson U, Jönsson G, et al. Improved microscopical diagnosis
of pulmonary tuberculosis in developing countries. Trans R Soc Trop Med
Hyg. 1995;89(2):191–193. PMID: 7539954, http://dx.doi.org/10.1016/0035-
9203(95)90491-3
- Vasanthakumari R. Concentrated sputum smear microscopy: A simple approach to
better case detection in pulmonary tuberculosis. Indian J Tuberc. 1988;35:80–82.
- Wilkinson D, Sturm AW. Diagnosing tuberculosis in a resource-poor setting: The
value of sputum concentration. Trans R Soc Trop Med Hyg. 1997;91(4):420–421.
PMID: 9373638, http://dx.doi.org/10.1016/S0035-9203(97)90263-7
- Allwood M, Lee Y, Salaniponi F, et al. Case finding with a single sputum sample and
household bleach. Int J Tuberc Lung Dis. 1997;1(Suppl 1):S144.
- Naganathan N, Ganapathy KT, Rajalakshmi R. Evaluation of sputum smears
prepared by different methods. Indian J Med Res. 1979;69:893–900. PMID:
381187.
- Lawson L, Yassin MA, Ramsay A, et al. Short-term bleach digestion of sputum
in the diagnosis of pulmonary tuberculosis in patients co-infected with HIV.
Tuberculosis. 2007;87(4):368–372. PMID: 17392025.
- Angeby KA, Hoffner SE, Diwan VK. Should the ‘bleach microscopy method’ be
recommended for improved case detection of tuberculosis? Literature review and
key person analysis. Int J Tuberc Lung Dis. 2004;8(7):806–815. PMID: 15260270.
- Cattamanchi A, Davis JL, Pai M, et al. Does bleach processing increase the accuracy
of sputum smear microscopy for diagnosing pulmonary tuberculosis? J Clin
Microbiol. 2010;48(7):2433–2439. PMID: 20421442, http://dx.doi.org/10.1128/
JCM.00208-10
- Frimpong EH, Adukpo R, Owusu-Darko K. Evaluation of two novel Ziehl-Neelsen
methods for tuberculosis diagnosis. West Afr J Med. 2005;24(4):316–320. PMID:
16483048.
- Merid Y, Yassin MA, Yamuah L, et al. Validation of bleach-treated smears for the
diagnosis of pulmonary tuberculosis. Int J Tuber Lung Dis. 2009;13(1):136–141.
PMID: 19105892.
- Lawson L, Yassin MA, Ramsay A, et al. Microbiological validation of smear
microscopy after sputum digestion with bleach; a step closer to a one-stop
diagnosis of pulmonary tuberculosis. Tuberculosis. 2006;86(1):34–40. PMID:
16263328, http://dx.doi.org/10.1016/j.tube.2005.06.003
- Gebre-Selassie S. Evaluation of the concentration sputum smear technique for the
laboratory diagnosis of pulmonary tuberculosis. Trop. Doct. 2003;33(3):160–162.
PMID: 12870603, http://dx.doi.org/10.1177/004947550303300313
- Miörner H, Ganlöv G, Yohannes Z, et al. Improved sensitivity of direct microscopy
for acid-fast bacilli: Sedimentation as an alternative to centrifugation for
concentration of tubercle bacilli. J Clin Microbiol. 1996;34(12):3206–3207. PMID:
8940473.
- Bonnet M, Ramsay A, Githui W, et al. Bleach sedimentation: An opportunity
to optimize smear microscopy for tuberculosis diagnosis in settings of high
prevalence of HIV. Clin Infect Dis. 2008;46(11):1710–1716. PMID: 18444789,
http://dx.doi.org/10.1086/587891
- Drewe JA, Tomlinson AJ, Walker NJ, et al. Diagnostic accuracy and optimal use of
three tests for tuberculosis in live badgers. PLoS One. 2010;5(6):e11196. PMID:
20585404, http://dx.doi.org/10.1371/journal.pone.0011196
- Squire SB, Belaye AK, Kashoti A, et al. ‘Lost’ smear-positive pulmonary
tuberculosis cases: Where are they and why did we lose them? Int J Tuberc Lung
Dis. 2005;9(1):25–31. PMID: 15675546.
- Chew R, Calderón C, Schumacher S, et al. Evaluation of bleach-sedimentation for
sterilising and concentrating Mycobacterium tuberculosis in sputum specimens.
BMC Infect Dis. 2011;11:269. PMID: 21985457, http://dx.doi.org/10.1186/1471-
2334-11-269
- 28. Githui WA, Matu SW, Tunge N, et al. Biocidal effect of bleach on Mycobacterium
tuberculosis: A safety measure. Int. J Tuberc Lung Dis. 2007;11(7):798–802. PMID:
17609057.
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام