درمان سرطان بر پایه داروهای کونژوگه شده به آنتیبادی
Antibody-drug conjugates
سید محمد غیبی حیات
گروه زیستفناوری پزشکی، دانشکده پزشکی، دانشگاه علوم پزشکی مشهد
مقدمه
اولین بار واژه Magic bullet توسط دانشمند روسی پل ارلیش بکار برده شد. او پیشنهاد داد در صورتیکه مادهای توانایی اتصال انتخابی به یک عامل بیماریزا را داشته باشد میتوان با اتصال یک عامل سمی بر روی این ماده، باعث انتقال هدفمند دارو (سم) به آن عامل بیماریزا شد. وی به خاطر این نظریه برنده جایزه نوبل پزشکی در سال 1908 شد.
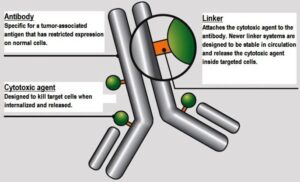
داروهای متصل به آنتیبادی (Antibody-drug conjugates) یا ADCs، کلاسی جدید از داروها هستند که جهت درمان بیماران سرطانی طراحی شدهاند. ADCs کمپلکسی متشکل از یک آنتیبادی و دارو (داروی ضدسرطان) است که توسط یک لینکر به هم متصل شدهاند، بهطوریکه آنتیبادی مونوکلونال در ناحیه Fab دارای پاراتوپهای اختصاصی جهت اتصال به اپیتوپهای آنتیهای سرطانی است. در شکل 1 سه جزء تشکیلدهنده یک ADCs به تصویر کشیده است.
شکل 1– اجزای تشکیلدهنده کمپلکس ADCs
مکانیزم عمل ADCs
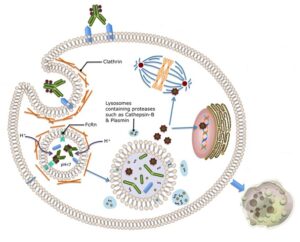
یک کمپلکس ADCs در پنج مرحله باعث القای آپوپتوز در سلول سرطانی میشود.
مرحله اول- اتصال به سطح سلول: ADCs میتواند از طریق اتصال آنتیبادی مونوکلونال به آنتیژن اختصاصیاش (آنتیژن سرطانی) به سطح سلول سرطانی متصل شود و بدین ترتیب کمپلکس آنتیبادی- آنتیژن تشکیل شود.
مرحله دوم- اینترنالیزه شدن: کمپلکس ADCs میتواند از طریق آندوسیتوز وابسته به رسپتور به درون سلول سرطانی آندوسیتوز شود.
مرحله سوم- جدا شدن دارو از آنتیبادی: پس از آندوسیتوز ADCs به درون سلول، ADCs درون وزیکول اولیه قرار میگیرد که در ادامه با تبدیل به وزیکول ثانویه باعث قطع لینکر شده و دارو از آنتیبادی جدا میشود.
مرحله چهارم- رهاسازی: دارو به درون سیتوپلاسم رها میشود.
مرحله پنجم- مرگ سلولی: دارو از طریق برهمکنش با DNA یا میکروتوبول باعث آپوپتوز سلول سرطانی میشود.
مراحل مختلف در شکل 2 نشان داده شدهاند.
شکل 2– مراحل مختلف اتصال یک ADCs به سلول سرطانی و القای آپوپتوز در آن
طراحی ADCs
جهت طراحی یک ADCs مناسب باید یک آنتیبادی مونوکلونال اختصاصی برای آنتیژن سرطانی تولید کرد و از یک لینکر مناسب جهت اتصال آنتیبادی به دارو استفاده نمود، در ادامه به موارد مهمی که در انتخاب آنتیبادی، لینکر و دارو باید توجه نمود، اشاره خواهد شد.
آنتیبادی
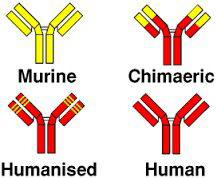
در گذشته جهت ساخت ADCs از آنتیبادی مورین استفاده میشد اما امروزه به علت پاسخ سیستم ایمنی بدن انسان به این نوع آنتیبادی موشی، از آنتیبادیهای کایمریک یا انسانیشده (humanized) که با روشهای فاژدیسپلی تولید میشوند استفاده میگردد (شکل 3). در هنگام انتخاب آنتیبادیها باید به فعالیت زیستی بخش Fc آنتیبادی که میتواند با سلولهای دارای رسپتور Fc (FcRs) برهمکنش دهد، توجه نمود. طراحی و ساخت یک آنتیبادی مونوکلونال مناسب در ساخت یک کمپلکس APCs نقش بسزایی دارد.
شکل 3– انواع مختلف آنتیبادی مورداستفاده
آنتیژن انتخابی
آنتیژنی که بهعنوان آنتیژن اختصاصی سلول سرطانی انتخاب میشود باید به میزان کافی بر روی سطح سلول بیان شود و همچنین باید به میزان کمی بر روی سلولهای سالم وجود داشته باشد تا باعث اتصال کمپلکس APCs به سلولهای نرمال نشود. یکی دیگر از ویژگی آنتیژن انتخابی، قابلیت القای بالای آندوسیتوز در هنگام اتصال آنتی به آن است. در جدول 1 چندین نمونه از آنتیژنهای مناسب جهت هدف قرارگیری توسط APCs معرفیشده است.
جدول 1– انواع مختلف آنتیژنهایی که میتوان آنتیبادی را علیه آن طراحی کرد
| Target antigens for ADCs in preclinical & clinical development | |
| Cancer | Target Antigens |
| Breast | CD174, GPNMB, CRIPTO & nectin-4 (ASG-22ME) |
| Ovarian | MUC16 (CA125), TIM-1 (CDX-014) & mesothelin |
| Lung | CD56, CD326, CRIPTO, FAP, mesothelin & GD2 |
| Pancreatic | CD74, CD227 (MUC-1) & nectin-4 (ASG-22ME) |
| Prostate | PSMA, STEAP-1 & TENB2 |
لینکر
بهطورکلی لینکرها به دو دسته قابلشکافتن Cleavable و غیرقابل شکافتن Noncleavable تقسیم میشوند. دسته لینکرهای قابلشکافتن به سه زیرگروه تقسیمبندی میشوند:
- حساس به پروتئولیز
- حساس به pH
- حساس به گلوتاتیون
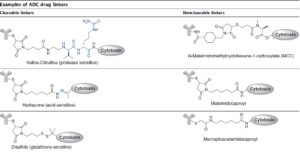
لینکرهایی که حساس به پروتئولیز هستند توسط catB موجود در لیزوزم شکافته شده و باعث رهاسازی دارو از آنتیبادی میشوند. درواقع این نوع لینکرها دارای یک پیوند دیپپتیدی والین-سیترولین میباشند که در درون لیزوزم توسط کاتپسین B قطع شده و باعث رهاسازی دارو میشود. این نوع لینکر در داروی Adcetris® که یک داروی بر پایه ADCs است وجود دارد. دسته دوم لینکرهایی هستند که حساس به pH میباشند و در pH پایین درون لیزوزوم شکسته شده و باعث رهاسازی دارو از کمپلکس ADCs میشوند اما این دسته از لینکرها بهراحتی با کاهش pH عمل رهاسازی را انجام خواهند داد و ممکن است قبل از ورود به درون لیزوزوم دارو از آنها جدا شود و معمولاً جهت ساخت کمپلکسهای ADCs مناسب نیستند. از داروهایی که از این نوع لینکر در آنها استفاده میشد میتوان به Mylotarg® اشاره نمود که به علت ضعیف بودن لینکر باعث شد این دارو از سطح بازار جمعآوری شود. دسته سوم لینکر قابلشکافتن، لینکرهای حساس به غلظت تیوهایی همچون گلوتاتیون است؛ این نوع لینکرها در درون سلولهای سرطانی که غلظت گلوتاتیون بالایی دارند لیز شده و دارو را آزاد مینمایند. در رابطه با لینکرهای غیرقابلشکافتن باید توجه نمود که این لینکرها در جریان خون از پایداری بالایی برخوردار بوده و در حال حاضر در داروی Kadcyla® مورد استفاده قرار میگیرند. در شکل 4 انواع لینکرهای معرفیشده نشان داده شدهاند.
شکل 4– انواع مختلف لینکرهای مورداستفاده در کمپلکس ADCs
آندوسیتوز ADCs
بعد از اتصال آنتیبادی به آنتیژن سرطانی، آندوسیتوز وابسته به رسپتور اتفاق میافتد. یکی از مهمترین فاکتورهایی که باعث افزایش آندوسیتوز میشود انتخاب نوع اپیتوپ آنتیژن سرطانی است. همچنین میزان افینیتی آنتیبادی با آنتیژن نیز در افزایش اینترنالیزه شدن ADCs به درون سلول سرطانی نقش بسزایی دارد. اینترنالیزه شدن توسط سه مکانیزم با واسطه کلاترین، با واسطه Caveolae و نیز با پینوسیتوز انجام میشود که دو مورد اولی وابسته به رسپتور و مورد آخری غیروابسته به رسپتور است. بعد از آندوسیتوز، ADCs درون وزیکول اولیه در درون سلول قرار میگیرد و در مرحله بعد با اتصال لیزوزوم به آن به وزیکول ثانویه تبدیلشده و بهواسطه pH پایین یا وجود کاتپسین B، لینکر قطعشده و دارو از آنتیبادی جدا میشود.
عامل سایتوتوکسیک
بهطورکلی دو نوع عامل سایتوتوکسیک میتواند به ADCs اتصال پیدا کند:
- مهارکننده میکروتوبول
- تخریبکننده DNA
از عواملی که باعث مهار پلیمریزاسیون و دپلیمریزاسیون میکروتوبولها میشود میتوان به Dolastatin اشاره نمود که در داروی Adcetris® مورد استفاده قرار میگیرد. Tubulysins شبیه به auristatins و maytansine بوده و از طریق مهار پلیمریزاسیون و دپلیمریزاسیون میکروتوبولها باعث القای آپوپتوز در سلولهای سرطانی میشود. Auristatins سومین نوع دارو است که از نوعی خرگوش دریایی به نام Dolabella auricularia تهیه میگردد. Monomethyl auristatin E (MMAE) نیز که 1000 برابر سمیتر از doxorubicin است در داروی Kadcyla® مورداستفاده قرار میگیرد.
آخرین نوع از داروهایی که از طریق تأثیر بر میکروتوبولها باعث مرگ سلولی میشود Maytansinoids است که بسیار سمی بوده و در حد پیکوگرم خاصیت آپوپتوتیک داشته و از گیاه Maytenus مشتق میشود.
از عوامل توکسیکی که با تأثیر بر روی ساختار DNA باعث القای آپوپتوز میشود میتوان Calicheamicinis را نام برد. این سم از یک باکتری بومی در تگزاس به دست آمده و 4000 برابر سمیتر از doxorubicin بوده و با نفوذ به شیار کوچک DNA باعث شکست در DNA و القای مرگ سلولی میشود. این سم در داروی Mylotarg® مورد استفاده قرار میگرفت. Duocarmycin نیز با نفوذ در شیار کوچک DNA باعث شکست DNA و مرگ سلولی میشود. داروهایی که تاکنون مجوز FDA را گرفتهاند و در بازار دارو یافت میشوند شامل Adcetris™ و Kadcyla™ میباشند. لیست کامل سایر داروهای بر پایه ADCs که در مراحل مختلف تولید هستند در جدول 2 مشاهده میشود.
جدول 2- انواع مختلف داروهایی که بر پایه ADCs طراحی شدهاند و در مراحل مختلف تائید کلینیکی قرار دارند
نتیجهگیری
در درمان سرطان با روشهای سنتی به علت تأثیر داروهای شیمیدرمانی بر روی سلولهای نرمال آثار نامطلوب در بدن شخص بیمار به وجود میآید اما با بکار بردن ADCs میتوان با یک دارورسانی هدفمند باعث آپوپتوز سلولهای سرطانی شد. کمپلکس ADCs از یک آنتیبادی که اختصاصی یک سلول سرطانی است تشکیلشده که این آنتیبادی از طریق یک لینکر به یک عامل سایتوتوکسیک (داروی ضد سرطان) متصل شده است. ADCs بهطور هدفمند داروهای سرطانی را به سلولهای سرطانی میرساند و باعث القای آپوپتوز در آنها میشود، ولی هنوز عوامل زیادی در بهبود کارایی کمپلکسهای ADCs باقیماندهاند که میتوان به انتخاب آنتیژن سرطانی، تهیه مونوکلونال آنتیبادی اختصاصی و خصوصاً نوع لینکر انتخابی و همچنین نوع عامل سایتوتوکسیک اشاره نمود. امید است در آینده با بهبود موارد فوق داروهای بر پایه ADCs گسترش یافته و داروهای مؤثری برای درمان سرطان ساخته شود.
منابع:
- Heidi L. Perez, Pina M. Cardarelli, Shrikant Deshpande, Sanjeev Gangwar, Gretchen M. Schroeder, Gregory D. Vite And Robert M. Borzilleri, Antibody–Drug Conjugates: Current Status And Future Directions, Drug Discovery, Pg. No. 1 -13, December 2013
- Zolot, Rachel S., Satarupa Basu, and Ryan P. Million. “Antibody–drug conjugates.” Nature Reviews Drug Discovery 12.4 (2013): 259-260.
- Pamela A. Trail, Antibody Drug Conjugates As Cancer Therapeutics, Antibodies, 2, Pg. No. 113 – 129, 2013
- Siler Panowski, Sunil Bhakta, Helga Raab, Paul Polakis And Jagath Rjunutula, Site-Specific Antibody Drug Conjugates For Cancer Therapy, Mabs 6:1, Pg. No. 1 – 12, January/February 2014
- Beverly A. Teicher And Ravi V.J. Chari, Antibody Conjugate Therapeutics: Challenges And Potential, American Association For Cancer Research, Pg. No. 6389 – 6397, 2011
- Singh Harsharan Pal, Gullaiya Sumeet, Kaur Ishpreet, Antibody Drug Conjugates: A Leap Ahead In Cancer Treatment, Journal Of Drug Delivery & Therapeutics, 4(3), Pg. No. 52 – 59, 2014
- Blaine Templar Smith, Introduction to Diagnostic and Therapeutic Monoclonal Antibodies, Volume 17, Lesson 1, Pg. No. 1 – 34, 2012
- Sochaj, Alicja M., Karolina W. Świderska, and Jacek Otlewski. “Current methods for the synthesis of homogeneous antibody–drug conjugates.” Biotechnology advances 33.6 (2015): 775-784.
- Aditya Wakankar, Yan Chen, Yatin Gokarn and Fredric S. Jacobson, Analytical Methods For Physicochemical Characterization Of Antibody Drug Conjugates, mAbs 3:2, Pg. No. 161 – 172, March/April 2011
- Jun Zhou and Paraskevi Giannakakou, Targeting Microtubules for Cancer Chemotherapy, Currrent Medicinal Chemistry – Anti-Cancer Agents, Vol. 5, No. 1, Pg. No. 1 – 7, 2005
- Trail, Pamela A. “Antibody drug conjugates as cancer therapeutics.” Antibodies 2.1 (2013): 113-129.Sarah Payne and David Miles, Chapter 4 Mechanisms of Anticancer Drugs, Part 1 Cell Biology, Pg. No. 34 – 46, 2007
- Casi, Giulio, and Dario Neri. “Antibody–drug conjugates: basic concepts, examples and future perspectives.” Journal of controlled release 161.2 (2012): 422-428.
- Patrick J. Burke, Peter D. Senter, David W. Meyer, Jamie B. Miyamoto, Martha Anderson, Brian E. Toki, Govindarajan Manikumar, Mansukh C. Wani, David J. Kroll, and Scott C. Jeffrey, Design, Synthesis, and Biological Evaluation of Antibody-Drug Conjugates Comprised of Potent Camptothecin Analogues, Bioconjugate Chem., Vol. 20, No. 6, Pg. No. 1242 – 1250, 2009
مقاومت دارویی در بیماران مبتلا به سل
نيتريك اكسيد و اهميت آن در برخي از بيماريها
«مقاومت دارویی در بیماران مبتلا به سل»
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام