روش برادفورد در اندازهگیری پروتئینها
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفی: کارشناس ارشد میکروب شناسی، دانشگاه علوم پزشكي جندي شاپور اهواز
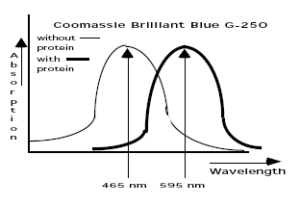
در سال 1976 ماريون برادفورد (Marion Bradford) روشي را براي اندازهگيري پروتئينها معرفي کرد كه بر اساس تغییر ماكزيمم جذب نوري كوماسي بريليانت بلو G-250 از 465 نانومتر به 595 نانومتر در هنگام اتصال به پروتئين عمل مينمود.
اندازهگيري پروتئينهاي محلول به اين روش ساده، دقيق، سريع و ارزان بوده و از نظر مقدار پروتئين مورد استفاده مانند روش لوري ميباشد. كوتاه بودن زمان انجام آزمايش به اين روش موجب شده است كه نمونههاي با غلظت پروتئين خارج از محدوده، در طي چند دقيقه مجددا به سهولت اندازهگيري شوند. اين روش همچنين نسبت به بسياري از عواملي كه در روش لوري اختلال ايجاد ميكنند از خود حساسيت كمتري نشان ميدهد.
روش برادفورد به عنوان يك روش رايج به ويژه براي اندازهگيري غلظت پروتئينهای فراكشنهاي سلولي و ارزيابي غلظت پروتئين در ژل هاي الكتروفورز ميباشد.
Ausubel و همكاران در سال 1996 روش برادفورد را به عنوان روش انتخابي اندازهگيري دقيق غلظت پروتئينها پيشنهاد نمودند.
كوماسي بريليانت بلو در فرم كاتيوني، قرمز رنگ، در فرم خنثي، سبز رنگ و در فرم آنيوني داراي رنگ آبي ميباشد. در شرايط اسيدي، كوماسي بلو به طور غالب پروتونه بوده و به فرم كاتيونيك قرمز رنگ ديده ميشود. هنگامي كه كوماسي بلو به پروتئين متصل ميشود، به فرم پايدار غير پروتونه آبي رنگ در ميآيد. رنگ آبي ايجاد شده را ميتوان در طول موج هاي 615-575 نانومتر نيز قرائت نمود. در دو سر طيف اين طول موجها (575 و 615 نانومتر) در مقايسه با نتايج به دست آمده با طول موج 595 نانومتر، 10 درصد كاهش در ميزان جذب نوري خواهيم داشت.
اصول آزمايش:
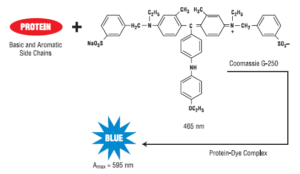
معرف رنگي كوماسي بلو با اسيد آمينههای بازي و آروماتيك از قبيل آرژينين، ليزين، تريپتوفان، تيروزين، هيستيدين و فنيلآلانين موجود در پروتئينها واکنش ميدهد. در اين ميان، اتصال كوماسي بلو به آرژينين حائز اهميت ميباشد. روشن است كه اين روش براي اندازهگيري غلظت پروتئينهاي بازي و اسيدي از دقت كمتري برخوردار ميباشد. مقدار رنگ متصل شده، وابسته به محتواي اسيدهاي آمينه بازي پروتئين ميباشد. بنابراين بايد محتواي اسيد آمينههاي بازي در پروتئين استاندارد، با پروتئين مورد نظر براي اندازهگيري يكسان باشد. نيروهاي واندروالس و هيدروفوبيك نيز در اتصال رنگ به پروتئين دخالت دارند. كوماسي بلو در فرم آنيونيك به آرژينين موجود در پروتئينها متصل ميشود كه در اين حالت در طول موج 595 نانومتر داراي ماكزيمم جذب نوري ميباشد.
كوماسي بريليانت بلو در شكل آنيوني خود و اتصال به پروتئين، داراي رنگ آبي و حداكثر جذب نوري در 595 نانومتر است؛ در حالي كه در شكل غير متصل، داراي حداكثر جذب نوري در 465 نانومتر است. كمپلكس رنگي تشكيل شده با پروتئين به مدت يك ساعت پايدار ميباشد. تعداد ليگاندهاي رنگ كوماسي بلو متصل شده به هر پروتئين تقريبا متناسب با تعداد بارهاي مثبت يافت شده در آن پروتئين است. اسيدهاي آمينه آزاد، پپتيدها و پروتئينهاي با وزن ملكولي پايين با معرفهای كوماسي بلو ايجاد رنگ نميكنند. به طور كلي بايد جرم پپتيد يا پروتئين مورد استفاده با اين روش، حداقل 3000 دالتون باشد که در برخي موارد، اين يك مزيت محسوب ميشود. روش اندازهگيري پروتئين كوماسي (برادفورد) براي اندازهگيري پروتئينهاي داراي وزن ملكولي بالا در صنايع آبجو سازي كاربرد دارد.
حساسيت روش برادفورد براي اندازهگيري پروتئين ها 20-0/2 ميكروگرم در ميليليتر پروتئين بسته به كيفيت رنگ مورد استفاده ميباشد. اما اين روش نميتواند پروتئينهاي رشتهاي و غشائي را به خوبي محلول نموده و لذا نتايج حاصل با اين پروتئينها همراه با خطا خواهند بود.
در غلظتهاي خاصي از پروتئين، تغییر رنگ در 595 نانومتر مستقيما متناسب با مقدار پروتئين نمونه ميباشد. در مقادير بالاتر پروتئين، تغييرات رنگ ديگر متناسب با مقدار پروتئين نمونه نميباشد (تصوير زیر).
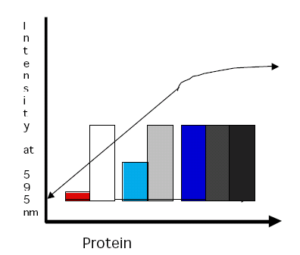
مزاياي روش برادفورد:
اين روش نسبت به ساير روشهاي اندازهگيري پروتئينها، سريعتر و آسانتر ميباشد. تهيه معرفهاي اين روش آسان بوده و ايجاد رنگ به سرعت روي داده و پايدار ميباشد. اندازهگيري در دماي اتاق انجام گرفته و وسيله خاصي مورد نياز نميباشد. پس از افزودن نمونه به لولههاي حاوي معرفها و ايجاد رنگ آبي مربوطه، پس از زمان كوتاهي انكوباسيون در دماي اتاق در طول موج 595 نانومتر، نتايج قرائت ميشوند. اين روش با اغلب نمكها، حلالها، بافرها، تيولها، تركيبات احيا كننده و عوامل شلاته كننده در نمونههاي پروتئيني سازگار بوده و تداخل كمتري ايجاد مينمايند.
دترجنت رايج سديم دودسيل سولفات (SDS)، كه در عمل ليز سلولي، نقش پاره كردن غشا دو لايه ليپيدي را بر عهده دارد، در اغلب پروتئينهاي استخراج شده يافت ميشود كه با روش برادفورد در اندازهگيري غلظت پروتئينها تداخلي ايجاد نميکند. در حالي كه اغلب دترجنتها در غلظتهاي بالا در اندازهگيري پروتئينها با اين روش تداخل ايجاد مينمايند. تداخل ايجاد شده با SDS، دو جنبه مختلف دارد كه وابسته به غلظت ميباشد.
براي غلظتهاي SDS پايينتر از غلظت ميسل شاخص (Critical Micelle Concentration; CMC) (0/00333-0/0667 وزني/حجمي) در محلول رنگي كوماسي، محلهاي اتصال معرف رنگي به پروتئين بلوكه شده و باعث ميشود كه مقدار پروتئين، كمتر از مقدار واقعي برآورد شود. SDS در غلظتهاي بالاتر از CMC، به طور محكم با فرم خنثي (سبز رنگ) كوماسي بلو متصل شده و موجب گرايش تعادل به سمت توليد فرم آنيوني (آبي رنگ) كوماسي بلو و افزايش ميزان جذب نور در طول موج 595 نانومتر، مستقل از غلظت پروتئين ميگردد.
با توجه به سادگي و تعداد كم محلولهاي مورد نياز براي انجام روش برادفورد، روشهاي اتوماتيك براي انجام اين آزمايش در بسياري از آزمايشگاهها گسترش يافتهاند. بسياري از محققين و دانشجويان هنوز هم به سادگي و سهولت از روش دستي برادفورد استفاده مينمايند.
روش تهيه محلول برادفورد:
معرف اين روش با حل كردن 10 ميليگرم كوماسي بريليانت بلو در 5 ميلي ليتر اتانول 95 درصد به دست ميآيد كه سپس 10 ميلي ليتر اسيد ارتوفسفريك 85 درصد به آن اضافه كرده و پس از حل شدن كامل رنگ، حجم را با آب مقطر به 100 ميليليتر ميرسانند. جهت حذف ذرات معلق، محلول حاصل را با كاغذ صافي شماره 1 واتمن صاف كرده و در ظرف تيره و در داخل يخچال نگهداري ميکنند. اين معرف بايد به رنگ قهوهاي روشن باشد. ممكن است لازم باشد عمل فيلتر کردن محلول را چند بار به منظور حذف ذرات آبي رنگ معرف، تكرار نمود. اين محلول حدود 8 هفته پايدار بوده، اما استوك رنگ/اتانول براي چندين سال قابل نگهداري است.
روش تهيه محلول استاندارد پروتئين (100 µg/ml):
جهت تهيه 10 ميليليتر از اين محلول، 1 ميليگرم پروتئين آلبومين سرم گاوي در مقداري آب مقطر حل نموده و سپس توسط آب مقطر به حجم 10 ميليليتر رسانده ميشود. در هر ميليليتر از محلول فوق، 10 ميكروگرم پروتئين وجود خواهد داشت.
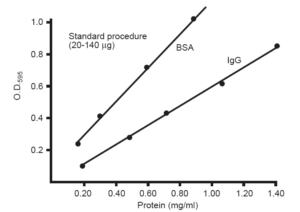
| برخي محققين به جاي استفاده از سرم آلبومين گاوي (BSA)، IgG را ترجيح ميدهند.
درصد ريشه اسيد آمينه تيروزين در BSA (از مجموع 607 اسید آمینه)، 3/5 درصد ميباشد. |
تهيه منحني استاندارد:
براي تعيين پروتئين يك محلول به روش برادفورد، ابتدا بايد منحني استاندارد را رسم كرد.
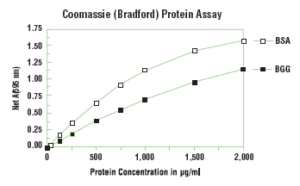
در هر روش اندازهگيري پروتئين، پروتئين ايدهآلي كه ميتوانيم به عنوان استاندارد انتخاب کنيم، فرم خالص شده همان پروتئين مورد نظر براي اندازهگيري است. در صورت در دسترس نبودن فرم خالص آن پروتئين، پروتئيني ارجح است كه رنگ حاصل از واكنش آن، مشابه رنگ حاصل از واكنش پروتئين مورد نظر براي اندازهگيري باشد. انتخاب اين نوع پروتئين بيشتر از روي تجربه انجام ميگيرد. در مواردي كه هيچ يك از اين دو روش عملي نبوده و يا ضرورتي براي اين كار احساس نشود، ممكن است كه هر پروتئيني براي انتخاب استاندارد استفاده شود. دو پروتئين رايج كه به عنوان استاندارد انتخاب مي شوند شامل سرم آلبومين گاوي و گاما گلبولين ميباشند.
براي اين منظور بايد با استفاده از سرم آلبومين گاوي (BSA)، غلظتهاي مختلفي از استاندارد پروتئين (حداقل سه استاندارد در محدوده غلظتي 20 الي 200 ميكروگرم در ميليليتر) تهيه كرده و جذب نوري هر لوله را در مقابل شاهد (بلانك) به وسيله اسپكتروفتومتر در طول موج 595 نانومتر قرائت نمود.
| رنگ كوماسي به شدت به كوارتز اتصال مييابد، بنابراين بايد در اين روش از كووتهاي شيشهاي يا پلياستيرن استفاده شود. |
ابتدا 11 لوله را انتخاب نموده و پس از شمارهگذاري، مقادير داده شده در جدول زير را از محلول استاندارد و آب مقطر در داخل آنها ميريزيم. محتويات هر لوله را به خوبي با هم مخلوط کرده، سپس به هر لوله، مقدار 5 ميليليتر از معرف برادفورد اضافه نموده و مجددا محتويات هر لوله را به خوبي با هم مخلوط میکنیم و به مدت 5 دقيقه در دماي اتاق نگهداري مينماييم.
| بلانك | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 | شماره لوله
محلول |
| – | 1000 | 900 | 800 | 700 | 600 | 500 | 400 | 300 | 200 | 100 | محلول استاندارد پروتئين (ميكروليتر) |
| – | – | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 800 | 900 | آب مقطر (ميكروليتر) |
| محتويات هر لوله به خوبي با هم مخلوط شوند. | |||||||||||
| 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | معرف برادفورد (ميليليتر) |
| محتويات هر لوله به خوبي با هم مخلوط شوند و به مدت 5 دقيقه در دماي اتاق نگهداري شوند. | |||||||||||
ابتدا با استفاده از لوله بلانك، اسپكتروفتومتر را در طول موج 595 نانومتر صفر کرده و سپس جذب نوري هر كدام از لولهها را در طول موج فوق قرائت ميکنیم؛ سپس منحني استاندارد را رسم مينماييم. بدين صورت كه ميزان جذب نوري را روي خط عمودي و ميزان غلظت پروتئين را روي خط افقي قرار ميدهيم. سپس مقادير قرائت شده را روي منحني مشخص کرده و آنها را به هم وصل مينماييم.
دو نمونه از منحنيهاي استاندارد رسم شده به روش برادفورد (595 nm=λ )
جهت تعيين مقدار پروتئين نمونه مجهول، در يك لوله مقدار 100 ميكروليتر نمونه و 900 ميكروليتر آب مقطر ريخته و پس از مخلوط كردن محتويات لوله، 5 ميليليتر از معرف برادفورد به آن اضافه ميکنیم. پس از 5 دقيقه، جذب نوري نمونه را در طول موج 595 نانومتر قرائت نموده و با استفاده از نمودار استاندارد و ضريب رقت، مقدار پروتئين نمونه مجهول را به دست ميآوريم.
| منحني استاندارد برادفورد در محدوده كوچكي خطي ميباشد كه به طور بارز در محدوده 120-2 ميكروگرم در ميليليتر مي باشد و معمولا لازم است كه قبل از اندازهگيري نمونه، آن را رقيق نمود. |
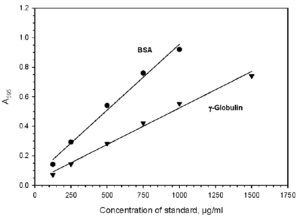
منحني استاندارد به دست آمده با BSA و BGG با روش برادفورد (595 nm=λ )
هنگامي كه منحنيهاي استاندارد سرم آلبومين گاوي (BSA) و گاماگلبولين گاوي (BGG) با هم مقايسه ميشوند، اختلاف در سيگنال توليد شده با روش كوماسي (برادفورد) بيشتر از 30 درصد بوده، در حالي كه اين اختلاف در روش اصلاح شده لوري كمتر از 15 درصد ميباشد.
روش اصلاح شده برادفورد:
اغلب غير خطي بودنهاي روش برادفورد، ناشي از تعادل بين دو فرم مختلف رنگ كوماسي بلو بوده كه به پروتئين افزوده ميگردد. با اندازهگيري نسبت جذب نوري در طول موج 595 نانومتر به 450 نانومتر، روش برادفورد خطي ميشود. اين روش اصلاح شده برادفورد تقريبا 10 مرتبه حساستر از روش رايج برادفورد ميباشد.
:Refrences
1- Bradford MM. A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 1976: 72; 248-254.
2- Fanger B. Adaptation of the Bradford protein assay to membrane-bound proteins by solubilizing in glucopyranoside detergents. Anal Biochem. 1987: 162; 11–17.
3- Stoscheck CM. Quantitation of Protein. Methods in Enzymology. 1990: 182; 50-69.
4- Zor T. and Selinger Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal. Biochem. 1996: 236; 302–308.
5- Noble J.E. and Bailey M.J.A. Quantitation of Protein. Methods Enzymol. 2009: 463;73–95.
6- Hwang DS., Yoo HJ., Jun JH., Moon WK. and Cha HJ. Expression of functional recombinant mussel adhesive protein Mgfp-5 in Escherichia coli. Appl Environ Microbiol. 2004; 70(6): 352–3359.
اندازهگیری پروتئینها(در تب جدید مرورگر باز می شود )
روش لوری در اندازهگیری پروتئینها(در تب جدید مرورگر باز می شود )
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام


عالی وممنون