آزمایشگاه و بالین
مطالعات شناسایی راهبردهای درمان بالقوه تومورهای مغزی DIPG در کودکان
دکتر محسن منشدی
آزمایشگاه تشخیص طبی دکتر منشدی
اهداف بالقوه درمانی یک تومور مغزی غیرقابل جراحی اطفال در یک گلیوم پایه مغزی داخلی منتشر (DIPG)، با دو مطالعه جداگانه شناسایی شدند. مسدود کردن این اهداف با داروهای تحقیقاتی، باعث کاهش رشد تومور در مدلهای حیوانی مبتلا به DIPG شده است. DIPG، توموری است که در پایه مغزی قرار دارد و تقریباً همیشه یکسان مرگبار است. دکتر Pratiti Bandopadhayay از مرکز سرطان کودکان دانا– فاربر بوستون و مرکز اختلالات خونی اظهار میدارد: “بهعنوان یک نوروانکولوژیست اطفال، این تومور یکی از مهلکترین تومورهای مشاهده شده است که هیچ درمان دارویی هم برای آن وجود ندارد.”
با وجود اینکه اکثر تومورهای DIPG دارای یک جهش ژنتیکی خاص هستند، اما پیش از این، مشخص نشده بود که در صورت وجود چنین جهشی، پروتئین جهشیافته چه نقشی در رشد تومور دارد و اینکه آیا عملکرد آن میتواند هدف درمان باشد یا خیر؟
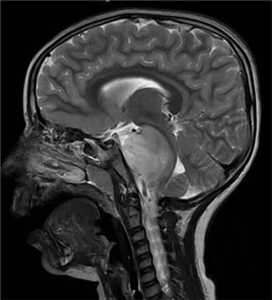
اسکن مغزی کودک مبتلا به تومور DIPG در ناحیه پایه مغز
برای هر دو مطالعه جدید، تیمهای تحقیقاتی، بیولوژی سلولهای DIPG انسانی واجد این موتاسیون را مورد بررسی قرار دادند و ویژگیهایی را شناسایی کردند که ممکن است آنها را در مقایسه با درمانهای کنترلی، نسبت به درمان آسیبپذیر کنند. آنها داروهایی را به نامهای مهارکنندههای PRC2 و BET یافتند که منجر به تحلیل تومورهای DIPG و افزایش طول عمر در مدلهای موش میشدند.
نتایج حاصل از دو مطالعه، یکی از گروه تحقیقاتی دانشگاه Northwestern و دیگری از گروه دانشگاه کپنهاگ دانمارک، در 27 فوریه در مجله Nature به چاپ رسید.
شناسایی یک هدف
حدود 5 سال پیش محققانی که روی پروژه ژنوم سرطان کودکان در دانشگاه “سنت جود” واشنگتن کار میکردند، کشف کردند که تقریباً 80 درصد تومورهای DIPG دارای موتاسیون خاصی در ژن پروتئینی به نام هیستون H3 هستند.
دکتر علی شیلاتی فرد از دانشکده پزشکی فاینبرگ دانشگاه Northwestern اظهارمیدارد: “این درصد بالا از تومورهای دارای چنین موتاسیونی، موجب تعجب انجمن تحقیقات DIPG شده است.”
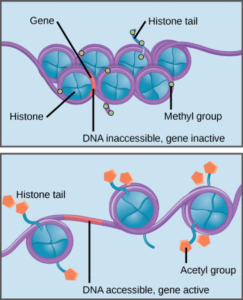
هیستونها دستهای از خانواده پروتئینها هستند که به بستههای DNAبرای تبدیل شدن به ساختارهای متراکم کمک میکنند. قسمتهای کوچکی از DNA همانند نخ دور قرقره، اطراف پروتئینهای هیستون میپیچند و هزاران هیستون لفاف شده با DNA (که به آن نوکلئوزوم گویند)، کروموزوم را تشکیل میدهند.
متیلاسون هیستون، فعل و انفعالات DNA– هیستون را تقویت میکند و باعث غیرقابلدسترس شدن ژنهای مرتبط برای بیان ژن میشود (غیرفعال)
استیله شدن هیستون باعث تضعیف این فعل و انفعال شده و منجر به قابلدسترس شدن ژنهای مرتبط در بیان ژن میگردد (فعال)
تغییراتی خاص در هیستونها، میتوانند باعث ترویج یا ممانعت از بیان ژن شوند، بهعنوانمثال پیوستن گروهی از ترکیبات شیمیایی به نام گروه استیل به هیستونها، تعامل آنها را با DNA تضعیف و بیان ژن را ترویج مینمایند، از سوی دیگر، اضافه شدن گروه متیل به هیستونها معمولاً باعث محکمتر پیچیده شدن DNA در اطراف هیستونها شده و از بیان ژن ممانعت به عمل میآورند.
به گفته خانم دکتر باندوپادهایای، شناسایی حضور موتاسیون یک هیستون H3 در بیمار مبتلا به DIPG اولین گام بوده است. او اضافه میکند که “اما برای اینکه بتوانیم تومورهایی با آن تغییرات را درمان کنیم، باید نحوه عملکرد موتاسیون را درک نماییم.”
دکتر شیلاتیفرد و همکارانش، در یک پژوهش از پیش انجامشده، از مگسهای میوه برای بررسی عملکرد موتاسیون ژن هیستون H3 استفاده کردند. مگسهای واجد پروتئین موتاسیونیافته، هیستونهای بیشتری در مقایسه با مگسهایی که دارای پروتئینهای طبیعی هیستون H3 بودند، داشتند که با گروههای استیل، نشاندار شده بودند (استیله). این هیستونهای استیله، بهنوبه خود توسط مولکولهایی به نام پروتئینهای حاوی برومودومین (BRD) که بیان ژن را تنظیم میکنند، محصور میشوند.
در پژوهش فعلی آنها که بخشی از آن توسط NCI تأمین اعتبار شده بود، محققین Northwestern تمایل داشتند معلوم کنند که آیا هیستون موتاسیونیافته در سلولهای انسانی هم عمل مشابه دارند؟ درواقع، آنها دریافتند سلولهای سرطانی کولون یا کلیه انسان که برای بیان ژن هیستون H3 جهشیافته، تغییر ماهیت داده بودند، هیستونهای استیله بیشتری نسبت به سلولهایی که ژن هیستون H3 طبیعی را بیان میکردند، داشتند.
پس از آن، نویسنده اول، دکتر آندریا پیونتی، تمام هیستونهای H3 جهشیافته موجود در سراسر ژنومهای سلولهای سرطانی DIPG در سه بیمار را بررسی کرد. نتایج حاصل از بررسی او آشکار ساخت که بسیاری از نوکلئوزومهایی که هیستونهای جهشیافته داشتند، استیله بوده و توسط پروتئینهای BRD احاطه شده بودند.
تجارب بیشتر نشان داد که پروتئینهای BRD احتمالاً نقش مستقیمی در رشد تومور DIPG دارند. درمان سلولهای DIPG انسانی با داروهای تحقیقاتی که پروتئینهای BRD را بلوکه میکنند و به نام مهارکنندههای BET نامیده میشوند، در مقایسه با درمان کنترل، رشد سلول DIPG را نشان داد. در مطالعات انجامشده بر روی موشهایی که سلولهای DIPG انسانی در ساقههای مغزی آنها قرار داده شده بود، مشاهده گردید که موشهای تحت درمان با مهارکنندههایBET ، در مقایسه با موشهای تحت درمان با درمان کنترل، تومورهای کوچکتری داشتند و به مدت بیشتری هم زنده ماندند.
بر طبق نظر دکتر شیلاتیفرد آزمایشها نشان میدهد که مهارکنندههای BET روش درمانی بالقوهای را برای DIPG ارائه میدهند. او اضافه میکند که مطالعات پیش بالینی نشان دادهاند که چندین نوع سرطان مختلف از جمله لوسمی و گلیوبلاستوم نیز به مهارکنندههای BET حساس هستند.
هدفی دیگر
گروه نورث وسترن پس از آزمایش بر روی سلولهای توموری DIPG انسان که حاوی هیستون H3 جهشدار بودند اعلام کردند که علاوه بر وجود استیلاسیون زیاد هیستون H3، بسیاری از هیستونها مزیّن به گروههای متیل (متیله) بودند. آنها همچنین دریافتند که آنزیمی به نام PRC2 که گروههای متیل را به پروتئینهای هیستون H3 متصل میکند، در نزدیکی بسیاری از این هیستونها حضور دارند. این نتایج، محققین نورث وسترن را بر آن داشت تا به دنبال فعالیت PRC2 باشند. آنها دریافتند که مهار فعالیت PRC2، چه از طریق ژنتیکی و چه با استفاده از مهارکننده PRC2 موسوم به tazemetostat، رشد سلول DIPG را کاهش میدهد.
گروه نورث وسترن ادعا میکنند، نقشی که این نتایج برای عملکرد PRC2 در پایداری رشد DIPG به تصویر میکشد، غیرمنتظره است.
همچنین گروه کپنهاکی، شواهدی دال بر نقش حمایتی PRC2 در ترویج رشد تومور DIPG پیدا کردند. آنها مشاهده کردند که tazemetostat و سایر مهارکنندههای PRC2، باعث کاهش رشد سلولهای مغز موش یا سلولهای دارای هیستون جهشیافته DIPG انسان میشوند، درحالیکه درمان کنترل، فاقد این توانمندی است و وقتیکه آنها سلولهای حاوی هیستون جهشیافته مغز موش را داخل مغز موشهای سالم یا موشهایی که در آنها PRC2 بهطور ژنتیکی بلوکه شده بود، کار گذاشتند، موشهایی که فاقد فعالیت PRC2 بودند، عمر طولانیتری داشتند. از طرفی، در مطالعه دیگری که توسط یک گروه تحقیقاتی در آلمان انجام شد، مشخص گردیده سلولهای حاصل از بیماران مختلف مبتلا به DIPG، حتی اگر تومورهای آنها توأم با جهش در هیستون H3 باشند، به tazemetostat حساس نیستند.
یک گام به جلو
دکتر باندو پاداهایا توضیح میدهد: طی دهها سال مطالعات بالینی، مشخص شد که تومورهای DIPG به شیمیدرمانی سنتی حساس نیستند و اگرچه تشعشع میتواند علائم را کاهش دهد، اما درمانکننده نیست و اکثر کودکان مبتلا به DIPG، طی دو سال بعد از زمان تشخیص میمیرند. دکتر شیلاتیفرد گفت: در حال حاضر نتایج حاصل از دو مطالعه به امکان نویدبخش بودن استراتژیهای درمان جدید اشاره دارند. او در ادامه میگوید: “ما میخواهیم مهارکنندههای BET را به فاز I مطالعه درمان DIPG منتقل کنیم و همکاران ما در بیمارستان کودکان Ann & Robert H.Lurie شیکاگو این مطالعات را به پیش میبرند.”
علاوه بر این، چندین مطالعه و بررسی مداوم بالینی، در حال آزمایش بر روی tazemetostat و مهارکننده PRC2، هم دربزرگسالان و هم در اطفال مبتلا به سرطانهای مختلف هستند، با این حال هیچ مطالعهای بهطور خاص بر روی tazemetostat در کودکان مبتلا به DIPG در حال حاضر صورت نمیگیرد.
دکتر باندوپادهایای گفت: هنوز هم سؤالات بدون پاسخ بسیاری وجود دارند؛ از جمله اینکه آیا این داروهای تحقیقاتی توانایی عبور از سد خونی– مغزی و رسیدن به تومورهای مغز انسان را دارند یا خیر؟ دکتر باندوپادهایای و همکارانش نیز در حال یادگیری بیشتر پیرامون بیولوژی DIPG، با مطالعه بر روی سلولهای توموری بدست آمده از بیوپسیها و اتوپسیها هستند. او همچنین شرح میدهد که بهتازگی، با پیشرفتهای عمدهای که در تکنیکهای جراحی اعصاب بدست آمده، اخذ نمونههای بیوپسی، امکانپذیر شده است. او گفت “این یک زمان هیجانانگیز است، در حال حاضر کارهای زیادی انجام میشود. هدف نهایی این است که قادر باشیم این کودکان را مداوا کنیم، بطوریکه شانس درمان با حداقل عوارض جانبی را داشته باشند.”
یک داروی تغییر هیستون یافته متفاوت
در سال 2015، یک کنسرسیوم بینالمللی از محققین DIPG برای مطالعه بر روی نمونههای سلول DIPG موجود با یکدیگر متحد شدند. مطالعه آنها نشان داد که سلولهای DIPG جمعآوریشده از چندین بیمار مختلف توسط داروی تغییر هیستون یافتهای به نام panobinostat (Farydak®) از بین رفتند. پانوبینواستات باعث بلوکه شدن آنزیمهایی میشود که گروه استیل را به هیستون اضافه میکنند. هماکنون محققینی که جزو کنسرسیوم تومور مغزی کودکان حمایتشده از سوی NCI هستند، در حال آزمایش بر روی ایمنی و بهترین دوز پانتوبینواستات برای کودکان مبتلا به DIPG در فاز I آزمون بالینی میباشند.
منبع:
National Cancer Institute,April 13, 2017, by NCI Staff
آزمایش مایع نخاع با نوار ادرار
برای دانلود پی دی اف برروی لینک زیر کلیک کنید
ورود / ثبت نام