بیومارکرها و ارزیابی عفونتها
سعید شعاع، دانشجوی PhD میکروبیولوژی دانشگاه آزاد اسلامی واحد شیراز
چکیده
عفونتهای باکتریایی بخصوص عفونت خون یا سپسیس مهمترین عامل مرگومیر در بخشهای ICU است، ولی این عفونت فاقد یک روش اختصاصی در شناسایی میباشد، درنتیجه حساسیت و اختصاصیت شاخصهای عفونت که بتواند آسان و با صحت زیاد نشاندهنده شدت و پیشآگهی عفونت باشد بسیار بااهمیت است.
معمولاً شاخصهای عفونت شامل حالت تب، شمارش گلبولهای سفید، پروتئین واکنشگر C (CRP)، پروکلسیتونین، ترم- 1، کالپروتکتین، اِنگل، CD163 پلیمورفیسم تکنوکلئوتیدی، سیتوکاینها، اینترلوکینها و میکروآرانایها میباشند؛ بنابراین توجه به بیومارکرهای جدید با اختصاصیت و حساسیت بالا یکی از زمینههای اصلی تحقیقات در مورد عفونتهای باکتریایی، بخصوص عفونت خون است. تشخیص و ارزیابی این بیومارکرهای جدید و سطح این بیومارکرها نهتنها در افتراق بین بیماران دارای عفونت باکتریایی و یا عفونت ویروسی مؤثر است، بلکه بین این بیماران با بیماران دچار سندرم پاسخهای التهابی سیستمیک میتواند افتراق ایجاد کند. در بیماران دارای عفونت خون زمان تشخیص و درمان سریع از فاکتورهای بسیار مهم در پیشآگهی است. شناسایی بیومارکرهای جدید بهعنوان تنظیمکننده اصلی سیستم ایمنی و بیان آنها در سیستم گردش خون میتواند در تشخیص بهعنوان بیومارکر عفونت و درمان مورد استفاده قرار گیرد. اگرچه مکانیسم عمل بعضی از این بیومارکرها کامل شناسایی نشدهاند، اما موارد کلینیکی بسیاری از این بیومارکرها را کاملاً تأیید کردهاند.
1-1 پروکلسیتونین[1]
تشخیص سریع و مناسب سپسیس جزء چالشهای روزمره بخشهای اورژانس و ICU میباشد. امروزه روشهای مختلف درمانی منجر به بهبود وضعیت زنده ماندن بیماران مبتلا به سپسیس شده است، لذا تشخیص سریع و صحیح امری ضروری است. سپسیس فاقد علائم و نشانههای اختصاصی است، کشت میکروبی مستلزم صرف وقت بوده و پاسخ التهابی سیستمیک بیماری را نشان نمیدهد، درعینحال نقص در عملکرد ارگانها را نشان نداده و ممکن است به دلایل متفاوت در بیماران مبتلا به سپسیس مثبت نباشد.
در بین جدیدترین بیومارکرهای سپسیس، پروکلسیتونین بالاترین صحت تشخیص را دارد. میزان پروکلسیتونین بهسرعت (در عرض 6 تا 12 ساعت) پس از حمله عفونی با عوارض سیستمیک افزایش مییابد. اندازهگیری پروکلسیتونین برای تشخیص مؤثر و سریع در بیمارانی که مشکوک به سپسیس و پاسخ التهابی سیستمیک هستند توصیه شده است.
علاوه بر ارزش تشخیصی پروکلسیتونین در سپسیس، پروکلسیتونین در پایش روند و شدت پاسخ التهابی سیستمیک نیز مفید است. تغییرات روزانه میزان پروکلسیتونین پلاسما شاخصی از روند بیماری و پیشآگهی بیماران مبتلا به سپسیس میباشد. بقا یا ادامهدار بودن مقادیر بالای پروکلسیتونین همراه با عاقبت نامطلوب برای بیمار بوده و شاهدی از نقص درمان یا عدم پاکسازی عفونت میباشد. بیومارکر پروکلسیتونین در حال حاضر بهطور گستردهای در اروپا برای تشخیص و ارزیابی پاسخ التهابی سیستمیک بکار میرود.
اولین شواهد از وجود پروکلسیتونین در سال 1962 دیده شد. منشأ این پیشساز هورمون تیروئید از غده تیروئید بدنبال مطالعه بر روی سگها مشاهده شد. ساختمان کامل پروکلسیتونین در سال 1981 بهطور کامل شناخته شد. در ابتدا فهمیدن وظیفه پروکلسیتونین و فیزیولوژی آن مشکل بود و بهخوبی شناسایی نشده بود.
سطح در گردش پروکلسیتونین در افراد سالم زیر حد قابل جداشدن بوده و تنها در موارد مدولار کارسینومای غده تیروئید و یا سرطان سلولهای کوچک ریه[2] افزایش آن دیده میشد.
افزایش سطح پروکلسیتونین در بیماران با عفونت باکتریایی بهوسیله Assoicot و همکارانش در سال 1993 گزارش شد و پروکلسیتونین بهعنوان یک پروتئین مهم در جداسازی و شناسایی و افتراق مراحل التهابی بکارگرفته شد (Roos et al. 1974).
پروکلسیتونین درواقع پروهورمون یا پیشهورمون کلسیتونین است، اما درواقع پروکلسیتونین و کلسیتونین دو پروتئین متفاوت هستند. کلسیتونین بهطور انحصاری توسط سلولهای C غده تیروئید در پاسخ به تحریک هورمونی تولید میشود، درحالیکه سلولهای مختلف در ارگانها در پاسخ به محرکهای پیشالتهابی بخصوص باکتریایی میتوانند پروکلسیتونین را تولید کنند.
در افراد سالم غلظت پروکلسیتونین پلاسما کمتر از ng/ml0/05 است و در بیماران مبتلا به سپسیس، سپسیس شدید یا شوک عفونی میتواند بهng/ml 1000 افزایش یابد. معمولاً غلظت بیش ازng/ml 5 پروکلسیتونین غیرطبیعی تلقی شده و میتواند نشاندهنده سپسیس باشد. مقادیر پروکلسیتونین بین 2-0/5 یک منطقه خاکستری و با عدم قطعیت سپسیس را مطرح میسازد، در چنین مواردی توصیه میگردد آزمایش پس از 6 تا 24 ساعت تکرار شود. پروکلسیتونین بیش از دو، وجود یک روند عفونی با عوارض سیستمیک را بهشدت مطرح میکند. غلظتهای بیش از ng/ml10 تقریباً بهطور انحصاری در بیماران با سپسیس شدید یا شوک سپتیک مشاهده میشــــود (Benoist et al. 1998).
اندوتوکسینهای باکتریها و سیتوکاینهای پیشالتهابی، محرکهای قوی برای تولید پروکلسیتونین میباشند. نقش بیولوژیک اصلی پروکلسیتونین تا حد زیادی نامشخص است، اما بههرحال بررسیهای اخیر نشاندهنده نقش احتــــــــــــمالی پاتولوژیک پروکلسیتونین در سپسیس میباشد .(Nylen et al. 1997)
پروتئین پروکلسیتونین دارای خواص جذبکننده لکوسیتها بوده و تعدیل تولید نیتریک اکسید توسط سلولهای اندوتلیال را برعهده دارد. پروکلسیتونین یک پروتئین پایدار در پلاسما و نمونههای خون است. در درجه حرارت اتاق بیش از 80 درصد اولیه آن بعد از 24 ساعت پایداری دارد و این میزان درصورتیکه نمونه در یخچال 4 درجه نگهداری شود بیش از 90 درصد است.
پروکلسیتونین پلاسما نیمهعمر طبیعی 25 تا 30 ساعته در افراد سالم و در بیماران با اشکال عملکردی شدید کلیهها 30 تا 45 ساعته خواهد داشت. در بیماران با سندرمهای پاسخ التهابی سیستمیک غیر باکتریایی[3] میزان پروکلسیتونین معمولاً کم است .(<1ng/ml)بعد از تروماهای متعدد یا جراحیهای عمده، سوختگیهای شدید یا در نوزادان، میزان پروکلسیتونین مستقل از پروسه عفونی افزایش مییابد. کاهش میزان پروکلسیتونین به مقادیر پایه در این گروه از بیماران معمولاً سریع بوده و افزایش دوباره پروکلسیتونین میتواند نشاندهنده حمله سپسیس باشد (Benoist et al. 1998).
1-3 مشخصات بیوشیمیایی[4]:
پروکلسیتونین یک پروتئین شامل 116 آمینواسید با وزن مولکولی 13KDa میباشد.
ساختمان پروکلسیتونین در پلاسما در طی التهاب جدا و مورد شناسایی قرار گرفت و مشخص گردید که بهوسیله سلولهای غده تیروئید و بهعنوان پیشساز کلسیتونین تولید میشود. توالی کلسیتونین شامل 32 آمینواسید میباشد که بین جایگاه 60 و 91 زنجــــیره پروکلسیتونین قرار دارند (Sikora et al. 2002).
تولید اصلی پروکلسیتونین توسط ژن CALC-I است که مسئول تولید پروکلسیتونین در سلولهای C غده تیروئید و در طی التهاب میباشد که تولید یک زنجیره آمینواسیدی از 141 آمینواسید بنام پریپروکلسیتونین میکند. توالی سیگنالینگ در N– ترمینال با خاصیت هیدروفوبیک باعث اتصال به اندوپلاسمیک رتیکولوم میشود؛ جائیکه بهوسیله اندوپپتیداز شکاف برمیدارد موجب تولید و زیاد شدن پروکلسیتونین میگردد.
در داخل سلولهای C پروکلسیتونین در قسمت توالی N– ترمینال و قطعه C ترمینال کاتاکالسین[5] باعث تولید کلسیتونین میشود (Roos et al. 1974).
کلسیتونین بعد از آزاد شدن به داخل جریان خون به فرم ساختمانی دوم و سوم خود تبدیل میشود. دو اسیدآمینه سیستئین باقیمانده در جایگاههای 1 و 7 یک پل دیسولفیدی و c –ترمینال پرولین هیدروکسیله میشوند. این دو ساختمان برای اتصال کلسیتونین به این رسپتورها ضروری هستند. قسمتی از همه پروکلسیتونین تولید شده از سلولهای C تبدیل به کلسیتونین شده بنابراین سطح مقدار پروکلسیتونین که در افراد سالم وارد جریان خون میشود قابل جدا شدن نیست.
در پلاسما آنزیمی که بتواند باعث شکسته شدن پروکلسیتونین در گردش شود وجود ندارد و این بدین معنی است که اگر پروکلسیتونین بهگونهای از پروتئولیزیز درونسلولی فرار کند و وارد جریان خون شود به مدت 30-25 ساعت بدون تغییر میماند در مقایسه با نیمهعمر کلسیتونین که 5-4 دقیقه است (Rosenfeld et al. 1981).
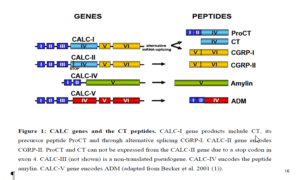
ژن پیشساز کلسیتونین CALC-I است که بر روی بازوی کوتاه کروزموم 11 قرار دارد و دارای 6 آکسون میباشد که دارای 4 توالی حملکننده کلسیتونین از 5 توالی (CGRP-I) ژن کلسیتونین وابسته به پپتید I هستند و ششمین هم بدون کد میباشد.
توالی CGRP-I بعد از نسخهبرداری از m-RNA جدا میشود (قبل از نسخهبرداری).
سه تا از ژنهای شناخته شده از خانواده کلسیتونین در نزدیکی و مجاورت CALC-I شناسایی شده است که به آنها CALC-II و CALC-IV گویند. از این 3 ژن وابسته تنها CALC-II دارای کدهای پروهورمون توالی کلسیتونین است.
بههرحال در طی پروسه درونسلولی و ترجمه، سلول مولکول CGRP-II را تولید میکند که فعالیت اصلی آن بهعنوان یک نروترانسمیتر است. ژن CALC-III یک سودوژن است که هیچ پروتئینی را کد نمیکند. ژن CALC-IV پروتئین آمیلین[6] را کد میکند (Maruna et al. 2000).
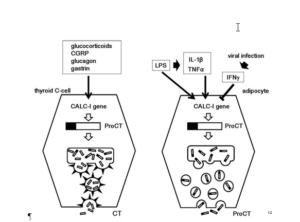
کنترل تولید تیروئید و پروسه التهاب پروکلسیتونین اساساً متفاوت است. سلولهای C غده تیروئید بر اثر افزایش سطح کلسیم و تعدادی دیگر از محرکها مثل گلوکوکورتیکوئیدها و CGRP و گلوکاگون و گاسترین افزایش مییابند.
سوماتواستاتین و ویتامین D تولید کلسیتونین را مهار میکنند. زیاد شدن پتاسیم[7] و یا بقیه محرکها نمیتوانند باعث افزایش سطح پروکلسیتونین در طی پروسه التهاب شوند.
تولید پروکلسیتونین در طی پروسه التهاب وابسته به تولید اندوتوکسین باکتریها و سیتوکینهای التهابی میباشد. دیده شده که سریعترین افزایش سطح پروکلسیتونین بعد از تزریق اندوتوکسین است که بیشترین خاصیت تحریککنندگی در آزاد شدن پروکلسیتونین در جریان خون را دارد
(Dandona et al. 1994) و بعد از آن فاکتور نکروزدهنده توموری این خاصیت را دارد. این تأثیرات بسیار شبیه عملکرد واسطههای شیمیایی مانند سیتوکینها است.
بعد از توکسین ابتدا TNF افزایش مییابد که پیک آن در 90 دقیقه میباشد. بدنـبال آن افزایش اینترلوکین-6 (IL-6) در 180 دقیقه میباشد. پروکلسیتونین تنها بعد از 6-3 ساعت واکنش داده و حداکثر آن در 8-6 ساعت است، درنتیجه بعد از ورود اندوتوکسین، ســطح پروکلسیتونین بعد از 48-12 ساعت به اوج خود میرسد. پروکلسیتونین بعد از افزایش فاکتور نکروزدهنده توموری[8] و اینترلوکین -6[9] افزایش مییابد، اما این افزایش قبل از افزایش پروتئین واکنشگر سی (CRP) میباشد (Assicot et al. 1993).
بعد از IL-6 ,IL-2 ,IL-1 ,TNF، مقدار پروکلسیتونین افزایش مییابد. این مکانیسمها کاملاً شناخته نشدهاند. بر اساس اطلاعات بدست آمده از حالات کلسیتونین این نظریه وجود دارد که سیتوکینها باعث مهار پروتئولیزیز مولکول پروکلسیتونین به کلسیتونین در اندوپلاسمیک رتیکولوم میشوند. بههرحال جایگاه تولید پروکلسیتونین و ورود آن به جریان خون متفاوت است و تنظیم آن نیز متفاوت میباشد.
برخلاف سیتوکینهایی مثل TNF و IL-6 که افزایش آنها در انواع مختلف التهابها غیراختصاصی است، پروکلسیتونین بهطور اختصاصی در پروسه التهابهای باکتریایی افزایش مییابد، بااینحال فاکتورهای بسیاری برای تولیــــد و آزاد شدن پروکلــــــــــــــــسیتونین درگیر میباشند (Muller et al. 2001) ,(Morgenthaler et al. 2003).
هفت سال بعد از اینکه نشان داده شد که پروکلسیتونین بهعنوان یک مارکر التهابی است تنها حدس و گمانهایی در جایگاه تولید و تنظیم پروکلسیتونین وجود دارد. شاید جایگاه تولید پروکلسیتونین در التهاب در سلولهای نرواندوکرین در ریهها و یا روده باشد.
بیان کدهای mRNA که در پروکلسیتونین دیده شده نشان میدهد که منوسیتها بهوسیله اندوتوکسین و یا سیتوکینهای التهابی تحریک میشوند (Oberhoffer et al. 1999). تولید پروکلسیتونین در جریان خون توسط سلولها هنوز بهوسیله مطالعات دیگر تأیید نشده است (Monneret et al. 1999).
در آزمایشهایی که بهوسیله نمونهگیری از جایگاههای مختلف بیماران در بعد از اعمال جراحی گرفته شده این گونه فرض میشود که پروکلسیتونین در امحاء و احشاء تولید میشود و سطح آن بهطور معنیداری بیشتر در نمونههایی دیده میشود که از وریدهای کبدی گرفته شده تا از جایگاههای دیگر بدن. درهرحال این نتایج میتواند این نظریه را مطرح کند که در طول عمل جراحی وقتیکه سد موکوزال دچار آسیب میشود اندوتوکسین میتواند وارد ورید پرتال و جریان خون شود.
1-7 اهمیت فیزیولوژیکی پروکلسیتونین:
مطالعات حاضر هیچ مدرکی را نشان نمیدهد که پروکلسیتونین موجود در پلاسما با رسپتورهای سلولی که برای کلسیتونین بهطور اختصاصی وجود دارد، باند میشود. فرضیات حاضر براساس مدلهای حیوانی و یا مطالعات آزمایشگاهی نشان میدهد که وظایف پروکلسیتونین در زمینههای زیر میباشد:
- متابولیسم کلسیم
- شبکه سیتوکینها و مدل سنتز نیتروژن اکسید
- تأثیرات ضددرد
براساس فرضیه، نقش و وظیفه پروکلسیتونین در متابولیسم کلسیم و فسفر و در پروسه سپسیس و عفونت خون بر اساس شباهت ساختمانی پروکلسیتونین و کلسیتونین میباشد.
توالی پروکلسیتونین مشابه توالی آمینواسیدهای کلسیتونین است اما شباهت در ساختمان اول پروتئین خطی کماهمیتتر از عوامل مختلف در ساختمان دوم و سوم میباشد. شکل کلسیتونین بهوسیله پلهای دیسولفیدی بین بقایای سیستئین در جایگاههای 1 و 7 مشخص میگردد. این باعث به وجود آمدن یک حلقه از 7 آمینواسید میشود که از طریق N– ترمینال با هیدروکسی پرولین از طریق –C ترمینال باند شده که با قدرت زیاد به رسپتور کلسیتونین باند میشود
(Sikora et al.2002).
این توضیحات و آزمایشها نشان میدهد که پروکلسیتونین پلاسما نمیتواند به رسپتورهای کلسیتونین متصل گردد. ارتباط بین پروکلسیتونین و متابولیسم کلسیم و فسفات اثبات نشده است. هرچند در بیماران دچار عفونت اغلب کمبود کلسیم دیده میشود اما ارتباط و هماهنگی بین سطح کلسیم و فسفات و پروکلسیتونین بهطور معنیداری دیده نمیشود.
سیتوکاینها وظیفه حساسی در تنظیم و تولید پروکلسیتونین و سطح پیشسازهای التهابی سیتوکاینها و هماهنگی معنیداری با بیماران دارای عفونت و پروکلسیتونین دارند.
پروکلسیتونین در سنتز نیتروژن اکسید مشابه سیتوکینهای پیشالتهابی نیز دخالت دارد.
در مکانیسم پروکلسیتونین مهار پروستاگلاندین G شبیه فعالیت داروهای غیراستروئیدی بوده و احتیاج به هورمون برای باند شدن به رسپتورهای اختصاصی سلولی ندارد.
نقش پروکلسیتونین بهعنوان یک فاکتور مثبت در پاسخهای التهابی مورد شک و تردید قرار دارد. (Aikawa et al. 2005)
1-8 سطح پروکلسیتونین در وضعیتهای مختلف پاتولوژیکی:
بیشترین سطح پلاسمای پروکلسیتونین در عفونت باکتریایی حاد و عفونت خون بدست آمده است. سطح پلاسمایی در عفونتهای سیستمیک افزایش مییابد (Nylen et al. 1997).
عفونتهای باکتریایی محدود مانند آبسهها مشخصاً باعث افزایش سطح پلاسمایی پروکلسیتونین نمیشود (Eberhard et al. 1997). مقدار واقعی پروکلسیتونین بهوسیله نوع وسعت التهاب مشخص میگردد.
پروکلسیتونین بهوسیله ویروسها و یا بیماریهای التهابی اتوایمیون و یا نئوپلاسمها افزایش نمییابد.
پروکلسیتونین میتـــــــواند بهاندازه 1000µg/L در عفونت باکتریایی شدید افزایش یابد (Benoist et al. 1998). مقدار نرمال پروکلسیتونین در پلاسما یا سرم از 0.5µg/l بیشتر نمیشود.
کاهش سطح پروکلسیتونین در انتهای فاز حاد یک التهاب خیلی زودتر از سیتوکینها رخ میدهد.
1-9 پروکلسیتونین چه موقعی باید اندازهگیری شود؟
در زمان بستری یا هر زمانی از بستری در بیمارستان که مشکوک به سپسیس باشیم.
1-10 مقادیر پروکلسیتونین را چگونه تفسیر کنیم؟
پروکلسیتونین پلاسما شاخصی از پاسخ التهابی بدن انسان به یک عفونت غیرویروسی است. افزایش پروکلسیتونین نشاندهنده قوی عفونت باکتریال با عوارض سیستمیک است. در مواردیکه پروکلسیتونین پلاسما کمتر از0.5ng/ml باشد، سپسیس باکتریال غیرمحتمل است. پروکلسیتونین بیش از 12ng/ml با افزایش احتمال وجود سپسیس باکتریال است، مگر اینکه موارد دیگر مثل تروماهای چندگانه، جراحی عمده، سوختگی شدید و یا در نوزاد باشد. وقتی مقادیر پروکلسیتونین بین 0/5 تا 2 باشد عفونت سیستمیک را نمیتوان رد کرد و میزان پروکلسیتونین در عرض 6 تا 24 ساعت باید تکرار شود.
یک راهنما برای تفسیر پروکلسیتونین سرم و پلاسما در جدول 2 آمده است.
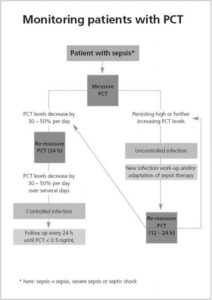
1-11 در چه مواقعی اندازهگیری پروکلسیتونین باید تکرار شود؟
- برای تشخیص افتراقی سپسیس، اگر غلظت پروکلسیتونین به میزان کمی افزایش یافته است (<12ng/ml) و یا اگر بیماری با علائم و نشانههای سپسیس تظاهر کرده است.
- در بیمارانی که در معرض خطر ایجاد سپسیس و اشکال عملکرد ارگان باشند.
- در بیماران با تشخیص سپسیس بهمنظور ارزیابی درما
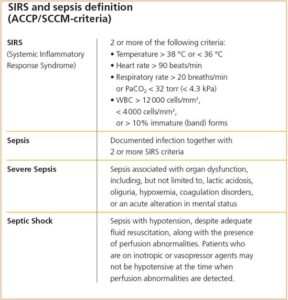
SIRS and Sepsis Definition
1-12 چگونگی استفاده از نتایج برای درمان بیماران
1-12-1 پروکلسیتونین کمتر از 0.5ng/ml
در بیمارانی که بیماریشان با معیارهای سندرم پاسخ التهابی سیستمیک[10]، علائم نارسایی ارگان یا کاهش بدون علت فشارخون تظاهر میکند پروکلسیتونین کمتر از ng/ml0.5 معمولاً تشخیص عفونت سیستمیک باکتریال را رد میکند و پزشک معالج در چنین مواردی باید به دنبال عللی غیر از سپسیس برای توجیه وضعیت بیمار باشد.
نکته مهم: میزان پروکلسیتونین کمتر از ng/ml0.5 مستقیماً یک عفونت را رد نمیکند چراکه عفونتهای موضعی (بدون علائم سیستمیک) ممکن است همراه با این موارد پائین باشد، در چنین مواردی انتخاب cut off پائینتر برای تصمیمگیری مفید است. همچنین اگر اندازهگیری
پروکلسیتونین خیلی زود پس از شروع عفونت انجام شده (معمولاً کمتر از 6 ساعت) نیز میتواند منجر به پائین بودن آن شود که باید در عرض 6 تا 24 ساعت بعد مجدداً بررسی شود.
1-12-2 پروکلسیتونین بین مقادیر 2/0-0/5 ng/ml
در بیماران مشکوک به سپسیس که مقادیر پروکلسیتونین قدری افزایش یافته است بیمار باید بهطور نزدیک پایش شده و مجدداً اندازهگیری پروکلسیتونین تا زمانی که نتوان عفونت سیستمیک را رد یا با روشهای میکروبیولوژیک تائید کرد، را برای بیمار انجام داد.
1-12-3 افزایش ادامهدار پروکلسیتونین به بیش از 2/0ng/ml:
افزایش پایدار پروکلسیتونین پلاسما به بیش از 2.0ng/ml نشاندهنده عدم کنترل روند عفونت است. چنین مواردی با پیشآگهی نامطلوب همراه بوده و برای مراقبت بیمار باید اصلاحاتی انجام شده، ارزیابیهای اضافی انجام پذیرفته یا حتی تغییر درمان انجام شود.
به الگوریتمهای نشاندهنده نحوه استفاده از پروکلسیتونین توجه کنید.
1-13 در چه مواردی افزایش پروکلسیتونین ممکن است مربوط به عفونت نباشد؟
شرایط محدودی برای افزایش پروکلسیتونین بدون علل عفونی شرح داده شده است. این شرایط شامل (اما نه محدود به) موارد زیر است:
روزهای اول پس از یک ترومای عمده، اعمال جراحی عمده، سوختگیهای شدید و داروهای دیگر که آزادسازی سیتوکاینهای پیشالتهابی را تحریک میکند، نوزادان با عمر کمتر از 48 ساعت.
بیماران با شوک کاردیوژنیک شدید یا طولانی، پروفیوژن غیرطبیعی و شدید ارگان و کانسر سلولهای کوچک ریه. بنابراین مقادیر پروکلسیتونین همیشه باید با توجه به وضعیت بالینی بیمار تفسیر گردد.
1-14 استفاده از پروکلسیتونین برای تشخیص سپسیس نوزادان
1-14-1 در کدام گروه از بیماران پروکلسیتونین باید اندازهگیری شود؟
در هر نوزادی که علائم بالینی نشاندهنده یک عفونت مادرزادی یا عفونتهای سیستمیک بیمارستانی باشد.
1-14-2 چه موقعی پروکلسیتونین باید اندازهگیری شود؟
هر موقع پس از زایمان که بر اساس تظاهرات بالینی و یا فاکتورهای خطر مشکوک به سپسیس باشیم.
1-14-3 مقادیر بالینی را چگونه تفسیر کنیم؟
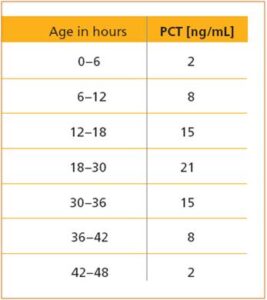
در طی دو روز اول پس از تولد مقدار پروکلسیتونین بهصورت فیزیولوژیک افزایش مییابد، بنابراین برای مقطع زمانی، مقادیر طبیعی خاص باید تعریف گردد. پروکلسیتونین بیش از این مقادیر نشاندهنده زودرس یک سپسیس نوزادی است (جدول 3).
با شروع روز سوم زندگی مقادیر طبیعی پروکلسیتونین نوزادان مشابه بزرگسالان میگردد، بنابراین در مقادیر کمتر از ng/ml0.5 شانس عفونت سیستمیک کم است. در مقادیر بیش از 2 ng/ml اگر علل دیگر افزایشدهنده رد شود عفونت سیستمیک خیلی محتمل است.
در مقادیر ng/ml 0.5-2عفونت سیستمیک را نمیتوان رد نمود و اگر علائم بالینی سپسیس وجود دارد پایش نزدیک بیمار باید موردتوجه قرار گیرد. این پایش شامل ارزیابی بالینی و اندازهگیری پیدرپی میزان پروکلسیتونین است که در عرض چند ساعت پس از سیستمیک شدن عفونت افزایش مییابد.
در مواردیکه میزان پروکلسیتونین بین ng/ml1-2 برای چند روز پایدار بماند ممکن است عفونت سیستمیک وجود داشته باشد.
در نوزادان شروع و سیر سپسیس ممکن است خیلی سریع باشد، در چنین مواردی القاء تولید و افزایش پروکلسیتونین ممکن است هنوز رخ نداده باشد که باید به علائم دیگر توجه نموده و اندازهگیری مجدد پروکلسیتونین در فواصل زمانی بعدی توصیه میشود.
1-14-4 در چه مواردی اندازهگیری پروکلسیتونین باید تکرار شود؟
در تمام مواردی که میزان پروکلسیتونین کم یا فقط مختصری (ng/ml<12) افزایش یافته باشد و وضعیت بالینی بیمار خوب ارزیابی نشده است، اندازهگیری مکرر پروکلسیتونین با فاصله زمانی 6 تا 12 ساعت در طی دو روز اول زندگی و در فواصل زمانی 12 تا 24 ساعت در نوزادان با عمر بیش از 2 روز توصیه شده است.
تکرار اندازهگیری پروکلسیتونین برای پایش پاسخ به درمان نوزاد مبتلا به سپسیس نیز توصیه شده است. مقادیر پروکلسیتونین افزایشیافته پایدار و یا افزاینده به بیش از مقدار طبیعی نشاندهنده وجود یک روند عفونی فعال است، درحالیکه کاهش ادامهدار پروکلسیتونین به میزان 30 تا 50 درصد در روز نشاندهنده بهبودی وضعیت بیمار است.
1-15 چگونه از اطلاعات موجود جهت اخذ تصمیم بالینی استفاده نماییم؟
در طی دو روز اول زندگی: افزایش میزان پروکلسیتونین به بیش از محدوده طبیعی پیشگوییکننده قوی برای حضور عفونت باکتریال سیستمیک بوده، درمان آنتیبیوتیکی زودرس را خاطرنشان میسازد.
مقادیر پائین (کمتر از محدوده طبیعی) احتمال وجود عفونت باکتریال را غیرمحتمل میسازد
از روز سوم زندگی به بعد: پروکلسیتونین ممکن است بهعنوان یک شاخص مفید مراقبت[11] در نوزادانی که در معرض خطر عفونتهای بیمارستانی شدید قرار دارند و نیز در آنهایی که علائم بالینی سپسیس تظاهر میکند، باشد. تا زمانی که عفونت سیستمیک را نتوان رد کرد نوزادانی که در معرض خطر سپتیک شدن هستند را باید بهدقت پایش کرد که این پایش هم پایش بالینی و هم ارزیابی مکرر پروکلسیتونین میباشد.
جدول زیر مقادیر طبیعی پروکلسیتونین نوزادان در طی 0 تا 48 ساعت پس از تولد را نشان میدهد.
سرم یا پلاسما (به شرط جمعآوری نمونه با نمک لیتیم هپارین) را میتوان مورد آزمایش قرار داد. توصیه میگردد نمونه خون را در لولههای بدون ضدانعقاد جمعآوری نموده و در اسرع وقت به آزمایشگاه منتقل نمود. در صورت جداسازی سرم میتوان آن را در 8-2 درجه سانتیگراد تا 48 ساعت قبل از انجام آزمایش نگهداری نمود.
2-1 کالپروتکتین[12]:
کالپروتکتین در ابتدا بهعنوان یک پروتئین آنتیباکتریال که در سیتوپلاسم از گرانولوسیتهای نوتروفیل تولید میشود شناخته شد (Dale et al. 1983)، سپس بهعنوان یک مارکر امیدبخش در التهابها و بهتر از آن بهعنوان یک ردیاب و یک ماده بر ضد ارگانیسمهای داخلی شناسایی گردید. (Sander et al. 1984) (Roth et al.2001)، بعلاوه این مولکول بهعنوان یک فاکتور جدید در سلولهای التهابی در واکنشهای سلولهای اندوتلیال موردتوجـــــــــــــه قرار گرفت (Srikrishna et al. 2001)، همچنین این مولکول در اعمال به دام انداختن مولکول روی (Zn) و تعادل فیزیولوژیکی این مولکول موردبررسی قرار گرفته است (Sampson et al. 2002).
مولکول کالپروتکتین دارای چندین عمل میباشد که بیشتر آنها وابسته به پروسه فعالیت التهابی شامل مکانیسمهای دفاع سلولی و یا پاسخ بهواسطه سلولهای کمکی[13] مثل پسزدن پیوندهای آلوگرافت و یا واکنشهای اتوایمیون میباشد.
2-2 ساختمان کالپروتکتین[14]:
کالپروتکتین در نوشتهها و مقالات دارای چندین معنای مترادف میباشد؛ ازجمله کمپلکسهای پروتئینی S100A8 و S100A9 و آنتیژن 27E10 و فاکتور پروتئینی مهارکننده ماکروفاژی MRP8/14 ,L1L ,L1H و کالگرانولین A/B.
این مولکول یک هترودایمر است که شامل زنجیره سبــــــــــــــک و سنگین میباشد (Bhardwaj et al. 1992) ,(Hunter and chazin. 1990) و از اعضای فامیل S-100 از پروتئینهایی که با کلسیم باند میشوند (Steinbakk et al. 1990). در حضور کلسیم، کمپلکس MRP8/14 که یک هترودایمر است میتواند به تترامرایز تبدیل شود (Strupat et al. 2000).
کالپروتکتین همچنین دارای یک ناحیه اتصال به عنصر روی (Zn) است که این ناحیه دارای ظرفیت و توانایی بالایی در اتصال به عنصر روی (Zn) و پروتئینهای S-100 میباشد و تمایلی به باند شدن با کلسیم (Ca) ندارد. هر دو پروتئین MRP14 و MRP8دارای یک پایه هیستیدین و توالی اتصال به روی (Zn) هستند که فعالیـــــت ضدباکتریایی کالپروتکتین را نشان میدهد
(Loomans et al. 199).
کالپروتکتین در ابتدا در نوتروفیلها و جمعیت وابسته به فاگوسیتهای تکهستهای یافته شد.
واکنشپذیری بهوسیله مونوکلنال آنتیبادی 27E10 نشان میدهد که کالپروتکتین دارای یک بیان ضعیف در دودمان سلول میلوئید و همچــــــــنین در اندوتلیال و اپیدرمال سلها میباشد (Zwadlo et al. 1986).
غلظت کالپروتکتین در نوتروفیلها بسیار زیاد و شامل نصف پروتئینهای سیـتوزول است (Hessian et al. 1993).
کالپروتکتین بهعــنوان یک ماده خـــــــارج ســلولی از نوتروفیــلهای تحریــــکشده (Boussac and carrin. 2000) و منوسیتها (Rammes et al. 1997) و یا پس از خراب شدن و یا مرگ آنها ترشح میشود (Voganatsi et al. 2001). بعد از مرگ سلول کالپروتکتین به داخل چرک و یا مایع آبسه به همراه مواد ضدمیکروبی دیگر آزاد میشود.
مطالعات ایمینوهیستوشیمی نشان میدهد که وجود کالپروتکتین نهتنها در نوتروفیلها و ماکروفاژهای فعال بافتی بلکه بر روی غشاء اپیتلیالهای پوششی غیرکراتینه و گاهی در توبولهای کلیه نیز دیده میشود.
بعضی از سلولهای پوششی موکوزال نیز کالپروتکتین را در ترکیبات پلاسمایی خود حمل میکنند (Brandtzaeg et al. 1987). نوع محلول کالپروتکتین در پلاسما و ادرار پیدا میشود (مقدار مرجع کمتر از 2mg/L در افراد سالم است) (Pillay et al. 1998). در ترشحات بدن بالاترین سطح کالپروتکتین در بزاق افراد دچار کاندیدیازیس و مایعات روده و مدفوع دیده میشود.
2-4 نقش فیزیولوژیکی کالپروتکتین غشایی[15]:
نقش کالپروتکتین در چسبیدن به سلولها در مهار مونوکلنال آنتیبادی 27E10 و چسبیدن منوسیتها به کلاژن و فیبرونکتین گزارش شده است، از طرف دیگر این پروتئینها و مواد خارج سلولی و کالپروتکتین به موازات آزاد شدن سیتوکینهای التهابی فاکتور نکروز توموری آلفا[16] و اینترلوکین 6[17] و تولید یونهای سوپراکسید افزایش مییابند (Mahnke et al. 1995).
اتصال کالپروتکتین به سلولهای میکروواسکولار اندوتلیال میتواند باعث افزایش آراشیدونیک اسید شود (Eue and Sorg. 2001).
2-5 نقش فیزیولوژیکی کالپروتکتین محلول:
فعالیت ضدمیکروبی و اپوپتوزیس کالپروتکتین بهصورت معکوس بهوسیله اضافه کردن روی (Zn) افزایش مییابد. با جدا شدن روی (Zn) از کالپروتکتین، MMPS (ماتریکس متالوپروتئیناز)، آنزیمهای وابسته به روی (Zn) و آنژیوژنزیس و التهاب، ترمیم زخمها، سرطان و تخریب بافتی مهار میشود. غلظت کالپروتکتین به مقدار µg/ml 50-250 باعث جلوگیری از رشد اشریشیاکلی، استافیلوکوکوس اورئوس و استافیلوکوکوس اپیدرمیدیس میگردد و همچنین غلظت µg/ml4-32 برای جلوگیری از رشد کاندیدا آلبیکنس کافی میباشد (Nisapakultorn et al. 2001).
هایپرکالپروتکتینمیا[18] نشان از کمبود روی (Zn) و بیماری التهابی مزمن دارد. بیماران جدید با عدم تنظیم در کالپروتکتین همراه با عود عفونتها، هایپراسپلینومگالی، آنمی و التهابهای سیستمیک گزارش شدهاند (Sampson et al. 2002).
نتیجه: کالپروتکتین یک پروتئین با وزن مولکولی 36KDa بوده و اولین بار در سال 1980 از گرانولوسیتها جدا شد که به آن پروتئین L1 نیز میگویند (Fagerhol et al. 1980). نام کالپروتکتین در اصل به دلیل اینکه این پروتئین با کلسیم باند شده و یک پروتئین ضدباکتری است عنوان گردید. در مقالات اسامی متفاوت و مشابهی مانند کمپلکس S100A8 و S100A9، پروتئینهای L1H, L1L و کالگرانولین A/B دارد (Dale et al. 1983).
کالپروتکتین یک کمپلکس از دو سابیونیت (S100A8, S100A9) از خانواده S100 از پروتئینهای باندشونده با کلسیم است (Kligman and Hilt. 1988). این پروتئین متشکل از دو زنجیره سنگین 14KDa و یک زنجیره سبک 8KDa که دارای پپتید غیرکووالانسی است، میباشد.
کالپروتکتین یک ماده مترشحه از نوتروفیلهای تحریکشده (Boussac and Grain. 2000) و منوسیتها است (Rammes et al. 1997) که نتیجه آزاد شدن از سلولهای خرابشده و مرده میباشد (Voganatsi et al. 1994). این ماده همچنین بر روی غشاء پوششی غیرکراتینه و گاهی از توبولهای کلیوی بدست میآید. سلولهای اپیتلیال تنها در زمان پروسه التهابی تولید کالپروتکتین میکنند. در طی حمله میکروبی از سلولهای اپیتلیال، کالپروتکتین به بیرون تولید و ترشح میشود. غلظت کالپروتکتین در روده بزرگ افراد سالم چندین برابر بیشتر از سرم و پلاسما است که این به دو دلیل است؛ اول مهاجرت نوتروفیلها به داخل محوطه لومن روده و آزاد شدن کالپروتکتین و دوم مجــاورت مداوم مولکولهای روده با باکتـــریهایی که بهصـــورت نرمال فلورا باعث تحریک سلولهای اپیتلیال شــــده و تولید کالپروتکــــــــــــــــــتین میکنند (Tibble and Bjarnoson. 2001).
کالپروتکتین به تغییرات میکروبی کولون مقاوم است. فرم محلول کالپروتکتین از پلاسمای سرم، ادرار، بزاق، مایعات روده و مدفوع قابل جدا شدن است.
2-7 عمل بیولوژیکی کالپروتکتین:
کالپروتکتین یک مولکول فعال با چندین وظیفه بیولوژیکی است؛ یکی از وظایف روشن آن نقش در تنظیم پروسه التهاب میباشد (Brun et al. 1994)، و همچنین دارای هر دو خاصیت ضدتکثیری (yui et al. 1997) و خاصیت ضدباکتریایی، قارچـــــــــــــی و کاندیدایی میباشـــــــــــــــــــــــــــد(Steinbakk et al. 1994), (Sohnle et al. 1991), (Hahn and Sohnle. 1995).
گفته شده که کالپروتکتین فعالیت ضدمیکروبی خود را بهوسیله 3 مکانیسم اجرا میکند:
اول: تأثیر مسـتقیم بـر روی میــکروارگانیســــمها بهوسیـــله بانــد شدن با روی (Zn) و مهــــار MMPS (ماتریکـــس متالوپروتئازها)، آنزیـــمهای وابـــسته به روی (Zn) که در تولید رگ بســـیار مهـــم هستـــند، ترمیم زخــــمها، التـــــهاب، سرطــــان و تخریـــب بافتی (Voganatsi et al. 2001) ,(Levy. 2000) ,(Fagerhol. 2000).
این فعالیتها مستقیماً در هر دو باکتریهای درون و بیرون سلولی بعد از فاگوسیتوزیس رخ میدهد (Levy. 2000).
دوم: کالپروتکتین مشابه یک فاکتور مهارکننده نوتروفیل (NIF) عمل میکند که باعث تحریک مهاجرت نوتروفیلها به ناحیه التهاب میشود (Tibble and Bjarnoson. 2001).
و در نهایت: کالپروتکتین توانایی فاگوسیتوز نوتروفیلها را افزایش میدهد. این سه عمل مخصوص و اختصاصی برای میکروبکشی و فعالـــــــــــــــــــــیت ضدقارچی نوتروفیلهاســت (Voganatsi et al. 2001) ,(Levy. 2000).
2-8 کالپروتکتین بهعنوان یک بیومارکر در التهاب:
همانطور که در بالا گفته شد کالپروتکتین از پلاسما، مایعات بدن و بافتی و مدفوع و بقیه مواد بیولوژیکی قابل جدا شدن میباشد. سطح پلاسمایی کالپروتکتین در انواع بیماریهای عفونی افزایش مییابد و میتواند باعث افتراق بین بیماریهای ویروسی از عفونتهای باکتریال شود. این سطح پلاسمایی هماهنگ با بیماریهای فعال و التهاب در مفاصل در بیماری روماتوئید آرتریت میباشد. مقدار پلاسمایی کالپروتکتین در افراد سالم
بین 0.6-0.1 mg/l و در بیــــــماریهای ویروسی 1.4-0.1 mg/l و در عفونتهای باکتریایی بین 11-0.6 mg/l میباشد (Poullis et al. 2003).
سطح سرمی کالپروتکتین میتواند یک مارکر خیلی حساس در تشخیص و افتراق با دیگر مارکرهای التهابی در یک عفونت باکتریایی سیســــــــــــتمیک در افراد دارای پیوند اعضاء باشد (Burkhardt et al. 2001).
کالپروتکتین بافتی تولیدشده توسط گرانولوسیتها، منوسیتها و سلولهای اپیتلیال پوششی میتوانند بهوسیله روشهای ایمینوفلورسنس و ایمینوهیستوشیمی شناسایی شوند.
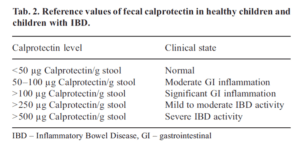
کالپروتکتین را میتوان در نمونههای مدفوع جدا و اندازهگیری کرد. افزایش کالپروتکتین در مدفوع بیماران با CRC (کلورکتال کانسر[19]) و [20]IBD و عفونتهای باکتریایی در روده کوچک اندازهگیری میگردد.
این مارکر در التهاب روده بزرگ مورد استفاده قرار میگیرد، زیرا بهطور قابلملاحظهای مقاوم به تغییرات پروتئولیتیک با حضور کلسیم میباشد (Fagerhol. 1996).
کالپروتکتین نشاندهنده فعالیت بیماری در IBD بوده و میتواند در پیگیری و مونیتورینگ پاســخهــای بیــماران بـه درمــان و عــود بیــماری مــورد استـــــــــــفاده قرار گیرد (Aadland and Fagerhol 2002).
در بیماران با IBD، سطح بالایی از کالپروتکتین در هر دو گروه بزرگسال و کودکان تشخیص داده شده است (Konikoff and Denson. 2006).
آزاد شدن گیرنده و بیان شدن آنها بر روی سلولهای میلوئید[21] (TREM-1) که اخیراً کشف شده یکی از اعضای سوپرفامیلی ایمنوگلوبولین و رسپتورهایی است که بر روی گرانولوسیتهای پلیمورفونوکلئر و منوسیتهای بالغ بیان میشود. عفونتهای باکتریایی و یا قارچی باعث افزایش بیان اینها میگردد.
3-2 (فرم محلول ترم -1)[22]:
sTERM-1 فرم محلول TERM-1 است که میتواند به داخل مایعات بدن آزاد شود و باعث تنظیم بیان TREM-1 گردد (Bouehon, et al. 2001).
نتایج تحقیقات نشان داده که افزایش سطح sTERM-1 در مایعات بدن در نمونههای گرفته شده در حالات و بیماریهای زیر افزایش مییابد:
عفونت نمونیای خون، آرتـــــــــــریت عفونی، مننژیت، پریتونیت، (Collins CE, et al. 2009) (Liu CL et al. 2007) ,(Gibot s , et al. 2004) ,(Kusaniovic JD, et al. 2010) (Determann RM, et al. 2006). اینها نشان میدهند که sTERM-1 یک شاخص گرانبها برای افتراق بین بیماریهای عفونی و غیرعفونی میباشد، همچنین مشخص شده که شوک سیستمیک (عفونی) در بیماران باعث افزایش سطح سرمی sTERM-1 در بیماریهای شدید عفونی میگردد. همچنین sTERM-1 یک راهنمای خوب در نشان دادن بیماری تشخیص نقص ارگانها میباشد(Dimopoulou, et al. 2009) (Gibot S, et al. 2004) (SOFA)[23]
با توجه به پیشآگهی عفونت خون، تغییرات سطح sTERM-1 میتواند یک هشدار در مورد زندگی یا مرگ بیماران باشد (Gibot, et al. 2005) ,(Zhang j, et al. 2011).
sTERM-1 موجود در ادرار بسیار حساستر از تعداد گلبولهای سفید[24] و مقدار سیرآکتیو پروتئین[25] خون و پروکلسیتونین در شناسایی اولیه سپسیس بهعنوان یک عامل پیشآگهیدهنده میباشد. همچنین sTERM-1 میتواند هشدار اولیه را در صدمات حاد کلیوی[26] (AKI) که بعد از عفونت خون میتواند ایجاد شود، بدهد (Sulx, et al. 2011).
پاسخهای ایمنی ذاتی علیه عفونتها اولین قدم از دفاع میزبان است که نشان میدهد که محدوده وسیعی از پاتوژنها و انواع سلولهای مختلف و پروتئینهای گوناگون در این راه با یکدیگر هماهنگی و فعالیت میکنند. بزرگترین فعالها در این نوع ایمنی شامل فاگوسیتکنندههای حرفهای (نوتروفیلها، منوسیتها و ماکروفاژها) و سلولهای طبیعی کشنده[27] میباشند.
این سلولها نشاندهنده گیرندههای سطحی سلول گوناگونی هستند که یکی از پاتوژنها و یا مولکولهای داخلی را شناسایی میکنند که طی آسیب بافتی حمل میشوند.
توللایک رسپتورها[28] بهصورت مستقیم مولکولهای مشترکی که در بین پاتوژنها مشترک میباشند را شـناسایی میکنـــــــــــــــــــــند (مانند LPS باکتریها). (Hoffman. 1999) (Kimbrell and Beulter. 2001), (Medzhitov. 2001),.
بسیاری از گیرندههای سلولهای کشنده طبیعی (NK) وابسته به تبدیلکنندههای غشاء مثل DAP12 میباشند (Lanier and Bakker, 2000).
TERM-1 انسانی یک گلیکوپروتئین با وزن مولکولی 30KDa و از سوپرفامیلی ایمنوگلوبولینها میباشد. این مولکول یک ایمنوگلوبولین تکی خارج سلولی و V-Type (از نوع v) است که دارای ناحیهای است که از غشاء میگذرد. این مولکول مشابه رسپتور NKP44 سلول NK و رسپتور CMRF-35 لکوسیتها (Jackson et al. 1992) و رسپتور پلیایمینوگلوبین میباشد.
TREM-1 در مرحله آخر افتراق سلول میلوئید بیان میشود (Gingras et al. 2002) و به مولکول DAP12 برای سیگنالینگ و اعمال خود احتیاج دارد (Bouchon et al. 2002).
3-4 عملکرد TREM-1 در التهاب حاد:
با استفاده از مونوکلنال آنتیبادیهای اختصاصی (MAb) نشان داده شده که TREM-1 در انسان بر روی نوتروفیلهای خون و منوسیتها CD14 و ماکـــــــــــــروفاژها حمل میشود. (Bouchon et al. 2000). این گستردگی و پراکندگی در سلولها و بافتها نشان میدهد که TREM-1 وظایفی در مقابل التهابها و عفونتها دارد.
درواقع TREM-1 در عفونتها بهوسیله پوست انسان و غدد لنفاوی که به علت باکتریهای گرم مثبت و گرم منفی و قارچها ایجاد میگردد، تولید میشود (Bouchon et al. 2001). در این خسارات TREM-1 نهتنها از نوتروفیلها تراوش مییابد، بلکه سلولهای اپیتلوئید و منوسیتهای اطراف واکنشهای گرانولوماتوز نیز دیده میشوند.
برعکس بیان و ترشح TREM-1 در عفونتهای گرانالوماتوز ناشی از مایکوباکتریوم توبرکلوزیس و گرانولوماهای با علل دیگر بسیار ضعیف است و یا اصلاً وجود ندارد؛ بنابراین شناسایی TREM-1 بهعنوان یک پروتئین محلول و یا یک پروتئین سطح سلولی که درنتیجه یک التهاب و یا آسیب بافتی به مقدار زیاد بیان میشود، بسیار امیدبخش میباشد (Bouchon et al. 2002). نقش TREM-1 بهعنوان یک افزاینده التهاب در آزمایشگاه در مدلهای حیوانی دارای عفونت باکتریایی تأیید شده است (Bouchon et al. 2001).
يك مولكول ترانسممبران است كه تاكنون فقط روي غشاء فاگوسيتهاي تکهستهای كشف شده است. اين پروتئين يك گيرنده براي هموگلوبين و آهن در داخل بدن است كه توانايي شناسايي اختصاصی كمپلكس هاپتوگلوبولين- هموگلوبين را دارد. مطالعات و تحقيقات چند سال اخير نشان داده است كه CD163 بيان و تنظيم مولكولهاي ضدالتهابی مثل اینترلوكين 10 (IL-10) و همواكسـيژناز– 1 (HO-1) را برعهــــــــــــــده دارد. (Graversen, et al. 2002) (Moestrup et al. 2004)
از مولكولهاي CD163 غـشاء سلـــولهاي تکهستهای که كنده شده بدسـت ميآيد (Moestrup, et al. 2004). سطح خوني اين مولكول بهعنوان يك عامل پیشآگهی براي بسياري از بيماريهاي التهابي و بهعنوان يك عامل شناسايي و بيوماركر در بيماريهاي التهابي مورد استفاده قرار ميگيرد. مطالعات آزمايشگاهي اين مسئله را تأييد ميكنند که سطح sCD163 در سرم افراد داراي عفونت شديد خون قبل از سطح پروکلسیتونین و پروتئین واکنشگرC- افزايش را نشان ميدهد. sCD163 همچنين داراي مزايايي در يك مونيتورينگ پويا در وخامت عفونت خون است و يك پيشآگهي مناسب جهت استفاده در موارد كلينيكي را دارا ميباشد. مطالعات نشان داده است كه sTREM-1 و sCD163 و بقيه پارامترها در عفونت خون مورد استفاده قرار گرفته است. امروزه در بيماران بستري در بخشهاي ICU سطح بالايي از sTREM و sCD163 و PCT و CRP در گروه سندرم پاسخهاي التهابي سیستمیک (SIRS) ديده شده است.
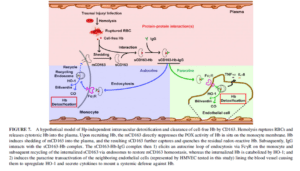
بـــدنبال ليزشدن گلبولهای قرمز در طي موارد كلينيكي متفاوت مثل آنمي هموليتيك (Sadrzadeh et al. 1997)، التهابها، عفونتها (Skaar et al. 2004) و صدمات بافتي و يا انتقال خون، مولكولهاي وابسته به آسيبهاي داخلي مثل هموگلوبين به داخل پلاسما آزاد ميشوند. بهطورقطع اين مسئله شناخته شده است كه چگونه سيستم ايمني در برابر اين هموگلوبين سيتوتوكسيك دفاع ميكند (Alayash. 2001). يك راه ميانبر جهت شناسايي و دفع و سمزدایی Hb (هموگلوبين) بهوسیله رســپتور CD163 موجود بر روي منوسیتها شناخته شده است (Puppo and Halliwell. 1988). دو مكانيسم كارآمد جهت سمزدايي و پاك كردن هموگلوبين وجود دارد:
- روش مستقيم سركوب بهوسیله CD163 و فعاليت هموگلوبين– سودوپروكسيداز
- روش فعال شدن سلولهاي اندوتليال بهوسیله آزاد كردن سلولهاي CD163 محلول كه باعث سمزدايي و پاك شدن باقيمانده Hb ميشود.
نشان داده شده است كه CD163 محلول و IgG با هموگلوبين آزاد در پلاسما ايجاد يك كمپلكس كرده كه بهوسیله منوسیتها اندوسيتوز ميگردد. بدنبال آن CD163 محلول دوباره به غشاء منوسیت بازگشته و مستقر ميگردد. بهوسیله آزمایشها نشان داده شد كه CD163 محلول و IgG بهوسیله يك حملکننده، بقيه Hb (هموگلوبين) را به نقطه دورتري به سلولهاي اندوتليال حمل میکنند و اين يافتهها نشان ميدهد كه CD163 و IgG بهواسطه منوسیتها و سلولهاي اندوتليال بهوسیله اين دو مكانيسم باعث دفاع در برابر سمزدايي آن ميشوند.
5-1 ميكرو آر-اِن–آ[29]:
ميكرو آر-اِن–آها (miRNAs) قطعات كوچك غيركدكننده داخلي از RNA هستند كه طول آنها 22 نوكلئوتيد ميباشد (Ambors. 2004). آنها نقش بيولوژيكي مهمي در مهار و يا بيان mRNA دارند (Krutzfeldt et al.2006). بعضي از miRNAs بهطور وسيع از بافتها توليد ميشوند و در مراحل اختصاصي وظيفه تنظيمي و اختصاصي در اعمال بافتي دارند (Ztheridge et al. 2014). يكي از اين miRNAs اختصاصي كبد به نام miR-122 است كه در متابوليــــــــــــــسم چربي و كلسترول كه هر دو از اعمال مهم كبد ميباشند، كاربرد دارد (Bolmeson et al. 2011)؛ (Fernandez- Hernando et al.2011). اين miRNAs بهعنوان يك بيوماركر و يا راهنماي درماني براي بسياري از بيماريها هستند؛ بهعنـــوان مثـال miR-122 در ويــــــروس هپـــاتيت C و همانــــندســــازي مـــــــــوردنیاز است miRNAs .(Zhang et al. 2010)ها در بسياري از پروسههای فيزيكي و بيولوژيكي نقش دارند بنابراین تغيير سطح بيان miRNA و ارتباط آنها با حضور و وسعت بيماري، نقش مهم آنهاست. تعداد قابلتوجهی از miRNAها در بيرون از سلولها و مايعات بدن ديده شده است. اين miRNAsهاي آزاد موجود در مايعات بدن در شرايط سخت مثل جوشيدن، pH بالا و پائين و در چنديـــن بار يخزدن و آبشدن مقاوم هستند (Mitchell et al. 2008). در حال حاضر 2 نظريه براي وجود miRNAsها در اين گردش وجود دارد؛ يك نظريه آزاد شدن غيرفعال و وجود آنها در طي صــدمه بافتي است؛ بهطور مثال miRNA-216a كه بهطور متفاوت در صدمه بافتي در پلاســــــــــــــــــــما ديده ميشود (Kong et al. 2010) و miR-122 كه بهعنوان يك بيوماركر در بيماري كبدي وجود دارد (Wang et al. 2009). ميكرو آر-اِن–آها داراي قسمتهاي كوچكي هستند كه باعث ميشوند اين مولکولها در مقابل فعاليت آنزيمي RNase محافظت شوند. اخيراً نشان داده شده mRNA و miRNA ميتوانند بهوسیله ميكرووزیکولهایی بين سلولها در رفتوآمد بوده و انتقال یابند (Valdi et al. 2007). اين قســـمتهاي كوچـــــك كه از غشاء پلاسمايي سلول گرفته شدهاند به خارج از فضاي سلولي و به داخل جريان خـــــــــون آزاد ميشوند (VanNiel et al. 2006)، (Coby et al. 2005). اين ميكرووزيكلها از سلولهاي مختلفي مشتق شدهاند مثل رتيكولوسيتها، دندرتيكسلها و سلولهاي B و T و ماستسلها (Brase et al. 2010). در خون محيطي دوسوم از اين ميكرووزیکولها از پلاکتها منشأ گرفتهاند. ميكرووزيكلهايي كه از پلاکتها مشتق شدهاند نقــــــــــــــــــش در رگزایی و متاستاز و گسترش سرطانها دارند (Janouska- Wieczorek et al. 2005). ميكرووزيكلهاي مشتق شده از پلاکتها باعث افزايش فعاليتهاي ايمني و تنظيم بيان ژن در هماتوپویتيك و اندوتليال و سلولهاي منوسیت ميگردند (Setzer et al. 2006), (Majka et al. 2007). در بيماران دچار عفونت خون ميكرووزيكلهاي مشتق شده از پلاکتها بهطور قابلملاحظهاي افزايش يافته است (janszeuski et al. 2004)، بااینوجود اينكه به چه مقدار اين وزیکولها در اين بيماريها دچار تغيير ميشوند ناشناخته است.
5-2 ما چه مقدار درباره miRNAsها بهعنوان بيوماركر در عفونت خون ميدانيم؟
– miRNAsهاي در گردش اخيراً بهعنوان يك بيوماركر در عفونت خون مورد شناسايي قرار گرفتهاند. اولين miRNAs كه در بيماران با عفونت خون بهعنـــــوان يك ماركر شناسايي شد miR-150 بود كه بهوسیله تكنيك ميكرواري با يك تفاوت معنيدار در بين گلبولهای سفيد ميان بيماران و گروه كنترل مورد ارزيابي قرار گرفت. بههرحال ديده شده كه ژنهای كدكننده تومور نكروزينگ فاكتور آلفا (TNF-α) و (IL-10) اينترلوكين 10 و اينتـــرلوكين 18 (IL-18) با miR-150 داراي توالي مكمل ميباشند (Vasilescu and Rossi et al. 2009). اين يافتهها نشان ميدهد كه miR-150 با بعضي از عدم كارآييهای سيستم ايمني در بيماران داراي عفونت خون و تصريح اينكه اين مولكول ميتواند نشاندهنده توان پاتولوژيكي بيماري عفونت خون باشد هماهنگي دارد.
– عفونت خون يا سپسيس يك بيماري پيچيده است كه ارگانها و بافتهاي متفاوتي را درگير ميكند. در يك غربالگري ساده در miRNAsهاي مختلف كه از لكوسيتها بيان ميشود شايد بسياري از miRNAsهاي مترشحه از انواع سلولهاي ديگر مخفي بمانند، بنابراين روشهاي ژنتيكي وسيعي را ميتوان در غربالگري و تفاوت ميان miRNAsهاي مختلف در بين گروه بيماران بهبودیافته و يا مرده در اثر سپسیس بكار برد؛ مثلاً miR-297 در بيماران بهبودیافته بسيار ديده شده درحالیکه برعكس miR-574-5P بيشتر از بيماران مرده جدا گردیده است، بنابراين بهطور خلاصه از غربالگري miRNAsهاي موجود در بيماران دچار عفونت خون و جدا کردن يكي از اين دو نوع miRNA يعني miR-297 و miR-574-5P از بيماران شايد بتوان به شناسايي و پیشآگهی و تهيه يك هدف درماني در بيماران رسيد.
– تشخيص بيوماركرها در عفونت خون و سطح اين بيوماركرها نهتنها در افتراق بين بيماران داراي عفونت و گروه كنترل کاربرد دارد، بلكه بين بيماران دارای عفونت خون و بيماران SIRS ميتواند افتراق ايجاد كند.
– miR-15a و miR-16 نيز جديداً بهعنوان بيوماركر در تشخيص عفونت شناسايي شدهاند. سطح اين دو miRNA در بيماران داراي عفونت خون و يا بيماران SIRS بهصورت معنيداري نسبت به افراد نرمال و شاهد داراي سطح بالاتري است (Wang et al. 2012). اين دو miRNA بهعنوان سركوبگر تومور شناسایی و در بسياري از ســـــــــــــــــــــــــــــرطانها ديده شدهاند. (Bandi and Vassella. 2011).
– در بيماران داراي عفونت خون، زمان تشخيص و درمان سريع از فاكتورهاي بسيار مهم در پیشآگهی است. miRNAsهاي جديد و شناسايي آنها بهعنوان تنظيمكنندههاي اصلي سيستم ايمني و بيان آنها در سيستم گردش خون ميتواند در تشخيص و بهعنوان بيوماركرهاي عفونت مورد شناسايي قرار گيرد. اگرچه مكانيسم عمل اين مولکولها بهطور كامل شناسايي نشدهاند اما موارد كلينيكي كاملاً آنها را تأييد كردهاند.
6-1 پلیمورفیسم تکنوکلئوتیدی[30]:
پليمورفيسم تكنوكلئوتيد (SNP) بيشترين شكل ژنتيكي پايدار از شكلهاي مختلف ژنتيكي يك جمعيت است، بنابراين SNPsها بيانهاي مختلف تواليهاي جانشين (اللها) يك جفت باز از DNA در افراد نرمال يك جمعيت است. پليمورفيسمها و جهشها در ناحيه غيركدكننده احتمالاً تولیدکننده اثرات شديد در فنوتيپ ميباشند (prucha et al. 2008).
SNPsها به 2 گروه اصلي تقسيم ميشوند؛SNPs هاي پيوندي و SNPsهاي عملكردي.
SNPsهاي پيوندي (كه معمولاً به آنها SNPsهاي نشانگر هم ميگويند) جايگاهشان در بيرون از ژنها بوده و داراي عملكرد پروتئيني نميباشند.
SNPsهاي عملكردي داراي فعاليت پروتئيني هماهنگ با يك بيماري و يا در افزايش پاسخ به درمان ميباشند. SNPsهاي عملكردي به دو شكل SNPsهاي كدكننده و SNPsهاي غيركدكننده تقسيم ميشوند [31](cSNPs) و (nsSNPs)[32].
SNPs کُدکننده: در ناحيه كدكننده از يك ژن قرار دارند كه ميتواند توالي يك ژن تولیدکننده پروتئين را تغيير دهد.
nsSNPs: كد توالي اسيدهاي آمينه پروتئينها را تغيير داده و باعث تغيير در ساختمان و عمل پروتئينها ميگردد و كانديداي خوبي براي تغيير آللهاي بيماري ميگردد (jegga et al. 2007). بيشترين SNPsها در بيرون از ناحيه توالي كدكننده ميباشند.
6-3 SNPs بهعنوان يك بيوماركر در عفونت خون:
شناسايي ژنتيكي متفاوت در مورد توللايك رسپتورها (TLRs) و سيتوكينهاي پيشالتهابی نشانههاي باارزشي در افزايش گوناگوني ژنتيكي در پاسخ به عفونت باكتريايي را نشان ميدهند. تجزيه و تحليل گوناگوني ژنها و ارتباط آن در پاسخ به عفونتها ميتواند نشان از شناسايي ژنهای جديد در تشخيص و درمان دهد.
TLRs: اين رسپتورها بهوسیله ماكروفاژها، سلولهاي دندرتيك، نوتروفيلها و ديگر جمعيتهاي سلولي بيان ميشوند. TLRsها يك نقش محوري در پاسخهاي ايمني ذاتي به آنتیژنهای عفونتهاي باكتريايي بازي ميكنند TLR4 .(Leulier and Lemaitre. 2008) يك دليل قطعي در شناسايي ليپوپليساكاريد ميباشد و TLR2 يك رسپتور ضروري در شناسايي باکتریهای گرم مثبت ميباشد (Martin. 2000; opal & Huber. 2002).
در تحقيقات انجامشده بر روي انســـــــــــــــان در آمريكا با دو جهش در TLR روبرو شدند؛ دو جهشي هستند كه در TRL4 تايپ وحشي در پاسخ به استنشاق سموم ديده شده است. دو جهش تعويض اسیدآمینه
بهطور مشخص باعث ميشود كه سطح NF-kB[33] در تحريك ليپوپليساكاريد و سلولهاي T کمکی-1 (Th-1) كاهش يابد. پليمورفيسم 299/399 باعث كاهش سطح اینترلوکین یک- آ (IL-1a) در اثر اندوتوكسين در انسانها ميشود (Arbour et al. 2000).
در بيماران با شوك سپتيك در اثر عفونت با باکتریهای گرم منفي، درصد بالايي از اين بيماران با اللهاي TLR4 ديده شدهاند (Lorenz et al. 2002)، بنابراين پليمورفيسم TLR4 299 وابسته به يك عفونت خون شديد، شوك سپتيك و درصد بالاي مرگومیر در بيماران با سپيس و يا بيماران SIRS است (Lorenz and Child et al. 2003) ,(Barber et al. 2004)
بعضي مطالعات نشان داده است كه ميتواند نشاندهنده استعداد عفونت بهوسیله باکتریهای گرم مثبت و يا عفونت بهوسیله توبركلوزيس و يا لپروسي باشد. (Ben-Ali et al. 2004) ;(Ogus et al.2004).
سايتوكاینها پروتئينها و يا گليكوپروتئينهايي با وزن مولكولي كم بوده كه توسط گلبولهای سفيد يا ديگر سلولها در پاسخ به تعدادي از محركها ترشح ميشوند. اين پروتئينها در گسترش سلولهاي ايمني مؤثر شركت داشته و تعدادي از آنها نيز اعمال خود را بهصورت مستقيم انجام ميدهند (Levi. et al.2000).
7-1 TNF-α (فاكتور نكروزدهنده تومور– آلفا):
TNF-α جزء گروه سايتوكاینها است كه باعث مرگ سلولي يا آپوپتوزيس ميگــــردد. TNF واسطه اصلي پاسخ التهابي حاد در برابر باکتـــریهای گرم منفي و ساير ميكروبهـــاي عفونتزا است و با بسياري از عــوارض سیـــسـتميك عفــــونتهاي شديد مرتـــــــــــــــــــــبط است .(Locksley et al. 2001) ;(O’shea et al. 2002)
7-2 توليد و ساختمان گيرندهها:
ماكروفاژهاي تکهستهای فعالشده منشأ اصلي توليد TNF هستند، البته سلولهاي تحریکشده با آنتيژن، سلولهاي كشنده طبيعي[34] و ماستسلها[35] نيز ميتوانند اين سيتوكين را توليد كنند. قویترین محرك توليد TNF توسط ماكروفاژها، لیپوپلیساکارید است و در عفونتهاي باكتريايي گرم منفي كه (ليپوپليساكاريد) آزاد ميشود ممكن است مقادير زيادي از اين سيتوكينها توليد شود. اینترفرونهاي گاماي سنتزشده توسط سلولهاي T و كشنده طبيعي (NK) اثر تقويتي بر روي توليد TNF توسط ماكروفاژهاي تحريك شده با ليپوپليساكاريد (LPS) دارند. بیگانهخوارهای تکهستهای TNF را بهصورت يك پروتئين غشايي نوع دو و غيرگليكوزيله ميسازند كه داراي يك انتهاي آميني داخل سلولي و يك انتهاي كربوكسيلي بزرگ در خارج از سلول است. جايگاههاي اتصال به گيرنده در قاعده هرم قرار دارد و در نتيجه TNF ميتواند همزمان به بيش از يك گيرنده متصل شود. (Locksley et al. 2001) ,(O’shea et al.2002).
عملكرد فيزيولوژيك اصلي TNF فراخواني منوسیتها و نوتروفيلها به جايگاههاي عفوني و فعال كردن اين سلولها بهمنظور از بين بردن ميكروبها است. TNF از طريق اثرات مختلفي كه بر روي سلولهاي اندوتليال رگی و لكوسیتي دارد اين اعمال را انجام ميدهد.
1) TNF سلولهاي اندوتليال رگي را وادار به بيان مولكولهاي چسبنده ميكند، اين مولکولها باعث چسبندگي نوتروفيلها و سپس منوسیتها و لنفوسيتها به سطح اندوتليوم ميشوند. مهمترین اين مولكولهاي چسبنده اینتگرینهای لكوسيتي و سلكتينهاي اندوتليال ميباشد.
2) TNF سلولهاي اندوتليال و ماكروفاژها را وادار به ترشح كموكاين ميكند كه باعث كموتاكسي و فراخواني لكوسيتها ميشود، بهعلاوه ماكروفاژهاي تکهستهای را وادار به ترشح IL-1 ميكند كه اثراتي بسيار شبيه به خود TNF دارد (Locksley et al.2001).
در عفونتهاي شديد مقدار زيادي TNF توليد ميشود كه منجر به عوارض سيستميك باليني و پاتولوژيك ميشود. درصورتیکه محرك توليد TNF بهاندازه كافي قوي باشد آنقدر سيتوكين توليد ميكند كه وارد جريان خون ميشود و بهعنوان هورموني اندوكرين در بافتهاي دوردست نيز اعمال اثر ميكند (O’shea et al. 2002).
7-4 اثرات سيستميك اصلي TNF عبارتند از:
1) TNF با تأثير بر هيپوتالاموس باعث ايجاد تب ميشود و به همين دليل است كه آن را مادهي تبزاي داخلي ناميدهاند. TNF با افزايش سنتز پروستاگلندينها در سلولهاي هيپوتالاموس باعث ايجاد تب ميگردد. مواد بازدارندهي سنتز پروستاگلندينها ازجمله آسپرين با ممانعت از اين عملكرد TNF يا IL-1 باعث كاهش تب ميشوند.
2) TNF با تأثير بر روي هپاتوسيتها آنها را وادار به سنتز پروتئينهاي سرمي خاصي از قبيل آميلوئيد A و فيبرينوژن ميكند و مجموعه پروتئينهاي پلاسمايي ساختهشده توسط هپاتوسيتها تحتتأثير TNF و دو سيتوكاين ايمني ذاتي ديگر يعني IL-1 و IL-6 پاسخ فاز حاد در برابر محركهاي التهابي را تشكيل ميدهد.
3) توليد TNF در درازمدت منجر به بروز تغييرات متابوليك و لاغري (كاشكسي) ميشود. اين لاغري حالتي است كه توأم با از دست رفتن سلولهاي ماهيچهاي و چربي ميشود. علت عمده اين امر بياشتهايي ایجادشده توسط TNF است. اين ماده مانع از سنتز آنزيم لیپوپروتئین ليپاز نيز ميشود. اين آنزيم براي آزاد شدن اسيدهاي چرب از ليپوپروتئينهاي موجود در گردش خون لازم است تا براي بافتها قابلاستفاده باشند.
4) TNF باعث ايجاد ترمبوز داخل رگي ميشود كه عمدتاً ناشي از زايل شدن خاصيت طبيعي ضدانعقادي اندوتليوم است. اين سيتوكاين سلولهاي اندوتليوم را وادار به بيان فاكتور بافتي ميكند. اين ماده بهشدت خاصيت انعقادي دارد. فعال شدن نوتروفيلها باعث تشديد تغييرات اندوتليال و انسداد عروقي ميشود. توانايي اين ماده در نكروزه كردن تومورها وجهتسمیه آن نيز هست و عمدتاً ناشي از ترمبوز رگهاي خوني تومور است .(Kovar et al. 2007) ,(Teuffel. et al. 2010)
IL-1 بهمثابه ماده تبزای درونی عمل میکند و تمام فعالیتهای بیولوژیکی اندوتوکسینها که شامل تب، نوتروفیلی، تحریک سیستم ایمنی و فعال کردن کمپلمان میباشد را تقلید میکند. اینترلوکین 1 با تأثیر بر روی مرکز تنظیم حرارت در هیپوتالاموس قدامی موجب افزایش سنتز پروستاگلندینها میشود. این پدیده منجر به بالارفتن نقطه ثابت درجه حرارت میگردد. تب باعث افزایش تکثیر سلولهای T و سنتز ایمنوگلوبولینها میشود، همچنین مسیر آلترناتیو سیستم کمپلمان نیز در درجه حرارت 39 درجه سانتیگراد (سلسیوس) در حد مطلوب عمل مینماید. از طرفی دیگر تب باعث کاهش تکثیر تعدادی از باکتریها و ویروسها میشود.
– علاوه بر اثراتی که اینترلوکین-1 بر روی سیستم ایمنی و عصبی دارد، این ماده بر روی پدیدههای متابولیکی بدن هم تأثیرات عمیقی برجا میگذارد (Arcaroli and Silva. 2006).
IL-1 با تأثیر بر روی عضلات اسکلتی، کاتابولیسم پروتئینها را افزایش داده که درنتیجه مقدار زیادی اسیدهای آمینه ایجاد میشوند که باعث میشوند لنفوسیتهای B سنتز ایمنوگلوبولینها و هپاتوسیتها سنتز پروتئینها بهویژه پروتئینهای فاز حاد را افزایش دهند. IL-1 همچنین باعث تولید نوتروفیلها و پلاکت از مغز استخوان میگردد (Ma et al. 2002).
IL-10 یک سیتوکاین تنظیمکننده سیستم ایمنی است که توسط سلولهای مختلفی ازجمله منوسیتها، ماکروفاژها، سلولهای B، سلولهای تی + CD8+ , CD4 تولید میشود. نشان داده شده است که IL-10 میتواند بهطور مستقیم از تولید سیتوکاینها توسط سلولهای T در in vitro جلوگیری کند، علاوه بر این میتواند مانع از بلوغ سلولهای دندریتیک شود، بدین ترتیب فعال کردن سلولهای T و سایر سلولها توسط سلولهای عرضهکننده آنتیژن[36] (APC) بهطور مؤثر صورت نمیگیرد، همچنین این سیتوکاین موجب بلوکه شدن تولید سیتوکاینهای پیشالتهابی[37]، کمک محرکها و بیان MHCII و نیز تولـــــــــــــــــــــــــــــــــــــــید کموکاین میشود. (Nicod et al. 1995) ,(thomassen et al. 1996).
8-1 اِنگل [38]NGAL:
مقدمه:
گلیکولها بخاطر بیماریهایی که در انسان تولید میکنند دارای جایگاه ویژهای هستند. گلیکولها بیشترین کاربرد بهعنوان بیومارکر را دارند، بهعنوان مثال CA19-9 که یک گلیکوپروتئین است در پیگیری سرطان پانکراس کاربرد دارد، همچنین کارسینوامبریونیک آنتیژن[39] در تشخیص بسیاری از تومورهای سفت و CA125 در تشخیص، پیگیری و درمان بیماران دارای سرطان تخمدان بکار برده میشوند. بیشتر این گلیکولها مولکولهای بزرگی هستند. بههرحال یک فامیلی کوچک از این گلیکوپروتئینهای ترشحی لیپوکالین نام دارد که در کشمکش بین بیماریها و سلامت انسان نقش بسیار مهمی دارد. یک نمونه اصلی از این فامیلی که از گلیکوپروتئینهای کوچک ترشحی است بنام NGAL نامیده میشود.
– در سالهای اخیر NGAL کاربرد وسیعی بهعنوان یک بیومارکر جدید در بسیاری از بیماریها و بیماریهای بدخیم پیدا کرده است.
– فامیلی لیپوکالین: لیپوکالینها یک فامیلی از پروتئینهای ترشحی کوچک (180-160 آمینواسید) هستند که جزء پروتئینهای عملکردی مثل حملکننده هیدروفوبیک لیگاندهای کوچک، میباشند. بیشتر پروتئینها که براساس توالی آمینواسیدها طبقهبندی میشوند جزء پروتئینهای ساختمانی هستند (Flower et al. 2000).
– مقدار پروتئین NGAL در بسیاری از بیماریهای خفیف و حالاتی مانند التهاب و بیماریهای متابولیک دچار تغییر میگردد. حالات التهابی و افزایش NGAL در بیماریهایی مثل پانکراتیت، مننژیت، میوکاردیت، سوریازیس و پریتونیت دیده میشود.
پانکراتیت حاد یک حالت التهابی قابلبرگشت در پانکراس است که بهتنهایی نزدیک به 210/000 نفر را در سال در ایالات متحده درگیر میکند (Banks and freeman. 2006).
سطح پلاسمایی NGAL بهصورت معنیداری در عرض 48 ساعت (از شروع علائم) در بیماران دارای پانکراتیت حاد نزدیک به 15 برابر افزایش مییابد (Chakraborty et al. 2010). مننژیتهایی که عامل آنها باکتریهای گرم منفی هستند میتوانند باعث سندرم پاسخ التهابی سیستمیک (SIRS) شوند که باعث مرگومیر در اثر سپیس (عفونت خون) میشود. یکی از دلایل این پاسخ التهابی لیپوپلی ساکارید (LPS) باکتریهای گرم منفی است.
LPS یک محرک قوی در پاسخ ایمنی است و نقش اصلی در شوک سپتیک در اثر باکتریهای گرم منفی را دارد. تنها 12 ساعت بعد از تزریق LPS سطح NGAL در جریان خون بهصورت خیلی شدید افزایش مییابد (Marques et al. 2008).
بهعلاوه در یک عفونت باکتریایی مقدار NGAL و سطح آن در خون بهطور معنیداری در برابر آلودگی با ویروس افزایش مییابد، بهعنوان مثال سطح NGAL در گردش خون افرادی که با ویروس HIV آلوده شدهاند بسیار پایین است (Landro et al. 2008).
یکی از اعمال NGAL در حالات فیزیولوژیکی عمل کردن بهعنوان یک عامل باکتریواستاتیک است، بنابراین محافظت بدن در مقابل باکتریهای گرم منفی و عفونت مایکوباکتریوم یک وظیفه مهم NGAL میباشد. این عمل بهواسطه باند شدن محکم این مولکول به پروتئین باندشده به آهن به نام سیدروفور میباشد. آهن بهصورت فروس برای رشد باکتری مورد احتیاج است، بههرحال سطح خیلی پائین از آهن آزاد در بدن برای سلولهای باکتری ضروری است.
برای بدست آوردن این آهن، باکتریها دارای مکانیسمی جهت بدست آوردن آن هستند. تولید پروتئینی بنام سیدروفور که با آهن باند میشود (در مایع گوارش و در داخل ماکروفاژها) بخصوص به فرم فریک آن جزء این مکانیسم میباشد.
NGAL تمایل بسیار زیادی به باند شدن با سیدروفور دارد چه موقعی که آهن بهصورت آزاد است و یا بهصورت ذخیره. زمانی که NGAL به این پروتئین باند شد، کمپلکس NGAL و سیدروفور بهوسیله سلولهای حملکننده برداشته شده و بهوسیله گیرندههای مشابه گیرندههای NGAL این آهن ذخیره از پروتئین جدا میگردد. با این روش باکتری از آهن موردنیاز خود بهوسیله NGAL محروم میشود (Nairz et al. 2009) (Holmes et al. 2005).
مطالعات اخیر نشان داده است که کتکولها که از گیاهان مشتق شدهاند و در رژیم غذایی ما وجود دارند میتوانند با NGAL متصل شده و باعث گشوده شدن یک امکان جدید برای نقش عملکردی NGAL انسانی در سلامت و یا بیماری انسان گردند.
جالب است که کتکولها وقتی بهتنهایی با NGAL متصل میشوند این اتصال بسیار ضعیف است. این اتصال با وجود آهن بخصوص نوع آهن فریک بهطور قابلتوجهی افزایش مییابد.
مطالعات بیشتر نشان داد که 3 مولکول کاتکول تشکیل یک کمپلکس (کمپلکس 3 کاتکول) را میدهند که با آهن نقش عامل تثبیتکننده را به مولکولهای کاتکول میدهد. این کمپلکس به همراه آهن در حفرهای از مولکول NGAL و ترکیب آهن و کاتکول در کلیهها قبل از بازجذب توسط گیرندههای NGAL فیلتر میشوند (Bao et al. 2010) (Backhed et al. 2005). بههرحال اعمال این کمپلکسها بهتنهایی و یا همراه با NGAL هنوز کاملاً روشن نشده است.
– عمل دیگر NGAL که موردمطالعه قرار گرفته فعالیت بهعنوان یک واکنشگر شیمیایی است که در مقابل نوتروفیلها بهعنوان یک مهارکننده محرکهای اکسیداتیو عمل میکند. نشان داده شده که نوتروفیلها که اولین واکنشگرها در پاسخ به التهابهای حاد در بدن هستند به NGAL جهت حرکت به سمت ارگان هدف نیازمندند.
NGAL در ترمیم زخمها دارای نقش و عملکرد خاصی است. همچنین NGALدارای نقش واسطهای در ازدیاد سنتز و ساخت غضروف بهوسیله سلولهای کندروسیت و نیز تحریک تکثیر سلولهای اپیتلیال توبولار کلیه میباشد (Owen et al. 2008).
اما تا بحال نشان داده نشده که NGAL بر روی ازدیاد سلولهای سرطانی تأثیری داشته باشد، درعوض بهطور معنیداری توانایی جلوگیری از حمله سلولهای سرطانی و متاستاز آنها را دارد (Tong et al. 2008) ,(Lee et al. 2006).
دو امکان در مکانیسم تأثیر ضد تهاجمی NGAL توضیح داده شده است؛ اولی مکانیسم مهار تیروزین کیناز غیرگیرنده [40]FAK است که یک کلید متاستاتیک در سلولهای سرطانی است.
مکانیسم دوم نشان داد که وقتی ئی–کادهرین[41] بهصورت خارجی بیان میشود میتواند باعث افزایش بیان NGAL شود (Tong et al. 2011). ئی-کادهرین یک مولکول است که باعث چسبندگی سلول میشود و وابسته به کلسیم است. بیان این پروتئین و تحریک سلولهای اپیتلیال باعث چسبیدن این سلولها به یکدیگر میگردد (بنابراین باعث جلوگیری از متاستاز میشود). مطالعات بیشتر نشان داد که NGAL باعث مهار رگزایی در سلولهای سرطانی پانکراس در انسان میشود (Tong et al. 2008).
8-3 نقش NGAL بهعنوان یک مارکر پیشآگهیدهنده و تشخیصی:
وجود انواع مختلف NGAL در مراحل بیماریها بهتنهایی میتواند دلیل قطعی برای نشان دادن توانایی NGAL بهعنوان یک بیومارکر در تشخیص بیماریها باشد.
در بیماریهای خوشخیم مثل صدمات حاد کلیه (AKI) وجود این پروتئین بیشترین ارزش مطالعاتی و تشخیصی را دارد. در یک مطالعه سطح NGAL در ادرار در 6 ساعت بعد از انجام عمل جراحی قلب در بیماران بستری در بخش ICU نشان داد که در بیماران دچار صدمات حاد کلیه ارزش تشخیصی بالایی دارد (Koyner et al. 2010). در مطالعهای دیگر که بر روی بیماران بعد از جراحی قلب بر روی سطح پلاسمایی انجام شد، NGAL نشان از افزایش این پروتئین در طی 24 ساعت در بیماران دچار صدمات حاد کلیه (AKI) را داد (Cruz et al. 2010).
NGAL همچنین یک شناسه خوب در بیماران دچار بدی عملکرد کلیه بعد از گرفتن کلیه پیوندی است که اغلب در یک هفته بعد از پیوند کلیه دچار بدی عملکرد میشــــــــــــــــوند (Korbely et al. 2011).
پریرنال ازتمی[42] (افزایش اوره قبل از کلیه) یک بیماری کلیوی قابلبرگشت است که بهطور کامل در عرض 72-24 ساعت قابلبرگشت است. تشخیص این بیماری از صدمات حاد کلیوی یکی از بزرگترین مباحث بین نفرولوژیستها و پزشکان بخش اورژانس میباشد. در مقایسه بین مقدار NGAL و سطح آن در ادرار بیماران با یک پریازتمی و صدمات حاد کلیه نشان داده شد که سطح NGAL ادرار در بیماران دارای صدمات حاد کلیوی بهطور معنیداری بیشتر از بیماران دچار ازتمی پیش از کلیوی میباشد (Nickolus et al.2008).
این نتایج در یک مطالعه دیگر بر روی 107 بیمار که 32 نفر آنها دچار ازتمی پیشکلیوی بودند مورد تأیید قرار گرفت (Singer et al.2011).
تشخیص صدمات حاد کلیوی در بچهها یک بحث پیچیده دیگر است؛ نفرونها در کودکان کامل نشدهاند و به همین دلیل حد نرمال کراتینین نسبت به افراد بزرگسال بالاتر است، بنابراین مقدار کراتینین سرم نمیتواند یک مارکر خوب جهت تشخیص صدمات حاد کلیوی در این بیماران باشد. یک مقایسه از مقدار NGAL و کراتینین در اطفال (شامل نوزادان و بیماران، با سن بالاتر) نشان داد که مقدار NGAL در ادرار تنها 2 ساعت بدنبال جراحی بایپاس قلبی[43] افزایش یافته و تا 48 ساعت این مقدار باقی میماند.
بهطور معنیداری مقدار NGAL در ادرار بیشتر از 185ng/ml و یا NGAL بیشتر از 95ng/ml در پلاسما دارای 100%حساسیت و 93% اختصاصیت در شناسایی AKI در نوزادان میباشد. این مقدار برای اطفال با سن بالاتر 45ng/ml در ادرار و 48ng/ml در پلاسما میباشد که دارای 85% حساسیت و 86% اختصاصیت میباشد (Krawczeski et al. 2011)
NGAL بهتر از CA19-9 و CEA (کارسینوامبریونیک آنتیژن) در تشخیص ابتدایی سرطان معده کاربرد دارد (مرحله 1 و 2).
در سرطان تخمدان NGAL دارای 72٪ حساسیت و تنها 50% اختصاصیت میباشد و در مقایسه CA125 دارای 80٪ حساسیت و 79٪ اختصاصیت میباشد (Argoni et al. 2001).
بههرحال NGAL به نسبت در عفونت بهوسیله باکتریهای گرم منفی بسیار حساس میباشد. نتایج خیلی شفاف و واضح نشان داده که NGAL میتواند یک عامل جلوگیریکننده از عفونت بهوسیله باکتریهای گرم منفی باشد.
9-1 هپارین باند شده با پروتئین (HBP):
HBP یک بایومارکر تشخیصی در عفونت مجاری ادرار بزرگسالان
مقدمه:
عفونت مجاری ادرار[44] یکی از بیشترین عفونتهایی است که در انسان باعث بستری شدن در بیمارستانها و استفاده از آنتیبیوتیکها بهعنوان درمان میشود (Swedres. 2010).
علائم این بیماری اغلب غیراختصاصی بوده و باعث اشکال در تشخیص و درمان میشود. تشخیص عفونت مجاری ادرار اغلب براساس وجود علائم کلینیکی همراه با نتایج سریع بدست آمده از نوارهای ادراری صورت میگیرد که نشاندهنده وجود باکتری در ادرار با تست نیتریت[45] و همچنین اندازهگیری نیمهکمی سطح گلبولهای سفید در ادرار میباشد. با وجود این نشان داده شده است که تشخیصهای ابتدایی دارای اشتـبـاهات زیادی در مقایسه با تستهای طلایی مثل کشت ادرار میباشـــــند (Bent et al. 2002), (Little et al. 2009), (Deville et al. 2004) , (Stjohn et al. 2006), (Hurlbut and littenberg. 1991), (Knottenerus et al. 2013).
این عمل باعث استفاده زیاد از آنتیبیوتیکها و ریسک واکنشهای منفی و نتایج برعکس میشود. (Paterson. 2004) ,(Gillings. 2013).
– برای اثبات تشخیص و بهعنوان جانشین، از اینترلوکین 6 (IL-6) بهجای لکوسیت و اپیتلیال در عفونتهای مجاری ادرار استفاده میشود. مطالعات نشان داده است که اندازهگیری IL-6 میتواند باعث افتراق بین یک التهاب مثانه (Cystitis) و عفونت کلیه (پیلونفریت) شود
(Nanda and Juthani- Metha. 2009), (Otto et al. 1999), (Rodhe et al. 2009).
بااینوجود استفاده کلینیکی از این مارکر دارای محدودیتهایی میباشد.
– هپارین بیندینگ پروتئین (HBP) یا هپارین باندشونده با پروتئین یک پروتئین با وزن مولکولی 37 KDa مترشحه از دانههای آزروفیلیک نوتروفیلهای انسانی است (Gautam et al. 2001). زمانی که این پروتئین از نوتروفیلهای فعالشده آزاد شود، این مولکول بهعنوان واسطه التهابی دارای چندین عملکرد بوده و باعث افزایش و نشت عواملی مانند عوامل شیمیایی شده و باعث فعال شدن منوسیتها میگردد (Linder et al. 2010)، بهعلاوه HBP یک آنتیباکتریال وسیعالطیف بوده و همچنین میتواند باعث پاک شدن باکتریها بهوسیله آپسونیزاسیون گردد (Soehnlein. 2009). هپارین بیندینگ پروتئین (HBP) در آزمایشهای کلینیکی بهعنوان یک بیومارکر برای عفونتهای باکتریایی متفاوت مورد ارزیابی قرار گرفته است. افزایش مقدار HBP در پلاسما و مایع مغزی نخاعی[46] (CSF) و بیوپسی پوست که باعث به ترتیب عفونت خون، مننژیت باکتریایی و عفونت پوست استرپتوککی میشوند، دیده شده است. (Linder et al. 2009), (Linder et al. 2012), (Linder et al, 2011), (Linder et al.2010).
اخیراً یک مطالعه بر روی HBP ادرار (U-HBP) در اطفال نشان داد که افزایش سطح این پروتئین عفونت مجاری ادرار را نشان میدهد. یکی از جالبترین نتایج این بوده که U-HBP موجود در ادرار دارای حساسیت و اختصاصیت بالاتری در عفونت مجاری ادرار در مقایسه با تعداد لکوسیتها در ادرار بوده است (Kjolvmark. 2012).
– در یک مطالعه که بر روی 365 بیمار مشکوک به عفونت مجاری ادرار صورت گرفت گستردگی بیومارکرهای وابسته به عفونت مجاری ادرار نشان داد که سطح U-HBP بهطور معنیداری در بیماران با تشخیص عفونت ادرار در مقایسه با بیماران بدون عفونت ادرار بالاتر است. در این مطالعه هیچ اختلاف معنیداری در سطح بیومارکرها بین یک عفونت مجاری ادرار واضح و روشن و یک UTI مشکوک وجود نداشت.
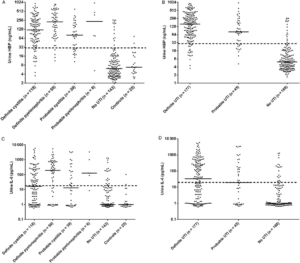
– با در نظر گرفتن 30ng/ml cut-off در غلظت NGAL تشخیص صریح و قطعی به ترتیب با حساسیت و اختصاصیت 89/2% و 89/8% بدست آمد.
– سطح IL-6 ادرار نیز بهطور معنیداری در گروه دارای UTI قطعی (میانگین 33pg/ml) در مقایسه با گروه سالم (میانگین 1pg/ml) را نشان داد. بااینوجود حساسیت آن در مقایسه با HBP پایینتر بود.
آنالیزهای نوار ادراری نشان داد که افزایش سطح مقدار لکوسیتهای ادرار و مثبت شدن نیتریت در بسیاری از بیماران دارای عفونت ادرار دیده میشود که حساسیت و اختصاصیت آن به ترتیب 82/7% و 78% بود.
– در بیماران بدون عفونت مجاری ادرار (25/8%) با وجود داشتن لکوسیت ادرار بالاتر از حد cut-off در نظر گرفته شده، مقدار U-HBP سطح پایین 30ng/ml را نشان میداد. (Fig2)
– مقدار HBP نیز متناسب با نتایج بدست آمده از کشت ادرار بود؛ یعنی بیماران با بالاترین غلظت باکتری در ادرار بهطور معنیداری دارای سطح بالاتری از U-HBP بودند و برعکس، بااینوجود اختلافی بین سطح U-HBP و انواع مختلف باکتریها پیدا نشد.
9-2 U-HBP و U-IL-6 در بیماران با عفونت کلیه و عفونت مثانه در گروه دارای عفونت مجاری ادرار قطعی:
بیماران با تب و عفونت مجاری ادرار (پیلونفریت) میانگین 227ng/ml غلظت HBP داشتند که بهطور معنیداری بیشتر از گروه بیماران دارای عفونت مثانه با میانگین 121 ng/ml بود.
– بهعلاوه وقتیکه از cut-off استفاده گردید مقدار حساسیت HBP برای تشخیص عفونت کلیه 93/3% بود که بیشتر از مقدار آن در عفونت مثانه که 86/4% بود، را نشان میداد.
Figure 2. Urine levels of heparin-binding protein (HBP) (A and B) and interleukin-6 (IL-6) (C and D) for the entire study population, n = 390 patients. The patient groups are described in the method section. Each dot represents the concentration in an individual of HBP and IL-6. Bars represent the median of the values. Dashed lines represent the proposed cutoff of 30 ng/mL for HBP and 30 pg/mL for IL-6.
9-3 سطح U-HBP و ازکارافتادگی کلیه:
در یک ارزیابی بر روی سطح U-HBP و ازکارافتادگی کلیه که بر روی سه گروه مختلف بیماران شامل:
- گروه بدون بیماری کلیوی
- گروه دارای بیماری حاد کلیوی
- گروه دارای بیماری مزمن کلیوی
صورت گرفت، یک اختلاف قابلاعتناء بین سطح U-HBP در این سه گروه دیده شد که این اختلاف بین گروه بدون بیماری کلیوی و گروه دارای بیماری مزمن کلیوی بود، ولی بین گروههای دیگر اختلاف قابلاعتنایی گزارش نگردید (Herwald et al. 2004). بههرحال مقدار U-HBP در بیماران با عفونت مجاری ادرار و بیماری کلیوی مزمن در مقایسه با بیماران عفونت مجاری ادرار و یا اختلال حاد عملکرد کلیه دارای افزایش غلظت معنیداری بوده است.
این مطالعات اولین ارزیابی از HBP بهعنوان یک مارکر در عفونت مجاری ادرار (UTI) بود. در این مطالعه نشان داده شده که U-HBP مارکر بهتری نسبت به IL-6 در بیماران دارای عفونت مثانه و عفونت مجاری ادراری بوده است، بههرحال U-HBP ارزش تشخیصی بالاتری در بیماران با عفونت مجاری ادرار و بیماران دارای بیماری مزمن کلیوی در مقایسه با بیماران بدون عفونت حاد کلیه داشته است؛ در ضمن هماهنگی بسیار قوی بین U-HBP و U-WBC وجود داشت. این نتایج موردانتظار بود زیرا HBP از نوتروفیلها ترشح میشوند، بااینوجود تمام بیـماران دارای U-WBC بالا دارای U-HBP بالا نبودند. جالبتوجه است که بیمارانی که دارای UTI نبوده اما دارای U-WBC در نوار ادراری بودند (مثبت کاذب) سطح بالای U-HBP نداشتند که نشان میدهد که U-HBP مارکری اختصاصیتر از U-WBC است. سطح بالای مقدار U-HBP در بیماران دارای غلظت زیاد باکتری در ادرار در مقایسه با بیماران با غلظت پایین باکتری دیده شد. این مشاهدات و یافتههای قبلی نشان میدهند که ساختمان باکتریها تأثیر مستقیم بر روی آزاد شدن HBP دارد.
در خاتمه اینکه U-HBP بهترین مارکر تشخیصی برای UTI (عفونت مجاری ادرار) بوده و میتواند باعث افتراق بین عفونت مثانه و عفونت کلیه شود. نتایج نشان میدهد که HBP میتواند برای تشخیص صحیح به آزمایشهای حاضر اضافه شود. مطالعات آینده بر روی HBP بهعنوان یک نامزد و رقیب در بیومارکر تشخیص عفونت مجاری ادرار مطرح میگردد، همچنین این بایومارکر میتواند بهطور گسترده در بیمارانی که ناقل و بدون علامت هستند و با علائم نوتروپنی و تب و آسیب مجاری ادراری مراجعه میکنند مورد استفاده قرار گیرد.
مقدمه:
یکی از مهمترین عوامل شناسایی یک هدف، استفاده از مولکول شناساگری با اختصاصیت و تمایل بالا میباشد. یکی از رایجترین این عوامل آنتیبادیهایی هستند که در بسیاری از روشهای تشخیص ایمنی مورد استفاده قرار گرفتهاند، اما محققان در پی دستیابی به مولکولهای شناساگر دیگر به الیگونوکلئوتیدهایی برخوردند که توانایی اتصال به پروتئینهای سلــــــولی و ویروس را داشتند (Lee et al. 2008).
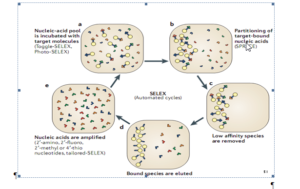
در سال 1990 به الیگونوکلئوتیدهای کوچک تکرشتهای که با تمایل و اختصاصیت بالایی به اهداف مولکولهای زیستی متصل میشدند لفظ آپتامر اطلاق شد (Elington and zostak. 1990). در همین سال روشی اختصاصی بهعنوان تکامل سیستمی از طریق غنیسازی نمایی[47] (SELEX) برای سنتز آپتامرها از کتابخانههای الیگونوکلئــــوتیدی سنتز شده بهصورت تصادفی، معرفی گردید (Tuerk and Gold. 1990). از آن زمان تاکنون آپتامرهای بیشماری برای انواع مولکولهای زیستی نظیر اسیدآمینهها، داروها، پروتئینها و دیگر مولکولها معرفی شده است.
پس از معرفی SELEX (سیلکس) در سال 1990، در سال 2001 این روش بهینهسازی شده و زمان انجام آن از 3 هفته به 3 روز تقلیل پیدا کرد (Sooter et al. 2001). در این روش قدم اول انتخاب کتابخانههای الیگونوکلئوتیدی سنتزشده بهصورت تصادفی است. این کتابخانه شامل 1012 تا 1015 الیگونوکلئوتید به طول 40 تا 100 جفت باز میباشد که هر یک از دو بخش ثابت در طرفین اولیگونوکلئوتیدها جهت تکثیر از طریق PCR (واکنشهای زنجیرهای پلیمراز) و یک بخش در میان این دو با توالی متغیر تصادفی تشکیل شدهاند (Marshall and Ellington. 2000). در مرحله دوم مولکولهای هدف تثبیتشده در سطح، در معرض این کتابخانه قرار گرفته و سپس با شستشو الیگونوکلئوتیدهای اتصالنیافته حذف میشوند، سپس مولکولهای اتصال یافته از سطح جدا و دوباره مرحله دوم 6 تا 20 بار تکرار میشود تا نهایتاً الیگونوکلئوتیدهای اتصالیافته بهصورت اختصاصی بدست آید.
این مولکولها از طریق PCR تکثیر و سپس کلون میشوند، پس از آن خالصسازی شده و مورد توالییابی قرار میگیرند (Stoltenburg. 2007).
آپتامرها ویژگیهای منحصربهفردی دارند که باعث برتری آنها به مولکولهای شناساگر دیگر نظیر آنتیبادیها میگردد. این ویژگیها شامل اندازه بســـــــــــیار کوچک در مقایسه با آنتیبادیها (Lee et al. 2006)، پایداری[48] بالا و برگشتپذیر بودن ساختار در برابر انواع تغییرات فیزیکی نظیر فشار، دما، pH، وجود یونهای فلزی و غیره (Jayasena. 1999)، امکان اتصال به اهداف بسیار متنوع از مولکولهای یونی نظیر + K تا سلولهای سرطانی و حتی میکروارگانیسمهایی نظیر ویروسها و باکتریها (Zelada-Guillen et al. 2009)، امکان ایجاد اصلاحات متنوع و افزودن گروههای عاملی و شیمیایی متنوع (Sooter et al. 2001)، تثبیت آسان بر سطوح مختلف (Balamurugan et al. 2008)، روش نگهداری و حمل و سنتز آسان (Jayasena. 1999)، تمایل اتصال بالا و سرعت تفکیک پایین و اختصاصیت بالا (Carothers et al. 2006) میباشد.
10-3 اساس بیوفیزیکی توانایی شناسایی اختصاصی مولکولهای هدف توسط آپتامر:
اساس بیوفیزیکی توانایی شناسایی اختصاصی مولکولهای هدف توسط آپتامر ناشی از چند عامل است؛ آپتامرها میتوانند بهصورت ساختارهای سهبعدی خاصی نظیر رشته حلقه[49]، سنجاقسری[50]، شبهگره[51]، ساختار چهارتایی پیچیده[52] و نظایر آنها تا بخورند. یکی از این ساختارها که بسیار موردتوجه و موردمطالعه نیز قرار گرفته ساختار چهارتایی پیچیده است.
– ازآنجاکه الیگونوکلئوتیدها در PH فیزیولوژیک قویاً دارای بار منفی هستند، اتصال آنها به بخشهای مثبت اهداف مولکولیشان نظیر پلیمرهای اسیدی که دارای بخشهایی با بار مثبت هستند، از طریق واکنش الکترواستاتیک میتواند صورت گیرد (Hermmann and Potel. 2000).
همچنین 80٪ از انرژی فعال آپتامرها به مولکولهای هدف را به پیوندهای هیدروژنی نسبت دادهاند که میتواند توجیهی برای اتصال آپتامرها بهصورت سهبعدی به لیگاندهایشان باشد.
ویژگیهای منحصربهفرد ذکرشده برای آپتامرها، آن را برای انواع کاربردها و عملکردها ازجمله تولید و حمل دارو، تشخیص مولکولی انواع مارکرها و تصویرســــــازی بیولوژیکی[53] مناسب ساخته است (Song et al. 2012), (Tombelli et al. 2005).
در علوم دارویی با توجه به شناسایی اختصاصی مولکول هدف، اندازه کوچک و ایمنیزایی اندک آپتامر، میتوان برای فعال و یا غیرفعالسازی پروتئین عامل ایجاد بیماریها و نیز تغییر بیان ژنهای مسئول و نیز انتقال دارو به محل موردنظر بدون اثرگذاری بر دیگر سلولها بافتها و اندامها، از این مولکول بهره جست. از داروهای آپتامری میتوان به داروی موکوگن[54]، آپتامر اختصاصی فاکتور رشد اندوتلیالی عروق[55] برای درمان بیماری تباهی لکه زرد و IMO 2055 آپتامر اختصاصی TLR-9 برای درمان سرطان اشاره نمود (Song et al. 2012). همچنین آپتامرهایی برای مارکرهای بیماریهای صعبالعلاجی چون آلزایمر، سندرم نقض ایمنی اکتسابی (AIDS)، انواع سرطانها و هپاتیت معرفی شدهاند که میتوانند به تولید داروهای خاص منجر شوند (Keefe et al. 2010).
یکی از مهمترین کاربردهای آپتامرها به دلیل اندازه کوچک و قابلیت تثبیت بر سطوح مختلف و اختصاصیت و تمایل بالا به هدف و دیگر وجوه متمایزکنندهشان، بهکارگیری آنها بهعنوان مولکول شناساگر زیستی بهجای آنتیبادیها در زیستحسگرها[56] میباشد. به زیستحسگرهایی که مولکول شناساگر زیستی آنها را آپتامرها تشکیل دادهاند آپتاحسگرها[57] اطلاق میشـــــــــــــــــود. (Song et al. 2012)
اگرچه بحث فناوری آپتامرها نوظهور بشمار رفته، بااینحال گامهای بلندی در راستای آن در فناوری برداشته شده است؛ اما با نتایج بدست آمده در مورد اختصاصیت و حساسیت و خصوصیات بیوفیزیکی و بیوشیمیایی، آینده روشنی برای تولید داروهایی با پایه آپتامرها و نیز تشخیص و درمان و حتی پیشگیری انواع بیماریها متصور است. مهمترین چالش پیش رو عدم وجود آپتامر برای بسیاری از مولکولهای مهم زیستی است، بنابراین قدم اول در این زمینه توسعه و گسترش بانک اطلاعاتی آپتامرها میباشد.
References:
Aadland E, Fargerhol MK. Faecal calprotectin: a marker of inflammation throughout the intestinal tract. Eur J Gastroenterol Hepatol 2002; 14: 823- 825.
Aderem A, Ulevitch RJ. Toll-like receptors in the induction of the innate immune response. Nature 2000; 406:782–7.
Aikawa N, Fujishima S, Endo S, Sekine I, Kogawa K, Yamamoto Y, Kushimoto S, Yukioka H, Kato N, Totsuka K, Kikuchi K, IkedaT, Ikeda K, Harada K, Satomura S. Multicenter prospective study of procalcitonin as an indicator of sepsis.J Infect Chemother 2005:11(3):152-9.
Alayash, A. I. 2001. Oxidative mechanisms of hemoglobin-based blood substitutes. Artif. Cells Blood Substit. Immobil. Biotechnol. 29: 415–425.
Ambros, V. (2004).The functions of animal microRNAs. Nature VOL.431, NO.7006, (2004): PP. 350-355, ISSN 1476-4687.
Arbour, N. C. E. Lorenz, et al. (2000).TLR4 mutations are associated with endotoxin hyporesponsiveness in humans. Nat Genet VOL.25, NO.2, (2000): PP. 187-191, ISSN 1061-4036.
Arcaroli, J. E. Silva, et al. (2006).Variant IRAK-1 haplotype is associated with increased nuclear factor-kappa B activation and worse outcomes in sepsis. American Journal of Respiratory and Critical Care Medicine VOL.173, NO.12, (2006): PP. 1335-1341, ISSN 1073-449X.
Argani P, Rosty C, Reiter RE, Wilentz RE, Murugesan SR, Leach SD, Ryu B, Skinner HG, Goggins M, Jaffee EM, Yeo CJ, Cameron JL, Kern SE, Hruban RH (2001) Discovery of new markers of cancer through serial analysis of gene expression: prostate stem cell antigen is overexpressed in pancreatic adenocarcinoma. Cancer Res 61, 4320- 4324
Assicot M, Gendrel D, Carsin H, Raymond J, Guilbaud J, Bohuon C. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993:341:515-8.
Backhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI (2005) Host-bacterial mutualism in the human intestine. Science 307, 1915-1920
Balamurugan, S. Obubuafo, A. , Soper, S. A. Spivak, D. A. Surface immobilization methods for aptamerdiagnostic applications. Anal Bioanal Chem, 2008. 390(4): p. 1009-21.
Bandi, N. and E. Vassella (2011).miR-34a and miR-15a/16 are co-regulated in non-small cell lung cancer and control cell cycle progression in a synergistic and Rb-dependent manner. Mol Cancer VOL.10, (2011): PP. 55, ISSN 1476-4598.
Banks PA, Freeman ML (2006) Practice guidelines in acute pancreatitis. Am J Gastroenterol 101, 2379-2400
Bao G, Clifton M, Hoette TM, Mori K, Deng SX, Qiu A, Viltard M, Williams D, Paragas N, Leete T, Kulkarni R, Li X, Lee B, Kalandadze A, Ratner AJ, Pizarro JC, Schmidt-Ott KM, Landry DW, Raymond KN, Strong RK, Barasch J (2010) Iron traffics in circulation bound to a siderocalin (Ngal)-catechol complex. Nat Chem Biol 6, 602-609.
Barber, R. C. C. C. Aragaki, et al. (2004).TLR4 and TNF-alpha polymorphisms are associated with an increased risk for severe sepsis following burn injury. J Med Genet VOL.41, NO.11, (2004): PP. 808-813, ISSN 1468-6244.
Ben-Ali, M. M. R. Barbouche, et al. (2004).Toll-like receptor 2 Arg677Trp polymorphism is associated with susceptibility to tuberculosis in Tunisian patients. Clin Diagn Lab Immunol VOL.11, NO.3, (2004): PP. 625-626, ISSN 1071-412X.
BENOIST J.F, MIMOZ O,ASSICOT M, EDOUCARD A: Serum procalcitonin, but not C-reactive protein, identifies sepsis in trauma pateints. Clin Chem 44: 1778-1779, 1998.
Bent S, Nallamothu BK, Simel DL, Fihn SD, Saint S. Does this woman have an acute ncomplicated urinary tract infection? JAMA 2002; 287:2701–10.
BHARDWAJ RS, ZOTZ C, ZWADLO-KLARWASSER G, ROTH J, GOEBELER M, MAHNKE K, FALK M, MEINARDUS-HAGER G, SORG C: The calcium-binding proteins MRP8 and MRP14 form a membraneassociated heterodimer in a subset monocytes/macrophages present in acute but absent in chronic inflammatory lesions. Eur J Immunol 22: 1891-1897, 1992.
Bolmeson, C. J. L. Esguerra, et al. (2011).Differences in islet-enriched miRNAs in healthy and glucose intolerant human subjects. Biochem Biophys Res Commun VOL.404, NO.1, (2011): PP. 16-22, ISSN 1090-2104.
Bou ssac M, Garin J. Calcium- dependent secretion in human neutrophils: a proteomic approach. Electrophoresis 2000; 21: 665-672.
Bouchon A, Dietrich J, Colonna M. Cutting edge: inflammatory responses can be triggered by TREM-1, a novel receptor expressed on neutrophils and monocytes. J Immunol 2000; 164:4991–
Bouchon A, Facchetti F, Weigand MA, Colonna M, (2001) TREM-1 amplifies inflammation and is a crucial mediator of septic shock. Nature 410: 1103-1107
Bouchon A, Facchetti F, Weigand MA, Colonna M. TREM-1 amplifies inflammation and is a crucial mediator of septic shock. Nature 2001; 410:1103–7.
BOUSSAC M, GARIN J: Calcium-dependent secretion in human neutrophils: a proteomic approach. Electrophoresis 21: 665-672, 2000.
BRANDTZAEG P, DALE I, FAGERHOL M K: Distribution of a formalin-resistant myelomonocytic antigen (L1) in human tissues. II. Normal and aberrant occurrence in various epithelia. Am J Clin Pathol 87: 700-707, 1987.
Brase, J. C. D. Wuttig, et al. (2010).Serum microRNAs as non-invasive biomarkers for cancer. Mol Cancer VOL.9, (2010): PP. 306, ISSN 1476-4598.
Brun JG, Ulvestad E,Fagerhol MK, Jonsson R. Effect of human calprotectin (L1) on in vitro immunoglobulin synthesis. Scand J Immunol 1994; 40: 675-680.
BRUNKHORS FM, EBERHARD OK, BRUNKHORST R: Discrimiation of infectious and noninfectionus causes of early acute respiratory distress syndrome by procalcitonin. Crit Care Med 27: 2172- 2176, 1999.
Burkhardt K, Radespiel- Troger M, Rupprecht HD et al. an increase in myeloid- related protein serum levels precedes acute renal allograft refection. J Amer Soc Nephrol 2001; 12: 1947- 1657.
Caby, M. P. D. Lankar, et al. (2005).Exosomal-like vesicles are present in human blood plasma. Int Immunol VOL.17, NO.7, (2005): PP. 879-887, ISSN 0953-8178.
Carothers, J.M. S.C. Oestreich, and J.W. Szostak, Aptamers selected for higher-affinity binding are not more specific for the target ligand. J Am Chem Soc, 2006. 128(24): p. 7929-37.
Chakraborty S, Kaur S, Muddana V, Sharma N, Wittel UA, Papachristou GI, Whitcomb D, Brand RE, Batra SK (2010b) Elevated serum neutrophil gelatinase-associated
Child, N. J. I. A. Yang, et al. (2003).Polymorphisms in Toll-like receptor 4 and the systemic inflammatory response syndrome. Biochem Soc Trans VOL.31, NO.Pt 3, (2003): PP. 652- 653, ISSN 0300-5127.
circulation bound to a siderocalin (Ngal)-catechol complex. Nat Chem Biol 6, 602-609
Collins CE, La DT, Yang HT, Massin F, Gibot S, Faure G, Stohl W, (2009) Elevated synovial expression of triggering receptor expressed on myeloid cells 1 in patients with septic arthritis or rheumatoid arthritis. Ann Rheum Dis 68: 1768-1774
Cruz DN, de CM, Garzotto F, Perazella MA, Lentini P, Corradi V, Piccinni, Ronco C (2010) Plasma neutrophil gelatinase-associated lipocalin is an arly biomarker for acute kidney injury in an adult ICU population. ntensive Care Med 36, 444-451
Dale I, Fagerhol MK, Naesgaard I. purification and partial characterization of highly immunogenic human leukocyte protein, the L1 antigen. Eur J Biochem 1983; 134: 1-6.
DALE I, FAGERHOL MK, NAESGAARD I: Purification and partial characterization of highly immunogenic human leukocyte protein, the L1 antigen. Eur J Biochem 134: 1-6, 1983.
DANDONA P,NIX D, WILSON MF, ALJADA A,LOVE J, ASSOICOT M, BOHUON C: Procalcitonin increase after endotoxin injection in normal subects. J Clin Endocrinol Metab 79: 1605-1608, 1994.
Determann RM, Weisfelt M, de Gans J, van der Ende A, Schultz MJ, van de Beek D, (2006) Soluble triggering receptor expressed on myeloid cells 1: a biomarker for bacterial meningitis. Intensive Care Med 32: 1243-1247
Deville WL, Yzermans JC, van Duijn NP, Bezemer PD, van der Windt DABouter LM. The urine dipstick test useful to rule out infections. A meta-analysis of the accuracy. BMC Urol 2004; 4:4.
Dimopoulou I, Orfanos SE, Pelekanou A, Kotanidou A, Livaditi O, Augustatou C, Zervou M, Douka E, Theodorakopoulou M, Karagianni V, Douzinas E, Armaganidis A, Giamarellos-Bourboulis EJ, (2009) Serum of patients with septic shock stimulates the expression of Trem-1 on U937 monocytes. Inflamm Res 58: 127-132
EBERHARD OK, HAUBITZ M, BRUNKHORST FM, KLIEM V, KOCH KM, BRUNKHORST R: Usefulness of procalcitonin for differentiation between activity of systemic autoimmune and invasive bacterial infection. Arthritis Rehum 40: 1250-1256, 1997.
Ellington, A.D. and J.W. Szostak, In vitro selection of RNA molecules that bind specific ligands. Nature, 1990. 346(6287): p. 818-22.
endotoxemia. Shock VOL.27, NO.3, (2007): PP. 238-241, ISSN 1073-2322.
Etheridge, A. I. Lee, et al. (2011).Extracellular microRNA: a new source of biomarkers. Mutat Res VOL.717, NO.1-2, (2011): PP. 85-90, ISSN 0027-5107.
EUE I, SORG C: Arachidonic acid specifically regulates binding of S100A8/9, a heterodimer complex of the S100 class of calcium binding proteins, to human microvascular endothelial cells. Atherosclerosis 154: 505-508, 2001.
expression is associated with a mature stage of myeloid development. Mol Immunol 2002; 38:817–24
Fagerhol MK, Dale I, Andersson I. Release and quantitation of a leucocyte derived protein (L1). Scan J Haematol 1980; 24: 393-398.
Fagerhol MK. Calprotectin, a faecal marker of organic gastrointestinal abnormality. The Lancet 2000; 356: 1783-1784.
Fagerhol MK. Nomenclature for proteins: is calprotectin a proper name for the elusive myelomonocytic protein? J Gastroenterol 1996; 49: 74-79.
Fernandez-Hernando, C. Y. Suarez, et al. (2011).MicroRNAs in lipid metabolism. Curr Opin Lipidol VOL.22, NO.2, (2011): PP. 86-92, ISSN 1473-6535.
Flower DR, North AC, Sansom CE (2000) The lipocalin protein family: structural and sequence overview. Biochim Biophys Acta 1482, 9-24
Gastroenterol 105, 2050-2059
Gautam N, Olofsson AM, Herwald H, Matussek A, Mölstad S. Heparinbinding protein (HBP/CAP37): a missing link in neutrophil-evoked alteration of vascular permeability. Nat Med 2001; 7:1123–7.
Gibot S, Kolopp-Sarda MN, Bene MC, Bollaert PE, Lozniewski A, Mory F, Levy B, Faure GC, (2004) A soluble form of the triggering receptor expressed on myeloid cells-1 modulates the inflammatory response in murine sepsis. J Exp Med 200: 1419-1426
Gillings MR. Evolutionary consequences of antibiotic use for the resistome, mobilome and microbial pangenome. Front Microbiol 2013; 4:4.
Gingras MC, Lapillonne H, Margolin JF. TREM-1, MDL-1, and DAP12
Graversen JH, Madsen M, Moestrup SK, (2002) CD163: a signal receptor scavenging haptoglobin-hemoglobin complexes from plasma. The international journal of biochemistry & cell biology 34: 309-314
Hahn BL, Sohnle PG. resistance of zinc- supplemented Candida albicans cells to the qrowth inhibitory effect of calprotectin. J Infect Dis 1995; 171: 1289-1294.
Hermann, T. and D.J. Patel, Adaptive recognition by nucleic acid aptamers. Science, 2000. 287(5454): p. 820-5.
Herwald H, Cramer H, Mörgelin M, et al.Mprotein, a classical bacterial virulence
Herwald H, Cramer H, Mörgelin M, et al.Mprotein, a classical bacterial virulence determinant, forms complexes with fibrinogen that nducevascular leakage. Cell 2004; 116:367–79.
HESSIAN PA, EDGEWORTH J, HOGG N: MRP-8 and MRP-14, two abundant Ca2+-binding proteins of neutrophils and monocytes. J Leukoc Biol 53: 197-204, 1993.
Hoffmann JA, Kafatos FC, Janeway CA, Ezekowitz RA. Phylogenetic perspectives in innate immunity. Science 1999; 284:1313–8.
Holmes MA, Paulsene W, Jide X, Ratledge C, Strong RK (2005) Siderocalin (Lcn 2) also binds carboxymycobactins, potentially defending against mycobacterial infections
HUNTER MJ, CHAZIN WJ: High level expression and dimer characterization of the S100 EF-hand proteins, migration inhibitory factor-related proteins 8 and 14. J Biol Chem 273: 12427-12435, 1998.
Hurlbut TA 3rd, Littenberg B. The diagnostic accuracy of rapid dipsticktests to predict urinary tract infection. Am J Clin Pathol 1991; 96:582–8.
individuals possess proapoptotic NAD(P)H oxidase activity: A novel vascular redox pathway. Crit Care Med VOL.32, NO.3, (2004): PP. 818-825, ISSN 0090-3493.
Jackson DG, Hart DN, Starling G, Bell JI. Molecular cloning of a novel member of the immunoglobulin gene superfamily homologous to the polymeric immunoglobulin receptor. Eur J Immunol 1992; 22:1157–63
Janiszewski, M. A. O. Do Carmo, et al. (2004).Platelet-derived exosomes of septic.
Janowska-Wieczorek, A. M. Wysoczynski, et al. (2005).Microvesicles derived from activated platelets induce metastasis and angiogenesis in lung cancer. Int J Cancer VOL.113, NO.5 (2005): PP. 752-760, ISSN 0020-7136.
Janowska-Wieczorek, A. M. Wysoczynski, et al. (2005).Microvesicles erived from activated platelets induce metastasis and angiogenesis in lung ancer. Int J Cancer VOL.113, NO.5, (2005): PP. 752-760, ISSN 0020-7136.
Jayasena, S.D. Aptamers: an emerging class of molecules that rival antibodies in diagnostics. Clin Chem, 1999. 45(9): p. 1628-50.
Jegga, A. G. S. Gowrisankar, et al. (2007).PolyDoms: a whole genome database for the identification of non-synonymous coding SNPs with the potential to impact disease. Nucleic Acids Res VOL.35, NO.Database issue, (2007): PP. D700-706, ISSN 1362-4962.
Keefe, A.D. S. Pai, and A. Ellington, Aptamers as therapeutics. Nat Rev Drug Discov, 2010. 9(7): p. 537-50.
Kimbrell DA, Beutler B. The evolution and genetics of innate immunity. Nat Rev Genet 2001; 2:256–67.
Kjölvmark C, Åkesson P, Linder A. Elevated urine levels of heparinbinding protein in children with urinary tract infection. Pediatr Nephrol 2012; 27:1301–8.
Kligman D, Hilt DC. The S100 protein family. Trends Biochem Sci 1988; 13: 437- 443.
KM, Landry DW, Raymond KN, Strong RK, Barasch J (2010) Iron traffics in
Knottnerus BJ, Geerlings SE, Moll van Charante EP, Ter Riet G. Toward a simple diagnostic index for acute uncomplicated urinary tract infections. Ann Fam Med 2013; 11:442–51.
Knottnerus BJ, Geerlings SE, Moll van Charante EP, Ter Riet G. Toward a simple diagnostic index for acute uncomplicated urinary tract infections. Ann Fam Med 2013; 11:442–51.
Kong, X. Y. Y. Q. Du, et al. (2010).Plasma miR-216a as a potential marker of pancreatic injury in a rat model of acute pancreatitis. World J Gastroenterol VOL.16, NO.36, (2010): PP. 4599-4604, ISSN 1007-9327.
Konikoff MR, Denson LA. Role of caplrotectin as a biomarker of intestinal inflammatory bowel disease. In flamm Bowel Dis 2006; 12: 524-534.
Korbely R, Wilflingseder J, Perco P, Kainz A, Langer RM, Mayer B, Oberbauer R (2011) Molecular biomarker candidates of acute kidney injury in zero-hour renal transplant needle iopsies. Transpl Int 24, 143-149
Kovar, F. M. C. Marsik, et al. (2007).The tumor necrosis factor alpha -308 G/A
Koyner JL, Vaidya VS, Bennett MR, Ma Q, Worcester E, Akhter SA, Raman J, Jeevanandam V, O’Connor MF, Devarajan P, Bonventre JV, Murray PT (2010) Urinary biomarkers in the clinical prognosis and early detection of acute kidney injury. Clin J Am Soc Nephrol 5, 2154-2165
Krawczeski CD, Woo JG, Wang Y, Bennett MR, Ma Q, Devarajan P (2011) Neutrophil Gelatinase-Associated Lipocalin Concentrations Predict Development of Acute Kidney Injury in eonates and Children after Cardiopulmonary Bypass. J Pediatr.
Krutzfeldt, J. M. N. Poy, et al. (2006).Strategies to determine the biological function of microRNAs. Nat Genet VOL.38 Suppl, (2006): PP. S14-19, ISSN 1061-4036.
Kusanovic JP, Romero R, Chaiworapongsa T, Mittal P, Mazaki-Tovi S, Vaisbuch E, Erez O, Gotsch F, Than NG, Edwin SS, Pacora P, Jodicke C, Yeo L, Hassan SS, (2010) Amniotic fluid sTREM-1 in normal pregnancy, spontaneous parturition at term and preterm, and intra-amniotic infection/inflammation. J Matern Fetal Neonatal Med 23: 34-47
Landro L, Damas JK, Flo TH, Heggelund L, Ueland T, Tjonnfjord GE, Espevik T, Aukrust P, Froland SS (2008) Decreased serum lipocalin-2 levels in human immunodeficiency virus-infected patients: increase during highly active anti-retroviral therapy. Clin Exp Immunol 152, 57-63
Lanier LL, Bakker AB. The ITAM-bearing transmembrane adaptor DAP12 in lymphoid and myeloid cell function. Immunol Today 2000; 21:611–4.
Lee HJ, Lee EK, Lee KJ, Hong SW, Yoon Y, Kim JS (2006) Ectopic expression of neutrophil gelatinase-associated lipocalin suppresses the invasion and liver metastasis of colon cancer cells. Int J Cancer 118, 2490-2497
Lee, J.F. Stovall, G. M.Ellington, A. D. Aptamer therapeutics advance. Curr Opin Chem Biol, 2006. 10(3): p. 282-9.
Lee, J.O. So, H. M. , Jeon, E. K. Chang, H. Won, K. ,Kim, Y. H. Aptamers as molecular recognitionelements for electrical nanobiosensors. Anal Bioanal Chem, 2008. 390(4): p. 1023-32.
Leete T, Kulkarni R, Li X, Lee B, Kalandadze A, Ratner AJ, Pizarro JC, Schmidt-Ott KM, Landry DW, Raymond KN, Strong RK, Barasch J (2010) Iron traffics in circulation bound to a siderocalin (Ngal)-catechol complex. Nat Chem Biol 6, 602-609.
Leulier, F. and B. Lemaitre (2008).Toll-like receptors-taking an evolutionary approach. Nat Rev Genet VOL.9, NO.3, (2008): PP. 165-178, ISSN 1471-0064.
Levi, M. E. de Jonge, et al. (2000). [Disseminated intravascular coagulation]. Ned Tijdschr Geneeskd VOL.144, NO.10, (2000): PP. 470-475, ISSN 0028-2162.
Levy O. Antimicrobial proteins and peptides of blood: templantes for novel antimicrobial agents. Blood 2000; 96: 2664- 2672.
Linder A, Åkesson P, Brink M, Studahl M, Björck L, Christensson B. Heparin-binding protein: a diagnostic marker of acute bacterial meningitis. Crit Care Med 2011; 39:812–7.
Linder A, Åkesson P, Inghammar M, Treutiger CJ, Linner A, Sunden- Cullberg J. Elevated plasma levels of heparin-binding protein in intensive care unit patients with severe sepsis and septic shock. Crit Care 2012; 16:R90.
Linder A, Christensson B, Herwald H, Björck L, Åkesson P. Heparinbinding
Linder A, Johansson L, Thulin P, et al. Erysipelas caused by group A streptococcus activates the contact system and induces the release of heparin-binding protein. J Invest Dermatol 2010; 130:1365–72.
Linder A, Soehnlein O, Åkesson P. Roles of heparin-binding protein in bacterial infections. J Innate Immun 2010; 2:431–8.
Little P, Turner S, Rumsby K, et al. Dipsticks and diagnostic algorithms in urinary tract infection: development and validation, randomised trial, economic analysis, observational cohort and qualitative study. Health Technol Assess (Winchester, England) 2009; 13:iii–iv, ix–xi, 1–73
Liu CL, Hsieh WY, Wu CL, Kuo HT, Lu YT, (2007) Triggering receptor expressed on myeloid cells-1 in pleural effusions: a marker of inflammatory disease. Respir Med 101: 903-909
Locksley, R. M. N. Killeen, et al. (2001).The TNF and TNF receptor superfamilies: integrating mammalian biology. Cell VOL.104, NO.4, (2001): PP. 487-501, ISSN 0092-8674.
LOOMANS HJ, HAHN BL, LI QQ, PHADNIS SH, SOHNLE PG.: Histidine-based zinc-binding sequences and the antimicrobial activity of calprotectin. J Infect Dis 177: 812-814, 1998.
Lorenz, E. J. P. Mira, et al. (2002).Relevance of mutations in the TLR4 receptor in patients with gram-negative septic shock. Arch Intern Med VOL.162, NO.9, (2002): PP. 1028-1032, ISSN 0003-9926.
Ma, P. D. Chen, et al. (2002). [Genomic polymorphism within interleukin-1 family cytokines influences the outcome of septic patients]. Zhonghua Yi Xue Za Zhi VOL.82, NO.18, (2002): PP. 1237-1241, ISSN 0376-2491.
MAHNKE K, BHARDWAJ R, SORG C: Heterodimers of the calcium-binding proteins MRP8 and MRP14 are expressed on the surface of human monocytes upon adherence to fibronectin and collagen. Relation to TNF-α, IL-6, and superoxide production. J Leukoc Biol 57: 63-71, 1995.
Majka, M. J. Kijowski, et al. (2007).Evidence that platelet-derived microvesicles may transfer platelet-specific immunoreactive antigens to the surface of endothelial cells and CD34+ hematopoietic stem/ progenitor cells-implication for the pathogenesis of immune thrombocytopenias. Folia Histochem Cytobiol VOL.45, NO.1, (2007): PP. 27-32, ISSN 0239- 8508.
Marques F, Rodrigues AJ, Sousa JC, Coppola G, Geschwind DH, Sousa N, Correia-Neves M, Palha JA (2008) Lipocalin 2 is a choroid plexus acute-phase protein. J Cereb Blood Flow Metab 28, 450-455
Marshall, K.A. and A.D. Ellington, In vitro selection of RNA aptamers. Methods Enzymol, 2000. 318: p. 193- 214
Martin, T. R. (2000).Recognition of bacterial endotoxin in the lungs. Am J Respir Cell Mol Biol VOL.23, NO.2, (2000): PP. 128-132, ISSN 1044-1549.
Maruna P, Nedelníková K, Gürlich R. Physiology and genetics of procalcitonin. Physiol Res 2000:49 Suppl 1:S57-61.
Medzhitov R. Toll-like receptors and innate immunity. Nat Rev Immunol 2001; 1:135–45.
Mitchell, P. S. R. K. Parkin, et al. (2008).Circulating microRNAs as stable blood-base markers for cancer detection. Proc Natl Acad Sci U S A VOL.105, NO.30, (2008): PP. 10513-10518, ISSN 1091-6490.
Moestrup SK, Moller HJ, (2004) CD163: a regulated hemoglobin scavenger receptor with a role in the anti-inflammatory response. Annals of medicine 36: 347-354
MONNERET G,LAROCHE B, BIENVENU J: Procalcitonin is not produced by circulating blood cells. Infection 7: 34-35, 1999.
Morgenthaler NG, Struck J, Weglöhner W, Agay D, Bohuon C, Suarez-Domenech V, Bergmann A, Muller B. Production of procalcitonin (PCT) in nonthyroidal tissue after LPS injection. Horm Metab Res 2003:35:290-5.
Müller B, White JC, Nylén ES, Snider RH, Becker KL, Habener JF. Ubiquitous expression of the calcitonin-gene in multiple tissues in response to sepsis. J Clin Endocrinol Metab2001:86(1):396-404.
Nairz M, Theurl I, Schroll A, Theurl M, Fritsche G, Lindner E, Seifert invasive Salmonella enterica serovar Typhimurium infection via induction of lipocalin-2. Blood 114, 3642-3651M, Crouch ML, Hantke K, Akira S, Fang FC, Weiss G (2009) Absence of functional Hfe protects mice from
Nanda N, Juthani-Mehta M. Novel biomarkers for the diagnosis of urinary tract infection-a systematic review. Biomark Insights 2009; 4:111–21.
Nickolas TL, O’Rourke MJ, Yang J, Sise ME, Canetta PA, Barasch N, Buchen C, Khan F, Mori K, Giglio J, Devarajan P, Barasch J (2008) Sensitivity and specificity of a single emergency department measurement of urinary neutrophil gelatinase-associated lipocalin for diagnosing acute kidney injury. Ann Intern Med 148, 810-819
Nicod, L. P. F. el Habre, et al. (1995).Interleukin-10 decreases tumor necrosis factor alpha and beta in alloreactions induced by human lung dendritic cells and 1044-1549.
NISAPAKULTORN K, ROSS KF, HERZBERG MC: Calprotectin expression inhibits bacterial binding to mucosal epithelial cells. Infect Immun 69: 3692-3696, 2001.
NYLEN ES, WHANG KT, SNIDER RH, STEINWALD PM, WHITE JC, BECKER KI: Mortality is increased by procalcitonin and decresed by an antiserum reactive to procalcitonin in experimental sepsis. Crit Care Med 26: 1001-1006, 1998.
OBERHOFFER M, STONANS I, RUSSWURM S, STONANE E, VOGELSANG H, JUNKER U, JAGER L, REINHART K: Procalcitonin expression in human peripheral blood mononuclear cells and its modulation by lipopolysaccharides and sepsis- related cytokines in vitro. J Lab Clin Med 134: 49-55, 1999.
Ogus, A. C. B. Yoldas, et al. (2004).The Arg753GLn polymorphism of the human toll-like receptor 2 gene in tuberculosis disease. Eur Respir J VOL.23, NO.2, (2004): PP. 219-223, ISSN 0903-1936.
Opal, S. M. and C. E. Huber (2002).Bench-to-bedside review: Toll-like receptors and their role in septic shock. Crit Care VOL.6, NO.2, (2002): PP. 125-136, ISSN 1364-8535.
O’Shea, J. J. A. Ma, et al. (2002).Cytokines and autoimmunity. Nat Rev Immunol VOL.2, NO.1, (2002): PP. 37-45, ISSN 1474-1733.
Otto G, Braconier J, Andreasson A, Svanborg C. Interleukin-6 and disease severity in patients with bacteremic and nonbacteremic febrile urinary tract infection. J Infect Dis 1999; 179:172–9.
Owen HC, Roberts SJ, Ahmed SF, Farquharson C (2008) Dexamethasone-induced expression of the glucocorticoid response gene lipocalin 2 in chondrocytes. Am J Physiol Endocrinol Metab 294, E1023-E1034
Paterson DL. “Collateral damage” from cephalosporin or quinolone antibiotic therapy. Clin Infect Dis 2004; 38 (Suppl 4):S341–5.
PILLAY SN, ASPLIN JR, COE FL: Evidence that calgranulin is produced by kidney cells and is an inhibitor of calcium oxalate crystallization. Am J Physiol 275: F255-F261, 1998.
polymorphism does not influence inflammation and coagulation response in human
Poullis A, Foster R, Mendall MA, Fagerhol MK. Emerging role of calprotectin in gastroenterology. J Gastroenterol Hepatol 2003; 18: 756- 762.
protein: an early marker of circulatory failure in sepsis. Clin Infect Dis 2009; 49:1044–50.
Prucha, M. R. Zazula, et al. (2008).Genomic polymorphism and sepsis-is there a reason for optimism? Prague Med Rep VOL.109, NO.2-3, (2008): PP. 113-126, ISSN 1214-6994.
Puppo, A. and B. Halliwell. 1988. Formation of hydroxyl radicals from hydrogen peroxide in the presence of iron. Is haemoglobin a biological Fenton reagent? Biochem. J. 249: 185–190.
Rammes A, Roth J, Goebeler M, Klempt M, Hartmann M, Sorg C. myeloid- related protein (MRP) 8 and MRP14, calcium- binding proteins of the S100 family, are secreted by activated monocytes via a novel, tubulin- dependent pathway. J Biol Chem 1997; 272 (14): 9496-9502.
RAMMES S, KEWITZ G, VERSMOLD H, NIGGEMANN B, RAMMES A: Myeloid-related protein (MRP) 8 and MRP14, calcium-binding proteins of the S100 family, are secreted by activated monocytes via a novel, tubulindependent pathway. Pediatr Allergy Immunol 8: 153-155, 1997
Rodhe N, Löfgren S, Strindhall J, Matussek A, Mölstad S. Cytokines in urine in elderly subjects with acute cystitis and asymptomatic bacteriuria. Scand J Prim Health Care 2009; 27:74–9.
Roos BA, Okano K, Deftos LJ. Evidence for a pro-calcitonin. Biochem Biophys Res Commun 1974:60(3):1134-40.
Rosenfeld MG, Amara SG, Roos BA, Ong ES, Evans RM. Altered expression of the calcitonin gene associated with RNA polymorphism. Nature 1981:290(5801):63-5.
ROTH J, GOEBELER M, SORG C: S100A8 and S100A9 in inflammatory diseases. Lancet 357: 1041, 2001.
Sadrzadeh, S. M. D. K. Anderson, S. S. Panter, P. E. Hallaway, and J. W. Eaton. 1987. Hemoglobin potentiates central nervous system damage. J. Clin. Invest. 79: 662–664.
SAMPSON B, FAGERHOL MK, SUNDERKOTTER C, GOLDEN BE, RICHMOND P, KLEIN N, KOVAR IZ, BEATTIE JH, WOLSKA-KUSNIERZ B, SAITO Y, ROTH J: Hyperzincaemia and hypercalprotectinaemia: a new disorder of zinc metabolism. Lancet 360: 1742-1745, 2002.
SAMPSON B, FAGERHOL MK, SUNDERKOTTER C, GOLDEN BE, RICHMOND P, KLEIN N, KOVAR IZ,BEATTIE JH, WOLSKA-KUSNIERZ B, SAITO Y, ROTH J: Hyperzincaemia and hypercalprotectinaemia: a new disorder of zinc metabolism. Lancet 360: 1742-1745, 2002
Sampson, T. Aptamers and SELEX:the technology. World Patent Information, 2003. 25: p. 123 129.
SANDER J, FAGERHOL MK, BAKKEN JS, DALE I: Plasma levels of the leukocyte L1 protein in febrile conditions: relation to aetiology, number of leucocytes in blood, blood sedimentation reaction and C-reactive protei.Scand J Clin Lab Invest 44: 357-362, 1984.
Setzer, F. V. Oberle, et al. (2006).Platelet-derived microvesicles induce differential gene expression in monocytic cells: a DNA microarray study. Platelets VOL.17, NO.8, (2006): PP. 571-576, ISSN 0953-7104.
Sikora J. P. Immunotherapy in the Management of Sepsis: Management of Sepsis. Archivum Immunologiae et Therapiae Experimentalis 2002:50:317-24.
Singer E, Elger A, Elitok S, Kettritz R, Nickolas TL, Barasch J, Luft FC, Schmidt-Ott KM (2011) Urinary neutrophil gelatinase-associated lipocalin distinguishes pre-renal from intrinsic renal failure and predicts outcomes. Kidney Int.
Skaar, E. P. M. Humayun, T. Bae, K. L. DeBord, and O. Schneewind. 2004. Iron-source preference of Staphylococcus aureus infections. Science 305: 1626– 1628.
Soehnlein O. Direct and alternative antimicrobial mechanisms of neutrophil-derived granule proteins. J Mol Med (Berl) 2009; 87:1157–64.
Sohnle PG, Collins- Leach C, Wiessner JH. The zinc – reversible antimicrobial activity of neutrophil lysates and abscess fluid supernatants. J Infect Dis 1991; 164: 136-142.
Song, K.M. Lee, S.Ban, C. Aptamersand their biological applications. Sensors (Basel), 2012. 12(1): p. 612- 31.
Sooter, L.J. Riedel, T. Davidson, E. A. Levy, M. Cox, J. C. Ellington, A. D. Toward automated nucleic acid enzyme selection. Biol Chem, 2001. 382(9): p. 1327-34.
SRIKRISHNA G, PANNEERSELVAM K, WESTPHAL V, ABRAHAM V, VARKI A, FREEZE HH: Two proteins modulating transendothelial migration of leukocytes recognize novel carboxylated glycans on endothelial cells. J Immunol 166: 4678-4688, 2001.
St John A, Boyd JC, Lowes AJ, Price CP. The use of urinary dipstick tests to exclude urinary tract infection: a systematic review of the literature. Am J Clin Pathol 2006; 126:428–36.
Steinbakk M, Naess – Andersen C-F, Lingaas E et al. Antimicrobial actions of calcium binding leucocyte Li protein, calprotectin. Lancet 1990; 336: 763-765.
STEINBAKK M, NAESS-ANDRESEN CF, LINGAAS E, DALE I, BRANDTZAEG P, FAGERHOL MK: Antimicrobial actions of calcium binding leucocyte L1 protein, calprotectin. Lancet 336: 763-765, 1990.
Stoltenburg, R. C. Reinemann, and B. Strehlitz, SELEX-a (r)evolutionary method to generate high-affinity nucleic acid ligands. Biomol Eng, 2007. 24(4): p. 381 403.
STRUPAT K, ROGNIAUX H, VAN DORSSELAER A, ROTH J, VOGL T: Calcium-induced noncovalently linked tetramers of MRP8 and MRP14 are confirmed by electrospray ionization-mass analysis. J Am Soc Mass Spectrom 11: 780-788, 2000.
Su LX, Feng L, Zhang J, Xiao YJ, Jia YH, Yan P, Feng D, Xie LX, (2011) Diagnostic value of urine sTREM-1 for sepsis and relevant acute kidney injuries: a prospective study. Crit Care 15: R250.
SWEDRES 2010: a report on Swedish antibiotic utilisation and resistance in human medicine. Available at: http://www.strama.se/uploads/ docs/Swedres%202010%20final.pdf. Accessed 26 November 2013.
Teuffel, O. M. C. Ethier, et al. (2010).Association between tumor necrosis factor-alpha promoter -308 A/G polymorphism and susceptibility to sepsis and sepsis mortality: a systematic review and meta-analysis. Crit Care Med VOL.38, NO.1, (2010): PP. 276-282, ISSN 1530-0293.
Thomassen, M. J. L. T. Divis, et al. (1996).Regulation of human alveolar macrophage inflammatory cytokine production by interleukin-10. Clin Immunol Immunopathol VOL.80, NO.3 Pt 1, (1996): PP. 321-324, ISSN 0090-1229.
through iron sequestration. Structure 13, 29-41
Tibble JA, Bjarnason I. non- invasive investigation of inflammatory bowel disease. World J Gastroenterol 2001; 7 (4): 460- 465.
Tombelli, S. M. Minunni, and M. Mascini, Analytical applications of aptamers. Biosens Bioelectron, 2005. 20(12): p. 2424-34.
Tong Z, Chakraborty S, Sung B, Koolwal P, Kaur S, Aggarwal BB, Mani SA, Bresalier RS, Batra SK, Guha S (2011) Epidermal growth factor down-regulates the expression of neutrophil gelatinase-associated lipocalin (NGAL) through E-cadherin in pancreatic cancer cells. Cancer, 117, 2408-2418
Tong Z, Kunnumakkara AB, Wang H, Matsuo Y, Diagaradjane P, Harikumar KB, Ramachandran V, Sung B, Chakraborty A, Bresalier RS, Logsdon C, Aggarwal BB, Krishnan S, Guha S (2008) Neutrophil gelatinase-associated lipocalin: a novel suppressor of invasion and angiogenesis in pancreatic cancer. Cancer Res 68, 6100-
Tuerk, C. and L. Gold, Systematic evolution of ligands by exponential enrichment: RNA ligands to bacteriophage T4 DNA polymerase. Science, 1990. 249(4968): p. 505-10.
Valadi, H. K. Ekstrom, et al. (2007).Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol VOL.9, NO.6, (2007): PP. 654-659, ISSN 1465-7392.
van Niel, G. I. Porto-Carreiro, et al. (2006).Exosomes: a common pathway for a specialized function. J Biochem VOL.140, NO.1, (2006): PP. 13-21, ISSN 0021-924X.
vascular leakage. Cell 2004; 116:367–79.
Vasilescu, C. S. Rossi, et al. (2009).MicroRNA fingerprints identify miR-150 as a plasma prognostic marker in patients with sepsis. PLoS One VOL.4, NO.10, (2009): PP. e7405, ISSN 1932-6203.
Voganatsi A, Panyutich A, Miyasaki KT, Murthy RK. Mechanism of extracellur release of human neutrophil calprotectin comples. J Leukoc Biol 2001; 70: 130-134.
VOGANATSI A, PANYUTICH A, MIYASAKI KT, MURTHY RK: Mechanism of extracellular release of human neutrophil calprotectin complex. J Leukoc Biol 70: 130-134, 2001.
Wang, H. K. Meng, et al. (2012).Serum miR-574-5p: A Prognostic Predictor of Sepsis Patients. Shock VOL.37, NO.3, (2012): PP. 263-267, ISSN 1540-0514.
Wang, K. S. Zhang, et al. (2009).Circulating microRNAs, potential biomarkers for druginduced liver injury. Proc Natl Acad Sci U S A VOL.106, NO.11, (2009): PP. 4402-4407, ISSN 1091-6490.
Yui S, Mikami M, Tsurumaki K, Yamazaki M. growth – inhibitory and apoptosis inducing activities of calprotectin derived from inflammatory exudated calls on normal fibroblasts: regulation by metal ions. J Leuckoc Biol 1997; 61: 50-57.
Zelada-Guillen, G.A., Riu, J., Duzgun, A., Rius, F. X., Immediate detection of living bacteria at ultralow concentrations using a carbon nanotube based potentiometric aptasensor. Angew Chem Int Ed Engl, 2009. 48(40): p. 7334-7.
Zhang J, She D, Feng D, Jia Y, Xie L, (2011) Dynamic changes of serum soluble triggering receptor expressed on myeloid cells-1 (sTREM-1) reflect sepsis severity and can predict prognosis: a prospective study. BMC Infect Dis 11: 53
Zhang, G., Q. Wang, et al. (2010).Therapeutics Based on microRNA: A New Approach for Liver Cancer. Curr Genomics VOL.11, NO.5, (2010): PP. 311-325, ISSN 1875-5488.
ZWADLO G, SCHLEGEL R, SORG C: A monoclonal antibody to a subset of human monocytes found only in the peripheral blood and inflammatory tissues. J Immunol 137: 512-518, 1986.
[1]– Procalcitonin
[2]– Small cell lung carcinoma
[3] – systemic inflammatory response syndrome(SIRS)
[4] – Biochemical characteristic
[5] – Catacalcin
[6] – Amyline
[7] -hyper kalemia
[8] -Tumor Necrosing Factor (TNF)
[9] – Inter leukin-6 (IL-6)
[10] – SIRS
[11] – surveillance
[12] – Calprotectin
[13] -T-helper-1 (Th1)
[14] – Calprotectin structure
[15] – Physiological role of membrane calprotectin
[16] – TNF-α
[17] – IL-6
[18] – hypercalprotectinemia
[19] – Clorectal Carcinoma
[20] – Inflamotory Bowel Disease (IBD)
[21] – Triggering receptor expressed on myeloid cells-1(TERM-1)
[22] – Soulble TERM-1
[23] -Sequential organ Failur Assesment (SOFA)
[24] – WBC count
[25] -C-Reactive Protein (CRP)
[26] -Acute kidney Injery (AKI)
[27] -Natural Killer cell (NK)
[28] – Toll- like Receptors (TLRs)
[29] – micro RNAs
[30] – Single nucleotide polymorphism (SNPs)
[31] -Coding SNPs(cSNPs)
[32] – Non Synonymous (nsSNPs)
[33] – nuclear factor kappa- light. Chain- enhancer of activated B-cell
[34] -Natural killer cell
[35] – Mast cells
[36] -Antigen Processing cell
[37] – Pro-inflamatory
[38] -Neutrophil Gelatinase Associated lipocalin
[39] -Carcino Embrionic Antigen (CEA)
[40] – Focal adhesion kinase
[41] – E.cadherin
[42]– Pre renal azotemia
[43] – Cardio Pumonary bynass (CPB)
[44] – Urinary Tract infection (UTI)
[45] -Nitrite
[46] -Cerebro spinal Floid
[47] – Systematic Evolution of ligands – by Exponential enrichment (SELEX)
[48] – stability
[49] – Stem-Loop
[50] – Hairpin
[51] – Psudo knot
[52] – quadruplex
[53] – BioImage
[54] – Mocugen
[55] Vascular endothelial Growth factor(VEGF)
[56] – Biosensor
[57] – Aptasensor
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام