كاربردهاي Quorum sensing
(بخش سوم)
لیلا دهاقین
فوق لیسانس بيماريشناسي گياهي – دانش آموخته دانشگاه تربيت مدرس
روشن شدن برخي از جنبههای مکالمه باکتریها (و نه همه آنها) ایدههایی را براي استفاده از اين پديده مهم در ذهن محققان ايجاد کرده است که تعدادي از آنها در اينجا نام برده شده و به دليل اهميت مورد اول در سلامتي انسان بهصورت خلاصه به آن پرداخته میشود.
1- كنترل بیماریهای گياهي و جانوري
2- طراحي شبکههای ژني سنتتيك
3- كاربردهاي آن در توليد محصولات مفيد تخميري
كنترل بیماریهای گياهي و جانوري
الف) توليد گياهان تراریخته
پديده Q.S براي كنش ميان باكتري (چه پاتوژن و چه همزيست) و گياه ميزبان ضروري ميباشد. فعال شدن و بروز صفاتي كه مسئول كنش باكتري با گياه ميزبان هستند در مراحل زماني مشخص، استقرار موفقیتآمیز جمعيت باكتريايي را در گياه ميزبان تضمين ميكند. بروز زودهنگام اين صفات ميتواند باعث تحريك سيستم دفاعي ميزبان شده و بنابراين براي جمعيت باكتريايي نابودکننده باشد. اين ايده براي توليد گياهان تراریختهای كه آنزیمهای AHL سنتتاز باكتريايي را كد ميكنند، بكار گرفته شده است. توليد مولکولهای سيگنال AHL توسط گياه تراریخته يك پيام اشتباه را به باكتري در مورد تراكم جمعيت آن ميفرستد كه نهايتاً باعث بروز صفات كنترلشونده بهواسطه Q.S شده و سيستم دفاعي ميزبان را قبل از افزايش جمعيت باكتريايي تحريك ميكند. اگرچه توليد گياهان تراریخته بهوسیله كلون كردن AHL سنتتازها اميدهايي را براي جلوگيري از بروز بیماریهای گياهي ايجاد كرده است، اما اين مسئله ميتواند همچنين سیستمهای Q.S را در ساير فلورهاي بالقوه مفيد موجود در خاك نيز مورد هدف قرار دهد و منجر به بروز نتايج و پيشآمدهاي نامطلوب شود. از طرفي اين راهكار ممكن است باكتري را مجبور كند تا از انواع ديگر مولکولهای پيامبر (AI) براي سيستم Q.S استفاده نمايد كه برخي از آنها ممكن است واقعاً براي ميزبان مضر باشند.
ب) كنترل تشكيل بيوفيلم
اغلب باکتریها در طبيعت در ارتباط با سطوحي كه روي آنها يافت ميشوند اجتماعاتي را تشكيل ميدهند. جوامع ميكروبي يا بيوفيلم از باکتریهايي تشكيل شدهاند كه درون زمينهاي از جنس پليساكاريد قرار دارند. باکتریها بهصورت تصادفي در اين ماده زمینهای توزيع نشدهاند، بلكه بهصورت ساختارهايي سازمانیافته ميباشند. اين شكل سازمانیافته به آنها اين امكان را ميدهد كه مواد غذايي و مواد زائد را بهراحتی به درون و خارج از بيوفيلم منتقل كنند. بيوفيلمها در طبيعت ندرتاً از يك گونه باكتريايي خاص تشكيل یافتهاند، بلكه در اجتماع بيوفيلم ميتواند چندين گونه باكتري وجود داشته باشد؛ براي مثال بيوفيلمهاي دهان (پلاك دنداني) از صدها گونه باكتري تشكيل شده است. بيوفيلم از لحاظ بیماریزایی و كلينيكي يك مشكل مهم و اساسي ميباشد، چرا كه بيوفيلم باکتریها مقاومت بالايي را به عوامل ضدميكروبي و مکانیسمهای دفاعي ميزبان نشان ميدهند، بنابراين دانستن مکانیسمهایي كه تشكيل بيوفيلم را كنترل میکنند مهم است. ارتباط سلول- سلول، يكي از مکانیسمهایي است كه براي توسعه و پايداري جوامع ميکروبي و سازمانیابی بيوفيلم ارائه شده است، بنابراين تداخل در ارتباطات سلول- سلول در میکروارگانیسمها بهعنوان يك راهكار فرعي جهت جلوگيري از تشكيل بيوفيلم پيشنهاد شده است.
تنظيم توليد آنتیبیوتیکهای کارباپنمی (Carbapenem) توسط Quorum sensing در Pectobacterium carotovorum
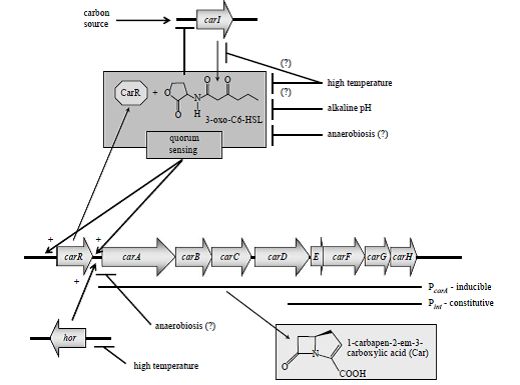
سویه ATCC 39048 carotovorum.subsp carotovorum Pectobacterium ابتدا سطوح قابل تشخيصي از آنتیبیوتیک گروهß–lactam به نامCar را طي عبور از مرحله لگاريتمي به مرحله ايستايي در كشت آزمايشگاهي توليد میکند. در اين سویه بيوسنتز Car و عملكردهاي مربوط به مقاومت خودكار، به كمك كلاستر ژني CarABCDEFGH كد میشود (شكل 1). آنزیـــمهای كدشده توسط CarA ، CarB و CarC جهت توليد Car ضروري هستند. CarB نخستين مرحله در بيوسنتز Car را كاتاليز میکند كه ساختن كربوكسيمتيلپرولين ازا پيشمادهاش میباشد. به نظر میرسد پيشماده مذكور از استات و گلوتامات مشتق شده باشد.
CarD و CarE در فراهم كردن اين پيشمادهها مرتبط هستند، با اين وجود ژنهای CarD و CarE ضروري نيستند و اختلال در هر دو ژن منجر به كاهش توليدCar میشود، اما منجر به عدم توليد آن نمیشود.
CarA، يك ß-lactam سنتتاز است كه روي محصول واكنش كاتاليزشده توسط CarB به نام كربوكسيمتيلپرولين عمل كرده و باعث بسته شدن حلقه ß -lactam میشود. در نهايت CarC تشكيل آنتیبیوتیک فعال Carbapenem را كاتاليز میکند، علاوه بر اين، سویه ATCC 39048 داراي مکانیسم مقاومت به آنتیبیوتیک توليد شده است كه توسط CarF و CarG كد میشود تا با عملكرد آنتیبیوتیکي كه خودش ساخته واكنش نشان بدهد. با اين وجود تاکنون عملكرد محصول ژن CarH ناشناخته باقی مانده است.
شكل 1. تنظيم توليد آنتیبیوتیک Carbapenem در
carotovorum .subsp carotovorum Pectobacterium
carA-E آنزیمهای بيوسنتز Car را كد میکنند و carF-G مکانیسم مقاومت به Car را كد میکنند. عملكرد محصول carH نامشخص است. ژنهای carA-H توسط پروموتور وابستــــــه به Quorum sensing بیان میشوند كه پروموتور مذکور در بالادست carA قرار گرفته است. همچنين يك پروموتور دائمي ضعيف درون carD قرار دارد (Pint) كه باعث بيان carEFGH میشود، بنابراين مکانیسم مقاومت Car را در غياب محصول وابسته به Quorum sensing فعال میکنـــد. Quorum sensing به يـــك مولكــول سيگنــــال قابــل انتشــــــــار N- (3-oxohexanoyl) -L-homoserine lactone (3-oxo-C6-HSL) نياز دارد كه بهوسیله car I سنتاز توليد میشود. 3-oxo-C6-HSL به تنظیمکننده CarRمتصل شده و آن را فعال میکند كه اين تنظیمکننده بلافاصله در بالادست ژن carA كد میشود. Car R /3-oxo-C6-HSL به پروموتور carA متصل شده و رونويسي از carA-H را فعال میکند. توليد Car همچنين توسط محصول ژن hor كنترل میشود. فاكتورهاي محيطي متعددي از جمله حرارت، pH محيط كشت، منبع كربن و شرايط بیهوازی در بيان carA-H مؤثرند. پیکانهای نوکتیز يا علامتهای + بيانگر تأثير مثبت هستند در حاليكه پیکانهای بدون نوك بيانگر تأثير منفي میباشند. علامت (؟) بيانگر تأثير احتمالي است.
كلاستر ژني Car در شكل 1 نشان داده شده است. هشت ژن car به همراه يك پروموتور مربوط به Q.S تحت يك اپرون سازماندهي شدهاند كه اين پروموتور bp 52 بالاتر از آغاز ترجمه carA قرار دارد، با اين وجود يك پروموتور ضعيف غيروابسته به Q.S درون carA قرار دارد كه باعث میشود سلولها بهطور مداوم carE-H را در غلظتهای پايين سلول بيان كنند تا در برابر Car توليدشده توسط باکتریهاي ديگر مقاومت كنند.
بيان ژنهای مقاومت، وابسته به Q.S نمیباشد؛ به اين دليل كه مکانیسم مقاومت به Car قبل از بيان ژنهای بيوسنتزكننده آنتیبیوتیک صورت میپذیرد. كارهاي پيشين نشان داده است كه محصول يك ژن واحد مسئول توليد مولكول سيگنال Q.S میباشد. اين ژن پروتئيني مشابه پروتئين شناختهشده LuxI در
Vibrio fischeri كد میکند كه CarI نام دارد. CarI سيگنال AHL را توليد میکند (شکل 1). سیستمهای Q.S مبتني بر AHL نياز به يك تنظیمکننده رونويسي دارند كه اين تنظیمکننده جزء گروه پروتئینهای LuxR میباشد كه سيگنال AHL را شناسايي میکند و باعث ايجاد تغيير در تنظيمات نسخهبرداری میشود. همولوگ LuxR كه در كنترل توليدCar در Pectobacterium نقش دارد CarR نام دارد و توسط ژن carR كد میشود كه بلافاصله در بالادست carA قرار میگیرد. ژن carR يك واحد نســـخهبرداری مجزا از اپران carA-H میباشد. ژنcarI در جاي ديگري از ژنوم قرار گرفته و نزديك ژن ديگري به نام expR قرار دارد كه توسط دومين همولوگ LuxR در باکتریهاي مولد پوسیدگی نرم كد میشود. در نهايت يك ژن ديگر در ژنوم اين باکتریها وجود دارد به نام VirR كه توسط سومين همولوگ LuxR كد میشود. VirR يك تنظیمکننده مهم در فاكتورهاي بیماریزایی میباشد. اختلال در carI يا carR منجر به عدم توليد Car و عدم رونويسي از پروموتور وابسته به Q.S میشود. با اين وجود غیرفعال كردن expR و virR در حضور يا عدم حضور ژن carI تأثیر آشکاری بر توليد Car نمیگذارد؛ بنابراين بهنظر میرسد كه CarR تنها همولوگ LuxR در ATCC 39048 است كه در ارتباط با تنظيم توليد Car است. در موتانهاي carI میتوان وابستگي توليد آنتیبیوتــیکCar به 3-oxo-C6-HSL را از طريق فراهم كردن carR روي پلاسميد از بين برد، بنابراين CarR در صورتيكه غلظت آن بالا باشد توانايي فعال كردن پروموتور carR را در روش مستقل از ليگاند دارد .
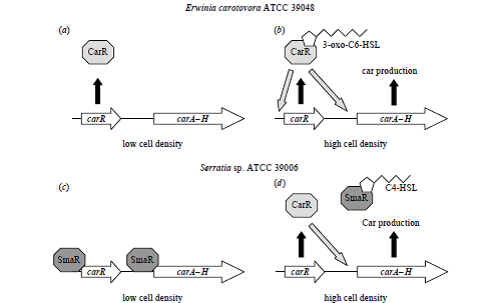
مدلي براي كنترل sensing Quorum در توليد Car در Pectobacterium
مدل Q.S مربوط به تنظيم توليد آنتیبیوتیک در Pectobacterium در شكل 2 نشان داده شــــــــــده است. 3-oxo-C6-HSL مستقيماً با پروتئين CarR واكنش میدهد و باعث افزايش ميل تركيبي DNA آن به ناحيه بينژني carA-R میشود. بدنبال اتصال 3-oxo-C6-HSL/ CarR به پروموتور carA، رونويسي از carA-H فعال شده و منجر به توليد Car میگردد، بنابراين تحت شرايــط عادي توليد Car توسط CarR تا زمانی که غلظت 3-oxo-C6-HSL به سطح بالايي نرسد فعال نمیشـــــــــــود كه اين افزايش غلظت 3-oxo-C6-HSL طي عبور از مرحله لگاريتمي به مرحله ايستايي اتفاق میافــــــــــتد. زمانی که سطوح 3-oxo-C6-HSL طي مرحله ايستايي كاهش مییابد فرض بر اين است كه 3-oxo-C6-HSL شروع به جدا شدن از CarR مینماید، زيرا كه بيش از اين قادر نيست به پروموتور carA و carR متصل بماند و آنها را فعال كند بنابراين توليد Car متوقف میشود.
شكل 2. مدلهایی براي كنترل مرتبط با sensing Quorum در توليد (Car b و a)
در carotovorum . P سویه ATCC 39048 و (d و c) در Serratia spp سویه ATCC 39006
در غلظتهای پايين سلول carA – H در Pectobacterium و Serratia بيان نمیشود (c و a). در Pectobacterium اين امر به اين دليل است كه رونويسي از carA – H فعال نمیشوند (a)؛ اما در Serratia بازدارنده SmaR در غياب سيگنال sensing Quorum يك لايه كنترل ديگري را هم اضافه مینماید كه باعث مهار رونويسي از carA-H و carR میشود (c). در غلظتهای بالاي سلول در Pectobacterium سيگنال 3-oxo-C6-HSL بهcarR متصل شده و آن را فعال مینماید كه باعث آغاز رونويسي میشود و در نتيجه توليدCar را فعال میکند .(b) در Serrattia در غلظتهای بالاي سلولي سيگنال sensing Quorum AHL بازدارنده SmaR را غیرفعال میکند، سپس پروتئين CarR در Serratia قادر به فعال كردن رونويسي carA – H در مسير غيروابسته به ليگاند میباشد .(d)
تنظیمکننده Hor
سيستم Q.S در carotovorum P. تنها سيستم ژنتيكي مسئول در كنترل توليد Car نيست. محصول ژن hor از تنظیمکنندههای رونويسي خانواده SlyA میباشد. اين خانواده از پروتئينها، طيف وسيعي از عملكردهاي فيزيولوژيكي مانند مقاومت چند دارويي، توليد توكسين، توليد متابوليتهاي ثانويه و شدت بیماریزایی را، هم در پاتوژنهای گياهي و هم حيواني كنترل مینمایند. در باکتریهاي مولد پوسیدگی نرم، Hor يك فعالکننده توليد (Car و PCDWE) میباشد. آناليز نسخهبرداری از carA در سویههای مختلف نشان داده است كه Hor رونويسي از پروموتور carA را فعال میکند. با اين وجود اتصال فيزيكي Hor به پروموتور carA هنوز ثابت نشده است. از آنجا كه Hor تأثيري روي رونويسي از carR يا carI ندارد، بهنظر میرسد كه بيوسنتز Car را از طريق مکانیسم غيروابسته به Q.S تنظيم میکند. با اين وجود، در فنوتيپ موتانهاي hor، Car و اگزوآنزيمها میتوانند بهصورت جزئي از طريق فراهم نمودن 3-oxo-C6-HSL اضافي و افزودن آن از بيرون جبران شوند كه اين نشاندهنده احتمال يك نوع تعامل بين Q.S و مسيرهاي وابسته به Hor براي كنترل توليد Car میباشد.
مکانیسم Quorum sensing در كنترل توليد فاكتورهاي مؤثر در شدت بیماریزایی
كنترل توليد Car از طريق غلظت سلول در Pectobacterium و Serratia با تصوير توضيح داده شد كه در پاتوژنهای مذکور تعدادي از پروتئینهای خانواده LuxR نقش مهمي را در Q.S بهعهده داشتند. در اكثر موارد، مشخص شده است كه پروتئینهای تيپ Lux-R جهت شناسايي سيگنال AHL توليدشده توسط اعضاي خانواده LuxI ضروري میباشند و مطابق آن بيان ژنها تنظيم میشود. تنظيم توليد آنتیبیوتیک Carbapenem از طريق CarR درPectobacterium صورت میپذیرد، با اين وجود ايجاد موتاسيون در ژن Car R carotovorum P. هيچگونه تأثيري بر توليد فاكتورهاي بیماریزا در اين سویه نداشت. ژنهای نظير luxIR در سویه Pcc71، expI و expR نام دارند. مطالعات اخير نشان داده است كه ExpR71 داراي يك نقش احتمالي در كنترل توليد فاكتورهاي بیماریزایی است. ExpR71 در غياب سيگنال AHL پروتئين RsmA (تنظیمکننده متابوليتهاي ثانويه) را تحریک میکند، در نتیجه بهصورت منفي توليد فاكتورهاي مؤثر در شدت بیماریزایی را تنظيم میکند. در مطالعه اخير كويي و همكاران نشان داده شد كه ExpR71 در آزمايشگاه در غيــاب AHL به پروموتـــــور rsmA متصل میشود و اين اتصال با افزودن سيگنال AHL، 3-oxo-C6-HSL، لغو میشود كه اين موضوع مرتبط میشود با مشاهداتي كه در آن سطوح RsmA در موتان expI بالاتر از موتان دوتايي expI و expR است، درحاليكه توليد فاكتور بیماریزایی در موتان expR افزايش پيدا میکند، اما اين افزايش توليد به سطح بيان 3-oxo-C6-HSL در سلولهاي تيپ وحشي Pcc 71 نمیرسد. در سال 2005 ولچ و همكاران بر روي ليگاندهاي متصلشونــــده به پروتئیـــنهای LuxR در ATCC 39048 Pcc. تحقيق کردند. آنها اتصالات را با استفاده از لیگاندهای مشتقشده از سيگنال فيزيولوژيكي Q.S 3-oxo-C6-HSL بررسي نمودند و نتايج آنها نشان داد كه از ميان ليگاندهاي مختلفي كه مورد آزمايش قرار گرفته، 3-oxo-C6-HSL محکمترین ليگاندي است كه با CarR Pcc برقرار میشود و در نتيجه به بيشترين القاء توليدCarbapenem میانجامد. با اين وجود،3-oxo-C6-HSL محکمترین ليگاندي نيست كه به ExpR متصل میشود، اما اين ليگاندي است كه بهشدت توليد PCWDE ها را القاء میکند (PCWDEها پروتئینهای ترشحي هستند که در ارتباط با حمله به بافت گياهي میباشند)، بنابراين ممكن است كه بخش تحریککننده توليد فاكتور بیماریزایی در واكنش با 3-oxo-C6-HSL توسط عامل ديگري صورت پذیرد.
منابع:
Loh, J., Lohar, D. P., Andersen, B. and Stacey, G. (2002). A two-component regulator mediates population-density-dependent expression of the Bradyrhizobium japonicum nodulation genes. Journal of Bacteriology, 184: 1759–1766.
Loh, J., Pierson, E. A., Pierson III, L. S., Stacey, G. and Chatterjee, A. (2002). Quorum sensing in plant-associated bacteria. Current Opinion in Microbiology, 5: 285–290.
Kirisits, M. J. and Parsek, M. R. (2006). Does Pseudomonas aeruginosa use intercellular signalling to build biofilm communities? Cell Microbiology, 8: 1841–1849.
Welch, M., Dutton, J. M., Glansdorp, F. G., Thomas, G. L., Smith, D. S., Coulthurst, S. J., Barnard, A. M. L., Salmond, G. P. C. and Spring, D. R. (2005). Structure–activity relationships of Erwinia carotovora quorum sensing signalling molecules. Bioorganic and Medicinal Chemistry Letters, 15: 4235–4238.
Welch, M., Todd, D. E., Whitehead, N. A., McGowan, S. J., Bycroft, B. W. and Salmond, G. P. C. (2000). N-acyl homoserine lactones binding to the CarR receptor determines quorum-sensing specificity in Erwinia. European Molecular Biology Organization Journal, 19: 631–641.
McGowan, S. J., Sebaihia, M., Porter, L. E., Stewart, G. S. A. B., Williams, P., Bycroft, B. W. and Salmond, G. P. C. (1996). Analysis of bacterial carbapenem antibiotic production genes reveals a novel β-lactam biosynthesis pathway. Molecular Microbiology, 22: 415–426.
McGowan, S. J. and Salmond, G. P. C. (1999). Regulation of carbapenem antibiotic and exoenzyme synthesis by chemical signalling. Cambridge University Press. Cambridge, UK: 161–175.
Burr, T., Barnard, A. M. L., Corbett, M. J., Pemberton, C. L., Simpson, N. J. L. and Salmond, G. P. C. (2006). Identification of the central quorum sensing regulatory of virulence in the enteric phytopathogen, Erwinia carotovora: the VirR repressor. Molecular Microbiology, 59: 113–125.
نقش Quorum sensing در باکتریها (2)
نقش Quorum sensing در باکتریها (1)
برای دانلود فایل pdf بر روی لینک زیر کلیک کنید
ورود / ثبت نام