تازههایی از بوردتلاها
دكتر رضا ميرنژاد (استاد تمام دانشگاه)
مقدمه:
گونههای بوردتلا کوکوباسیلهای کوچک، هوازی اجباری، غیرتخمیرکننده و کاتالاز مثبت هستند که میتوانند اسیدهای آمینه را اکسید کرده اما قندها را تخمیر نمیکنند. چندین گونه بوردتلا وجود دارد. این گونهها در مجاری تنفسی حیوانات خونگرم یافت میشوند. بوردتلا پرتوسیس (Bordetella pertussis) یك بیماریزای بسیار مسری و مهم در انسان است كه ایجاد سیاهسرفه یا پرتوسیس (Whooping Cough) مینماید. بوردتلا پاراپرتوسیس (B.parapertussis) نیز ایجاد بیماری مشابهی مینماید. این باکتری علاوه بر آلودگی انسان برهها را هم آلوده میکند، اما یک پاتوژن غیرشایع انسانی است که ممکن است ایجاد عفونت بدون علامت و یا بیماری سیاهسرفه یا خروسک و اغلب برونشیت نماید.
بوردتلا برونشیسپتیكا (B.bronchiseptica) در حیوانات مانند سگ و خرگوش ایجاد بیماری میكند و در انسانهای با ضعف سیستم ایمنی گاهی اوقات بیماری شبیه به سیاهسرفه را سبب میشود. این باکتری اساساً سبب ایجاد سرفه کنل در سگ[1] میگردد. گونه چهارم بوردتلا آویوم تنها پرندگان را آلوده میکند. مطالعات ژنتیکی نشان میدهد که این چهار گونه خیلی به هم نزدیک هستند، بطوریکه بعضی از محققان اعتقاد دارند که آنها چهار زیرگونه در یک گونه بوردتلا هستند. بوردتلا هینزی (B.hinzii) عامل باکتریمی و بیماری تنفسی، بوردتلا هولمسئی (B.holmseii) عامل باکتریمی و بوردتلا تریماتوم (B.trematum) عامل زخم و عفونت گوش میانی هستند. بوردتلا پتری (B. petri) و بوردتلا آنسورپی (B.ansorpii) سبب عفونت در افرادی که ضعف سیستم ایمنی دارند، میشوند.
بوردتلاها مانند بروسلاها، لیستریاها، مایکوباکتریومها و سالمونلاها باکتری درون سلولی اختیاری هستند و برخی از سویههای آن کپسولدار هستند. بوردتلاها سختگیر بوده و بهآرامی رشد میکنند. کشت بوردتلا پرتوسيس روی محیط اختصاصی که دارای نشاسته، چارکول (زغال) یا دانههای رزيني جهت حذف اسيدهاي چرب و ساير مواد توكسيك تولیدشده در هنگام رشد است، صورت میگیرد. مثال از این نوع محیطها محيط بوردت- ژانگو آگار[2] (حاوي نشاسته سیبزمینی) و ریگان-لو آگار[3] (حاوي چارکول) است. ساير گونههاي بوردتلا (به غیر از بوردتلا پرتوسیس) میتوانند روي شكلات آگار رشد نمایند. بوردتلاها دو تا هفت روز بعد از كشت روی این محیطها، ايجاد کلنیهای ريز و براق میکنند. در جدول 1 ویژگیهای بیوشیمیایی جهت افتراق گونههای بوردتلا نشان داده شده است.
جدول 1: ویژگیهای بیوشیمیایی جهت افتراق گونههای بوردتلا
بوردتلا پرتوسيس
این ارگانیسم كوكوباسیل گرم منفی كوچكی شبیه به هموفیلوس آنفلوانزا است و بر روي اپيتليوم مخاطي مژكدار نازوفارنكس و ناي انسان رشد ميكند. بوردتلا پرتوسيس بدون حركت است. این باكتری دارای گرانولهای متاكروماتیك در دو قطب و كپسول است. جداسازی اولیه بوردتلا پرتوسیس احتیاج به محیطهای غنیشده دارد، از این رو از محیطهای بوردت- ژانکو (Bordet-Gengou) حاوی آنتيبيوتيك و ریگان-لو آگار (Regan–Lowe agar) (حاوي چارکول) استفاده مینمایند. ساير گونههاي بوردتلا (به غیر از بوردتلا پرتوسیس) ميتوانند روي شكلات آگار رشد نمایند. بوردتلاها دو تا هفت روز بعد از كشت روی این محیطها، ايجاد كلنيهاي ريز و براق ميكنند.
این باكتری همانند بوردتلا پاراپرتوسیس و برخلاف سایر بوردتلاها غیرمتحرك بوده و در كشتهای اولیه نیاز به فاكتورهای X و V دارد و در محیطهای خوندار ایجاد همولیز میكند. برخلاف ساير گونهها، بوردتلا پرتوسیس فعالیت اورهآزی نداشته و روی محیط شکلات آگار و سیترات رشد نمیکند. تولید سم پرتوسیس
(Pertussis Toxin) بهوسیله بوردتلا پرتوسیس، مهمترين اختلاف بوردتلا پرتوسیس با ساير گونهها است. این سم مسئول بسياري از علائم و يافتههاي پاتولوژيك مرتبط با سياهسرفه است. بوردتلا پرتوسیس در دمای 28 درجه سلسیوس و در حضور سولفات منيزیم یا اسید نیکوتینیک در محیط كشت، تغییرات فنوتیپی قابلبرگشتی پیدا
میکند و قدرت بیماریزایی آن كاهش مییابد.
ايزولههاي اوليه بوردتلا پرتوسیس، بسیار بیماریزا و توليدكننده توكسين هستند، اما سابکالچرهای بعدی منجر به ايجاد و ظهور تيپهاي جديد كلني ميگردد كه از نظر ميزان بيماريزایي متفاوتند. اين تغييرات در بيماريزایي، ناشی از تغییرات فاز است. بهطور کلی بوردتلا پرتوسیس دارای 4 تيپ كلني يا فاز است. ایزولههای فاز I (ايزولههاي تازه) دارای کپسول، پيلي، سمی و بیماریزا هستند. سابکالچرهای بعدی دارای فازهای III ,II ,IV هستند که به تدریج خصوصیات بیماریزایی خود را از دست میدهند. فازIV بدون كپسول و پيلي و غيربيماريزا است.
آنتیژنها و فاكتورهاي بیماریزایی بوردتلا پرتوسیس
حداقل چهار نوع ادهسین بر روی سطح بوردتلا پرتوسیس یافت میشود و این باکتری تولید چهار توکسین میکند.
(الف) ادهسینها
پرتاكتين[4]، پيلي، هماگلوتینين رشتهای[5] و هماگلوتينين- توكسين پرتوسیس[6]، همگي در سطح باكتري قرار دارند و در شروع و پایداری کلونيزاسيون در نازوفارنكس موردنیاز هستند.
پرتاكتين، یک پروتئین 69 کیلودالتونی است که ابتدا بهصورت پيشساز 93 کیلودالتونی تولید و پردازش شده و در سطح باكتري قرار میگیرد. نشان داده شده كه پرتاکتین اتصال بوردتلا پرتوسيس را به سلولهای Hela و تخمدان هامستر چینی[7] تسهيل می كند.
پرتاكتين داراي سكانس Arg-Gly-Asp (يا سكانس RGD) در محل باندینگ خود بوده و داراي چندین واحد تكراري Pro-Gln-Pro و Gly-Gly-Xaa-Xaa-Pro در نواحی ساختمانی خود است. ســــكانس Arg-Gly-Asp ورود بوردتلا پرتوسیس را به داخل سیتوپلاسم سلولهای کشتدادهشده، تسهیل میکند.
فاز I بوردتلا دارای چندين تيپ پيلي است. حداقل دو سروتيپ از پیلی بوردتلا پرتوسیس شناسايي شده که پیلی یا فیمبریه 2 و 3 نامیده میشود. بعضی مواقع، محققان به این سروتیپها آگلوتينوژن هم ميگويند. احتمالاً پيلي، ادهسین اصلي و كليدي بوردتلا پرتوسیس نیست، ولی در كشت سلولي حلقه نای[8] نشان داده شده است كه در اتصال به اريتروسيتهاي انسان و سلولهای اپيتليال مژكدار موردنياز است. نتایج آزمایشها در موش نشان میدهد که پیلی بوردتلا پرتوسیس نقش مهمی در اتصال بوردتلا پرتوسیس به نای دارد، ولی در اتصال به نازوفارنکس نقشی ندارد.
هماگلوتینين رشتهای (FHA) اصلیترین ادهسین بوردتلا پرتوسیس است. ابتدا FHA بهصورت پيشساز 370 کیلودالتونی تولید شده كه در مرحله بعد بهصورت ادهسین FHA220 کیلودالتونی درميآيد. FHA واسطه اتصال به انواع مختلفی از سلولهای کشت داده شده، شامل سلولهای اپیتلیال مژکدار در كشت سلولي حلقه نای است. نتایج آزمایشها در موش نشان میدهد که FHA ادهسین اختصاصی در هردو ناحیه نازوفارنکس و نای است. همانند جایگاه اتصال پرتاکتین، محل اتصال FHA نیز داراي سكانس Arg-Gly-Asp (سكانس RGD) است. برخلاف سكانس پرتاكتين، اين سكانس در FHA بهنظر نميرسد در تهاجم به سلول دخالت داشته باشد.
FHA داراي سه جایگاه مجزای اتصال است: ناحیه Arg-Gly-Asp به لاكتوزیل سرامید متصل شده و دو ناحيه نامشخص كه جداگانه به هپارين و CR3 (گیرنده 3 کمپلمان اينتگرين لکوسيت) متصل ميشوند. اتصال FHA به CR3 بدليل تقليد CR3 از گیرنده اندوتليال است. آنتیبادی ضد FHA به سلولهای اندوتليال متصل شده و با بسیج لكوسيتها و افزايش نفوذپذيري اندوتليوم تداخل ميکنند. بوردتلا پرتوسیس بواسطة اتصال به گیرنده CR3 موجود در سطح ماكروفاژها به درون آنها راه مييابد. از آنجایي كه باكتري در ماكروفاژ از بين نميرود در ريه بقا پیدا میکند.
بعضی از مطالعات نشان میدهد که ايمنسازی دهاني و تنفسي موش با FHA خالصشده، آنها را از عفونت ریه و نای با بوردتلا پرتوسیس محافظت ميكند. دیگر مطالعات نشان میدهد که ایمونیزاسيون داخل عضلانی يا صفاقي با FHA خالصشده، موشها را از کلونیزاسیون ريه و ناي با بوردتلا پرتوسیس محافظت میکند و این اثر حفاظتی ناشی از توليد IgM ,IgG (بيشتر از IgA) عليه FHA است.
توكسين پرتوسیس- هماگلوتينين (TOX-HA) هماگلوتينينی است كه داراي 5 درصد توانايي اتصالي FHA بوده و از باكتــــري بوردتلا پرتوسیس به محيط خارج ترشح ميشود. بعضی از محققان حدس میزنند که TOX-HA، بواسطة اتصال به ساير پاتوژنهای مخاطی مانند هموفيلوس آنفلوانزا و استرپتوکوک پنومونيه، عفونت ثانویه را در نواحی آلودهشده به بوردتلا پرتوسیس القاء و تسهيل میکند.
(ب) توكسينها
بوردتلا پرتوسیس تولید چهار سم مهم پرتوسیس توكسين، آدنیلات سیکلاز پرتوسیس، درمونكروتيك توكسين[9] و سیتوتوکسین نای[10] میکند.
توكسين پرتوسیس. این سم كليد توانايي بوردتلا پرتوسیس در ايجاد سیاهسرفه است. در حقیقت، ساير گونهها به دلیل نداشتن این سم، بندرت بيماري مشابه سیاهسرفه در انسان ایجاد میکنند.
توكسين پرتوسیس، از نوع توکسین A-B است. زيرواحد A آن (توکسیک) داراي يك زيرواحد S1 است، درحالیکه زيرواحد B (باندینگ رسپتور) داراي دو دايمر است؛ يكي از این دو دايمر داراي زيرواحد S2-S3 و دیگری دارای زيرواحد کمپلکس S2-S4 است. این دو دایمر توسط یک S5 به هم متصل میشوند. مدل A-B یک مدل عمومی برای اگزوتوکسینها است.
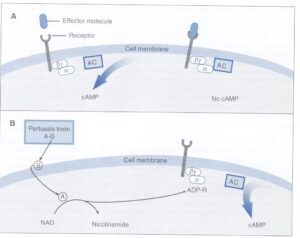
شکل 1 مکانیسم عمل توکسین پرتوسیس را نشان میدهد. بوردتلا پرتوسیس این سم را به محیط بیرون ترشح میکند. زيرواحد B با اتصال به گیرندههای سلولي، سبب ورود زيرواحد A به داخل سلول هدف میشود. در داخل سلول، توكسين با شکستن NAD، سبب اتصال ADP- ریبوزیله به زيرواحد( از پروتئين Gi متصل به غشاء میگردد (پروتئینهایی كه داراي فعاليت گوانوزين تريفسفاتاز هستند، پروتئين G ناميده میشوند. عملكرد Gi مهار يا تنظیم منفی فعاليت يك آدنيلات سيكلاز وابسته به آنها است).
ADP-ریبوزیله، Gi را غیرفعال کرده و آن را از آدنيلات سيكلاز جدا میکند. از آنجایی که در این زمان هيچ مكانيسمي جهت مهار فعاليت آدنيلات سيكلاز وجود ندارد، طي پاسخ به هرگونه افکتوری كه آدنيلات سيكلاز را فعال كند، مقادير فراواني cAMP در سلول تجمع مییابد. ترشح و دفع یون کلر در حضور مقادير فراوان cAMP القاشده و تغييرات در جريان يوني، باعث میگردد تا سلولهای تحت تأثير، مقادير فراواني مايعات و الكتروليت را ترشح نمايند. اگرچه مکانیسم عمل این سم از کلرا توکسین متفاوت است، ولی در نهایت هر دوی آنها سبب تجمع آب و الکترولیت میشوند.
توكسين پرتوسیس یک فاکتور القاکننده لنفوسیتوز[11] و فاکتور حساسکننده به هیستامین[12] است. محققين معتقدند كه توكسين در اثر القاء سنتز اینترلوکین یک سبب لنفوسیتوز میگردد و اين امر باعث میشود تا اثر هيستامين در بسياري از سلولها بارز گردد. توكسين پرتوسیس باعث میشود تا دستگاه تنفسي مقادير فراواني از ترشحات موكوئيدی را ترشح نماید و به محرکها بسيار حساس گردد. در این حالت فرد دچار سرفههای شديد حملهای میشود.
بوردتلا پرتوسيس دو نوع آدنيلات سيكلاز دارد؛ يكي از آنها در باكتري باقي میماند و ديگري ترشح میشود. آدنيلات سيكلاز پرتوسیس هم میتواند بهتنهایی و هم بهصورت توأم با ورود باكتري، به درون سيتوپلاسم سلول وارد گردد. در درون سلول ميزبان، آدنيلات سيكلاز بوسيلة كالمودولين فعال میشود. آدنيلات سيكلاز پرتوسيس فعالشده، سبب فعال شدن درمونكروتيك توكسين میگردد. هرچند نقش آدنيلات سيكلاز باكتري در بیماریزایی مشخص نشده، ولي تحقیقات نشان داده كه سویههای فاقد آدنيلات سيكلاز، غيربيماريزا هستند.
شکل 1: مکانیسم عمل توکسین پرتوسیس
شکل A عملکرد طبیعی زیرواحد α پروتئین Gi را نشان میدهد. بهطور نرمال این زیرواحد به تحریکات خارجی از طریق ارتباط با آدنیلات سیکلاز (AC) باندشده به غشاء پاسخ میدهد. ارتباط فعالیت AC را متوقف میکند. شکل B نشان میدهد که هنگامی که توکسین پرتوسیس وجود دارد، زیرواحد B توکسین به گیرندههای سطحی سلول باند میکند و ورود زیرواحد A را به داخل سلول تسهیل مینماید. زیرواحد A با شکستن نیکوتین آمیدآدنین در نوکلئوتید (NAD)، آدنوزین دی فسفات به اضافه ریبوز (ADP – R) را به زیرواحد پروتئین Gi متصل میکند. پروتئینADP
-ریبوزیله شده Gi از AC همراه خود جدا شده و مقدار زیادی آدنوزین منوفسفات حلقوی (cAMP) به دلیل فعالیت آدنیلات سیکلاز بدون کنترل آزاد میشوند. در نهایت تجمع cAMP، سبب افزایش ترشحات مایعات و الکترولیتها میگردد
(برگرفته از کتاب میکروبشناسی پزشکی استوارت واکر)
درمونكروتيك توكسين. که اغلب سم حساس به گرما نیز نامیده میشود، هنگامی که بوردتلا پرتوسيس فاز I ليز میگردد، آزاد میشود. نقش آن در پاتوژنز بوردتلا پرتوسيس دقيقاً اثبات نشده است، ولی این توکسین دارای خاصیت Ciliastatic (آسيب به مژه)، سايتوتوكسيك، نکروز بافتی (درمونکروزیس) و حساس به حرارت[13] 56 درجه سلسیوس است. تزریق درمونكروتيك توكسين بهصورت داخل صفاقي در موش مرگآور است.
سیتوتوکسین نای. یک قطعه 921 دالتونی از پپتیدوگلیکان است كه طي رشد باكتري آزاد میگردد. نام دیگر TCT،N-acetyleGlucoseAminyl-1,6-anhydromuramylalnyl-g-Glutamyldiaminopimelyalanine است. این مولکول، مشابه مولكول آزادشده طي رشد گنوكك و مشابه مولكول فاكتوری بنام FSu یا فاکتور S است و در CSF حيوانات بیخواب یافت میشود. TCT و موراميل پتپيدهاي همراه آنها، داراي فعالیتهای تغییردهنده سیستم ایمنی[14]، Ciliostatic(همانند درمونكروتيك توكسين) و Ciliocidal هستند. همچنین این مولکولها از اتصال هيدروكسي تريپتامين به گیرندههای سلولي جلوگيري میکنند و مهمتر آنكه در سلولهای مژهدار از سنتز DNA ممانعت به عمل میآورند.
بوردتلا پرتوسيس در حلق، بینی و خلط بیماران و در حیوانات یافت میشود و از طریق تنفسی میزبان انسانی خود را آلوده میکند. این باکتری دارای هیچ ناقلی نیست و به خون همانند ویبریوکلرا تهاجم ندارد و سبب سپتیسمی یا باکتریمی نمیگردد. در افراد غیرواکسینه که با بوردتلا پرتوسيس مواجه میشوند، میزان بروز بیماری 90 تا 95 درصد گزارش شده است. تلاشهای وسیع برای یافتن افراد ناقل بوردتلا پرتوسيس کاری بیفایده است. نتیجه مطالعه روی افراد غیرواکسینه در دانمارک نشان داد که 61 درصد افراد در دوران کودکی خود، سیاهسرفه را تجربه کردند، بطوریکه همه افراد در بررسی ایمنولوژیک، ابتلای قبلی به بوردتلا پرتوسيس را نشان میدادند. این مطالعه این حدس را قوی کرد که اگرچه بوردتلا پرتوسيس ناقل بدون علامت ندارد، ولی در بعضی از افراد، سبب بیماری تنفسی شده که بهعنوان سیاهسرفه شناسایی نمیگردد.
مراحل بیماریزایی
بوردتلا پرتوسيس یک باکتری Viscerotropic است که گرایش زیادی به سلولهای مژهدار اپيتليال دارد. بوردتلا پرتوسيس به کمک FHA، پیلی و پرتاكتين به سلولهای نازوفازنكس و ناي متصل میشود. اغلب باکتریها هنگامی که توسط ماکروفاژها فاگوسیت میشوند به برونش میرسند. بعضی از باکتریها در داخل ماکروفاژها و سلولهای اپیتلیال تکثیر مییابند، اما بیشتر تغییرات پاتولوژیک ناشی از باکتریهای خارج سلولی است که به اپیتلیوم سلولهای مژهدار متصل میشوند.
علائم سیاهسرفه، ناشی از تولید توکسین توسط بوردتلا پرتوسيس است. توکسین پرتوسیس سبب افزایش ترشحات و همچنین سبب حساس شدن مخاط به هیستامین میگردد. درمونکروتیک توکسین و TCT سبب از بین رفتن اپیتلیوم مژهدار و کاهش توانایی مژهها در پاک کردن باکتریها و ترشحات از دستگاه تنفسی میشود. در بیمار، آسیب نازوفارنکس بهصورت تحریکپذیری و عطسه مکرر ظاهر میشود. در حضور عامل القاکننده هیستامین (مانند وجود آلرژن و عفونتهای ویروسی)، حساسیت زیاد به هسیتامین سبب افزایش ترشحات و اسپاسم میگردد. درنهایت، تمام سطح اپیتلیوم مژهدار توسط ترشحات زیاد و چرکی پوشانیده میشود. اثرات ترکیبی ترشحات، حساسیت به هیستامین و نکروز سبب حملات وحشتناک سرفه در فرد بیمار میگردد.
عموماً سیاهسرفه در ایالات متحده آمریکا، در نوجوانان (بیشتر موارد در افراد بالای یک سال) مشاهده میشود. در طی دهه 50 میلادی میزان بروز سیاهسرفه در حدود 23 در 100/000 نفر بود. با بهکارگیری واکسن سیاهسرفه این میزان کاهش و به 2 مورد در 100/000 نفر رسید. در سال 2012 بیش از 48 هزار مورد بیماری سیاهسرفه به CDC گزارش گردید که بیشترین تعداد موارد از سال 1955 در ایالات متحده آمریکا بود. یک همهگیری گسترده با 10 هزار مورد به تنهایی در سال 2014 در کالیفرنیا گزارش گردید که اغلب در افراد غیرواکسینه بود. سیاهسرفه در بزرگسالان بهآسانی قابل تشخیص نیست اما نشانههایی وجود دارد که نشان میدهد تعداد موارد بیماری در بزرگسالان همانند کودکان در حال افزایش است.
در افراد غیرواکسینه که با بوردتلا پرتوسيس مواجه میشوند، میزان بروز بیماری 90 تا 95 درصد گزارش شده است. تلاشهای وسیع برای یافتن افراد ناقل بوردتلا پرتوسيس کاری بیفایده است. نتیجه مطالعه روی افراد غیرواکسینه در دانمارک نشان داد که 61 درصد افراد در دوران کودکی خود، سیاهسرفه را تجربه کردند، بطوریکه همه افراد در بررسی ایمنولوژیک، ابتلای قبلی به بوردتلا پرتوسيس را نشان میدادند. این مطالعه این حدس را قوی کرد که اگرچه بوردتلا پرتوسيس ناقل بدون علامت ندارد، ولی در بعضی از افراد، سبب بیماری تنفسی شده که بهعنوان سیاهسرفه شناسایی نمیگردد.
تشخیص
(1) تاریخچه و معاینه بالینی
بهطور كلي بيماري سیاهسرفه دارای سه مرحله است:
مرحله نزلهای یا کاتارال مرحله اولیه بیماری سیاهسرفه است. 10 روز بعد از تماس با بوردتلا پرتوسيس علائم اولية بيماري شامل عطسه فراوان، آبريزش بيني، سرفه شبانه، تب و كونژنكتيویت در فرد بیمار ظاهر میشود. همانند ویروس سرخک و تعدادی پاتوژنهای دیگر دستگاه تنفسی، بوردتلا پرتوسيس در مرحله اولیه بیماری بهشدت مسری است.
يك يا دو هفته بعد از مرحله اولیه، مرحله حملهای (پاروکسیمال) سیاهسرفه آغاز ميگردد. در طی هر مرحله حملهای سرفه (که حداقل 30 ثانیه یا بیشتر طول میکشد) بیمار دچار 20-5 دقیقه سرفه بدون مكث همراه با خروج ترشحات چركی زیادی از بيني و دهان میشود. در انتهای هر حمله، فرد بیمار دچار آنوکسی و كبودي میگردد. سپس هوا با سرعت به ششهای خالی از هوا برمیگردد و صداي خروس يا خسخس را سبب میشود.
از دیگر علائم بیماری در مرحله حملهای، استفراغ، خونریزی از بینی (Epistaxis)، ادم در ناحیه پریاربیتال و کونژنکتیویت هموراژيك است. تب فقط در صورت ابتلاي ثانويه به ساير باکتریها مثل استرپتوکوک گروه A ايجاد ميگردد. لنفوسیتوز لنفوسیتیک در 25 درصد از بیماران با سن زیر شش ماه و 75 درصد در بیماران با سن بالای شش ماه مشاهده میشود. کل این دوره 4-2 هفته طول ميكشد، اما در بعضی از بیماران این مرحله تا 6 هفته ادامه مییابد.
سیاهسرفه عموماً در طی مرحله نقاهت (Convalescent Stage) رفع میشود. این مرحله معمولاً دو هفته طول ميكشد (البته ممکن است تا چند ماه طول بکشد) و بیمار در معرض ابتلا به پنومونی تهدیدکننده حیات و دیگر عفونتهای دستگاه تنفسی ایجادشده توسط استرپتوکوک گروه A، پنوموكك و هموفیلوس آنفلوانزا قرار داشته باشد. این حساسیت بالا به دلیل این است که اپیتلیال مژهدار ناحیه دستگاه تنفسی بیمار بهشدت آسیب دیده و ریه به این عفونتها حساسیت بالا پیدا کرده است.
2- تشخیص آزمایشگاهی:
تشخیص سیاهسرفه در روزهای اول بیماری اغلب مشکل است و با گریپ و برونشيت اشتباه میشود، ولی در هفته سوم و چهارم چون علائم ظاهر شدهاند تشخیص بسیار ساده است. در تشخیص آزمایشگاهی بیشتر از کشت و شمارش گلبولی و کمتر از روشهای دیگر استفاده میشود. آزمایشهای سرولوژی به علت اینکه قاطع نبوده و دیر مثبت میشوند کمتر مورد استفاده قرار میگیرند.
نمونههای ارسالی به آزمایشگاه:
نمونه ترجیحی، مایع حامل از شستشوی بینی با نمک است. همچنین ميتوان از سوآب نازوفارنکس یا قطرات حاصل از سرفه در داخل ظرف سرفه (که در هنگام سرفه در جلوی دهان بیمار قرار داده میشود) استفاده کرد، ولی این نمونهها بهخوبی نمونه حاصل از شستشوی بینی نیست. در نوزادان و کودکان با سن پائین نمونه پیشنهادی بسیار رایج آسپیره نازوفارنژیال است، ولی در بزرگسالان، کودکان با سن بالاتر و نوجوانان یک سواب نازوفارنژیال مناسب است. با این حال همچنان آسپیرهها برای جداسازی حساستر هستند. چون باکتری به پنبه و کلسیم آلژینات حساس است باید سواب جهت نمونهگیری از داکرون و ریون (الیاف مصنوعی) باشد. (بهخصوص اگر بخواهیم با روش مولکولی مانند PCR بوردتلا پرتوسیس را ایزوله کنيم نباید از سوابهای از جنس پنبه و کلسیم آلژینات و از جنس فلزات بهخصوص آلومینیوم استفاده کرد).
سواب را باید تا ديواره خلفي گلو وارد کرد و چند لحظه در آنجا نگه داشت تا با ترشحات آغشته گردد. سپس سواب را بایستی در محیطهای انتخابی بوردتلا تلقيح نمود. همچنین میتوان از تکنیک Cauph plate برای نمونهگیری استـــفاده کرد. در این طریقه پلیت حاوی محیط کشت بوردت-ژانکو دارای آنتيبيوتيك را در هنگام سرفه در فاصله 10 سانتیمتری جلوی دهان بیمار نگاه داشته تا قطراتی از دهانش خارج شده و بر سطح آن قرار گیرد و سپس در گرمخانه قرار میدهند. هرچند که در این روش، فلور نرمال دهان بیمار سطح محیط کشت را میپوشاند و تشخیص را دچار مشکل میکند ولی روشی بسیار مناسب برای نمونهگیری در افراد مبتلا به سیاهسرفه است.
نکته: نمونههای بوردتلا پرتوسیس و پارپرتوسیس باید در طی 2-1 ساعت کشت داده شوند، در غیر این صورت از محیطهـای انتقالی مانند casamino acid broth با pH=7.2، ریگان-لو و چارکول میشلو آگار (Charcol Michli agar) بایستی استفاده کرد. سایر بوردتلاها به شرایط انتقال حساس نیستند و نیازی نیست که سریعاً کشت داده شوند.
در آزمایشگاه پس از انتقال نمونهها، برای تشخیص بوردتلا پرتوسیس از روشهای زیر استفاده میشود:
کشت:
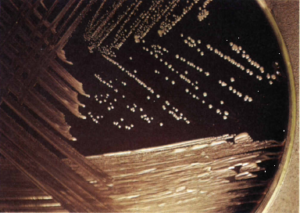
از محیط اختصاصی بوردت- ژانکو (آگار سیبزمینی، خون گوسفند، گلیسرول به اضافه متیسیلین (2.5μg/ml) یا سفالکسین (40 μg/ml) یا اگزاسیلین (0.625 μg/ml)، ریگانلو (جدول 2)، اســـتانیر-اسکولیت آگار (Stanier-Scholte-Ager) (حاوی سیکلوسرین و سفالکسین) و محیط BCYE (آگار عصــــــــاره مخمر- چارکول بافری شده) که برای لژیونلا پنوموفیلا مورد استفاده قرار میگیرد، استفاده میشود. ظروف باید در دمای 35 تا 37 سلسیوس به مدت 3 تا 12 روز (در 4-2 روز قابل جداسازی است) در حضور 7-5 درصد CO2 و در محیطهای مرطوب (مانند یک کیسه پلاستیکی دربسته) نگهداری شوند. پس از آن با مشاهده پلیتها زیر میکروسکوپ (با عدسی × 10)، کلنیهای به بزرگی 1 تا 2 میلیمتر، گرد، گنبدی شکل، صاف براق و خاکستری رنگ و شبیه قطره جیوه یا دانه مروارید ظاهر میشود که وقتی تمام سطح محیط کشت را بپوشاند، پوشش چسبنده خاکستری رنگی شبیه رنگ آلومینیوم بهوجود میآید (شکل 2).
این باکتری تولید همولیز میکند و پس از چند بار کشت روی محیطهای ساده قدرت رشد پیدا میکند. واکنشهای منفی تستهای اکسیداز، کاتالاز و اورهآز میتوانند برای شناسایی احتمالی بوردتلا پرتوسیس مورد استفاده قرار گیرند. بوردتلا پاراپرتوسیس رشد سریعتری داشته و روی بلاد آگار و گاهی مکانکی آگار رشد میکنند. کلنیهای آنها اکسیداز منفی و کاتالاز و اورهآز مثبت هستند. بوردتلا برونشیسپتیکا بهخوبی روی هردو محیط بلاد آگار و مکانکی آگار رشد میکند و از نظر بیوشیمیایی از 2 گونه دیگر فعالتر است. این باکتری کاتالاز، اکسیداز، اورهآز و احیای نیترات مثبت دارد (جدول 1). بوردتلا هولمسی بهتازگی در این جنس قرار داده شده البته نه بهعنوان عامل سیاهسرفه بلکه تا حدودی با موارد باکتریمی، اندوکاردیت، بیماری تنفسی در بیماران دارای ضعف سیستم ایمنی بهویژه بیماران فاقد کبد مرتبط است.
این باکتری بهخوبی روی محیط بلادآگار رشد میکند و ظهور آن روی مکانکی آگار ممکن است با تأخیر باشد. این ارگانیسم از نظر اکسیداز، احیای نیترات و اورهآز منفی است. دیگر گونههای بوردتلا شامل بوردتلا هنزی، بوردتلا ترماتوم و بوردتلا اویوم هستند. این باکتریها، برخلاف سایر اعضای این جنس روی بلاد آگار و مکانکی رشد میکنند و متحرکند.
جدول 2: اجزاي محیط ریگان– لو جهت ایزولاسیون بوردتلا پرتوسیس
(اين تركيبات در 1 لیتر آبمقطر حل ميشوند)
پس از مشاهده کلنی ارگانیسمها بهوسیله رنگآمیزی ایمونوفلورسانس با آنتیبادیهای منوکلونال یا پلیکلونال یا بهوسیله آگلوتیناسیون روی لام در اثر آنتیسرمهای اختصاصی تشخیص داده میشوند.
شکل 2: رشد بوردتلا پرتوسیس روی محیط ریگان– لو
نکات مهم:
- افراد بيمار از نظر آنتیبادی عليه پرتوسیس بررسي نميگردند، زيرا تا دورة نقاهت، آنتیبادی قابل جداسازی ظاهر نميشود.
- كشت خون نيز مفيد نیست، زيرا اين باكتري وارد خون نشده و فاز باكتريمي ندارد.
- جداسازی بوردتلا پرتوسیس با کشت بسیار اختصاصی است و حساسیت آن با سن بیمار، دوره بیماری و وضعیت واکسیناسیون ارتباط دارد. کشت در هفته اول بیماری 90% و در هفته سوم در 50% بیماران مثبت میشود.
- بوردتلا پرتوسیس برخلاف سایر گونههای بوردتلا بر روی مکانکی آگار، بلاد آگار و شكلات آگار رشد نمیکند (جدول 1).
رنگآمیزی گرم:
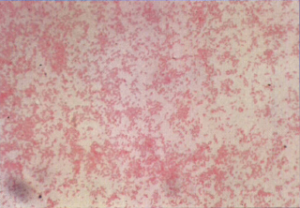
اگر در رنگآمیزی گرم از سافرانین به مدت 2 دقیقه، یا از فوشین بازی آبی 0/2% استفاده گردد، مشاهده کوکوباسیلهای گرم منفی بهصورت تکی یا جفت افزایش مییابد (شکل 3).
شکل 3: اسمیر گرم بوردتلا پرتوسیس
شمارش گلبولی:
در بیماری سیاهسرفه، افزایش گلبول سفید شدید، از 20000 تا 30000 به همراه لنفوسیتوز 70 تا 90 درصد وجود دارد که این افزایش ناشی از اثر محرک بر آنها است.
آزمایش ایمونوفلورسانس:
براي شناسايي قطعي ارگانيسم از آگلوتيناسيون با آنتيباديهاي سرمي اختصاصي يا آنتيباديهاي نشاندار با مواد فلوئورسنت استفاده ميشود (شکل 4).
از تست ايمونوفلورسانس مستقیم آنتــــــــــیبادی Direct fluorescent antibody(DFA) برای ارزیابی بوردتلا پرتوسیس در نمونه استفاده میشود. این تست اگرچه سریع است، ولی کشت، حساسيت بيشتري نسبت به آن دارد؛ برای مثال گروهی گزارش کردند که تست ايمونوفلورسانس آنتیبادی تنها در 6 نمونه از 20 نمونه بیمارانی که کشت آنها مثبت شده بود، مثبت گردید، بنابراین تا حساسیت این تست اصلاح نشود، نمیتوان آن را برای کارهای روتین توصیه کرد. باید توجه داشت که نتایج تست DFA باید احتمالی در نظر گرفته شود و باید کشت یا PCR نیز در کنار آن استفاده گردند.
شکل 4: تست DFA جهت شناسایی بوردتلا پرتوسیس
تکنیکهای جدید شناسایی بوردتلاها
از منوکلونال آنتیبادی ضد LPS و FHA در روشهای Dot- blot و ELISA استفاده میگردد. همچنین از روشهای مولکولی مانند PCR جهت شناسایی استفاده میشود.
تشخیص مستقیم بوردتلا پرتوسیس در نمونههای بالینی توسط روشهای مولکولی مانند PCR بهترین روش شناسایی بوردتلا پرتوسیس است. جمعآوری نمونه برای PCR همانند کشت است، اما زمانی که از PCR برای تشخیص استفاده میشود، نحوه انتقال اهمیت ندارد. یک مطالعه به بررسی تجهیزات انتقال پرداخته است و نشان داده است که با یکدیگر برابرند و زمان انتقال نسبت به روش کشت اهمیت ندارد. از زمانی که محصولات تجاری به فراوانی در دسترس قرار گرفتهاند، تکرارپذیری نتایج در آزمایشگاهها بهبود یافته است.
یک مطالعه به بررسی تعدادی از آزمایشگاههای سلامت عمومی با استفاده از چند روش پرداخته است که نتایج قابل ارزیابی بهتری را در مقایسه با گزارش مطالعه قبلی نشان داد، اگرچه نتایج تستهای PCR حتی با وجود درمان ضدمیکروبی مناسب ممکن است همچنان در مقایسه با نتایج کشت یا DFA مدت زمانی بیشتری مثبت باقی بمانند. روشهای PCR برای شناسایی بوردتلا پرتوسیس در نمونههای بالینی موجود هستند. باید در نظر داشت که روش PCR به شکلی مورد استفاده قرار گیرد که همزمان هر دو ارگانیسم را شناسایی کند زیرا در برخی همهگیریها در حقیقت عامل شاخص سیاهسرفه بوردتلا پاراپرتوسیس است.
روشهای سرولوژیک برای بوردتلا پرتوسیس و پاراپرتوسیس ممکن است جهت تشخیص سیاهسرفه در کودکان غیرواکسینه، نوجوانان و بزرگسالان استفاده شود. آنزیم ایمنواسی (EIA) یک روش معمول موردپسند است. بهنظر میرسد مشاهدات تغییرات سرمی و یا افزایش شاخص در غلظت IgG علیه PT حساسترین و اختصاصیترین روش باشد. با این حال روش سرولوژی نباید تا یک سال پس از واکسیناسیون با واکسن فاقد سلول انجام گردد. در یک مطالعه روشهای کشت، PCR و سرولوژی برای تشخیص سیاهسرفه مقایسه شدهاند. نشان داده شد که چنانچه حداقل دو آنتیژن بوردتلا پرتوسیس (IgM، IgG یا IgA) در هردو سرم فاز حاد و نقاهت استفاده شوند، روش سرولوژی به اندازه PCR حساس بوده و هردو از کشت حساستر هستند.
آنتیبیوگرام:
عوامل ضدمیکروبی احتمالاً هیچ نقشی در درمان سیاهسرفه ندارند، اما کشت نازوفارنژیال 1 تا 2 روز پس از درمان منفی میشود که ممکن است درمان در بیماران از عوارض باکتریایی جلوگیری کند و یا از انتشار بیماری به افراد دارای مواجهه غیرایمن نیز پیشگیری نماید. به دلیل اینکه تاکنون ماکرولیدها (اریترومایسین، آزیترومایسین و یا کلاریترومایسین) داروی انتخابی بیماری سیاهسرفه باقی مانده و مقاومت کمی نسبت به آنها گزارش شده، لذا نیازی به تعیین حساسیت به آنتیبیوتیک نیست. در صورتی که نیاز به آنتیبیوگرام باشد بایستی از محیطهای مختلفی مانند مولر هینتون با 5% خون گوسفند، بوردت-ژانگو با 5 تا 20% خون اسب و ریگان- لو استفاده کرد. لازم به ذکر است سویههای بوردتلا پرتوسیس در آزمایشگاه دارای MIC رنجی 0/02 تا 0/12 میکروگرم در میلیلیتر است.
درمان و پیشگیری
اریترومایسین درمان انتخابی افراد مبتلا به سیاهسرفه است. درمان جایگزین، آمپیسیلین یا تریمتوپریم-سولفومتاکسازول (TMP/SMX) است. تری متوپریم– سولفومتوکسازول یک جایگرین مورد قبول در بیماران با عدم تحمل ماکرولیدها است و در موارد نادری که ایزوله مقاوم به ماکرولید است، استفاده میشود.
انتشار سیاهسرفه از طریق واکسینه و کموپروفیلاکسی قابل پیشگیری است. امروزه واکسن سیاهسرفه مورد استفاده، حاوی باكتري کشتهشده فاز I بوده و به همراه توكسوئيد ديفتري و کزاز تجویز میشود (بهعنوان واکسن DPT یا DTP). در افراد دریافتکننده واکسن، میزان عوارض نورولوژيك، 0/00023 درصد (1/310000نفر واکسینه شده) است. این میزان در بیماران بستری در بیمارستان به 1/5 تا 14 درصد میرسد. به این دلیل است که کودکان باید واکسینه شوند.
ایمنی محافظتکننده علیه بوردتلا پرتوسیس پس از عفونت یا پس از واکسیناسیون در طی زمان کاهش مییابد، لذا در حال حاضر توصیه میگردد که بزرگسالان با واکسن فاقد سلول سیاهسرفه (Tdap) واکسینه شوند تا بار بورتلا پرتوسیس در گردش بهویژه در نوزادان و نوزادانی که تازه متولد شدهاند کاهش یابد. در ایالات متحده آمریکا، واکسنهای DTaP و Tdapو Td بیشترین واکسنهای مورد استفاده هستند. DTaP برای کودکان کمتر از 7 سال و Tdap و Td برای کودکان بالاتر و بزرگسالان استفاده میگردند.
یک دوره 10 روزه از مصرف اریترومایسین، برای پیشگیری از عفونت در بین کودکان غیرایمن و بالغینی که با بوردتلا پرتوسیس برخورد دارند، توصیه میشود. به کودکان زیر 4 سال بایستی یادآور واکسن سیاهسرفه را تزریق کرد.
به دلیل ترس از عوارض نورولوژیکی در افراد دریافتکننده واکسن حاوی سلول کامل، محققين چندین واكسن بدون سلول[15] ساختهاند. در مطالعات کلینیکی، واکسن بدون سلول که دارای توکسین پرتوسیس، هماگلوتینین رشتهای یا پرتاكتين است، نسبت به واکسن سلول کامل ایمنتر است، ولی در اثر هر دو یکسان عمل میکنند.
[1] -Kennel cough in dogs
[2] -Bordet – Gengou agar
[3] -Regan – Lowe agar
[4] -Pertactin
[5] -Filamentous Hemagglutinin(FH)
[6] -Pertussis Toxin Hemagglutinin
[7] -Chinese Hamster Ovary Cell
[8] -Tracheal Ring
[9] -Dermonecrotic Toxin
[10] -Tracheal Cytotoxin((TCT)
[11] -Lymphocytosis-Promoting Factor
[12] -Histamine-Sensitizing Factor
[13] – Heat-Labile
[14] -Immunomodulating
[15] -Acellular
مروری بر آزمونهای تعیین حساسیت ضد میکروبی و روشهای نویدبخش در آینده
https://en.wikipedia.org/wiki/Bordetella
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام