درمان بدخیمیهای خونی با استفاده از سلولهای T بروزدهنده پذیرندههای کایمریک (CAR)

زهرا چیذری1، غزاله بردباری1، اکبر اشتری2
1: کارشناس ارشد
2: مسئول فنی آزمایشگاه
اولین نتایج آزمایشهای کلینیکی انسانی با استفاده از تکنولوژی گیرندههای آنتیژنی کایمریک سلولT در سال 2006 انتشار یافت و از آن زمان توسط مقالات فراوان ادامه یافت که به نتایج ارزشمند و جالبی منتهی شده است. ساختمان گیرندههای کایمریک سلول T بر اساس مهندسی ژنتیکی گیرندههای ایمنی میباشد. یک تعریف ساده این است که این گیرنده یک پلیپپتید است که توالیی از زنجیره سبک و سنگین یک آنتیبادی را بیان میکند که در اتصال با سیستم پیامرسانی سلول T ازجمله زنجیره ξ میباشد. تغییرات بعدی و اصلاحات مختلف بر این طراحی اولیه باعث اضافه شدن دومنهای کمک تحریکی دیگری از سلول T مانند CD27، CD28، CD134 یا CD137 به گیرندههای کایمریک شد.
گیرندههای آنتیژنی کایمریک (CAR):
شکل و عملکرد
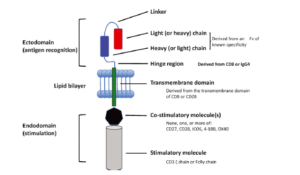
CAR شامل دومن خارج سلولی متصلشونده به هدف، یک دومن لولا، یک دومن گذرنده از غشا که باعث لنگر انداختن CAR در غشای سلول میشود و یک یا چندین دومن پیامرسان داخل سلولی میباشد (شکل 1). دومن متصلشونده به هدف معمولاً از بخش متغیر زنجیره سبک و سنگین آنتیبادی (FV) تشکیل شده است. طبیعت واکنش بین CAR با لیگاند خود از آنچه که بین TCR و لیگاند پپتیدی متصل به MHC اتفاق میافتد، متفاوت است. میل پیوندی (affinity) و میل پیوندی تام (avidity) بین آنتیبادی-لیگاند بسیار بیشتر از TCR- لیگاند میباشد. CARها پروتئینهای پردازشنشده سطح سلولی را شناسایی میکنند و بنابراین برخلاف شناسایی آنتیژن توسط TCR، شناسایی هدف توسط CAR مستقل از پردازش و عرضه آنتیژن میباشد و ازاینرو نسبت به مکانیسم رایج فرار تومورها که همان از دست دادن HLA میباشد، مقاوم است. تنها نقطهضعف CAR این است که نمیتواند مولکولهای داخل سلولی را شناسایی کند، اگرچه اخیراً یک CAR شبه TCR که توانایی شناسایی پپتیدهای آنتیژنی داخل سلولی WT1 در شیار MHC را دارد، معرفی شده است که کاملاً اختصاصی است. ناحیه لولا معمولاً از مولکولهای CD8 یا IgG4 حاصل شده است. ناحیه لولا برای بیان CAR بر سطح سلول بسیار مهم است. ناحیه لولا باعث انعطافپذیری بخش متصلشونده به لیگاند میشود. اتصال CAR به لیگاند باعث انتقال پیام از طریق دومن پیامرسان میشود که بطور معمول زنجیرهξ CD3 میباشد. برخی گروهها از دومن پیامرسان حاصل از گیرندههای FCγ استفاده میکنند. همراهی مولکولهای کمکتحریکی ازجمله CD27،CD28 ،CD34(OX40) ، CD137(4-1BB)، CD244 یا ICOS میتواند باعث افزایش اثرات پیامرسانی زنجیره ξ شود و بنابراین باعث بقا و تکثیر سلول T میشود.CD28 اولین مولکول کمکتحریکی بود که در ساختمان CAR استفاده شد و بطور قابلتوجهی باعث افزایش تولید IL-2 گردید و نیز نسبت به مهار توسط سلولهای T تنظیمی مقاوم بود.
شکل 1: آناتومی CAR
انتقال ژن به سلولهای T و تکثیر سلولهای مهندسیشده و انتقال آنها به بیمار
ابتدا سلولهای تکهستهای خون محیطی بیمار با استفاده از روش آفرزیس (Apheresis) جدا شده و سلولها تحت شرایطی که برای تکثیر سلولهای T مناسب باشد، کشت داده میشوند.
بهمنظور انتقال توالی ژنتیکی کدکننده گیرنده آنتیژنی کایمریک به داخل سلولهای T بیماران، از تکنیکهایی برپایه ویروس یا غیروابسته به ویروس استفاده میشود. بدین منظور از وکتورهای لنتیویروسها یا گامارتروویروسها بهمنظور ادغام در ژنوم سلول میزبان استفاده میشود. در مقایسه با وکتورهای گامارتروویروسی، وکتورهای لنتیویروسی میتوانند در سلولهایی که تقسیم نمیشوند هم ادغام شوند و نسبت به فاکتورهای مهارکننده میزبان هم مقاومند و میتوانند توالی بزرگتری از DNA را انتقال دهند.
از معایب استفاده از وکتورهای ویروسی پرهزینه بودن آنها و نیاز به نیروی متخصص جهت تولید آنها میباشد. تکنیکهای غیرویروسی ازنظر هزینه مقرونبهصرفهتر و ایمنتر میباشند. یکی از این روشها استفاده از سیستم ترانسپوزون/ترانسپوزاز میباشد که میتواند محموله بزرگتری را انتقال دهد و بیان بالای ژن را حفظ کند.
تکثیر این سلولهای مهندسیشده بهوسیله تحریک سلولهای T توسط آنتیبادی بر ضد CD3(OKT3) در حضور یا عدمحضور آنتیبادیهای کمکتحریکی مانند anti-CD28 یا به همــــــــــــــــراه سایتوکاینهایی مانند IL-2،IL-7 ، IL-12، IL-15 یا IL-21 انجام میشود. همینطور میتوان از سلولهای عرضهکننده آنتیژن ساختگی مانند سلولهای توموری K562 اشعهدیده یا سلولهای تغییریافته ویروس اپشتینبار (EBV) نیز استفاده کرد.
درنهایت این سلولهای T بروزدهنده CAR به بیمار تزریق میشود (شکل 2). به دنبال تزریق این سلولها در گردش خون بیماران، سلولهای T به محل بیماری میروند. سلولهای T مهندسیشده با تکثیر خود در محل بیماری تجمع پیدا میکنند و با شناسایی هدف خود فعال شده و عملکردهای اجرایی آنها القا میشود. این سلولها در مقابل پیامهای مهاری و سرکوبکننده حاصل از سلولهای هدف، سلولهای تنظیمی ایمنی و محیط تومور مقاومت میکنند و تا زمانی که تومور از بین برود باقی میمانند (شکل 3).
شکل 2: مراحل تولید سلولهای T مهندسیشده و انتقال آنها به بیمار
شکل 3: مراحل ایمونوتراپی موفق سلول T
بیماران مبتلا به لوسمی لنفوسیتی مزمن (CLL) و لوسمی لنفوسیتی حاد (ALL) بهطور کارآمدی با سلولهای بروزدهنده CAR که برای CD19 اختصاصی میباشند (یک شاخص عمومی سلول B که در سطح سلولهای توموری نیز بروز مییابد)، درمان شدهاند.
از دیگر آنتیژنهای سلول B که در تحقیقات مختلف مورد هدف قرار گرفته است CD22،CD23 ،ROR1 و زنجیره سبک است. CD22 به میزان زیادی در بدخیمیهای لنفوئیدی سلول بالغ مانند B-ALL بیان میشود. CD23 بر سطح سلولهای CLL بیان میشود و مطالعات مختلف نشان داده است که سلولهای T بروزدهنده CAR علیه CD23 باعث جلوگیری از رشد سللاین مشابه CLL میشوند. ROR1 یک تایروزین کیناز گذرنده از غشا میباشد که در سلولهای B بدخیم در CLL و MCL یافت میشود و به میزان ناچیزی در سلولهای آدیپوز طبیعی و برخی پیشسازهای سلول B بیان میشود و مطالعات کلینیکی که ROR1 را مورد هدف قرار بدهد در حال انجام است. مورد هدف قرار دادن یکی از دو زنجیره سبک میتواند در بدخیمیهای سلول B که همراه با بیان زنجیره سبک بر سطح سلول است، مفید باشد. امروزه مطالعات کلینیکی برای درمان بدخیمیهای سلول B با کمک سلولهای T بروزدهنده CAR در حال انجام میباشد.
درمان لوسمی میلوئید حاد با استفاده از سلولهای T بروزدهنده CAR
ازآنجاییکه AML یک بدخیمی سلولهای بنیادی هماتوپوئتیک میباشد، پیدا کردن هدفی که بر سطح سلولهای بدخیم باشد ولی بر سطح سلولهای هماتوپوئتیک طبیعی نباشد چالشی را در پیش روی محققان قرار داده است. زنجیره α گیرنده IL-13 (CD123) که بهعنوان آنتیژن اولیه هماتوپوئتیک شناخته میشود، در بسیاری از بیماران AML بیان میشود و همینطور بر سطح پیشسازهای مغز استخوان طبیعی هم بیان میشود، بنابراین هدف قرار دادن این آنتیژن توسط سلولهای T بروزدهنده CAR باعث از بین بردن سلولهای خونساز میشود. در میان دیگر اهداف درمانی برای AML، آنتیژن CD33 است که بر سطح سلولهای میلوئید نابالغ بیان میشود و مورد هدف قرار دادن سلولهایی که ازنظر CD33 مثبت هستند باعث تخلیه این سلولها میشود. CD44 یک مولکول چسبندگی است که بهطور گسترده بر سطح بافتهای طبیعی بیان میشود. یک ایزوفرم این مولکول به نام CD44v6 بر سطح برخی بلاستهای AML و برخی سلولهای میلوما بیان میشود. سلولهای T بروزدهنده CAR بر ضد CD44v6 باعث اثرات ضدتوموری مناسبی در مدلهای موشی میشوند.
درمان لنفومای هوچکین با استفاده از سلولهای T بروزدهنده CAR
سلولهای B بدخیم در لنفومای هوچکین بهوسیله بیان مداوم CD30 شناسایی میشوند. در چندین مطالعه نشان داده شده است که لاینهای سلولی مثبت ازنظر آنتیژن CD30 میتوانند بهوسیله سلولهای T بروزدهنده CAR مورد هدف قرار داده شوند، از طرفی CD30 بر سطح برخی از سلولهای T فعال بیان میشود و بنابراین سلولهای T بروزدهنده CAR بر ضد CD30 ازنظر تئوریک میتواند باعث پیشبرد مرگ سلولهای مهندسیشده توسط همدیگر شود. تحقیقات در زمینه هدف قرار دادن CD30 در درمان لنفوم هوچکین هنوز در حال انجام میباشد.
درمان بدخیمیهای سلول T با استفاده از سلولهای T بروزدهنده CAR
هدف قرار دادن سلولهای T بدخیم توسط سلولهای T بروزدهنده آنتیژن بسیار مشکل میباشد. اولین و مهمترین مسئله هدف قرار دادن آنتیژنی میباشد که فقط بر سطح سلول T بدخیم یافت شود. برخی لنفوماهای سلول T مولکول CD30 را بیان میکنند و ازنظر تئوری میتوانند توسط سلول T بروزدهنده CAR مورد هدف قرار بگیرند.
درمان میلوما با استفاده از سلولهای T بروزدهنده CAR
میلوما میزان بالایی CD138 (syndecan-1) و CD38 را بیان میکند.CD138 یک پروتئوگلیکان هپارین سولفات غشایی میباشد که بیان آن در سیستم هماتوپوئتیک محدود به پلاسماسل است، علاوه بر آن بهطور گستردهای بر سطح اپیتلیوم هم بیان میشود و هدف قرار دادن آن توسط سلول T بروزدهنده CAR میتواند باعث التهاب در سطوح اپیتلیالی شود. CD38 یک مولکول مهاری پیامرسانی میباشد که بر سطح بسیاری از پیشسازهای چندتوانه میلوئیدی و لنفوئیدی بیان میشود و همین موضوع باعث نگرانی در هدف قرار دادن CD38 توسط سلول T بروزدهنده CAR میشود. هدف بعدی شناختهشده در میلوما BCMA است که از خانواده گیرنده فاکتور نکروزدهنده تومور میباشد و بر سطح سلول B بالغ و پلاسماسل بیان میشود و باعث پیشبرد بقای پلاسماسلهای با طول عمر بالا در مغز استخوان میشود. مطالعات مختلفی بر پایه هدف قرار دادن BCMA توسط سلول T بروزدهنده CAR انجام شده است. گلیکوپروتئین CS1 بر سطح بیشتر سلولهای مولتیپل میلوما و پلاسماسلهای طبیعی بیان میشود، همچنین به میزان کمی بر سطح لنفوسیتهای دیگر، مونوسیتهای فعال و سلولهای دندرتیک فعال هم بیان میشود. نگرانی که در مورد هدف قرار دادن این آنتیژن وجود دارد بیان آن بر سطح سلولهای T فعال است که باعث میشود درمان بهوسیله سلول T بروزدهنده CAR علیه CS1 موجب از بین بردن سلولهای T بروزدهنده CAR توسط یکدیگر در محیط کشت یا در داخل محیط بدن بیمار شود. مطالعات مختلفی درزمینهٔ استفاده از سلول T بروزدهنده CAR علیه CD44v6 در میلوما وجود دارد. نگرانی اصلی این است که CD44v6 بر سطح کراتینوسیتها هم بیان میشود.
منابع برای مطالعه بیشتر:
- Gill, Saar, and Carl H. June. “Going viral: chimeric antigen receptor T‐cell therapy for hematological malignancies.” Immunological reviews 263.1 (2015): 68-89.
- Curran, Kevin J., Hollie J. Pegram, and Renier J. Brentjens. “Chimeric antigen receptors for T cell immunotherapy: current understanding and future directions.” The journal of gene medicine 14.6 (2012): 405-415.
- Cheadle, Eleanor J., et al. “CAR T cells: driving the road from the laboratory to the clinic.” Immunological reviews 257.1 (2014): 91-106.
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام