اورهآپلاسما
و پیشرفتهای اخیر در بیماریزایی، تشخیص و درمان آن
سمیرا دهاقین (دانشجوی کارشناسی ارشد میکروبشناسی)
دکتر رضا میرنژاد (دانشیار دانشگاه)
مقدمه:
مايكوپلاسماها کوچکترین ارگانیسمهای دارای زندگی آزاد و تکثیر مستقل هستند. آنها در طبیعت بهعنوان انگل انسان، پستانداران، خزندگان، ماهیها، بندپایان و گیاهان انتشار دارند. مایکوپلاسماها عمدتاً در دهان، دستگاه تنفسی فوقانی و بخشهای انتهایی دستگاه ادراری- تناسلی انسان یافت میشوند.
در میان مایكوپلاسماهای تناسلی، گونههای اورهآپلاسما شایعترین و بهطور بالقوه باکتریهای بیماریزا هستند كه از دستگاههای ادراری- تناسلی مردان و زنان جدا شدهاند. آنها همچنین اغلب با تولد زودرس و سایر پیامدهای سوء حاملگی مرتبط هستند. مطالعه حاضر، مروری بر روی اورهآپلاسما و پیشرفتهای اخیر در بیماریزایی، تشخیص و درمان آن دارد.
تاکسونومی:
اورهآپلاسما متعلق به خانواده مایکوپلاسماتاسه، کلاس مولیکوتس و راسته مایکوپلاسماتالس میباشد. اورهآپلاسما اولین بار در سال 1954 از یک مرد مبتلا به اورتریت غیرگنوکوکی توسط Shepard و همکارانش کشف شد. از آنجایی که این ارگانیسمها کلنیهای کوچکی را تشکیل میدهند (قطر 15-7 میکرومتر)، آنها را در اصل سویه T، سویه T مایکوپلاسما یا مایکوپلاسما T نامیدند. آنها در میان مایکوپلاسماهای با منشأ انسانی، منحصربهفرد تلقی میشوند، زیرا قادر به متابولیزه کردن اوره هستند و نمیتوانند آرژینین یا گلوکز را مصرف نمایند؛ بنابراین پیشنهاد شد که یک نامگذاری جدیدی میبایست برای جنس و گونههای این موجودات منحصربهفرد درون راسته مایکوپلاسماتالس بوجود بیاید. در نهایت این ارگانیسمها در سال 1974 توسط Shepard و همکارانش به نام U. urealyticum نامگذاری شدند.
ویژگیهای عمومی اورهآپلاسماها:
اورهآپلاسماها که فاقد پپتیدوگلیکان هستند از طریق تکامل دژنراتیو از باکتریهای گرم مثبت تکامل یافتهاند. آنها باکتریهایی با شکل کروی یا کوکوباسیل با قطر بین 0/3-0/2میکرومتر هستند. عدم وجود دیواره سلولی، این ارگانیسم را به بتالاکتامها حساس کرده، همچنین مانع از رنگآمیزی آنها توسط رنگآمیزی گرم شده و مسئول ایجاد فرم پلیمورفیک در آنها است. از آنجایی که آنها با توجه به ژنوم کوچکشان قابلیتهای بیوسنتز محدودی دارند، به محیط کشت غنیشده با مکمل سرم برای رشد در شرایط آزمایشگاهی نیاز دارند. زمان نسبی تکثیر اورهآپلاسما حدود یک ساعت میباشد.
اورهآپلاسما در دستگاه ادراری- تناسلی و تنفسی زندگی میکند و تنها در حین سرکوب ایمنی و یا استفاده از تجهیزات پزشکی به زیر مخاط نفوذ مینماید. در انسان، اورهآپلاسما از طریق تماس جنسی، از مادر به فرزندان بهصورت عمودی در داخل رحم یا از طریق مایعات آلوده بدن در زمان تولد منتقل میشود.
اورهآپلاســـــــــــماها دارای 14 سروتیپ شناخــــــــــــــــته شدهانـــــــد و به دو گروه
Ureaplasma parvum (UPA Biovar 1 Parvo) و (UUR Biovar 2 T960) Ureaplasma urealyticum طبقهبندی میشوند. بیووار 1 شامل سروتیپهای 1، 3، 6، 14 و 10 و سروتیپهای باقی مانده متعلق به بیووار 2 میباشد. جداسازی آنها در بیووارها بر اساس شواهد فیلوژنتیک از طریق مطالعات هیبریداسیون DNA-DNA انجام شده است. بیووارها همچنین در حساسیت به نمکهای منگنز، RFLP و الگوهای سلولی کامل بر روی الکتروفورز ژل پلیآکریل آمید (PAGE) با یکدیگر اختلاف دارند. اورهآپلاسماها در مطالعات انتشار یافته قبل از تقسیم آن به دو بیووار، بهعنوان گونههای اورهآپلاسما یا Ureaplasma urealyticum نامیده میشدند.
canigenitalium, U. cati, U. felinum, U. gallorale, U. diversum بهترتیب اورهآپلاسماهای جدا شده از گاو، پرنده، گربه و گونههای سگ هستند.
ژنوم اورهآپلاسما:
اندازه ژنوم سرووارهای U. parvum بین Mbp 0/75-0/78 و سرووارهای U. urealyticum بیــــــن Mbp 0/84-0/95 میباشد. ژنوم U. parvumبهطور قابلتوجهی کوچکتر از U. urealyticum است. سرووارهای UPA بهطور متوسط 608 ژن دارند که 201 ژن از آنها، پروتئین فرعی را کد میکنند و سرووارهای UUR بهطور متوسط 664 ژن دارند که 230 ژن از آنها، پروتئین فرعی را کد مینمایند. بطورکلی ژنوم اورهآپلاسما دارای 1020 ژنهای کدکننده پروتئین است که معمولاً 515 ژن در بین همه سرووارها (یعنی ژنوم هستهای) محافظت شدهاند.
Paralanov و همکاران، یک مقایسه کل ژنوم در سطح نوکلئوتید را با استفاده از استرینهای ATCC در تمام 14 سرووار انجام دادند. آنها دریافتند که میانگین اختلاف درونگونهای 0/62% با حداقل تفاوت بین UUR4 و UUR12(0/06%) و بیشترین تفاوت بین UUR9 و UUR13 (1/27%) میباشد. در سطح بین گونهها، میانگین تفاوت 5/9% با بیشترین تفاوت بین UPA1 و UUR9 (10/2%) است.
اورهآپلاسما دارای چندین ژن کدکننده برای پروتئینهای سطحی و لیپوپروتئینها است که ژن کدکننده آنتیژن چند بانده[1] (MBA) بیشتر مورد مطالعه قرار گرفته است. ناحیه ´5 از MBA یک پایه N ترمینال حفاظتشده لیپوپروتئین را کد میکند، درحالیکه ناحیه ´3 MBA، دومین C ترمینال را کد مینماید که شامل چندین ناحیه تکراری پشتسرهم میباشد که در معرض سطح قرار دارند. دومین C ترمینال، آنتیژنیک بوده و موجب پاسخ آنتیبادی میزبان در طی عفونت اورهآپلاسما میشود. حذف یا اضافه شدن تعداد واحدهای تکراری در منطقه پایینتر از MBA با تنوع آنتیژنیکی مرتبط است. علاوه براین، MBA میتواند با ژنهای کناری تغییر فاز داشته باشد و اخیراً نشان داده شده است که سویههای UPA3 ژنهای کایمریک را از طریق تغییرات فازی تولید میکنند.
اورهآپلاسما شامل یک یا چند ژن اینتگراز ریکامبیناز میباشد. برخی از سرووارها حاوی ترانسپوزازها یا بقایای آن و برخی پروتئینهای مرتبط با فاژ هستند. در سرووار 9 که مقاومت به تتراسایکلین را کسب کردهاند، ژن tetM بهعنوان بخشی از ترانسپوزون Tn916 شناسایی شده بود. اگرچه اورهآپلاسماهای مقاوم به تتراسایکلین (زمانی که در سرووار 9 شناسایی شدند)، احتمالاً فراوانی کمی داشتند، ولی در حال حاضر آنها 25% تا 35% از همه ایزولههای بیماران را تشکیل میدهند. گزارش سالهای 2000 تا 2004 از چندین ایالت در USA نشان داد که 45٪ از ایزولههای بالینی منحصربهفرد گونههای اورهآپلاسما حاوی tetM و مقاومت به تتراسایکلین هستند.
خصوصیات بالینی:
اورهآپلاسماها و عفونتهای دستگاه تناسلی:
اورهآپلاسماها بخشی از فلور نرمال دستگاه تناسلی با میزان کلونیزاسیون 80-40% میباشند. علیرغم آن، این ارگانیسمها در چندین بیماری مانند اورتریت غیرگنوکوکی (NGU)، پروستاتیت، سنگهای ادراری، بیماریهای زنان، ناباروری و بیماریهای مزمن ریه در نوزادان دخیل میباشند. آنها پاتوژنهای فرصتطلب در نظر گرفته میشوند، زیرا میتوانند بهراحتی از دستگاه تناسلی تحتانی افراد سالم و افراد مبتلا به بیماری جدا شوند.
مطالعات متعدد نشان میدهد که اورهآپلاسما یکی از عوامل ابتلا به اورتریت غیرگنوکوکی و غیرکلامیدیایی در مردان است، هرچند که بیماریزایی آن هنوز معلوم نیست. تلقیح تجربی اورهآپلاسماها در داوطلبان انسانی منجر به علائمی در مجاری ادراری، دفع ارگانیسمها و سلولهای چرکی و بهبود تدریجی و ریشهکن شدن عفونت با مینوسایکلین به مدت 6 روز میگردند. از این رو، درجه آن پائینتر از C. trachomatis و M. genitalium بهعنوان عامل NGUمیباشد. مطالعات انجامشده در هندوستان توسط Gupta و همکارانش و Deodhar و همکارانش نشان داد که به ترتیب شیوع 11% و 1/16% اورهآپلاسما در میان بیماران مبتلا به اورتریت غیرگنوکوکی وجود دارد.
اورهآپلاسما از لولههای فالوپ آسیبدیده در بیماران مبتلا به بیماری التهابی لگن (PID) نیز جدا شده است، اما بروز آن در این ناحیه نادر است و معمولاً در ارتباط با سایر پاتوژنهای شناختهشده است.
اگرچه اورهآپلاسما به میزان زیادی (97-62%) از بیماران با واژینوز باکتریایی (BV) جدا شده است، ولی نقش آن بهعنوان یک پاتوژن هنوز مشخص نیست. میزان کلونیزاسیون واژن توسط اورهآپلاسما از 8/5 تا 77/5 درصد متغیر است که این میزان کلونیزاسیون بستگی به فعالیت جنسی داشته و با احتمال بیشتری در افراد با چندین شریک جنسی مشاهده میگردد. در مطالعه Dhawan و همکاران، اورهآپلاسما در 25/8% بیماران مبتلا به عفونتهای دستگاه تناسلی و در زنان نابارور به میزان 20/8% شناسایی شدهاند.
مطالعات قبلی نشان داده است که بیووارهای اورهآلیتیکوم با بیماریزایی ارتباط دارند. مطالعه Chua و همکارانش نشان داد که بیووار 2 نسبت به بیووار 1 ارتباط بیشتری با از دست دادن لاکتوباسیل در زنان دارد. آنها نشان دادند که بیووار 2 در مقایسه با بیووار 1 که تنها در دستگاه ادراری- تناسلی کلونیزه میشوند، با عفونت دستگاه ادراری- تناسلی (58/18%) مرتبط است.
اورهآپلاسما و HIV:
عفونتهای دستگاه تناسلی با گونههای اورهآپلاسما با فراوانی زیادی در بیماران مبتلا به HIV گزارش شده است. در مطالعه Martinelli و همکارانش که روی 187 نفر از مردان آلوده به نوع 1 ویروس نقص ایمنی انسانی(HIV-1) بدون علائم بالینی اورتریت انجام شد، میزان شیوع U.urealyticumدر بیماران مبتلا به ایدز (12/3%) نسبت به بیماران آلوده به HIV-1 (8/5%) و افراد سالم (7%) بالاتر بود.
Ghosh و همکارانش، میزان آلودگی اورهآپلاسما را در بیماران مبتلا به HIV6%، در مقایسه با داوطلبان سالم که 2% بود را نشان دادند. این مطالعات نشان میدهد که عفونت با گونههای اورهآپلاسما بهطور بالقوه حساسیت به کسب کردن و انتقال HIV را افزایش میدهد. دیگر مایکوپلاســــــــــماهای ژنیتال مانند M. hominis و M. genitalium بهعنوان عوامل کاندیدای کمکی در بیماریزایی ایدز شناخته شدهاند، زیرا آنها در همکاری با ویروس HIV عمل کرده و بیماری رتروویروسی را تشدید میکنند. اگرچه اثبات نشده است که اورهآپلاسما ممکن است نقش مشابهی در بیماران آلوده به HIV داشته باشد.
اورهآپلاسما و ناباروری:
کلونیزاسیون دستگاه تناسلی تحتانی توسط اورهآپلاسما بهعنوان یک علت ناباروری مورد ارزیابی قرار گرفته است. Gupta و همکاران، حضور U.urealyticum را در 32% زنان نابارور در مطالعهشان نشان دادهاند. همچنین اورهآپلاسما از لولههای فالوپ بیماران مبتلا به PID جدا شده است. علاوه بر این، نشان داده شده است که این ارگانیسم به سلولهای اسپرم متصل شده و در نتیجه باعث کاهش تحرک اسپرم میگردد که این ممکن است ارتباط اورهآپلاسما را با ناباروری توضیح دهد.
اورهآپلاسما و سنگهای کلیوی:
اورهآپلاسما از ادرار بیماران مبتلا به سنگهای عفونی، بیشتر از افرادی که دارای سنگهای متابولیکی هستند جدا شده است. همانند پروتئوس، اورهآپلاسما نیز میتواند به دلیل فعالیت متابولیسمی آنزیم اورهآز، سطح اوره را کاهش دهد و استروویت (فسفات منیزیم آمونیم) را در مدلهای حیوانی کریستالیزه نماید. عفونت با باکتریهای تولیدکننده اورهآز بهطور قابلتوجهی خطر تشکیل استروویتها را افزایش میدهد که منجر به افزایش pHادرار و آسیب مستقیم به اپیتلیوم مجاری ادراری توسط آمونیاک میگردد. این باکتریها در داخل شکافهای سنگهای ادراری که در آن عوامل ضدمیکروبی نفوذ نمیکنند، زندگی میکند؛ درنتیجه عفونتهای پایدار منجر به رشد سریع سنگها و پر کردن تمام یا بخشی از لگنچه کلیه طی یک دوره چند هفته یا چند ماه میگردد.
در مطالعه Dewan و همکاران بروی 70 بیمار مبتلا به سنگ کلیه، کشت از سنگها انجام شد که U.urealyticum در کشت سنگ کلیه تنها دو بیمار رشد کرد.
Shafi و همکاران مطالعهای را انجام دادند که نمونههایی از 45 سنگ کلیه همراه با نمونههای ادراری که بهوسیله کاتتریزاسیون (سونداژ) همزمان مثانه به دست میآمد، انجام شد. نتیجه آن که اگرچه E.coli شایعترین باکتری است که از سنگها رشد کرده بود، ولی U.urealyticum شایعترین ارگانیسم ایجادکننده UTI است که از 62/5% نمونههای ادراری جدا گردید.
اورهآپلاسما و پیامدهای سوء حاملگی:
اورهآپلاسما از مایع آمنیوتیک زنان با التهاب کوریوآمنیوتیک جدا شده است که منجر به زایمان زودرس میگردد. با استفاده از PCR ژن 16S DNA ریبوزومی در نمونههای مایع آمنیوتیک نشان داده شد که گونههای اورهآپلاسما شایعترین جنس میکروبی شناختهشده در مایع آمنیوتیک زنان مبتلا به پارگی زودرس و نابهنگام غشاها (پارگی کوریوآمنیوتیک) بودند.
Gerberو همکارانش، از مایع آمنیوتیک 254 زن بدون علامت در هفته 17-15 بارداری توسط آمنیوسنتز نمونهگیری کردند و گونههای اورهآپلاسما را در 11% موارد شناسایی نمودند. زایمان زودرس نیز در زنان مبتلا به اورهآپلاسما مثبت نسبت به زنان اورهآپلاسما منفی، بهطور چشمگیری بالاتر بود.
مطالعات اخیر بر روی 150 زن مبتلا به پارگی زودرس غشا نشان داد که 96% زنان مبتلا، توسط U.urealyticum کلونیزه شده بودند. مطالعهای در ژاپن نشان میدهد که در میان 151 جفت از حاملگیهایی که با زایمان زودرس خودبخودی به پایان رسیدند، 63 مورد کشت مثبت برای اورهآپلاسما بوده و 83% از آنها دچار کوریوآمنیونیتیس بافتی (التهاب غشاها) بودند.
عفونت اورهآپلاسما همچنین با دیگر پیامدهای سوء حاملگی همراه است. اورهآپلاسما از جنینهای خودبخودی سقط شده، نوزادان مرده به دنیا آمده و نوزاد نارس جدا شده است. یافتن این ارگانیسم از جنینهای سقط شده، بهطور کامل به علت آلودگی سطحی آنها نیست، زیرا این ارگانیسم از اندامهای داخلی آنها نیز جدا شده است.
اورهآپلاسما و بیماری در نوزادان:
اورهآپلاسما گاهی منجر به بیماریهای تنفسی در نوزادان میگردد. اورهآپلاسما در ابتلا به بیماریهای تنفسی در نوزادان متولدشده با وزن بسیار پایین نقش دارد، بنابراین نوزادان با وزن کمتر از 1000 گرم که اورهآپلاسما از آسپیراسیون تراشههای آنها جدا شده بود، نسبت به نوزادانی که عفونت نداشته و وزن آنها بیشتر از 1000 گرم بود، در 24 ساعت اولیه عمرشان یا از دنیا رفتند و یا دچار بیماری مزمن ریوی شدند. جداسازی اورهآپلاسما از ترشحات نای نوزادان نشان میدهد که عفونت جنین میتواند در رحم اتفاق بیفتد یا از طریق دیگری بهوسیله انتقال عمودی در تولد کسب شود.
Sethi و همکارانش U. urealyticum را از 14% آسپیراسیون تراشه نوزادان با وزن پائین در زمان تولد و دارای زجر تنفسی، جدا کردند.
بر این اساس فرض شده است که التهاب داخل رحمی و کلونیزاسیون اورهآپلاسما، عدم تشکیل بافت ریه جنین را سبب شده و احتمال ابتلا به دیســــپلازی ریـــــــوی نایژهای[2] (BPD) و یا بیمـــــــاری مزمن ریوی[3] (CLD) را در آینده افزایش میدهد. با این حال گزارشهای متعددی وجود دارد که ارتباط اورهآپلاسما در ترشحات تنفسی نوزادان را با بروز بیماری BPD میپذیرند یا رد میکنند.
Pandey و همکارانش در مطالعه خود گزارش کرده بودند که کلونیزاســـــــــــــیون راههای هوایی با U. urealyticum نقش مهمی در گسترش CLD در نوزادان نارس هندی نداشت.
Scheonkaو همکاران، یک متاآنالیز در مطالعات منتشرشده انجام دادند و دریافتند که خطر نسبی BPD در نوزادان اورهآپلاسما مثبت 1/6 (CI 1.1-2.3) برای BPD در 36 هفته، یا 2/8 (CI 2.3-3.5) برای BPD در 28 هفته، در مقایسه با گروه اورهآپلاسما منفی بود.
تنوع در مطالعات ممکن است به علت جمعیتهای مختلف بیمار، شیوههای مداخلهای در استفاده از ونتیلاتورها، تکنیکهای کشت غیر یکسان اورهآپلاسما و سوگیری در انتشار آمار باشد.
عفونت اورهآپلاسما همچنین ممکن است سبب ایجاد رتینوپاتی زودرس[4] (ROP) در نوزادان نارس با دخالت در عروق کرونری طبیعی شبکیه شود. Ozdemirو همکارانش نشان دادند که کلونیزاسیون U.urealyticum با ROP شدید همراه بوده و نیاز به عمل جراحی برش لیزری دارد.
اورهآپلاسما و سایر عفونتها:
اورهآپلاسما از مفاصل بیماران مبتلا به هیپوگاماگلوبولینمی که با آرتریت چرکی مواجه هستند جدا شده است. دیده شده است که آرتریت در این بیماران حتی طی ماهها بعد از درمان با آنتیبیوتیکها و عوامل ضدالتهابی همچنان باقی مانده است.
Sethiو همکارانش یک مورد آرتروز چرکی در یک دختر جوان 10 ساله را گزارش دادند که U.urealyticum از مایع مفصلی (سینوویال) برداشته شده از مفصل زانو جدا شد. فرض بر این است که سرایت به مفصل هدف ممکن است هماتوژنوس (انتشار عفونت توسط خون) باشد.
پاتوژنز:
اورهآپلاسما به کمک پروتئینهای متصلشونده به سلول که بر روی سطح سلول باکتری بیان میشوند به سطوح مخاطی متصل میگردد. مشخص شده است که اورهآپلاسما به انواع سلولهای انسانی شامل اریتروسیتها، اسپرمها و سلولهای اپیتلیال مجاری ادراری متصل میگردد.
فاکتور کلیدی ویرولانس اورهآپلاسما، یک لیپوپروتئین سطحی به نام MBA است. TLR1، TLR2 و TLR6 گیرندههای شناسایی الگو هستند که از طریق MBA، فاکتور هستهای کاپا B را فعال میکنند. مشخص شده است که MBA دارای تنوع در اندازه میباشد. رابینسون و همکارانش نشان دادهاند که شدت کوریوآمنیونایتیس بهطور معکوس با تعداد تغییرات در اندازهMBA که در مایع آمنیوتیک آلوده وجود داشته است، ارتباط دارد، لذا این تحقیق نشان داد که تنوع MBA با بیماریزایی اورهآپلاسما مرتبط است.
Zimmerman و همکارانش نشان دادند که MBA در U. parvum، تحت تأثیر تغییرات فاز متناوب با یک ژن مجاور UU376 قرار دارد. علاوه بر این، اخیراً تغییرات فاز پارالوگهای N ترمینالMBA UU171 و UU172 در U. parvum و U. urealyticumشرح داده شده است.
یکی از نتایج اولیه تغییرات آنتیژنیکی، فرار کردن از پاسخ سیستم ایمنی اکتسابی میباشد. Dando و همکارانش با استفاده از یک مدل گوسفندی نشان دادند که تغییرپذیری در اندازه MBA از تشخیص گیرندههای شناسایی الگوی میزبان جلوگیری نمیکند، با این وجود ممکن است از پاسخ ایمنی میزبان در ریشهکن کردن اورهآپلاسما از حفره آمنیوتیک جلوگیری نماید؛ بنابراین نقش مهمی در بیماریزایی این میکروارگانیسمها ایفا میکند.
اورهآپلاسما با بیان فسفولیپاز A و C، باعث تولید پروستاگلاندینها میشود که یک محرک شناختهشده برای زایمان است. Kacerovsky و همکارانش مشخصات پروتئین مایع آمنیوتیک و شدت پاسخ التهابی داخل آمنیوتیک به گونههای اورهآپلاسما را با استفاده از تکنولوژی Multiplex xMAP مورد بررسی قرار دادند. حضور گونههای اورهآپلاسما در مایع آمنیوتیک با افزایش سطح IL -6، IL-8، IL-10، فاکتور نوروتروپیک مشتق از مغز، فاکتور تحریک کلنی ماکروفاژ گرانولوسیتی، پروتئین 1 کموتاکتیک مونوسیت، پروتئین 1 التهابی ماکروفاژ و متالوپروتئیناز 9 ماتریکس مرتبط است. این التهاب عمومی در آمنیون و غشاء کوریون منجر به تولید واسطههای پیشالتهابی مانند IL-1β،IL-6 و پروستاگلاندینها گردیده که در نهایت باعث ایجاد زایمان زودرس میشوند.
همچنین نشان داده شده است که اورهآپلاسما فعالیت IgA پروتئازی دارد که میتواند IgA مخاطی را از بین ببرد. از آنجایی که IgA ایمونوگلوبولین غالب ترشحشده در سطوح مخاطی است، IgA پروتئاز میتواند کلونیزاسیون توسط میکروارگانیسمها را با تخریب این جزء مهم سیستم ایمنی مخاطی تسهیل نماید. با این حال، آنالیز ژنوم تمام سرووارها نشاندهنده وجود این ژن در آنها نیست. پیشبینی میشود که این آنزیم از ارتولوگوس (ژنهایی که در نمونههای متفاوت ولی شبیه به یکدیگرند) در باکتریهای دیگری که غیرقابل تشخیص هستند تکامل یافته باشد و یا ممکن است بهطور همگرا از یک آنزیم بدون هیچ شباهت قابل تشخیص با آنزیمهای دیگر تکامل یافته باشد.
فعالیت اورهآز اورهآپلاسما باعث تولید آمونیاک از شکستن اوره میشود که میتواند سبب سمیت بافتهای میزبان به دلیل تغییر pH شود. بیماری مزمن ریه پس از قرار گرفتن در معرض آمونیاک در بزرگسالان گزارش شده است. با این حال، رابینسون و همکاران نشان دادند که pH افزایشیافته در مایع آمنیوتیک و یا مایع ریه جنین با افزایش تعداد سلولهای التهابی در کوریوآمنیون یا بافت ریه جنین ارتباط ندارد، اما آمونیاک آزادشده توسط اورهآپلاسما ممکن است به آسیب مزمن بافتی و نابهنجاری مشاهدهشده در کوریوآمنیون و ریه جنین در داخل رحم منجر گردد.
بیماریزایی و پایداری اورهآپلاسما نیز تحت تأثیر توانایی میکروارگانیسمها در تشکیل بیوفیلم قرار دارد. مطالعهای که توسط Pandelidis و همکارانش انجام شد، تأیید کرد که اکثر ایزولههای اورهآپلاسمای بالینی، بیوفیلمها را در شرایط آزمایشگاهی تشکیل میدهند. این بیوفیلمها ممکن است به مقاومت ارگانیسم و التهاب مزمن کمک کنند، اما تشکیل بیوفیلم بر رویMIC ها برای آزیترومایسین یا اریترومایسین تأثیر نمیگذارد.
تشخیص:
جمعآوری نمونه:
نمونههای مناسب برای تشخیص اورهآپلاسما شامل سوآب مجرای ادراری، ادرار، سوآب اندوسرویکال و بیوپسی رحم است.
سوآب داکرون (نوعی الیاف مصنوعی)، آلژینات کلسیم و سوآبهای پلیاستر بر روی پایههای پلاستیکی، ایدهآل هستند، چرا که سوآبهای پنبهای روی پایههای چوبی اثر مهاری بر ارگانیسمها دارند.
از آنجایی که این ارگانیسمها بسیار ظریف و حساس به خشکی و گرما هستند، باید از محیطهای انتقالی مانند SP4، 2SP، Shepard’s 10 B و PPLO broth استفاده گردد. سایر محیطهای کشت عبارتند از: محیط کشت Stuart، محیط کشت Amie’s و Trypticase soy broth با 5% آلبومین سرم گاو.
اگر انتقال فوری به آزمایشگاه امکانپذیر نباشد، نمونهها باید در زنجیره سرد قرار گیرند. از آنجایی که اورهآپلاسما بهعنوان پاتوژن سطح 2 در نظر گرفته شده است، میز کار آزمایشگاهی و یا کابینت ایمنی کلاس 2 برای کار بر روی این میکروارگانیسمها کفایت میکند.
در آزمایشگاه، PPLO brothحاوی سوآبها، ورتکس شده و بعد سوآبها دور انداخته میشوند. سپس نمونهها به مدت 30 دقيقه در g 500 سانتريفوژ میشوند تا ده برابر تغلیظ شده و از فيلتر غشاءμm 45/0 عبور داده میشوند.
میکروسکوپ:
فقدان یک دیواره سلولی سفت و سخت، دیدن اورهآپلاسما را بهطور مستقیم با استفاده از میکروسکوپ نوری تقریباً غیرممکن ساخته است. اگرچه رنگآمیزی گرم موجب نمایان شدن آنها نمیگردد، ولی برای رد کردن سایر باکتریهای عفونی مفید است. رنگآمیزی فلوروکروم DNA نظیر آکریدین آرنج و Hoechst 33258 ممکن است در نمونههای سانتریفیوژ شده مانند مایع آمنیوتیک مفید باشند.
کشت:
کشت بهعنوان استاندارد طلایی در تشخیص اورهآپلاسما محسوب میشود، اما سخت است. از آنجایی که این موجودات حساس هستند، برای جداسازی آنها نیاز به حضور سرم، مواد متابولیکی و فاکتورهای رشد مانند عصاره مخمر میباشد.
محیط کشتهای توصیهشده شامل SP4 broth و SP4 آگار، Shepard’s 10 B broth و آگار و PPLO broth و PPLOآگار میباشند. از آنجایی که این ارگانیسمها هیچ کدورتی را در رشد ایجاد نمیکنند، شاخصهای pH مثل فنلرد به محیطهای براث اضافه میشوند که رشد ارگانیسمها منجر به تغییر pH در محیط کشت گشته و بهعنوان تغییر رنگ شاخص، نمایان میگردد. آنتیبیوتیکهایی مانند پنیسیلین G و ضدقارچهایی مانند نیستاتین نیز برای جلوگیری از رشد آلودگیها به محیط بایستی اضافه گردند.
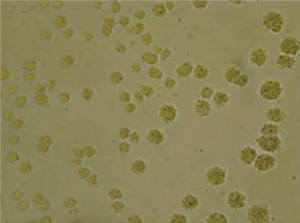
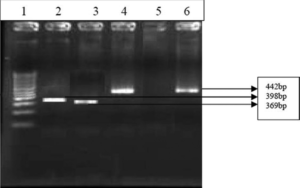
محیطهایی که معمولاً برای جداسازی اورهآپلاسما استفاده میگردد، PPLO broth حاوی اوره است. نمونههای پروسس شده بهصورت رقتهای 10 برابر از 1:10 تا 105: 1 برای تلقیح رقیق میشوند. رقیق کردن ضروری است چراکه تداخل با آنتیبیوتیکها، آنتیبادیها و یا مهارکنندههای دیگر برطرف شده و مانع مرگ باکتریها میگردد. محیطهای براث تلقیحیافته در دماي 37 درجه سلسیوس و 5٪ CO2 انکوبه شده و دو بار در روز بررسی میشوند. افزایش pH که از طریق تغییر رنگ بدون هیچگونه کدورتی مشاهده میشود، نشاندهنده رشد است. سپس رشدیافتهها دوباره در براث و آگار کشت داده میشوند. بالاترین رقت که نشاندهنده تغییر رنگ است، بیانگر تعداد موجودات حاضر در نمونه در واحد تغییر رنگ در هر میلیلیتر (CCU/ml) است (شکل 1). غلظت بالاتر از CCU/ml 104cut off بیانگر حضور اورهآپلاسما میباشد. بر روی محیط PPLO آگار هنگامی که با رنگآمیزی Dienes رنگ میگردند، رشد آنها شبیه تخممرغ نیمرو است (شکل 2).
شکل 1: کشت گونههای اورهآپلاسما در PPLO broth حاوی اوره:
لوله 1: کشت مثبت، لوله 2: کشت منفی
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14)
شکل 2: مشخصههای کلنیهای اورهآپلاسما بر روی PPLOآگار (10×)
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14)
تست (ELiTech Diagnostic, France) Mycofast Revolution یک تست تجاری جدید است که شناسایی و شمارش آسان گونههای اورهآپلاسما و مايکوپلاسما هومينيس را در عرض 24 تا 48 ساعت فراهم میکند. این روش یک روش مایع بر اساس توانایی گونههای اورهآپلاسما در متابوليزه کردن اوره و مايکوپلاسما هومينيس در متابولیزه کردن آرژینین است که متشکل از 20 چاهک هستند که از قبل با يک محيط کشت دهیدراته پوشانده شده (سرم اسب، عصاره مخمر، سيستئين، آرژینين، اوره، فنلرد و آنتیبیوتیکها) و حاوي يک محیط براث جداگانه با عوامل ضدميکروبي برای انتقال و حفظ مایکوپلاسماهای ژنیتال میباشد (UMMt) (ELiTech Diagnostic, France).
سایر تستهای تجاری تشخیصی با روشهای مشابه شناسایی، آزمایش حساسیت ضدمیکروبی و سهولت استفاده، شامل کیت Mycoplasma Duo (Sanofi Diagnostics Pasteur France)، کیت آزمایش (Ivagen) Mycoview و (BioMérieux) MycoIST2 نیز قابل دسترسی هستند. مزیت آزمایش Mycofast Revolution این است که آزمایش حساسیت ضدمیکروبی علیه عوامل مختلف ضدمیکروبی با حداقل غلظت مهارکنندگی (MICs) انجام میشود که طبق استانداردهای مؤسسه استاندارد بالینی و آزمایشگاهی 2011 (CLSI) تعریف شده است. تست حساسیت ضدمیکروبی علیه پنج عامل ضدمیکروبی شامل لووفلوکساسین، موکسی فلوکساسین، اریترومایسین، کلیندامایسین و تتراسایکلین انجام میگردد.
در مطالعهای Redelinghuyhs و همکارانش، آزمایش Revolution mycofaste را با PCR برای تشخیص مایکوپلاسماهای ژنیتال در زنان باردار مقایسه کردند. آنها نشــان دادند که کیـــت Revolution mycofaste دارای حساسیت 77/3% و اختصاصیت 80% نسبت به آزمایش PCR بود.
سرولوژی:
روشهای آزمایش سرولوژیک برای اورهآپلاسما شامل میکروایمونوفلورسانس، مهار متابولیسم و آنزیم ایمونواسی میباشد، اما شیوع اورهآپلاسما در افراد سالم باعث میشود تفسیر تیترهای آنتیبادی در برابر این موجودات مشکل باشد. هیچ آزمایش سرولوژیکی برای مایکوپلاسماهای دستگاه تناسلی استاندارد نشده و برای اهداف تشخیصی در دسترس نیستند.
تستهای تشخیصی بر مبنای اسید نوکلئیک:
ژل مبتنی بر PCR رایج، توالیهای هدف ازS rRNA 16 و برای نواحی فاصلهانـــداز بیـــــــــــن ژنی S rRNA16 تا S rRNA23، ژن اورهآز و MBA را بررسی میکند، درحالیکه تســــــــــتهای Real Time PCR عمدتاً ژنهای اورهآز و زیرواحدهای آنها یا MBA را هدف قرار میدهند.
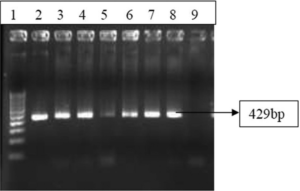
در مطالعه انجام شده توسط Dhawan و همکاران، شیوع U.urealyticumرا در بیماران دارای ترشحات ژنیتال توسط هر دو روش کشت و PCR تعیین نمودند. در مطالعه این افراد PCR یک قطعه bp 429 را در ژن ساختاری اورهآز در U.urealyticumهدف قرار داد (شکل 3). شيوع U.urealyticum بهواسطه کشت 32% و با استفاده از PCR 45% تعيين شد. در یکی دیگر از مطالعات، یک multiplex PCRکه ژن اورهآز را برای شناسایی اورهآپلاسما وS rRNA 16 را برای شناسایی M. hominisهدف قرار داد بود، استفاده شد. اورهآپلاسماهای مثبت شده، با استفاده از PCR ژن آنتیژن چندبانده (MBA) بیوتایپینگ شدند (شکل 3). اکثریت ایزولههای اورهآپلاسما متعلق به بیووار 1 (U. parvum) بودند. پرایمرهایی مانند UMS83 / UMA269، UMS125 / UMA269 و UMS54 / UMA269بیشتر برای شناسایی سرووارها مورد استفاده قرار گرفتند (شکل 5) و سرووارهای 3 تا 14 بهعنوان شایعترین آنها شناسایی شدند. آزمایشگاه تشخیصی مایکوپلاسمای UAB، تست Real Time PCR را برای تشخیص و تمایز گونههای اورهآپلاسما مبتنی بر UU063 (NP_077893) (که پروتئین فرضی محافظتشده بوده و در هر چهار سرووار U. parvum همسان هستند) و ORF، bp 15072UUR10_0680(NC_011374.1) را که در تمام 10 سرووار U.urealyticum محافظت شدهاند، بکار برده است.
تشخیص STD6 و STD6B ACE (Seegene Inc)، یک آزمایش مولکولی است که فقط در کشورهای مختلف اروپایی در دســـــــــترس است. این تست بهطـــور همزمان Trichomonas vaginalis، M. hominis، M. genitalium، C. trachomatis، N.gonorrhoeae و گونههای اورهآپلاسما را در سوآبهای اندوسرویکال و مجاری ادراری تشخیص میدهد. ویژگی جدید این تکنولوژی تست این است که در آن یک سیستم dual‑priming بکار رفته که این پرایمرها توسط یک لینکر از جنس پلیداکسی اینوزین با یکدیگر ارتباط دارند. این کیت با هر ترموسایکلری کار میکند و آزمایش پس از PCR برای الکتروفورز ژل دستی یا خودکار طراحی شده است. آزمایش Ureaplasma STD6 یک منطقه bp 130 از کاست ureD را تکثیر میکند. نسخه جدید آن (STD6B) با استفاده از ژنهای ureC دو گونه U. urealyticum و U. parvum را از یکدیگر افتراق میدهد.
گونههای اورهآپلاسما در دستگاه ادراری تناسلی تحتانی افراد سالم بهصورت فلور نرمال هستند، بنابراین معمولاً مثبت شدن آزمایش PCR از نمونههای این قسمتها جای تعجب ندارد، ولی افزایش میزان تعداد باکتریهایی که توسط Real Time PCR تعیین میشوند، بهعنوان نشاندهنده عفونت بالینی، ارزشمندتر است. نتایج مثبت PCR برای گونههای اورهآپلاسما از مجاری ادراری در مردان مبتلا به اورتریت، از آسپیره نای نوزادان مبتلا به بیماریهای تنفسی، از جریان خون یا مایع مغزی نخاعی در نوزادان مبتلا به پلئوسیتوزیس و از محلهای خارج از دستگاه تناسلی بهصورت نرمال، بایستی از نظر بالینی مهم در نظر گرفته شود.
تست حساسیت آنتیبیوتیکی:
روشهای متعددی برای تشخیص حساسیت آنتیبیوتیکی روی مایکوپلاسماهای ژنیتال استفاده شده است که روش رقت آگار، روش میکرودایلوشن براث و E تست برخی از آنها است.
روش میکرودایلوشن براث
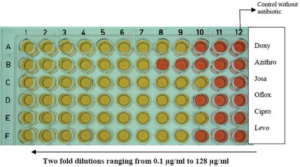
عملیترین و اقتصادیترین روشی که بهطور گسترده مورد استفاده قرار میگیرد، تست میکرودایلوشن براث است. در این روش از میکروپلیت 96 خانهای استفاده میشود که در آن رقتهای از آنتیبیوتیک با غلظتهای مختلف با غلظت استاندارد موجودات زنده (معمولاً 104/ میلیلیتر) در محیط کشت براث مخلوط شده و انکوبه میشوند. محيط مورد استفاده broth B10 يا PPLO broth حاوي اوره است. ارگانیسمها در صورت تکثیر، اوره را در محیط متابولیزه میکنند که این امر موجب تغییر pH و در نهایت منجر به تغییر رنگ (قرمز شدن) میگردد. این تغییر رنگ معمولاً 18-16 ساعت پس از انکوباسیون رخ میدهد.
اگر ارگانیسم، حساس به غلظت آنتیبیوتیک موجود در چاهک باشد، رشد مهار شده و تغییر رنگ رخ نمیدهد. MICبالاترین رقت آنتیبیوتیک است که مانع تغییر رنگ در زمان میگردد؛ زمانی که تغییر در کنترل بدون آنتیبیوتیک رخ داده و بهتازگی رشد کرده باشد (شکل 6). از محاسن این روش این است که میتوان حساسیت باکتری را به چند آنتیبیوتیک بهطور همزمان مشخص کرد، اما زمان خواندن و میزان تلقیح به محیط، به استانداردسازی نیاز دارد. لازم بذکر است که جمعیت ناهمگن ارگانیسمها با سویههای مقاوم و حساس میتواند در محیط تکثیر شده و حساسها نادیده گرفته شوند، لذا مهم است که نقطه پایانی MIC را در اولین بروز تغییر رنگ در چاهک کنترل رشد بهخوبی بررسی کرد. به این نکته نیز باید توجه شود که دوره انکوباسیون طولانی، MIC را تغییر داده و به همین ترتیب MIC را به اشتباه افزایش میدهد.
روش رقت آگار:
روش رقت آگار برای تعیین MIC بر اساس ترکیب رقتهای دو برابر شده عوامل ضدمیکروبی به پلیتهای آگار مایع میباشد که هر پلیت حاوی غلظتهای مختلف است. در این روش از محیطهایA8 آگار یا PPLO آگار با اوره میتوان استفاده کرد. رقتهای مناسب داروها، با آگار مخلوط میشوند. پس از سفت شدن آگار پلیتها، μl 10 از مایع تلقیح ارگانسیم معین که از 104 تا 105 CFU/ml در براث مناسب تهيه شده، به پلیت آگار اضافه میگردد. پلیتها در حضور 5% CO2 در دمای 37 درجه سلسیوس انکوبه میشوند. MIC بهعنوان پایینترین غلظت عامل آنتیبیوتیک رقتی میباشد که مانع تشکیل کلنی (زمانی که در زیر استریومیکروسکوپ بررسی شود) میگردد که در زمان مشابه در پلیت کنترل بدون آنتیبیوتیک، رشد تقریبی 30 تا 300 CFU در هر نقطه از تلقیح مشاهده گردد. طول مدت زمانی کهMIC ها میتوانند خوانده شوند، مشابه روش میکرودایلوشن براث است.
این روش اگرچه دشوار و وقتگیر است، ولی دارای مزایایی است که نقطه پایان نسبتاً پایدار بوده و این باعث تشخیص کشتهای مخلوط میگردد. دو کار برای سادهسازی این روش میتوان انجام داد: روش اول E تست است که با استفاده از یک نوار که حاوی یک آنتیبیوتیک خاص در یک گرادیان غلظت میباشد، انجام میشود.MIC ها بهعنوان غلظت آنتیبیوتیک روی نوار، در نقطه تقاطع با منطقه مهار کلنی مشخص میشوند. روش دوم شامل استفاده از دیسکهای کاغذی فیلتردار است که حاوی غلظتهای دو برابر کاهشیافته متوالی آنتیبیوتیک است. پایینترین غلظت آنتیبیوتیک که منجر به مهار رشد آن ناحیه باشد، MIC در نظر گرفته میشود.
هیچ دستورالعمل کلی از هیچ سازمان نظارتی برای انجام این آزمایشها و نیز تفسیر نقاط ضعف اجرا و نتایج MIC وجود ندارد. روش میکرودایلوشن براث بهطور معمول برای تست حساسیت آنتیبیوتیکی ایزولههای M.hominis و گونههای Ureaplasma استفاده میشود. این ارگانیسمها علیه آزیترومایسین، ژوزامایسین، افلوکساسین و داکسیسایکلین تست شدهاند. Cut off غلظت MICsبرای حساس، متوسط و مقاوم در آزیترومایسین، ژوزامایسین و افلوکساسین به ترتیب 4 و 2 ≥ میکروگرم در میلیلیتر و 8 ≤ میکروگرم در میلیلیتر و برای داکسیسیکلین به ترتیب 4 و 8 ≥ میکروگرم در میلیلیتر و 16≤ میکروگرم در میلیلیتر است. گونههای مقاوم به تتراسایکلین دارای MIC8 ≥ میکروگرم در میلیلیتر و سویههای حساس معمولاً دارای MIC2 ≥ میکروگرم در میلیلیتر هستند.
شکل 3: PCR برای ژن اورهآز
چاهک 1: لدر 100 bp، چاهک 2: کنترل مثبـــــــــــت U. urealyticum
(اورهآز مثبتNCTC 10177;)، چاهک 8-3: نمونههای بالینی (مثبت)، چاهک 9: کنترل منفی.
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14.)
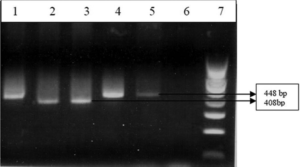
شکل 4: PCR برای ژن MBA
چاهک 1: کنترل مثبت (بیووار 2) NCTC 10177-، چاهک 2: کنترل مثبت (بیووار 1) – سرووار 3، چاهک 3: نمونه بالینی مثبت برای بیووار 1، چاهک 4 و 5: نمونه بالینی مثبت برای بیووار 2، چاهک 6: کنترل منفی، چاهک 7: لدر bp100
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14.)
شکل 5: تکثیر PCR برای شناسایی سرووارهای U. parvum
چاهک 1: لدر 100bp، چاهک 2: کنترل مثبت سرووار 1، چاهک 3: کنترل مثبت سرووار 6، چاهک 4: کنترل مثبت 14-3، چاهک 5: کنترل منفی، چاهک 6: نمونه بالینی مثبت برای سرووارهای 14-3
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14.)
شکل 6: میکرودایلوشن براث در میکروتیتر پلیت 96 خانهای برای گونه استاندارد U. urealyticum NCTC 10177 و ایزوله بالینی
داکسی: داکسیسایکلین، آزیترو: آزیترومایسین، ژوزا: ژوزامایسین، افلوکس: افلوکساسین سیپرو: سیپروفلوکساسین، لوو: لووفلوکساسین
(Kokkayil P,et.al. Indian J Med Microbiol. 2015;33(2):205-14.)
پروفایل حساسیت و مقاومت ضدمیکروبی:
مایكوپلاسماهای تناسلی، مانند مولیکوتسهای دیگر، بهطور ذاتی به آنتیبیوتیکهایی كه بر اجزای دیواره سلولی اثر میگذارند (بتالاكتامها)، مقاوم هستند. گونههای اورهآپلاسما دارای مقاومت ذاتی نسبت به لینکوزآمیدها هستند (مانند کلیندامایسین). مقاومت مشاهدهشده به ماکرولیدها مرتبط با جهش در ژن S rRNA23 میباشد، درحالیکه مقاومت به تتراسایکلین با حضور ترانسپوزون متحرک M tet همراه است. ژن tet M پروتئینی را کد میکند که به ریبوزوم متصل میشود و در مورد U.urealyticum نشان داده شده است که در کروموزوم، با Tn916که یک ترانسپوزون کونژوگه است مرتبط میباشد. مطالعات قبلی نشان دادند که مقاومت اورهآپلاسما به کینولونها عمدتاً به علت جهشهای هدف آنزیم DNA هلیکاز (ریشههای نواحی 107-68 که نواحی مقاومت به کینولونها (QRDR) میباشند) هستند.
علاوه بر بتالاکتامها، مايكوپلاسماها همچنین در برابر سولفوناميدها، تريمتوپريم و ريفامپيسين مقاومت نشان میدهند. مقاومت به ریفامپیسین به حضور یک اسیدآمینه تکی در موقعیت 526 زیرواحد بتا RNA پلیمراز مربوط میشود. در یک مطالعه اخیر که توسط Dhawan و همکارانش انجام گردید که شامل بیماران مبتلا به ناباروری و ترشحات دستگاه تناسلی بود، تمام ایزولههای M. hominis مقاوم به اریترومایسین، ولی حساس به داکسیسایکلین، ژوزامایسین و افلوکساسین بودند. همه ایزولههای گونههای اورهآپلاسما به داكسيسايكلين و ژوزامايسين، 77% از ایزولهها به افلوکساسين و 71% به آزيترومايسين حساس بودند. اگرچه بیشتر مطالعات، میزان مقاومت کمتری نسبت به تتراسایکلینها (کمتر از 5%) گزارش دادهاند، ولی مطالعه اخیر توسط Redelinghuyhs و همکارانش نشان داد که تنها 27% ایزولههای اورهآپلاسما به تتراسایکلین حساس هستند.
در مطالعه Chiang-tai و همکارانش در شانگهای چین نشان دادند که بیووار 1 میزان حساسیت بالایی (بیش از 90%) را به تمام عوامل ضدمیکروبی دارند؛ اما بیووار 2، حساسیت بالایی (بیش از 95%) تنها به داکسیسایکلین و مینوسایکلین دارند. درواقع فقط تعداد کمی از سویههای بیووار 2، به روکسیترومایسین و کینولونها حساس بودند.
درمان:
از آنجا که سندرمهای مشخص عفونتهای دستگاه ادراری تناسلی، تنها توسط مایکوپلاسماهای تناسلی ایجاد نمیشوند، بلکه توسط ارگانیسمهای مختلف دیگر نیز ایجاد میگردند، حساسیت آنتیبیوتیکی به همه آنها باید در هنگام تجویز درمان تجربی در نظر گرفته شود. با توجه به این موضوع، درمان ترجیحی، آزیترومایسین 1 گرم بهصورت خوراکی یک دوز، یا داکسیسایکلین 100 میلیگرم خوراکی دو بار در روز به مدت 7 روز میباشد. با این حال، از آنجا که مقاومت به تتراسایکلینها در حال افزایش است، بیمارانی که قادر به پاسخ به داکسیسایکلین نیستند، ممکن است به مدت 7 روز با اریترومایسین 500 میلیگرم نیز بهصورت خوراکی درمان شوند.
فلوروکینولونها همچنین اثربخشی برابر با داکسیسایکلین در درمان اورتریت غیرگنوکوکی را نشان میدهند. اثربخشی و ایمنی یک دوره 7 روزه اسپارفلوکساسین نیز قابل مقایسه با داکسیسایکلین است. تجویز عوامل ضدمیکروبی به زنان باردار مبتلا به پارگی زودرس غشاها (PROM) ممکن است دوره بارداری را افزایش داده و خطر عوارض مرتبط و عفونت نوزادان را کاهش دهد. ماکرولیدها اغلب بهصورت تجربی استفاده میشوند زیرا تتراسایکلینها و فلوروکینولونها در دوران بارداری منع مصرف دارند. با این حال اریترومایسین بهطور مؤثر نمیتواند به کیسه آمنیوتیک نفوذ کند و اورهآپلاسما از واژن و سرویکس توسط این عامل ریشهکن نمیشود. درمان با آزیترومایسین نیز در مقایسه با اریترومایسین به همان اندازه موفق بوده ولی عوارض جانبی کمتری دارد.
نوزادانی که به علت گونههای اورهآپلاسما بهطور بالینی مبتلا به پنومونی شدهاند، با اریترومایسین درمان میشوند.
Waitesو همکارانش مطالعهای بر روی اثربخشی فارماکوکینتیک (اثر دارو در بدن) و میکروبیولوژیکی اریترومایسین داخل وریدی در نوزادان نارس که دستگاه تنفسی تحتانی آنها توسط گونههای اورهآپلاسما کلونیزه شده بودند، انجام دادند. این مطالعه اطلاعاتی فراهم کرد که به موجب آن مصرف mg/kg/day 40 اریترومایسین برای درمان داخل وریدی نوزادان نارس مفید میباشد.
تعداد محدودی از مطالعات، استفاده از ماکرولیدها را برای ریشهکن کردن اورهآپلاسما در نوزادانی که در معرض خطر ابتلا به BPD هستند، گزارش کرده است.
Ballard و همکارانش، 220 نوزاد نارسی که وزن آنها 1250 ≤ بوده و تهویه تنفسی آنها بهصورت مکانیکی انجام میشد را بهطور تصادفی انتخاب کرده و به مدت 6 هفته با آزيترومايسين يا پلاسیبو آنها را درمان کردند. در زیرگروه نوزادانی که اورهآپلاسما را از آسپیراسیون نای آنها جدا کرده بودند، آزیترومایسین میزان BPD را از 94% در دسته پلاسیبو به 73% در دسته آنتیبیوتیک کاهش داد. اخیراً در یک مطالعه تصادفی در ترکیه، اثر کلاریترومایسین را در 74 نوزاد نارس بررسی کردند و دریافتند که درمان برای 10 روز میزان بروز BPDرا کاهش میدهد. اگرچه در این مطالعات هیچ عوارض قابلتوجهی گزارش نشده است، اما از آنجایی که مصرف طولانی مدت آنتیبیوتیک با افزایش انتروکولیت نکروزه شونده، یا با شروع تأخیری بیماری سپسیس همراه است، آنتیبیوتیکها باید با احتیاط در نوزادان نارس استفاده شوند.
برای عفونتهای تهاجمی مايکوپلاسما نیز مانند عفونت CSF، تتراسایکلینها بهترین درمان هستند.
نتیجهگیری:
اورهآپلاسما با طیف گستردهای از بیماریها شامل اورتریت غیرگنوکوکی، سنگهای ادراری، بیماریهای زنان، ناباروری، دیسپلازی برونشهای ریوی نوزادان، بیماری مزمن ریوی و رتینوپاتی زودرس همراه است. از آنجایی که آنها از ابعاد سلولی و ژنومی باکتریهای معمول کوچکتر هستند و دارای نیازهای غذایی خاصی میباشند، شناسایی، جداسازی و توصیف آنها نیاز به تکنیکهای مولکولی برای تکمیل روش کشت دارد. شروع سریع درمان آنتیبیوتیک مناسب برای جلوگیری از عوارض طولانی مدت و عود این عفونتها نیز اهمیت دارد.
منبع:
Kokkayil P, Dhawan B. Ureaplasma: current perspectives. Indian J Med Microbiol. 2015;33(2):205-14.
[1] Multiple Banded Antigen (MBA)
[2] Bronchopulmonary Dysplasia (BPD)
[3] Chronic lung disease(CLD)
[4] Retinopathy of prematurity(ROP)
تازههایی از مايكوپلاسماها (2)
کلامیدیا تراکوماتیس و پیشرفتهای اخیر در بیماریزایی، تشخیص و درمان آن
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام