اهميت و اندازهگيري ليپيدهاي سرم
مراد رستمي: کارشناس ارشد بیوشیمی بالینی، دانشگاه علوم پزشكي جندي شاپور اهواز
معصومه جرفي: کارشناس ارشد ميكروب شناسي، دانشگاه علوم پزشكي جندي شاپور اهواز
محمد علیمحمدی: کارشناس ارشد بیوشیمی بالینی، دانشگاه آزاد اسلامي واحد اراک
بيماري عروق كرونر (Cronary Heart Disease; CHD)، عمدهتـــرين علت مرگ و مير در سراسر دنيا است. عليرغم شناسايي عوامل خطرزاي اصلي اين بيماري، توجيه علت پيدايش اين بيماري تنها در نيمي از بيماران امكان پذير ميباشد. افزايش LDL و نفوذ آن به زير سلولهاي آندوتليال و اكسيداسيون آنها توسط راديكالهاي آزاد و ايجاد تغييرات ساختماني در آنها باعث فرآيندهايي ميشود كه در نهايت موجب تسريع ايجاد آترواسكلروزيس ميگردند. ناهنجاريهاي متابوليسم ليپيد، نقش اصلي را در آترواسكلروز و CHD بازي ميكنند.
يك ارتباط مستقيم بين سطح بالاي كلسترول و انفاركتوس ميوكارد وجود دارد و در سطح بافتي، رسوب كلسترول در مناطق با آسيب سلول اندوتليال رخ ميدهد كه بخش بارز آسيبهاي آترواسكلروزي ميباشد. لازم به ذكر است كه آترواسكلروز شامل ضايعات چربي به نام پلاكهاي آترومي در سطح داخلي جدار شريانها و آرتريواسكلروز نيز يك اصطلاح كلي براي افزايش ضخامت و سختي عروق خوني در هر اندازه ميباشد.
از جمله عوامل مؤثر در ايجاد آترواسكلروز به بيتحركي فيزيكي، چاقي، ديابت قندي، افزايش فشار خون، هيپرليپيدمي و كشيدن سيگار ميتوان اشاره نمود. وجود ديابت قندي و يا افزايش فشار خون هر كدام به تنهايي خطر ايجاد آترواسكلروزيس را 2 برابر مينمايند؛ در حالي كه وجود اين دو عامل با همديگر، به دليل اثر همافزا، خطر ايجاد آترواسكلروزيس را به 8 برابر ميرسانند و يا خطر ايجاد آترواسكلروزيس در حضور ديابت قندي، افزايش فشار خون و هيپرليپيدمي با هم به بيش از 20 برابر ميرسد. در حدود نيمي از افراد بالغ در ايالات متـــــحده داراي سطح بالايي از كلسترول (mg/dl 200 ≤) بوده و از بين هر 5 نفر، 1 نفر در محدوده ريسك بالا براي كلسترول (mg/dl 240 ≤) قرار دارد.
اگرچه به خاطر موارد بالا، كلسترول ميتواند «بد» در نظر گرفته شود اما كلسترول واقعاً يك جزء ساختاري حياتي در غشاها و پيشساز هورمونهاي استروئيدي و اسيدهاي صفراوي ميباشد. ليپيد ديگر يعني تريگليسريد، منبع اصلي انرژي براي سلول ميباشد. كلسترول و تريگليسريدها، مهمترين ليپيدها در مطالعه ريسك بيماري عروق كرونر قلب ميباشند.
ليپيدها در حلالهاي آلي غير قطبي از قبيل كلروفرم و اتر قابل حل بوده، اما در حلالهاي قطبي از قبيل آب، نسبتاً غير قابل حل ميباشند، بنابراين كلسترول و تريگليسريدها در پلاسما به صورت مولكولهاي آزاد و شناور منتقل نشده، بلكه به صورت بخشي از مولكولهاي قابل حل در آب به نام ليپوپروتئينها جابجا ميشوند. اين ذرات حاوي كلسترول به فرمهاي كلسترول آزاد (كلسترول غير استريفيه قطبي) (30%) و استر كلسترول (فرم هيدروفوبي كه در آن كلسترول به اسيدهاي چرب متصل شده است) (70%)، وجود دارند.
آرايش ليپوپروتئينها شبيه به ميسل ميباشد. ليپيدهاي هيدروفوب (آب گريز) از قبيل استرهاي كلسترول و تريگليسريدها در مركز ذره واقع شدهاند. ليپيدهاي هيدروفيل (آب دوست) از قبيل كلسترول آزاد و فسفوليپيدها كه محلول در آب ميباشند، در سطح به گونهاي آرايش يافتهاند كه گروههاي قطبي آنها به سمت بيرون قرار گرفته است. آپوليپوپروتئينها (بخش پروتئيني ليپوپروتئينها) نيز در سطح آرايش يافتهاند.
در تمامي افراد با سن 20 سال و يا بالاتر بايد پروفايل ليپيدي (تريگليسريد، كلسترول، HDL و LDL) حداقل هر 5 سال يك بار چك گردد.
چهار دسته اصلي از ليپوپروتئينها كه شامل شيلوميكرونها (CM)، ليپوپروتئينهاي با چگالي بسيار كم (VLDL)، ليپوپروتئين با چگالي كم (LDL) و ليپوپروتئين با چگالي زياد (HDL) ميباشند، وجود دارد. ليپوپروتئينهاي ديگري نيز شامل ليپوپروتئين با چگالي حد واسط (IDL) و ليپوپروتئين α (a)LP وجود دارد كه مقادير بسيار كمي را شامل ميشوند.
تريگليسريد (TG) (Triglycerides)
تریگلیسریدها، ترکیبات استری از گلیسرول و اسیدهای چرب هستند که در تشخیص و پیگیری اختلالات مربوط به لیپوپروتئینها اهمیت زیادی دارند. تریگلیسریدها تا حدود 90% از راه خوراکی وارد بدن شده و حدود 90% چربی ذخیره بدن را تشکیل میدهند. تریگلیسریدها در بدن به دو شکل اندوژن و اگزوژن دیده میشوند، که در حالت اندوژن در کبد تولید شده و به وسیله VLDL حمل میشوند و در حالت اگزوژن نیز در سلولهای مخاطی روده تولید شده و توسط شیلومیکرونها در خون منتقل میگردند.
به طور طبیعی این تركيب در بافت چربی به صورت گلیسرول، اسیدهای چرب و مونوگلیسریدها ذخیره شده و در کبد مجدداً به تریگلیسرید تبدیل میشود. تریگلیسریدها از منابع مهم انرژیزاي بدن هستند که هر گرم از آنها به ميزان 3/9 کیلو کالری انرژی تولید میکند. سطح تریگلیسرید در صبح، کمترین مقدار و در حوالی ظهر، در بالاترین میزان قرار دارد.
روشهای اندازهگیری:
آنزیماتیک، شیمیائی و نفلومتری
اصول آزمایش:
در این آزمایش ابتدا تريگليسريدها توسط ليپوپروتئين ليپاز به گليسرول و اسيدهاي چرب تجزيه ميشوند. در مرحله بعد گليسرول به كمك گليسرول كيناز با ATP واكنش داده و توليد گليسرول- 3 – فسفات و ADP مينمايد. ADP توليد شده با كمك پيروات كيناز با فسفوانول پيروات واكنش داده و توليد پيروات و ATP ميكند. در مرحله بعد نيز پيروات با استفاده از لاكتات دهيدروژناز با NADH و H+ جفت شده و توليد لاكتات و NAD مينمايد. از روي ميزان احيا شدن NADH به ميزان تريگليسريد پي ميبرند.
افزایش تریگلیسرید (هیپرتریگلیسریدمی):
بالا بودن سطح TG، در بیماریهای مختلف کبدی، کلیوی و پانکراتیک دیده میشود. مصرف غذاهای چرب باعث افزایش سطح تریگلیسرید میشود. مصرف الکل باعث افزایش تولید VLDL و در نتیجه بالا رفتن سطح تریگلیسرید میشود. بارداری نيز مقدار تریگلیسرید سرم را افزایش میدهد، به طوری که به هنگام زایمان ممکن است مقدار آن دو برابر مقدار قبل از حاملگی باشد. داروهای کلستیرامین، استروژنها و قرصهای ضد بارداری، باعث افزایش سطح تریگلیسرید میشوند. در بیماری فونژیرکه (نوعي بیماری ذخیره گلیکوژن)، به دليل افزايش تولید VLDL و همچنين كاهش تجزیه آن، مقدار TG افزايش مییابد. هایپرتریگلیسریدمی فامیلی، نوعی استعداد ژنتیکی افزایش TG بوده كه در آن کمبود آپو پروتئین C-II که با کمبود آنزیم لیپوپروتئین لیپاز (Lipoprotein lipase; LPL) همراه است، سبب تجمع TG میشود.
در هيپوتيروئيدي، تجزیه تریگلیسریدها کاهش يافته كه این خود سبب افزایش TG میگردد. در رژیم پر کربوهیدرات نيز کربوهیدراتهای اضافی تبدیل به TG شده و غلظت آن را در خون بالا میبرند. در بیماری دیابت که به خوبی کنترل نشده باشد، تولید VLDL افزایش يافته و منجر به افزایش TG میشود. در سندرم نفروتیک، دفع پروتئینها باعث کاهش فشار انکوتیک پلاسما شده و این پدیده باعث تحریک تولید لیپوپروتئینهای LDL و VLDL در کبد میگردد، همچنين احتمالاً از اتلاف كليوي لیپوپروتئینها نيز کاسته شده و سطح TG خون افزایش مییابد. در نارسایی مزمن کلیهها، سطح انسولین افزایش مییابد، زیرا انسولین توسط کلیهها دفع میشود. انسولین باعث تشديد لیپوژنز و افزایش سطح TG میگردد. به علاوه این بیماران دچار کمبود LPL نيز میباشند.
کاهش تریگلیسرید (هیپوتریگلیسریدمی):
از داروهای کاهنده TG به اسید آسکوربیک، آسپاراژیناز، کلوفیبرات و کولستیپول ميتوان اشاره نمود. در سندرم سوء جذب، شخص بیمار دچار سوء جذب چربیهای رژیم غذایی میباشد. از آن جايي كه TG نیز جزء اصلی چربی رژیم غذایی میباشد، به همین دلیل انتظار میرود که به دلیل جذب کم آن از دستگاه گوارش، سطح آن نيز کاهش یابد. بیماران دچار آبتالیپوپروتئینمی، نه تنها دچار سوء جذب چربیها بلکه دچار اختلالات تولید آپوپروتئین B (لیپوپروتئین ناقل تریگلیسرید) نيز میباشند؛ به همین دلیل، سطح TG خون در اين افراد پایین میباشد. سوء تغذیه نیز سبب کاهش مقدار TG خون میشود. در هيپرتيروئيدي، به دلیل تجزیه VLDL، سطح TG خون کاهش مییابد.
مقادیر نرمال:
بر اساس طبقه بندي (Adult treatment panel III) ATPIII، مقادير نرمال TG به شرح ذيل ميباشد:
|
TG
|
150 > | طبيعي |
| 199 – 150 | سرحد بالا | |
| 499 – 200 | بالا | |
| 500 ≤ | بسيار بالا |
كلسترول (Cholesterol)
کلسترول جزء لیپیدهای ساده (غیر قابل صابونی شدن) میباشد و ساختمان آن از یک حلقه سیکلوپنتانو پرهیدروفنانترن تشکیل شده است. كلسترول هم در سلولها سنتز شده و هم از طریق مواد غذایی جذب بدن میگردد. سنتز كلسترول عمدتاً در طي شب رخ ميدهد و از اين روست كه توصيه ميشود داروهاي پايين آورنده كلسترول در شب مصرف شوند. کلسترول خون به دو شکل وجود دارد یک قسمت با اسیدهای چرب استریفیه شده و یک قسمت به صورت آزاد است. در شخص نرمال 50 تا 70 درصد کلسترول خون به صورت استریفیه است. توزیع آن در بدن گسترده بوده و قسمت عمده آن در خون، مغز، کبد، کلیهها و فیبرهای عصبی میباشد و یکی از اجزاء اصلی تکمیل کننده غشاء سلولی و اسیدهای صفراوی، استروئیدهای آدرنال و هورمونهای جنسی ميباشد.
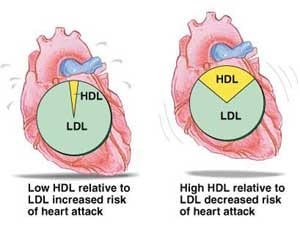
کلسترول در پلاسما توسط لیپوپروتئینها که مجموعهای از لیپیدها و آپولیپوپروتئینها هستند حمل میگردد. LDL نقش انتقال کلسترول به درون نسوج را به عهده دارد که به آن چربی «بد» میگویند. HDL هم عمل برداشت کلسترول از نسوج را به عهده دارد، که به آن چربی «خوب» میگویند. حدود 75 درصد کلسترول به LDL و 25 درصد آن به HDL متصل میشود. در مطالعات انجام شده رابطه نزدیکی میان LDL بالا در سرم افراد و بیماری رگهای کرونر قلبی و سایر انواع آترواسکلروزیس مشاهده شده است. حتی در مواردی که مقدار کلسترول نرمال باشد نیز بالا بودن LDL نشانگر بالا بودن خطر ابتلا به بیماریهای فوق است.
HDL بر خلاف LDL، عمل محافظت و پیشگیری را از طریق برداشت کلسترول از نسوج به عهده داشته و بالا بودن HDL باعث کاهش خطر ابتلا به بیماریهای قلبی و عروقی میشود، در حالی که پایین بودن سطح HDL حتی در صورت نرمال بودن کلسترول باعث افزایش خطر ابتلا به بیماریهای فوق میباشد، بنابراین اندازهگیری کلسترول تنها جهت غربالگری بیماران به کار میرود، در حالی که برای تخمین احتمال وقوع حمله قلبی اندازهگیری HDL و LDL ضروری است. ورزش و هورمونهای زنانه میزان HDL را افزایش میدهند، در حالی که سیگار و کربوهیدراتها میزان HDL را کاهش میدهند.
چربیها ممكن است در بافتهای مختلفی از بدن تجمع يابند. اگر این تجمع در جدار شریانها باشد به آن آترواسکلروزیس، در بافت زیر جلد، گزانتوماتوز، در تاندونها، گزانتوم و اگر در کبد باشد به آن کبد چرب (Fatty liver) میگویند. تجمع چربی در قرنیه نیز ممکن است اتفاق بیافتد. کبد چرب بیشتر در مصرف زیاد الکل و تجمع تریآسیل گلیسرولها در بافت کبد همراه است و میتواند در نهایت به سیروز کبدی منجر شود.
تغییر قابل ملاحظهای در سطوح کلسترول وجود دارد. در یک فرد ممکن است تغییر کلسترول از یک روز تا روز بعد به 15 درصد برسد و در یک روز میتواند 8 درصد تغییر کند. تغییر حالت میتواند بر این سطوح اثر بگذارد. در حالت خوابیده سطح آن میتواند 15 درصد کاهش یابد، در نتیجه به نظر میرسد بیماران بستری نسبت به سرپایی سطوح کمتری داشته باشند. به دلیل این تغییرات نتایج غیرطبیعی بالا باید با تکرار آزمایش تأیید شوند. سطوح کلسترول تام و کلسترول HDL در هنگام ناشتا و غیر ناشتا یکسان هستند. حداقل 3 روز لازم است تا تغييرات رژيم غذايي بتوانند بر روي ميزان كلسترول خون اثر بگذارند.
روشهای اندازهگیری كلسترول:
آمپرومتری، کروماتوگرافی گاز- مایع، آنزیماتیک، شیمیایی بدون جداسازی و صابونی کردن از روشهای اندازهگیری کلسترول میباشند. از روشهای کلاسیک نیز میتوان به روشهای لیبرمن- بورشاد و سالکوفسکی اشاره کرد. روشهای اندازهگیری کلسترول، کلسترول توتال یا تام را اندازهگیری میکنند. روشی به نام روش رسوب با دیژیتونین نيز وجود دارد که برای سنجش کلسترول آزاد به کار میرود.
اصول آزمایش:
در این آزمایش ابتدا استرهاي كلسترول تحت تأثير كلسترول استراز (CHE) به كلسترول و اسيدهاي چرب آزاد تجزيه ميشوند. سپس كلسترول با اكسيژن تركيب شده و تحت تأثير كلســـــــــــــترول اكسيداز (CHO) به تركيبي به نام Cholest-3-ene-4-one و H2O2 تبديل ميشود. در مرحله بعد نيز H2O2 توليد شده تحت تأثير پراكسيداز با 4-آمينو آنتيپيرين تركيب شده و توليد آب و يك كروموژن (ماده رنگي) (کینونیمین) مينمايد كه از روي شدت رنگ آن، ميزان كلسترول سرم را مشخص مينمايند.
افزایش کلسترول (هیپر کلسترولمی):
موارد بالای کلسترول خون را در هایپرکلسترولمی فامیلی تیپ 2، هیپرآپولیپوپروتئینمی (تیپهاي 1، 4 و 5)، بیماری هپاتوسلولار سیروز و صفراوی، کلستاز، نازسایی مزمن کلیه، دیابت شیرین کنترل نشده، الکلیسم، چاقی و … میبینیم. بارداری معمولاً با افزایش سطح کلسترول همراه است. در یرقانهای انسدادی به علت اختلالاتی که در ترشح و دفع صفرا حاصل میشود، کلسترول به خون بازگشته و مقدار آن افزایش پیدا میکند. در نفروزها، دفع زیاد پروتئین توسط ادرار باعث کاهش یافتن فشار انکوتیک پلاسما شده كه برای جبران این کاهش، مقدار لیپیدهای خون و به خصوص کلسترول افزایش مییابد و ممــــــــکن است تا mg/dl 1000 نيز برسد.
در دیابت به علت اختلال در متابولیسم قندها، چربیهای بدن آزاد شده كه تجزيه ناقص آنها باعث پیدایش ترکیبات کتونی و نیز افزایش کلسترول خون میگردد. در هیپوتیروئیدی، سوخت و ساز كاهش يافته که به دنبال آن افزایش کلی لیپیدها را خواهیم داشت.
کاهش کلسترول (هیپوکلسترولمی):
کاهش کلسترول در نقص α- لیپوپروتئین، نئوپلاسم بدخیم کبد، هیپرتیروئیدی، سوءتغذیه و سوختگی شدید دیده میشود. به دلیل اینکه کبد مواد دارای کلسترول را متابولیزه میکند، سطح غیرطبیعی پایین کلسترول نشان دهندهی بیماریهای شدید کبد است. به علاوه به دلــــــیل این که منبع اصلی کلسترول رژیم غذایی است، سوء تغذیه هم با سطوح پایین کلسترول همراه خواهد بود. مبتلایان به سکتهی قلبی حاد (Acute myocardial infarction; AMI) ممکن است به مدت 8-6 هفته تا 50 درصد کاهش کلسترول داشته باشند. در هیپرتیروئیدی و بیماری بازدو (Basedow) با افزایش متابولیسم پايه، مقدار لیپیدها و کلسترول خون کم میگردد.
مقادیر نرمال:
بر اساس طبقهبندي ATPIII، مقادير نرمال TC به شرح ذيل ميباشد:
|
TC
|
200 > | مطلوب |
| 239 – 200 | سرحد بالا | |
| 240 ≤ | بالا |
ليپوپروتئينها (Lipoproteins)
1– شيلوميكرونها (Chylomicrones):
شيلوميكرونها (CM) ذرات بزرگ توليد شده توسط روده ميباشند كه ليپيدهاي با منشأ غذايي را به بافتهاي بدن منتقل ميسازند، آنها غني از تريگليسريد بوده اما كلسترول آزاد، فسفوليپيدها و پروتئين كمتري دارند. واكنش شيلوميكرونها با ليپوپروتئين ليپاز در سطح لومني اندوتليوم مويرگ منجر به تخليه تريگليسريدها و عناصر سطحي ميگردد. ذرات كوچكتر حاصله، «باقيمانده شيلوميكرون» ناميده ميشوند كه توسط كبد (عمدتاً از طريق واكنش آپو E با رسپتورها مانند رسپتور LDL) از گردش خون برداشته ميشوند.
به دليل نسبت بسيار كم پروتئين، شيلوميكرونها به طور قابل ملاحظهاي كم چگالتر از آب بوده و بدون سانتريفوژ كردن نيز شناور ميمانند. وقتي كه سطح شيلوميكرونها بالا ميرود، منجر به ايجاد پلاسماي شيري ميگردد و چنانچه بدون حركت باقي بماند پس از چند ساعت به صورت يك لايه كرم مانند شناور انباشته ميگردد. آپوليپوپروتئينهاي شيلوميكرونها شامل پروتئينهايي است كه در ذرات تازه سنتز شده موجود است (آپو B-48، آپو A-I و آپو A-IV) و پروتئينهايي كه از ساير ليپوپروتئينهاي در گردش خون به دست ميآيند.
2– ليپوپروتئينهاي با چگالي بسيار كم
(Very Low Density Lipoproteins):
ليپوپروتئينهاي با چگالي بسيار كم (VLDL) توسط كبد توليد شده و بافتهاي بدن را با تريگليسريد و كلسترول اندوژن تغذيه مينمايند. در مقايسه با شيلوميكرونها، ذرات VLDL كوچكتر بوده و وقتي به مقادير مازاد موجود باشند، ايجاد پلاسماي كدر مينمايند. آنها غني از تريگليسريد بوده اما در مقايسه با شيلوميكرونها، اين ميزان كمتر ميباشد. به دليل نسبت پروتئين به ليپيد پايين اين ذرات، چگالي شناوري اين ذرات نيز بالا ميباشد. از نظر جرمي، ذرات VLDL حاوي تقريباً 50% تريگليسريد، 40% كلسترول و فسفوليپيد و 10% پروتئين (اكثراً آپو B-100، آپو C و آپو E) ميباشند.
ذرات VLDL از نظر اندازه و تركيب شيميايي بسيار متغير ميباشند. ذرات بزرگتر غني از تريگليسريد و آپو C ميباشند. ذرات كوچكتر VLDL داراي مقادير كمتري از اين دو جزء ميباشند. LPL، VLDL را هيدروليز نموده و توليد ذرات بسيار آتروژنيك، كوچكتر و تخليه شده از تريگليسريد و مواد سطحي را نموده كه «VLDL باقيمانده» و IDL ناميده ميشوند. اين ذرات ميتوانند به LDL متابوليزه گردند. براي محاسبه VLDL از فرمول زير استفاده ميشود:
VLDL (mg/dL)=
3- ليپوپروتئينهاي با چگالي بالا (High Density Lipoproteins):
ليپوپروتئينهاي با چگالي بالا (HDL) ذرههاي كوچكي شامل پروتئين، كلسترول و فسفوليپيد همراه با مقادير جزئيتريگليسريد بوده و به «ذره خوب» موسوم ميباشند. HDL توليد شده توسط كبد در انتقال معكوس كلسترول، فرآيندي كه به وسيله آن كلسترول مازاد از بافتها به كبد برگشت داده ميشود، دخالت دارد. HDL از طريق واكنش آپو E با رسپتور LDL از گردش خون پاك ميشود، اگرچه رسپتورهاي ديگري نيز شناسايي شدهاند. زيرجمعيتهاي مجزاي ذرات HDL بر اساس تفاوت در اندازه يا بار مانند HDL2 و HDL3 شناسايي شدهاند. تمايز دادن اين دو اهميت دارد زيرا تصور ميشود كه HDL2 نسبت به HDL3 اثر محافظتي قلبي بيشتري دارد و تصور ميشود كه افراد با سطوح پايين HDL2 خطر بالايي براي CHD داشته باشند.
علاوه بر آن، HDL به اجزايي ريزتر نيز تقسيم بندي ميشود كه حاوي آپو A-I و نه آپو A-II ميباشد. عملكرد فيزيولوژيك اين ذرات كاملاً مشخص نشده است. تصور ميشود ذراتي كه تنها حاوي آپو A-I ميباشند براي دريافت كلسترول از بافتها مهمتر ميباشند. درصد بالاي ذرات HDL2 تنها در گروه آپو A-I قرار ميگيرد. اندازهگيري آزمايشگاهي اين قبيل ذرات داراي اهميت باليني ميباشد.
مواد حاجب راديوگرافيك و تغييرات وزني در طي روزهاي اخير ميتواند بر روي نتايج ارزيابي ميزان HDL اثر بگذارد. همچنين ميزان HDL ميتواند تحت تأثير بيماري حاد، استرس و حاملگي نيز قرار بگيرد. در اين مواقع ميبايست اين آزمايش را به 6 هفته بعد موكول نمود.
مقادير نرمال:
بر اساس طبقهبندي ATPIII، مقادير نرمال C-HDL به شرح ذيل ميباشند:
|
C–HDL
|
40 > | كم |
| 40-60 | طبيعي | |
| 60 ≤ | زياد |
4- ليپوپروتئينهاي با چگالي كم (Low Density Lipoproteins):
ليپوپروتئينهاي با چگالي كم (LDL)در گروه β-گلبولينهاي پروتئينهاي پلاسما قرار ميگيرند. LDL از طريق متابوليسم VLDL در گردش خون توليد شده و حدود 50% كل ليپوپروتئينهاي پلاسماي انسان را تشكيل ميدهد. از LDL به عنوان «ذره بد» ياد ميشود. اين ذرات بسيار كوچكتر از ليپوپروتئينهاي غني از تريگليسريد (CM و VLDL) بوده و حتي در غلظتهاي بسيار بالا نيز نور را پراكنده ننموده و شفافيت پلاسما را تغيير نميدهند. LDL تقريباً متشكل از 50% كلسترول (اكثراً استري شده)، 25% پروتئين (اكثراً آپو B-100 با مقدار جزئي آپو C)، 20% فسفوليپيد و تنها مقدار جزئي تريگليسريد ميباشد. اگرچه تصور ميشود كه هر ذره VLDL يا LDL، حاوي تنها يك ملكول آپو B-100 باشد، اندازه فوقالعاده اين پروتئين، آن را بزرگترين جزء پروتئيني اين ذرات ساخته است.
كبد اكثراً LDL در گردش (تقريباً 75%) را به وسيله آپو B-100 به عنوان هدفي براي رسپتور كبدي جذب ميكند. LDLهاي باقيمانده به بافتهاي ديگر تحويل داده شده يا به وسيله سلولهاي رفتگر از قبيل آنهايي كه در پلاكهاي آترومايي يافت ميگردند، از گردش خون برداشته ميشوند. ذرات كوچكتر LDL حاوي استر كلسترول كمتري بوده و نسبت كلسترول به آپو B كمتري دارند. ميزان بالاي ذرات كوچك در بيماران با چندين فرم رايج ديسليپوپروتئينمي كه با CHD همراه شدهاند، يافت شده است. به طور كلي، مطالعات نشان ميدهند كه به ازاي هر mg/dl 1 كاهش در LDL پلاسما، مرگ و مير ناشي از بيماريهاي آترواسكلروزي قلبي در حدود 2% كاهش مييابد.
مقادير نرمال:
بر اساس طبقه بندي ATPIII، مقادير نرمال LDL-C به شرح ذيل ميباشند:
|
C – LDL |
100> | بهينه |
| 129- 100 | نزديك بهينه | |
| 159 – 130 | سرحد بالا | |
| 189 – 160 | بالا | |
| 190 ≤ | بسيار بالا |
معادله فريدوالد:
سالهاست كه از معادله فريدوالد (Friedwald formula) به طور گستردهاي به منظور محاسبه ميزان LDL نمونههاي سرم استفاده ميشود. در اين محاسبه از ميزان كلسترول تام، تريگليسريد و HDL استفاده ميگردد. اين فرمــول به صورت (LDL= Total Cholesterol – [HDL+ TG/K]) ميباشد كه در آن K مساوي 5 ميباشد.
در مواردي كه سطح TG بيش از mg/dl 400 ميباشد، نميتوان از معادله فريدوالد براي محاسبه ميزان LDL استفاده نمود و بايد ميزان LDL را به طور مستقيم اندازهگيري نمود.
مثال: نتايج آزمايشهاي TG، TC و HDL بيماري به شرح ذيل ميباشد. ميزان LDL را در اين شخص محاسبه نماييد.
جواب: چون ميزان TG اين شخص كمتر از mg/dl 400 است، پس ميتوان از فرمول فريدوالد براي محاسبه LDL آن استفاده نمود. بنابراين خواهيم داشت:
LDL=TC-HDL-(TG/5)
LDL=350-30-(150/5)
LDL=290 mg/dl
بيماراني كه داراي بيماريهاي قلبي مزمن هستند و يا ريسك بالايي براي بروز اين بيماري دارند، نياز است كه سطح سرمي LDL خود را مرتب چك نموده و سطح آن را به زير mg/dl 100 برسانند.
فاكتورهاي خطر اصلي براي تعديل هدفهاي LDL:
- استعمال دخانيات
- هيپرتانسيون (140/90 ≤BP با داروهاي آنتيهيپرتانسيون)
- HDL-C پايين (mg/dl 40 >)
- تاريخچه فاميلي CHD نابالغ (CHD در مردهاي با درجه اول خويشاوندي بيشتر از 55 سال، CHD در زنان با درجه اول خويشاوندي بيشتر از 65 سال)
- سن (45 ≤ مردان؛ 55 ≤ زنان)
- عارضه ديابت
- CHD موجود از قبل
افرادي كه فاقد هر كدام از ريسك فاكتورهاي ذكر شده در بالا بوده و يا داراي يكي از اين فاكتورها ميباشند، بايد ميزان LDL خود را در محدوده كمتر از mg/dl 160 نگه دارند. اين ميزان بايد در مورد افرادي كه داراي 2 و يا بيشتر از اين ريسك فاكتورها هستند، كمتر از 130 و در مورد افراد با بيماري كرونري قلب و يا ديابتي بايد به ميزان كمتر از mg/dl 100 برسد.
تعيين نسبت برخي اجزاي پروفايل ليپيدي نسبت به هم
به نظر ميرسد كه نسبت HDL به LDL (HDL/LDL Ratio) و يا نسبت LDL به HDL (LDL/HDL Ratio)، اطلاعات بسيار مهمتري از هر كدام از آنها به تنهايي به دست ميدهد. در حال حاضر از اين نسبتها براي پيشگويي وقوع بيماريهاي قلبي استفاده ميشود؛ اگرچه برخي اعتقادها بر آن است كه اطلاعات به دست آمده از هر كدام از اين پارامترها به تنهايي، مفيدتر از نسبتهاي بين آنها ميباشد.
تعيين نسبت كلسترول توتال به HDL (TC/HDL Ratio):
اين نسبت از تقسيم ميزان كلسترول توتال به HDL به دست ميآيد. در مواقعي كه سطح كلسترول توتال افزايش يابد و يا ميزان HDL كاهش پيدا نمايد، اين نسبت نيز افزايش يافته و در مواقعي نيز كه سطح كلسترول توتال كاهش يابد و يا ميزان HDL افزايش پيدا كند، اين نسبت كاهش مييابد. هر چه اين نسبت پايينتر باشد، دلالت بر احتمال كمتر وقوع بيماريها و حملات قلبي مينمايد؛ در حالي كه نسبت بالا دلالت بر ريسك بالاتر وقوع بيماريها و حملات قلبي دارد. هدف بر آن است كه اين نسبت را به زير 5 رسانيم؛ اگرچه ميزان ايدهآل آن در محدوده كمتر از 4 ميباشد.
تعيين نسبت LDL به HDL (LDL/HDL Ratio):
اين نسبت از تقسيم ميزان LDL به HDL به دست ميآيد. اين نسبت بسيار مهمتر از نسبت كلسترول توتال به HDL است. ميزان ايدهآل اين نسبت در محدوده كمتر از 3 ميباشد.
| Risk Level | LDL/HDL Ratio |
| Low risk Average risk Moderate risk High risk |
4.4 – 3.3 7.1 – 4.4 11 – 7.1 11.0 |
تعيين نسبت HDL به LDL (HDL/LDL Ratio):
اين نسبت از تقسيم ميزان HDL به LDL به دست ميآيد. چنانچه اين نسبت بيشتر از 0/3 باشد، گفته ميشود كه شخص از نظر پروفايل ليپيدي سالم ميباشد؛ اگرچه ايدهآل آن است كه اين نسبت را به زير 0/4 رساند. توصيه بر آن است كه اين نسبت بايد حداقل در محدوده بالاي 0/3 حفظ شود.
| Risk Level | HDL/LDL Ratio |
| Low risk Average risk Moderate risk High risk |
0.30 – 0.22 0.22 – 0.14 0.014 – 0.09 0.09 |
تغييرات فيزيولوژيك سطح ليپيدها و ليپوپروتئينها:
در زناني كه در سنين قبل از يائسگي قرار دارند، افرادي كه مرتباً ورزش ميكنند و افرادي كه داراي وزن پايين هستند ولي در سلامت كامل به سر ميبرند، ميزان HDL بالا ميباشد. انسولين، استروژن و تيروكسين (T4) داراي يك رابطه معكوس با سطح كلسترول تام ميباشند. هنگامي كه سطح استروژن بالا است (مثلاً در زنان در طي سيكل قاعدگي)، سطح كلسترول تام پايين بوده و ترجيحاً در محدوده كمتر از mg/dl 200 ميباشد. همچنين در اين زنان (زناني كه در طي سيكل قاعدگي ميباشند)، هنگامي كه ميزان LDL ميل به كاهش دارد، سطح HDL نيز افزايش مييابد.
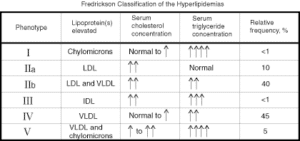
طبقه بندي فردريكسون:
بر اساس طبقه بندي فردريكسون، انواع هيپرليپيدميها (هيپرليپوپروتئينميا) به 6 نوع شامل نوع I، IIa، IIb، III، IV و V طبقهبندي ميشوند.
نمونهگيري و نگهداري خون:
خطا ميتواند قبل يا حين نمونهگيري و يا هنگام انتقال و يا به طور كلي قبل از آناليز نمونهها رخ دهد، بنابراين اهميت دارد تا شرايطي را كه تحت آن نمونههاي باليني جمعآوري و براي آناليز مهيا ميشوند را استاندارد نمود.
تغييرات بيولوژيك:
ميانگين ضريب تغييرات فيزيولوژيك براي كلسترول در يك فرد حدود 6/5 درصد ميباشد. سطوح كلسترول در 95 درصد نمونهها تا حدود 13 درصد بالا يا پايينتر از سطح ميانگين فرد تغيير ميكند، بنابراين تغييرات فيزيولوژيك ميتواند چندين برابر خطاي آناليز بزرگتر بوده و اندازهگيريها بايستي بر روي نمونههاي خون جمعآوري شده با فاصله حداقل يك هفتهاي انجام شود تا غلظت ليپوپروتئين معمول فرد مشخص گردد. سطوح كلسترول با افزايش سن از آغاز بلوغ در هر دو جنس افزايش مييابد. خانم ها- غير از كودكي و پس از 50 سالگي- سطوح كلسترول كمتري نسبت به مردان دارند. سطوح كلسترول در زمستانها كمي بيشتر است. جذب غذايي چربي اشباع و كلسترول نيز به طور بارزي سطوح ليپيدي پلاسما را متأثر ميسازد.
اثر تغييرات غذايي چندين هفته طول ميكشد تا ظاهر گردد، بنابراين قبل از مطمئن شدن از سطح كلسترول فرد اهميت دارد كه براي دو هفته رژيم غذايي معمولي داشته و نه اضافه وزن و نه كاهش وزن داشته باشد. داروهايي از قبيل ضد بارداريهاي خوراكي، استروژنهاي پس از يائسگي و برخي از داروهاي ضد افزايش فشار خون موجب تغيير در سطوح ليپيدي ميگردند. شيوه زندگي و فاكتورهاي بيولوژيك كه تغييرات كوتاه مدت از مقادير پايه ليپيدي را ايجاد مينمايند شامل ناشتايي، وضعيت بيمار، انسداد رگ، ضد انعقادها، سكته قلبي اخير، سكته مغزي، كاتتريزاسيون قلبي، تروما، عفونت حاد و بارداري ميباشند. توصيه شده است كهاندازهگيري ليپوپروتئينها زودتر از 8 هفته بعد از هر گونه تروما يا عفونت حاد باكتريايي و ويروسي و 4-3 ماه پس از زايمان صورت نگيرد.
ناشتايي:
به طور ايدهآل فرد بايد به مدت 12 ساعت قبل از نمونهگيري ناشتا باشد. شيلوميكرونها معمولاً در پلاسماي پس از غذا، بسته به نوع و ميزان غذاي بلع شده وجود داشته و ميتوانند به طور قابل ملاحظهاي غلظت تريگليسريد پلاسما را افزايش دهند. شيلوميكرونها طي 9-6 ساعت تقريباً كاملاً پاك شده و حضورشان پس از 12 ساعت ناشتايي غيرطبيعي به نظر ميرسد. به طور كلي، سطوح TC و HDL-C را ميتوان در افراد غير ناشتا اندازهگيري نمود كه اين كار سبب تسهيل غربال كردن و مانيتور كردن ميگردد.
ناشتايي اثر كمي روي سطح TC پلاسمايي دارد و اگر چه سطوح غير ناشتاي HDL-C ميتواند چند mg/dl كمتر از سطوح ناشتا باشد، اما اين وضع نبايستي به طبقه بندي اشتباه بيمار با سطوح پايين HDL منجر گردد. وقتي كه TG و LDL-C اندازهگيري ميشوند، ناشتايي لازم ميشود. وجود شيلوميكرونها پس از تغذيه و تغييرات در LDL منجر به تخمين كمتر از حد LDL-C شده و ميتواند منجر به طبقه بندي اشتباه بيماران گردد.
به طور كلي ميتوان گفت كه براي انجام آزمايشهاي كلسترول و HDL ميتوان از نمونههاي غير ناشتا هم استفاده نمود، اما براي اندازهگيري ميزان تريگليسريد و LDL بايد حتماً فرد ناشتا باشد. همچنين ميتوان براي ارزيابي وضعيت پروفايل ليپيدي در بيمار و در صورت ضرورت و اضطرار از نمونههاي غير ناشتا استفاده نموده و فقط آزمايشهاي كلسترول و HDL را درخواست نمود. در اين موارد چنانچه ميزان كلسترول بيمار مساوي و يا بيشتر از 200 و ميزان HDL نيز كمتر از mg/dl 40 بود، لازم است كه در وضعيت ناشتا نيز مجدداً پروفايل ليپيدي شخص بررسي گردد و در غير اين صورت نيازي به اين كار نميباشد.
وضعيت بدن در هنگام نمونهگيري:
هنگامي كه وضعيت بيمار از حالت ايستاده به حالت درازكش تغيير مييابد، آب خارج رگي به سيستم عروقي منتقل شده و اجزاي پلاسمايي غير قابل انتشار را رقيق مينمايد. كاهشي به بزرگي 10% در غلظت TC، LDL-C، HDL-C، آپو A-I و آپو B پس از 20 دقيقه دراز كشيدن مشاهده شده است. كاهش در TG حدود 50% بيشتر بوده كه پيشنهاد ميكند فاكتورهايي غير از رقيق شدن خون نيز ميتوانند در اين امر دخيل باشند. اين تغييرات در فردي كه از حالت ايستاده به حالت نشستن تغيير وضعيت ميدهد، نصف ميگردد. دستورالعملهاي اخير NCEP توصيه مينمايد كه بيمار به مدت 5 دقيقه قبل از نمونهگيري به منظور ممانعت از تغليظ خوني بنشيند. انسداد طولاني رگ ميتواند منجر به تغليظ خون و افزايش 15-10 درصدي در كلسترول گردد.
نمونهگيري رگي در مقابل مويرگي:
به طور كلي، به نظر ميرسد كهاندازهگيريها در نمونههاي خوني مويرگي، مختصري كمتر از نمونههاي رگي باشد. اگرچه استفاده از نمونههاي مويرگي تحت برخي شرايط اجتناب ناپذير ميباشد، اما بايستي به خاطر داشته باشيم كه دادههاي اپيدميولوژيك كه از آنها سطوح خطر براي ليپيدها و ليپوپروتئينها حاصل ميگردد بر اساس اندازهگيري در نمونههاي رگي ميباشند.
منابع:
- علیمحمدی م. و رستمی م. بیوشیمی عملی با تکیه بر نکات بالینی. انتشارات راز نهان. ۱۳۹۰. چاپ اول.
- رستمي م، جرفي م. و عليمحمدي م. آزمايشهاي كاربردي در مامايي. انتشارات معتبر. اهواز. 1390. چاپ اول.
- Tietz textbook of clinical chemistry and molecular diagnosis. 2006; 4th Edition.
- Henrys clinical diagnosis and management by laboratory methods. 2007; 21st Edition.
- Harrisons principles of internal medicine. 2005; 16th Edition.
- Guyton AC and Hall JE. Textbook of medical physiology. 2006; 11th Edition.
- Pagana KD and Pagana TJ. Diagnostic and laboratory test refrence. 2005; 7th Edition.
- Arneson W, Brickell J. Clinical chemistry; a laboratory perspective. 2007.
- emedtv.com/hdl/hdl-ldl-ratio.html
- webmd.com/cholesterol…/finding-the-ideal-holesterol-ratio
- hughchou.org/calc/chol.php
- mayoclinic.com/health/cholesterol-ratio/AN01761
- medicinenet.com › home › cholesterol center › cholesterol az list
- livestrong.com/…/446138-what-should-ratio-of-hdl-to-ldl-be/
غربالگري جامع چربيها در كودكان
عوامل مداخلهگر، تداخلات دارویی و مقادير بحراني در تستهاي بیوشيمي ( 1)
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام