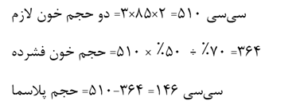اهداف و اهمیت بالینی اسکرین آنتیبادیها در حاملگی
قسمت سوم
دکتر حبیبالله گلافشان
عضو هیئت علمی دانشگاه علوم پزشکی شیراز
با مشخص شدن هویت آنتیبادی در خانم حامله به نکات زیر توجه کنید:
- آنتیبادیهای خانوادهی LIPMAN از قبیل Anti Leb و Anti Lea ,Anti p1 و آنتی N از جنس IgM بوده و حائز اهمیت بالینی نمیباشند. آنتیبادیهای فوق در حرارت اتاق با سلولهای اسکرین واکنش میدهند. گفتنی است که شکلگیری آنتیلوئیس در حاملگی به علت تغییرات لیپوپروتئینهای پلاسما شایع بوده و با توجه به IgM بودن آن و نیز شکل نگرفتن آنتیژنهای لوئیس در بدو تولد حائز اهمیت نمیباشد.
- آنتیبادی علیه آنتیژنهای Lub ,Lua, JK ,Fyb ,CW ،JK ،S و M چنانچه بخش IgG آنها دارای عیار بالا باشد، ممکن است حائز اهمیت قلمداد گردد.
- آنتیبادی علیه آنتیژنهای Rh از قبیل D، C، E، c و e و سیستم Kell از قبیل K و k و دافی a حائز اهمیت بوده و امروزه کمخونی همولیتیک ناشی از Anti K و Anti c به علت تحت کنترل درآوردن تحریک آنتیژنی D از سیستم ارهاش توسط روگام شایعترین میباشد.
آنتی K نه تنها موجب همولیز میشود، بلکه با سرکوبکردن بافت خونساز موجب کمخونی و ترومبوسیتوپنی جنین- نوزاد میگردد. آنتی p (Anti Tja) در فنوتایپ p (فاقد آنتیژنهای Pk, P2 ,P1) با سقطهای مکرر همراهی دارد.
در لیست فوق آنتیبادیهای حائز اهمیت بالینی که با کمخونی همولیتیک جنین-نوزادی همراهی دارند و نیز آنتیبادیهای بدون اهمیت بالینی مشاهده میشود
با شناسایی هویت آنتیبادی بایستی گلبولهای قرمز پدر را برای آنتیژن مربوطه آزمایش کرد. برای مثال چنانچه مادر دارای Anti K باشد، بایستی گلبولهای قرمز پدر را برای آنتیژن K با استفاده از آنتیسرمهای گروهبندی استاندارد آزمایش کرد. چنانچه نتیجه منفی باشد نیاز به پیگیری بیشتر ندارد و خطری جنین را تهدید نمیکند زیرا جنین آنتیژن K را از پدر به ارث نمیبرد.
با مشخص شدن هویت آنتیبادی بایستی گلبولهای قرمز پدر را با استفاده از آنتیبادیهای استاندارد تجارتی برای آنتیژن مربوطه چک کرد، برای مثال چنانچه هویت آنتیبادی در مادر آنتی E بوده و گلبولهای قرمز پدر با معرف گروهبندی آنتیژن E را نشان دهد میتوان نتیجه گرفت که جنین در خطر است
چنانچه مادر دارای آلوآنتیبادی حائز اهمیت و پدر از نظر آنتیژن مربوطه هموزیگوت باشد، جنین در خطر ابتلا به کمخونی همولیتیک است و چنانچه پدر هتروزیگوت باشد 50 درصد احتمال کمخونی همولیتیک جنین- نوزادی مطرح است؛ برای مثال چنانچه در سرم مادر آنتی D کشف شود و ژنوتیپ پدر برای سیستم Rh، هموزیگوت یا DD باشد، شانس ابتلای جنین 100 درصد و چنانچه پدر Dd باشد شانس ابتلای جنین به 50 درصد میرسد.
در شرایطی که خطر عبور آنتیبادی از جفت و کمخونی همولیتیک جنین مطرح است بایستی عیار آنتیبادی را مشخص کرد؛ برای مشخص کردن عیار آنتیبادی، رقتهای مختلف سرم با آنتیژن هموزیگوت آن ویال از پانل که حاوی آنتیژن مربوطه است را در شرایط حرارتی مخصوص واکنش آنتیبادی مجاور ساخته و آخرین رقتی که +1 واکنش دهد بهعنوان عیار یادداشت میگردد، برای مثال برای تعیین رقت آنتی c، رقتهای مختلف سرم با گلبولهای +c را در 37 درجه انکوبه کرده و واکنشها در فاز کومبز قرائت میگردد.
آخرین رقتی از سرم که با گلبولهای پانل واکنش 1+ دهد بهعنوان عیار در نظر گرفته میشود، برای مثال عیار آنتی c در مثال بالا 32 است
با مشخصشدن عیار بحرانی (Critical titration) بایستی اقدامات درمانی را برای جلوگیری از همولیز و عوارض ناشی از آن انجام داد. گرچه ارتباط روشنی بین عیار بحرانی و شدت همولیز وجود ندارد ولی گروهی عیار 8 تا 32 برای آنتی D و عیار 4 را برای آنتی K بحرانی قلمداد میکنند.
چنانچه عیار آنتیبادی پایین باشد بایستی هر 2 تا 4 هفته آزمایش عیاربندی را تکرار و با سرم نمونه قبل که در 20- درجه نگهداری شده است، مقایسه کرد. چنانچه تاریخچهی مادر از نظر آنتیبادی و جنین مبتلا شده به کمخونی همولیتیک مثبت باشد، نیازی به تیتراسیون آنتیبادی ندارد و هماکنون جنین در خطر است. هنگامی که عیار آنتیبادی به آستانهی بحرانی رسید تکرار تیتراسیون ارزشی ندارد.
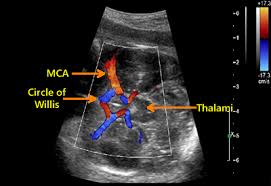
امروزه استفاده از سونوگرافی داپلر و محاسبهی اوج سرعت جریان سیستولیک سرخرگ مغزی جنین (MCAPSV)، امکان ارزیابی شدت کمخونی جنین را در بعد از 18 هفتگی حاملگی به دست میدهد و نیاز به تیتراسیون آنتیبادی در مادر را کاهش داده است.
با سونوگرافی داپلر از سرخرگ مغزی جنین امکان تعیین شدت کمخونی جنین فراهم گردیده و نیاز به تکرار تیتراسیون آنتیبادی یا گرفتن مایع آمنیون را کاهش داده است
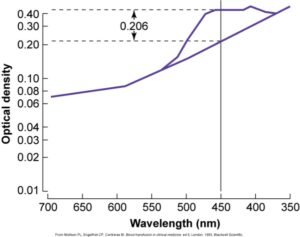
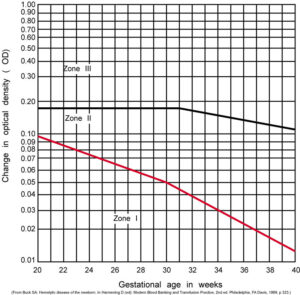
قبل از فراهم بودن روش سونوگرافی داپلر که دارای حساسیت و اختصاصیت 88 درصد و 82 درصد در پیشبینی شدت کمخونی جنین است، از آنالیز اسپکتروفتومتری مایع آمنیون برای ارزیابی شدت همولیز استفاده میشد که روشی تهاجمی و عارضهدار برای مادر و جنین بود. در آنالیز اسپکتروفتومتری مایع آمنیون اوج جذب نوری در طولموج 450 نانومتر که ماکزیمم طولموج جذبی بیلیروبین است محاسبه و پس از تصحیح برای جذب پایهی مایع طبیعی بهصورت پارامتر OD Δ450 گزارش میگردد. با انتقال هفتههای حاملگی مادر و پارامتر ΔOD به ترتیب بر روی محور x و y در گراف لایلی (Liley) منطقهی شدت همولیز جنین تعیین میگردد. گراف لایلی دارای سه ناحیه (Zone) است که ناحیهی 3 منطقهی پرخطر و بیانگر شدت همولیز در جنین است. قرار گرفتن پارامتر ΔOD در ناحیه 2 بیانگر همولیز خفیف بوده و نیاز به تکرار آزمایش برای 2 هفتهی دیگر است. استفاده از گراف لایلی از هفتهی 27 حاملگی میتواند راهنمای صحیح و خوبی برای ارزیابی همولیز باشد.
با انتقال پارامترهای ΔOD و هفتههای حاملگی مادر بر روی گراف لایلی میتوان شدت همولیز جنین را محاسبه کرد. تغییرات جذب نوری (ΔOD) در طولموج 450 نانومتر ارتباط مستقیم با بیلیروبین مایع آمنیون و شدت همولیز دارد
شدت همولیز جنین وابسته به عیار آنتیبادی در مادر و تراکم آنتیژن مربوطه است. از همولیز هر گرم هموگلوبین، 35 میلیگرم بیلیروبین تولید میشود که توسط گردش خون مادر پاکسازی میشود و چنانچه بعد از تولد همولیز ادامه یابد کبد نوزاد قادر به دفع بیلیروبین نبوده و ممکن است عوارض خطرناکی مانند یرقان مغزی (Kernicterus) را به دنبال داشته باشد.
رسوب بیلیروبین در بازال گانگلیا و مخچه موجب بروز عارضه خطرناک آنسفالوپاتی ناشی از بیلیروبین یا مغز زرد میگردد. کبد نارس نوزاد قادر به کانژوگه کردن بیلیروبین و سمزدایی آن نیست. از همولیز هر گرم هموگلوبین، 35 میلیگرم بیلیروبین تولید میشود
همولیز گلبولهای قرمز جنین موجب تداوم فراخوانی کبد و طحال برای جبران خونسازی گردیده و کاهش سنتز پروتئین توسط کبدی که فعالیت خونسازی دارد موجب ورم عمومی، افیوژن در حفرههای بدن، آسیب و نارسایی قلب میگردد که در حالت شدید با هیدروپس فتالیس یا تولد نوزاد ورمکرده و مرده همراه است.
چنانچه نوزاد زنده متولد شود، انباشت سریع بیلیروبین موجب زردی شدید گردیده و گستره محیطی نوزاد انبوهی از گلبولهای قرمز هستهدار در مراحل گوناگون چرخهی بلوغ را نشان میدهد که به آن اریتروبلاستوز فتالیس گویند و تنها راه نجات نوزاد تعویض خون است.
چنانچه عارضهی هیدروپس (ورم عمومی بدن) که با سونوگرافی جنین قابلتشخیص است قبل از 17 هفتگی حاملگی آشکار شود باعث مرگومیر میشود ولی امروزه با فراهم بودن تزریق خون داخل رحمی امکان نجات جنین وجود دارد. تزریق داخل رحمی از هفتهی 18 امکانپذیر است. چنانچه کمخونی جنین شدید باشد و تزریق داخل رحمی امکانپذیر نباشد، از ترکیب درمانی پلاسمافرز و تجویز ایمونوگلوبینهای تزریق وریدی (IVIg) برای مادر استفاده میشود که در نتیجه از شدت همولیز جنین میکاهد تا زمان لازم برای تزریق داخل رحمی میسر گردد.
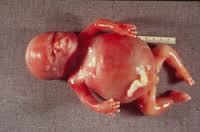
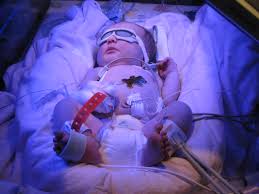
جنین مبتلا به هیدروپس فتالیس
تزریق داخل رحمی در ورید نافی یا فضای صفاقی یا ترکیبی از هر دو روش با راهنمای سونوگرافی انجام میگیرد و یک تا دو درصد خطر مرگ برای جنین دارد. خون انتخابی برای تزریق داخل رحمی بایستی فشرده تازه، اشعهدیده، منفی از نظر ویروس CMV و یا خون فیلترشده با برداشت سه لگاریتم (99/9 درصد) از گلبولهای سفید باشد. خون انتخابی باید از نظر هموگلوبین S منفی و بدون کاهش G6PD باشد. در اغلب موارد از گروه O منفی فشرده که با سرم مادر کراسمچ میشود استفاده میشود.
تزریق داخل رحمی هر 2 تا 4 هفته بهمنظور نگهداری هماتوکریت جنین بین 30-27 درصد تا هفتهی 35 حاملگی صورت گرفته و سپس اقدام به تولد جنین در هفتههای 38-37 حاملگی به شرط تأیید بلوغ ریه میشود.
برای محاسبهی حجم تزریق داخل رحمی از رابطهی زیر استفاده میشود:
- حجم خون در جنین و جفت را با ضرب کردن وزن تخمینی جنین در سونوگرافی در عدد ml/gram 0/14 محاسبه کنید.
- حجم خون جنینی را در تفاوت میزان مطلوب افزایش هماتوکریت از مقدار اولیه ضرب کنید.
- حجم محاسبهشده از رابطهی دوم را بر هماتوکریت فرآورده تقسیم کنید تا حجم تزریقی به دست آید.
مثال: برای افزایش هماتوکریت جنین با وزن تخمینی ۱۲۰۰ گرم از ۲۰ درصد به ۴۰ درصد به چند سیسی خون فشرده با هماتوکریت ۸۵ درصد برای تزریق داخل رحمی نیاز است؟
هماتوکریت تخمینی اولیه از طریق سونوگرافی داپلر با محاسبه سرعت سیستولیک سرخرگ مغزی یا نمونهگیری از بندناف به دست میآید.
یک راه سادهتر برای محاسبه حجم تزریقی آن است که برای هر ۱۰ درصد افزایش هماتوکریت، وزن تخمینی جنین در عدد 0/02 ضرب شود. برای مثال برای افزایش ۲۰ درصد هماتوکریت جنین به وزن ۱۲۰۰ گرم نیاز به ۴۸ سیسی خون فشرده است.
تزریق داخل رحمی نه تنها برای کمخونی همولیتیک جنینی بلکه در مواردی از قبیل عفونت جنین با پارو ویروس ، کمبود G6pd و ابتلای به هیدوپس فتالیس با هموگلوبین بارت و انتقال خــــــــــون از دوقلوها (Twin into twin transfusion) ممکن است نیاز باشد. تزریق داخل رحمی علاوه بر خطر یک تا دودرصدی مرگومیر در پارهای موارد مانند کمخونی همولیتیک ناشی از آنتی D، با افزایش خطر بیماری صفراوی کبدی (Cholestatic) در نوزاد همراه بوده است.
نوزادی که تزریق داخل رحمی دریافت داشته است پس از تولد به علت سرکوب مغز استخوان ممکن است کمخون با کاهش شمارش رتیکولوسیت باشد و نیاز به هورمون اریتروپوئتین و یا تزریق خون باشد.
افزایش سطح بیلیروبین پس از تولد موجب انباشت این مادهی سمی و غیرپولار در جریان خون و در بافتهای فسفولیپیدی بهویژه در مغز و مرگ سلولهای عصبی در بازال گانگلیا (basalganglia) و ساقهی مغز میشود که به آن یرقان مغزی یا آنسفالوپاتی ناشی از بیلیروبین گفته میشود که تنها راه نجات آن تعویض خون است. گرچه میتوان با تزریق ایمونوگلوبینهای وریدی (IVIg) به میزان 0/5 گرم بر کیلو همولیز را در نوزاد کاهش داد و نیاز به تعویض را کم کرد ولی تزریق با خطر انتروکولیت نکروزان (Necroting Enterocohtis) همراه میباشد.
تخمین مقدار بیلیروبین و درجهبندی با توجه به گسترش زردی در نقاط مختلف بدن
هایپربیلیروبین و تعویض خون
ژاندیسی که در ۲۴ ساعت اول زندگی نوزاد رخ دهد ناشی از کمخونی همولیتیک جنین- نوزادی، عفونتهای داخل رحمی و کمبود آنزیم G6PD است. ژاندیسهایی که پس از یک هفته ظاهر شده و طولانیمدت باقی باشند دارای عللی از قبیل هپاتیت، انســـــــداد مجاری صفراوی، ژاندیس شیر (breast milk)، اختلالات متابولیک، سندرم کریگلر (criggler najar)، کمکاری تیروئید، تنگی پیلور و همولیز مزمن است. بیلیروبین غیرمستقیم مادهای غیرپولار و سمی و محلول در چربی و قابلرخنه در سلولهای عصبی است. چنانچه بیلیروبین از یک حد بحرانی فراتر رفت منجر به ضایعات دائمی نورولوژیک و عقبافتادگی ذهنی میگردد.
فتوتراپی در طولموج آبی (nm420-470) موجب تبدیل بیلیروبین به فتوایزومرهای بیلیروبین گردیده و قابلیت دفع آن از ادرار و مدفوع را بدون نیاز به کانژوگه شدن فراهم میسازد.
فتوتراپی در طولموج نور آبی موجب تبدیل بیلیروبین به ایزومرهای بیلیروبین گشته که بدون نیاز به کانژوگه شدن امکان دفع ادراری آن را فراهم میکند
هموگلوبین کمتر از gr/dl۱۰، بیلیروبین بندناف بیشتر از mg/dl ۵/۵، افزایش سرعت بیلیروبین بیشتر از mg/dl/H 0/5 با وجود فتوتراپی یا بیلیروبین خون بیشتر از ۲۰ میلیگرم در دسیلیتر، نوزاد را کاندیدای تعویض خون میکند.
چنانچه نوزاد علاوه بر زردی مبتلا به عفونت، تب، هیپوکسمی و اسیدوز باشد تعویض خون در سطح کمتری از بیلیروبین انجام میگیرد.
گسترهی محیطی نوزاد در ناسازگاری خونی به علت سیستم ارهاش و سیستمهای دیگر گروه خونی، تصویری ماکروسیتیک همراه با انبوهی از گلبولهای قرمز هستهدار را نشان میدهد. تعداد طبیعی گلبولهای قرمز هستهدار 10NRBC/100WBC تا هفته اول تولد است. تعداد گلبولهای قرمز هستهدار در اریترویلاستوز فتالیس بالغ بر دهها برابر میزان طبیعی میشود.
در ناسازگاریهای گروه خونی، شدت مثبت شدن آزمایش کومبز مستقیم نوزاد بستگی به عیار آنتیبادی و دانسیتهی آنتیژن مربوطه روی گلبولهای قرمز دارد. آستانهی شناسایی گلبولهای آلوده به آنتیبادی در آزمایش کومبز مستقیم، آغشتگی هر گلبول با ۲۰۰ تا ۵۰۰ مولکول آنتیبادی است. آزمایش کومبز مستقیم در ناسازگاری ارهاش و ناسازگاری به علت سیستمهای دیگر مثبت قوی و در ناسازگاری ABO ضعیف تا منفی است. یادآوری میشود که بخش بزرگی از Anti AB در ناسازگاری ABO توسط سلولهای غیرخونی و مواد ترشحی جنین- نوزاد خنثی میشود. ناسازگاری ABO اغلب در نوزادان با گروهA یا B و مادر با گروه خون O رخ میدهد. گسترهی محیطی در ناسازگاری ABO اسفروسیتوز را نشان میدهد. در ناسازگاری به علت آنتی K سرکوب بافت خونساز و کمخونی شدید همراه با ترومبوسیتوپنی مشاهده میشود.
آلوده شدن خون بندناف با ژلهی وارتی موجب تجمع غیراختصاصی گلبولهای قرمز و گروهبندی اشتباه و مثبت کاذب آزمایش کومبز مستقیم نوزاد میگردد. در گروه خون نوزادی که نمونه از بندناف تهیه شده و گروه خون AB گردیده است، آلودگی با ژلهی وارتی را قبل از گزارش گروه خون مدنظر قرار دهید زیرا تجمع غیراختصاصی گلبولها با ژله وارتی ممکن است با آگلوتیناسیون اشتباه شود. شستن چندبارهی خون یا اضافه کردن یک قطره آنزیم هیالورونیداز به خون موجب پاک شدن خون از ژلهی وارتی و پخش سلولها میگردد.
در گروهبندی سیستم ABO تنها تایپ سلولی نوزاد اطمینان دارد و بکتایپ ارزشی نداشته و ممکن است آنتیبادیهای ABO مادر را از نوع IgG نشان دهد. در تعیین گروه ارهاش نوزاد بهویژه هنگامی که کومبز مستقیم مثبت است پدیدهی D بلوکه (blocked D) را درنظرداشته باشید. در پدیدهی D بلوکه سایتهای آنتیژنی D با آنتی D که از جفت عبور کرده است پوشیده شده و دیگر جای خالی برای واکنش با آنتی D در محیط آزمایشگاه ندارد. گلبولهای آغشته به آنتیبادی در محیط غنی از پروتئین خودبهخود آگلوتینه میدهد و ازاینرو کنترل منفی با آلبومین در هنگام گروهبندی Rh ضروری است و مثبت شدن آن بیانگر آغشتگی گلبولها به آنتیبادی است. برای گروهبندی D بلوکه باید با الوشن، آنتیبادیهای آغشته را از سطح گلبول جدا کرد و یا با Anti D از جنس IgM گروهبندی را انجام داد.
تعویض خون نوزاد و نکتههای مهم آزمایشگاهی
با تعویض دو حجم خون حدود ۷۵ تا ۹۰ درصد گلبولهای آغشته به آنتیکر از گردش خون خارج گردیده و حدود ۲۵ درصد بیلیروبین تام یا 50-45 درصد از مقدار بیلیروبین خون کاسته میشود. ورود بیلیروبین از پوست به گردش خون ممکن است موجب خیز برگشت و افزایش دوبارهی این ماده سمی گردد و نیاز به تعویض دوباره باشد.
با توجه به اینکه حجم خون در نوزادان نارس و رسیده به ترتیب ۱۰۰ و ۸۵ سیسی بر کیلوگرم میباشد حجم لازم جهت تعویض دو حجمی را میتوان از رابطهی زیر به دست آورد:
مثال: نوزادی به وزن ۳ کیلوگرم نیاز به تعویض دو حجم خون دارد؛ چنانچه هماتوکریت ۵۰ درصد بعد از تعویض موردنیاز باشد به چند سیسی خون فشرده با هماتوکریت ۷۰ درصد و پلاسمای تازه نیاز است؟
با مخلوط کردن ۳۶۴ سیسی خون فشرده با ۱۴۶ سیسی پلاسمای تازه از همگروه نوزاد یا از گروه AB، خون کاملی با هماتوکریت ۵۰ درصد برای تعویض تهیه میگردد.
خون انتخابی بایستی تازه (کمتر از ۷ روز)، فیلتر شده و چنانچه وزن نوزاد کمتر از ۱۵۰۰ گرم است اشعه نیز داده شود. خون اشعهدیده را بایستی ظرف ۲۴ ساعت استفاده کرد زیرا نشت پتاسیم از گلبولهای اشعهدیده موجب بروز هایپرکالمی (افزایش پتاسیم) در نوزاد میگردد، در غیر این صورت برای کاهش پتاسیم بایستی از خون اشعهداده و شستهشده استفاده کرد. در برخی از مراکز برای تمام کودکان از خون فیلترشده با برداشت سه لگاریتم (99/9 درصد) از گلبولهای سفید برای کاهش شانس سرایت ویروس CMV استفاده میشود. با استفاده از دستگاه گرمکننده (warmer)، بایستی خون جهت تعویض و یا تزریق به نوزاد تا دمای نزدیک بدن گرم شود، در غیراینصورت تزریق خون سرد موجب آریتمی و حملات قطع تنفس و اختلال در سیستم انعقادی میگردد.
تعویض خون مانند تهیهی سریال رقت در آزمایشگاه است، بدین مفهوم که با توجه به وزن نوزاد، حجمی از خون خارج و جایگزین میگردد؛ برای مثال این حجم برای نوزاد کمتر از ۱۵۰۰ گرم حدود ۵ سیسی و برای 2500-1500 گرم ۱۰ سیسی و برای 3500-2500 گرم ۱۵ سیسی و برای بیشتر از ۳۵۰۰ گرم ۲۰ سیسی میباشد.
تعویض خون دوحجمی در ۶۰ تا ۹۰ دقیقه پایان میپذیرد و سطح بیلیروبین هر ۴ ساعت یا کمتر مورد ارزیابی قرار میگیرد.
از مهمترین عوارض تعویض میتوان به ترومبوسیتوپنی، افزایش پتاسیم، کاهش کلسیم، کاهش قند خون و کاهش سدیم اشاره کرد. از اینرو اندازهگیری الکترولیتها و شمارش پلاکت در حین پروسه و پایان آن سفارش میشود.
انتخاب خون و آزمایشهای سازگاری برای تعویض
با مخلوط کردن گلبولهای قرمز فشرده ¯O با پلاسمای تازه AB یا پلاسمای تازه همگروه نوزاد، خون کامل دهنده همگانی تهیه میشود. استفاده از گلبولهای فشرده در نگهدارندههای AS (SAGM) مانند به علت اینکه میزان آنتیبادیهای گروه خونی مانند آنتی AB بسیار اندک است، بهتر است. برخی از متخصصین استفاده از نگهدارندهی AS بدون مانیتول (AS3) را ترجیح میدهند. خون فشرده در نگهدارندههای AS دارای هماتوکریت ۵۵ تا ۶۰ درصد و در نگهدارندههای CPD-A1 دارای هماتوکریت ۷۰ تا ۸۰ درصد است.
در ناسازگاری ABO که مادر دارای گروه خون O و نوزاد A یا B است حتماً بایستی از گلبولهای O برای تعویض استفاده شود و ارهاش آن بستگی به ارهاش نوزاد دارد ولی در مواردی که امکان ناسازگاری RH و ABO احتمال برود از گلبولهای O منفی استفاده میشود. در ناسازگاری ارهاش بایستی حتماً تعویض را با گروه ارهاش منفی انجام داد. در ناسازگاری ارهاش، مادر دارای گروه منفی و نوزاد دارای گروه ارهاش مثبت است.
با توجه به اینکه آنتیبادیهای مادر تا ۴ ماهگی در بدن نوزاد باقی میمانند، ازاینرو آزمایش سازگاری برای تعویض یا تزریق خون به نوزاد با سرم مادر صورت میگیرد و خون انتخابی بایستی از نظر ABO با سرم مادر سازگار باشد. اگر مادر از نظر اسکرین آنتیبادیها منفی باشد تا ۴ ماهگی نیازی به کراسمچ نیست ولی چنانچه اسکرین آنتیبادی مثبت باشد نیاز به کراسمچ کامل است.
برای مثال چنانچه مادر ¯AB و نوزاد B+ باشد اگر کومبز مستقیم نوزاد مثبت باشد احتمال ناسازگاری RH مطرح است و در این حالت خون انتخابی جهت تعویض ¯B یا ¯O است که با سرم مادر کراسمچ میگردد.
چنانچه مادر ¯O و نوزاد ¯A باشد خون انتخابی ¯O است و چنانچه در شرایطی از خون A استفاده شود بایستی کراسمچ کامل با خون نوزاد انجام گیرد و با اطمینان از اینکه آنتی AB عبوری از جفت در نوزاد موجب ناسازگاری نمیگردد میتوان خون را جهت تعویض با این گروه تهیه کرد.
انتظار میرود که کومبز مستقیم نوزاد در ناسازگاریهای سیستم ارهاش و ناسازگاری به علت سیستمهای دیگر گروه خونی مثبت و در ناسازگاری ABO مثبت ضعیف تا منفی باشد. چنانچه برای کراس مچ امکان دسترسی به نمونه خون مادر نباشد گروه را با سرم و الوشن تهیه شده از گلبولهای نوزاد در مواردی که کومبز مستقیم مثبت باشد کراسمچ میشود.
چنانچه مادر دارای یک آنتیبادی علیه آنتیژنی با شیوع بالا باشد و خون تمام اهداکنندگان ناسازگار باشد میتوان از گلبولهای شسته شدهی مادر حتی با گروه ناسازگار ABO در شرایط اورژانس استفاده کرد ولی قبل از این کار سفارش میشود که اقوام درجه یک مادر جهت آزمایش سازگاری بررسی شوند، چون این امکان وجود دارد که خون سازگار در میان اقوام درجه اول از نظر آنتیژن مربوطه و سیستم ABO یافت گردد.
برای دانلود پی دی اف بر روی لینک زیر کلیک کنید
ورود / ثبت نام